- Preparation and Characterization of Injectable Biohybrid Thermogel Scaffold for Cartilage Regeneration
Seong Eun Kim# , Hye-Eun Shim*, **,#, Sun-Woong Kang**, ***,†
 , and Kang Moo Huh*,†
, and Kang Moo Huh*,† 
Departments of Materials Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
*Departments of Polymer Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
**Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
***Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea- 연골재생을 위한 주입형 바이오하이브리드 써모젤 스캐폴드 제조 및 특성분석
충남대학교 신소재공학과, *충남대학교 고분자공학과, **안전성평가연구소, ***과학기술연합대학원대학교 인체 및 환경 독성학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Thermogels are highly useful as injectable hydrogel formulations due to their unique temperature-sensitive sol-gel properties, but their application in tissue engineering formulations has been limited by their poor mechanical properties and cellular affinity. In this study, a novel injectable biohybrid thermogel scaffold with enhanced mechanical properties and cellular affinity was prepared and evaluated by physical blending of hexanoyl glycol chitosan (HGC), a natural polymer-based thermosensitive hydrogel, with chondroitin sulfate (CS), an extracellular matrix-derived component. The resulting HGC/CS hydrogel retained the temperature-sensitive sol-gel properties attributed to HGC and exhibited suitable physicochemical and rheological properties as an injectable formulation. Furthermore, this biohybrid thermogel showed excellent potential as an injectable tissue engineering scaffold for effective cartilage regeneration due to low toxicity towards chondrocytes and enhanced cell affinity.
써모젤은 특정 온도에 반응하는 졸-젤 전환 특성으로 인해 약물전달을 위한 주입 가능한 하이드로젤 제형으로 유용성이 높으나 제한된 기계적 특성과 세포 친화성으로 인해 조직공학적 응용에는 한계가 있다. 본 연구에서는 천연고분자 기반 온도감응성 하이드로젤인 헥사노일 글리콜키토산(HGC)과 세포외기질 유래 성분인 콘드로이틴 설페이트(CS)를 물리적으로 혼합함으로써 기계적 특성과 세포 친화성이 향상된 새로운 주입형 바이오하이브리드 써모젤 스캐폴드를 개발하고 유효성을 평가하였다. 결과적으로, HGC/CS 하이드로젤은 HGC로부터 부여된 온도반응성 졸-젤 전환 특성을 유지하며 주입형 제형으로 사용하기에 적합한 물리화학적 및 유변학적 특성을 나타내었다. 또한, 연골세포에 대한 낮은 독성과 향상된 세포친화력을 기반으로 연골재생을 위한 조직공학용 주입형 하이드로젤로서의 우수한 잠재력을 확인하였다.
A novel injectable biohybrid thermogel scaffold with enhanced mechanical properties and cellular affinity was prepared by physical blending of hexanoyl glycol chitosan (HGC), with chondroitin sulfate (CS). The resulting biohybrid HGC/CS thermogel exhibited suitable physicochemical and biological properties as an injectable tissue engineering scaffold for effective cartilage regeneration due to low toxicity towards chondrocytes and enhanced cell affinity.
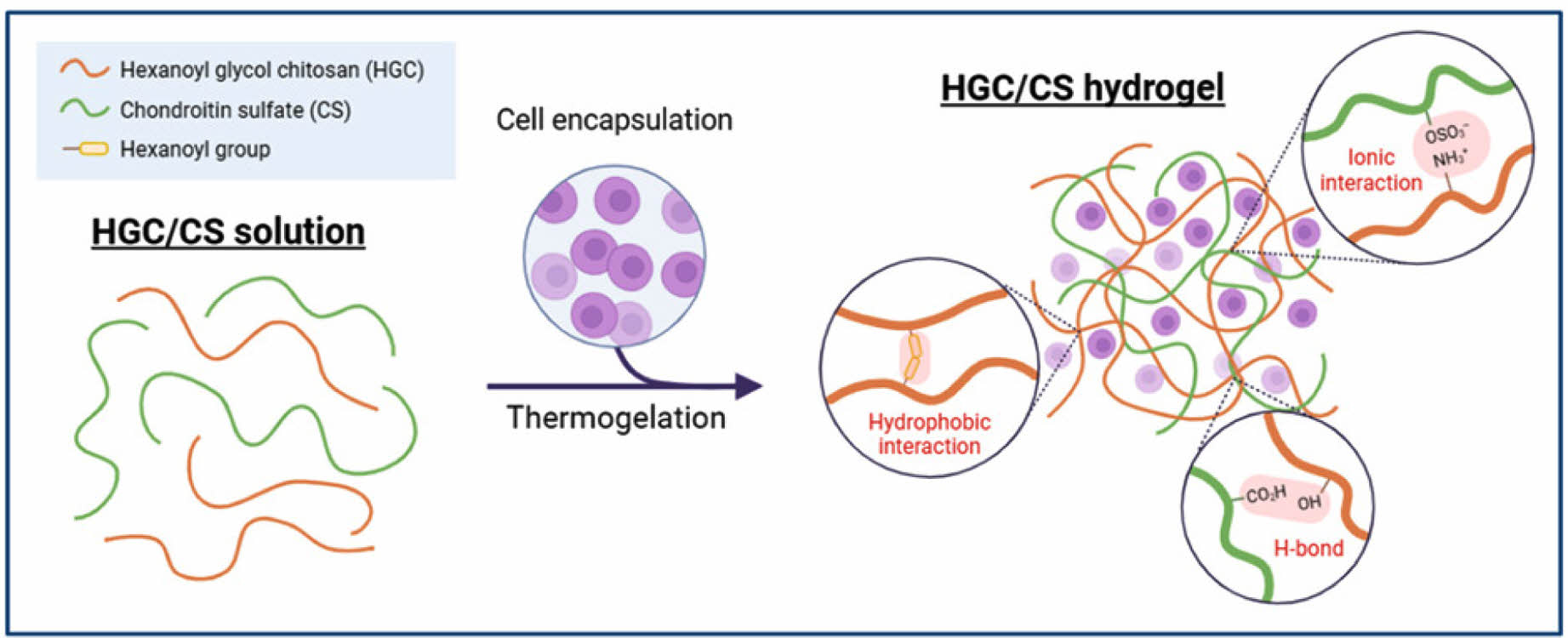
Keywords: biohybrid thermogel, injectable scaffold, hexanoyl glycol chitosan, chondroitin sulfate, cartilage regeneration.
본 연구는 충남대학교 학술연구비에 의해 지원되었음.
저자들은 이해상충이 없음을 선언합니다.
조직공학은 인체의 손상된 조직이나 장기를 대체하거나, 재생 및 복구하는 기술로서 조직 손상, 장기 이식, 만성 질환 치료 등의 다양한 바이오메디컬 분야에서 활용되고 있다.1-3 이 분야에서는 특히 생체 내에서의 효과적인 조직 재생을 달성하기 위한 다양한 전략이 모색되고 있으며, 생체적합성을 지닌 3차원 다공성 스캐폴드(scaffold)의 사용이 그 중 하나의 중요한 접근법으로 시도되고 있다.3,4 이러한 스캐폴드는 세포외기질(ECM)과 유사한 기능을 가지며 조직 재생 및 복구를 촉진하는 역할을 한다.5,6 스캐폴드의 기계적 및 물리화학적 특성은 대상 조직과 응용 목적에 따라 다양하게 설계될 수 있으나, 대부분은 이식 후 주변 조직과 유사한 물성을 확보하여 통합을 용이하게 하고, 세포의 부착과 성장, 분화를 지원하는 동시에 생체 활성 분자의 침투와 전달을 통해 줄기세포와 같은 치료용 세포의 손실을 최소화하며 대상 조직에 도달할 수 있도록 고안되어야 한다.7,8
최근 조직공학 연구에서는 첨단기능을 갖는 생체재료의 개발과 그 응용에 대한 관심이 급격히 증가하고 있다.9-11 특히, 하이드로젤은 뛰어난 생체적합성, 높은 수분 함량, 그리고 조직과 유사한 물리적 특성으로 인해 조직공학 분야에서 널리 연구되고 있다.5,6,12-16 이 중에서 써모젤은 주입 가능한 형태로 제공되며, 체온에서 자동으로 겔화되어 특정 부위에서 고정될 수 있는 특성을 지니고 있어 조직공학용 스캐폴드로서의 잠재력이 높게 평가되고 있다.15,17,18 대표적인 써모젤 생체재료로는 폴록사머(poloxamer)와 poly(ethylene oxide)/polylactide 또는 poly(lactide-co-glycolide) 및 poly(e-caprolactone) 블록공중합체가 있으며, 이들은 우수한 생체적합성으로 약물전달과 같은 다양한 바이오메디컬 응용분야에서 광범위하게 활용되어 왔다.19-21 하지만, 이러한 기존의 합성고분자 기반 써모젤은 낮은 물리적 안정성, 높은 젤화농도(20 wt% 이상), 낮은 세포 친화성 등 조직공학용 스캐폴드로 사용하기에 제한된 특성을 지니고 있다.22-24 반면, 천연고분자인 키토산 기반의 아실 글리콜키토산 써모젤은 기존 합성고분자 기반 써모젤과 비교하여 낮은 젤화 농도, 높은 생체 내 안정성, 점막 부착성, 다수 화학 기능기의 잔류 등 우수한 특성을 보유하고 있어 조직공학용 스캐폴드로의 응용 가능성을 보여주었다.13,16,22,25,26 콘드로이틴 설페이트(CS)는 세포외기질에서 유래한 천연 고분자로, 세포 간의 신호전달 뿐만 아니라 음전하 특성을 기반으로 양전하를 갖는 물질과의 상호작용을 통해 물리적 가교 역할을 할 수 있다는 점에서 주목을 받고 있다.27-32 이러한 CS의 특성은 하이드로젤의 구조적 안정성과 세포 친화성을 향상시키는 데 기여할 수 있다.33-37
본 연구에서는 HGC와 CS를 다양한 비율로 혼합함으로써 새로운 형태의 바이오하이브리드 써모젤을 개발하였다. 이 하이브리드 써모젤은 HGC의 온도감응성과 CS의 생물학적 특성을 결합하여 주입 후 체내에서 안정적인 3차원 구조를 형성하며, 특히 연골세포와 같은 세포 유형과의 높은 친화도를 제공할 것으로 기대된다. 본 연구에서는 이러한 바이오하이브리드 써모젤의 제조 방법, 그들의 물리화학적 및 생물학적 특성, 그리고 연골세포와의 상호작용에 대한 평가를 실시하였다.
재료. 본 연구에서 글리콜키토산(GC, DP³400, 아세틸화도 10.4%)은 Wako Pure Chemical Industries, Ltd.(일본)에서 구입하였다. Hexanoic anhydride(97%)는 Sigma-Aldrich(인도)에서, 메탄올과 아세톤은 삼전화학(한국)에서 구입해 사용하였다. 투석막(molecular weight cut-off: 12-14 kDa)은 Spectrum Laboratory(미국)에서 구입하였다. Deuterium oxide(D2O)와 Dulbecco’s phosphate buffered saline(PBS)은 Sigma-Aldrich (미국)에서 구입하였다. Chondroitin sulfate(CS)는 Tokyo Chemical Industry(일본) 제품을 사용하였다. 모든 시약은 별도의 정제 과정 없이 사용되었다.
HGC의 합성 및 분석. 헥사노일 글리콜키토산(HGC)은 글리콜키토산(GC)의 N-hexanoylation 반응을 통해 합성되었다(Table 1). 3 g의 GC를 375 mL의 3차 증류수에 녹인 뒤 375 mL의 메탄올을 첨가하여 충분히 용해시킨다. 상온 조건에서 미리 계산된 함량의 헥사노일 무수물을 첨가하고 24시간 동안 교반 하에 반응을 진행하였다. 합성된 고분자는 과량의 아세톤에 침전하여 정제되었으며, 고분자 침전물은 투석막(MWCO, 12-14 kDa)을 이용하여 3차 증류수에 48시간 동안 투석하였다. 이후 동결 건조하여 파우더 상태의 HGC를 얻었다. GC와 HGC의 화학적 조성은 1H NMR과 ATR-FTIR 분석을 통해 확인하였다. 600 MHz의 공명 주파수로 작동하는 AVANCE III 600(BRUKER, 독일)을 이용해 1H NMR 스펙트럼을 얻었다. 각 고분자 시료는 0.5 wt%의 농도로 D2O에 용해되었으며, 4.80 ppm의 D2O 피크를 기준 피크로 설정하였다. GC와 HGC의 ATR-FTIR 스펙트럼은 Nicolet iS 5(Thermo Scientific, USA)를 통해 얻었다. 각 고분자 시료는 파우더 형태로 준비되었으며, ATR-FTIR 분석은 4000-750 cm-1 주파수 범위에서 8 cm-1의 분해능, 32회 스캔 조건을 통해 측정하였다.
바이오하이브리드 써모젤 HGC/CS 제조. 서로 다른 CS 함량을 갖는 바이오하이브리드 써모젤 HGC/CS는 두 고분자의 물리적 혼합을 통하여 제조하였다(Table 2). 먼저 PBS(pH 7.4, 0.01 M)에 HGC를 용해시켜 HGC 4 wt% 수용액을 만들었다. 하이브리드 써모젤 HGC/CS-2는 충분히 용해된 HGC 고분자 용액에 CS를 첨가하여 HGC의 농도가 4 wt%, CS의 농도가 2 wt%가 되도록 제조하였다. 하이브리드 써모젤 HGC/CS-4 또한 HGC/CS-2와 동일하게 제조하되 CS의 농도가 4 wt%가 되도록 용해시켰다. 제조된 모든 고분자 샘플은 사용 전까지 4 ℃ 냉장고에서 보관하였다.
졸-젤 상전이 온도 측정. HGC와 HGC/CS 용액의 졸-젤 전이 온도는 tube-tilting 방법을 통해 측정하였다. 각 시료는 PBS 용액(pH 7.4, 0.01 M)에 충분히 용해시킨 고분자 수용액 상태로 사용하였다. Multi-Blok® heater(Lab-Line Instruments, 미국)를 사용해 0.2 ℃/min의 승온속도로 온도를 상승시켰다. 1분 동안 샘플을 기울여 육안으로 관찰하였을 때 샘플이 흐르지 않는 온도를 기준으로 졸-겔 전이 온도를 결정하였다. 실험은 3회 측정되었으며 각 데이터는 표준 편차를 갖는 평균 값으로 표시하였다.
SEM 형태 분석. 바이오하이브리드 써모젤의 다공성 구조 및 형태학적 분석을 위해 장방출 주사 전자 현미경(FE-SEM, S-4800, Hitachi, 일본)을 이용하여 HGC와 HGC/CS의 표면과 단면을 관찰하였다. 각 고분자 시료는 37 ℃에서 1시간 동안 젤화를 진행하고, 액체질소를 이용해 급냉시킨 후 동결 건조하여 제조하였다. 준비된 시료를 플라즈마 스퍼터를 이용해 60초 동안 백금 코팅한 후 10 kV에서 SEM 분석을 통해 바이오하이브리드 써모젤의 형태학적 특성을 관찰하였다.
유변학적 특성 평가. HGC와 HGC/CS의 유변학적 특성을 분석하기 위해 온도조절기가 장착된 HR-10 Rheometer(TA Instruments, 미국)를 사용하였다. 각 시료는 PBS 용액(pH 7.4, 0.01 M)에 충분히 용해시킨 고분자 수용액 상태로 사용하였다. 직경 40 mm, 간격 1000 μm 인 두 티타늄 평형 플레이트 사이에 측정하고자 하는 HGC와 HGC/CS 수용액을 위치시켰다. 고분자 용액의 저장 탄성률(elastic modulus, G')과 손실 탄성률(loss modulus, G'')은 10 Pa의 일정한 응력 하에서 1 Hz의 주파수로 측정되었다. 측정 조건으로 사용된 응력 및 주파수는 stress sweep과 frequency sweep을 통해 최적화되었으며 승온 속도는 3 ℃/min, 온도 범위는 10-50 ℃로 설정했다.
주입형 조직공학 스캐폴드로의 응용을 위하여 HGC, HGC/CS의 shear-thinning 거동을 분석하였다. 전단 속도 범위를 0.01-100 s-1로 설정하였고 25 ℃의 일정한 온도 조건에서 점도의 변화를 측정하였다. 또한 recoveries test를 진행하여 써모젤의 재현성 있는 점도 회복 거동을 분석하였다. 37 ℃의 일정한 온도 조건에서 200초간 전단 속도 1 s-1, 100초간 전단 속도 100 s-1 를 반복적으로 가하며 점도의 변화를 측정하였다.
압축강도 평가. HGC, HGC/CS 바이오하이브리드 써모젤의 압축강도는 500 N load cell이 장착된 texture analyzer(EZ-SX, Shimadzu, Japan)를 이용해 분석하였다. 각 써모젤 시료는 37 ℃에서 1시간 동안 젤화를 진행하여 지름 10 mm, 높이 10 mm의 실린더 형태로 제조하였으며, 2 mm/min의 속도로 써모젤의 압축강도를 측정하였다. 실험은 3회 측정되었으며 각 데이터는 표준 편차를 갖는 평균 값으로 표시하였다.
써모젤 안정성 평가 및 생분해성 평가. 보고된 문헌을 참조하여 HGC, HGC/CS 바이오하이브리드 써모젤의 안정성 및 생분해성 평가를 수행하였다.38 각 고분자 시료는 5 mL 바이알에 0.5 mL씩 분주하고 37 ℃의 일정한 온도 조건으로 유지되는 항온수조에서 1시간 동안 젤화를 진행하였다. 써모젤의 안정성 평가를 위해 같은 온도의 PBS 용액(pH 7.4, 0.01 M)을 2 mL씩 각각 바이알에 첨가하여 항온수조에 정치하고 시간에 따른 써모젤의 무게 변화를 측정하였다. 또한 써모젤의 생분해성 평가를 위해 분해 효소로 라이소자임(5 mg/mL)을 첨가한 PBS 용액에서의 시간에 따른 써모젤의 무게 변화를 측정하였다. 젤이 잔류하지 않을 때까지 일정한 시간 간격으로 써모젤의 무게를 측정하고 PBS를 교환하였으며, 잔류하는 써모젤의 무게(%)는 다음과 같은 식을 이용해 계산하였다.
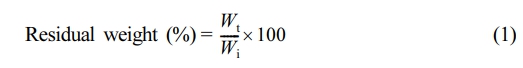
여기서 Wi는 초기 써모젤의 무게, Wt는 시간에 따른 잔류 써모젤의 무게이다. 실험은 3회 측정되었으며 각 데이터는 표준 편차를 갖는 평균 값으로 표시하였다.
세포 독성평가. 바이오하이브리드 써모젤이 인체에 미칠 수 있는 잠재적 위험을 평가하기 위해, 국제표준화기구(ISO)의 ISO 10993-5 규정을 바탕으로 한 세포독성 실험을 수행하였다. 실험 절차는 토끼의 무릎 연골에서 취한 연골세포를 사용하여 진행되었다. 연골세포는 2×105 cells/well의 농도로 6-well 배양판(Corning, USA)에 접종되었으며, 이후 37 ℃, 5% CO2 조건에서 2일간 배양되었다. 배양 기간 이후, 써모젤 시료(1×1 cm2)를 배양판 중앙에 배치하여 세포와 직접 접촉시킨 후 추가적으로 3일간 배양하였다. 세포독성을 판단하기 위한 양성 대조군으로는 0.1%의 zinc diethyldithiocarbamate를 함유한 polyetherurethane 필름(PU-ZDEC, Hatano Research Institute, Japan)이 사용되었다. 세포의 생존율과 사멸을 분석하기 위해 배양 1일과 3일 차에 Live-Dead assay(Invitrogen, USA)를 실시하였고, 형광 현미경(DMi8, Leica, Germany)을 이용해 관찰하였다. 또한, 세포의 변화를 더 자세히 관찰하기 위해 헤마톡실린 염색(HemaMAX, BBC Biochemical, USA)을 진행하였다. 실험으로부터 얻어진 독성 반응 영역의 크기는 ImageJ 소프트웨어를 통해 측정되었으며, 독성의 정도는 Table 3과 같이 분류하여 기록하였다.
연골세포 친화력 평가. 써모젤의 세포 친화력을 평가하기 위해, 세포 독성 평가와 유사한 절차를 사용하여 실험을 진행하였다. 이 평가는 토끼의 무릎 연골에서 추출한 연골세포를 사용하여 수행되었다. 초기에 연골세포를 2×103 cells/well의 농도로 96-well 배양판에 접종하고, 각기 다른 고분자 조성(HGC, HGC/CS-2, HGC/CS-4)을 0.6%(w/v) 농도로 녹인 용액을 세포 배양 배지에 첨가하여 5일간 배양하였다. 세포의 성장률은 배양 1, 3, 5일째에 CCK-8 분석을 통해 평가되었다. 추가적으로 써모젤의 세포 친화성 및 조직공학적 응용 가능성을 검증하기 위해, 6%(w/v) 농도로 녹인 젤에 연골세포를 봉입시킨 후, 배양 기간 동안의 1, 3, 5일째에 live/dead 분석을 실시하여 젤 내에서의 세포 생존 변화 경향을 관찰하였다.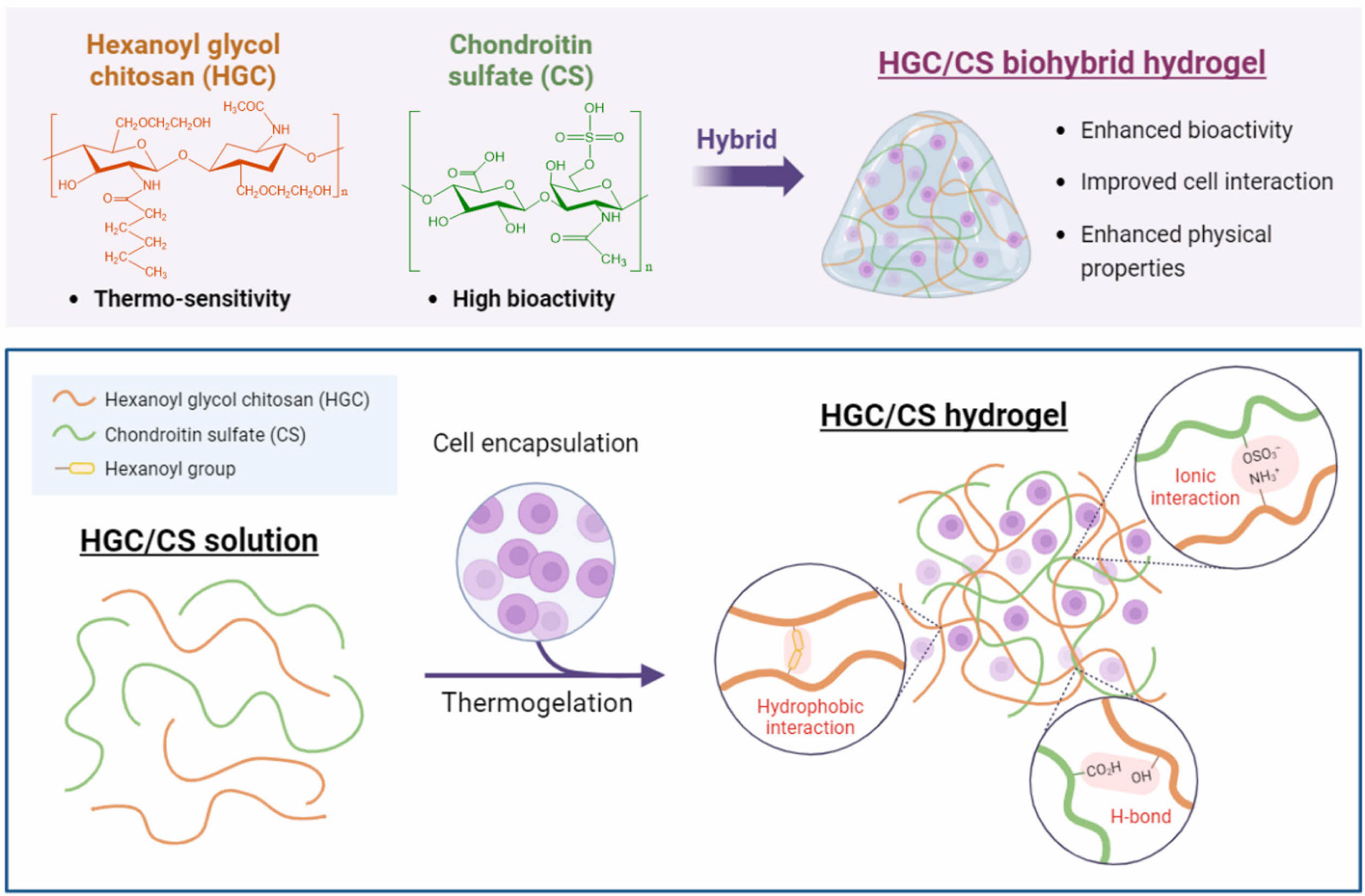
Scheme 1. Schematic illustrations of HGC/CS biohybrid thermogel as a tissue engineering scaffold (created with BioRender.com).
|
Table 1 Synthetic Results of HGC |

aFeed molar ratio of hexanoic anhydride (HA) to glucosamine residue of GC |
|
Table 2 Chemical Compositions of HGC/CS Thermogels |

aSol-gel transition temperature determined by the tube tilting method |
HGC의 합성 및 분석. HGC는 GC의 N-hexanoylation을 통해 합성하였다(Scheme 2). Glucosamine residue에 대한 hexanoylic anhydride의 반응 몰비를 0.39으로 설정하여 GC의 free amine group에 소수성의 헥사노일기를 도입하였다. 합성된 HGC의 화학적 조성은 1H NMR 스펙트럼 분석을 통해 확인하였다(Figure 1(a)). NMR 스펙트럼의 4.8 ppm에서 나타난 D2O 피크를 참조로 분석하였다. 글루코피라노실 고리의 H2-H8에 해당하는 특성 피크가 3.5-4.0 ppm에서 관찰되었다. GC와 비교하여 HGC의 스펙트럼에서 새롭게 나타난 2.3, 1.6, 1.3 ppm의 특성 피크는 헥사노일기의 메틸렌 피크(-CO-CH2-, -CO-CH2-CH2-, -CH2-CH2-CH3)에 해당한다. 또한 헥사노일기의 메틸기 피크(-CH3)에 해당하는 0.9 ppm의 피크가 확인되었으며, 이를 통해 N-hexanoylation 반응이 성공적으로 진행되었음을 확인하였다. HGC의 치환율(degree of hexanoylation, DH)은 글루콜피라노실 고리의 양성자와 헥사노일기의 양성자 피크를 적분한 값을 상대적으로 비교하여 계산하였다. 결과적으로 Table 1에 나타낸 바와 같이 37.9%의 치환율을 가지는 HGC가 합성됨을 확인하였다.
ATR-FTIR 스펙트럼을 통해 GC와 HGC의 특성을 분석하였다(Figure 1(b)). 3400 cm-1에서 -OH 신축 진동에 의한 넓은 밴드가 나타났으며, 같은 위치에 N-H 진동 밴드가 중첩되어 나타났다. 2870 cm-1의 피크는 C-H 신축 진동에 의한 흡수 피크, 1655 cm-1의 피크는 C=O 신축 진동에 의한 피크에 해당한다. 1056 cm-1에서 C-O 신축 진동으로 인한 피크가 확인되었다. 특히 GC 스펙트럼에서 발견된 1587 cm-1의 1차 아민의 굽힘 진동 피크가 HGC의 스펙트럼에서 사라진 반면, 1558 cm-1의 아마이드 II 굽힘 진동에 의한 피크가 새롭게 나타났음을 관찰하였다. 결과적으로 N-hexanoylation 반응을 통해 GC의 아미노기에 헥사노일기가 치환되며 HGC가 성공적으로 합성되었음을 확인하였다. 또한 HGC 스펙트럼에서 관찰할 수 없었던 1222 cm-1의 S=O 피크가 HGC/CS 하이브리드 스펙트럼에서 새롭게 나타났으며, 이를 통해 HGC와 CS의 하이브리드 써모젤이 성공적으로 제조됨을 확인하였다.
온도감응성 졸-젤 전이 특성. HGC와 HGC/CS 용액의 졸-젤 전이 온도는 tube-tilting 방법으로 측정되었다. 소수성의 헥사노일기의 도입으로 인해 써모젤 HGC는 온도가 높아짐에 따른 소수성 상호작용 기반의 졸-젤 전이 특성을 보인다. Figure 2(a)에서 나타난 바와 같이 HGC와 HGC/CS 모두 상온에서는 유동성을 가지는 투명한 수용액 상태를 가지며, 37 ℃ 에서는 흐르지 않는 투명한 젤 상태를 나타냈다. Tube-tilting 방법을 이용해 HGC와 다양한 조성의 HGC/CS 하이브리드 수용액(PBS, pH 7.4)의 온도감응성 졸-젤 전이 온도를 측정하였다(Figure 2(b)). 먼저 하이브리드를 진행하지 않은 HGC의 졸-젤 전이 온도는 28.2±0.2 ℃로 나타났다. 반면 HGC/CS-2 하이브리드 써모젤의 졸-젤 전이 온도는 27.3±0.5 ℃로, HGC/CS-4 하이브리드 써모젤의 졸-젤 전이 온도는 26.5±0.4 ℃로 관찰되었다. 결과적으로 HGC/CS 하이브리드 써모젤은 HGC와 비교했을 때 더 낮은 온도에서도 졸-젤 전이를 일으킬 수 있는 것으로 확인되었다. 이는 CS와의 하이브리드를 진행함에 따라 HGC의 작용기로 존재하는 하이드록실기, 잔류 아민기와 CS의 작용기인 하이드록실기, 카보닐기 및 설폰기 사이에 쌍극자-쌍극자 상호작용, 이온 상호작용, 수소 결합과 같은 물리적 가교가 형성되었기 때문이다. 헥사노일기의 소수성 상호작용을 기반으로 형성되었던 HGC의 물리적 가교에 더불어 HGC/CS 하이브리드 써모젤은 이온 상호작용 및 수소 결합 등의 추가적인 물리적 가교를 가질 수 있어 보다 높은 밀도의 가교구조를 형성할 수 있으며, 상대적으로 낮은 온도에서도 흐름성이 없는 젤 상태를 유지할 수 있는 것으로 사료된다. 또한 하이브리드 써모젤에서 가교제 역할을 하는 CS 함량이 높을수록 더 많은 물리적 가교를 형성하기 때문에, HGC/CS-2와 비교하여 HGC/CS-4의 졸-젤 전이 온도가 더 낮은 값을 보이는 것으로 판단할 수 있다.
SEM 형태 분석. SEM 분석을 통하여 HGC와 HGC/CS 하이브리드 써모젤의 표면 및 단면의 모폴로지 관찰을 진행하였다(Figure 3). HGC와 HGC/CS 써모젤 모두 표면과 단면에서 상호 연결된 다공성 구조를 확인할 수 있었다. 결과적으로 HGC와 HGC/CS 하이브리드 써모젤은 잘 형성된 다공성 구조를 가지며, 스캐폴드로 활용 시 산소와 영양분을 비롯하여 대사에 필요한 다양한 물질의 투과가 가능할 것으로 사료된다.
유변학적 특성 평가. HGC와 HGC/CS 하이브리드 써모젤의 유변학적 특성은 rheometer를 통해 측정되었다(Figure 4). 측정 온도 범위인 10-50 ℃ 내에서 온도를 높일 때 HGC와 다양한 조성의 HGC/CS 수용액(PBS, pH 7.4)의 각 고분자 샘플의 G'과 G''을 분석하였다. 그래프 상에서 G'과 G''의 값이 교차하는 지점의 온도를 각 고분자의 상전이 온도라고 정의하였다. HGC 단독 써모젤의 상전이 온도는 29.8±1.4 ℃로 측정되었다. 한편 HGC/CS-2, HGC/CS-4 하이브리드 써모젤의 상전이 온도는 각각 27.6±0.8 ℃, 26.8±1.0 ℃로 측정되었다. Tube-tilting 분석 결과와 마찬가지로 CS의 함량이 증가할수록 상전이 온도가 낮아지는 결과를 확인하였다. 또한 Figure 4(d)에서 나타난 바와 같이 37 ℃에서의 G' 분석한 결과, HGC 써모젤이 25.0±12.3 Pa, HGC/CS-2 하이브리드 써모젤이 57.1±4.1 Pa, 그리고 HGC/CS-4 하이브리드 써모젤이 63.6±6.6 Pa의 G'을 나타냈다. 결과적으로 CS의 함량이 증가할수록 써모젤의 G'이 높아졌음을 관찰할 수 있었다.
주입형 조직공학 스캐폴드로의 응용을 위한 특성으로 써모젤의 온도감응성과 더불어 injectability를 분석하였다(Figure 5). HGC와 HGC/CS 모두 써모젤에 가해지는 전단 변형이 증가할수록 점도가 감소하는 shear-thinning 거동이 확인되었으며, 첨가된 CS의 양이 증가할수록 써모젤의 점도가 더 높은 것을 관찰할 수 있었다(Figure 5(a)). 또한 주입 후 탄성력의 재현성 있는 회복 능력을 평가하기 위해 thixotropic 거동을 분석하였다. 낮은 전단 속도와 높은 전단 속도의 변형을 반복적으로 가했을 때 HGC와 HGC/CS 모두 우수한 탄성력의 회복 거동이 관찰되었다. 결과적으로 주사 시 가해지는 전단 변형에 의해 점도가 감소하는 특성으로 주사가 용이하며, 체내로의 주사 후 변형력이 감소할 경우 물리적 가교의 회복을 통해 하이드로젤의 탄성력 및 형태를 복구할 수 있을 것으로 기대된다.
압축강도 평가. HGC, HGC/CS 바이오하이브리드 써모젤의 기계적 물성은 압축강도 평가를 통하여 측정하였다. 그 결과 Figure 6(a)에서 나타난 바와 같이 HGC 써모젤은 0.28 kPa의 압축강도를 나타냈다. HGC/CS-2와 HGC/CS-4 하이브리드 써모젤의 경우 각각 0.48 kPa, 0.61 kPa의 압축강도를 가지는 것으로 측정되었다. 이를 토대로 첨가된 CS의 함량이 높을수록 하이드로젤의 가교 밀도가 증가하며 기계적 물성이 향상됨을 알 수 있다.
써모젤 안정성 평가 및 생분해성 평가. 37 ℃ 환경에서의 시간에 따른 HGC, HGC/CS 바이오하이브리드 써모젤의 안정성을 평가하였다. 연골 세포외 기질의 주 성분인 콘드로이틴 설페이트는 수용성 천연고분자로 분해가 빠르기 때문에 조직 공학으로의 응용이 제한되며 다양한 물질과의 결합을 필요로 하는 것으로 알려져 왔다.39 Figure 6(b)에서 나타난 바와 같이 PBS 하에서 HGC, HGC/CS-2, HGC/CS-4 모두 초기 팽윤에 의해 각각 6일, 3일, 2일까지 질량이 증가하였다. 이후 시간에 따라 써모젤의 분해에 의해 질량이 서서히 감소하는 거동을 보였으며 한달 이상까지도 써모젤의 제형을 유지하는 것으로 관찰되었다. HGC와의 하이브리드를 통해 젤 안정성이 낮은 CS를 효과적으로 써모젤 내에 통합하고 제형 유지가 가능함을 확인할 수 있었다.
HGC, HGC/CS 바이오하이브리드 써모젤의 생분해성을 평가하기 위해 라이소자임이 포함된 PBS 하에서의 써모젤 잔류 무게를 측정하였다. HGC 써모젤은 수용성 천연고분자인 GC 기반의 유도체로 분해 효소인 라이소자임 존재 하에서 효과적으로 생분해되는 것으로 보고된 바 있다.38,40 Figure 6(c)에서와 같이 HGC 써모젤과 HGC/CS 하이브리드 써모젤은 모두 시간에 비례하여 잔류량이 감소하는 zero-order kinetics 분해거동을 보이는데, 이는 효소 분해에서 관찰되는 전형적인 surface erosion 거동에 의한 것으로 사료된다.41 HGC 써모젤이 36시간에 걸쳐 분해가 빠르게 진행되는 반면, HGC/CS-2, HGC/CS-4 하이브리드 써모젤의 경우 단일 써모젤과 비교했을 때 생분해 속도가 CS의 함량에 비례하여 크게 지연됨을 확인할 수 있었다. CS의 함유량이 높은 HGC/CS-4가 효소 분해에 대한 입체 장애 효과가 가장 크기 때문에 가장 느리게 분해되는 것으로 사료된다. 결과적으로 HGC/CS 하이브리드 써모젤은 우수한 생분해성을 가지며 조성 변화에 따라 생분해 속도의 조절이 가능하여 맞춤형 특성의 생체재료로서 응용이 가능할 것으로 사료된다.
세포 독성평가. 세포 독성 평가를 통해 바이오하이브리드 써모젤의 세포적합성을 검증하였다. 직접 접촉 세포 독성 평가 방법을 사용하여 얻은 결과를 나타내는 Figure 7(a)에서는, 양성 대조군인 PU-ZDEC가 접촉 3일 후 세포 독성 영역이 시료의 크기를 0.63±0.04 cm 초과하여 영향을 미쳤음을 보여준다(Table 4). 이와 대비하여, HGC, HGC/CS-2, HGC/CS-4를 포함한 모든 써모젤 시료들에서는 대조군과 유사하게 세포 독성 영역이 전혀 관찰되지 않았다. 이는 해당 써모젤들이 세포에 대해 독성을 나타내지 않음을 의미한다. 더 나아가, Figure 7(b)에서 실시한 생존/사멸 분석 결과 모든 써모젤 시료들에서 배양 접시 표면에 부착된 세포들이 대부분 생존 상태를 유지하고 있었다는 것이 확인되었다. 이는 HGC를 기반으로 하며 CS가 혼합된 써모젤들이 세포에 대해 안전하며, 의미 있는 독성을 나타내지 않는다는 것을 뒷받침한다. 이러한 결과들은 HGC와 CS를 포함하는 써모젤이 잠재적인 조직공학용 스캐폴드로서 사용될 때, 세포에 미치는 독성 걱정 없이 안전하게 적용될 수 있음을 시사한다.
연골세포 친화력 평가. 본 연구에서는 써모젤의 연골세포 친화력을 평가하기 위해 세포 배양 배지에 녹인 써모젤 용액을 이용해 연골세포를 배양하고, CCK-8 분석을 통해 세포 성장률을 측정하였다. 또한, 써모젤 내에 연골세포를 담지(encapsulation)한 후 live/dead 분석을 통해 써모젤 안에서의 세포 생존을 검증하였다. CCK-8 분석 결과, 모든 써모젤 샘플에서 연골세포의 증식에 대한 유의미한 차이는 관찰되지 않았으며 시간 경과에 따라 연골세포의 증식이 일어났고, 이는 신선한 배지에서 배양된 대조군과 유사한 경향을 보였다(Figure 8(a)). 그러나 써모젤에 봉입된 연골세포의 생존 분석에서는 HGC 단독 사용 그룹과 CS가 혼합된 그룹 간에 차이가 명확히 관찰되었다(Figure 8(b)). 세포 독성 실험에서 모든 써모젤이 우수한 세포적합성을 나타내며 세포독성이 없음을 확인했음에도 불구하고, 연골세포 친화도 검사에서 HGC 그룹은 시간이 지남에 따라 죽은 연골세포의 비율이 증가하는 경향을 보였다. 반면, 연골조직의 ECM 성분인 CS가 포함된 써모젤 그룹에서는 배양 5일째에도 대부분의 연골세포가 생존 상태를 유지하였다.
이러한 결과는 HGC/CS 써모젤이 HGC 단독 써모젤에 비해 연골세포와의 친화력이 더 높음을 시사한다. CS가 포함된 써모젤이 연골세포의 생존에 더 유리한 환경을 제공하며, 이는 연골 조직의 재생 능력을 향상시킬 가능성을 가지고 있음을 나타낸다. 따라서, HGC/CS 써모젤은 연골 조직공학 및 재생의학 분야에서의 응용에 있어 매우 유망한 재료로 활용될 수 있다. 이 연구는 연골세포와의 높은 친화력을 지닌 써모젤 기반 바이오하이브리드 재료의 개발을 통해, 연골 조직 재생에 대한 새로운 접근법을 제시하며 향후 조직공학적 응용에 있어 중요한 기여를 할 것으로 기대된다.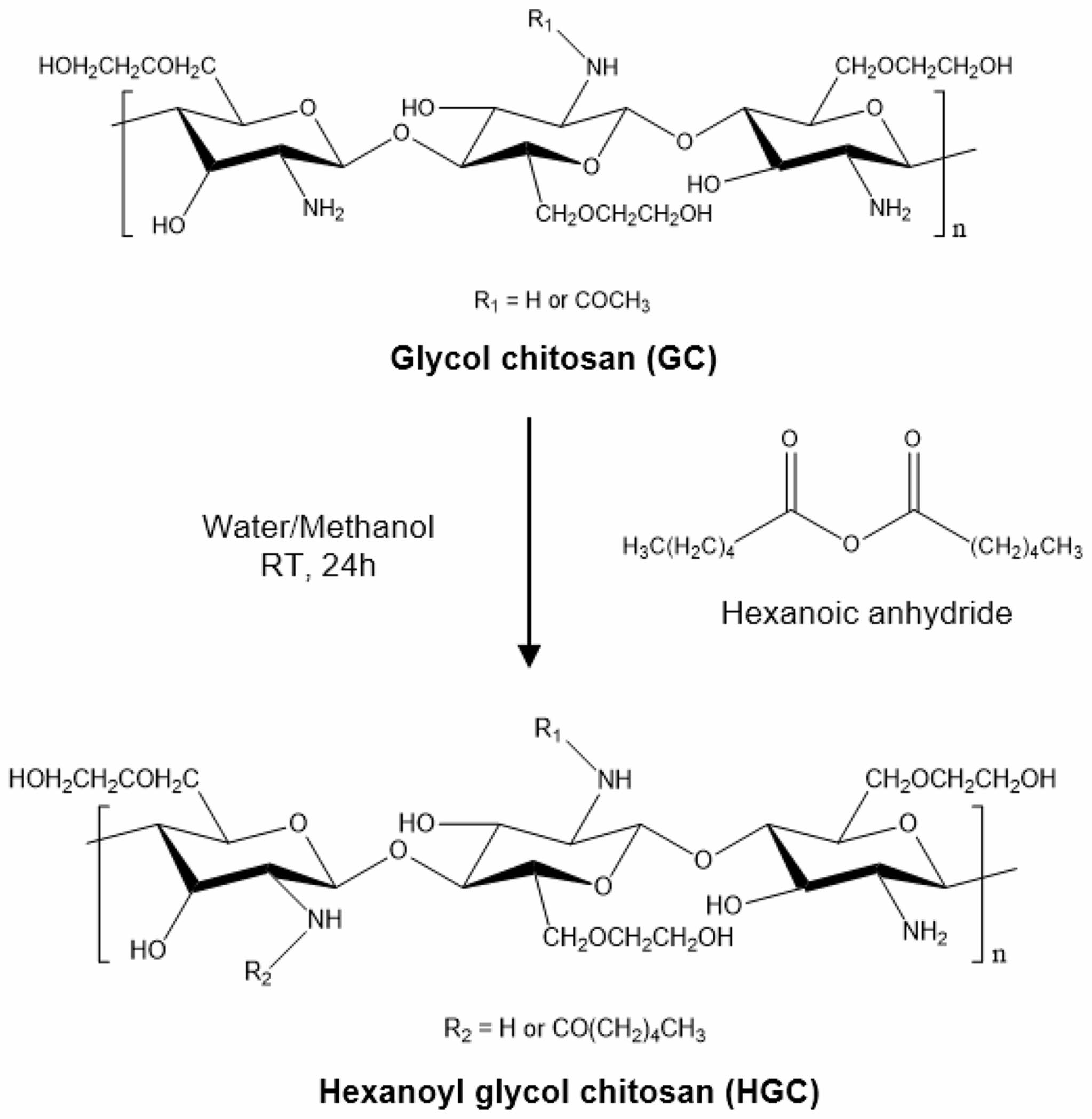
Scheme 2. Synthetic procedure of hexanoyl glycol chitosan (HGC).

|
Figure 1 (a) 1
H NMR spectra of GC and HGC; (b) ATR-FTIR
characterization of GC, HGC, CS, and HGC/CSs. |

|
Figure 2 (a) Photographs showing the phase transition behavior; (b) thermo-sensitive sol-gel phase transition diagrams of HGC and HGC/CSs. |

|
Figure 3 FE-SEM images of HGC, HGC/CS-2, and HGC/CS-4. |

|
Figure 4 Temperature-dependent rheological behavior of (a) HGC; (b) HGC/CS-2; (c) and HGC/CS-4. (d) Storage modulus of HGC, HGC/ CS-2, and HGC/CS-4 thermogels at 37 ℃. |

|
Figure 5 (a) Shear-thinning property of HGC and HGC/CSs at 25 ℃; Recovery behavior of (b) HGC; (c) HGC/CS-2; (d) and HGC/CS-4 at 37 ℃. |

|
Figure 6 (a) Compressive strength of HGC and HGC/CSs at 37 ℃. (b) In vitro hydrogel stability test of HGC and HGC/CSs in PBS at 37 ℃; (c) Enzymatic degradation profiles of HGC and HGC/CSs in PBS containing 5 mg/mL lysozyme at 37 ℃. Each data point presents mean ± standard deviation (n=3). |

|
Figure 7 (a) Direct contact cytotoxicity assay; (b) live/dead assay of Non-treatment, PU-ZDEC, HGC, HGC/CS-2, and HGC/CS-4 group at day 1 and 3. |

|
Figure 8 (a) CCK-8; (b) Live/dead analysis for evaluation of chondrocyte compatibility. Yellow circles indicate dead chondrocytes. |
본 연구에서는 우수한 생체적합성과 세포친화성, 연골 재생능력과 향상된 기계적 특성을 가지는 새로운 주입형 조직공학 스캐폴드용 바이오하이브리드 써모젤 시스템을 개발하고 그 특성을 평가하였다. 수용성 천연고분자인 글리콜키토산 기반의 써모젤, HGC를 합성하고 그 구조적 특성 및 화학적 조성을 분석하였다. HGC와 우수한 생체적합성 및 세포친화성, 연골 재생능력을 가지는 CS의 하이브리드 써모젤을 제조하고 하이브리드 조성에 따른 온도감응성을 분석하였다. 또한 주입형 조직공학 스캐폴드용 써모젤로서 요구되는 injectability와 탄성 회복력을 평가하였다. 조직공학을 위한 생체 재료 분야에 있어서 천연 ECM의 물리화학적, 생물학적 특성을 모방하는 것은 효과적인 조직 재생을 위해 필수적으로 요구되는 조건이다. HGC/CS 하이브리드 써모젤은 조성에 따라 물리화학적 특성이 조절 가능하여 다양한 물성을 필요로 하는 여러 조직에 맞춤형으로 적용이 가능할 것으로 사료된다. 또한 HGC 단독 써모젤에 비해 HGC/CS 하이브리드 써모젤이 보다 향상된 연골세포 친화력을 가지는 것을 확인하였다. 결과적으로 HGC/CS 바이오하이브리드 써모젤은 온도감응성 및 생분해성, 향상된 생체적합성 및 연골세포 친화력을 기반으로 연골 재생을 위한 주입형 조직공학 스캐폴드로서 높은 잠재력을 가질 것으로 기대된다.
- 1. Garg, T.; Singh, O.; Arora, S.; Murthy, R. Scaffold: A Novel Carrier for Cell and Drug Delivery. Crit. Rev. Ther. Drug Carr. Syst. 2012, 29, 1-63.
-

- 2. Hollister, S. J.; Porous scaffold design for tissue engineering. Nat. Mater. 2005, 4, 518-524.
-

- 3. Ambekar, R. S.; Kandasubramanian B.; Progress in the Advancement of Porous Biopolymer Scaffold: Tissue Engineering Application. Ind. Eng. Chem. Res. 2019, 58, 6163-6194.
-

- 4. Masri, S.; Fauzi, M. B.; Current Insight of Printability Quality Improvement Strategies in Natural-Based Bioinks for Skin Regeneration and Wound Healing. Polymers 2021, 13, 1011.
-

- 5. Drury, J. L.; Mooney, D. J. Hydrogels for Tissue Engineering: Scaffold Design Variables and Applications. Biomaterials 2003, 24, 4337-4351.
-

- 6. Lee, K. Y.; Mooney, D. J. Hydrogels for Tissue Engineering. Chem. Rev. 2001, 101, 1869-1880.
-

- 7. Ding, X.; Zhao, H.; Li, Y.; Lee, A. L.; Li, Z.; Fu, M.; Li, C.; Yang, Y. Y.; Yuan P. Synthetic Peptide Hydrogels as 3D Scaffolds for Tissue Engineering. Adv. Drug Deliv. Rev. 2020, 160, 78-104.
-

- 8. Fan C.; Wang, D. A.; Macroporous Hydrogel Scaffolds for Three-Dimensional Cell Culture and Tissue Engineering. Tissue Eng. Part B Rev. 2017, 23, 451-461.
-

- 9. Byun, H.; Jang, G. N.; Jeong, H.; Lee, J.; Huh, S. J.; Lee, S.; Kim, E.; Shin, H. Development of a Composite Hydrogel Incorporating Anti-inflammatory and Osteoinductive Nanoparticles for Effective Bone Regeneration. Biomater. Res. 2023, 27, 132.
-

- 10. Schneider, K. H.; Goldberg, B. J.; Hasturk, O.; Mu, X.; Dötzlhofer, M.; Eder, G.; Theodossiou, S.; Pichelkastner, L.; Riess, P.; Rohringer, S.; Kiss, H.; Andreas H. Woller, T.; Fitzpatrick, V.; Enayati, M.; Podesser, B. K.; Bergmeister H.; Kaplan D. L. Silk Fibroin, Gelatin, and Human Placenta Extracellular Matrix-based Composite Hydrogels for 3D Bioprinting and Soft Tissue Engineering. Biomater. Res. 2023, 27, 117.
-

- 11. Do, N. T.; Lee, S. Y.; Lee, Y. S.; Shin, C.; Kim, D.; Lee, T. G.; Son, J. G.; Kim, S. H. Time-sequential Fibroblast-to-myofibroblast Transition in Elastin-variable 3D Hydrogel Environments by Collagen Networks. Biomater. Res. 2023, 27, 103.
-

- 12. Hunt, J. A.; Chen, R.; Veena, T. V. Bryan, N. Hydrogels for Tissue Engineering and Regenerative Medicine. J. Mater. Chem. B 2014, 2, 5319-5338.
-

- 13. Gyles, D. A.; Castro, L. D.; Silva Jr, J. O. C.; Ribeiro-Costa, R. M. A Review of the Designs and Prominent Biomedical Advances of Natural and Synthetic Hydrogel Formulations. Eur. Polym. J. 2017, 88, 373-392.
-

- 14. Nguyen, K. T.; West, J. L. Photopolymerizable Hydrogels for Tissue Engineering Applications. Biomaterials 2002, 23, 4307-4314.
-

- 15. Zhang, Y.; Yu, J.; Ren, K.; Zuo, J.; Ding, J.; Chen, X. Thermosensitive Hydrogels as Scaffolds for Cartilage Tissue Engineering. Biomacromolecules 2019, 20, 1478-1492.
-

- 16. Taheri, S.; Ghazali, H. S.; Ghazali, Z. S.; Bhattacharyya, A.; Noh, I. Progress in Biomechanical Stimuli on the Cell-encapsulated Hydrogels for Cartilage Tissue Regeneration. Biomater. Res. 2023, 27, 22.
-

- 17. Gil, E. S.; Hudson, S. M. Stimuli-reponsive Polymers and Their Bioconjugates. Prog. Polym. Sci. 2004, 29, 1173-1222.
-

- 18. Schuetz, Y. B.; Gurny, R.; Jordan, O. A Novel Thermoresponsive Hydrogel Based on Chitosan. Eur. J. Pharm. Biopharm. 2008, 68, 19-25.
-

- 19. Soliman, K. A.; Ullah, K.; Shah, A.; Jones, D. S.; Singh, T. R. R. Poloxamer-based in Situ Gelling Thermoresponsive Systems for Ocular Drug Delivery Applications. Drug Discov. Today 2019, 24, 1575-1586.
-

- 20. Hu, Y.; Jiang, X.; Ding, Y.; Zhang, L.; Yang, C.; Zhang, J.; Chen, J.; Yang, Y. Preparation and Drug Release Behaviors of Nimodipine-loaded Poly(caprolactone)-poly(ethylene oxide)-polylactide Amphiphilic Copolymer Nanoparticles. Biomaterials 2003, 24, 2395-2404.
-

- 21. Mosqueira, V. C. F.; Legrand, P.; Morgat, J. L.; Vert, M.; Mysiakine, E.; Gref, R.; Devissaguet, J. P.; Barratt, G. Biodistribution of Long-circulating PEG-grafted Nanocapsules in Mice: Effects of PEG Chain Length and Density. Pharm. Res. 2001, 18, 1411-1419.
-

- 22. Cheung, H.Y.; Lau, K. T.; Lu, T. P.; Hui D. A Critical Review on Polymer-based Bio-engineered Materials for Scaffold Development. Compos. B: Eng. 2007, 38, 291-300.
-

- 23. Ban, E.; Park, M.; Jeong, S.; Kwon, T.; Kim, E. H.; Jung, K.; Kim, A. Poloxamer-Based Thermoreversible Gel for Topical Delivery of Emodin: Influence of P407 and P188 on Solubility of Emodin and Its Application in Cellular Activity Screening. Molecules 2017, 22, 246.
-

- 24. Dumortier, G.; Grossiord, J. L.; Agnely, F.; Chaumeil, J. C. A Review of Poloxamer 407 Pharmaceutical and Pharmacological Characteristics. Pharm. Res. 2006, 23, 2709-2728.
-

- 25. Lee, E. J.; Kang, E.; Kang, S. W.; Huh, K. M. Thermo-irreversible Glycol Chitosan/hyaluronic Acid Blend Hydrogel for Injectable Tissue Engineering. Carbohydr. Polym. 2020, 244, 116432.
-

- 26. Cho, I. S.; Oh, H. M.; Cho, M. O.; Jang, B. S.; Cho, J. K.; Park, K. H.; Kang, S. W.; Huh, K. M. Synthesis and Characterization of Thiolated Hexanoyl Glycol Chitosan as a Mucoadhesive Thermogelling Polymer. Biomater. Res. 2018, 22, 30.
-

- 27. Lee, C. T.; Kung, P. H.; Lee, Y. D. Preparation of Poly(vinyl alcohol)-chondroitin Sulfate Hydrogel as Matrices in Tissue Engineering. Carbohydr. Polym. 2005, 61, 348-354.
-

- 28. Bali, J. P.; Cousse, H.; Neuzil, E. Biochemical Basis of the Pharmacologic Action of Chondroitin Sulfates on the Osteoarticular System. Semin. Arthritis Rheum. 2001, 31, 58-68.
-

- 29. Yang, J.; Shen, M.; Wen, H.; Luo, Y.; Huang, R.; Rong, L.; Xie, J. Recent Advance in Delivery System and Tissue Engineering Applications of Chondroitin Sulfate. Carbohydr. Polym. 2020, 230, 115650.
-

- 30. Ustyuzhanina, N. E.; Bilan, M. I.; Panina, E. G.; Sanamyan, N. P.; Dmitrenok, A. S.; Tsvetkova, E. A.; Usov, A. I. Structure and Anti-inflammatory Activity of a New Unusual Fucosylated Chondroitin Sulfate from Cucumaria Djakonovi. Mar. Drugs 2018, 16, 389.
-

- 31. Zhu, W.; Ji, Y.; Wang, Y.; He, D.; Yan, Y.; Su, N.; Zhang, C.; Xing, X. H. Structural Characterization and in vitro Antioxidant Activities of Chondroitin Sulfate Purified from Andrias Davidianus Cartilage. Carbohydr. Polym. 2018, 196, 398-404.
-

- 32. Wu, F.; Zhou, C.; Zhou, D.; Ou, S.; Liu, Z.; Huang, H. Immune-enhancing Activities of Chondroitin Sulfate in Murine Macrophage RAW 264.7 Cells. Carbohydr. Polym. 2018, 198, 611-619.
-

- 33. Kasravi, M.; Ahmadi, A.; Babajani, A.; Mazloomnejad, R.; Hatamnejad, M. R.; Shariatzadeh, S.; Bahrami, S; Niknejad, H. Immunogenicity of Decellularized Extracellular Matrix Scaffolds: a Bottleneck in Tissue Engineering and Regenerative Medicine. Biomater. Res. 2023, 27, 10.
-

- 34. Lee, G.; Ko, Y. G.; Bae, K. H.; Kurisawa, M.; Kwon, O. K.; Kwon, O. H. Green Tea Catechin-grafted Silk Fibroin Hydrogels with Reactive Oxygen Species Scavenging Activity for Wound Healing Applications. Biomater. Res. 2022, 26, 62.
-

- 35. Krichen, F.; Bougatef, H.; Sayari, N.; Capitani, F.; Amor, I. B.; Koubaa, I.; Maccari, F.; Mantovani, V.; Galeotti, F.; Bougatef, A. Isolation, Purification and Structural Characterestics of Chondroitin Sulfate from Smooth Hound Cartilage: In vitro Anticoagulant and Antiproliferative Properties. Carbohydr. Polym. 2018, 197, 451-459.
-

- 36. Sun, Y.; Zhang, G.; Liu, Q.; Liu, X.; Wang, L.; Wang, J.; Liang, L. Chondroitin Sulfate from Sturgeon Bone Ameliorates Pain of Osteoarthritis Induced by Monosodium Iodoacetate in Rats. Int. J. Biol. Macromol. 2018, 117, 95-101.
-

- 37. Kwon, H. J.; Han, Y. Chondroitin Sulfate-based Biomaterials for Tissue Engineering. Turk. J. Biol. 2016, 40, 290-299.
-

- 38. Park, S. G.; Li, M. X.; Eom, J. H.; Suh, E. Y.; Cho, W. K.; Joung, Y. K.; Huh, K. M. Synthesis and Characterization of Gallic Acid Conjugated Glycol Chitosans for Tissue Adhesive Applications. Polym. Kor. 2021, 45, 372-379.
-

- 39. Cho, M. O.; Li, Z.; Shim, H. E.; Cho, I. S.; Nurunnabi, M.; Park, H.; Lee, K. Y.; Moon, S. H.; Kim, K. S.; Kang, S. W.; Huh, K. M. Bioinspired Tuning of Glycol Chitosan for 3D Cell Culture. NPG Asia Mater. 2016, 8, e309.
-

- 40. Cho, I. S.; Cho, M. O.; Li, Z.; Nurunnabi, M.; Park, S. Y.; Kang, S. W.; Huh, K. M. Synthesis and Characterization of a New Photo-crosslinkable Glycol Chitosan Thermogel for Biomedical Applications. Carbohydr. Polym. 2016, 144, 59-67.
-

- 41. Bosworth, L. A.; Downes, S. Physicochemical Characterisation of Degrading Polycaprolactone Scaffolds. Polym. Degrad. Stab. 2010, 95, 2269-2276.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(5): 518-529
Published online Sep 25, 2024
- 10.7317/pk.2024.48.5.518
- Received on Mar 25, 2024
- Revised on May 23, 2024
- Accepted on May 28, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sun-Woong Kang**, *** , and Kang Moo Huh*
-
*Departments of Polymer Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
**Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
***Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea - E-mail: swkang@kitox.re.kr, khuh@cnu.ac.kr
- ORCID:
0000-0001-8862-2151, 0000-0001-8862-2151










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.