- Generation of pH-responsive Ca-alginate/polyethylene Oxide Hydrogel Microspheres for Oral Drug Delivery System
*Department of Green Chemical Engineering, Sangmyung University, Cheonan 31066, Korea
**Future Environment and Energy Research Institute, Sangmyung University, Cheonan 31066, Korea- 경구투여 약물전달 시스템을 위한 pH 반응성 칼슘-알긴산/PEO 하이드로젤 미세입자 합성
*상명대학교 그린화학공학과, **상명대학교 미래환경에너지연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Functional microspheres exhibit great potential in the field of smart drug delivery system. Till now, there are challenges in developing cost-effective synthetic technique and functional responsive microspheres for delivery of various drugs. In this work, we synthesized Ca-alginate/polyethylene oxide (PEO) microspheres using centrifugal microfluidic reactor, demonstrating a pH-responsive drug delivery and release. To synthesize the functional microspheres, we have fabricated a centrifuge-based microfluidic reactor which is simple, rapid technique for generation of the microspheres. In addition, the Ca-alginate/PEO microspheres showed the selective response in neutral and basic condition and demonstrated for encapsulation of albumin as a next-generation model drug. We believe that our findings will pave the way for smart functional materials and targeted drug delivery system.
기능성 미세입자는 스마트 약물전달 분야에서 큰 가능성을 보여준다. 하지만 다양한 약물전달 시스템으로 응용을 위한 경제적 합성기술 개발 및 이를 통한 다기능성 미세입자 제조에 한계점이 존재한다. 본 연구에서는 원심력 기반 미세유체 반응기를 통해 칼슘-알긴산/폴리에틸렌옥사이드(PEO) 미세입자를 합성함으로써 서로 다른 pH 조건에서 약물의 전달 및 방출이 가능함을 확인하였다. 원심분리 미세유체 반응기를 통한 미세입자의 합성은 간단하고 단시간에 단분산성 입자제조가 가능하였다. 그리고 칼슘-알긴산/PEO 미세입자는 중성 및 알칼리성 조건에서 선택적 pH 반응성을 확인하였으며, 알부민을 함입시켜 차세대 약물소재로 활용가능성을 검증하였다. 본 연구결과를 바탕으로 기능성 스마트 소재 개발 및 표적 약물전달 시스템에 대한 발전을 기대한다.
We develop a centrifugal microfluidic reactor that can control the flow of fluid based on centrifugal force and generate pH-responsive Ca-alginate/poly(ethylene) oxide hydrogel microspheres with various sizes and compositions. Demonstrated for loading and controlled release of albumin as a next-generation model drug.
Keywords: alginate, pH-responsive, centrifuge, microfluidic reactor, drug delivery system.
본 연구는 2022학년도 상명대학교 교내연구비를 지원받아 수행하였음.
저자(들)는 이해상충이 없음을 선언합니다.
최근 4차 산업혁명 시대에 들어서면서 의료 및 제약, 그리고 바이오 산업의 중요성이 급증함에 따라 우수한 생체적합성(biocompatibility)과 생분해성(biodegradability)을 갖는 기능성 소재 개발에 관심이 집중되고 있다.1 하이드로젤(hydrogel)이란, 3차원 망상구조(3-dimensional network structure)를 갖는 고분자 소재로써 내부로 상당한 양의 물을 함유할 수 있는 특징이 있다.2-4 일반적으로 하이드로젤을 합성하는 방법은 이온 상호작용(ionic interaction), 소수성 상호작용(hydrophobic interaction), 그리고 수소결합(hydrogen bond)과 같은 물리적 결합을 이용한 방법과 첨가제 및 가교제를 이용함으로써 고분자 사슬의 공유결합(covalent bond)을 유도하는 화학적 합성방법으로 나눠진다. 하이드로젤은 우수한 생체적합성을 바탕으로 조직공학,5 재생의학,6 인공피부,7 그리고 약물전달 시스템(drug delivery system)등8 다양한 생명공학 산업 및 연구에 응용되고 있다.9,10
하이드로젤은 키토산(chitosan),11 피브린(fibrin),12 젤라틴(gelatin),13 그리고 알긴산(sodium alginate)과14,15 같은 천연 고분자(natural polymer)와 폴리에틸렌글리콜(polyethylene glycol, PEG), 폴리에틸렌옥사이드(polyethylene oxide, PEO), 그리고 폴리비닐알콜(polyvinyl alcohol, PVA)을 포함하는 합성 고분자(synthetic polymer)로 분류된다.16 특히, 하이드로젤은 다양한 관능기(functional group) 도입을 통해 새로운 기능성 확장을 유도할 수 있으며 이를 통해 인장강도, 유연성, 부착력, 그리고 외부자극에 대한 민감성 및 수용성 극대화 등 다양한 물리화학적 물성제어를 수행할 수 있다.4,14 알긴산은 해양생물인 미역과 다시마와 같은 갈조류의 세포막과 세포막간 물질을 구성하는 천연 고분자로써 높은 생체적합성,17 생분해성,18 그리고 무독성과19 같은 고유한 특징을 가지고 있기 때문에 스마트 재료 등 여러 가지 분야로 활용될 수 있으며 이에 많은 연구가 진행되고 있다.14
알긴산은 β-D-만누론산(β-D-mannuronic acid)과 α-L-글루론산(α-L-guluronic acid)으로 구성된 선형의 공중합체(copolymers)이며,20,21 2가 양이온과 글루론산의 선택적 이온결합을 통해 3차원 계란상자 모델(egg-box model)을 쉽게 형성 시킴으로써 합성이 가능하다는 특징이 있다.22 알긴산 미세입자 합성방법에는 압출(extrusion),23 전기분무(electrospray),24 정전발생 장치(electrostatic generator),25 그리고 유화(emulsification),26 등이 대표적이며 칼슘(Ca2+) 양이온과의 이온결합 메커니즘을 통해 쉽고 빠르게 고형화를 수행할 수 있다. 이러한 특성을 바탕으로 기능성 나노입자, 단백질, 그리고 세포 등을 물질의 함입(encapsulation), 전달(delivery), 그리고 배출(release)이 가능하다는 장점이 있지만 합성되는 입자의 크기 제어가 불안정하고 이를 통해 유도되는 높은 다분산성(polydispersity) 결과물 때문에 실질적 사용에 대한 한계점이 존재하고 있다.12 이를 해결하기 위해 미세영역 내에서 입자의 물리적, 화학적 제어를 연속적으로 수행할 수 있는 미세유체 시스템이 이러한 한계점을 해결할 수 있다. 공정을 수행하기 위해 제작되는 미세유체 반응기는 실시간 관찰을 바탕으로 소량의 시약사용, 반응시간의 단축, 다양한 반응조건 제공, 그리고 단분산성 알긴산 입자합성이 가능하며27,28 합성되는 입자 내부로 기능성 나노입자, 생체물질 및 약물을 함입시킴으로써 목적에 맞는 맞춤형 소재를 개발해 다양한 연구결과를 도출할 수 있다.29,30 하지만 미세유체 시스템은 복잡한 제작공정, 값비싼 외부기기 사용, 그리고 소량생산에 대한 고질적인 한계점이 존재하고 있으며 이를 해결하기 위한 새로운 시스템 개발이 필요한 실정이다.31,32
따라서 본 연구는 원심력 기반 미세유체 반응기를 개발함으로써 칼슘-알긴산/PEO 기능성 약물전달체(drug carrier)를 합성하였다. 원심력 기반 미세유체 반응기 제작은 실험실 수준에서 쉽게 구할 수 있는 재료를 사용해 제작하였으며, 원심분리기의 회전속도 및 알긴산 기반 전구체의 농도조건 변화와 같은 공정 매개변수 제어를 수행함으로써 단분산성 알긴산 미세입자 합성이 가능하였다. 그리고 무독성, 친수성, 생체적합성의 특징을 갖는 합성 고분자인 PEO를 첨가함으로써 합성되는 알긴산 미세입자의 pH 반응성을 극대화시켰으며 다양한 pH 수용액 내에서 이를 증명하였다. 최종적으로 알부민(albumin) 함입 및 방출을 통해 기능성 약물전달체로써 응용가능성을 검증하였다.
재료. 알긴산(sodium alginate, C6H9NaO7) 및 pH 4.01, pH 7.00, 그리고 pH 10.01 완충용액은 Thermo Fisher Scientific (MA, U.S.A.)에서 구입하여 사용하였다. 염화칼슘(calcium chloride, CaCl2, ³93.0%), 폴리에틸렌옥사이드(PEO, M.W. = 100000), 적색 형광 미세입자(carboxylate 0.2 μm, λex = 575 nm, λem = 610 nm), 그리고 fluorescein-isothiocyanate(FITC) 표지가 이루어진 소 혈청 알부민(bovine serum albumin, BSA)은 Sigma-Aldrich chemicals(MO, U.S.A.)에서 구입하였다. 염산(0.01 M hydrochloric acid, HCl)은 Samchun(Pyeongtaek, Republic of Korea)에서 구입하였다. 합성되는 미세입자는 3차 초순수 (18.2 MΩ) 증류수로 세척하여 사용하였다.
원심력 기반 미세유체 반응기 제작. 원심력 기반 미세유체 반응기는 다음과 같이 제작된다. 1.5 mL 원심분리 튜브(Eppendorf AG, Germany) 끝단에 2 cm 길이로 절단이 이루어진 23-Gauge(외경 = 640 μm, 내경 = 340 μm) 주사침을 삽입함으로써 미세유체 반응기 노즐을 제작하였다. 노즐 지지대는 50 mL 원심분리 튜브(SPL Life Sciences, Republic of Korea) 캡의 중앙에 정사각형(1 cm × 1 cm) 구멍을 만들어 주사침 노즐을 삽입하였으며 알긴산/PEO 혼합 전구체의 외부누출을 막기 위해 에폭시 수지(epoxy resin, Loctite, U.S.A.)로 고정하였다. 최종적으로 칼슘 수용액 15 mL가 분주되어 있는 원심분리 튜브와 스크류(screw) 형식으로 주사침 노즐을 접합함으로써 미세유체 반응기를 완성한다.
칼슘-알긴산/PEO 미세입자 합성. 미세입자 합성을 위해 1, 2, 3, 4, 5 wt%, 그리고 6 wt%의 알긴산 수용액을 상온에서 12시간 이상 교반시켜 제조하였다. PEO 용액 제조를 위해 10 wt% PEO를 증류수에 첨가하여 상온에서 12시간 이상 교반하고 필터링을 통해 미반응 PEO를 제거 후 사용하였다. 최종적으로 알긴산 전구체와 PEO 수용액을 8:2 질량비율로 혼합하여 알긴산/PEO 혼합 전구체를 제조하였다. 50 mL 원심분리 튜브 내부에 분주되는 5 wt% 칼슘 수용액은 염화칼슘을 증류수에 첨가 후 상온에서 1시간 이상 교반하여 제조하였다. 칼슘-알긴산/PEO 미세입자 합성은 알긴산/PEO 혼합 전구체를 주사침 노즐 내부로 1 mL씩 분주시켜 원심분리기(Pro-Analytical C2006, Centurion scientific, U.K.)를 통한 원심분리를 통해 합성을 수행하였다. 알긴산/PEO 혼합 전구체 내의 알긴산 농도에 따른 미세입자의 변형(deformation, D)은 아래 식 (1)을 통해 계산하였다.33

본 식에서 a와 b는 각각 합성된 미세입자의 단축 및 장축의 길이를 나타낸다. 설정한 원심분리 속도에 도달하기 전의 속도 범위에서는 불규칙한 유동이 유도됨으로써 불균일한 미세입자 합성이 가능하며 이를 막기 위해 본 연구에서는 가속시간을 5초로 최소화시켜 알긴산/PEO 미세입자 합성을 수행하였다.
칼슘-알긴산/PEO 미세입자 크기 제어. 알긴산과 PEO의 조성비에 따른 경향성을 확인하기 위해 10:0, 8:2, 그리고 6:4의 질량비율로 혼합 후 칼슘-알긴산/PEO 미세입자를 각각 합성하였다. 칼슘 수용액 내에서 5분 동안 고형화가 진행된 칼슘-알긴산/PEO 미세입자의 크기는 식 (2)를 통해 예측 가능하며 실제 실험결과와 비교분석을 수행하였다.

본 식에서 dn은 주사침의 내경(m), σ는 알긴산/PEO 혼합 전구체의 표면장력(mN/m), ρdrop은 알긴산/PEO 혼합 전구체의 밀도(g/mL), 그리고 g는 원심력(m/s2)을 나타낸다.
칼슘-알긴산/PEO 미세입자의 pH 변화 민감성 실험 및 안정성. 0.5 vol%의 적색 형광입자가 분산되어 있는 알긴산/PEO 혼합 전구체를 사용하여 미세입자를 합성하였다. 이후 pH 2.00, 4.01, 7.00, 그리고 10.01의 서로 다른 pH 조건에서 1 g의 칼슘-알긴산/PEO 미세입자를 분산시킨 뒤 12시간 동안 40 rpm 회전교반기(RT-10, DAIHAN Scientific Co., Ltd., Republic of Korea)를 통해 반응시켜 이미지 데이터를 획득하였다.
약물함입 미세입자 합성 및 약물방출. 0.02 wt% 알부민이 함입되어 있는 칼슘-알긴산/PEO 미세입자를 합성해 약물방출 실험을 수행하였다. 인공소장 환경을 모사하기 위해 pH 7.00 완충용액 내에서 40 rpm 회전교반을 통해 1 g의 미세입자에 대한 알부민 방출을 유도하였으며 일정 시간 간격으로 반응물의 상층액을 추출하여 흡광도 분석(λex = 495, λem = 520 nm)을 수행하였다.
분석기기. 원심력 기반 미세유체 반응기로 합성한 칼슘-알긴산/PEO 미세입자들은 3차 증류수로 3회 이상 세척하고 건조 후 사용하였다. 흡광도 분석은 마이크로 플레이트 리더(MRX A2000, K LAB Co., Ltd., Republic of Korea)을 사용해 수행하였다. 광학 및 형광 이미지는 높은 분해능의 CCD(E3ISPM05000KPA, ToupTek Photonics Co., Ltd., China)를 갖춘 형광현미경(Olympus, IX73, Japan)을 사용하였으며 광학현미경 소프트웨어(ToupTek; ProSciTech, Australia)를 통해 고해상도 이미지를 획득하였다. 촬영된 이미지들은 ImageJ를 이용하여 분석하였다.
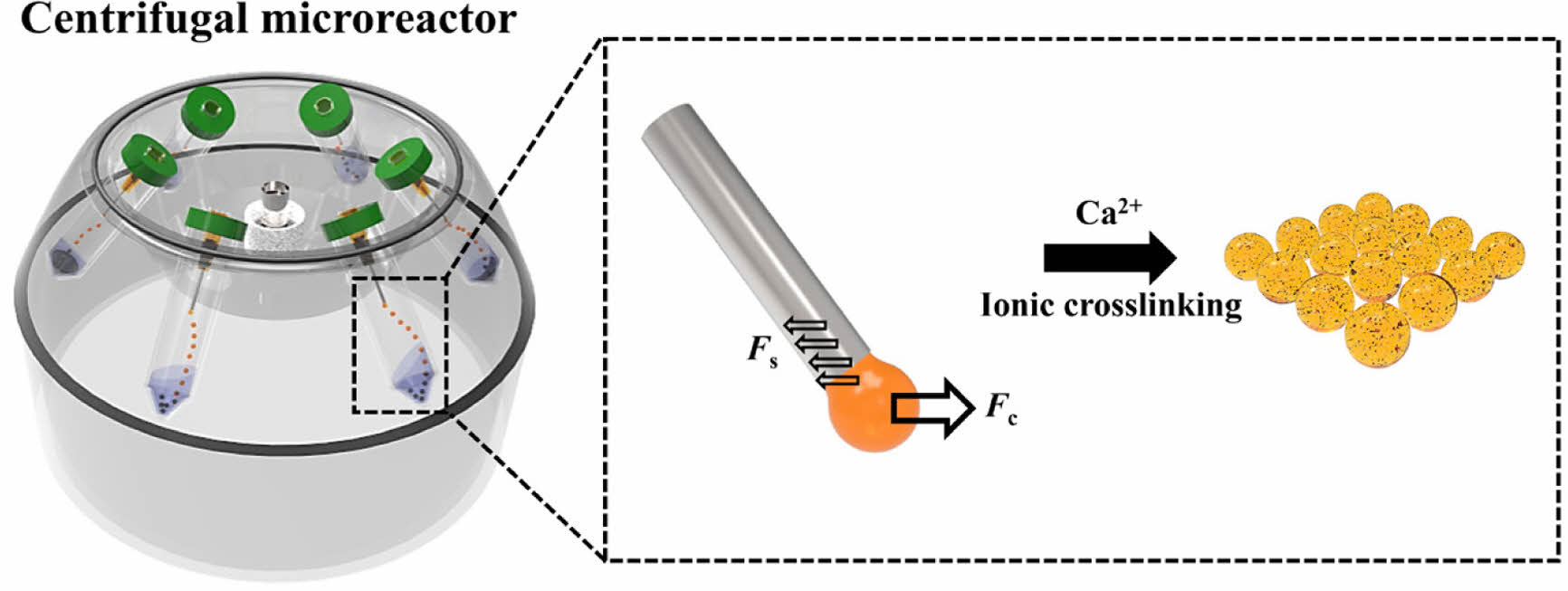
원심력 기반 미세유체 반응기를 통한 미세입자 합성. 본 연구에서는 실험실 수준에서 쉽게 구할 수 있는 재료를 사용하여 경제적이고 재사용이 가능한 미세유체 반응기를 제작하였다. 미세유체 반응기는 일반적인 사용자가 훈련없이 쉽게 제작 가능하며, 실험실 수준에서 쉽게 구할 수 있는 원심분리기 조작을 통해 장치구동이 가능하다(Figure 1(a)). 먼저 미세입자의 합성은 원심분리를 통해 유도되는 원심력(centrifugal force, Fc) 방향으로 미세노즐에 분주되어 있는 전구체의 흐름을 유도할 수 있으며 미세노즐 말단의 주사침에서 전구체의 표면장력(surface tension, Fs)보다 강한 원심력을 통해 구형의 액적을 형성시킬 수 있다. 이후 액적은 주사침으로부터 분리가 이루어지며 칼슘 수용액 내에서 이온교환을 통해 3차원 네트워크(3-dimensional network)를 형성하고 3분 이내에 균일한 고형 미세입자를 대량 합성할 수 있다. 뿐만 아니라, Figure 1(b)와 같이 본 연구에서 합성한 미세입자는 천연 고분자인 알긴산(sodium alginate)과 합성 고분자인 폴리에틸렌옥사이드(polyethylene oxide, PEO)로 구성되어 있다. 알긴산을 구성하는 a-L-글루론산(a-L-guluronic acid)과 칼슘(Ca2+) 이온과의 이온결합(ionic crosslinking)을 통해 3차원 다공성 구조체를 형성함으로써 실시간 물질 함입 및 배출이 가능한 장점이 있다.34,35 그리고 알긴산 관능기(functional group) 중 하이드록실기(hydroxy group, -OH)와 PEO의 에터(ether, -O-) 간의 수소결합(hydrogen bond)을 통해 부분적 상호침투 망상구조(semi-interpenetrating polymer networks, semi-IPN)를 형성함으로써 가교 밀도(crosslinking density) 제어가 가능하기 때문에 새로운 기능성 유도를 위한 맞춤형 물성제어를 할 수 있다는 특징이 있다.36
미세유체 반응기 매개변수 제어를 통한 칼슘-알긴산/PEO 미세입자 합성. 미세입자의 물리적(크기, 형상) 특성은 약물방출 속도 및 유효용량 제어를 수행함에 있어 중요한 요소이다.37 일반적으로 크기가 작은 미세입자는 상대적으로 큰 입자보다 넓은 비표면적(specific surface area)을 갖기 때문에 빠른 약물방출 속도제어를 수행할 수 있다.38
Figure 2와 같이 원심력 기반 미세유체 반응기를 통한 물리적 크기 및 형상제어는 전구체의 농도와 원심분리 속도변화를 통해 쉽게 제어 가능하다. 알긴산/PEO 혼합 전구체에서 알긴산의 농도가 0.8 wt%에서 4.5 wt%로 증가되고 원심분리 속도를 500 rpm에서 1500 rpm으로 증가시킴에 따라 합성되는 칼슘-알긴산/PEO 미세입자는 4가지의 형상 변화가 발생함을 확인하였다. 0.8, 1.6 wt%, 그리고 2.3 wt% 알긴산 농도범위 내에서 500 rpm의 원심분리 속도를 통해 무작위의 불균일한 형상의 미세입자가 합성됨을 확인할 수 있다(Figure 2(a)). 또한 Figure 2(b)와 같이 750 rpm, 0.8 wt%의 알긴산 농도조건과 1250 rpm, 1.6 wt%의 알긴산 농도조건에서 불균일한 미세입자를 관찰할 수 있다. 반면 Figure 2(c)와 같이 750 rpm 원심분리 조건 내에서 1.6 wt% 이상 3 wt% 이하의 알긴산 농도조건 내에서 구형(sphere)의 미세입자를 합성할 수 있었다. 추가적으로 Figure 2(d)와 같이 그 외의 조건에서는 눈물(tear) 형상의 미세입자가 합성됨을 확인할 수 있다. 따라서 본 결과를 바탕으로 원심분리 속도와 전구체의 농도제어를 통해 균일도 향상 및 다양한 형상제어가 가능함을 확인하였다.
간단한 알긴산의 농도제어를 통해 미세입자의 형상제어가 가능함을 Figure 3과 같이 확인할 수 있다. 실험결과 1000 rpm의 고정된 원심분리 속도조건 내에서 알긴산의 농도를 증가시킬수록 변형상수(D)를 0.204±0.058, 0.095±0.050, 0.022±0.015, 그리고 0.024±0.016로 확인할 수 있다. 이를 통해 칼슘-알긴산/PEO 미세입자는 변형이 적은 2.3 wt%에서 최적 조건임을 확인하였고 이후 다음 실험에 적용하여 수행하였다.
칼슘-알긴산/PEO 미세입자의 크기제어. Figure 4와 같이 사용하는 전구체의 조성제어는 합성되는 칼슘-알긴산/PEO 미세입자의 크기를 제어할 수 있는 주요변수로 작용한다. 혼합 전구체에서 알긴산의 농도가 1.8 wt%에서 2.9 wt%로 증가하고 PEO의 농도가 감소함에 따라 미세입자의 크기가 증가됨을 광학 이미지를 통해 증명하였다(Figure 4(a-c)). 정량분석결과 387.74±6.12 μm에서 505.19±10.74 μm로 미세한 크기제어가 가능함을 확인하였으며(Figure 4(d)), coefficient of variance (C.V.) 값은 각각 2.12%, 1.99%, 그리고 1.57%로써 US National Institute of Standards and Technology(NIST)의 단분산성 기준 값인 5% 보다 낮은 수치이므로 단분산성 미세입자 조건을 충족하는 결과이다.39,40 추가적으로 Figure 4(e)와 같이 Tate’s law에 근거한 합성되는 미세입자 크기 예측 비교를 수행한 결과 약 24 μm의 오차가 발생함을 확인할 수 있으며 본 결과가 발생하는 이유는 알긴산 전구체와 칼슘이온의 강한 이온결합 메커니즘을 통한 미세입자 수축으로 해석할 수 있다.41,42 따라서 본 연구에서 개발한 원심력 기반 미세유체 반응기는 기존의 PDMS 기반 미세유체 칩(microfluidic chip)과43,44 캡슐화 장비(encapsulator)를45 통한 공정에서 사용하는 계면활성제와 다양한 유기용매로부터 자유롭게 알긴산 미세입자 제조가 가능해 2차 세척과정이 필요 없으며 상대적으로 간단한 원심분리 공정제어를 통해 누구나 쉽게 접근할 수 있다는 장점이 있고 다양한 내경을 갖는 주사침 기반 미세노즐을 장착함으로써 합성되는 알긴산 미세입자의 광범위한 크기제어가 가능하다.
칼슘-알긴산/PEO 미세입자 pH 민감성 실험. 최근 약물전달 시스템은 pH,46 온도,47 빛,48 그리고 초음파와49 같은 다양한 외부자극을 도입함으로써 가역적(reversible) 또는 비가역적(irreversible) 반응을 통해 다양한 약물방출 방법이 제안되고 있다. 본 연구에서 합성된 칼슘-알긴산/PEO 미세입자의 약물전달 시스템으로 응용 가능성을 확인하기 위해 다양한 pH 환경에서 미세입자의 민감성(sensitivity)을 확인하였다(Figure 5). 실험결과 칼슘-알긴산/PEO 미세입자는 중성(pH = 7.00)과 알칼리성(pH = 10.01) 환경에서 급격한 팽윤을 통해 형광입자 방출이 이루어지고 산성(pH = 2.00) 환경에서는 형광입자가 미세입자 내에서 유지됨을 확인할 수 있다. 이는 칼슘-알긴산/PEO로 구성된 미세입자의 pKa보다 낮은 pH에서는 탈양성자화 작용(deprotonation)을 통한 고분자 사슬의 이온화 상태를 유도할 수 없기 때문에 팽윤 현상이 발생되지 않지만 pH가 미세입자의 pKa보다 높은 경우 미세입자는 팽윤되어 함입된 형광입자가 급속하게 방출됨을 확인할 수 있다.50 따라서 본 실험을 통해 합성된 칼슘-알긴산/PEO 미세입자는 경구투여용 약물전달체로 활용 가능함을 증명할 수 있으며, 구체적으로 위장관(gastrointestinal tract)을 통한 약물전달이 진행될 경우 산성 환경인 위(pH = 2.00)에서 약물이 보호되고 알칼리성 환경인 소장(pH = 7.00)에서 선택적인 약물방출이 발생되어 약물흡수를 극대화시킬 수 있음을 의미한다.
알부민 함입을 통한 칼슘-알긴산/PEO 미세입자의 약물방출. 최종적으로 칼슘-알긴산/PEO 미세입자 내부로 모델 약물인 알부민(albumin)을 함입시켜 선택적 약물방출을 확인하였다(Figure 6). 일반적으로 알부민은 생체내 세포조직 또는 체액에 넓게 분포되어 있는 단백질 중 하나로써 면역원성, 생체적합성, 그리고 생분해성 특징을 바탕으로 생의학, 재료공학, 화장품 등 다양한 산업에서 약물로 사용되고 있다.51-53 Figure 6(a)와 같이 알부민 함입이 이루어진 칼슘-알긴산/PEO 미세입자는 인체의 소장 환경인 pH 7.00에서 팽윤 현상이 발생함을 가시적으로 확인하였다. 또한 Figure 6(b)와 같이 0.1 mg/mL부터 0.6 mg/mL까지의 다양한 농도의 알부민 방출이 가능함을 확인하였다. 흡광도 분석결과 약물방출 효율은 시간이 증가함에 따라 점진적으로 증가되는 경향성을 보여주고 있으며 1200초 이후 pH 2.00, pH 4.01, 그리고 pH 7.00에서 각각 24.78, 25.44, 80.93%의 알부민 약물방출이 가능함을 확인하였다. 추가적으로 PEO의 농도를 감소시킴으로써 약물방출 시간을 증가시킬 수 있으며 다양한 알긴산/PEO 조합을 통해 약물방출 속도제어가 가능할 것으로 기대한다.

|
Figure 1 Centrifuge-based synthetic process for Ca-alginate/PEO microspheres: (a) Schematic illustration showing the operation of centrifugal microreactor. Sodium alginate/PEO pendant drop detached from the microneedle tip when a higher centrifugal gravity force (Fc) was applied than the surface tension (Fs) of precursor solution. Sodium alginate/PEO droplets are immersed into CaCl2 solution to allow ionic crosslinking; (b) The formation of Ca-alginate/PEO microsphere. |

|
Figure 2 (a-d) Optical micrographs showing the shape changes in the Ca-alginate/PEO microspheres depending on the alginate concentration and centrifugation (rpm); (e) Diagram showing the relationship between alginate concentration and rpm. The gray area represents the optimum condition for the generation of monodisperse microspheres. Each experiment was repeated ten times. |

|
Figure 3 Optical micrographs of Ca-alginate/PEO microsphere generation using various alginate concentrations such as (a) 0.8; (b) 1.6; (c) 2.3; (d) 3 wt%, respectively; (e) General trend of Ca-alginate/PEO microsphere deformation (D) which is the ratio of (a) the minor; (b) major axes of the microspheres. Each experiment was repeated ten times. |

|
Figure 4 Physical size control of Ca-alginate/PEO microspheres. Optical micrographs of Ca-alginate/PEO microspheres composed of (a) 1.8; (b) 2.3; (c) 2.9 wt% sodium alginate solution; (d) its corresponding results of diameter measurement. All microspheres were crosslinked in 5 wt% of CaCl2 solution; (e) The correlation between experimental and theoretical diameter of the main microsphere (i.e., 1.8 wt% of alginate concentration) after Ca2+ ionic crosslinking. |

|
Figure 5 Generation of pH-responsive microspheres encapsulating red fluorescence polystyrene microspheres. Bright-field and its corresponding fluorescence images of Ca-alginate/PEO microspheres to apply different pH conditions. |

|
Figure 6 (a) Time sequential micrographs of albumin-encapsulated Ca-alginate/PEO microspheres under neutral environment (pH 7.00) at different time intervals. (b) UV–vis absorption spectra with increasing albumin concentration from 0.1 to 0.6 mg/mL. The inset in (b) shows a linear relationship between the concentration of albumin versus absorbance at 495 nm. (c) Drug release profile of albumin-encapsulated Caalginate/PEO microspheres. Each experiment was repeated three times. |
본 연구에서는 원심력 기반 미세유체 반응기를 통해 칼슘-알긴산/PEO 미세입자를 합성하였고 기능성 약물전달체로써 가능성을 검증하였다. 원심력 기반 미세유체 반응기는 실험실 내에서 쉽게 구할 수 있는 재료로 제작이 가능하며 간단한 원심분리 조작을 통해 구동 및 제어가 가능하다. 합성되는 칼슘-알긴산/PEO 미세입자는 2.3 wt% 알긴산, 1000 rpm 원심분리 회전속도 조건에서 단분산성 미세입자가 120 particles/min의 수율(yield)로 합성됨을 확인하였다. 최종적으로 모델약물인 알부민 함입을 통해 인체의 소장 환경을 대체할 수 있는 pH 7.00 환경에서 최대 약물방출 효율(80.93%)이 가능함을 증명하였다. 본 연구를 통해 개발한 원심력 기반 미세유체 반응기는 연구와 산업기술의 격차를 줄일 수 있는 핵심기술로써 자리잡을 수 있으며 이를 통해 합성되는 칼슘-알긴산/PEO 미세입자는 차세대 경구투여 기능성 약물전달체로써 이를 통해 환자 개인의 약물복용에 대한 유효용량 제어를 수행할 수 있고 앞으로 미래의 개인맞춤형 약물전달 시스템 발전에 기여할 수 있을 것으로 기대한다.
- 1. Hoffman, A. S. Hydrogels for Biomedical Applications. Adv. Drug Deliv. Rev. 2012, 64, 18-23.
- 2. Yang, J. S.; Kim, B. S. Effect of pH-Sensitive P(MAA-co-PEGMA) Hydrogels on Release and Stability of Albumin. Polym. Korea 2013, 37, 262-268.
-

- 3. Pawar, S. N.; Edgar, K. J. Alginate Derivatization: A Review of Chemistry, Properties and Applications. Biomaterials 2012, 33, 3279-3305.
-

- 4. Baimark, Y.; Srisuwan, Y. Preparation of Alginate Microspheres by Water-in-Oil Emulsion Method for Drug Delivery: Effect of Ca2+ Post-Cross-Linking. Adv. Powder Technol. 2014, 25, 1541-1546.
-

- 5. Zhu, J.; Marchant, R. E. Design Properties of Hydrogel Tissue-Engineering Scaffolds. Expert Rev. Med. Devices 2011, 8, 607-626.
-

- 6. El-Sherbiny, I. M.; Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Glob. Cardiol. Sci. Pract.2013, 2013, 316-342.
- 7. Fu, R.; Tu, L.; Zhou, Y.; Fan, L.; Zhang, F.; Wang, Z.; Xing, J.; Chen, D.; Deng, C.; Tan, G.; Yu, P.; Zhou, L.; Ning, C. A Tough and Self-Powered Hydrogel for Artificial Skin. Chem. Mater.2019, 31, 9850-9860.
-

- 8. Hamidi, M.; Azadi, A.; Rafiei, P. Hydrogel Nanoparticles in Drug Delivery. Adv. Drug Deliv. Rev.2008, 60, 1638-1649.
-

- 9. Ahmed, E. M. Hydrogel: Preparation, Characterization, and Applications: A Review. J. Adv. Res.2015, 6, 105-121.
- 10. Hong, G. S.; Choi, J. Y.; Choi, J. H. Evaluation of Physical Properties and Biocompatibility of HA-Dex Fusion Hydrogel Patch for Atopic Healing Ability. J. Soc. Cosmet. Sci. Korea 2020, 46, 219-229.
- 11. Hu, X.; Wang, Y.; Zhang, L.; Xu, M. Formation of Self-Assembled Polyelectrolyte Complex Hydrogel Derived from Salecan and Chitosan for Sustained Release of Vitamin C. Carbohydr. Polym.2020, 234, 115920.
-

- 12. Kumar Giri, T.; Thakur, D.; Ajazuddin; Badwaik, H.; Krishna Tripathi, D. Alginate Based Hydrogel as a Potential Biopolymeric Carrier for Drug Delivery and Cell Delivery Systems: Present Status and Applications. Curr. Drug Deliv. 2012, 9, 539-555.
-

- 13. Takei, T.; Yoshihara, R.; Danjo, S.; Fukuhara, Y.; Evans, C.; Tomimatsu, R.; Ohzuno, Y.; Yoshida, M. Hydrophobically-Modified Gelatin Hydrogel as a Carrier for Charged Hydrophilic Drugs and Hydrophobic Drugs. Int. J. Biol. Macromol. 2020, 149, 140-147.
-

- 14. Kang, S.-M.; Lee, J. H.; Huh, Y. S.; Takayama, S. Alginate Microencapsulation for Three-Dimensional in Vitro Cell Culture. ACS Biomater. Sci. Eng. 2021, 7, 2864-2879.
-

- 15. Jung, J.-E.; Song, K.; Kang, S.-M. Development of a Centrifugal Microreactor for the Generation of Multicompartment Alginate Hydrogel. Appl. Chem. Eng. 2023, 34, 23-29.
- 16. Bashir, S.; Hina, M.; Iqbal J.; Rajpar, A. H.; Mujtaba, M. A.; Alghamdi, N. A.; Wageh, S.; Ramesh, K.; Ramesh, S. Fundamental Concepts of Hydrogels: Synthesis, Properties, and Their Applications. Polymers 2020, 12, 2702.
-

- 17. Lee, K. Y.; Mooney, D. J. Alginate: Properties and Biomedical Applications. Prog. Polym. Sci.2012, 37, 106-126.
- 18. Bouhadir, K. H.; Lee, K. Y.; Alsberg, E.; Damm, K. L.; Anderson, K. W.; Mooney, D. J. Degradation of Partially Oxidized Alginate and Its Potential Application for Tissue Engineering. Biotechnol. Prog. 2001, 17, 945-950.
-

- 19. Zimmermann, U.; Federlin, K.; Hannig, K.; Kowalski, M.; Bretzel, R. G.; Horcher, A.; Zekorn, T. Production of Mitogen-Contamination Free Alginates with Variable Ratios of Mannuronic Acid to Guluronic Acid by Free Flow Electrophoresis. Electrophoresis 1992, 13, 269-274.
-

- 20. Silva, C. M.; Ribeiro, A. J.; Figueiredo, I. V.; Gonçalves, A. R.; Veiga, F. Alginate Microspheres Prepared by Internal Gelation: Development and Effect on Insulin Stability. Int. J. Pharm. 2006, 311, 1-10.
-

- 21. Kapishon, V.; Whitney, R. A.; Champagne, P.; Cunningham, M. F.; Neufeld, R. J. Polymerization Induced Self-Assembly of Alginate Based Amphiphilic Graft Copolymers Synthesized by Single Electron Transfer Living Radical Polymerization. Biomacromolecules 2015, 16, 2040-2048.
-

- 22. Abasalizadeh, F.; Moghaddam, S. V.; Alizadeh, E.; Akbari, E.; Kashani, E.; Fazljou, S. M. B.; Torbati, M.; Akbarzadeh, A. Erratum: Alginate-Based Hydrogels as Drug Delivery Vehicles in Cancer Treatment and Their Applications in Wound Dressing and 3D Bioprinting. J. Biol. Eng.2020, 14, 8.
-

- 23. Kang, S.-M.; Rethinasabapathy, M.; Lee, G. W.; Kwak, C. H.; Park, B.; Kim, W. S.; Huh, Y. S. Generation of Multifunctional Encoded Particles Using a Tetrapod Microneedle Injector. J. Ind. Eng. Chem. 2019, 74, 164-171.
-

- 24. Wang, H.; Zhao, Z.; Liu, Y.; Shao, C.; Bian, F.; Zhao, Y. Biomimetic Enzyme Cascade Reaction System in Microfluidic Electrospray Microcapsules. Sci. Adv. 2018, 4, eaat2816.
-

- 25. Poncelet, D.; Neufeld, R.; Bugarski, B.; Amsden, B. G.; Zhu, J.; Goosen, M. F. A. A Parallel Plate Electrostatic Droplet Generator: Parameters Affecting Microbead Size. Appl. Microbiol. Biotechnol.1994, 42, 251-255.
-

- 26. Min, K. W.; Youm, K. H. Preparation of Alginate Microspheres by Rotating Membrane Emulsification. Membr. J. 2021, 31, 52-60.
-

- 27. Kang, S.-M.; Rethinasabapathy, M.; Hwang, S. K.; Lee, G. W.; Jang, S. C.; Kwak, C. H.; Choe, S. R.; Huh, Y. S. Microfluidic Generation of Prussian Blue-Laden Magnetic Micro-Adsorbents for Cesium Removal. Chem. Eng. J.2018, 341, 218-226.
-

- 28. Li, W.; Zhang, L.; Ge, X.; Xu, B.; Zhang, W.; Qu, L.; Choi, C.; Xu, J.; Zhang, A.; Lee, H.; Weitz, D. A. Microfluidic Fabrication of Microparticles for Biomedical Applications. Chem. Soc. Rev. 2019, 47, 5646-5683.
-

- 29. Park, B.; Ghoreishian, S. M.; Kim, Y.; Park, B. J.; Kang, S.-M.; Huh, Y. S. Dual-Functional Micro-Adsorbents: Application for Simultaneous Adsorption of Cesium and Strontium. Chemosphere 2021, 263, 128266.
-

- 30. Shin, Y. C.; Kim, K. S.; Kim B. S. Loading Behavior of pH-Responsive P(MAA-co-EGMA) Hydrogel Microparticles for Intelligent Drug Delivery Applications. Polym. Korea 2008, 32, 421-426.
- 31. Vigata, M.; Meinert, C.; Hutmacher, D. W.; Bock, N. Hydrogels as Drug Delivery Systems: A Review of Current Characterization and Evaluation Techniques. Pharmaceutics 2020, 12, 1188.
-

- 32. Kumar, K.; Kim, E.; Alhammadi, M.; Reddicherla, U.; Aliya, S.; Tiwari, J. N.; Park, H. S.; Choi, J. H.; Son, C. Y.; Vilian, A. T. E.; Han, Y. K.; Bu, J.; Huh, Y. S. Recent Advances in Microfluidic Approaches for the Isolation and Detection of Exosomes. TrAC Trends Anal. Chem. 2023, 159, 116912.
-

- 33. Maeda, K.; Onoe, H.; Takinoue, M.; Takeuchi, S. Controlled Synthesis of 3D Multi-Compartmental Particles with Centrifuge-Based Microdroplet Formation from a Multi-Barrelled Capillary. Adv. Mater. 2012, 24, 1340-1346.
-

- 34. Shin, H. S.; Kim, S. Y.; Lee, K. H.; Kim, S. J.; Lee, Y. M. Synthesis and Properties of Poly(acrylamide)-Gelatin Interpenetrating Polymer Networks. Polym. Korea 1998, 22, 683-690.
- 35. Bajpai, S. K.; Sharma, S. Investigation of Swelling/Degradation Behaviour of Alginate Beads Crosslinked with Ca2+ and Ba2+ Ions. React. Funct. Polym. 2004, 59, 129-140.
-

- 36. Ko, N. Y.; Lee, P. H.; Sung, A. Y.; Lee, H. M. Study on Characteristic Changes of Contact Lenses According to Interpenetrating Polymer Network Time and Method Using Seaweed Polysaccharide. Polym. Korea 2021, 45, 775-782.
-

- 37. Berkland, C.; Kipper, M. J.; Narasimhan, B.; Kim, K.; Pack, D. W. Microsphere Size, Precipitation Kinetics and Drug Distribution Control Drug Release from Biodegradable Polyanhydride Microspheres. J. Control. Release 2004, 94, 129-141.
-

- 38. Kim, B. J.; Jeong, H. S.; Choi, C-H. Highly Efficient Production of Monodisperse Poly(Ethylene Glycol) (PEG) Hydrogel Microparticles by Utilizing Double Emulsion Drops with a Sacrificial Thin Oil Shell. Korean Chem. Eng. Res.2022, 60, 139-144.
- 39. Naiel, B. H.; El-Subruiti, G. M.; Khalifa, R. E.; Eltaweil, A. S.; Omer, A. M. Construction of Gastroretentive Aminated Chitosan Coated (Sunflower Oil/Alginate/i-Carrageenan) Floatable Polymeric Beads for Prolonged Release of Amoxicillin Trihydrate. J. Drug Deliv. Sci. Technol 2023, 84, 104534.
-

- 40. Park, J. H.; Han, C. M.; Lee, E. J.; Kim, H. W. Preparation of Highly Monodispersed Porous-Channeled Poly(Caprolactone) Microspheres by a Microfluidic System. Mater. Lett. 2016, 181, 92-98.
-

- 41. Kang, S.-M.; Lee, G. W.; Huh, Y. S. Centrifugal Force-Driven Modular Micronozzle System: Generation of Engineered Alginate Microspheres. Sci. Rep.2019, 9, 12776.
-

- 42. Lee, B. B.; Ravindra, P.; Chan, E. S. A Critical Review: Surface and Interfacial Tension Measurement by the Drop Weight Method. Chem. Eng. Commun. 2008, 195, 889-924.
-

- 43. Sattari, A.; Janfaza, S.; Mashhadi Keshtiban, M.; Tasnim, N.; Hanafizadeh, P.; Hoorfar, M. Microfluidic On-Chip Production of Alginate Hydrogels Using Double Coflow Geometry. ACS Omega 2021, 6, 25964-25971.
-

- 44. Yu, D.; Dong, Z.; Lim, H. T.; Chen, Y.; Ding, Z.; Sultana, N.; Wu, J.; Qin, B.; Cheng, J.; Li, W. Microfluidic Preparation, Shrinkage, and Surface Modification of Monodispersed Alginate Microbeads for 3D Cell Culture. RSC Adv. 2019, 9, 11101-11110.
-

- 45. Olivares, A.; Silva, P.; Altamirano, C. Microencapsulation of Probiotics by Efficient Vibration Technology. J. Microencapsul. 2017, 34, 667-674.
-

- 46. Lee, E.; Kim, K.; Kim, B. Effect of P(MAA-PEGMA) Hydrogel Compositions and Loading pH on the Loading Efficiency of Cosmetic Active Agents. Polym. Korea 2009, 441-445.
- 47. Kang, M. K.; Kim, J.-C. Preparation and Release Property of Alginate Beads Immobilizing Poly(N-isopropylacrylamide-co-dimethylamino ethyl methacrylate). Polym. Korea 2010, 34, 79-83.
-

- 48. Chiang, C. Y.; Chu, C. C. Synthesis of Photoresponsive Hybrid Alginate Hydrogel with Photo-Controlled Release Behavior. Carbohydr. Polym. 2015, 119, 18-25.
-

- 49. Baghbani, F.; Chegeni, M.; Moztarzadeh, F.; Mohandesi, J. A.; Mokhtari-Dizaji, M. Ultrasonic Nanotherapy of Breast Cancer Using Novel Ultrasound-Responsive Alginate-Shelled Perfluorohexane Nanodroplets: In Vitro and in Vivo Evaluation. Mater. Sci. Eng. C 2017, 77, 698-707.
-

- 50. Suhail, M.; Li, X. R.; Liu, J. Y.; Hsieh, W. C.; Lin, Y. W.; Wu, P. C. Fabrication of Alginate Based Microgels for Drug-Sustained Release: In-Vitro and in-Vivo Evaluation. Int. J. Biol. Macromol. 2021, 192, 958-966.
-

- 51. Smith, P. T.; Altin, G.; Millik, S. C.; Narupai, B.; Sietz, C.; Park, J. O.; Nelson, A. Methacrylated Bovine Serum Albumin and Tannic Acid Composite Materials for Three-Dimensional Printing Tough and Mechanically Functional Parts. ACS Appl. Mater. Interfaces 2022, 14, 21418-21425.
-

- 52. Long, T.; Tan, W.; Tian, X.; Tang, Z.; Hu, K.; Ge, L.; Mu, C.; Li, X.; Xu, Y.; Zhao, L.; Li, D. Gelatin/Alginate-Based Microspheres with Sphere-in-Capsule Structure for Spatiotemporal Manipulative Drug Release in Gastrointestinal Tract. Int. J. Biol. Macromol.2023, 226, 485-495.
-

- 53. Sharma, V.; Jaishankar, A.; Wang, Y. C.; McKinley, G. H. Rheology of Globular Proteins: Apparent Yield Stress, High Shear Rate Viscosity and Interfacial Viscoelasticity of Bovine Serum Albumin Solutions. Soft Matter 2011, 7, 5150-5160.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(5): 660-668
Published online Sep 25, 2023
- 10.7317/pk.2023.47.5.660
- Received on Jun 4, 2023
- Revised on Jul 2, 2023
- Accepted on Jul 4, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sung-Min Kang
-
*Department of Green Chemical Engineering, Sangmyung University, Cheonan 31066, Korea
**Future Environment and Energy Research Institute, Sangmyung University, Cheonan 31066, Korea - E-mail: smkang@smu.ac.kr
- ORCID:
0000-0001-5758-2628









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.