- Preparation of (−)-Epigallocatechin Gallate (EGCG)-encapsulated Gelatin Nanoparticles by Nanoprecipitation and Their Characteristics
Department of Chemical Engineering, Daegu University, Gyeongbuk 38453, Korea
- (−)-Epigallocatechin Gallate (EGCG)를 담지한 젤라틴 나노입자의 나노침전법을 이용한 제조 및 특성
대구대학교 공과대학 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
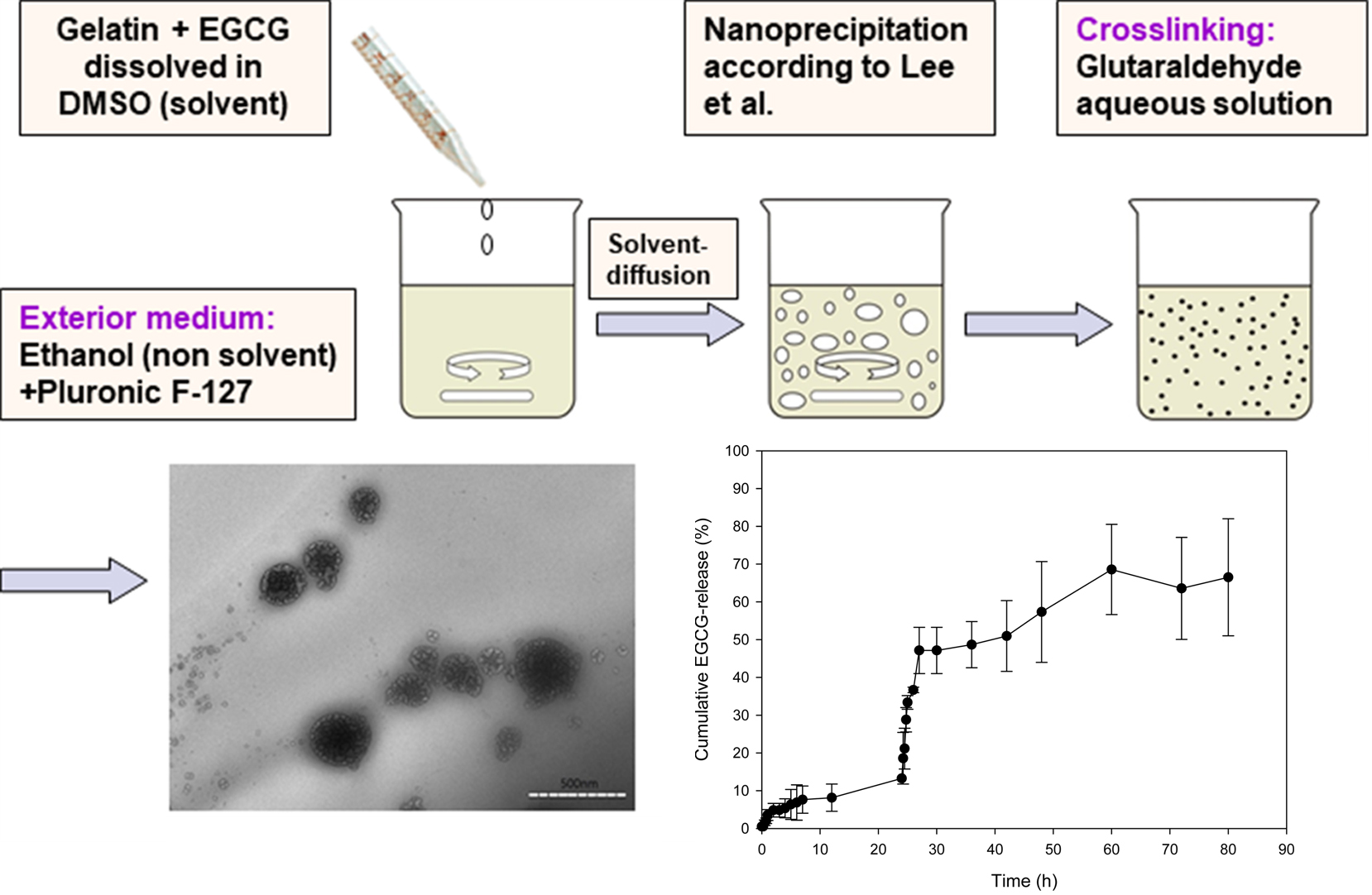
In this study, gelatin nanoparticles loaded with (-)-epigallocatechin gallate (EGCG) were prepared by nanoprecipitation reported by Lee et al. (Bioprocess Biosyst. Eng., 2012, 35, 297-307; J. Biomater. Sci. Polym. Ed., 2011, 22, 753-771) in order to improve cumulative EGCG-release efficiency as well as to extend the period of slow release of EGCG, using dimethyl sulfoxide, which is a polar aprotic solvent, and ethanol as a solvent and a nonsolvent, respectively. Average size and zeta potential of the gelatin nanoparticles loaded with EGCG (GNLE) were 160.5(±7.2) nm and –13.9(±0.14) mV, respectively. In EGCG-release studies, GNLE released 66.5% of the amount of encapsulated EGCG. Moreover, GNLE showed a slow EGCG-release behavior for ca. 60 h except for the period of 2-3 h during which EGCG-cumulative release was increased rapidly due to the acceleration of EGCG-release by the addition of trypsin
본 연구에서는 (-)-epigallocatechin gallate(EGCG)의 방출효율 개선과 서방(slow release) 기간 연장을 위하여 Lee 등이 보고한 나노침전법을 적용하여(Bioprocess Biosyst. Eng., 2012, 35, 297-307; J. Biomater. Sci. Polym. Ed., 2011, 22, 753-771), 극성 비양자성 용매인 dimethyl sulfoxide와 에탄올을 각각 용매와 비용매로 사용하여 EGCG를 담지한 젤라틴 나노전달체를 제조하였다. EGCG 담지 젤라틴 나노입자의 평균 크기는 160.5(±7.2) nm이었고 평균 제타포텐셜 값은 –13.9(±0.14) mV이었다. 본 연구의 방출실험에서 젤라틴 나노입자에 담지된 EGCG의 66.5%가 방출되었다. 본 연구의 방출실험에서 EGCG 담지 젤라틴 나노입자의 방출특성은, 트립신(trypsin)을 첨가하여 EGCG의 누적방출량이 가속화되어 방출이 급격히 증가한 2-3시간을 제외한 방출시간인 약 60시간 동안 EGCG의 서방성을 보였다
Gelatin nanoparticles loaded with (-)-epigallocatechin gallate (EGCG) were prepared by nanoprecipitation reported by Lee et al. in order to improve cumulative EGCG-release efficiency as well as to extend the period of slow release of EGCG, using dimethyl sulfoxide (DMSO), which is polar aprotic solvent, and ethanol as a solvent and a nonsolvent, respectively.
Keywords: (-)-epigallocatechin gallate, gelatin, nanoprecipitation, dimethyl sulfoxide, gelatin nanoparticles loaded with EGCG
이 논문은 2019년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No. NRF-2019R1F1A1059707).
녹차는 차 작물을 우려낸 것으로서 동 아시아에서 건강증진에 도움이 되어 오랜 기간 소비되어 왔다.1,2 녹차에는 플라바놀(flavanol), 플라본(flavone) 및 플라보놀(flavonol)로 구성된 폴리페놀(polyphenol)이 다량 함유되어 있고,3 특히 카테킨(catechin)과 같이 폴리페놀이라는 항산화제가 고농도가 함유되어 있다.4,5 최근 연구에서 이러한 폴리페놀은 암, 혈관 및 퇴행성 질병, 당뇨, 비만 등의 예방과 치료에 유용하다고 보고되었다.6-8 플라바놀은 녹차의 주요 성분으로서 건조엽 질량의 1/3을 차지하는 카테킨이고, (-)-epicatechin(EC), (-)-epigallocatechin(EGC), (-)-epicatechin gallate(ECG), and (-)-epigallocatechin gallate(EGCG)의 네가지 분자로 구성되어 있다.4 그 중에서 EGCG는 녹차에 존재하는 총 카테킨의 65%를 차지하여 가장 풍부하고, 치료 효능이 있는 카테킨이다.9
나노전달체는 일부 약물의 약물동력학적 특성이나 안정성을 변화시킬 수 있는데,10 EGCG 경우도 나노기술이 카테킨의 생체이용률을 크게 개선할 수 있는 경우에 해당된다.11 EGCG 전달에 사용되는 나노시스템은 lipid 나노입자, 무기나노입자 및 젤라틴과 같은 단백질/펩타이드 기반 나노입자 등을 포함한다. 젤라틴은 생체적합성과 생분해성이 있고 독성이 적은 천연고분자이다.12 젤라틴은 찬 물에는 용해되지 않으나, 체온 근처(35-38 oC)에서의 더운 물에서 완전하게 용해된다.13-15 젤라틴의 친수성은 젤라틴 입자 내부로 물의 침투를 용이하게 하고, 확산을 통한 약물방출을 개선한다.16 젤라틴의 친수성은 면역체계로부터 보호될 수 있어서, 젤라틴 나노입자는 인체 내에서의 순환기간이 연장되고 암세포 주변에 축적률이 높다고 보고되고 있다.17-19 젤라틴은 생체재료로서 구하기 쉬운 천연 거대분자(macromolecule)이고, 비교적 낮은 항원성을 가지는 등의 많은 장점을 가지고, 지금까지 비경구 제재에 폭넓게 사용되었다.20 젤라틴 분자는 다른 기능성을 확장하고 화학적 유도체화를 통하여 구조변경하기 유리하게 풍부한 관능기가 있다.21 게다가, 젤라틴은 백신의 안정제로서 널리 쓰이며 혈관 외 투여에 FDA에 의하여 승인되었다.16,22
Honda 등은23 EGCG와 젤라틴을 증류수에서 용해시키고, 탈수축합제로서 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride(DMT-MM)와 N-methylmorpholine (NMM)을 첨가하여 탈수축합(dehydrative condensation) 반응을 시켜서 EGCG와 젤라틴이 가교된 스펀지 폼의 EGCG-conjugated 젤라틴을 제조하였는데, 적은 양의 탈수축합제로 가교된 EGCG-conjugated 젤라틴 스펀지 폼은 물에 쉽게 재용해되어서 EGCG와 젤라틴 외에 적정량의 탈수축합제의 첨가의 필요성을 보고하였다. 또한 가교된 EGCG-conjugated 젤라틴은 EGCG-conjugated 젤라틴의 분해를 늦추었으며, 골 치료에서 EGCG 방출을 지연(delayed release)시켰다고 보고하였다. Admire 등은24 sodium tripolyphosphate(TPP)를 polyanion으로 하고, 초산용액에 (+)-catechin hydrate 또는 (-)-epigallocatechin gallate과 함께 용해된 키토산을 polycation으로 하여, 카테킨을 담지하는 키토산 나노입자를 polyelectrolyte complex 법으로 제조하였다. Chen 등은25 카테킨 용액과 젤라틴 용액을 직접 혼합하여, 젤라틴과 카테킨 각각의 지방족과 방향족 수산화(-OH)기 간의 수소결합에 의하여 200 nm 이하의 음전하를 가지는 차 카테킨/젤라틴 나노입자를 제조하였고, 카테킨 담지율(loading efficiency)은 96%를 초과하여 거의 모든 카테킨이 나노입자에 담지되었다고 보고하였다. 또한 수소결합된 카테킨은 카테킨/젤라틴 나노입자에서 트립신(trypsin)에 의한 젤라틴의 분해를 억제하였다고 보고하였다. 마찬가지로 폴리페놀은 콜라겐과 비공유결합을 통하여 결합하는 것으로 알려져 있다. 카테킨은 수소결합과 소수성 상호작용(hydrophobic interaction)을 통해서 콜라겐을 열적 안정화 및 고농도의 우레아(urea)와 같은 화학적인 디스테빌라이저(destabilizer) 처리에도 불구하고 구조적으로 안정화시킨다고 보고되고 있다.26 그러나 Chen 등의25 연구에서 젤라틴과 카테킨 간의 직접적인 수소결합은 96% 이상의 높은 담지율을 가지지만 젤라틴으로부터 카테킨의 방출을 비가역적으로 거의 봉쇄함으로써, 차 카테킨/젤라틴 나노입자의 카테킨 방출용 전달체로서의 효용성을 낮춘다. Chang 등은27 인간의 제대정맥혈관 내피세포(HUVECs)에 발현되는 aVb3 인테그린(integrin)을 표적하는 알기닌(arginin)-글라이신(glycin)-아스파틱산(aspartic acid) 펩타이드로 코팅된 젤라틴/EGCG 나노입자를 Chen 등과25 같이 수소결합에 의하여 제조하여, 각막 신생혈관증식 방지(corneal neovascularization)를 위한 점안액으로서 제대정맥혈관 내피세포의 활성을 방지하여 혈관생성을 억제하였다고 보고하였다. 그러나 Chang 등은27 약물방출 거동 분석에 있어서 젤라틴과 수소결합된 EGCG가 아닌 carboxytetramethylrhodamine(TAMRA) 형광염료를 사용하여 TAMRA 형광염료의 약 11.5%가 방출되었다고 보고하였다. 한편, Lee 등은28,29 종래에 소수성 약물을 소수성 고분자 나노입자에 담지하기 위하여 적용되던 나노침전법(nanoprecipitation)을 수용성 약물을 함유한 젤라틴 나노입자의 제조에 처음으로 적용하였다. 또한 Lee 등은30 2단계 방식이 아닌 single stage 방식의 o/w/o 에멀젼법을 적용하여 파클리탁셀(paclitaxel)을 함유한 젤라틴 나노입자를 제조하고, 담지된 약물의 방출특성으로써 젤라틴 나노입자에 담지된 파클리탁셀의 서방성(slow release)을 입증하였다.
양자성 용매(protic solvent)는 강한 수소결합에 의하여 음전하의 용질을 용해시키고, 비양자성 용매(aprotic solvent)는 큰 쌍극자 모멘트(dipole moment)를 가지기 쉽고 음의 쌍극자(dipole)를 통하여 양전하의 용질을 용해시킨다.31 Ka 등은32 o-nitroanilide가 극성 비양자성(polar aprotic) 용매인 poly (aryl ether amide)에 용해되고 용매에 의한 수소결합 모드 변화에 의해서, 수소결합 수용체인 극성 비양자성 용매 분자가 o-nitroanilide 분자 내의 수소결합을 깨고 o-nitroanilide 분자 간의 수소결합을 유도하여 물리적 젤을 형성하였다고 보고하였다.
본 연구에서는 EGCG의 방출효율 개선과 서방(slow release) 기간 연장을 위하여, 천연고분자로서 젤라틴을 활용하여 항암약물인 EGCG를 함유한 젤라틴 나노전달체를, 극성 비양자성 용매인 dimethyl sulfoxide(DMSO)와 에탄올을 각각 용매와 비용매로 사용하여 Lee 등이28,29 보고한 나노침전법을 적용하여 제조하고 분석하였다. 또한 제조한 EGCG를 함유한 젤라틴 나노입자의 EGCG 방출특성을 트립신과 같은 효소 투입 전과 후의 거동특성으로 나누어 관찰하고, Chen 등과25 Chang 등의27 연구 결과와 비교 분석하였다.
시약 및 재료.젤라틴(Type B(bloom 75)) 및 Pluronic F-127은 Sigma-Aldrich(USA)에서 구매하여 사용하였다. Dimethyl sulfoxide(DMSO)(extra pure, 99% min)는 OCI Company Ltd.(한국)에서 구매하여 사용하였다. (-)-Epigallocatechin gallate(EGCG)(No. 70935, purity ³98%)는 Cayman chemical (USA)에서 구매하여 사용하였다. 글루타알데히드 용액(glutaraldehyde solution 25%)은 Merk(독일)에서 구매하여 사용하였다. 트립신(trypsin)(Biochemica 93613)은 Fluka(스위스)에서 구매하여 사용하였다.
나노침전법에 의한 EGCG 담지 젤라틴 나노입자 제조.젤라틴 40 mg을 극성 비양자성 용매인 2 mL의 DMSO에 60 oC를 유지하면서 용해시키고, 교반한 용액에 EGCG 1 mg을 첨가하였다. 계면활성제로서 pluronic F-127 1.28 g을 30 mL의 에탄올에 첨가하여 용액을 준비한 뒤, EGCG가 첨가된 젤라틴용액을 비용매인 에탄올에 적하하였다. 15분 후에 가교제로서 5% 글루타알데히드용액 96 μL를 첨가하고, 생성된 젤라틴 나노입자를 가교시키기 위하여 약 12시간 동안 950 rpm으로 교반하였다. 생성된 젤라틴 나노입자를 포함한 용액은 15분간 12000 g로 원심분리 후에 상층액(supernatant)을 제거하였다. 분리된 젤라틴 나노입자에 6 mL 증류수를 첨가하여 재분산한 후에 15분간 12000 g로 원심분리하고 상층액을 제거하였다. 상층액을 제거한 EGCG를 담지한 젤라틴 나노입자를 -75 oC로 예비동결하고 동결건조기로 2일간 건조시켰다.
EGCG 담지 젤라틴 나노입자의 크기, 제타포텐셜 및 수율 분석.EGCG가 담지된 젤라틴 나노입자의 크기 및 제타포텐셜 값을 측정하기 위하여 제타포텐셜측정기(Malvern, Zetasizer Nano ZS, 영국)를 이용해서 3개의 시료를 사용하여 각각 3회 측정하였다. 또한 동결건조기로 건조 후의 젤라틴 나노입자 무게를 측정하여 수율(yield)을 산출하였다.
EGCG 담지 젤라틴 나노입자의 SEM 및 TEM 분석. EGCG가 담지된 젤라틴 나노입자의 SEM 분석을 위하여 scanning electron microscopy(Hitachi High-Technologies, SU-8220, 일본)을 사용하였다. SEM 분석에서, 젤라틴 나노입자 서스펜션의 한 방울을 유리판에 집적시키고 실온 및 대기 상에서 건조한 후에 백금으로 sputter 코팅시키고 15 kV의 가속전압에서 scanning electron microscopy로 EGCG가 담지된 젤라틴 나노입자의 표면형태를 관찰하였다. 또한 동결건조한 EGCG가 담지된 젤라틴 나노입자의 SEM 분석을 하였다. 한편, EGCG가 담지된 젤라틴 나노입자의 TEM 분석을 위하여 transmission electron microscope(Hitachi High-Technologies, H-7600, 일본)를 사용하였다. TEM 분석에서는 젤라틴 나노입자 서스펜션의 한 방울을 카본코팅된 그리드(carbon-coated grid)에 집적시키고 진공오븐에서 25 oC에서 24시간 동안 건조한 후에, 100 kV에서 TEM으로 관찰하였다.
EGCG 담지 젤라틴 나노입자의 FTIR 분석.KBr 분말과 EGCG가 담지된 젤라틴 나노입자 분말을 100:1의 비율로 혼합하고 혼합물을 압축하여, EGCG가 담지된 젤라틴 나노입자 펠렛을 제조하였다. 이러한 펠렛의 FTIR 스펙트럼(Perkin Elmer, Frontier, USA)을 구하여 FTIR 분석을 수행하였다.
EGCG의 표준곡선(Standard Curve) 분석.1 mg EGCG를 100 mL의 phosphate 완충용액(PBS, pH 7.4)에 용해시켜서 0.01 mg/mL 표준곡선 원액을 제조하였다. 이 원액을 PBS로 계속 희석하여 0.0075, 0.005, 0.0025, 0.001 및 0.0005 mg/mL의 EGCG 용액을 제조하였다(A). 한편, 원액을 10배 희석하여 0.001 mg/mL의 EGCG 용액을 제조하였다. 이 용액을 PBS로 희석하여 0.00075, 0.0005, 0.00025, 0.0001 및 0.00005 mg/mL의 EGCG 용액을 제조하였다(B). 이와 같이 제조된 각 농도 군(A, B)에 대한 흡광도를 280 nm 파장에서 측정하여 EGCG의 표준곡선을 구축하였다.
EGCG 담지 젤라틴 나노입자의 담지효율 분석.EGCG를 담지한 젤라틴 나노입자 제조공정에서 원심분리 후에 제거된 상층액의 흡광도를 측정하고 EGCG의 표준곡선에 기준하여 구한 젤라틴 나노입자에 담지되지 않은 상층액의 EGCG 농도에 상층액 부피를 곱하여 비담지된 EGCG 양(free EGCG)을 도출하였다. 도출된 비담지된 EGCG 양을 식 (1)에 대입하여 EGCG 담지효율(encapsulation efficiency)을 구하였다.
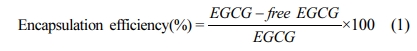
where, EGCG: EGCG-input, free EGCG: Mass of EGCG dissolved in the supernatant.
EGCG 담지 젤라틴 나노입자의 약물방출실험 및 Entrapment 효율분석.약물방출을 관찰하기 위하여 동결건조한 젤라틴 나노입자 10 mg을, PBS(pH 7.4) 50 mL가 각각 담긴 두 개의 플라스크에, 각각 첨가하고 각 플라스크를 진탕배양기를 이용하여 37 oC에서 100 rpm으로 진탕하면서 각각 예정된 시간에 샘플링하고, 각 샘플의 280 nm의 파장에서의 흡광도를 측정하였다. 진탕 후 24 시간 후에 각각의 플라스크에 트립신 25 mg을 첨가하였다. 진탕 후 10, 20, 30분, 1, 2, 3, 4, 5, 6, 12, 24시간 및 그 후에 10, 20, 30분, 25, 26, 27, 30, 36, 42, 48, 60, 72 및 80시간에 샘플을 각각 채취하여 각각의 흡광도를 측정한 후에 각각의 플라스크에 재충전하였다.
나노침전법에 의한 EGCG 담지 젤라틴 나노입자 크기, 제타포텐셜 및 수율 분석 결과.EGCG 담지 젤라틴 나노입자의 평균크기와 PDI 값은 각각 160.5(±7.2) nm과 0.167 (±0.068)이었고 평균 제타포텐셜 값은 –13.9(±0.14) mV이었다. 또한 EGCG 담지 젤라틴 나노입자의 수율은 33.7%이었다.
EGCG 담지 젤라틴 나노입자의 SEM 및 TEM 분석 결과. EGCG가 담지된 젤라틴 나노입자의 SEM 및 TEM 분석결과는 각각 Figure 1(A)/1(B) 및 1(C)와 같다. EGCG가 담지된 젤라틴 나노입자의 건조 후에 유리판 위에서 분산된 SEM 이미지와 동결건조 후의 응집된 나노입자의 SEM 이미지를 각각 Figure 1(A) 및 Figure 1(B)와 같이 관찰하였다. EGCG 담지 젤라틴 나노입자의 형태는 일반적으로 구형에 근접하였고, EGCG 담지 젤라틴 나노입자의 크기는 입도분석에 의한 평균 크기와 유사하게 관찰되었다. 한편, EGCG 담지 젤라틴 나노입자는 TEM microscopy에 의하면 Figure 1(C)와 같이 더 작은 젤라틴 입자들이 응집하여 구성되었음이 관찰되었다. 이러한 젤라틴 나노입자의 구성에서 더 작은 나노입자의 크기는 젤라틴 마이셀의 크기와33 유사하였고, 젤라틴 나노입자가 젤라틴 마이셀로 구성되었다고 제시한 Lee 등의30 관찰과 일치하였다.
EGCG 담지 젤라틴 나노입자의 FTIR 분석결과.EGCG, 젤라틴 및 EGCG가 담지된 젤라틴 나노입자의 FTIR 분석결과로 구한 FTIR 스펙트럼은 Figure 2와 같다. EGCG의 FTIR 스펙트럼에서 3349 cm-1 근처의 흡수대에서 피크가 나타났고, 이러한 피크는 페놀 하이드록실(hydroxyl, -OH) 기의 진동에 기인하였다. 젤라틴의 FTIR 스펙트럼에서 1632과 1520 cm-1 근처에서 관찰된 피크들이 나타났고, 이러한 피크들은 각각 C=O(amide I) 및 N-H(amide II) 기의 굽힘진동에 기인하였다. 또한 3281 cm-1 근처의 흡수대에서 젤라틴의 지방족(aliphatic) 하이드록실기를 나타내는 특성 피크가 나타났다. 한편, EGCG가 담지된 젤라틴 나노입자의 FTIR 스펙트럼에서는 3293 cm-1 근처의 흡수대에서 하이드록실기를 나타내는 특성 피크가 나타나서, 젤라틴의 지방족 하이드록실기가 관찰된 3281 cm-1 근처의 흡수대에서의 이동이 관찰되었다. 이러한 본 연구에서의 흡수대의 이동관찰은,
Chen 등이25 보고한 젤라틴의 하이드록실기와 EGCG의 하이드록실기 간의 수소결합으로 인한 EGCG가 담지된 젤라틴 나노입자의 하이드록실기를 나타내는 특성 피크의, 젤라틴의 하이드록실기의 특성 피크의 파수(wavenumber)인 3426 cm-1로부터 3388 cm-1으로의 이동보다 더 작았다. 따라서 본 연구에서 극성 비양자성 용매를 이용하여 나노침전법으로 제조한 EGCG가 담지된 젤라틴 나노입자는 Chen 등이25 보고한 젤라틴 나노입자에 비하여 담지된 EGCG와 젤라틴 분자 간에 수소결합의 영향이 상대적으로 더 적어서, 젤라틴으로부터 카테킨의 방출이 비가역적으로 봉쇄되지 않고 서서히 방출되어서 담지된 EGCG의 생체이용률(bioavailability)이 개선되리라고 사료된다.
EGCG 담지 젤라틴 나노입자의 EGCG 방출 흡광도 분석.EGCG를 담지한 젤라틴 나노입자의 in vitro 약물방출실험에서 in vitro 약물방출실험 24시간째에 트립신 25 mg을 실험 중인 시료에 첨가하여 젤라틴의 단백질을 분해하여 미방출된 EGCG를 방출되게 하였다. EGCG 담지 젤라틴 나노입자의 in vitro 약물방출실험에서 280 nm의 파장에서 시간에 따른 흡광도 추이는 Figure 3과 같다.
EGCG의 표준곡선 식(Standard Curve Equation).EGCG의 표준곡선 분석 결과로 280 nm의 파장에서 다음과 같은 선형 식이 도출되었다. 변수(x)인 0.01, 0.0075, 0.005, 0.0025, 0.001 및 0.0005 mg/mL의 EGCG 용액(A)의 흡광도 측정값(y)으로부터 y = 49.978x + 0.0019(R2 = 0.9977)의 표준곡선 식을 구하고, 변수(x)인 0.001, 0.00075, 0.0005, 0.00025, 0.0001 및 0.00005 mg/mL의 EGCG 용액(B)의 흡광도 측정값(y)으로부터 y = 42.661x + 0.002(R2 = 0.9604)의 표준곡선식을 구하였다.
EGCG 담지 젤라틴 나노입자의 EGCG 담지효율 분석 및 EGCG 방출.본 연구에서 EGCG를 담지한 젤라틴 나노입자의 담지효율 분석에서 EGCG 담지효율은 92%로서 Chen 등이25 보고한 96%의 담지효율보다 다소 적었다. 따라서 EGCG 방출실험에서 투입된 10 mg의 EGCG-담지 젤라틴 나노입자에 담지된 EGCG 양은 0.23 mg으로 산정되었다. 한편, EGCG를 담지한 젤라틴 나노입자의 in vitro 약물방출실험에서 280 nm의 파장에서의 상기 표준곡선 식으로 환산한 EGCG의 방출량 추이는 Figure 4와 같다.
나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자는 진탕 후 24시간까지 EGCG 누적 방출량이 서서히 증가하는 비정상 상태에서 0.03 mg에 도달하여 EGCG 누적 방출률이 13%인 서방성을 보였다. 그 후에 EGCG 방출을 가속하기 위하여 트립신을 첨가한 후에는 젤라틴 나노입자가 급격히 분해되면서 누적 방출량은 트립신 첨가 후 2~3시간까지 급격히 증가하였다. 따라서 Chen 등25 연구에서와 같은 카테킨/젤라틴 나노입자의 젤라틴에 수소결합된 카테킨의, 트립신에 의한 젤라틴 분해에 대한 억제는 관찰되지 않았다. 한편, 누적 방출량은 대부분의 방출시간인 60시간까지 서서히 증가하고 그 후부터 80시간까지 정상 상태를 유지하였다. 방출된 총 EGCG 양은 0.153 mg이었고 총 누적 방출률은 66.5%이었다. 따라서 본 연구의 방출실험에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자는, 젤라틴과 수소결합되어 담지된 EGCG 대신에 사용한 TAMRA 형광염료의 약 11.5%가 방출된 Chang 등의27 연구 결과보다 훨씬 우수한 약물 방출효율(%)을 보였다. 더구나 Chang 등의27 약물방출실험에서 방출 시간은 30시간까지였으나, 본 연구의 방출실험에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자의 방출특성은 트립신을 첨가하여 EGCG의 누적방출량이 급격히 증가한 2-3시간을 제외한 60시간까지 서방성을 보였다. 또한 Chang 등은27 약물방출실험에서 EGCG의 방출이 비가역적으로 봉쇄되는 젤라틴과 수소결합된 EGCG 대신에 TAMRA 형광염료의 방출을 관찰하였으므로 Chang 등의27 약물방출실험에서 예상되는 EGCG의 방출효율(%)은 약 11.5%보다 훨씬 더 적다고 제시되었다. 따라서 본 연구에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자는, 본 연구의 방출실험 결과와 같이 Chang 등의27 실험 결과보다 훨씬 우수한 EGCG의 방출효율(%)과, 더 우수한 서방성을 특성으로 가졌다. 이와 같이 본 연구에서 제조된 EGCG를 담지한 젤라틴 나노입자의 EGCG 서방에 의하여 피부 콜라겐을 수소결합과 소수성 상호작용을 통해서 안정화하여 원하는 미용효과를 실현할 수 있다.

|
Figure 1 SEM image and TEM analysis of EGCG-encapsulated gelatin nanoparticles (GNLE) prepared by nanoprecipitation:(A) SEM image on glass plate upon drying; (B) SEM image upon freeze-drying; (C) TEM micrography. |

|
Figure 2 FTIR spectra of EGCG, gelatin and EGCG-entrapped gelatin nanoparticles (GNLE). |

|
Figure 3 EGCG release absorption profile from EGCG-entrapped gelatin nanoparticles (GNLE) prepared with DMSO and ethanol as solvent and nonsolvent, respectively, in PBS (pH. 7.4). |

|
Figure 4 EGCG release profile from EGCG-entrapped gelatin nanoparticles (GNLE) prepared with DMSO and ethanol as solvent and nonsolvent, respectively, in PBS (pH. 7.4). |
극성 비양자성 용매인 DMSO와 에탄올을 각각 용매와 비용매로 시용하여 나노침전법으로 제조한 EGCG 담지 젤라틴 나노입자의 특성을 구하고 EGCG의 방출거동을 분석하였다. EGCG 담지 젤라틴 나노입자의 평균크기는 160.5 nm (±7.2 nm)이었고 평균 제타포텐셜 값은 -13.9 mV((±0.14 mV)이었다. 본 연구의 방출실험에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자는, 담지된 EGCG의 66.5%가 방출되었고 담지된 EGCG의 약 11.5%가 방출된 Chang 등의27 연구 결과보다 더 우수한 약물 방출효율(%)을 보였다. 더구나 Chang 등의27 약물방출실험에서 방출 시간은 30시간까지였으나, 본 연구의 방출실험에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자의 방출특성은 트립신을 첨가하여 EGCG의 누적방출량이 급격히 증가한 2-3시간를 제외한 60시간까지 서방성을 보였다. 또한 Chang 등은27 약물방출실험에서 EGCG의 방출이 비가역적으로 봉쇄되는 젤라틴과 수소결합된 EGCG 대신에 TAMRA 형광염료의 방출을 관찰하였으므로 Chang 등의27 약물방출실험에서 EGCG의 방출효율(%)은 그보다 훨씬 더 적다고 제시되었다. 따라서 본 연구에서 나노침전법에 의해 제조된 EGCG 담지 젤라틴 나노입자는, 본 연구의 방출실험 결과와 같이 Chang 등의27 실험 결과보다 더 우수한 EGCG의 방출효율(%)과 더 우수한 서방성을 특성으로서 가졌다.
- 1. Chowdhury, A.; Sarkar, J.; Chakraborti, T.; Pramanik, P. K.; Chakraborti, S. Protective Role of Epigallocatechin-3-gallate in Health and Disease: a Perspective. Biomed. Pharmacother. 2016, 78, 50-59.
-

- 2. Afzal, M.; Safer, A. M.; Menon, M. Green Tea Polyphenols and Their Potential Role in Health and Disease. Inflammopharmacology 2015, 23, 151-161.
-

- 3. Botten, D.; Fugallo, G.; Fraternali, F.; Molteni, C. Structural Properties of Green Tea Catechins. J. Phys. Chem. B 2015,119, 12860-12867.
-

- 4. Graham, H. N. Green Tea Composition, Consumption, and Polyphenol Chemistry. Prev. Med. 1992, 21, 334-350.
-

- 5. Cirillo, G.; Curcio, M.; Vittorio, O. Polyphenol Conjugates and Human Health: A Perspective Review. Crit. Rev. Food Sci. Nutr. 2016, 56, 326-337.
-

- 6. Singh, G.; Kaur, H.; Harikumar, S. L. Pleiotropic Effects of Green Tea: an Overview. Int. J. Pharm. Phytopharm. Res. 2015, 4, 223-226.
- 7. Zaveri, N. T. Green Tea and Its Polyphenolic Catechins: Medicinal Uses in Cancer and Noncancer Applications. Life Sci. 2006, 78, 2073-2080.
-

- 8. Crespy, V.; Williamson, G. A Review of the Health Effects of Green Tea Catechins In In Vivo Animal Models. J. Nutr. 2004,134, 3431S-3440S.
-

- 9. Islam, M. A. Cardiovascular Effects of Green Tea Catechins: Progress and Promise. Recent Pat. Cardiovasc. Drug Discov. 2012, 7, 88-99.
-

- 10. Sanvicens, N; Marco, M. P. Multifunctional Nanoparticles—properties and Prospects for Their Use in Human Medicine. Trends Biotechnol. 2008,26, 425-433.
-

- 11. Huo, C.; Wan, S. B.; Lamet, W. H. Thec hallenge of Developing Green Tea Polyphenols as Therapeutic Agents. Inflammophar-macology 2008,16, 248-252.
-

- 12. Mogosanu, G. D.; Grumezescu, A. M.; Bejenaru, C.; Bejenaru, L. E. Polymer Rotective Agents for Nanoparticles in Drug Delivery and Targeting. Int. J. Pharm. 2016, 510, 419-429.
-

- 13. Tseng, C. L.; Wang, T. W.; Dong, G. C.; Wu, S. Y. H.; Young, T. H.; Shieh, M. J.; Lou, P. J.; Lin, F. H. Development of Gelatin Nanoparticles with Biotinylated EGF Conjugation for Lung Cancer Targeting. Biomaterials 2007, 28, 3996-4005.
-

- 14. Ofokansi, K.; Winter, G.; Fricker, G.; Coester, C. Matrix-loaded Biodegradable Gelatin Nanoparticles as New Approach to Improve Drug Loading and Delivery. Eur. J. Pharm. Biopharm. 2010, 76, 1-9.
-

- 15. Parikh, S. S.; Mehta, H. H.; Doshi, V. P. A Review: a Novel Gelatin Based Delivery Systems for Gene Therapy and Paclitaxel Targeting Cancer Cells. Int. J. Pharm. Biol. Sci. 2012, 2, 183-192.
- 16. Lu, Z.; Yeh, T. K.; Tsai, M.; Au, J. L. S.; Wientjes, M. G. Paclitaxelloaded Gelatin Nanoparticles For Intravesical Bladder Cancer Therapy. Clin. Cancer. Res. 2004, 10, 7677-7684.
-

- 17. Kommareddy, S.; Amiji, M. Antiangiogenic Gene Therapy with Systemically Administered sFlt-1 Plasmid DNA in Engineered Gelatin-based Nanovectors. Cancer Gene. Ther. 2007, 14, 488-498.
-

- 18. Kaul, G.; Amiji, M. Tumor-targeted Gene Delivery Using Poly(Ethylene Glycol)-modified Gelatin Nanoparticles: in Vitro and In Vivo Studies. Pharm. Res. 2005, 22, 951-961.
-

- 19. Kommareddy, S; Amiji, M. Biodistribution and Pharmacokinetic Analysis of Long-circulating Thiolated Gelatin Nanoparticles Following Systemic Administration in Breast Cancer-bearing Mice. J. Pharm. Sci. 2007, 96, 397-407.
-

- 20. Coester, C. J.; Langer, K.; Briesen, H. V.; Kreuter, J. Gelatin Nanoparticles by Two Step Desolvation a New Preparation Method, Surfacemodifications and Cell Uptake. J. Microencapsul. 2000, 17, 187-193.
-

- 21. Han, S.; Li, M.; Liu, X.; Gao, H.; Wu, Y. Construction of Amphiphillic Copolymer Nanoparticles Based on Gelatin as Drug Carriers For Dexorubicin Delivery. Colloids Surf. B. 2013, 102, 833-841.
-

- 22. Zwiorek, K. Gelatin Nanoparticles as Delivery System for Nucleotide-based Drugs. Ph. D. Thesis, Dissertation Ludwig-Maximilians-University Munchen, 2006.
-

- 23. Honda, Y.; Tanaka, T.; Tomoko, T.; Kashiwagi, T.; Kaida, K.; Hieda, A.; Umezaki, Y.; Hashimoto, Y.; Imai, K.; Matsumoto, N.; Baba, S.; Shimizutani, K. Local Controlled Release of Polyphenol Conjugated With Gelatin Facilities Bone Formation. Int. J. Mol. Sci. 2015,16, 14143-14157.
- 24. Admire, D.; Nicolazzo, J. A.; Larson, I. Chitosan Nanoparticles Enhance the Intestinal Absorption of the Green Tea Catechins (+)-Catechin and (-)-Epigallocatechin Gallate. Eur. J. Pharm. Sci. 2010,41, 219-225.
-

- 25. Chen, Y. C.; Yu, S. H.; Tsai, G. J.; Tang, D. W.; Mi, F. L.; Peng, Y. P. Novel Technology for the Preparation of Self-assembled Ctechin/Gelatin Nanoparticles and Their Characterization. J. Agric. Food Chem. 2010,58, 6728-6734.
-

- 26. Madhan, B.; Subramanian, V.; Rao, J. R.; Nair, B. U.; Ramasami, T. Stabilization of Collagen Using Plant Polyphenol: Role of Catechin. Int. J. Biol. Macromol. 2005, 37, 47-53.
-

- 27. Chang, C. Y.; Wang, M. C.; Miyagawa, T.; Chen, Z. Y.; Lin, F. H.; Chen, K. H.; Liu, G. S.; Tseng, C. L. Preparation of Arginine-glycine-aspartic Acid-modified Biopolymeric Nanoparticles Containing Epigallocatechin-3-gallate for Targeting Vascular Endothelial Cells to Inhibit Corneal Neovascularization. Int. J. Nanomed. 2017,12, 279-294.
-

- 28. Lee, E. J.; Khan, S. A.; Park, J. K.; Lim, K. H. Studies on the Characteristics of Drug-loaded Gelatin Nanoparticles Prepared by Nanoprecipitation. Bioprocess Biosyst. Eng. 2012,35, 297-307.
-

- 29. Lee, E. J.; Khan, S. A.; Lim, K. H. Gelatin Nanoparticle Preparation by Nanoprecipitation. J. Biomater. Sci. Polym. Ed. 2011, 22, 753-771.
-

- 30. Lee, E, J.; Lim, K. H. Hardly Water-soluble Drug-loaded Gelatin Nanoparticles Sustaining A Slow Release: Preparation By Novel Single-step O/W/O Emulsion Accompanying Solvent Diffusion. Bioprocess Biosyst. Eng. 2017,40, 1701-1712.
-

- 31. Lowery, T. H.; Richardson, K. S. Mechanism and Theory in Organic Chemistry (3rd ed.); Harper Collins: New York, 1987; pp 183.
- 32. Ka, D.; Seo, M.; Choi, H.;, Kim, E. H.; Kim, S. Y. Physical Gelation of Polar Aprotic Solvents Induced by Hydrogen Bonding Modulation of Polymeric Molecules. Chem. Commun. 2010, 46, 5722-5724.
-

- 33. Hwang, J. S.; Gi, H. J. Optical Mixing Spectroscopic Studies of Gelatin Solution. Chin. J. Phys. 1989, 27, 50-57.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(2): 322-328
Published online Mar 25, 2021
- 10.7317/pk.2021.45.2.322
- Received on Jan 18, 2021
- Revised on Feb 22, 2021
- Accepted on Feb 25, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kwang-Hee Lim
-
Department of Chemical Engineering, Daegu University, Gyeongbuk 38453, Korea
- E-mail: khlim@daegu.ac.kr
- ORCID:
0000-0001-7768-1797









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.