- Cure Kinetics and Chemorheology of Epoxy/Clay Nanocomposites for Outdoor Use with Various Nanoclays
Division of Chemical Engineering, Dankook University, 126 Jukjeon-dong, Suji-gu, Gyeonggi-do 16890, Korea
- 나노충전제의 종류에 따른 옥외용 에폭시 나노복합체의 경화속도론 및 화학유변학
단국대학교 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
The curing behavior of silicone rubber modified epoxy/clay nanocomposites with various nanoclays was studied using a differential scanning calorimeter (DSC) and an oscillatory rheometer. The nanocomposites were prepared from the reaction of cycloaliphatic epoxy resins, silicone rubber containing amine functional group, anhydride hardener and nanoclay. The nanocomposites containing 30B of nanoclay had the largest amount of heat generated by DSC, and the rheometer test showed the shortest gelation time. The isothermal cure results were well matched with the modified Kamal's model. Therefore, it is thought that the nanocomposites for outdoor use in this study can be simulated the overall cure characteristics by applying a modified Kamal’s model
여러 가지 나노클레이에 대해 실리콘 고무로 개질된 에폭시/클레이 나노복합체의 경화 거동을 미분주사열량계(DSC)와 진동 레오미터를 이용하여 연구하였다. 지환형 에폭시 수지, 아민기를 포함하는 실리콘 고무, 무수 경화제, 나노클레이의 반응을 통해 나노복합체를 제조하였다. 나노클레이 30B를 함유한 나노복합체가 DSC 결과 발열량이 가장 컸으며 레오미터 결과 젤화시간이 가장 짧았다. 등온경화 실험의 결과는 개선된 Kamal 모델에 잘 부합하였다. 이에 개선된 Kamal 모델을 적용하여 본 연구에서의 옥외용 나노복합체의 전체적인 경화특성을 모사할 수 있으리라 사료된다
The curing behavior of silicone rubber modified epoxy/clay nanocomposites with various nanoclays was studied using a differential scanning calorimeter (DSC) and an oscillatory rheometer. The dynamic cure results were well matched with the modified Kamal¡¯s model. It is thought that the nanocomposites for outdoor use in this study can be simulated the overall cure characteristics by applying a modified Kamal¡¯s model.
Keywords: silicone rubber, cycloaliphatic epoxy, cure kinetics, chemorheology, nanoclay
본 연구는 2020년도 산업통상자원부(MOTIE) 및 한국산업기술평가관리원(KEIT)의 지원을 받아 수행한 연구입니다(No. 20011362). 여러모로 도움을 주신 홍영기 박사님께 특별한 감사를 드립니다.
나노복합체는 그 안에 나노미터 스케일로 박리된 층상 실리케이트가 5 wt% 이하 정도만 충전되어 있어도 기계적, 열적, 전기적 물성의 향상은 물론 내화학성, 난연성과 가스차단성 등의 향상도 기대할 수 있다. 이를 위해서는 층상실리케이트를 유기화시켜야 하는데 여기에 사용되는 modifier의 종류와 그 첨가량은 고분자 매트릭스의 물성 향상에 큰 영향을 주고 있다.1-6 고분자 기지재에 나노미터 스케일로 박리된 층상 실리케이트를 함유한 고분자 나노복합체를 제조하기 위해서는 고분자와 층상 실리케이트의 상용성이 필수적인데 일반적으로 자연에서 얻어지는 실리케이트는 상용성이 없다. 이에 보통 실리케이트의 층간 양이온을 이온교환 반응을 통해서 알킬암모늄 이온으로 치환하여 고분자의 친화력을 부여한다. 이러한 나노복합체에 대해 전기 전자분야에서는 유전 및 절연 현상에 관한 많은 연구가 보고되고 있다.7-12 박리된 층상실리케이트를 함유한 에폭시 나노복합체는 내부방전특성 등이 우수하여 전기절연재료로 관심이 점점 높아지고 있다.13,14
에폭시 나노복합체는 포함하고 있는 층상 실리케이트의 종류와 함량, 표면처리 방법 및 가공할 때의 경화조건 등에 따라 경화 후 물성들이 큰 영향을 받게 된다. 상업공정에서 최종제품의 품질을 최적화하기 위해서는 가공 중에 혼합물의 물리적 특성을 잘 조절해야 한다. 이를 위해서는 에폭시 수지의 구조와 물성의 관계를 조사해야 하며 여러 온도에서의 경화속도와 반응 활성화 에너지를 알아야 하므로 경화반응 속도론의 연구는 필수적이다. 반응 속도론 연구는 FTIR, NMR, Raman 등 분광학적 장치와 TGA, DSC 등 열분석 장치를 통해 연구되고 있다.15-19 이 중 열경화성 수지의 반응 속도론에는 DSC가 널리 활용되고 있다.20-22
본 연구에서는 옥외용 지환형 에폭시수지에 여러 종류의 유기치환 층상실리케이트를 이용하여 나노 복합체를 제조한 후 경화반응 속도론과 화학유변학을 비교하였다.
원료.본 연구에서 사용된 에폭시 수지는 지환형으로 에폭시 당량이 164~177 g/eq인 하진켐텍(한국)의 ES602를 정제하지 않고 그대로 사용하였으며, 액상 실리콘수지는 아민 당량이 250~270 g/eq인 Dow Corning(USA)의 DC3055를 사용하였다. 경화제로는 분자량이 168 g/mol인 하진켐텍의 HJ5500 (methyl hexahydrophtalic anhydride)를 사용하였고, 반응 촉진제는 시코쿠 카세이(일본)의 1-cyanoethyl-2-ethyl-4-methyl imidazole(2E4MZ-CN)을 사용하였다. 나노클레이는 세 종류로 Southern Clay사(미국)의 Cloisite 30B, 10A, 20A를 사용하였다. 본 연구에서 사용한 물질과 나노클레이의 구조식은 각각 Figure 1과 2와 같다.
실리콘 고무로 개질된 에폭시 나노수지의 제조.먼저 50 oC로 예열된 실리콘 수지와 에폭시 수지를 10분간 500 rpm으로 혼합하면서 나노클레이를 첨가하였다. 다시 5분간 500 rpm으로 혼합한 다음, 혼합물에 초음파 Horn(1500 W, 20 kHz)을 침지시키고 20분간 초음파 처리를 실시하였다. 그 다음 진공오븐에서 15분간 감압하여 혼합 시 발생된 기포를 제거하면서 에폭시 수지와 실리콘 수지를 반응시킨 후 상온에서 3시간 이상 냉각시켜 제조하였다. 본 연구를 위한 시료의 혼합비를 Table 1에 수록하였다.
경화반응 거동.경화반응에 의한 발열거동을 측정하기 위하여 미분주사열량계(DSC, DSC2910, TA Instrument, 미국)를 사용하였다. 제조된 미경화 시료 약 10±3 mg을 hermetic pan에 넣고 질소 조건 하에서 각각 5, 10, 15, 20 oC/min의 승온 속도로 동적경화 실험을 하였다. 등온경화 실험의 경우에는 각각 120, 130, 140, 150, 160 oC의 일정온도에서 경화시켜 발열곡선을 얻었다.
유변학적 분석.혼합수지의 경화반응에 따른 젤화시간은 스트레스제어 레오미터(MCR500, Anton Paar, 오스트리아)를 사용하여 측정하였다. 직경이 25 mm인 parallel plate fixture 사용하여 1 mm gap을 유지하면서 주파수(frequency) 1 Hz, 전단응력 10 Pa과 전단속도 10 rad/sec로 측정하였다. 온도는 80, 90, 100, 120 oC의 등온조건으로 시간에 따른 저장 모듈러스와 손실 모듈러스를 측정하였다.

|
Figure 1 Chemical structures of epoxy resin, silicone rubber, hardener and accelerator used in this study: (a) Epoxy (ES602); (b) hardener (HJ5500); (c) silicone rubber (DC3055); (d) accelerator (2E4MZ-CN). |

|
Figure 2 Chemical structures of nanoclay used in this study: (a) Cloisite 10A; (b) Cloisite 20A; (c) Cloisite 30B. |
DSC 실험에서 열경화수지의 경화도는 식 (1)과 같이 정의한다.

여기서, c0, c, cf는 각각 수지의 초기농도, 시간 t에서의 농도 그리고 최종농도이다. 반응이 진행됨에 따라 열이 발생하는데 각각의 에폭시 기가 반응하며 생성하는 반응열이 모두 동일하다는 가정을 하면 경화도는 식 (2)와 같이 계산할 수 있다.23
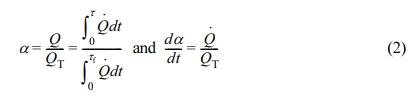
여기서, Q는 시간 t까지 발생한 열이고 {{{EQUATIONS}}}는 순간 발열속도이다. QT는 반응이 종결되었을 때의 시간 tf까지 발생한 열이다.
동적경화 반응.Figure 3은 나노클레이를 함유하지 않은 C0에 대해 승온속도를 달리하면서 측정한 전형적인 열경화성 수지의 DSC 결과이다. 온도가 증가함에 따라 약 80 oC부터 발열을 시작하여 피크를 보이고 180~220 oC까지 지속되었다. 승온속도가 증가함에 따라 피크가 더 높아지고 피크의 위치가 더 높은 온도에서 나타나는 것을 볼 수 있다.
이와 같은 경향은 나노복합체의 경우도 유사하였는 바 그 중 승온속도 15 oC/min에 대해 샘플들의 발열거동을 비교하여 Figure 4에 도시하였다. 나노클레이가 없을 때보다 나노클레이를 첨가하였을 때 피크가 생기는 온도가 전반적으로 더 낮아진 것을 볼 수 있는데 이는 나노클레이가 첨가됨에 따라 더 높은 열전달효과가
생겨서 빠르게 설정온도에 도달하였기 때문이라고 사료된다. 발열곡선의 아랫면을 시간에 대해 적분한 발열량을 정리하여 Table 2에 수록하였다. 단위 g 당 발열량은 C0 > C30B > C10A > C20A 순이었다. 나노복합체의 경우 첨가된 나노클레이의 종류에 따라 발열량의 차이가 발생하였는데 이는 첨가된 나노클레이의 구조에 기인하는 것으로 사료된다. 나노복합체의 표면에서 ammonium과 hydroxyl group의 반응촉진효과와 고온에서 나노복합체의 유기이온들이 homopolymerization을 촉진시켜 가교밀도를 낮추어 반응열을 감소시키는 효과와의 서로 경쟁적인 작용이 발생하는데 이러한 거동이 나노클레이의 종류에 따라 달라서 발열량의 차이가 발생한 것으로 판단된다.24-26
동적분석에서 활성화 에너지는 Kissinger에 의해서 유도된 식 (3)을 이용하여 구하였다.27
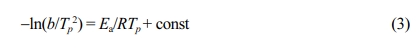
여기서, b는 승온속도(oC/min), Tp는 DSC 곡선 상에서의 피크온도(K) 그리고 R은 기체상수이다. 이 식은 피크온도에서의 경화도가 승온속도에 무관하게 일정하다는 가정 하에 유도된 것으로 여러 종류의 열경화성 수지에 적용된 바 있다.28,29 Figure 5는 식 (3)에서의 ln(b/Tp2)과 1000/Tp를 나노클레이에
따라서 나타낸 것으로 각 추세선의 기울기로부터 활성화 에너지를 구하여 Table 2에 발열량에 추가하여 수록하였다. 활성화 에너지를 비교해 보면 그 차이는 별로 크지 않을 것을 볼 수 있었다.
Figure 6에 승온속도 15 oC/min일 때 온도에 따른 각 나노복합체의 경화도 변화를 도시하였다. 나노복합체들의 경우가 C0에 비해 전반적으로 더 빠르게 경화가 진행되는 것을 볼 수 있는데 이는 Figure 4에서 설명한 열전달 효과에 기인한다고 사료된다.
등온경화 반응.DSC를 130 oC의 등온으로 일정하게 유지 하였을 때 시간에 따른 다양한 나노복합체 들의 열분석 결과를 Figure 7에 도시하였다. 시작 초기 부분의 그래프의 형태가 원만하지 않고 약간씩 찌그러진 것을 볼 수 있다.
이는 온도에 따른 반응성이 큰 샘플을 처음부터 기기에 넣고 설정온도까지 올린다면 그 과정에서 이미 반응이 상당 부분 진행될 우려가 있다. 따라서 DSC를 이용한 등온경화 실험을 하려면 장치를 등온으로 유지하여 평형을 만든 후 재빠르게 장치를 열어 샘플을 넣고 실험을 시작하는 수 밖에 없다. 하지만, 이때는 이미 평형이 순간적으로 깨어져서 다시 회복하는데 시간이 소요되며 이 과정에서도 경화반응은 다소 진행되고 있다. 따라서 초기의 발열곡선은 다소 흔들리는 것을 볼 수 있다.
Figure 8에 경화온도 및 나노클레이 종류를 변화시켰을 때 나노복합체들의 발열피크 시간과 발열량을 도시하였는데 나노클레이 첨가여부와 첨가된 나노클레이의 구조의 영향을 받는 것을 알 수 있다. 동적경화의 경우와 비슷하게 온도가 증가함에 따라 전반적으로 피크시간이 짧아지며 발열이 더 빠르게 진행되었고 C0와 C30B보다 C10A와 C20B가 더 빠른 것을 볼 수 있었다. 발열량은 전체적으로 C30B를 제외하고는 온도에 따른 변화가 크지 않았는데 대체로 C0와 C30B가 C10A와 C20보다 큰 값을 보였다. 여기에서 160 oC에서의 피크시간을 도시하지 않았는데 이는 Figure 7에서 언급한 바와 같이 등온 온도가 올라감에 따라 초기에 피크가 발생하였고 160 oC의 경우에는 평형에 도달하는 과정에서 피크가 생겨서 그래프를 통해 피크시간을 얻을 수 없었기 때문이다. 그러나 적분값 등은 일부 오차를 감수하더라도 최대한 계산하여 그래프에 포함하였다.
에폭시 나노복합체의 반응은 Figure 7과 같이 전형적인 에폭시-아민 시스템의 자촉매 반응(autocatalytic reaction)의 형태를 보여주고 있다.30,31 이를 표현하는 현상학적 모델로서 Kamal 식이 있는데 경화도에 따른 경화속도는 식 (4)와 같다.32
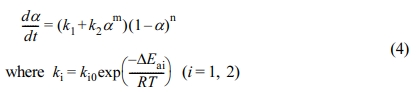
여기서, k1은 에폭시와 아민 작용기 사이의 비자촉매 반응에 해당하는 반응속도상수이고 k2는 아민 경화제와 에폭시의 반응에서 생성된 수산화기의 촉매작용으로 인한 자촉매 반응에 해당하는 반응속도상수이다. m과 n은 반응차수, k10, k20는 지수 앞자리인자, Ea1, Ea2는 활성화 에너지이다.
에폭시의 경화거동은 초기에는 활성화 조절반응(activation-controlled reaction)으로 시작되지만 점차 반응이 진행함에 따라 그 기전이 확산조절반응(diffusion-controlled)으로 전환되기 때문에 확산 계수, f(a)를 고려하여 수정된 개선된 Kamal 모델 식 (5)와 같다.33,34
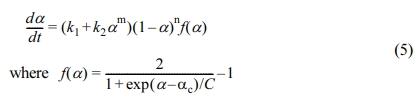
여기서, ac는 주어진 경화온도에 대한 최대 전환율이고, C는 확산매개변수이다. 개선된 Kamal 모델에 대한 반응변수들을 다변수 회귀법(multivariable regression method)을 이용하여 구한 후 Table 3에 수록하였다. 온도가 높을수록 반응속도 상수 k1, k2 값이 둘 다 증가하였는데 k2가 더 예민하게 증가하였고 나노클레이가 첨가되었을 때 더 컸으며 C20A > C10A > C30B > C0 순이었다. m, n 값은 변동폭이 크고 경향이 일정치 않았다. αc는 일정한 경향성 없이 0.82~0.97 사이의 값을 보였는데 전체적으로는 나노클레이가 첨가된 나노복합체가 더 낮은 값을 보였다. 반면에, 확산매개변수 C 값은 편차가 심하였다. 일반적으로 반응차수인 m, n의 온도에 민감하지 않은 것이 보통인데 여기에서는 앞에서 언급한 바와 같이 반응초기 부분의 오차 등이 다변수 회귀법으로 변수를 구할 때 영향을 준 것으로 사료된다.
반응속도 상수 k1, k2에 대한 반응 활성화 에너지와 지수 앞자리인자(pre-exponential factor)를 구하기 위하여 반응속도 상수에 자연로그를 취하여 온도의 역수에 대해서 도시한 결과 Figure 9와 같이 대체로 직선 형태를 보였다. 직선의 기울기와 절편으로부터 각각 반응 활성화 에너지와 지수 앞자리인자를 구하여 Table 4에 정리하였다. 나노클레이가 첨가된 나노복합체의 경우 활성화 에너지와 지수 앞자리인자의 값이 떨어졌으며 특히 Ea1 및 ln k01 값들이 급격하게 감소하는 것을 볼 수 있었다.
이상에서 구한 반응속도론의 반응활성화 에너지와 속도상수 등을 개선된 Kamal 모델에 대입하면 경화도에 따른 반응속도를 계산할 수 있다. Figure 10에 130 oC의 일정한 경화온도에서 식 (5)의 개선된 Kamal 모델로 계산한 이론값과 측정한 실험 값을 여러가지 나노복합체에 대해 경화반응속도와 경화도의 그래프로 도시하였다. 다른 온도의 경우 경화반응 속도의 차이만 있을 뿐 유사한 경향을 보이는 바 생략하였다. 경화반응속도와 경화도의 실험값과 개선된 Kamal 식의 계산 값이 잘 일치하는 것을 볼 수 있었는데 개선된 Kamal 모델이 본 연구의 등온 경화시스템을 잘 표현하고 있다고 사료된다.
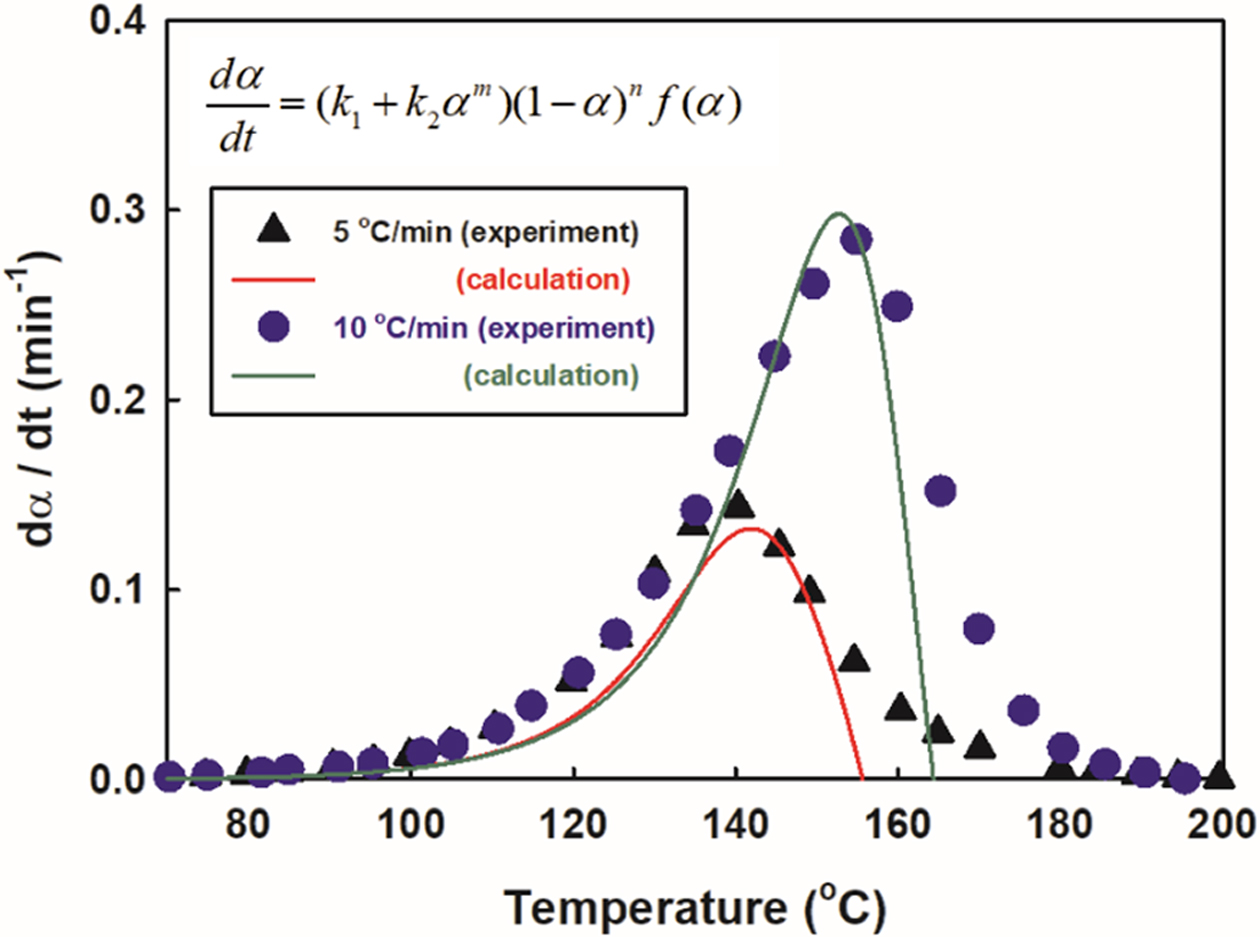
추가적으로 Figure 11에 등온 경화 데이터로부터 구한 개선된 Kamal 모델을 이용하여 동적 경화 데이터와 비교해 보았다. C0를 대상으로 승온속도가 5 oC/min, 10 oC/min일 때 온도에 따른 경화속도를 도시하였는데 Table 3의 m, n 값들이 온도에 따라 편차가 커서 피크 중심점에 가까운 온도에 해당하는 값을 사용하여 계산한 결과 비교적 잘 맞는 것을 볼 수 있었다. 그러나 피크를 지나 온도가 높아지는 영역에서는 계산 값이 실험 값보다 급격하게 떨어지는 것을 볼 수 있는데 이는 개선된 Kamal 식 하나만으로 동적 경화과정 전 영역에 대해 표현하는 것이 부족한 것을 의미한다. Macan 등은 이러한 문제를 해결하기 위해 낮은 온도 영역과 높은 온도 영역을 분리하여 Kamal 식을 도입하여 보완하고자 시도하였다.35 비록 개선된 Kamal 식이 등온경화 실험 결과를 잘 표현한다고 할지라도 데이터가 양호하게 측정되는 온도를 벗어나는 고온에서의 결과는 고온 실험의 한계로 인하여 적절하게 예측하기는 매우 어렵다. 따라서 향후에는 데이터 손실이 없는 동적경화실험을 이용한 모델의 개발 등 보완이 필요할 것으로 사료된다.
화학유변학.C30B를 대상으로 100 oC 등온에서 경화반응이 진행되는 동안의 저장 모듈러스와 손실 모듈러스의 변화를 Figure 12에 도시하였다. 두 가지의 모듈러스 모두 시간이 경과함에 따라 서서히 증가하다가 15분을 전후해서 급격한 증가를 보였다. 이는 열경화성 수지의 전형적인 특성으로 경화가 진행됨에 따라 분자의 운동성이 조금씩 감소하다가 분자 간의 얽힘이 시작되는 점부터는 더욱 급격하게 운동성이 낮아지고 단단해지기 때문이라고 사료된다. 경화가 진행되면서 급격하게 점도가 증가하는 것과 동시에 높은 분자량의 고분자가 처음으로 나타나는 시점을 젤화점이라고 하고 이때까지 경과한 시간을 젤화시간이라 한다. 젤화시간 이후 에는 높은 점도로 인하여 가공이 거의 불가능하기 때문에 실제 공정에서 작업 가능한 시간을 알기 위해서 경화하는 물질의 젤화시간을 아는 것은 매우 중요하다.
일반적으로 젤화시간은 시간에 따른 점도 변화의 변곡점이나 저장 모듈러스 G'와 손실 모듈러스 G''의 교차점, 즉 tand(=G''/G')=1에 도달하는 시간으로 정의하는데 이 시점에서 고분자 사슬이 충분히 서로 얽히어 점탄성의 유체가 점탄성의 고체로 전이되는 점을 의미한다.36 그림에서 G'와 G''가 같은 값을 보이는 젤화점을 점선으로 나타내었는데 이 때의 젤화시간은 약 17.3분 이었다.
C0와 여러가지 나노복합체의 온도에 따른 젤화시간을 Figure 13에 도시하였다. 경화온도가 높을수록 젤화시간이 급격하게 감소하는데 이는 온도가 높으면 유동성이 증가하여 반응기 들이 서로 만날 확률이 높아지기 때문에 젤화시간이 감소하는 것으로 보인다. 젤화시간을 Table 5에 정리하여 수록하였다. 반면에, 같은 온도, 예를 들면 100 oC를 대상으로 샘플들의 젤화시간을 비교해 보면 C0 ≒ C30B < C10A < C20A으로 나노복합체의 경우 C0보다 젤화시간이 다소 증가하는 것을 볼 수 있다. 나노복합체의 경우 가리움 효과로 인해 반응기 들이 서로 만날 확률이 줄어들어 반응성이 감소하여 젤화시간이 증가하게 된 것으로 사료된다. 젤화시간과 온도와의 관계는 식 (6)과 같이 Arrhenius law 형태로 표시할 수 있다.
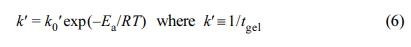
여기에서 k'는 젤화시간을 이용한 속도상수, k0'는 지수 앞자리인자, Ea는 활성화 에너지이고, R은 기체상수이다. 식 (6)의 양변에 자연로그를 취하면 식 (7)과 같이 된다.

이 식을 이용하여 등온 조건에서 모듈러스 교차점을 기준으로 한 젤화시간을 온도의 온도의 역수에 대해 Figure 14에 도시하였고 기울기로부터 구한 Ea를 Table 5의 젤화시간에 추가하여 수록하였다. C30B를 제외하고는 C0에 비해 C10A와 C20A의 Ea가 감소한 것을 볼 수 있었다. 이러한 Ea의 경향은 앞의 동적경화 반응에서 Kissinger plot으로 얻은 값들의 경향과 다소 차이가 있는데 이는 열의 출입으로 얻은 Ea는 반응을 직접 표현하지만 점도 변화를 이용하여 구한 Ea는 반응뿐만 아니라 망상구조 등 점도에 영향을 미치는 요인들도 포함하는 바 이에 따른 차이라고 사료된다.

|
Figure 3 Typical DSC thermograms of C0 at different heating rates. |

|
Figure 4 DSC thermograms of the nanocomposites with various nanoclays at 15 oC/min. |

|
Figure 5 Kissinger plots of the nanocomposites with various nanoclays. |

|
Figure 6 Degree of cure of the nanocomposites with various nanoclays at 15 oC/min. |

|
Figure 7 Isothermal DSC thermograms of the nanocomposite with various nanoclays at 130 oC. |

|
Figure 8 Isothermal peak time and heat of cure vs temperatures of the nanocomposites with various nanoclays. |

|
Figure 9 Rate constants vs 1000/T(K) of the nanocomposites with various nanoclays. |

|
Figure 10 Reaction rate vs degree of cure of the nanocomposites with various nanoclays at 130 oC: experimental results (symbol) and modified Kamal model (line). |

|
Figure 11 Comparison of dynamic experimental data for C0 with the modified Kamal model data. |

|
Figure 12 G' and G'' vs time of the C30B at 100 oC. |

|
Figure 13 Gel time vs temperature of the nanocomposites with various nanoclays. |

|
Figure 14 ln tgel vs 1000/T of the nanocomposites with various nanoclays. |
|
Table 3 Kinetic Parameters of Kamal’s Model for the Nanocomposites with Various Clays |

|
Table 4 Activation Energy and Pre-exponential Factor of the Nanocomposites with Various Clays |

DSC 동적경화분석 결과 나노클레이의 종류에 따라 샘플들 간 활성화 에너지의 차이는 작았으나, 반응 속도는 C0와 C30B보다 10A와 20A가 빨랐다. 발열량은 C20A < C10A < C30B < C0 순이었다. 나노클레이의 구조와 그에 따른 modifier의 구성과 첨가여부에 따라 반응속도와 발열량의 차이가 발생하였다. DSC 등온분석에서도 동적분석과 유사한 경향을 보여주었고, 등온경화 반응의 실험
값들은 개선된 Kamal 모델의 계산값들과 잘 일치하였다. 레오미터를 이용하여 측정한 젤화시간은 C30B < C0 < C10A < C20A 순이었다. 다양하게 표면 처리된 나노클레이는 경화반응 메커니즘 자체에는 영향을 미치지 않았으나 젤화시간에는 비교적 큰 차이를 나타내었다.
이에 본 연구의 옥외용 나노복합체의 경우 등온 DSC 등온경화 실험 결과에 개선된 Kamal 모델을 적용하면 전체적인 경화 특성을 잘 모사할 수 있으리라 사료된다.
- 1. Kavitha, D.; Balachandran, M. XLPE-layered Silicate Nanocomposites for High Voltage Insulation Applications: Dielectric Characteristics, Treeing Behavior and Mechanical Properties. IET Sci. Meas. Technol. 2019, 13, 1019-1025.
-

- 2. Ashok, N.; Balachandran, M.; Lawrence, F. Organo-modified Layered Silicate Nanocomposites of EPDM–chlorobutyl Rubber Blends for Enhanced Performance in γ Radiation and Hydrocarbon Environment. J. Compos. Mater. 2018, 52, 3219-3231.
-

- 3. Kong, J.; Li, Z.; Cao, Z.; Han, C.; Dong, L. The Excellent Gas Barrier Properties and Unique Mechanical Properties of Poly (propylene carbonate)/Organo-montmorillonite Nanocomposites. Polym. Bull. 2017, 74, 5065-5082.
-

- 4. Rahmaoui, F. E. Z.; Mederic, P.; Hocine, N. A.; Saada, A. A.; Poirot, N.; Belaidi, I. Contribution of the Organo-montmorillonite/Graphene Pair to the Rheological and Mechanical Properties of Polyethylene Matrix Based Nanocomposites. Appl. Clay Sci. 2017, 150, 244-251.
-

- 5. Ismail, N. H. C.; Akil, H. M.; Salim, Z. A. S. A. Thermal and Morphological Properties of ABS/Muscovite Layered Silicate Composites. Mater. Sci. Forum 2019, 947, 185-189.
-

- 6. Scarfato, P.; Incarnato, L.; Maio, L. D.; Dittrich, B.; Schartel, B. Influence of a Novel Organo-silylated Clay on the Morphology, Thermal and Burning Behavior of Low Density Polyethylene Composites. Compos. Part B: Eng. 2016, 98, 444-452.
-

- 7. Peng, S.; Yang, X.; Yang, Y.; Wang, S.; Zhou, Y.; Hu, J.; Li, Q.; He, Direct Detection of Local Electric Polarization in the Interfacial Region in Ferroelectric Polymer Nanocomposites. J. Adv. Mater. 2019, 31, 1807722.
-

- 8. Zhang, D.-Li.; Zha, J.-W.; Li, C.-Q.; Li, W.-K.; Wang, S.-J.; Wen, Y.; Dang, Z.-M. High Thermal Conductivity and Excellent Electrical Insulation Performance in Double-percolated Three-phase Polymer Nanocomposites. Compos. Sci. Technol. 2017, 144, 36-42.
-

- 9. Al-Saleh, M. H. Clay/Carbon Nanotube Hybrid Mixture to Reduce the Electrical Percolation Threshold of Polymer Nanocomposites. Compos. Sci. Technol. 2017, 149, 34-40.
-

- 10. Dhatarwal, P.; Sengwa, R. J.; Choudhary, S. Effect of Intercalated and Exfoliated Montmorillonite Clay on the Structural, Dielectric and Electrical Properties of Plasticized Nanocomposite Solid Polymer Electrolytes. Compos. Commun. 2017, 5, 1-7.
-

- 11. Rana, A. S.; Vamshi, M. K.; Naresh, K.; Velmurugan, R.; Sarathi, R. Mechanical, Thermal, Electrical and Crystallographic Behaviour of EPDM Rubber/Clay Nanocomposites for Out-door Insulation Applications, Advances in Materials and Processing Technologies. Adv. Mater. Process. Technol. 2020, 6, 54-74.
-

- 12. Arya, A.; Sharma, A. L. Investigation on Enhancement of Electrical, Dielectric and Ion Transport Properties of Nanoclay-based Blend Polymer Nanocomposites. Polym. Bull. 2020, 77, 2965-2999.
-

- 13. Nakamura, S.; Kumada, A.; Hidaka, K.; Hirai, H.; Imai, T.; Nakamura, T.; Yoshimitsu, T. Effects of Temperature on Electrical Treeing and Partial Discharges in Epoxy/Silica Nanocomposites. IEEE Trans. Dielectr. Electr. Insul. 2020, 27, 1169-1177.
-

- 14. Wen, H.; Zhang, X.; Xia, R.; Hu, G.; Wu, Y. Decomposition Characteristics of SF6 under Flashover Discharge on the Epoxy Resin Surface. Materials 2019, 12, 1408.
-

- 15. Lee, S.; Jin, B. S.; Lee, J. W. Thermal Degradation Kinetics of Antimicrobial Agent, Poly(hexamethylene guanidine) Phosphate. Macromol. Res. 2006, 14, 491-498.
-

- 16. Rath, S. K.; Ishack, A. M.; Suryavansi, U. G.; Chandrasekhar, L.; Patri, M. Phase Morphology and Surface Properties of Moisture Cured Polyurethane-urea (MCPU) Coatings: Effect of Catalysts. Prog. Org. Coat. 2008, 62, 393-399.
-

- 17. Burel, F.; Feldman, A.; Bunel, C. Hydrogenated Hydroxy-functionalized Polyisoprene (H-HTPI) and Isocyanurate of Isophorone Diisocyanates (I-IPDI): Reaction Kinetics Study Using FTIR Spectroscopy. Polymer 2005, 46, 15-25.
-

- 18. Seo, Y.; Lee, S. M.; Kim, D. Y.; Kim, K. U. Kinetic Study of the Imidization of a Poly(ester amic acid) by FT-Raman Spectroscopy. Macromolecules 1997, 30, 3747-3753.
-

- 19. Nagle, D. J.; Celina, M.; Rintoul, I.; Frederics, P. M. Infrared Microspectroscopic Study of the Thermo-oxidative Degradation of Hydroxy-terminated Polybutadiene/Isophorone Diisocyanate Polyurethane Rubber. Polym. Degrad. Stabil. 2007, 92, 1446-1454.
-

- 20. Lee, S.; Choi, C. H.; Hong, I.-K.; Lee, J. W. Curing Behavior of Polyurethane as a Binder for Polymer-bonded Explosives. J. Ind. Eng. Chem. 2015, 21, 980-985.
-

- 21. Lee, S.; Choi, C. H.; Hong, I.-K.; Lee, J. W. Polyurethane Curing Kinetics for Polymer Bonded Explosives: HTPB/IPDI Binder. Korean J. Chem. Eng. 2015, 32, 1701-1706.
-

- 22. Hong, I.-K.; Lee, S. Cure Kinetics and Modeling the Reaction of Silicone Rubber. J. Ind. Eng. Chem. 2013, 19, 42-47.
-

- 23. Young, R. J.; Lowell, P. A. Introduction to Polymers; 2nd ed.; CRC Press: Great Britain, 2000.
- 24. Sahoo, S. K.; Mohanty, S.; Nayak, S. K. Study of Thermal Stability and Thermo-mechanical Behavior of Functionalized Soybean Oil Modified Toughened Epoxy/organo Clay Nanocomposite. Prog. Org. Coat. 2015, 88, 263-271.
-

- 25. Xidas, P. I.; Triantafyllidis, K. S. Effect of the Type of Alkylammonium Ion Clay Modifier on the Structure and Thermal/Mechanical Properties of Glassy and Rubbery Epoxy–clay Nanocomposites. Eur. Polym. J. 2010, 46, 404-417.
-

- 26. Park, J.; Jana, S. C. Adverse Effects of Thermal Dissociation of Alkyl Ammonium Ions on Nanoclay Exfoliation in Epoxy–clay Systems. Polymer 2004, 45, 7673-7679.
-

- 27. Kissinger, H. E. Reaction Kinetics in Differential Thermal Analysis. Anal. Chem. 1957, 29, 1702-1706.
-

- 28. Gheno, G.; Ganzerla, R.; Bortoluzzi, M.; Paganica, R. Determination of Degradation Kinetics of Two Polyester Thermosetting Powder Coatings Using TGA and Colorimetric Analysis. Prog. Org. Coat. 2015, 78, 239-243.
-

- 29. Sheng, X.; Akinc, M.; Kessler, M. Cure Kinetics of Thermosetting Bisphenol E Cyanate Ester. J. Therm. Anal. Calorim. 2008, 93, 77-85.
-

- 30. Horie, K.; Hiura, H.; Sawada, M.; Kambe, H. Calorimetric Investigation of Polymerization Reactions. III. Curing Reaction of Epoxides with Amines. J. Polym. Sci. A-1 1970, 8, 1357-1372.
-

- 31. Ozawa, T. Kinetic analysis of derivative curves in thermal analysis. J. Therm. Anal. 1970, 2, 301-324.
-

- 32. Kamal, M. R.; Ryan, M. E. The Behavior of Thermosetting Compounds in Injection Molding Cavities. Polym. Eng. Sci. 1980, 20, 859-867.
-

- 33. Rabearison, N.; Jochum, Ch.; Grandidier, J. C. A Cure Kinetics, Diffusion Controlled and Temperature Dependent, Identification of the Araldite LY556 Epoxy. J. Mater. Sci. 2011, 46, 787-796.
-

- 34. Perrin, F. X.; Nguyen, T. M. H.; Vernet, J. L. Chemico-diffusion Kinetics and TTT Cure Diagrams of DGEBA–DGEBF/Amine Resins Cured with Phenol Catalysts. Eur. Polym. J. 2007, 43, 5107-5120.
-

- 35. Macan, J.; Brnardic, L.; Ivankovic, M.; Mencer, H. J. DSC Study of Cure Kinetics of DGEBA-based Epoxy Resin with Poly (oxypropylene) Diamine. J. Therm. Anal. Calorim. 2005, 81, 369-373.
-

- 36. Standard Test Method For Plastics: Dynamic Mechanical Properties: Cure Behavior. ASTM D4473 -08, 2016.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(2): 219-227
Published online Mar 25, 2021
- 10.7317/pk.2021.45.2.219
- Received on Oct 4, 2020
- Revised on Dec 20, 2020
- Accepted on Dec 28, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sangmook Lee
-
Division of Chemical Engineering, Dankook University, 126 Jukjeon-dong, Suji-gu, Gyeonggi-do 16890, Korea
- E-mail: sangmooklee@dankook.ac.kr
- ORCID:
0000-0001-8965-3590












 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.