- Synthesis of Methacrylate Derivatives Based on Abietic Acid and Their Photo-curing Properties
Department of Engineering Chemistry, College of Engineering, Chungbuk National University, Cheongju 28644, Korea
- Abietic Acid 기반 Methacrylate 유도체의 합성과 광경화 특성
충북대학교 공과대학 공업화학과
In this study,
methacryloyl-2-hydroxypropyl abietate (MHPA) was synthesized through the
reaction of abietic acid, a plant-derived natural substance, with glycidyl
methacrylate. The synthesized MHPA was mixed with various ratios of
poly(ethylene glycol) dimethacrylate (PEGDMA) to prepare a photocurable resin,
and the effect of MHPA content on curing behavior was evaluated. As a result,
it was found that while the MHPA content increased, the degree of curing
decreased, but the curing efficiency of 96% was maintained up to 30 wt% of
MHPA. In addition, the presence of MHPA reduced the hydrophilicity of the cured
film and improved the peel strength and elastic modulus. In particular, the
peel strength and modulus of elasticity were improved by 140% and 500%,
respectively, in the cured film containing 30 wt% of MHPA
본 연구에서는 식물유래 천연물질인 abietic acid와 glycidyl methacrylate의
반응을 통해 methacryloyl-2-hydroxypropyl abietate(MHPA)를 합성하였다. 합성된
MHPA는 다양한 비율의 poly(ethylene glycol)
dimethacrylate(PEGDMA)와 혼합되어 광경화용 레진으로 제조되었으며 MHPA가
경화에 미치는 영향을 평가하였다. 그 결과 MHPA 함량이
증가할수록 경화도가 감소하였지만 30 wt%까지는 96%의
경화도를 유지하였다. 또한 MHPA의 존재는 경화필름의 친수성을
감소시키고 박리강도와 탄성계수에 대한 개선을 가능하게 하였다. 특히
30 wt%의 MHPA가 포함된 경화필름에서 박리강도와 탄성계수가 각각 140%와 500% 향상된 결과를 보여주었다.
Methacryloyl-2-hydroxypropyl abietate monomer derived from
abietic acid, was synthesized through the reaction of abietic acid with
glycidyl methacrylate. The synthesized monomer was mixed with poly(ethylene
glycol) dimethacrylate to prepare a crosslinked polymer by UV irradiation.
Keywords: abietic acid, photoinitiator, methacrylate, photo-curing, adhesive properties
Abietic
acid는 소나무, 전나무 등 침엽수의 rosin에 포함되어있는 다양한 이성질체 중 한 성분이다.1,2 이들은
식물유래 천연물질로서 생체 적합성이 우수하고, 고분자와의 호환성이 양호하여 고분자 제품의 친환경 첨가제 및 접착제의 구성요소로 많이 활용되고 있다.3-5
특히 최근 폐플라스틱 제품으로 인한 토양 및 해양오염 사례들이 빈번하게 대두되는 상황에서 비석유계 화학물질에 대한 개발 필요성이 어느때보다 증가하고
있어 abietic acid와 같은 천연물 기반 플라스틱 소재에 관심이 집중되고 있다. Abietic acid에는 이중결합과 카복시산이 존재하는데,
이를 활용하여 다양한 유도체가 합성될 수 있다. 분자내 이중결합을 활용한 polyamideimide와 polyester의 제조는 대표적인 축합계
고분자로의 응용이며 내열성과 내구성이 우수한 코팅제 및 필름으로 활용 가능한 특징이 보고되고 있다.6,7 한편,
접착제 및 첨가제로 활용하기 위해서는 간단한 라디칼로 고분자 합성이 가능한 비닐계 유도체가 필요하며 관련된 연구에 많은 관심이 집중되고 있다.4
일반적으로 비닐계 유도체의 합성은 카복시산의 에스테르화 반응을 통해 진행될 수 있으며 sodium abietate를 경유한
vinylbenzyl abietate를 예로 들 수 있다.8,9 하지만, abietic acid는 입체적 장애가 큰 환상구조를
가지는 분자로서 합성된 비닐계 유도체 역시 고분자량으로의 중합이 어렵다는 단점이 있다. 따라서 abietic acid의 비닐계 유도체는 단독중합체에
사용되기 보다는 입체적 장애를
감소시킬 수 있는 공중합체에 더
적용되기 쉬울 것이다. 또한 분자량이 큰 단량체의 경우 열중합보다는 광중합이 중합속도 향상 측면에서 유리할 것으로 예측된다. 실제 빠른 속도의
광경화 기술은 코팅, 도료, 인쇄잉크, 접착제 등의 분야에서 폭넓게 활용되고 있다.10-13 광경화 방식은 기존의 열경화 방식대비
경화 속도가 빠른 특징 이외에 낮은 온도에서도 경화가 가능하여 에너지 소비가 적다는 장점과 경화된 레진의 경우 내구성 및 내화학성 등이 우수하다는 점 등이 보고되고 있다.14
이와 같은 관점에서 abietic acid 기반 비닐계 유도체에 대한 광경화 연구는 친환경 (meth)acrylate의 적용분야 확대 측면에서 중요성이
있다고 할 수 있다.15,16 하지만, abietic acid 유도체는 하나의 비닐그룹이
포함되기 때문에 자체적인 중합은 가능하지만 가교반응은 불가능하다. 따라서 공중합체의 형태로 광경화 반응을 유도할 수 있는 별도의 단량체가 필요하다.
또한 접착특성이 우수한 abietic acid를 광경화 시스템에 도입하는 연구는 일반적인 광경화 필름에서 달성하기 어려운 박리강도의 향상을 기대하게
한다. 즉, 경화된 필름에서 사슬의 일부분으로 참여하는 abietic acid 기반 유도체는 어느정도 움직임이 가능하고 그에 따라 고유의 접착특성이
발현될 수 있기 때문이다.
본 연구에서는
abietic acid기반 methacrylate 유도체를 비교적 간단한 과정을 통하여 합성하고 광경화 및 경화필름의 물성에 미치는 영향을 평가하였다.
구체적으로 abietic acid와 glycidyl methacrylate(GMA)의 직접반응으로 유도체인 meth-acryloyl-2-hydroxypropyl
abietate(MHPA)를 합성하였다. 다음으로 가교용 단량체 poly(ethylene glycol) dimethacrylate (PEGDMA)를 비율별로 혼합하여 가교거동을 분석하였고
경화필름의 물성을 접착력 및 친수성 측면에서 평가하였다.
재료. 단량체 합성을 위해 abietic
acid(70.0% TCI, 일본), GMA(97.0%, Aldrich, 미국), 촉매로 벤질트리에틸암모늄 염화물(BTEAC, 98.0%,
TCI, 일본)과 중합금지제로 하이드로퀴논 모노메틸에테르(MEHQ, Aldrich, 미국), 용매로 methyl ethyl ketone(MEK, 99.5%,
Samchun, 한국)을 정제없이
사용하였다. 단계별 정제과정에서는 NaOH(99.0%, Samchun, 한국),
NaHCO3(99.0%, Samchun, 한국), MgSO4(98.0% Samchun, 한국), 헵탄(95.0%, Samchun, 한국), tetrahydrofuran(THF,
99.5%, Samchun, 한국) 등이 활용되었다. 광경화 거동 평가를 위해 가교용
단량체인 PEGDMA(Mn:
550 g/mol, Aldrich, 미국)가 도입되었고, 광개시제로
2-hydroxy-2-methyl-1-phenyl propane-1-one(Darocur 1173, Aldrich, 미국), diphenyl-(2, 4,
6-trimethyl-benzoyl)phosphine
oxide(PI-TPO, Aldrich,
미국),
phenylbis(2, 4, 6-trimethyl-benzoyl)phosphine oxide(Irgacure 819, 97%, Aldrich, 미국)를
사용하였다. 기타 언급이 되지
않은 용매 및 시약은 정제없이 사용하였다.
Abietic
Acid 유도체 MHPA 합성. 건조된 플라스크에 abietic acid 4.0 g(13.23 mmol)과 GMA 4.42 g(29.75 mmol)을 MEK 20 mL에 녹인 후 BTEAC 0.42 g(5.0 wt%), MEHQ 0.21 g(2.5 wt%)을 도입하고 80oC에서 24시간 동안 반응시켰다. 이후 NaOH 5 wt% 및 NaHCO3 수용액으로
미반응물을 추출 제거하였으며 MgSO4 존재 하에서 24시간 동안 교반한 다음 여과 후 감압증류하여 MEK를 제거하였다. 이어서 얻어진 용액을
THF 5 mL에 녹인 후 헵탄 200 mL에 천천히 적하시켜 노란색 침전물을 유도하였다. 다음으로
40 oC에서 24시간 동안 진공 건조하여 단량체 MHPA(2.13 g, 수율 38.2%)를 얻었다. 합성 결과는 핵자기공명
분광계(1H NMR, Advance 500 MHz, Bruker)와 적외선 분광광도계(FTIR, 480 plus, Jasco Co.)를 통해서 확인하였다.
광경화 특성 평가 및 분석. 합성된 MHPA의 광경화 특성은 가교용 단량체
PEGDMA의 도입을 통하여 진행되었다. 구체적으로 혼합된 레진에 개시제를 첨가하고 슬라이드 글라스에 얇게 도포한 후 강도가 4400 μW/cm2이며 평균 파장이
370 nm인 UV를 시간대별로 조사하였다. 개시제의 흡수 파장은
UV-Vis 분광광도계(UV-Vis spectroscopy, PerkinElmer TM)로 평가되었으며 acetonitrile 용매에
0.001 wt%로 용해시켜 20 oC에서 측정하였다. 레진의 경화도는 경화 후의 필름을 THF 용매에 노출시켜 남아있는 무게의 차이를 통해 계산되었다.
MHPA와 PEGDMA의 비율에 따른 레진의 점도 변화는 cone/plate viscometer(DV 2T, Brookfield)로 관찰하였다.
혼합레진에 대한 경화후 접착력은 시료 0.7 mg을 지름 5 mm인 원의 면적이 되도록 두 슬라이드 글라스 사이에 도포 후 경화하여 만능시험기(universal
testing machine, UTM, 3344R1742, Instron Instrument)로 측정되었으며 3회 이상 측정하여 평균값을 사용하였다.
경화 레진의 친수성은 접촉각 측정기(Contact Angle Meter, SEO, P-300 Touch)를 통하여 평가되었다.
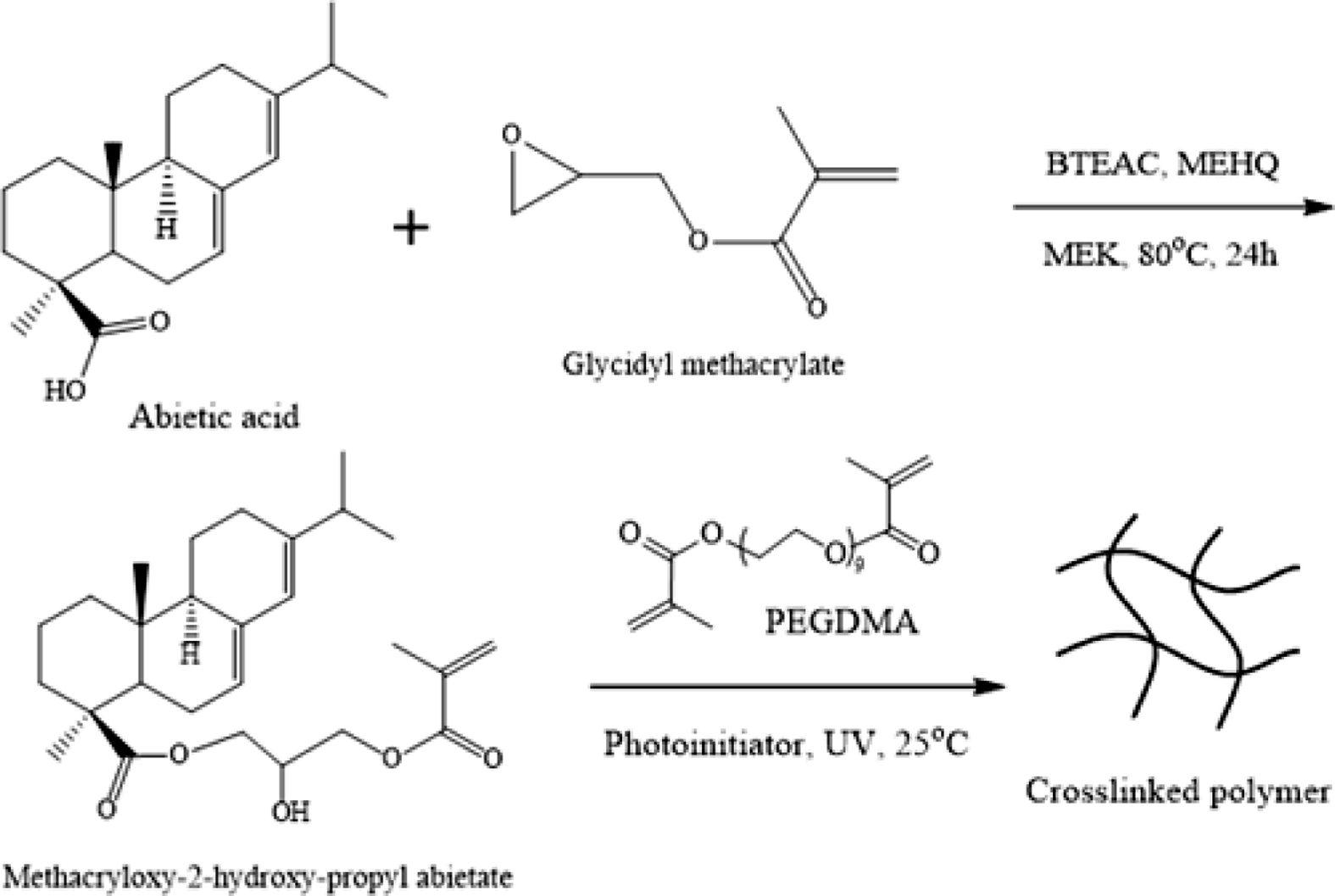
비닐형 단량체인
methacrylate가 도입된 MHPA는 abietic acid와 GMA와의 반응으로 합성되었으며 Scheme 1에 전체 과정을 나타내었다.
일반적으로 abietic acid의 카복시산은 입체적 장애가 있기 때문에 에폭시 그룹과의 적접 반응에 어려움이 예상되지만 BTEAC 촉매를 활용한
본 연구에서는 비교적 양호하게 진행되었다. 또한 출발물질인 abietic acid의 순도는 70%이며 나머지 30%의 불순물은 rosin의 유도체인
pimaric 구조이지만 유사한 카복시산을 보유하고 있으므로 합성반응에는 영향을 주지 않을 것이다.3 합성 전과 후 1H NMR 결과를 Figure 1에 나타내었으며 반응물질과
합성물질의 중요한 특성 피크를 함께 표시하였다. GMA의 경우 에폭시 관련 피크가 2.6, 2.8, 3.1 ppm에서 확인되며 methacrylate의 이중결합
피크(-C(CH3)=CH2)도 5.5, 6.1 ppm에서 관찰된다. 또한 abietic acid의 분자
내 이중결합 피크가 5.39, 5.79 ppm에서 나타나고 있으며 복잡한 분자구조에서 기인하는 0.9~2.5 ppm의 피크가 특징적으로 관찰된다.17 한편, 반응 후 GMA에 존재하던 에폭시 피크가
모두 사라지고 methacrylate와 abietic acid의 분자 내 이중결합 피크가 5.39, 5.5, 5.79, 6.1 ppm에 함께 나타나는 것으로 봐서 MHPA가 합성되었음을
확인할 수 있다. FTIR 측정을 통해서도 에폭시기와 카복시산과의 반응 여부를 관찰할 수 있었으며 그 결과를 Figure 2에 나타내었다. 합성
단량체인 MHPA의 FTIR 측정에서는 에폭시기에 의해 발현되는 760, 909 cm-1(ring stretch)와
1253 cm-1(CH bend)의 피크가
사라지고 카복시산에 기인하는
1695 cm-1의 피크도 더 이상 관찰되지
않는다. 대신, 카복시산은 에폭시와의
반응으로 에스테르화되면서 1720 cm-1로 이동하는 것을 알 수 있는데
이것은 보고된 문헌과 일치하는 결과이다.18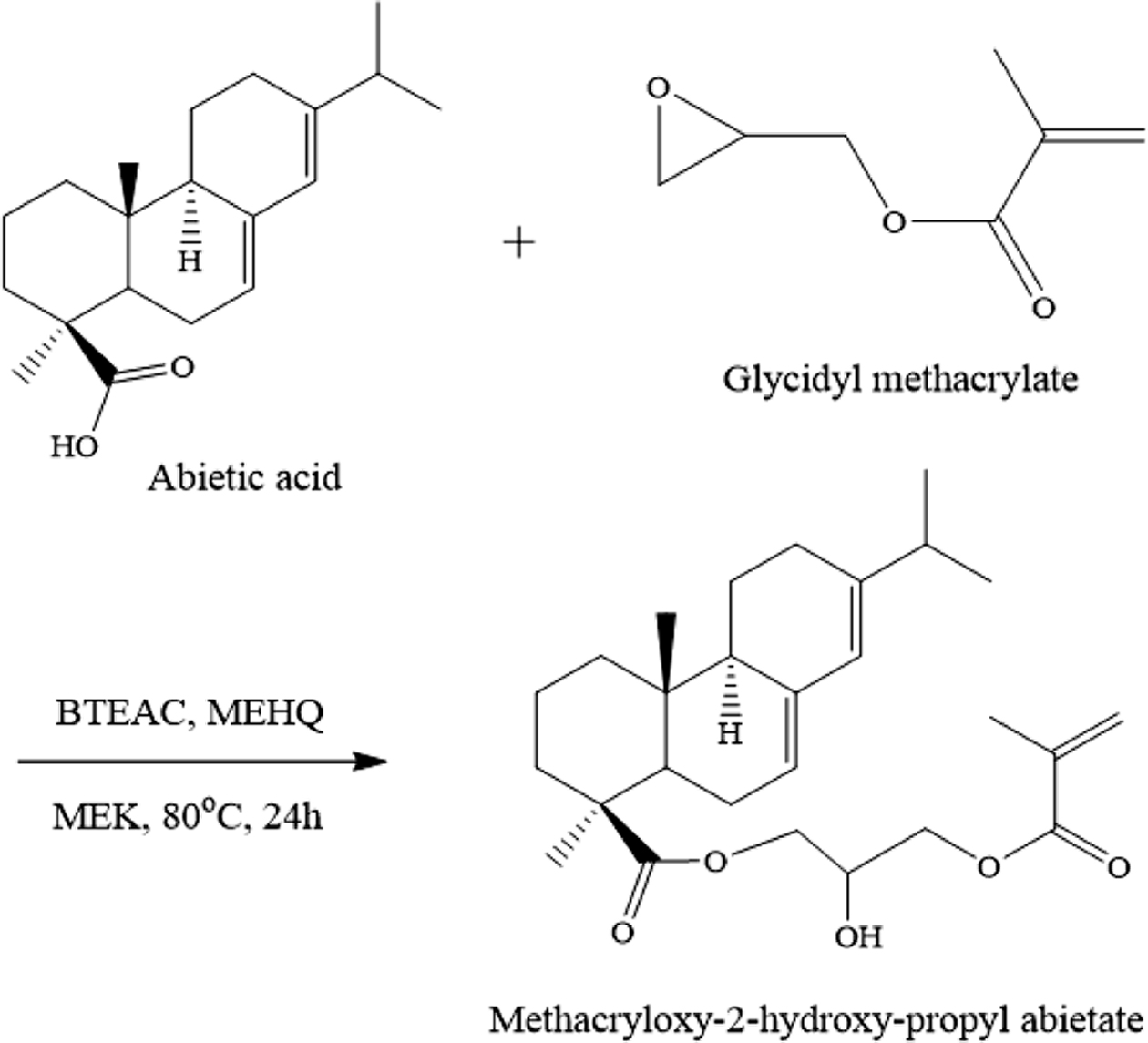
Scheme 1. Synthetic procedure for methacryloxy-2-hydroxypropyl
abietate (MHPA).
합성된 MHPA의
용해도 측정 결과는 Table 1에 나타내었다. 특징적으로 출발물질인 abietic acid는 톨루엔에 녹지 않으나 MHPA로 치환 후 용해되는 결과를 보여주고 있는데 카복시산이 에스테르화되면서
비극성 용매에 대한 용해도가 증가하기 때문으로 판단된다. 하지만, 생성된 히드록시기에 의해 헵탄에는 여전히 녹지 않았다.
Scheme 2에
나타낸 것처럼 가교용 단량체 PEGDMA를 비율별로 도입하여 MHPA의 광경화 거동을 간접적으로 조사하였다. 이것은 서론에서 언급하였지만
MHPA에는 하나의
methacrylate기가 존재하여 자체적인 가교결합이 불가능하기 때문이다. 한편, PEGDMA에도 같은 methacrylate기가 존재하여 MHPA와 유사한 광경화특성을 보여줄 것으로
생각된다. 합성 단량체 MHPA에 대한 PEGDMA의 도입 비율은 0~100%이며 조성에 따라 점도의 변화가 관찰되었다. Figure 3에 나타낸
것처럼 25 oC에서 PEGDMA 자체의 점도는 3 cPs였으며 MHPA 함량이 증가할수록 점진적으로 증가하였는데
70%까지 495 cPs의 비교적 낮은 점도가 관찰되었다. 하지만, 순수 MHPA는
3254 cPs의 고점도 특징을 잘 보여주고 있다.
Scheme 2. UV curing process for MHPA based resin.
본 연구에서 사용된
광개시제는 Darocur 1173, PI-TPO, Irgacure 819이며 각 개시제의 자외선 흡수 영역을 조사하기 위해
acetonitrile 용매에서 측정한 UV-Vis 결과를 Figure 4에 나타내었다.
자외선 경화에서는
에너지가 강한 320 nm를 사용할 수도 있지만 장파장인 370 nm가 사용자의 안전성 측면에서 유리하다. 실험결과
PI-TPO와 Irgacure 819는 최대 흡수피크가 각각 384 nm와 371 nm로 관찰되어 안정적 광개시제로서의 가능성을 확인하였고 특히 PI-TPO의 경우 MHPA와 우수한 상용성을
보여주었다. 한편, Darocur 1173은 360 nm 주변에서 약한 흡수만을 보여주고 있어 장파장 개시제로
적당하지 않음을 알 수 있다. 또한 MHPA는 370 nm 주변에서 광흡수가 일어나지 않아 비교적 안정적인 단량체임을 알 수 있는데 각 광개시제와 PEGDMA의
광경화 거동을 평가하여 Figure 5에 나타내었다.
광경화가 진행되면
라디칼 발생에 의해 methacrylate의 이중결합 피크(1635 cm-1)가 감소하게 된다. 따라서 광경화 전후에 변화가 없는 에스테르기 피크(1720 cm-1)와의 상대적인 비교를 통해서
광개시제의 효율을 추측할 수 있는데 Darocur 1173의 경우 광개시제가 없는 시료와 큰 차이를 보여주지 못하고 있다. 반면, PI-TPO와
Irgacure 819의 경우 1635 cm-1에서 피크의 감소가 확인된다. 이러한 결과를 바탕으로 본 연구에서는 370 nm의 광파장에서 개시효율이 좋고 레진과의 상용성이 우수한
PI-TPO를 광개시제로 사용하였다.
광경화 실험에서는
앞에서 설명한 것처럼 MHPA와 PEGDMA가 비율별로 혼합된 레진를 사용하였는데 자외선 조사 시간에 따른 비용해성 성분의 양을 측정하여
Figure 6에 나타내었다. 용매에
노출 후 비용해성 성분이 많다는 것은 경화도가 크다는 것을 의미하는 것으로 MHPA와 PEGDMA가 고분자 사슬에 포함됨을 간접적으로 증명하는 것이다.
비율에 상관없이 전체적으로 자외선 조사시간이 증가할수록 경화도가 증가하고 있는데 초기 60초 정도에서 경화과정이 대체로 끝나는 것을 볼 수 있다.
한편, 같은 자외선 조사시간에서는 MHPA의 함량이 증가할수록 경화도가 감소되었는데 MHPA의 큰 분자량 및 하나의 methacrylate기
존재로 인한 낮은 중합 참여 기회가 원인으로 판단된다. 하지만, MHPA가 30% 이내로 함유된 레진의 경우 30초에서
85%, 60초에서 96%의 높은 경화도를 나타내고 있다. 이를 통해 MHPA가 30 wt%까지 혼합되어도 광경화에 큰 문제가 없음을 알 수
있으며 이 결과는 abietic acid기반 methacrylate 유도체의 광경화 응용에 활용될 수 있을 것이다. 한편, MHPA가 광경화에
미치는 영향을 좀 더 세밀하게 분석하기 위해 MHPA 70%, PEGDMA 30%로 구성된 레진의 시간에 따른 경화거동을 FTIR로 측정하여
Figure 7에 나타내었다. 물론, FTIR에서는 정량분석이 어렵지만 동일한 샘플에 대한 측정이므로 상대적 비교는 가능할 것이다.
그 결과,
MHPA가 70% 함유되어 광경화가 어려울 것이라는 예상과 달리 광조사시간이 길어질수록 이중결합을 나타내는 1635 cm-1의 피크가 점진적으로 감소됨을
알 수 있다. 이것은 큰 분자량의 MHPA도 라디칼에 의한 개시가 비교적 잘 진행됨을 의미한다. 하지만, 경화도 실험에서
60초 후 55% 정도의 비용해성 성분이 관측된 결과와 비교해볼 때,
MHPA의 이중결합이 광개시제에 의해 개시되지만 고분자사슬에 참여하는 비율이 상대적으로 낮은 것으로 판단된다. 따라서 개시 후 올리고머 수준으로
존재하다가 용매에 의해 용출되는 것으로 판단되며 광경화를 위한 최적의 조성은 MHPA 30% 이내가 적당할 것으로 판단된다. 한편,
abietic acid는 소수성 물질로서 MHPA 합성과정에 히드록시기가 생성되기 때문에 소수성이 감소될 가능성이 있다. 이를 확인하기 위해 광경화된
레진의 접촉각을 측정하여 Figure 8에 나타내었다. 사진으로도 표시되어 있지만 PEGDMA로만 구성된 레진의 경우 접촉각이 40.1°였고
MHPA가 10, 30 wt%로 증가함에 따라 그 값이 43.6°, 45.1°로
다소 증가하는 것을 볼 수 있다. 물론, PEGDMA가 대표적인 친수성 물질이기 때문에 전체적인 접촉각이 친수성을 나타내는 범위에서 관찰되고 있지만,
조금씩 친수성이 감소된다는 것은 레진 내 MHPA가 여전히 소수성으로 작용한다는 것을 보여주는 결과이다.
Figure 9는
MHPA 함량에 따른 경화 후 박리강도 측정결과를 보여주고 있으며 계산된 물성값을 Table 2에 요약하였다. 일반적으로 abietic
acid는 접착력 향상 특성이 보고되는 천연물질이기 때문에 본 연구에서도 박리강도의 향상이 예상된다. 실제 PEGDMA로 구성된 경화필름의 경우
박리강도 0.91 MPa, 탄성계수 18 MPa을 보여주고 있지만 MHPA가 10 wt% 도입된 계에서는 각각 1.06, 88 MPa로 증가하였다. 특히 MHPA가 30 wt%로 구성된 경화필름에서는 1.27 MPa의 박리강도와
90 MPa의 탄성계수가 확보되어 기존대비 각각 140%,
500% 향상된 결과를 보여주었다.

|
Figure 1 1
H NMR spectra of (a) GMA; (b) abietic acid; (c) MHPA
in CDCl3. |

|
Figure 2 FTIR spectra of (a) GMA; (b) abietic acid; (c) MHPA. |

|
Figure 3 Viscosity of MHPA/PEGDMA blend as a function of
MHPA wt% at 25 oC. |

|
Figure 4 UV-Vis spectra of photoinitiators and MHPA monomer in
acetonitrile solution consisting of 0.001 wt%. |

|
Figure 5 FTIR spectra of PEGDMA after 370 nm UV irradiation
for 30 sec as a function of photoinitiator: (a) no photoinitiator; (b)
Darocur 1173; (c) PI-TPO; (d) Irgacure 819 at 25 oC. |

|
Figure 6 Insoluble fraction of MHPA based resins after exposed at
different UV irradiation time. |

|
Figure 7 FTIR spectra of MHPA based resin (70 wt% of MHPA)
containing PI-TPO as photoinitiator in aspect of UV irradiation
time: (a) 0 s; (b) 10 s; (c) 30 s; (d) 60 s; (e) 180 s at 25 oC. |

|
Figure 8 Contact angle of cured resins as a function of MHPA content. |

|
Figure 9 Ad hesive peel strengths of resins after UV-curing: (a)
MHPA 0 wt%; (b) MHPA 10 wt%; (c) MHPA 30 wt%. |
|
Table 1 Solubility of Abietic Acid and MHPAa |

a Meacured at 25 oC with a concentration of 0.05 g/mL. b
I = Insoluble,
S= Soluble. |
본 연구에서는 침엽수
rosin의 한 성분인 abietic acid를 활용하여 환경친화적인 자외선경화 레진을 제조하였다. 비록 합성 수율은 높지 않았지만 한 단계의
간단한 반응으로 methacrylate기가 도입된 MHPA를 합성하였으며 광경화 목적을 달성하기 위해 PEGDMA를 비율별로 도입하였다. 그 결과
MHPA의 함량이 증가할수록 광경화도가 감소하였는데, 이는 고분자 사슬에 참여하지 못한 MHPA계열 올리고머의 생성이 원인으로 판단된다. 하지만, MHPA가
30 wt% 이하로 구성된 레진의 경우 60초의 자외선노출 시간에서
최소 96%의 경화도를 보여주는 등 광경화 반응에 충분히 적용될 수 있음을 증명하였다. 또한 같은 조성의 경화필름에서 MHPA가 존재하지 않은
필름 대비 140% 향상된 박리강도와 500% 향상된 탄성계수가 관찰되었다. 따라서 본 연구는 자연유래 천연물질을 활용한 친환경 광경화 레진의
다양한 합성 및 응용에 긍정적인 영향을 줄 것으로 기대된다.
- 1. C. Ding and A. S. Matharu, ACS Sustain. Chem. Eng., 2, 2217 (2014).
-

- 2. X. Liu, R. Zhang, T. Li, P. Zhu, and Q. Zhuang, ACS Sustain. Chem. Eng., 5, 10682 (2017).
-

- 3. S. Janocha, J. Zapp, M. Hutter, M. kleser, J. Bohlmann, and R. Bernhardt, ChemBioChem, 14, 467 (2013).
-

- 4. W. Ding, S. Wang, K. Yao, M. S. Ganewatta, C. Tang, and M. L. Robertson, ACS Sustain. Chem. Eng., 5, 11470 (2017).
-

- 5. S. S. Ray, A. K. Kundu, and S. Maiti, J. Macromol. Sci. Chem., A23, 271 (1986).
- 6. S. Maiti, S. S. Ray, and A. K. Kundu, Prog. Polym. Sci., 14, 297 (1989).
-

- 7. R. A. El-Ghazawy, A. M. El-saeed, H. I. Al-Shafey, A. M. A. Raheim, and M. A. El-Sockary, Eur. Polym. J., 69, 403 (2015).
-

- 8. M. F. Sloan, U. S. Patent 3,554,981 (1971).
- 9. S. S. Ray, A. K. Kundu, M. Ghosh, and S. Maiti, Eur. Polym. J., 21, 131 (1985).
-

- 10. M. Shirai, K. Mitsukura, and H. Okamura, Chem. Mater., 20, 1971 (2008).
-

- 11. P. Froehling, J. Polym. Sci., Part A: Polym. Chem., 42, 3110 (2004).
-

- 12. M. H. M. Oudshoorn, R. Penterman, R. Rissmann, J. A. Bouwstra, K. J. Broer, and W. E. Hennink, Langmuir, 23, 11819 (2007).
-

- 13. A. Vitale, R. Bongiovanni, and B. Ameduri, Chem. Rev., 115, 8835 (2015).
-

- 14. C. Decker, T. N. T. Viet, D. Decker, and E. Weber-Koehl, Polymer, 42, 5531 (2001).
-

- 15. H. S. Do, J. H. Park, and H. J. Kim, Eur. Polym. J., 44, 3871 (2008).
-

- 16. G. S. Kwak, J. U. Choi, K. H. Seo, L. S. Park, S. H. Hyun, and W. S. Kim, Chem. Mater., 19, 2898 (2007).
-

- 17. K. Studer, C. Decker, E. Beck, and R. Schwalm, Prog. Org. Coat., 48, 92 (2003).
-

- 18. H. M. Badawi and S. A. Ali, Spectrochim. Acta A, 74, 558 (2009).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(6): 875-880
Published online Nov 25, 2020
- 10.7317/pk.2020.44.6.875
- Received on Jul 24, 2020
- Revised on Sep 16, 2020
- Accepted on Sep 16, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sang-Woog Ryu
-
Department of Engineering Chemistry, College of Engineering, Chungbuk National University, Cheongju 28644, Korea
- E-mail: swryu@chungbuk.ac.kr
- ORCID:
0000-0002-4728-2725










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.