- Synthesis and Characterization of Vinyl Terminated Poly(vinyl methyl Siloxane) by Ring Opening Polymerization
Department of Polymer Science and Engineering, Dankook University, Gyeonggi-do 16890, Korea
- 개환 중합에 의한 폴리비닐메틸 실록산 합성과 분석
단국대학교 고분자공학과
The vinyl terminated
poly(vinyl methyl siloxane) (VPVMS) was synthesized by ring opening
polymerization of cyclic vinyl methyl siloxane to investigate the effect of the
synthesis conditions on molecular weight, molecular weight distribution, and
reaction yield. When the excess capping agent was added and synthesized at a
temperature at which activation of the capping agent occurred well, the ring
opening reaction equilibrium was quickly achieved, and high yield and low
molecular weight were obtained. To synthesize high molecular weight of VPVMS,
the reaction temperature needed to be set lower than the activation temperature
of end capping agent but it was found that the ring opening reaction
equilibrium was slow and the yield was also low. Using minimized end capping agent
at 120 oC showed the stable ring opening polymerization and it
was confirmed that the yield increased as well as the molecular weight.
환형 비닐 메틸 실록산을 개환 중합에 의하여 vinyl terminated poly(vinyl methyl siloxane)을 합성하여 합성 조건이 분자량, 분자량 분포 그리고 반응 수율에 미치는 영향을 살펴보았다. 과량의
말단 캡핑제를 첨가하고 말단 캡핑제의 활성화가 잘 일어나는 온도로 합성하면 개환반응 평형이 빨리 이루어지며 높은 수율과 낮은 분자량을 얻을 수
있었다. 말단 캡핑제 활성화 온도보다 낮게 반응 온도를 설정하면 상대적으로 높은 분자량을 얻을 수 있으나
개환반응 평형 시간이 늦어지며 수율 또한 낮음을 알 수 있었다. 개환반응이 상대적으로 안정적으로 일어나는 120 oC에서 말단 캡핑제 함량을 최소화하면 분자량 증가와 동시에 수율도 함께 개선됨을 확인할 수 있었다.
The vinyl terminated poly(vinyl methyl siloxane) (VPVMS)
was synthesized by ring opening polymerization of cyclic vinyl methyl siloxane.
Using a minimized end
capping agent at 120 oC
shows the stable ring opening polymerization and it was confirmed that the
yield increased as well as the molecular weight.
Keywords: vinyl terminated poly(vinyl methyl siloxane), ring opening polymerization, end capping agent, reaction temperature, reaction time
본 연구는 2020년도 정부(산업통상자원부)의 재원으로 한국산업기술진흥원의 지원을 받아 수행된
연구임(P000 2007 2020년 산업혁신인재성장지원사업). 본
연구는 경기도가 지원한 경기도 지역협력연구센터(GRRC) 사업(과제명: 유연 소재 정밀성형용 기능성 미세복합소재 개발(GRRC단국2016-B02)) 지원으로 수행되었습니다.
Polyorganosiloxane은
낮은 유리전이 온도, 소수성에 의한 낮은 표면장력 그리고 열 안정성과 산화 안정성 및 기체 투과성이 우수하여 다양한 산업 소재로 널리 사용되고
있다.1,2 특히 여러 가지 단량체를 이용하여 곁사슬에 결합된 물질을 변화시켜 사용 용도에 맞는 다양한 물성을 가질 수 있으며
아울러 복합 단량체를 사용할 수 있음에 따라 공중합체 합성이 가능하다.3-5
폴리실록산은 실리콘이라
불리며 오일, 고무, 레진으로 분류되어 상업적으로 많이 사용되고 있다. 그중 가장 대표적인 실리콘 오일은 사용 범위가 넓어 공업용 재료로 주로
사용되고 있으며2-4 가장 대표적인 예로 선형 poly(dimethyl siloxane) (PDMS)가 있다. PDMS는 주사슬이
Si-O 결합으로 이루어져 있으며 Si에 메틸 그룹이 결합되어 있다. 말단에는 비반응성 물질이 주로 결합되어 있기 때문에 강산, 강염기 조건이 형성되지 않는 이상 반응성을 보이지
않아 관능성 유기물질을 결합하여 반응성을 부여할 수 있다.2 일반적으로 PDMS를 얻기 위해 사용되는 cyclic siloxane은
octamethylcyclosiloxane(D4)이다. 이렇게 얻어진 PDMS는 소량의 cyclic polymer를 포함하고
있으며, 이들은 reticulation 및 backbiting 현상을 일으키는 원인이 되기도 한다.6,7
PDMS는
chlorosilane의 가수분해, 양이온성 개환 중합, 음이온성 개환 중합의 3가지 방법으로 합성할 수 있으며 고분자량의
PDMS를 합성할 수 있는 방법인 개환 중합은 상업적인 합성 방법으로 주로 사용되고 있다. Chlorosilane의 가수분해는
폴리실록산의 단량체를 합성하기 위하여 물과 함께 일으키는 반응이다. 일반적으로 PDMS를 합성하기 위하여
dimethyldichlorosilane을 이용하며 염산 수용액의 농도를 조절하여 cyclic siloxane과 linear siloxane의
비를 조절하는 방법으로 합성시키게 된다. Cyclic siloxane의 양이온 개환 중합은 선형 폴리실록산을 합성할 때 주로 사용하는 방법으로, 평형 반응에 의해 조절되며, 실온에서도 반응이 쉽게
일어나며 개시제를 중합체로부터 쉽게 제거할 수 있다는 장점이 있다. 그러나 반응 초기에 cyclic oligomer가 다량 생성된다는 단점이 있다.
Cyclic siloxane의 음이온 개환 중합은 규칙적인 블록 공중합체를 합성하거나 siloxane의 그래프팅 혹은 망상 구조를 형성하기
위해 사용된다. 이는 평형 중합에 의해 적용되며 좁은 분자량 분포를 얻을 수 있다는 장점이 있다.2,4,6,8
Cyclotetrasiloxane은
개환 중합으로9 vinyl end-capped polyorganosiloxane을 합성하는 단량체 중의 하나로 실리콘 산업에서
중요한 중간체이며, 실리콘 오일이나 고무, 실리콘 수지를 합성할 때에 중요한 역할을 한다.10 특히 주사슬에 포함되어 있는
비닐기의 이중결합 반응성을 이용하여 다른 관능기로 쉽게 변형을 일으킬 수 있기 때문에 다양한 반응성 코팅제와 같은 실리콘 제품에 응용되고 있다.11
실록산 중합체 사슬을 따라 위치하는 비닐기는 실리콘 엘라스토머의 가황 및 기계적 특성에 영향을 미친다.10 그 예로 D4와
D4Vi,Me의 공중합체의 경우 비닐기에 의해 열 안정성이 우수해지며 점도에 대한 온도 의존성이 낮아지는
특성을 보인다고 연구된 바 있다.12 함유하고 있는 비닐기가 실리콘 물성에 영향을 미치는 것은 많이 알려져 있으나9-13
사용 용도에 따른 다양한 분자량을 얻기 위한 D4Vi,Me의 개환 중합 시 중합조건이 합성 메커니즘에 미치는
영향에 대한 연구는 상대적으로 미흡하다.
본 연구에서는
cyclotetrasiloxane을 이용하여 음이온 개환 중합 반응을 통해 말단에 비닐기가 치환된 vinyl terminated poly(vinyl methyl
siloxane)(VPVMS)를 합성하고 반응 온도, 반응 시간, 사용된 말단 캡핑제의 양이 합성된 VPVMS의 분자량과 분자량 분포 그리고 반응 수율에 미치는
영향을 살펴보았다.
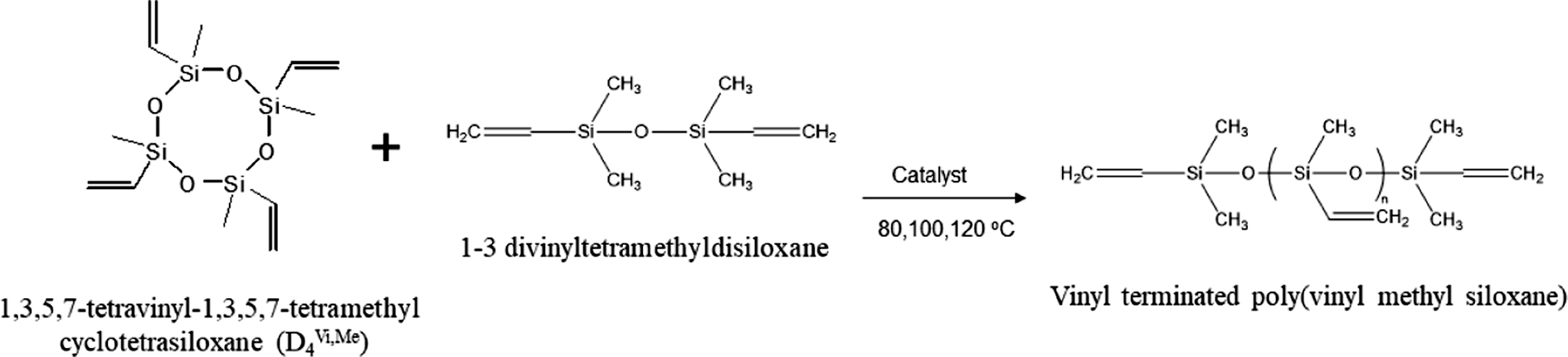
재료. 비닐기를 함유한 VPVMS를 합성하기 위해서
Gelest사로부터
1,3,5,7-tetramethyl 1,3,5,7-tetravinylcyclotetrasiloxane (D4Vi,Me)과
1,3-divinyltetramethyldisiloxane(VMS)를 구입하여 각각 단량체와 말단 캡핑제(end capping agent)로 그대로
사용하였다. D4Vi,Me 단량체의 비닐기가 반응에 미치는 영향을 상대 비교하기 위하여 비닐기가 없는
Gelest 사의 octamethyl cyclosiloxane(D4)을 vinyl terminated poly(methyl
siloxane) (VPDMS) 합성을 위한 단량체로 사용하였다. 다미폴리캠으로부터 제공받은 potassium
trimethylsiloxanolate를 촉매로 사용하였으며, 중화제로는 Aldrich사의 tris(2-chloroethyl)
phosphate를 그대로 사용하였다.
Vinyl
Terminated Poly(vinyl methyl siloxane)의 합성. VPVMS를 합성하기 위해 Kang의14
방법을 참고하였다. 환류냉각기, 온도계, 교반기, 질소 유입구가 장착된 250 mL의 3구 플라스크를 사용하여 단량체인 D4Vi,Me과
말단 캡핑제인 VMS를 비율에 따라 혼합한 뒤 촉매를 혼합액의 0.3 wt% 만큼 첨가하여 반응 온도 및 반응 시간을 조절하여 평형 중합시켰다. 반응 종결 후 촉매의 0.06 wt% 만큼의 중화제를 첨가하여 30분간 중화하였으며,
이후 Jeio Tech사의 진공건조기(OV-11)로 90 oC에서 24시간 동안
진공 증류시켜 단량체와 미반응물을 제거하여 반응 수율을 확인하였다. 각 실험에서 단량체와 말단 캡핑제의 비율, 반응 온도
및 반응 시간은 Table 1에 나타내었으며, 반응 모식도는 Scheme 1에 나타내었다. 반응 온도 120 oC는 단량체와 캡핑제 끓음 현상을 최소화할 수 있는 중합 가능 최대 온도로 적용하였다.
분석. 합성된 VPVMS 구조를 분석하기 위해 Jeol사
Jeol 400을 이용하여 nuclear magnetic resonance(NMR) 분석을 하였다. 1H NMR은 400 MHz의 주파수를 이용하여 측정하였고, 각 시료는 CDCl3에 용해하여 사용하였다.
Thermo Scientific사의
FTIR spectrometer(Nicolet iS10)를 사용하여 합성 VPVMS에 나타나는 흡수 피크를 살펴보아 구조를 분석하였다. 합성된
VPVMS의 분자량과 분자량 분포를 확인하기 위하여 Tosoh사의 GPC(HLC-8320)를 사용하였으며, tetrahy-drofuran(THF)에
2000 ppm의 농도로 시료를 희석시킨 뒤, 필터링하여 측정할
샘플을 만들었고, 이를 25 oC, 1 mL/min의 조건으로 상대 질량 분자량을 측정하였다. 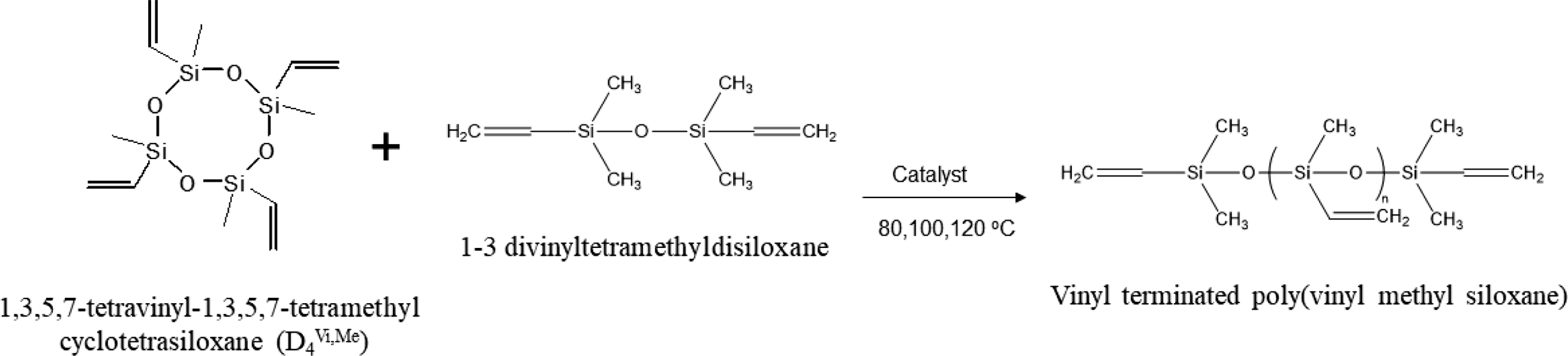
Scheme 1. Synthesis of VPVMS.
합성된 VPVMS 분석. Figure 1과 Figure 2에 D4Vi,Me과
VMS를 1대 1로 혼합하여 120 oC에서 2시간 동안
합성한 뒤 진공 건조하여 얻은 VPVMS를 1H NMR과 FTIR을 통하여 분석한 결과를 나타내었다. 1H
NMR의 경우, Figure 1에서 보는 바와 같이 (–Si-CH3) 메틸기에서의 H에 해당하는 피크가 D4Vi,Me,
VMS 그리고 VPVMS 모두 0.2-0.1 ppm 부근에서 나타나는 것을 확인할 수 있었다.
(-Si-CH=CH2) 비닐기의 H에 해당하는 피크는 D4Vi,Me의 비닐기의 경우
5.8-6.1 ppm에서 확인되고, VMS의 비닐기의 경우 5.7-5.8, 5.9-6.0, 6.1-6.2 ppm 부근에서 확인되었다. 합성된 VPVMS의 경우 함께 5.7-6.2 ppm 부근에서 주사슬의 비닐기와 VMS의 비닐기가 함께 확인되어 개환 중합이 잘 이루어졌음을 알 수 있었다.
FTIR의 경우,
Figure 2에서 보는 바와 같이 VPVMS의 주사슬인 Si-O-Si 결합은 1068-1034 cm-1에서 볼 수 있으며 Si과 결합한 메틸기의 경우 2962, 2094,
1258, 850-670 cm-1의 피크를 통해 확인할 수 있었다. 또한 1406 cm-1에서 C-H 결합을 확인할 수 있었다. 비닐기는 1597 cm-1에서 C=C 결합을 확인할 수 있고, 3054, 3016, 956 cm-1의 피크를 통해 이중 결합된 탄소와 결합한 수소의 존재(=C-H)를 확인할 수
있었으며 1000 cm-1에서 비닐기에 존재하는 C-H 결합을 볼 수 있었다. 이상의 결과로
VPVMS가 성공적으로 합성되었음을 확인할 수 있었다.
반응 시간 및 반응 온도에 따른 VPVMS의 분자량과 반응 수율. Table 1의 실험 1 조건에서 단량체 D4Vi,Me과
말단 캡핑제인 VMS의 질량비를 1대 1로 혼합하여 얻어진 VPVMS의 분자량과 분자량 분포 그리고 반응 수율을 Figure 3에 나타내었다.
반응 온도 80 oC의 경우, 2시간까지 VPVMS 분자량이 서서히 증가하다가 2시간 이후에는 분자량이 감소함을 알 수 있다.
100 oC와 120 oC에서 합성한 경우는
반응 시간 30분에서 분자량이 가장 크고 이후로 점점 감소하다가 2시간이 되면서 안정화되는 것을 볼 수 있다. 분자량 분포의 경우, 모든 온도에서 30분 반응에서 가장 넓어지며 시간이
경과함에 따라 감소함을 알 수 있다. 그림에서 보는 바와 같이 반응 온도가 증가됨에 따라 분자량이 작아지며 분자량 분포 또한 좁아짐을 알 수 있다.
이러한 결과는 단량체 함량에
비하여 과량의 말단 캡핑제(1:1)가 적용되면 VMS 활성화가 충분히 일어나는 120 oC에서 평형 중합에 의해 D4Vi,Me이 개환반응이 일어나면서 말단이
비닐기로 캡핑되어 분자량이 작아지며 개환되었던 사슬이 backbiting 반응에15 의하여 분자량 분포도 또한 좁아지는 반면,
반응 온도가 VMS 활성화 온도보다 낮으면 말단에 비닐기로 terminate되지 못하고 환으로 돌아가며 다시 평형 중합에 의하여 반복적인 개환이
일어나 분자량은 증가되며 분자량 분포 또한 넓어지게 된다. Figure 3(c)에서 보는 바와 같이 과량의 말단 캡핑제를 적용하면 반응
온도와 관계없이 수율이 40-60%로 상업적 합성에서 인정할 수 없는 정도의 매우 낮은 수율로 VPVMS가 얻어짐을 알 수 있다. 수율은 낮은
온도에서 말단 캡핑제의 활성화가 원활하지 않음에 따라 미반응 단량체의 양이 증가되고 그 결과, 높은 반응 온도에 비하여 상대적으로 수율이 낮음을 알 수 있다. 결과적으로 과량의 말단 캡핑제를 사용하는
경우 반응성 코팅제로 사용 가능한 분자량이 낮은 VPVMS를 얻을 수 있으나 낮은 수율 그리고 반응이 안정화되는 시간이 길어진다는 문제점을 가짐을
알 수 있다.
Figure 4에
Figure 3과 비교하여 상대적으로 소량의 말단 캡핑제가 첨가된(D4Vi,Me:VMS=1:0.1) 단량체를
80 oC와 120 oC로 반응시킨
VPVMS의 분자량, 분자량 분포 그리고 반응 수율 결과를 나타내었다.
Figure 3과
비교하여 80, 120 oC에서 반응시킨 VPVMS의 분자량은 각각 150000과 50000으로 말단 캡핑제 양의 감소가 분자량의 증가를
초래함을 알 수 있으며 Figure 3의 말단 캡핑제 과량 첨가와 마찬가지로 고분자량을 얻기 위해서는 낮은 온도에서 반응시키는 것이 더 효과적임을
확인할 수 있다. 또한 과량의 말단 캡핑제로 합성한 VPVMS에 비하여 상대적으로 30분-1시간의 짧은 시간에서 반응이 평형에 도달하며 반응 온도가
높을수록 더 짧은 시간에 반응이 이루어짐을 알 수 있다. 이러한 결과는 앞에서 언급된 바와 같이 개환 중합의 특성상 개환이 일어나면 말단 캡핑이
일어나면서 분자량이 조절됨으로 말단 캡핑제의 양이 적은 경우, 지속적인 단량체의 연결이 일어나면서 분자량이 증가되며 상대적으로 말단 캡핑제 활성화
정도가 낮은 저온에서 분자량 증가가 두드러짐을 알 수 있다. 이러한 지속적인 분자량 증가에 의하여 Figure 4(b)에서 확인된 바와
같이 반응 온도에 관계없이 30분 이내의 분자량 분포는 2.0으로 안정화됨을 알 수 있다. Figure 4(c)에 소량의 말단
캡핑제의 첨가로 얻어진 VPVMS의 반응 수율을 나타내었다. 과량의 VMS를 첨가한 경우 낮은 분자량의 VPVMS를 얻을 수 있지만, 수율은
60% 이하로 매우 낮아 합성의 효율이 현저히 떨어지는 반면 소량의 말단 캡핑제를 첨가하는 경우 120 oC 반응의 경우, 반응 30분 이내에 80% 정도에 안정된 수율을 얻을 수 있음을 알
수 있다. 이는 소량의 말단 캡핑제로
인하여 말단이 캡핑되지 못함에 따라 지속적인 반응이 일어나 잔존 단량체를 최소화하기 때문이다.
단량체와 말단 캡핑제 비가 분자량과 반응 수율에 미치는 영향.
Figure 3과 Figure 4의 결과로부터 말단 캡핑제의 활성화 최적 온도에 근접하는 반응 온도 120 oC에서 반응이 가장 빨리 평형에 도달하며 아울러 반응 수율 또한 최대치가 됨에 따라 Figure 5에
120 oC에서 2시간 동안 합성반응을 진행하여 단량체와 말단 캡핑제의 비가 분자량과 수율에 미치는 영향을 나타내었다.
단량체인 D4Vi,Me의 비율이 증가할수록 분자량과 수율도 증가함을 알 수 있다. 즉, 고분자량의
VPVMS를 합성하기 위해서는 말단 캡핑제의 단량체 첨가 비율을 낮추어야 하며, 저분자량의 VPVMS를 얻기 위해서는 과량의 말단 캡핑제를 첨가해야
함을 알 수 있다. 이상의 결과로부터 반응 수율을 60-80% 이상 유지하며 단량체와 말단 캡핑제의 비를 조절함으로써 분자량을
4000-15000 정도로 다양하게 조절할 수 있으며 반응 온도를 낮춤에 따라 180000 이상의 고분자량의 VPVMS를 합성할 수 있었다.
Figure 6은
단량체로 사용한 D4Vi,Me의 비닐기가 중합에 미치는 영향을 확인하기 위하여
Table 1에서 실험 2의 조건으로 단량체를 비닐이 없는 octamethylcyclosiloxane(D4)로 하여 120 oC에서 2시간 동안 합성하여 vinyl terminated poly (dimethyl siloxane)(VPDMS)를 얻은 결과이다.
Figure 5와
Figure 6을 비교하면 VPDMS 역시 VPVMS와 같이 사용된 말단 캡핑제의 양이 줄어들수록 분자량 및 수율이 증가함을 알 수 있다. 그러나
VPDMS의 경우, 과량의 말단 캡핑제를 첨가하여 저분자량을 얻을 수 있으나 캡핑제의 양이 1:0.4까지 수율이 증가되지 않으며 다소 감소함을
보이나 수율이 40% 미만으로 매우 낮아 효율적인 합성 방법이 아님을 알 수 있다. 하지만, 캡핑제 양을 더 감소시키면 D4Vi,Me
와 유사한 수율과 분자량을 얻을 수 있음을 알 수 있다. 결과적으로 D4Vi,Me 와는 달리 비닐기가 없는
D4를 사용하면 과량의 VMS를 사용하여 적절 수율을 만족하면서 저분자량의 VPDMS의 합성이 가능하지 않음을 알 수 있다.
같은 합성 조건임에도 불구하고 전체적으로 VPVMS의 분자량이 VPDMS의 분자량보다 큰 것을 볼 수 있다. 이를 통하여 D4Vi,Me의
반응성이 D4보다 큰 것을 알 수 있다. D4를 이용한 VPDMS의 합성의 경우 상대적으로 말단 캡핑제
양이 반응에 미치는 영향이 적은 반면, D4Vi,Me 경우, 포함하고 있는 비닐기의 이중결합이 높은 반응성을
보이기 때문에 말단 캡핑제없이 벌크 상태로 중합하게 되면 반응 속도도 더 빨라지게 되고 생성물로 인한 점도 증가 및 합성 중 발열 반응으로 인한
반응의 조절이 어려운 합성의 문제점을 유발한다. 따라서 D4Vi,Me 개환 중합에서 말단 캡핑제의 조절은
반응에 매우 중요한 요소가 됨을 알 수 있다.
미반응 단량체의 제거에 따른 분자량 변화. Figure 7과 Figure 8에 단량체와 말단 캡핑제의
비가 각각 1:1과 1:0.1로 2시간 동안 80 oC와 120 oC에서 반응하여 얻어진 VPVMS의 잔존 단량체 제거를 위하여 90 oC에서 24시간 건조 후 VPVMS의 분자량 변화를 나타내었다. Figure 8의 말단 캡핑제의 양을 과량으로
사용하고 80 oC에서 반응시킨 Figure 7(a)의 경우, 진공 건조 전보다 후의 분자량이 증가된 것을
볼 수 있으며 반응 온도가 120 oC의 경우(Figure 7(b)) 반응 시간과 관계없이 전체적으로 분자량의 차이가 거의
없다. 이는 80 oC에서 합성 시에는 과량으로 존재하는 말단 캡핑제가 충분히 활성화되지 않았기에 반응이 종결되지 않았으며,
120 oC의 경우 말단 캡핑제가 충분히 활성화되어 미반응 단량체의 제거 과정 전에 반응이 완전히 종결되었음을 추측할
수 있다. VPVMS 합성 시 과량으로 사용된 말단 캡핑제인 VMS의 끓는점이 약 140 oC이며 이를 제거하기 위해 90 oC에서 진행하는 진공 건조
과정에서 말단 캡핑제가 활성화되어 잔존하는 미반응 단량체와 반응이 일어나며 상대적으로 미반응 단량체가 많은 80 oC에서 평형 반응에 따라 합성된 VPVMS의 개환 중합이 일어나 분자량 증가를 초래함을 알 수 있다.
Figure 8에
상대적으로 말단 캡핑제의 양이 적은 경우 그림에서 보는 바와 같이 80 oC(Figure 8(a))와 120 oC(Figure 8(b))에서 합성된 VPVMS는 오히려 분자량의 감소가 일어남을
알 수 있다. 이는 Figure 7에 비하여 말단 캡핑제가 적은 만큼 분자량은 증가하였으나 장기간의 건조로 인해 backbiting 반응이 일어나
분자량 변화를 초래하는 것으로 유추된다.

|
Figure 1 1
H NMR spectrum of (a) D4
Vi,Me; (b) VMS; (c) VPVMS. |

|
Figure 2 FTIR spectrum of VPVMS. |

|
Figure 3 Effect of reaction time and reaction temperature on (a)
molecular weight; (b) polydispersity; (c) yield when applied
D4
Vi,Me:VMS (wt%) ratio is 1:1. |

|
Figure 4 Effect of reaction time and reaction temperature on (a)
molecular weight; (b) polydispersity; (c) yield when applied
D4
Vi,Me:VMS (wt%) ratio is 1:0.1. |

|
Figure 5 Molecular weight and yield of VPVMS polymerized at
120 ℃ for 2 h as a function of the ratio of monomer and end capping agent. |

|
Figure 6 Molecular weight and yield of VPDMS polymerized at
120 ℃ for 2 h as a function of the ratio of monomer and end capping agent. |

|
Figure 7 Effect of vacuum distillation process to remove the unreacted monomer in VPVMS polymerized at (a) 80 ℃; (b) 120 ℃
when applied D4
Vi,Me:VMS (wt%) ratio is 1:1. |

|
Figure 8 Effect of vacuum distillation process to remove the unreacted monomer in VPVMS polymerized at (a) 80 ℃; (b) 120 ℃
when applied D4
Vi,Me:VMS (wt%) ratio is 1:0.1. |
1,3,5,7-tetravinyl-1,3,5,7-tetramethylcyclotetrasiloxane(D4Vi,Me)을 이용하여 음이온 개환 중합 반응을 통해 말단에 비닐기가
치환된 vinyl
terminated poly(vinyl methyl siloxane) (VPVMS)를 합성하고 반응 온도, 반응 시간, 말단 캡핑제의 사용 양이 VPVMS의 분자량, 분자량 분포
그리고 반응 수율에 미치는 영향을 살펴본 결과 다음과 같은 결론을 얻을 수 있었다.
1. 반응 온도의
조절에 의하여 VPVMS의 분자량을 조절할 수 있으나 말단 캡핑제의 활성화 온도보다 낮은 반응 온도의 경우, 말단 캡핑이 잘 일어나지 않아 분자량이
커지며 상대적으로 반응 수율이 떨어지고 평형에 도달하는 반응 시간 또한 길어짐을 알 수 있었다.
2. 말단 캡핑제의
활성화 온도에 근접하는 120 oC의 경우 30분-1시간 이내 반응이 평형에 도달함을 알 수 있으며 높은 수율과 일정한 분자량 분포를 가질
수 있으나 상대적으로 낮은 분자량의 VPVMS을 얻을 수 있었다.
3. 가장 높은 수율을
얻을 수 있는 최적의 반응 온도인 120 oC에서 VPVMS의
분자량은 단량체와 말단 캡핑제의 비에 의하여 조절될 수 있으며 말단 캡핑제의 함량이 적을수록 높은 분자량을 얻을 수 있었다.
4. D4Vi,Me
경우, 포함하고 있는 비닐기의 이중 결합의 높은 반응성으로 인하여 비닐기가 없는 D4와 비교하여 말단 캡핑제의 양 조절이 반응에
매우 중요한 요소임을 알 수 있었다.
5. 말단 캡핑제의
과량 첨가에 의한 잔류 비활성 말단 캡핑제는 이들의 제거 과정에서 합성된 VPVMS에 함유되어 있는 미반응 단량체와 개환 반응을 초래하여 분자량
변화를 초래함을 알 수 있었다.
- 1. D. W. Kang and Y. M. Kim, Prospec. Ind. Chem., 2, 3 (1999).
- 2. B. I. Kil, Polym. Sci. Technol., 8, 298 (1997).
- 3. S. H. Yoo and H. J. Kang, Polym. Korea, 42, 521 (2018).
-

- 4. S. H. Yoo, Master’s Thesis, Dankook University (2018).
- 5. B. R. Yoo and I. N. Jung, J. Korean Ind. Eng. Chem., 13, 109 (2002).
- 6. D. E. Kherroub, M. Belbachir, S. Lamouri, and K. Chikh, Iran. J. Sci. Technol. A, 43, 75 (2017).
-

- 7. B. Chen, X. Zhan, L. Yi, and F. Chen, Chin. J. Chem. Eng., 15, 661 (2007).
-

- 8. G. M. Choi, Prospect. Ind. Chem., 6, 4 (2003).
- 9. X. F. Yang, Q. Shao, Q. Fang, L. L. Yang, C. Cao, Z. N. Ren, L. B. Wu, G. Q. Lai, and G. R. Han, Polym. Int., 63, 347 (2014).
-

- 10. Y. Lv, F. Shao, H. Dong, and C. Wu, J. Chem. Thermodyn., 129, 99 (2019).
-

- 11. S. Curteanu and M. Cazacu, J. Macromol. Sci. A, 40, 23 (2008).
- 12. S. W. Han and H. J. Kang, Polym. Korea, 42, 35 (2018).
-

- 13. M. Cazacu, M. Marcu, C. Ibanescu, S. Petrovan, M. Holerca, and M. Simionescu, Polym.-Plast. Technol. Eng., 35, 327 (1996).
-

- 14. D. W. Kang and B. C. Lee, Polym. Korea, 28, 143 (2004).
- 15. A. M. Tasic, M. V. Pergal, M. P. Antic, and V. V. Antic, J. Serb. Chem. Soc., 82, 1395 (2017).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(5): 633-640
Published online Sep 25, 2020
- 10.7317/pk.2020.44.5.633
- Received on Apr 4, 2020
- Revised on May 5, 2020
- Accepted on May 6, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Ho-Jong Kang
-
Department of Polymer Science and Engineering, Dankook University, Gyeonggi-do 16890, Korea
- E-mail: hjkang@dankook.ac.kr
- ORCID:
0000-0001-8411-3667











 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.