- Preparation of Water-soluble Polydithiocarbonates and Effective Copper Ion Isolation Through Polymer Binding
Department of Chemistry Education, Pusan National University, 2, Busandaehak-ro, 63 Beon-gil, Geumjeong-gu, Busan 46241, Korea
- 수용성 싸이오카보네이트 고분자 제조와 구리이온 결합 연구
부산대학교 화학교육과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Water-solublepoly(dithiocarbonate)s were prepared through cationic ring-opening polymerization of 5-membered cyclic dithiocarbonates containing hydrophilic substituents, such as alcohol, triethyleneglycol, and morpholine. The morpholine attached monomer underwent polymerization in CF3CO2H solvent, leading to in-situ protonation of an amine moiety as a catalyst scavenger. When the prepared polymers were exposed to an aqueous copper(II) ion solution, the concentration of free copper ion was measured by UV-vis absorption spectroscopy after adding a rhodamine chemosensor. A characteristic absorption of a copper-rhodamine complex at 560 nm was weakened with polymer addition, indicating consumption of free copper ion through the formation of copper-polymer complex. The absorption intensity of 0.5 μm copper solution was reduced to 1/4 in the presence of a 200 ppm polymer.
수용성 싸이오카보네이트 고분자를 합성하기 위해 알콜기, 트리에틸렌글리콜, morpholine이 결합된 단분자를 합성하고 양이온 개환고분자 반응을 진행하였다. Morpholine이 결합된 단분자는 CF3CO2H 용매조건에서 아민의 중합 방해 기능을 억제시켜 고분자로 전환될 수 있었다. 구리(II) 이온 수용액에 합성된 고분자를 첨가하여 구리이온의 농도 변화를 관찰하였다. 구리이온의 농도는 첨가된 로다민 화학센서의 흡광도로 결정하였다. 구리와 로다민센서의 혼합 몰비를 1/2로 유지된 마이크로몰의 묽은 용액에서 흡광도 변화를 관찰하였다. 고분자 첨가에 따라 흡광도 감소가 일어났고 구리-고분자 결합 효과로 설명되었다. 0.5 μM의 구리이온은 200 ppm의 고분자를 첨가할 때 560 nm에서 흡광도가 약 1/4로 줄어들었다.
Water-soluble poly(dithiocarbonate) was developed for metal isolation from aqueous Cu2+ solution through metal-polymer binding. The concentration of free copper ion was determined by absorption intensity at 560 nm with a rhodamine chemosensor and reduced to 1/4 with 200 ppm polymer.
Keywords: hydrophilic polythiocarbonate, copper-polymer binding, water-soluble rhodamine copper sensor, ring-opening polymerization.
저자들은 이해상충이 없음을 선언합니다.
수용성 유기고분자는 고흡수성소재, 하이드로젤, 약물전달 소재, 전해질, 계면활성제, 이온분리 용 멤브레인 등 다양한 분야에서 활용되고 있다.1,2 폴리아민, 폴리아마이드, 폴리비닐알콜, 폴리아크릴산, 폴리에틸렌글리콜, 폴리비닐피롤리돈과 같은 대표적인 수용성고분자는 중성의 극성 작용기를 갖는 단분자로 제조된다.3-5 물에 대한 강한 수소결합을 제공하는 고분자 구조는 금속이온과의 결합능력에 따라 금속이온을 안정화시킬 수 있다. 폴리아민은 질소와 전이금속과 배위결합을 통해 중금속이온의 분리에 사용되었다.6,7 금속의 약한 배위결합은 물에서 쉽게 해리되지만 고분자에 의한 금속 결합은 다수의 작용기가 참여하는 킬레이트 형성을 통해 안정될 수 있다. 에테르, 에스테르, 아민, 아마이드 결합 고분자에서 금속의 안정화 효과가 관찰되었고, 이온분리막에서도 입증되었다. 비수용성이지만 친수성이 요구되는 경우 수용성 고분자는 가교반응이나 공중합체 형성 등의 방법으로 변형되어 사용될 수 있다.8 비수용성 고분자의 친수성을 향상시키는 방법으로 친수성 곁가지를 도입하거나, pH에 민감한 구조를 활용하기도 한다.
본 연구에서는 황이 결합된 고분자를 사용하여 금속이온 결합을 유도하고 특성 평가를 하고자 한다. 금속과 유기황의 결합은 금속이온 분리와 함께 선택적 결합에 따른 화학센서 개발에서 주요한 연구주제가 되고 있다.9,10 높은 황 함유를 갖는 유기황화물 구조의 싸이오카보네이트 고분자는 5각환 구조의 디싸이카보네이트 단분자에서 간단히 제조될 수 있다.11,12 3개의 탄소에 두개의 황이 결합되는 고농도의 황 결합 고분자는 개환 반응을 통해 매우 효율적으로 생성될 수 있다. 친수성 작용기를 곁가지로 도입한 수용성 싸이오카보네이트 고분자의 금속이온 결합 특성을 연구하고자 한다. 구리이온이 포함된 수용액에 고분자를 처리함으로써 구리와 고분자의 결합에 따른 구리 농도 감소는 흡광도 측정을 통해 관찰될 수 있다. 친수성 곁가지가 도입된 싸이오카보네이트 단분자를 사용하여 다양한 고분자를 제조하고 구조변화에 따른 금속분리 효과를 비교하고자 한다.
시약 및 화학구조 분석. 본 실험에 사용된 모든 시약은 Sigma Aldrich Chemical(USA) 사의 시약으로 별도의 정제 과정없이 사용하였다. 반응은 silica gel plate(Merck 5715)를 사용한 thin layer chromatography로 추적하였으며 자외선 램프 및 p-anisaldehyde를 포함하는 발현용액에 의한 발색으로 확인하였다. 혼합물의 분리와 정제는 실리카겔(Merck, 250-430, Germany)을 이용한 관 크로마토그래피로 진행하였다. 합성된 시료의 화학구조 해석은 VARIAN(USA)의 Mercury 300 MHz와 400 MHz NMR을 사용하여 분석하였으며, CDCl3를 용매겸 내부 기준 물질로 사용하였다.
Alkanethiol(1) 합성. Morpholine(4.40 mL, 50.0 mmol)을 1-bromo-3-chloropropane(10.0 mL, 100 mmol)을 CH3CN(200 mL)에 녹인 뒤 Cs2CO3(19.7 g, 60 mmol) 을 넣어 상온에서 3시간 교반하였다. 물을 첨가하고 ethyl acetate로 생성물을 추출하여 N-(3-chloropropyl)morpholine(7.4 g, 90%)을 얻었다. 생성물(5.0 g, 30.6 mmol)을 에탄올(170 mL)에 녹인 후 KI(2.51 g, 15.3 mmol)와 싸이오우레아(3.52 g, 45.8 mmol)를 첨가하여 24시간 환류하였다. NaOH(1.93 g, 45.8 mmol) 수용액(34 mL)을 반응기에 넣은 후 3시간 환류하였다. 상온으로 식은 반응 용액에 증류수를 첨가하고 ethyl acetate로 추출하였다. 유기층을 분리한 후 무수 MgSO4로 처리한 뒤 고체를 걸러내고 진공회전 증발기로 농축하였다. 실리카겔 관 크로마토그래피로 생성물을 분리 정제하여 생성물(1)를 83% 수율로 얻었다. 1H NMR(300 MHz, CDCl3): δ 3.71(s, 4H), 2.58(t, J=7.0 Hz, 2H), 2.44(s, 6H), 2.17(s, 2H), 1.36-1.16 (m, 1H); 13C NMR(75 MHz, CDCl3): δ 67.0, 57.2, 53.7, 30.6, 22.6.
Epoxide(2) 합성. Alkylthiol(1)(4.1 g, 25.4 mmol)을 1,4-dioxane(50 mL)에 녹인 후, KOH(4.98 g, 76.3 mmol)를 녹인 수용액(26 mL)을 첨가한다. 이 용액에 epichlorohydrine(6.10 mL, 76.3 mmol)을 주입하고 상온에서 24 시간 동안 반응시켰다. 증류수를 넣어 반응을 종결하고 EA로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카겔 관 크로마토그래피(EA/hexane, 1/10)로 에폭시 생성물(2)을 55% 수율로 분리하였다. 1H NMR (300 MHz, CDCl3): δ 3.72(s, 4H), 3.16(s, 1H), 2.89-2.79 (m, 1H) 2.75-2.62(m, 3H), 2.60(d, J=7 Hz, 2H,), 2.44(s, 7H), 1.83(d, J=7 Hz, 2H); 13C NMR(75 MHz, CDCl3): δ 66.9, 57.6, 53.6, 52.2, 46.8, 34.2, 30.3, 26.5.
Cyclic Dithiocarbonate(M3) 합성. Epoxide(2) (2.00 g, 9.20 mmol)와 CS2(1.1 mL, 18.4 mmol)의 혼합용액에 촉매량의 LiOtBu(41 mg, 0.46 mmol)를 첨가한 후 30 ℃에서 48 시간 교반하였다. 실리카겔 관 크로마토그래피(MeOH/EA, 1/10)로 생성물을 분리 정제하여 고리형 디싸이오카보네이트(M3)를 65% 수율로 얻었다. 1H NMR(300 MHz, CDCl3): δ 5.29(s, 1H), 3.73(s, 4H), 3.15-2.86(m, 2H), 2.79-2.59(m, 2H), 2.47 (s, 6H), 1.83(d, J=6.5 Hz, 2H); 13C NMR(75 MHz, CDCl3): δ 211.5, 89.9, 66.6, 57.2, 53.4, 38.7, 34.0, 30.5, 26.5.
2-Mercaptoethanol 또는 2-(2-(2-methoxyethoxy)ethoxyeth- anethiol12와 epichlorohydrine의 반응으로 형성된 에폭시 화합물을 CS2와 반응시켜 단분자 M1(88%)과 M2(85%)를 합성하였다.
M1: 1H NMR(400 MHz, CDCl3): δ 5.44(m, 1H), 3.99(s, 1H), 3.81(m, 2H), 3.79-3.62(m, 2H), 3.20-3.08(m, 2H), 2.80 (m, 2H; 13C NMR(100 MHz, CDCl3): δ 212.5, 91.2, 62.1, 39.0, 36.2, 34.9.
M2:1H NMR(300 MHz, CDCl3): δ 5.20-5.11(m, 1H), 3.75-3.69(m, 1H), 3.60-3.53(m, 1H), 3.50-3.49(d, J=3 Hz, 1H), 3.28-3.20(d, J=24 Hz, 1H); 13C NMR(75 MHz, CDCl3): δ 223.7, 133.5, 130.7, 129.6, 127.7, 89.0, 38.5, 36.1.
고분자 반응. 단분자 M1(1.05 g, 5.00 mmol) 를 포함하는 플라스크에 CHCl3(3 mL)를 넣어 만든 용액을 30 ℃로 유지한다. 이 반응기에 MeOTf(methyl triflate) (28 μL, 0.25 mmol)를 빠르게 주입한 뒤 12 시간 교반하였다. 농축시킨 후 실리카겔 관 크로마토그래피를 통해(EA/Hex=1/1, v/v) 고분자 이외의 물질을 제거하고 THF를 사용하여 고분자 Poly-A를 분리하였다. 같은 조건에서 단분자 M2로부터 고분자 Poly-B를 합성하였다.
단분자 M3(1.47 g, 5.00 mmol)를 CF3CO2H(5 mL)를 넣어 만든 용액을 30 ℃로 유지한다. 이 반응기에 MeOTf(methyl triflate)(28 μL, 0.25 mmol)를 빠르게 주입한 뒤 48 시간 교반하였다. 용액을 진공 농축시킨 뒤 CHCl3(5 mL)에 녹이고 Et3N(3 mL)를 첨가한 후 1시간 교반하였다. 반응용액을 CHCl3(20 mL)으로 묽힌 후 증류수로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카겔 관 크로마토그래피(THF)를 통해 고분자 고분자 Poly-C를 분리하였다.
Pol-A(88%) 1H NMR(400 MHz, DMSO-d6) δ 3.56(t, J=8 Hz, 2H), 3.35(m, 4H), 3.13(m, 1H), 2.71(t, J=8 Hz, 2H), 2.69-2.53(br, 1H); 13C NMR(100 MHz, CDCl3) δ 188.2, 60.9, 45.2, 34.4, 33.4.
Pol-B(70%) 1H NMR(300 MHz, CDCl3) δ 3.66-3.41(m, 10H), 3.33(s, 3H), 3.24-2.91(m, 2H), 2.87-2.80(m, 1H), 2.75-2.70(m, 2H); 13C NMR(75 MHz, CDCl3) δ 188.7, 71.8, 70.9, 70.4, 70.3, 59.0, 46.01, 34.6, 34.1, 31.2, 30.2.
Pol-C(67%)1H NMR(400 MHz, CDCl3) δ 3.88-3.65(m, 4H), 3.58-3.12(m, 4H), 3.12-2.82(m, 1H), 2.76-2.52(m, 2H), 2.52-2.40(s, 6H), 1.8(m, 2H).
이성질체(M3a) 합성. 단분자 M3(0.59 g, 2.0 mmol)와 ZnCl2(0.14 g, 1.0 mmol)를 chlorobenzene(8 mL)에 녹인 용액을 80 ℃에서 48 시간 교반하였다. 반응 용액에 증류를 첨가한 뒤 ethyl acetate로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카겔 관 크로마토그래피(MeOH/EA, 1/10)로 생성물 M3a (40%)를 분리하였다. 1H NMR(300 MHz, CDCl3): δ 4.17 (m, 1H), 3.87-3.65(m, 6H), 2.60-2.55(m, 2H), 2.44(m, 6H), 1.79(m, 2H); 13C NMR(75 MHz, CDCl3): δ 197.0, 64.0, 56.5, 52.1, 51.8, 39.3, 35.6, 29.1, 23.0.
구리 농도 측정. 제조된고분자 Poly-A와 Poly-B(300 mg)을 각각 DMSO(100 mL)에 녹여 3000 ppm 용액을 제조하여 사용한다. Poly-C는 묽은 HCl로 pH가 조절된 수용액에 녹여 3000 ppm 용액을 제조하였다. 구리와 수은 이온을 포함한 용액은 CuSO4와 HgCl2를 증류수에 녹여 만든 5.0 μM 수용액을 사용하였다. 금속 검출 로다민 용액은 Dye를 증류수에 녹인 5.0 μM 수용액을 제조하여 사용하였다. 로다민 용액과 금속 용액을 2/1(v/v)로 섞은 후 상온에서 1시간 경과 후 증류수를 첨가하여 1.0 μM의 Dye 농도 조건에서 흡광도를 측정하였다. 200 ppm 고분자 용액 실험을 위하여, 제조된 고분자 용액 1.0 mL와 구리 수용액 1.5 mL 혼합하여 2시간 교반 후 Dye 용액(3 mL)를 첨가하여 1시간 더 교반하였다. 증류수(3 mL)와 DMSO(6.5 mL)를 더 첨가하여 Dye 농도(1.0 μM)를 조절한 후 흡광도를 측정하였다. Poly-C 혼합 용액은 pH 용액을 첨가하여 농도를 조절함으로써 일정한 pH를 유지하였다.
단분자 및 고분자 제조. 고분자에 수용성 및 친수성 특성을 부여하기 위하여 고리형 디싸이오카보네이트에 알코올기, 트리에틸렌 글리콜 및 morpholine이 도입된 단분자를 제조하였다. Cs2CO3 존재하에서 morpholine과 1-bromo-3-chloropropane의 반응으로 N-알킬화 반응을 하였고 싸이오우레아를 처리하여 싸이올이 결합된 화합물 1을 합성하였다. Figure 1에 서술된 것처럼 epichlorohydrine을 도입하는 싸이올 알킬화 반응을 통해 에폭시 화합물 2를 합성하였다. 에폭시와 CS2의 고리화 첨가반응은 LiOtBu 촉매에 의해 진행되었고 고리형 디싸이오카보네이트 단분자 M3가 제조되었다. 같은 합성 방법으로 2-mercaptoethanol 로부터 단분자 M1을 높은 수율로 합성하였고 트리에틸렌글리콜이 결합된 M2는 기존의 합성법에 따라 제조되었다.12
고리형 디싸이오카보네이트는 강한 수소산이나 루이스산에 의해 고리열림 고분자화 반응으로 진행될 수 있고 동시에 고리형구조가 유지되는 O/S 이성질화 반응이 경쟁적으로 진행되는 특성이 있다. MeOTf와 같은 중성의 고반응성 알킬화 물질 사용으로 이성질화 반응이 억제되고 고분자 전환이 증가된다는 연구결과가 발표되었다.11 단분자 구조에 의존성이 높은 이러한 고분자 반응은 최근 인접한 황의 참여로 매우 효과적인 고분자 제조로 유도될 수 있음이 보고되었다. Figure 2에서, 단분자의 S에 MeOTf로부터 CH3가 결합되어 진행되는 고리열림반응과 인접 S의 참여로 episulfonium cation 중간체가 형성되어 고분자 사슬 성장이 진행되는 과정이 밝혀졌다. 리빙 양이온 중합반응 특성을 보이는 이 고분자 반응의 말단기는 충분히 안정하여 수분이나 산소의 존재에 큰 영향을 받지 않는 특성을 보였다. 알콜기를 갖는 단분자 M1의 고분자화 반응은 OH의 영향없이 잘 진행되어 Poly A를 형성하였다. 유사하게 M2로부터 Poly B를 합성하였다. 고분자화 반응에서 M1과 M2의 이성질화는 관찰되지 않았다. 같은 조건에서 단분자 M3의 고분자 반응은 진행되지 않았다. 고분자화 촉매인 MeOTf가 morpholine의 질소와 반응하여 소모되기 때문인 것으로 판단되었다. 이러한 이유로 질소를 화학적으로 결합시켜 비활성화할 수 있는 CF3CO2H를 용매로 사용하였다. 강한 산의 도입으로 morpholine은 양성자 염으로 전환되어 양이온 고리열림반응에 비활성화되고 고분자 반응이 잘 진행되었다. MeOTf를 첨가할 때 고분자화가 서서히 진행되었다. 위의 반응조건에서 생성된 고분자는 양성자 염의 구조를 가짐으로써 고분자 반응 후 과량의 아민으로 탈수소화 반응을 거쳐 고분자 Poly C를 제조할 수 있었다. 고분자의 구조는 Figure 3의 1H NMR 스펙트럼으로 확인되었다. 고분자 구조와 함께 isomer를 일부 포함하고 있다. CF3CO2H와 같은 강한 수소산에서 단분자의 O/S이성질화 반응은 경쟁적으로 일어날 수 있다. 이를 확인하기 위해 단분자의 이성질화 반응조건에서 이성질체를 합성하여 구조를 확인하였었다. M3는 ZnCl2 존재하에서 O/S 교환반응이 진행되어 이성질체인 isomer(M-3a)가 주 생성물로 형성되었고 1H NMR 스펙트럼을 통해 확인할 수 있었다. 4.15 ppm에서 나타난 흡수띠는 isomer의 H(a)에 해당되기 때문에 이 수소의 적분값을 비교하여 30%의 이성질화 반응과 70%의 고분자화 반응이 경쟁적으로 진행되었음을 알 수 있다.
친수성 작용기를 갖는 합성 고분자 Poly A는 DMSO와 THF에 용해가 좋으나 메탄올과 CHCl3 및 물에서는 거의 녹지 않았다. 유사하게 Poly B의 수용성도 좋지 않았다. 본 연구에서는 Poly A와 Poly B를 DMSO와 물의 혼합 용매를 사용하여 녹인 후 특성 평가를 진행하였다. Poly C는 메탄올 비롯한 대부분의 유기용매에 대한 용해도가 좋고 물에 대한 용해도는 HCl 포함된 산성pH 수용액에서 좋은 용해도를 보였다.
고분자 제조 조건과 분자량특성은 Table 1에 정리하였다. 고분자 반응은 리빙중합 특성을 보이기 때문에 개환중합반응을 위한 반응 개시제 MeOTf의 양을 5 mol%로 사용하여 분자량을 조절하였다. 이론적으로 약 20개의 단분자 결합이 예상됨으로서 3.0 kD에서 6.1 kD 범위의 {{{EQUATIONS}}}을 갖는 고분자가 형성되었다. Poly C의 분자량은 수용액에서 점도 측정을 하여 결정하였다.13
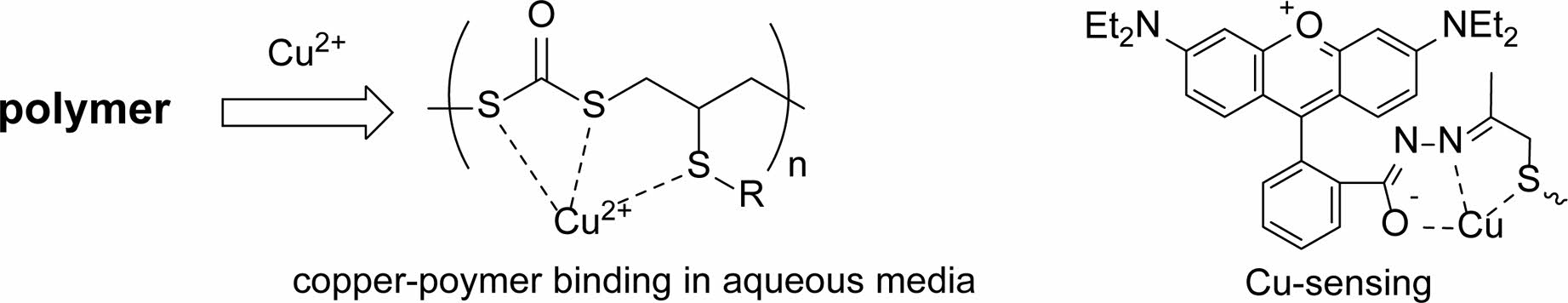
수용성 고분자의 구리결합 특성. 수용액에서 친수성 고분자와 구리이온 결합특성을 조사하기 위해 구리이온에 대한 선택성이 있는 화학센서 물질로 로다민 유도체(Dye)를 선택하였다(Figure 4).14
무색의 Dye는 Cu2+와 결합을 통해 강한 가시광 흡수 특성이 나타난다. 용액의 Cu2+ 농도에 따라 흡광도가 선형비례함으로써 구리 이온의 농도 측정에 활용하고자 하였다. 가장 흡수가 강한 560 nm의 흡광도 변화를 측정하여 구리이온 농도를 비교하였다. 합성고분자와 구리이온의 결합을 통해 용액내 Cu2+ 농도 감소가 될 경우 흡광도가 줄어들 것으로 예상된다.
Figure 5에서 첨가된 고분자의 농도에 따른 흡광도 변화를 도시하였다. 고분자 함량이 200 ppm까지 Cu2+ 농도가 급격하게 감소하였고 이후 완만한 변화를 보였다. Dye는 Cu2+에 대한 선택적 감응이 일어나고 Hg2+에 대한 감응은 거의 진행되지 않는다. Figure 6에서 Dye의 Cu2+대한 흡광도는 Hg2+이 함께 존재하는 조건에서도 거의 유사하게 관찰되었다. Dye는 1.0 μM 농도로 유지하고 Cu2+(0.5 μM)의 농도를 절반으로 줄여 구리 농도 변화에 민감한 조건을 만들었다. 3종의 합성 고분자를 사용하여 Cu2+결합 효과를 비교하였다. Figure 7에서 고분자가 첨가되지 않은 흡광도(I0)를 기준으로 고분자 첨가될 때의 상대적인 흡광도(I/I0)를 결정하여 비교하였다. Poly A와 Poly B는 흡광도 감소가 뚜렷이 진행되었음을 나타낸다. Poly C의 물에 대한 용해 특성은 낮은 pH에서 morpholine의 양성자염 변환을 통해 증가된다. 그러나, pH4와 pH5에서 상대 흡광도(I/I0)는 1보다 크게 나타났다. 이것은 Cu2+의 화학센서 물질로 사용된 로다민이 산성에도 민감하게 작동하기때문에 산과 구리 이온에 의한 효과가 함께 나타난 결과로 설명된다. pH6과 pH7 조건에서 Dye의 산에의한 흡광도 기여는 거의 무시할 수 있기 때문에, 측정된 흡광도 변화는 고분자에 의한 Cu2+의 농도 변화만 반영 한다. 황화물 고분자의 금속이온과 결합 능력은 Hg2+의 존재에 의해서도 관찰되었다. Cu2+와 Hg2+이 동시에 존재하는 용액에서 상대 흡광도가 약간 증가되는 것은 고분자에 Hg2+가 결합되어 고분자의 Cu2+ 결합 능력이 부분적으로 감소되고 유리되는 Cu2+가 용액에 증가했기 때문이다.

|
Figure 1 Preparation of 5-cyclic dithiocarbonate monomers |

|
Figure 2 Synthesis of poly(dithiocarbonate). |

|
Figure 3 1H NMR spectra of Poly C prepared from monomer M3 in CF3CO2H. |

|
Figure 4 Polymer-binding and reduction of Cu2+ concentration determined by chemosensor. |

|
Figure 5 Absorption intensity of Cu-Dye complex with a variance of polymer concentration. |

|
Figure 6 UV-vis absorption spectra of Dye solution sensitive to copper ion. |

|
Figure 7 Relative absorption at 560 nm of Cu-Dye complex treated with Poly A & Poly B dissolved in DMSO-water and Poly C in water. |
|
Table 1 Polymerization Condition and Characterization |

Polymerization was conducted using MeOTf (5.0 mol%) in 1.0 M concentration at 30 ℃. aThe average number of molecular weight (M̅n, kD/mol) and the average weight of molecular weight (M̅w) were determined by gel-permeation chromatography. PDI means M̅w/M̅n. bThe molecular weight was calculated from Mark-Houwink-Sakrada equation based on viscosity. |
오각환 디싸이오카보네이트로부터 수용성 싸이오카보네이트 고분자를 제조하였다. 친수성 작용기로 알콜기와 트리에틸렌글리콜이 도입된 단분자의 양이온 중합반응은 높은 고분자 전환율을 보였고, 질소를 포함된 morpholine 결합단분자의 개환중합반응은 CF3CO2H와 같은 강산성 용매에서 진행되었다. 황함유 수용성 고분자의 금속 결합력을 구리이온으로 평가하였다. 구리이온의 농도는 로다민 화학센서의 흡광도 변화를 통해 측정하였다. Cu2+ 수용액에 첨가되는 고분자의 양을 증가시킬 때 Cu2+의 농도는 비례하여 감소하였다. 수은 이온이 존재할 때 유리된 구리이온이 증가됨으로써 고분자와 수은 결합이 부분적으로 진행되는 것으로 관찰되었다. 수용성 싸이오카보네이트의 금속이온 결합 능력은 중금속 제거 및 분리에 활용될 수 있을 것이다.
- 1. Palencia, M.; Rivas, B. L.; Pereira, E.; Hernández, A.; Prádanos, P. Study of Polymer-Metal Ion-Membrane Interactions in Liquid-Phase Polymer-based Retention (LPR) by Continuous Diafiltration. J. Mem. Sci. 2009, 336, 128-139.
-

- 2. Reed, W. F.; Alb, A. M. Monitoring Polymerization Reactions: from Fundamentals to Applications, John Wiley & Sons, USA, 2013.
- 3. Halake, K.; Birajdar, M.; Kim, B. S.; Bae, H.; Lee, C. C.; Kim, Y. J.; Kim, S.; Kim, H. J.; Ahn, S.; An, S. Y.; Lee, J. Recent Application Developments of Water-Soluble Synthetic Polymers. J. Ind. Eng. Chem. 2014, 20, 3913-3918.
-

- 4. Mendonça, P. V.; Konkolewicz, D.; Averick, S. E.; Serra, A. C.; Popov, A. V.; Guliashvili, T.; Matyjaszewski, K.; Coelho, J. F. J. Synthesis of Cationic Poly((3-acrylamidopropyl)trimethyl ammonium chloride) by SARA ATRP in Ecofriendly Solvent Mixtures. Polym. Chem. 2014, 5, 5829-5836.
-

- 5. Geng T. M.; Wu, D. Y. Water-Soluble Polymeric Chemosensor for Selective Detection of Hg2+ in Aqueous Solution using Rhodamine-based Modified Poly(acrylamide-acrylic acid). Luminescence 2015, 30, 1263-1268.
-

- 6. Jarvis, N. V.; Wagener, J. M. Mechanistic Studies of Metal Ion Binding to Water-Soluble Polymers using Potentiometry. Talanta 1995, 42, 219-226.
-

- 7. Ko, L. A.; Huang, Y. S.; Lin, Y. A. Bipyridine-Containing Polysulfide Materials for Broad-Spectrum Removal of Heavy Metals from Water. ACS Appl. Polym. Mater. 2021, 3, 3363-3372.
-

- 8. Rivas, B. L.; Urbano, B. F.; Sánchez, J. Water-Soluble and Insoluble Polymers, Nanoparticles, Nanocomposites and Hybrids with Ability to Remove Hazardous Inorganic Pollutants in Water. Front. Chem. 2018, 6, 320.
-

- 9. Xin, Y.; Peng, H.; Xu, J.; Zhang, J. Ultrauniform Embedded Liquid Metal in Sulfur Polymers for Recyclable, Conductive, and Self-Healable Materials. Adv. Funct. Mater. 2019, 29, 1808989.
-

- 10. Zhang, Y. Y.; Glass, R. S.; Char, K.; Pyun, J. Recent Advances in the Polymerization of Elemental Sulphur, Inverse Vulcanization and Methods to Obtain Functional Chalcogenide Hybrid Inorganic/Organic Polymers (CHIPs). Polym. Chem. 2019, 10, 4078-4105.
-

- 11. Kim, C. G.; Son, M. J.; Do, J. Y. Cationic Living Polymerization of Cyclic Dithiocarbonates Involving Sulfide-Migration. Eur. Polym. J. 2021, 156, 110611.
-

- 12. Diebler, J.; Spannenberg, A.; Werner, T. Atom Economical Synthesis of Di- and Trithiocarbonates by the Lithium tert-Butoxide Catalyzed Addition of Carbon Disulfide to Epoxides and Thiiranes. Org. Biomol. Chem. 2016, 14, 7480-7489.
-

- 13. Wu, Y.; Zhang, N. Aqueous Photo-Polymerization of Cationic Polyacrylamide with Hybrid Photo-Initiators. J. Polym. Res. 2009, 16, 647-653.
-

- 14. Ahn, S.; Shin, S. B.; Jo, H.; Do, J. Y., Development of Water-soluble Rhodamine and Cationic Polyacrylate-Supported Chemosensor for Selective Cu(II) Sensing. Polym. Korea 2018, 42, 888-894.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(6): 744-749
Published online Nov 25, 2023
- 10.7317/pk.2023.47.6.744
- Received on Jul 18, 2023
- Revised on Aug 29, 2023
- Accepted on Sep 1, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jung Yun Do
-
Department of Chemistry Education, Pusan National University, 2, Busandaehak-ro, 63 Beon-gil, Geumjeong-gu, Busan 46241, Korea
- E-mail: jydo@pusan.ac.kr
- ORCID:
0000-0003-4348-727X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.