- Design and Evaluation of Hexanoyl Glycol Chitosan-Based Ultra-Low Attachment Mesh-Pattern Culture Dishes for 3D Cell Culture
Eun Young Koo# , Kyoung Hwan Park# , Sun-Woong Kang*, **,†
 , and Kang Moo Huh†
, and Kang Moo Huh† 
Department of Polymer Science and Engineering, Chungnam National University, Daejeon 34134, Korea
*Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
**Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea- 3차원 세포배양을 위한 헥사노일 글리콜 키토산 기반 세포비부착성 메쉬-패턴 배양접시 설계 및 성능평가
충남대학교 고분자공학과, *안전성평가연구소, **과학기술연합대학원대학교 인체 및 환경 독성학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
3D spheroid cell culture is widely used for various biomedical applications such as drug screening, cell therapy, and tissue regeneration due to higher bio-similarity compared to conventional 2D culture. In this study, effective 3D cell culture dishes were designed by optimizing the structure and coating stability of hexanoyl glycol chitosan (HGC) materials with ultra-low attachment (ULA) characteristics, and their effectiveness was evaluated. Various HGCs with different substitution ratios were synthesized and their coating stability and 3D cell culture ability were compared. In addition, ULA mesh-pattern culture dishes capable of mass-production of 3D spheroids of various and uniform sizes were produced by utilizing meshes of various specifications. The HGC polymer with a substitution ratio of 36% or more showed high stability and spheroid formation ability as a ULA coating material, and the mesh-pattern culture dishes were very effective in mass-production of cell spheroids of uniform and controlled sizes.
삼차원 스페로이드 세포배양은 기존 2차원 세포배양보다 높은 생체유사성으로 약물 스크리닝, 세포치료제 및 조직재생 등 다양한 바이오메디컬 연구에서 광범위하게 활용되고 있다. 본 연구에서는 ultra-low attachment(ULA) 특성을 갖는 헥사노일 글리콜 키토산(HGC) 소재의 구조 및 코팅 안정성의 최적화를 통해 효과적인 3차원 세포배양접시를 제조하고, 그 유효성을 평가하였다. 글리콜 키토산의 N-헥사노일화를 통해 치환율이 다양한 HGC 고분자들을 합성하였고, 코팅 안정성과 3차원 세포배양능을 비교하였다. 또한, 다양한 규격의 메쉬(mesh)를 활용하여 균일한 사이즈의 3차원 스페로이드 대량배양이 가능한 ULA 메쉬-패턴 배양접시를 제작하였다. 치환율 36% 이상의 HGC 고분자는 ULA 코팅소재로 높은 안정성과 스페로이드 형성능을 보였고, 메쉬-패턴 배양접시는 다양한 크기의 세포 스페로이드를 균일하고 대량으로 제조하는데 매우 효과적이었다.
In this study, effective 3D cell culture dishes were designed by optimizing the structure and coating stability of hexanoyl glycol chitosan (HGC) materials with ultra-low attachment (ULA) characteristics, and their effectiveness was evaluated. The HGC polymer with a substitution ratio of 36% or more showed high stability and spheroid formation ability as a ULA coating material, and the mesh-pattern culture dishes were very effective in mass-production of cell spheroids of uniform and controlled sizes.
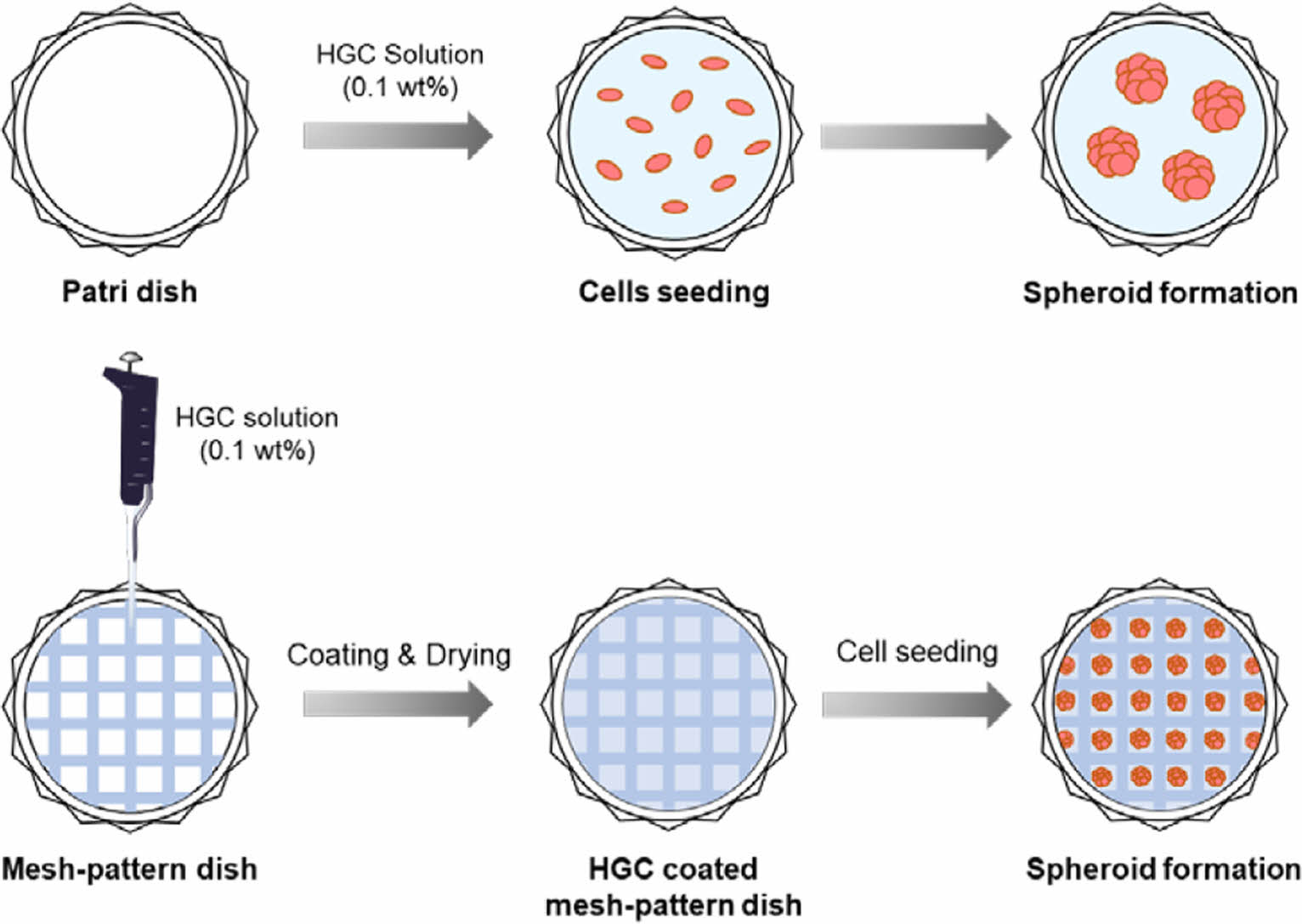
Keywords: 3D cell culture, hexanoyl glycol chitosan, ultra-low attachment, spheroid, mass-production.
본 연구는 한국연구재단 기초연구사업(NRF-2020R1A2C2100794, NRF-2022R1A2C1010161)과 정부(과학기술정보통신부, 보건복지부)의 재원으로(재)범부처재생의료기술개발사업단의 지원을 받아 수행된 연구결과입니다(22A0105L1-11).
저자들은 이해상충이 없음을 선언합니다.
전통적인 2차원 세포배양은 체외에서 배양된 세포의 성장, 증식 및 분화의 관찰을 통해 우리 몸에서 일어나는 현상을 유추하기 위한 가장 일반적이고 간단한 방법 중 하나이나, 생체 유사성 및 대응성이 낮아 그 효용성의 한계가 있었다.1,2 최근, 정교하고 복잡한 생물학적 시스템으로 구성되어 있는 생체 조직 및 기관을 모사하기 위해 개발된 3차원 세포배양 기술은 복잡하고, 어려운 제조과정에도 불구하고 생체 유사성과 대응성이 뛰어나 기존의 2차원 세포배양 및 동물실험을 대체할 수 있는 새로운 세포배양 모델로 주목받고 있다.3,4 삼차원 세포배양은 인체 내 세포들을 둘러싸고 있는 3차원 조직의 구조적, 물리적 및 생물학적 특성을 보다 정확하게 모사할 수 있게 해준다는 큰 장점을 제공한다.5-7 최근, 인체 장기의 구조와 기능을 모방할 수 있는 오가노이드 배양 모델이 새로운 3차원 배양법으로 주목을 받고 있음에도 불구하고, 현재로서는 상대적으로 기술의 편리성 및 재현성이 우수한 3차원 세포 스페로이드(spheroid) 배양법을 활용한 연구와 제품개발이 보다 광범위하게 이루어지고 있다. 이러한 예로, 항암제 개발에 있어 고형암을 모방하기 위해 암세포주를 이용하여 스페로이드를 유도하기도 하고,8 당뇨병 치료를 위해 정상적인 인슐린 분비를 유도하는 췌도 세포 구조체 개발 방법으로 스페로이드 이식이 시도되고 있다.9 또한, 줄기세포의 3차원 스페로이드 배양을 통해 각종 분화 기전 연구에 활용되기도 한다.10,11
지금까지 개발된 다양한 3차원 스페로이드 배양법 중에 가장 일반적인 방법으로서 세포와 기질의 부착을 최소화하여 세포-세포 상호작용을 향상시켜 스페로이드를 형성하는 세포비부착(ultra-low attachment, ULA) 시스템이 광범위하게 사용되고 있다.12,13 스페로이드 형성을 위한 가장 이상적인 ULA 시스템은 스페로이드 형성 제조과정이 간단하고, 스페로이드 크기 조절과 대량생산이 가능하며 형성된 스페로이드 수거가 용이해야 한다. 이를 위해서 ULA 성격을 갖는 생체소재의 개발은 매우 중요하다. ULA 시스템 제조를 위해서 일반적으로 사용된 코팅소재로는 poly-2-hydroxyethyl methacrylate(poly-HEMA),14 PEG-based materials,15 agarose,16 및 poly(vinyl alcohol)17 등이 있으며, 주로 세포배양접시의 표면을 코팅하여 바닥면에서 세포의 응집을 유도한다. 하지만, 이러한 코팅소재는 ULA 특성의 지속성이 낮아 장기간 배양 시 형성된 스페로이드가 배양접시 바닥에 부착하여 온전한 3차원 배양을 장기간 유지하기 어렵고, 스페로이드 수거 과정의 어려움과 손실 등으로 기술적 한계가 보고되고 있다.18 또한, 코팅소재의 비부착성이 낮은 경우에는 스페로이드 형성률이 낮거나 형성에 오랜 시간이 소요된다. 이러한 경우에 스페로이드를 구성하는 세포의 생존율이 낮아지고, 스페로이드 형성에 있어서도 재현성이 떨어지는 문제가 발생한다.19 따라서, ULA 시스템을 위한 코팅소재의 안정성, 지속성 및 ULA 특성 향상은 성공적인 3차원 배양 시스템 설계를 위한 핵심 기술이다.
최근 생체적합성 고분자인 키토산은 약물전달, 조직공학 등 다양한 바이오메디컬 응용을 위한 생체재료뿐만 아니라 스페로이드 배양을 위한 ULA 코팅소재로 재조명되고 있다.20,21 기존 연구보고에 의하면, 키토산이 코팅된 배양접시에서 성체줄기세포들의 스페로이드를 형성하였고, 다양한 세포로의 분화능을 확인하였다.22-24 하지만, 스페로이드 형성 효율이 낮았고, 산성 용액에서만 용해되어 중화과정이 필요하기 때문에 코팅 과정이 복잡하다.25,26 최근, 본 연구실에서는 기존 코팅소재보다 우수한 ULA 특성을 보이는 키토산 유도체, 아실 글리콜 키토산(N-acyl glycol chitosan)을 개발하였다.27,28 다양한 아실 그룹 중에서 헥사노일 그룹과 결합한 헥사노일 글리콜 키토산(hexanoyl glycol chitosan, HGC)은 가역적인 온도감응성과 중성 pH에서의 수용성으로 수성 코팅소재로써 유용하였고, 우수한 ULA 특성에 기반하여 다양한 세포들에 대해 매우 높은 스페로이드 형성률을 보임과 동시에 재부착 없이 장기간 3차원 배양이 가능함을 보여주었다.28,29
본 연구에서는 ULA 특성을 갖는 HGC 소재의 구조 및 코팅 안정성의 최적화를 통해 효과적인 3차원 세포배양 시스템을 설계하고, 최적화하고자 하였다. 글리콜 키토산(GC)의 N-헥사노일화를 통해 치환율이 다양한 HGC 고분자들을 합성하였고, ULA 코팅소재로의 안정성과 3차원 세포배양능을 비교하였다. 또한, 다양한 규격의 메쉬(mesh)를 활용하여 다양하고 균일한 크기를 보이는 3차원 스페로이드의 대량배양이 가능한 ULA 메쉬-패턴 배양접시를 제작하고, 비교 평가하였다. 본 연구결과는 3차원 세포배양 기술의 대중화 및 상용화에 기여할 수 있을 뿐 아니라, 약물 스크리닝, 세포치료제 및 조직재생 등 다양한 바이오메디컬 연구분야와 화장품 및 기타 기초 생명과학 분야에서 기술적 및 경제적 파급효과가 클 것으로 기대된다.
재료. 글리콜 키토산(GC, degree of polymerization ³ 400)은 Wako Pure Chemical Industries Ltd.(일본) 제품을 사용하였고, hexanoic anhydride (97%)는 Sigma-Aldrich사(미국) 제품을 사용하였다. 용매로는 3차 증류수와 메탄올(삼전화학, 한국)을 사용하였으며, 침전 시 아세톤(삼전화학, 한국)을 사용하였다. 투석막(molecular weight cut-off: 12-14 kDa)은 Spectrum Laboratories(미국) 제품을 사용하였다. Deuterium oxide(D2O) 및 Dulbecco’s Phosphate Buffered Saline(DPBS)는 Sigma-Aldrich(미국) 제품을 사용하였다.
헥사노일 글리콜 키토산(HGC) 합성. Scheme 1에서 나타난 것과 같이 GC의 N-헥사노일화 반응을 통하여 HGC를 합성하였다.30 먼저 실온에서 GC 1.5 g을 3차 증류수 190 mL에 녹인 후 메탄올 190 mL를 첨가하였다. 준비한 GC 용액에 hexanoic anhydride를 다양한 반응몰비(hexanoic anhydride/glucosamine residue) 0.32, 0.38, 0.43으로 첨가하여 치환율을 조절하였다. 상온에서 24시간 동안 교반 하에 반응시킨 후, 반응 용액을 아세톤에 침전하고 원심분리를 이용하여 침전된 물질을 수집하였다. 이를 다시 증류수에 녹여 투석막을 이용하여 48시간 동안 투석하였고, 5일 동안 동결건조를 통하여 최종적으로 파우더 형태의 HGC를 얻었다.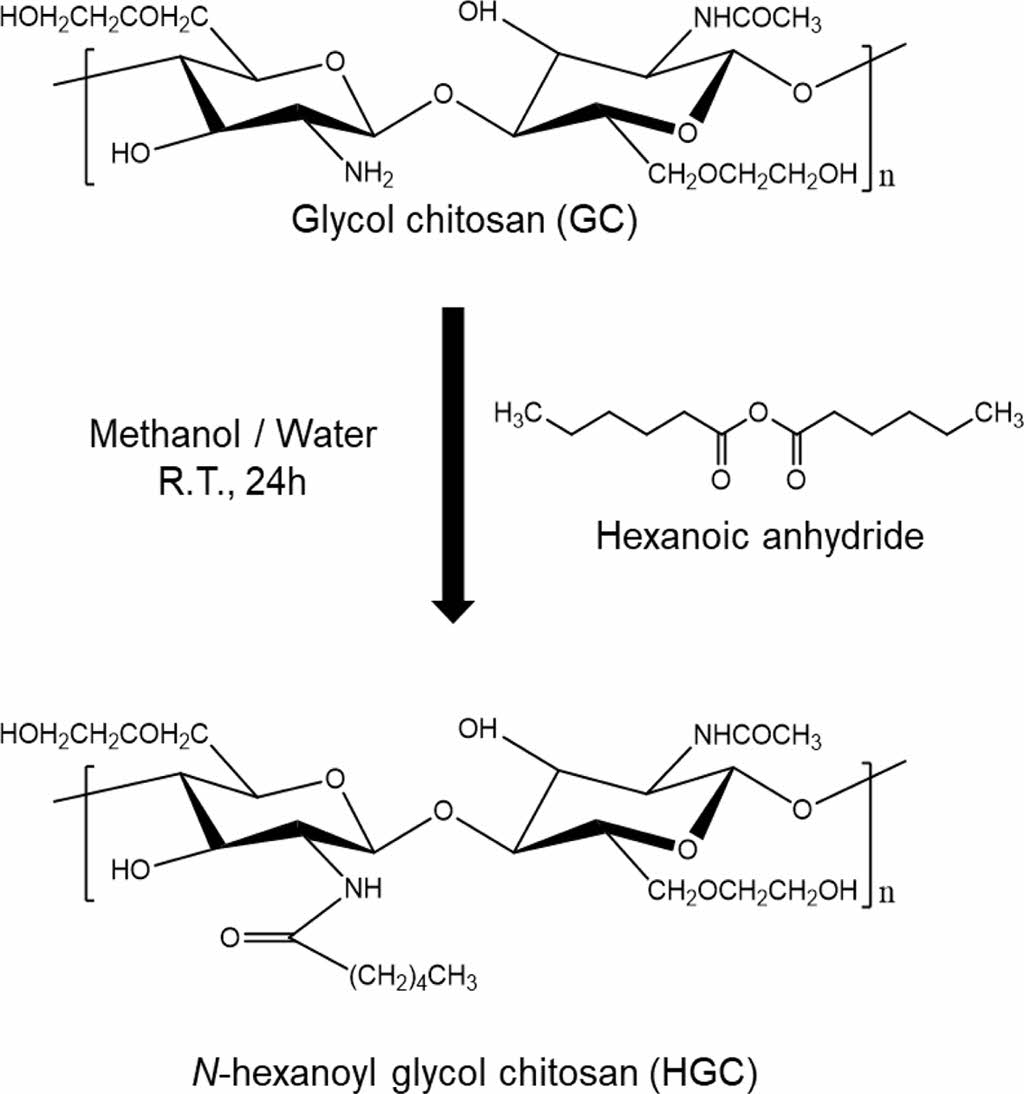
Scheme 1. Chemical structure of N-hexanoyl glycol chitosan (HGC).
HGC 합성 분석. 합성된 HGC 고분자의 화학적 조성을 관찰하기 위해 1H NMR과 ATR-FTIR 분석을 하였다. 먼저, 공명주파수 600 MHz에 작동시킨 AVANCE III 600(BURKER, 독일)을 사용하여 얻은 1H NMR 스펙트럼에 의해 치환율과 화학적 조성 및 구조적 특성을 분석하였다. 각 샘플은 용매 D2O에 농도 0.5 wt%로 녹였고, 4.85 ppm의 D2O 피크를 기준 피크로 설정하였다. ATR-FTIR 스펙트럼을 통한 화학적, 구조적 특성 분석은 Nicolet iS 5(Thermo Scientific, 미국) 기기를 이용하여 분석하였다. 샘플은 동결 건조한 후 파우더 형태로 얻어진 HGC를 사용하였다. 기기의 스펙트럼은 750-4000 cm-1 주파수 범위에서 4 cm-1의 분해능, 32회 스캔을 통해 측정하였다.
졸-젤 전이 온도 측정. 각각의 치환율에 따른 HGC 용액의 온도감응성을 확인하기 위해 졸-젤 전이 온도를 Multi-Blok® heater(Lab-Line Instruments, 미국)을 사용하여 승온 과정과 함께 tube tilting 방법으로 측정하였다. HGC 시료는 DPBS 용액(pH 7.4, 0.01 M)에 3 wt% 및 4 wt%의 농도로 녹인 후 4 ℃에서 냉장 보관하면서 투명한 수용액이 될 때까지 충분한 시간 동안 용해시켰다. 졸-젤 전이 온도는 기울인 tube에서 30초간 관찰하였을 때 흐르지 않는 온도를 기준으로 정하였다.
HGC 코팅 배양접시 제조. 치환율이 다른 HGC의 코팅 안정성을 비교하기 위해 고분자 샘플들을 3차 증류수에 농도 0.1 wt%로 녹여 고분자 코팅 수용액을 제조하였다. 고분자 수용액 750 μL을 35 mm petri dish(SPL Life Sciences Co., Ltd., 대한민국)에 분주하고 고르게 퍼뜨리고, 30분 동안 상온에서 방치한 후 과량의 용액을 제거하여 60 ℃ 오븐에서 48시간 동안 건조하였다.
코팅 표면분석. 각각의 고분자로 코팅된 표면과 단면 분석은 field emission scanning electron microscopy(FE-SEM; S-4800; HITACHI, 일본)을 통해 10 kV에서 실행되었다. HGC로 코팅된 3차원 세포배양접시를 액체질소를 이용해 냉각시킨 후 물리적 힘을 가하여 조각으로 쪼개어진 샘플들의 표면과 파단면을 관찰하였다. 샘플을 홀더에 고정시킨 후, 플라즈마 스퍼터를 이용해 아르곤 가스 하에서 60초 동안 백금 코팅을 하고 SEM 분석을 수행하였다. 이때, 대조군으로 코팅되지 않은 petri dish가 사용되었다. 코팅된 세포배양접시의 표면 친수성을 측정하기 위해 water contact angle(Theta Lite 101; Biolin Scientific, 스웨덴)기기를 사용하였으며 static sessile drop 방법으로 분석하였다.
코팅 안정성 평가. 시간에 따른 하이드로젤 코팅 배양접시의 안정성을 평가하기 위해 HGC로 코팅된 배양접시를 37 ℃ 3차 증류수에 1일, 3일 및 7일 동안 담가 놓았다. 증류수에 담가 놓은 코팅 접시를 60 ℃ 오븐에서 24시간 건조한 후 접촉각 분석을 통해 시간에 따른 표면 친수성의 변화를 측정하여 치환율이 다른 고분자의 코팅안정성을 비교하였다.
메쉬-패턴 배양접시 제조. 다양한 크기의 스페로이드를 배양할 수 있는 3차원 배양접시 제조를 위해 격자 무늬를 갖는 다양한 규격의 SEFAR® PET 1500 메쉬 제품들(24/60-120 PW(60 mesh), 32/83-100 PW(80 mesh), 40/103-80 PW(100 mesh). 48/123-70 PW(120 mesh), 61/156-64 PW(150 mesh))을 Sefar사(스위스)에서 구입하여 Scheme 2에서와 같이 petri dish 바닥에 polystyrene으로 제작된 링 구조물을 이용하여 물리적으로 고정 후, 코팅공정을 통해 메쉬-패턴 배양접시를 제작하였다. 각각의 메쉬의 격자 크기(well size), 두께(thickness), 접시당 격자 수(well number)를 광학 현미경(ECLIPSE Ci-POL; Nikon, 일본)을 통해 관찰하였다. 메쉬-패턴 배양접시를 활용하여 HGC 고분자 수용액(0.1 wt%)을 코팅하여 다양하고 균일한 크기의 스페로이드 형성 메쉬-패턴 배양접시를 제조하였다.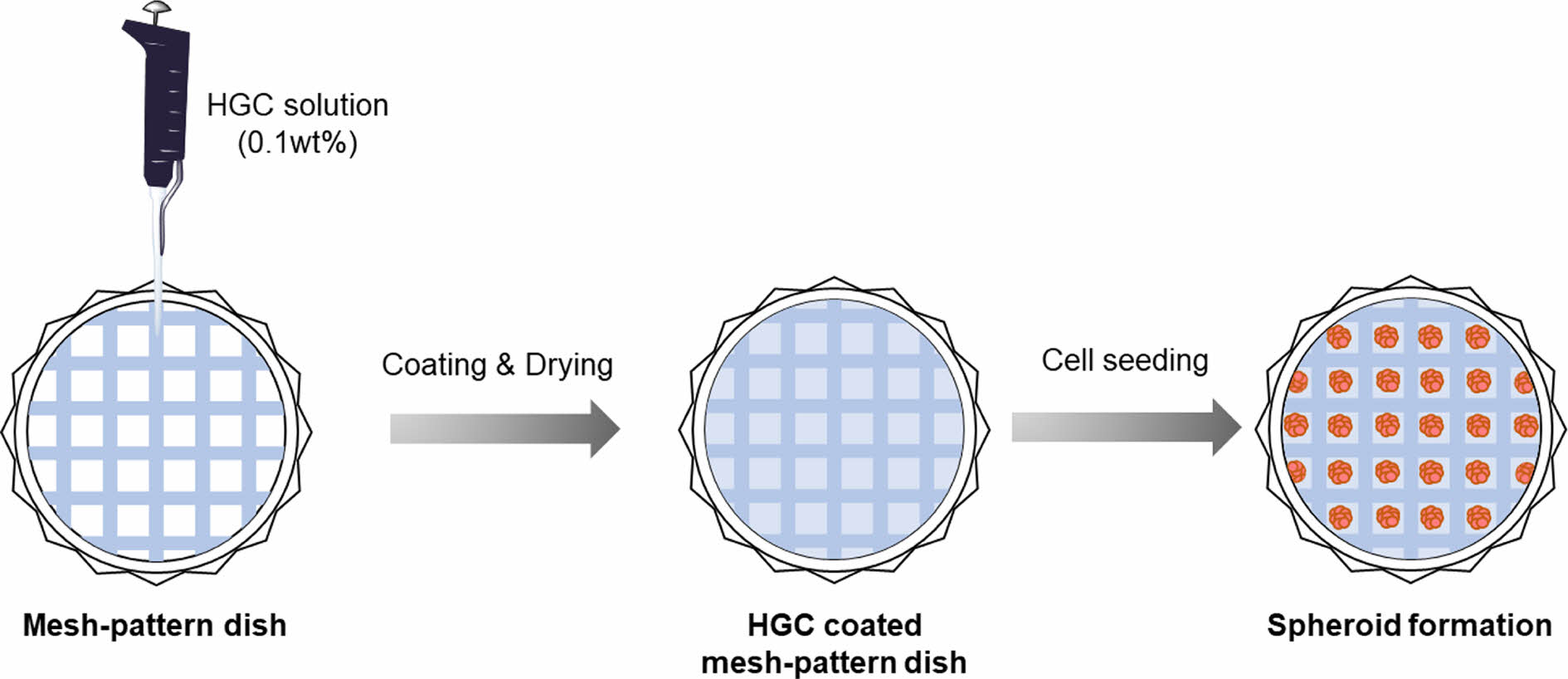
Scheme 2. Preparation of HGC coated mesh-pattern dish for spheroid formation and 3D cell culture application of HGC coated mesh-pattern
dish.
3차원 세포 스페로이드 배양. 제조된 HGC 코팅 배양접시(non-pattern dish)의 스페로이드 형성능을 관찰하기 위해 human dermal fibroblast(HDF) 세포(Cat#: CCD-986sk; 한국세포주은행, 대한민국)를 1×104 cells/cm2의 밀도로 접종하고, 37 ℃, 5% CO2 환경에서 15일 동안 배양했다. 2-3일에 한번씩 모든 배양접시의 세포를 수거하여 800 rpm에서 2분 동안 원심 분리하고, 상층액을 제거한 후 새로운 배지를 첨가했다. 메쉬-패턴 배양접시의 경우에는 HeLa 세포를 1×106 cells/dish의 밀도로 접종하고, 37 ℃, 5% CO2 환경에서 7일 동안 배양했다. 2일에 한번씩 메쉬-패턴 배양접시에서 1 mL 배지를 제거하고, 새로운 배지 1 mL를 첨가하여 배지교환을 했다. 스페로이드의 형태는 시간별로 광학 현미경(DMi8; Leica, 독일)을 통해 관찰되었다. 스페로이드의 분포도 및 스페로이드 형성 세포의 평균 직경과 크기분포도를 측정하기 위해 각 3차원 배양접시의 스페로이드를 촬영하고, Leica Application Suite X program(Leica, 독일) 프로그램을 사용하여 분석했다.
통계 분석. 정확한 통계적 차이를 확인하기 위해 OriginPro 8.1(OriginLab Corp, MA, 미국) 프로그램을 사용하여 통계 분석하였다. 접촉각 값의 평균과 표준편차를 통해 일원 분산 분석(one-way ANOVA)을 사용하여 데이터 분석하였다. 샘플 간 데이터 값 차이는 p<0.05(*), p<0.01(**), p<0.001(***)에서 통계적으로 유의미한 값을 가지는 것으로 보았다.
HGC의 합성 분석. GC와hexanoic anhydride의 다양한 반응몰비를 적용하여 치환율이 서로 다른 소수성 헥사노일 그룹을 갖는 HGC(HGC30, HGC36, HGC41)를 합성하였다(Table 1). N-헥사노일화 반응의 결과를 Figure 1(a)에서와 같이 1H NMR 분석에 의해 확인하였다. GC의 글루코피라노실 고리의 수소(H-2~H-8)에 상응하는 특성 피크가 3.2-4.0 ppm에서 나타났다. 또한, 도입된 헥사노일 그룹(-CH3, -CH2-CH2-CH3, -CO-CH2-CH2- 및 -CO-CH2-)에 해당하는 특성 피크들이 0.8, 1.3, 1.6 및 2.3 ppm에서 각각 관찰되었다.30 글루코피라노실 고리의 양성자의 통합된 수소 피크와 헥사노일 그룹의 통합된 수소 피크를 상대적으로 비교함으로써 HGC의 헥사노일기 치환율(DH)이 각각 30, 36, 41%인 HGC가 합성된 것을 확인하였다. GC와 합성된 HGC 고분자의 ATR-FTIR 분석 결과를 Figure 1(b)에서 비교하였다. 3300 cm-1에 넓은 띠는 -OH 기의 신축 진동 피크가 나타나고 같은 영역에서 N-H의 신축 진동 피크가 겹쳐 나타났다. 2890 cm-1에 흡수 피크는 HGC의 메틸기(-CH3)와 메틸렌(-CH2-)의 C-H 신축진동과 연관되어 나타난다. 1655 cm-1과 1555 cm-1에서 흡수 띠의 외형은 각각 HGC의 카보닐 신축진동과 아미노 아세틸기의 아마이드 II 굽힘 진동에 대응하였다.30
온도감응성 특성평가. 기존연구에서 HGC는 치환율이 36% 일 때, 효과적인 온도감응성 졸-젤 전이현상을 보였고, 이러한 온도감응성은 3차원 배양을 위한 코팅소재로서의 안정성과 관련됨을 보고하였다.28 HGC의 온도감응성은 농도에 따라 조절가능하였고, 3~5 wt%의 농도범위에서 42~27 ℃ 사이에서 졸-젤 전이가 관찰되었다. 본 연구에서는 3차원 배양 코팅소재로서의 HGC의 구조최적화를 위해 다양한 소수성 그룹의 치환율을 갖는 HGC를 합성하여 기존 연구와 유사한 농도 조건에서 온도감응성 졸-젤 전이 거동 변화를 관찰하였다. HGC30, HGC36 및 HGC41의 DPBS 용액(pH 7.4, 0.01 M)은 온도가 증가함에 따라 유동성을 갖는 투명한 액체 상태의 졸에서 유동성이 없는 투명한 고체 상태의 젤의 상전이를 나타내었다. 치환율이 가장 낮은 HGC30의 경우, 졸-젤 온도는 Table 1에 나타난 것과 같이 4 wt%에서 65 ± 1 ℃로 나왔고, 3 wt%에서는 졸 상태만 관찰되었다. 이는 소수성 치환기의 함량이 낮아 온도감응성 젤화에 필요한 소수성 상호작용이 약하게 작용하기 때문일 것으로 사료된다. 한편, HGC36은 3 wt%에서 42 ± 1 ℃, 4 wt%에서 31 ± 1 ℃로 관찰되었다. 치환율이 가장 높은 HGC41은 3 wt%에서 11 ± 1 ℃로 관찰되었고, 4 wt%이상에서는 젤 상태만 관찰되었다. 이러한 결과는 치환율이 높을수록 소수성 헥사노일 그룹의 함량이 높고, 그로 인해 고분자 사슬 간 소수성 상호작용이 증가하기 때문에 온도감응성 젤화가 더 낮은 온도 또는 농도 조건에서 일어나는 것으로 사료된다. 결과적으로 HGC의 온도감응성은 고분자의 농도 및 치환율에 크게 의존함을 알 수 있었다. HGC의 온도감응성은 수성 환경하에서의 코팅 공정 및 코팅 후 안정성에 영향을 줄 수 있으므로, 고분자의 치환율과 함께 중요하게 고려되어져야 한다.
HGC 코팅 배양접시 표면 분석. Figure 2(a)에서와 같이 치환율이 서로 다른 HGC 고분자 수용액을 이용하여 HGC 코팅 배양접시를 제조하고 관찰하였다. Figure 2(b)에서 보이듯이 모든 HGC 코팅 배양접시는 코팅처리를 하지 않은 petri dish나 GC로 코팅된 접시와 마찬가지로 깨끗하고 투명하게 관찰되는 것을 알 수 있었다. 이러한 투명한 특성은 배양되는 세포를 직접적으로 관찰하는데 매우 유용한 특성으로 활용될 수 있다. 코팅 배양접시의 표면과 단면을 SEM 분석을 통해 관찰하였다(Figure 2(c)). HGC 코팅 배양접시는 모든 그룹에서 균일하게 코팅된 표면을 관찰할 수 있었고, petri dish와 비교하여 표면상에서의 특이한 차이는 관찰되지 않았지만, 단면 관찰에서는 GC에서는 관찰되지 않았던 HGC30, HGC36 및 HGC41 코팅층이 각각 약 0.45, 0.26, 0.25 μm의 두께로 존재함을 확인할 수 있었다.
수성 환경하에서 치환율에 따른 코팅 배양접시의 코팅 안정성을 평가하기 위해 각각의 코팅 배양접시를 7일 동안 증류수에 담그고 시간에 따른 표면 접촉각의 변화를 관찰하였다. Figure 3(a)에서와 같이 초기 접촉각은 코팅되지 않은 petri dish가 88.04 ± 0.42o, GC 코팅 배양접시가 53.64 ± 1.61o, HGC30, HGC36, HGC41 코팅 배양접시의 경우는 각각 57.60 ± 0.70o, 65.88 ± 0.50o, 71.90 ± 2.33o로 관찰되었다. Petri dish보다 친수성 고분자인 GC와 HGC로 코팅된 배양접시가 더 낮은 접촉각을 보였다. HGC 코팅 접시의 경우 소수성 치환기의 함량이 높을수록 소수성이 상대적으로 높으므로, HGC30의 접촉각이 가장 낮고, 소수성 치환기의 함량이 제일 높은 HGC41의 경우가 가장 높은 접촉각을 보이는 것으로 사료된다. 한편, 수성 환경에 노출되는 시간이 길어짐에 따라 GC와 HGC30으로 코팅된 접시의 경우 접촉각이 의미있게 높아지는 것을 관찰할 수 있었는데, 이는 상대적으로 친수성이 높은 고분자의 경우 시간에 따라 표면 코팅층의 용해가 서서히 진행되면서 나타나는 결과라고 사료된다. 반대로 소수성이 높은 HGC36과 HGC41의 경우에는 시간이 지나도 접촉각 값의 유의미한 차이가 없는 것을 보아 HGC36과 HGC41 접시의 코팅 안정성이 우수하다는 것을 확인할 수 있다(Figure 3(b)).
3차원 스페로이드 형성평가. 헥사노일 그룹의 치환율이 HGC의 3차원 스페로이드 배양에 미치는 영향을 평가하기 위해 다양한 치환율을 갖는 HGC 코팅 배양접시에 HDF 세포를 15일간 배양하였다. 대조군으로서 Corning사의 60 mm ULA 배양접시와 코팅되지 않은 petri dish, GC 코팅 배양접시를 사용하였다. Corning사의 배양접시와 HGC가 코팅된 배양접시에서는 세포 접종 1일 후부터 세포가 뭉쳐서 효과적으로 스페로이드를 형성하기 시작하였고, 배양 3일째에는 거의 모든 세포가 스페로이드를 형성하였다(Figure 4(a)). 반면에 petri dish와 GC가 코팅된 배양접시에는 아직도 세포끼리 뭉치지 못하고 단일 세포로 상당 부분 남아있는 것을 관찰할 수 있었다. 결과적으로 HGC 코팅 배양접시는 Corning사의 배양접시와 함께 petri dish나 GC 코팅 배양접시 보다 우수한 ULA 특성을 보이는 것으로 나타났다. 배양 15일차까지도 HGC 코팅 배양접시와 Corning사 배양접시에서는 바닥면에 부착된 세포가 여전히 관찰되지 않고, 여전히 ULA 특성을 잘 유지하고 있었다. 한편, petri dish에서는 배양기간 동안 바닥에 부착된 단일 세포 또는 스페로이드가 관찰되었고, GC 코팅 세포에서는 시간이 지나도 효과적인 스페로이드 형성이 관찰되지 않았다.
스페로이드 평균 직경의 관찰에서도 HGC의 ULA 특성이 우수하다는 것을 확인할 수 있었다. 세포 접종 1일 후에 HGC36과 HGC41 코팅 배양접시에서 가장 큰 평균 직경을 보였고, HGC30과 Corning사 배양접시는 이 수준에 다다르는데 추가적으로 2일의 배양기간이 더 소요되었다. Petri dish와 GC 코팅 배양접시의 경우에는 15일 배양기간 내내 HGC36과 HGC41 코팅 배양접시에서 배양된 수준의 직경을 갖는 스페로이드는 형성되지 않았다. 이는 HGC36과 HGC41이 가장 높은 세포비부착능을 갖고 있으며, 이로 인해 3차원 스페로이드 배양에도 효과적인 것을 확인할 수 있었다(Figure 4(b)). 배양시간에 따른 스페로이드 크기의 변화를 보다 자세히 관찰한 결과에서도 HGC36과 HGC41에서 빠른 스페로이드 형성을 확인할 수 있었다. 다만, 모든 그룹에서 배양기간이 길어짐에 따라 스페로이드 간의 뭉침 현상으로 인해 스페로이드의 크기 변화가 커진 것을 확인할 수 있었다(Figure 4(c)). 재현성을 높이고, 안정적으로 균일한 크기의 스페로이드를 생산 및 배양하기 위해서는 별도의 추가 제어기술이 필요한 부분이라 사료된다.
메쉬-패턴 배양접시의 3차원 스페로이드 형성평가. 본 연구에서는 스페로이드의 균일한 크기 형성 및 스페로이드 간의 뭉침 현상을 제어하기 위해 다양한 규격의 격자 무늬를 갖는 메쉬를 활용하여 메쉬-패턴 배양접시를 제조하고 그 유효성을 평가하였다. 메쉬는 60, 80, 100, 120, 150 메쉬로 5가지 종류를 준비하였고, 격자의 무늬, 크기, 두께, 배양접시당 격자 수를 광학현미경 분석을 통해 관찰하였다(Figure 5). 우선 격자 크기가 209 μm인 80 메쉬를 세포 배양접시에 고정하고, 메쉬-패턴 상에서 3차원 스페로이드 형성을 위한 HGC 코팅의 유효성을 평가하였다. 비교군으로서의 GC와 치환율이 다른 HGC30, HGC36, HGC41을 각각 코팅하였고, HeLa세포를 접종하여 스페로이드 형성을 관찰하였다. 이전 실험에서 보인 결과와 유사하게 petri dish와 GC가 코팅된 배양에서는 세포가 바닥에 붙거나 스페로이드가 형성되지 않고 단일 세포로 남아 있는 것을 관찰할 수 있었다(Figure 6). 반면에, HGC가 코팅된 모든 그룹에서는 격자 하나에 하나의 스페로이드가 형성되었고, 대부분의 세포가 단일 세포로 남아있지 않고 스페로이드를 형성한 것을 확인할 수 있었다. 따라서, HGC의 ULA 특성은 메쉬-패턴의 도입과 관계없이 잘 유지되는 것으로 확인되었다.
다양한 사이즈의 세포 스페로이드를 균일하게 형성할 수 있는 제어능을 평가하기 위해 서로 다른 격자 크기를 갖는 배양접시를 제조한 후, 세포배양을 통해 격자의 종류에 따른 스페로이드 형성률을 평가하였다(Figure 7(a)). HGC30의 경우 낮은 코팅 안정성으로 본 실험에서 배제하였고, HGC41과 유사한 코팅 안정성과 스페로이드 형성능을 보이는 HGC36을 코팅소재로 적용하였다. 예상했던 것과 같이, 모든 그룹에서 세포 접종 1일 이내에 스페로이드를 효과적으로 형성하였다. 스페로이드 크기 또한 격자의 크기가 클수록 큰 크기의 직경을 갖는 스페로이드가 형성되었다(Figure 7(b)). 격자의 크기가 294 μm(60 mesh)의 경우에는 다소 표준편차가 큰 스페로이드가 형성되었고, 209 μm(80 mesh)보다 작은 격자 크기에서는 표준편차의 변화는 크지 않았다(Figure 7(c)). 배양시간에 따른 스페로이드 크기 변화를 관찰하였을 때, 격자 크기가 큰 그룹에서는 시간이 지남에 따라 스페로이드 직경도 커지는 것을 확인할 수 있다(Figure 7(d)). 이것은 스페로이드를 구성하는 HeLa 세포가 증식해서 커진 것으로 추측할 수 있다. 반면 격자가 작은 그룹에서는 스페로이드 크기가 커지지 않았는데, 이는 격자가 너무 작아서 더 이상 커질 수 있는 공간을 충분히 확보하지 못했기 때문일 것으로 사료된다. 결론적으로 격자무늬를 갖는 메쉬-패턴은 균일한 크기를 갖는 스페로이드 형성과 형성되는 스페로이드의 크기 제어에 매우 효과적이었다.

|
Figure 1 (a) 1 H NMR; (b) ATR-FTIR spectra of GC, HGC30, HGC36, and HGC41. |

|
Figure 2 (a) Preparation procedure; (b) optical images; (c) SEM images of uncoated and coated dishes. |

|
Figure 3 Contact angle measurement graph of uncoated and coated dishes: (a) water contact angles graph; (b) water contact angle images. |

|
Figure 4 Human dermal fibroblast (HDF) cells cultured on uncoated petri dish and, corning, GC, HGC30, HGC36, and HGC41 coated dishes for 15 days: (a) optical microscopic images of spheroid (scale bars indicate 500 µm); (b) average diameter by date; (c) distribution of diameter of spheroid. |

|
Figure 5 Microscopic analysis of mesh-pattern dishes |

|
Figure 6 Optical images of HeLa cells cultured petri dish and coated mesh-pattern dishes (80 mesh dishes). Scale bars indicate 250 µm |

|
Figure 7 HeLa cells cultured on HGC36 coated on 60, 80, 100, 120, and 150 mesh-pattern dishes for 7 days: (a) optical microscopic images of spheroid; (b) average diameter by date (scale bars indicate 500 µm); (c) average of {(S.D./average diameter)×100}; (d) distribution of diameter of spheroid. |
|
Table 1 Synthesis Results of HGC and Sol-Gel Transition Temperature |

aFeed molar ratio of hexanoic anhydride to glucosamine residue; bDegree of hexanoylation determined by the integration of 1H NMR; cDetermined by tube tilting method (conc.=3 wt% in DPBS); dDetermined by tube tilting method (conc.=4 wt% in DPBS) |
본 연구에서는 ULA 특성을 갖는 헥사노일 글리콜 키토산(HGC) 소재의 구조 및 코팅 공정의 최적화를 통해 효과적인 3차원 세포배양접시를 제조하고 평가하였다. 글리콜 키토산의 N-헥사노일화를 통해 치환율이 다양한 HGC 고분자를 합성하였으며 치환율이 36% 이상인 HGC 고분자가 ULA 코팅소재로 높은 코팅 안정성과 스페로이드 형성능을 보임을 확인하였다. 또한, HGC 코팅기술에 더하여 다양한 규격의 메쉬-패턴화 기술을 도입함으로써 균일하면서도 크기가 제어된 3차원 스페로이드를 효과적으로 배양할 수 있었다. 세포의 증식 속도는 스페로이드를 형성하는데 중요한 요소 중 하나이다. 본 연구에서는 일반적으로 세포의 증식속도가 느린 normal cell line(HDF)와 증식속도가 상대적으로 빠른 cancer cell line (HeLa)에서 스페로이드 형성 검증을 통해 세포 증식 속도에 상관없이 효과적인 스페로이드 형성이 가능함을 보여주었다. 따라서, HGC 기반 3차원 세포배양접시는 메쉬-패턴의 다양한 설계 요소와 함께 조직재생, 약물 스크리닝, 독성평가 모델 등 다양한 분야에서 요구하는 맞춤형 스페로이드를 단시간 안에 대량으로 형성할 수 있는 매우 유용한 방법으로 기대될 수 있다.
- 1. Baker, B. M.; Chen, C. S. Deconstructing the Third Dimension-how 3D Culture Microenvironments Alter Cellular Cues. J. Cell Sci. 2012, 125, 3015-3024.
-

- 2. Knight, E.; Przyborski, S. Advances in 3D Cell Culture Technologies Enabling Tissue-like Structures to be Created In Vitro. J. Anat. 2015, 227, 746-756.
-

- 3. Wang, A.; Madden, L. A.; Paunov, V. N. Advanced Biomedical Applications based on Emerging 3D Cell Culturing Platforms. J. Mat. Chem. B 2020, 8, 10487-10501.
-

- 4. Jensen, C.; Teng, Y. Is It Time to Start Transitioning From 2D to 3D Cell Culture? Front. Mol. Biosci. 2020, 7, 1-15.
-

- 5. Priwitaningrum, D. L.; Blonde, J. G.; Sridhar, A.; van Baarlen, J.; Hennink, W. E.; Storm, G.; Le Gac, S.; Prakash, J. Tumor Stroma-containing 3D Spheroid Arrays: A Tool to Study Nanoparticle Penetration. J. Control. Release 2016, 244, 257-268.
-

- 6. Ivascu, A.; Kubbies, M. Diversity of Cell-mediated Adhesions in Breast Cancer Spheroids. Int. J. Oncol. 2007, 31, 1403-1413.
-

- 7. Weiswald, L.-B.; Guinebretière, J.-M.; Richon, S.; Bellet, D.; Saubaméa, B.; Dangles-Marie, V. In Situ Protein Expression in Tumour Spheres: Development of an Immunostaining Protocol for Confocal Microscopy. BMC Cancer 2010, 10, 106.
-

- 8. Ishiguro, T.; Ohata, H.; Sato, A.; Yamawaki, K.; Enomoto, T.; Okamoto, K. Tumor-derived Spheroids: Relevance to Cancer Stem Cells and Clinical Applications. Cancer Sci. 2017, 108, 283-289.
-

- 9. Jun, Y.; Kang, A. R.; Lee, J. S.; Jeong, G. S.; Ju, J.; Lee, D. Y.; Lee, S. H. 3D Co-culturing Model of Primary Pancreatic Islets and Hepatocytes in Hybrid Spheroid to Overcome Pancreatic Cell Shortage. Biomaterials 2013, 34, 3784-3794.
-

- 10. Wang, W.; Itaka, K.; Ohba, S.; Nishiyama, N.; Chung, U. I.; Yamasaki, Y.; Kataoka, K. 3D Spheroid Culture System on Micropatterned Substrates for Improved Differentiation Efficiency of Multipotent Mesenchymal Stem Cells. Biomaterials 2009, 30, 2705-2715.
-

- 11. Lin, R. Z.; Chang, H. Y. Recent Advances in Three-dimensional Multicellular Spheroid Culture for Biomedical Research. Biotechnol. J. 2008, 3, 1172-1184.
-

- 12. Malhao, F.; Macedo, A. C.; Ramos, A. A.; Rocha, E. Morphometrical, Morphological, and Immunocytochemical Characterization of a Tool for Cytotoxicity Research: 3D Cultures of Breast Cell Lines Grown in Ultra-Low Attachment Plates. Toxics 2022, 10, 415.
-

- 13. Imamura, Y.; Mukohara, T.; Shimono, Y.; Funakoshi, Y.; Chayahara, N.; Toyoda, M.; Kiyota, N.; Takao, S.; Kono, S.; Nakatsura, T.; Minami, H. Comparison of 2D- and 3D-culture Models as Drug-testing Platforms in Breast Cancer. Oncol. Rep. 2015, 33, 1837-1843.
-

- 14. Zhao, Z.; Gu, J.; Zhao, Y.; Guan, Y.; Zhu, X. X.; Zhang, Y. Hydrogel Thin Film with Swelling-induced Wrinkling Patterns for High-throughput Generation of Multicellular Spheroids. Biomacromolecules 2014, 15, 3306-3312.
-

- 15. Song, H. H.; Park, K. M.; Gerecht, S. Hydrogels to Model 3D In Vitro Microenvironment of Tumor Vascularization. Adv. Drug Deliv. Rev. 2014, 79, 19-29.
-

- 16. Li, Q.; Chen, C.; Kapadia, A.; Zhou, Q.; Harper, M. K.; Schaack, J.; LaBarbera, D. V. 3D Models of Epithelial-mesenchymal Transition in Breast Cancer Metastasis: High-throughput Screening Assay Development, Validation, and Pilot Screen. J. Biomol. Screen 2011, 16, 141-154.
-

- 17. Yu, H.; Chong, Z. Z.; Tor, S. B.; Liu, E.; Loh, N. H. Low Temperature and Deformation-free Bonding of PMMA Microfluidic Devices with Stable Hydrophilicity via Oxygen Plasma Treatment and PVA Coating. RSC Adv. 2015, 5, 8377-8388.
-

- 18. Gao, W.; Wu, D.; Wang, Y.; Wang, Z.; Zou, C.; Dai, Y.; Ng, C. F.; Teoh, J. Y.; Chan, F. L. Development of a Novel and Economical Agar-based Non-adherent Three-dimensional Culture Method for Enrichment of Cancer Stem-like Cells. Stem Cell Res. Ther. 2018, 9, 243.
-

- 19. Liu, B. H.; Yeh, H. Y.; Lin, Y. C.; Wang, M. H.; Chen, D. C.; Lee, B. H.; Hsu, S. H. Spheroid Formation and Enhanced Cardiomyogenic Potential of Adipose-derived Stem Cells Grown on Chitosan. Biores. Open Access 2013, 2, 28-39.
-

- 20. Bernkop-Schnurch, A.; Dunnhaupt, S. Chitosan-based Drug Delivery Systems. Eur. J. Pharm. Biopharm. 2012, 81, 463-469.
- 21. Ragetly, G.; Griffon, D. J.; Chung, Y. S. The Effect of Type II Collagen Coating of Chitosan Fibrous Scaffolds on Mesenchymal Stem Cell Adhesion and Chondrogenesis. Acta Biomater. 2010, 6, 3988-3997.
-

- 22. Huang, G. S.; Dai, L. G.; Yen, B. L.; Hsu, S. H. Spheroid Formation of Mesenchymal Stem Cells on Chitosan and Chitosan-hyaluronan Membranes. Biomaterials 2011, 32, 6929-6945.
-

- 23. Cheng, N. C.; Wang, S.; Young, T. H. The Influence of Spheroid Formation of Human Adipose-derived Stem Cells on Chitosan Films on Stemness and Differentiation Capabilities. Biomaterials 2012, 33, 1748-1758.
-

- 24. Mathews, S.; Gupta, P. K.; Bhonde, R.; Totey, S. Chitosan Enhances Mineralization During Osteoblast Differentiation of Human Bone Marrow-derived Mesenchymal Stem Cells, by Upregulating the Associated Genes. Cell Prolif. 2011, 44, 537-549.
-

- 25. Rodrigues, S.; Dionisio, M.; Lopez, C. R.; Grenha, A. Biocompatibility of Chitosan Carriers with Application in Drug Delivery. J. Func. Biomater. 2012, 3, 615-641.
-

- 26. Khan, M. M.; Madni, A.; Filipczak, N.; Pan, J.; Rehman, M.; Rai, N.; Attia, S. A.; Torchilin, V. P. Folate Targeted Lipid Chitosan Hybrid Nanoparticles for Enhanced Anti-tumor Efficacy. Nanomed.-Nanotechnol. Biol. Med. 2020, 28, 102228.
-

- 27. Li, Z.; Cho, S.; Kwon, I. C.; Janat-Amsbury, M. M.; Huh, K. M. Preparation and Characterization of Glycol Chitin as a New Thermogelling Polymer for Biomedical Applications. Carbohydr. Polym. 2013, 92, 2267-2275.
-

- 28. Cho, M. O.; Li, Z.; Shim, H.-E.; Cho, I.-S.; Nurunnabi, M.; Park, H.; Lee, K. Y.; Moon, S.-H.; Kim, K.- S.; Kang, S.-W.; Huh, K. M. Bioinspired Tuning of Glycol Chitosan for 3D Cell Culture. NPG Asia Mater. 2016, 8, e309.
-

- 29. Jang, B. S.; Park, K. H.; Suh, E. Y.; Lee, B. S.; Kang, S.-W.; Huh, K. M. Non-cell Adhesive Hexanoyl Glycol Chitosan Hydrogels for Stable and Efficient Formation of 3D Cell Spheroids with Tunable Size and Density. Int. J. Biol. Macromol. 2021, 187, 955-963.
-

- 30. Cho, I.-S.; Cho, M. O.; Li, Z.; Nurunnabi, M.; Park, S. Y.; Kang, S.-W.; Huh, K. M. Synthesis and Characterization of a New Photo-crosslinkable Glycol Chitosan Thermogel for Biomedical Applications. Carbohydr. Polym. 2016, 144, 59-67.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(3): 369-378
Published online May 25, 2023
- 10.7317/pk.2023.47.3.369
- Received on Feb 8, 2023
- Revised on Apr 4, 2023
- Accepted on Apr 6, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sun-Woong Kang*, **, and Kang Moo Huh†
-
Department of Polymer Science and Engineering, Chungnam National University, Daejeon 34134, Korea
*Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
**Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea - E-mail: swkang@kitox.re.kr, khuh@cnu.ac.kr
- ORCID:
0000-0001-8862-2151, 0000-0002-2406-6659









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.