- Characterization of Bioreducible and Cathepsin B Responsive PAMAM Dendrimer Derivative for Gene Delivery System
Department of Biochemistry, Chungnam National University, 99 Daehak-ro, Daejeon 34134, Korea
- 생체환원성 및 카텝신 효소 감응성 PAMAM 덴드리머 유도체의 유전자 전달체 특성 연구
충남대학교 자연과학대학 생화학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Gene delivery technology is one of the useful methods for treating diseases and can be used to deliver therapeutic genes specifically to target sites to treat genetic diseases. Nanoparticles composed of lipids and macromolecules, which are used as gene delivery vehicles, can be composed of various compounds according to the application, and have the advantage that their physical and chemical properties can be engineered according to the tissue environment. Polyamidoamine (PAMAM) dendrimer is a representative gene delivery polymeric carrier. It consists of a dendritic chemical structure with multivalent peripheral primary amine groups that can be conjugated with various functional moieties such as drugs, targeting compounds, peptides, and fluorescence probes. In this study, we synthesized a cystamine core PAMAM dendrimer derivative by conjugating with Arg-His dipeptide (R-H) via an enzyme cleavable peptide sequence (Gly-Phe-Leu-Gly, GFLG), and evaluated its characteristics as a polymeric gene carrier. The cystamine core PAMAM dendrimer generation 3 (cPAMAM G3) was responsive to intracellular bioreducing condition. The multivalent RHGFLG peptides were introduced on the surface of cPAMAM to enhance its intracellular entry and enzyme-sensitive degradation inside cells. R-H-GFLG-cG3 PAMAM showed high transfection efficiency and low cytotoxicity in HepG2 and SW480 cells. The results show that R-H-GFLG-cG3 holds a potential to be used as a gene delivery carrier for specific cancer cells.
유전자 전달 기술은 유용한 질병 치료 방법 중 하나이며, 질병의 유전적 돌연변이 치료를 위해 표적 부위에 특이적으로 전달할 수 있다. 유전자 전달체로 사용되는 리포좀, 고분자 등의 나노입자는 용도에 따라 다양한 화합물로 구성이 가능하며, 전달하고자 하는 물질에 따라 물리·화학적 물성을 변형할 수 있다는 장점을 갖고 있다. Polyamidoamine(PAMAM)은 대표적인 유전자 전달체 고분자로써 표면의 2차 아민기와 덴드리머(dendrimer) 구조로 구성되어 약물, 표적화 부분, 기능성 펩타이드, 형광 프로브 등 다양한 기능적 부분을 접합할 수 있다. 본 연구에서는 효소 민감성 서열(Gly-Phe-Leu-Gly, GFLG)을 포함하는 시스타민 코어 PAMAM 덴드리머를 기반으로 하는 유전자 전달 시스템의 유전자 전달 효율에 대해 연구하였다. PAMAM 3세대(cPAMAM G3)의 시스타민 코어는 세포 내 글루타티온(GSH)에 반응하며, 이는 이황화 결합의 환원에 의해 분해된다. 그리고 cPAMAM G3의 표면에는 GFLG 펩타이드 서열이 접합되어 있는데, GFLG 서열은 카텝신 B에 의한 효소반응 서열로 암에서 과발현되는 카텝신 B로 인해 암 특이적 표적이 될 수 있다. 본 연구에서 R-H-GFLG-cG3 PAMAM은 HepG2 및 SW480 세포에서 높은 유전자 발현 효율과 낮은 세포독성을 나타냈으며, 이는 R-H-GFLG-cG3가 특정 암세포에 대한 유전자 전달체로서 잠재력이 있음을 보여준다.
In this study, we synthesized a cystamine core polyamidoamine dendrimer derivative by conjugating with Arg-His dipeptide (R-H) via an enzyme cleavable peptide sequence (Gly-Phe-Leu-Gly, GFLG), and evaluated its characteristics as a polymeric gene carrier.
Keywords: polyamidoamine, dendrimer, Cathepsin B, disulfide bond, Gly-Phe-Leu-Gly, gene carrier.
본 연구는 2020년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(NRF-2020R1I1A3070280).
저자들은 이해상충이 없음을 선언합니다.
2019년 코로나 19가 발병하여 전세계적으로 확산되었으며, 이를 예방하는 mRNA를 기반으로 하는 백신이 개발되었다. 코로나19 백신 개발사인 화이자와 모더나의 백신은 지질 나노입자(lipid nanoparticle)를 기반으로 바이러스의 항원 단백질을 합성하는 유전 정보를 전달하는 백신 기술로서 코로나19의 확산을 방지할 수 있었다.1
이러한 코로나 19 백신에서 사용된 지질나노입자는 유전자 전달체로써 불안정하고 분해되기 쉬운 mRNA를 인체 내로 안전하게 전달하는 역할을 하였다. 이는 유전자전달법(gene delivery)으로 질병의 원인이 되는 유전자에 대한 치료 유전자를 전달함으로써 교정 또는 제거하여 치료하는 방법이다.2 치료용 핵산은 miRNA, siRNA, mRNA, 올리고뉴클레오티드 및 plasmid DNA 등 다양한 형태로 연구되었으며, 질병의 치료 또는 예방 목적에 따라 다양하게 설계가 가능하다.3,4 하지만, 자연상태의 핵산은 세포막과 RNase 또는 DNase와 같은 분해효소를 통과하여 핵으로 전달되기가 어렵기 때문에 치료 유전자를 원활히 세포 내로 유입하여 전달하기 위한 유전자 전달체가 연구되었으며, 양이온성 고분자(cationic polymer), 리포좀(liposome), 펩타이드(peptide), 무기나노입자(inorganic nanoparticle) 등 다양한 형태로 개발되고 연구되고 있다.5-7 이러한 전달체 입자들은 그 특징에 따라 핵산과 정전기적·소수성·수소결합 등의 상호작용에 의해 나노미터 크기의 복합체를형성할 수 있다. 이는 음이온성 세포막을 통과하고 세포 내 소화효소에서 핵산을 보호할 수 있다는 장점을 갖고 있으며, 최근에는 기능성 고분자와 양이온성, 함입성, 암세포 특이적인 펩타이드 서열을 이용한 기능화된 전달체의 효율이 보고되고 있다.8-10 예를 들어, 아르지닌(arginine), cell-penetrating peptide (CPP)와 같은 양이온성 펩타이드는 핵산의 세포 내 흡수율을 높였으며, 히스티딘(histidine)은 양성자 스폰지 효과로 핵산을 방출하여 전달율을 높이는 연구가 보고되었다.11-13 또한, Arg-Gly-Asp(RGD), nuclear localization sequence(NLS), hyaluronic acid(HA)는 특이적인 세포 인식 서열로써 전달체에 결합하였을 때 상대적으로 높은 유전자 발현을 나타냄을 확인하였다.14-17 이는 세포 환경에 맞게 기능화된 고분자가 안정적이고 안전한 유전자 전달을 가능하게 함을 알 수 있다.
본 연구에서 사용한 양이온성 고분자 폴리아미도 아민 (polyamidoamine, PAMAM) 덴드리머는 유전자 전달체 중 하나이며, 나뭇가지 모양 고분자(dendritic polymers) 형태로 가지 구조의 증가에 따른 여러 크기와 표면은 하이드록시기, 아민기, 카보닐기 등의 다양한 작용기를 갖는 파생물이 있으며 이는 구조적인 기능화가 용이하며, PEI25kD에 비해 낮은 세포 독성이 보고되었다.18 이전 연구에서는 4세대 PAMAM 덴드리머를 이용하여 표면에 효소 카텝신 B(Cathepsin B)에 의해 절단되는 Gly-Phe-Leu-Gly(GFLG) 펩타이드 서열의 접합하여 높은 유전자 발현율을 확인하였다.19,20 카텝신 B는 lysosomal protease로 자가포식작용(autophagy), 신경보호(neuroprotection) 등의 정상세포에서 중요한 역할을 하며, 암에서는 과발현되어 암의 진행 및 전이와 관련이 있음이 보고되어 암의 표적화가 가능한 효소로써 연구되고 있다.21,22
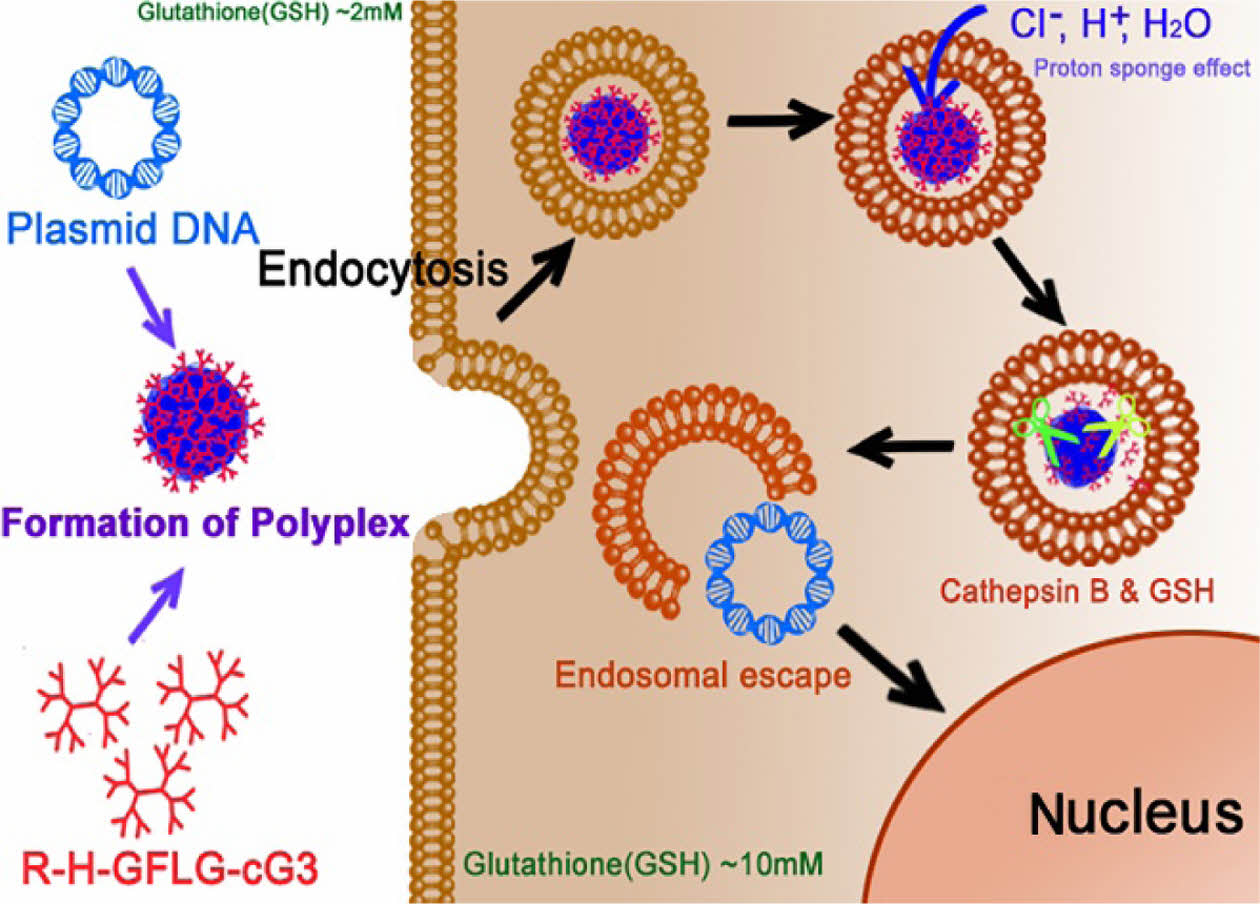
본 연구에서는 중심부에 디설파이드 결합(disulfide bond)을 갖는 3세대 cystamine core PAMAM 덴드리머 고분자의 아민기 말단에 다가의 아르기닌(Arg, R)-히스티딘(His, H) 및 글리신(Gly, G)-페닐알라닌(Phe, F)-류신(Leu, L)-글리신(Gly, G) 펩티드를 도입하여 신규 접합 고분자 R-H-GFLG-cG3를 합성하였다. 다가의 R-H 펩티드의 도입으로 접합 고분자의 세포 내 투과율과 완충능력(buffer capacity)의 증가로 엔도좀 탈출을 용이하게 하여 유전자 전달체로서의 효율을 높이고자 하였다(Figure 1). 또한, R-H-GFLG-cG3의 pDNA와의 나노복합체 형성 가능성을 확인하였다. 형성된 R-H-GFLG-cG3 복합체의 카뎁신 B와 글루타티온에 의한 분해를 in vitro에서 확인하였다. 또한, 카텝신 B 효소가 과발현된 세포주인 Hep G2, SW480에서 유전자 발현 효율과 세포 독성 및 내재화 효율을 분석하였다. 본 연구 결과들을 통해 R-H-GFLG-cG3의 기능성 펩타이드에 의한 향상된 유전자 전달 효율 및 신규 유전자 전달체로서의 가능성을 확인하였다.

|
Figure 1 Illustration of the transfection of R-H-GFLG-cG3 PAMAM dendrimer/plasmid DNA polyplexes. |
재료. Cystamine core generation 3 PAMAM(cG3 PAMAM)은 Andrews Chemservices(Berrien Springs, MI)에서 구매하였다. Fmoc-His(trt)-OH, Fmoc-Gly-OH, 2-(1H-benzotriazole-1-yl)-1,1,3,3-tetramethyluronium hexaafluorophosphate(HBTU)는 Novabiochem(Darmstadt, Germany)에서 구매하였다. Fmoc-Leu-OH, Fmoc-Phe-OH, Fmoc-Arg(pbf)-OH, 1-hydroxybenzotriazole hydrate(HOBt)는 Anaspec(Fremont, CA, USA)에서 구매하였다. Piperidine, triisopropylsilane(TIS), trifluoroacetic acid(TFA), cathepsin B(from human liver), ethidium bromide(EtBr), N,N-diisopropylethylamine(DIPEA), dimethylsulfoxide(DMSO), dimethylformamide(DMF), dithiothreitol(DTT)는 Sigma Aldrich (St. Louis, MO, USA)에서 구매하였다. Luciferase assay kit는 Promega(Madison, WI, USA)에서 구매하였다. BCA protein assay kit는 Thermo Fisher Scientific(Hudson, NH, USA)에서 구매하였다. Antibiotic-antimycotic(100×) solution, Dulbecco modified eagle medium(DMEM), Dulbecco phosphate-buffered saline(DPBS), trypsin-EDTA solution(0.25%), fetal bovine serum(FBS)는 Gibco(Gaithersburg, MD, USA)에서 구매하였다.
R-H-GFLG-cG3의 합성. cG3 PAMAM의 말단 잔기의 아민기에 액체상 펩타이드 합성법을 이용하여 RHGFLG 서열을 합성하였으며, 합성 과정은 Figure 2에 나타내었다.20,23 cG3 PAMAM의 양에 비례하여 Fmoc-Gly-OH(4eq), HOBt(4eq), HBTU(4eq), DIPEA(8eq)를 정량하여 DMF/DMSO(1:1, v/v) 용매에 녹여주었다. 16시간 후, 차가운 다이에틸에터(diethyl ether)를 이용하여 침전시키고 2-3번 다이에틸에터로 세척하였다. 합성물을 질소가스를 이용하여 건조시킨 후, DMF/DMSO(1:1, v/v) 용매에 희석시킨 30% 피페리딘(piperidine) 용매에 녹인 후 1시간 30분 동안 암반응시킨다. 이 후, 차가운 다이에틸에터(diethyl ether)를 이용하여 침전과 세척 과정을 진행하고, 펩타이드 서열 순서대로 위 과정을 반복한다. Fmoc-Leu-OH, Fmoc-Phe-OH, Fmoc-Gly-OH, Fmoc-His(trt)-OH and Fmoc-Arg(pbf)-OH를 차례대로 진행한 합성물을 TFA 용매(TFA : TIS : D.W=95 : 2.5 : 2.5, v/v/v)에 녹이고 6시간 동안 반응을 진행하여 pbf와 trt 보호기를 제거한다. 차가운 다이에틸에터(diethyl ether)를 이용하여 침전하고 질소가스로 건조시킨 후, 증류수에서 MWCO 3500 투석 튜빙으로 투석하여 정제를 진행한 후에 동결건조하였다. R-H-cG3도 위와 같은 방법으로 GFLG 서열이 없이 진행하였다. R-H-cG3와 R-H-GFLG-cG3를 D2O에 녹여 300 MHz 1H NMR spectroscopy (Fourier 300, Bruker, USA)를 이용하여 구조를 확인하였다.
아가로스 겔 전기영동을 이용한 pDNA의 복합체 형성과 방출 실험. R-H-GFLG-cG3와 pDNA(pCN-luc)을 이용하여 전기영동을 진행하였다. 복합체 샘플은 각각 pDNA(0.25 mg):polymer(1:5, 1:10, 1:15, 1:20) 중량비로 준비하여 25 mM HEPES 버퍼 내에서 30분간 진행하였다. 이후 pDNA 방출 실험에서는 환원제인 DTT와 효소 카텝신 B를 이용하였다. 첫번째로 R-H-GFLG-cG3/pDNA 복합체 샘플을 중량비 1:20으로 위와 같은 조건으로 준비하였다. 그리고 25 mM DTT를 처리하고 37 ℃에서 20분간 반응시켰다. 두번째로, 효소실험은 활성화 버퍼(0.1 M acetate, 0.01 M EDTA, 0.05 M reduced GSH pH 5.0)에서 R-H-GFLG-cG3/pDNA 복합체와 카텝신 B 0.5 uM 최종 농도에서 37 ℃, 4시간 동안 반응을 진행하였다. 위의 모든 샘플은 EtBr을 함유한 0.7% 아가로스 겔에서 20분간 전기영동하여 UV 램프에서 밴드를 확인하였다.
동적광산란법(Dynamic Light Scattering, DLS)과 제타전위(Zeta Potential Values) 측정. pDNA/R-H-GFLG-cG3 복합체의 크기와 표면전하를 측정하기 위해 DLS와 제타전위를 진행하였다. 복합체는 pDNA(5 mg):polymer(1:5, 1:10, 1:15, 1:20)의 중량비로 준비하여 30분간 복합체 형성을 진행하였다. 각각의 샘플은 1:400(v/v)의 비율로 증류수를 이용하여 희석하였고 각각 DLS(ELS-Z, Otsuka Electronics, Osaka, Japan), zeta instrument(Malvern, London, UK)를 이용하여 측정하였다.
전계방출주사전자현미경(Field Emission-Scanning Electron Microscopy, FE-SEM). pDNA/R-H-GFLG-cG3 복합체의 형태를 관찰하기 위해 FE-SEM으로 확인하였다. 복합체는 각각 pDNA(0.25 mg)/polymer(1:5, 1:10, 1:15, 1:20)의 중량비로 준비하여 30분간 복합체 형성을 진행하였다. 이후, 1:200(v/v) 비율로 증류수를 이용해 희석하여 실리콘 웨이퍼 위에 점적하여 건조하였다. 이후 platinum(Pt) 코팅하여 FE-SEM(S-4800, Hitachi, Japan) 장비를 이용하여 측정하였다.
세포 배양과 WST-1 측정 실험. SW480와 Hep G2 세포주를 CO2 인큐베이터(습도 95%, CO2 5%, 37 ℃)에서 10% FBS, 1% antibiotic-antimycotic를 함유한 DMEM 미디어를 이용해 배양하였다. 세포는 trypsin-EDTA 0.5%를 이용하여 계대배양하였다. WST-1 실험은 세포 독성을 평가하기 위함으로 96 well plate에 1×104 cells/well로 넣어준 후 24시간 배양하였다. 이후 샘플을 희석하여 2, 1, 0.5, 0.25, 0.125 mg/mL의 농도로 각 well에 처리하고, 24시간 동안 배양 후, WST-1 용액을 첨가하고 2시간 동안 반응하였다. VERSAmax microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 450 nm에서의 흡광도를 측정하였다.
루시페라아제 실험과 공초점 현미경 측정 실험. 유전자 발현율 측정을 위해 루시페라아제 실험을 진행하였다. 48 well plate에 3×104 cells/well의 세포를 넣어준 후 배양하였다. 샘플은 1:5, 10, 15, 20(pDNA : polymer) 중량비로 준비하였고, 세포배양액으로 희석하여 각각 처리하였다. 24시간 후, 배양액을 제거하고 DPBS를 이용하여 세척하였다. Lysis 버퍼를 150 mL씩 각각 처리하여 20분간 교반하였다. 이후 샘플을 수득하여 12000 rpm에서 10분간 원심분리하였다. 상층액의 단백질을 수득하여 BCA assay kit를 이용하여 단백질 정량을 진행하고 루시페린(Luciferin)을 처리하여 발광세기를 발광측정기(Lumat LB 9507, Berthold Technology, Bad Wildbad, Germany)를 이용하여 측정하였다.
R-H-GFLG-cG3의 세포 내 분포도를 확인하기 위해 공초점 현미경을 측정하였다. SW480 세포주를 2×104 cells/well의 양으로 idibi-8u dish에 배양하였다. R-H-GFLG-cG3, R-H-cG3, cG3는 Alexa 488(green)으로 표지하였고, pDNA는 Cyanine 3(red)로 표지하였다. 복합체는 24시간 동안 처리하였으며, DPBS로 세척 후 Hoechst 33342를 이용하여 핵을 염색하였다. 세포는 Zeiss LSM 5 Live confocal laser microscope(Zeiss, Oberkochen, Germany)를 이용하여 관찰하였다.
통계처리. 통계 분석은 GraphPad Prism 5를 이용하여 Student’s t-test를 진행하였다.

|
Figure 2 Synthesis scheme of Arg-His-Gly-Phe-Leu-Gly-cystamine core PAMAM G3 (R-H-GFLG-cG3) following Fmoc chemistry: (1) Fmoc-Gly-OH, HoBt, HBTU, DIPEA in DMF/DMSO(1:1); (2) piperidine 30% in DMF/DMSO(1:1); (3) Fmoc-Leu-OH, HoBt, HBTU, DIPEA; (4) Fmoc-Phe-OH, HoBt, HBTU, DIPEA; (5) Fmoc-GlyOH, HoBt, HBTU, DIPEA; (6) Fmoc-His(Trt)-OH, HoBt, HBTU, DIPEA; (7) Fmoc-Arg(pbf)-OH, HoBt, HBTU, DIPEA; (8) TFA solution (TFA : TIS : D.W = 95 : 2.5 : 2.5, v/v/v) for 6 h. |
R-H-GFLG-cG3 PAMAM의 합성. R-H-GFLG-cG3는 Fmoc 합성법을 이용하여 합성하였다(Figure 1). 합성된 R-H-GFLG-cG3와 R-H-cG3는 300 MHz 1H NMR spectroscopy를이용하여 구조를 분석하였으며, 결과는 아래와 같다(Figure 3).
(A) R-H-cG3 피크: δ(in ppm) arginine:1.58(-HCCH2CH2-CH2NH-), 1.84(-HCCH2CH2CH2NH-), PAMAM cG3: 2.50(-NHCH2CH2CO-), 3.19(-NHCH2CH2CO-), 3.24(-NHCH2CH2NH-), histidine: 7.06(-CH(CH2(CCHNCHNH))NH-), 7.88(-CH(CH2 (CCHNCHNH)). (B) R-H-GFLG-cG3피크: δ(in ppm) leucine: 0.83(-CH(CH3)2CHCH2CH-), arginine: 1.55(-HCCH2CH2CH2NH-), 1.76(-HCCH2CH2CH2NH-), 4.29(-HCCH2CH2CH2NH), PAMAM cG3: 2.43(-NHCH2CH2CO-), 2.95(-NHCH2CH2CO-), 3.30(-NHCH2CH2NH-), phenylalanine: 7.02, 7.25(-COCHCH2 (C6H5) NH-), histidine: 7.33(-CH(CH2(CCHNCHNH))NH-), 7.80(-CH(CH2(CCHNCHNH)). 이러한 결과를 통하여 R-H-cG3 PAMAM, R-H-GFLG-cG3 PAMAM의 구조를 확인하였고 합성이 성공적으로 진행되었음을 확인하였다.20
R-H-GFLG-cG3 PAMAM의 나노복합체 분석. 전기영동법을 이용하여 루시페라아제 발현 플라스미드 DNA와 R-H-GFLG-cG3의 안정적인 복합체(polyplex) 형성을 확인하였다. 양이온성인 R-H-GFLG-cG3의 양을 중량비로 증가함에 따라 pDNA의 전기영동 밴드의 변화가 일어나는지 관찰하였다. Figure 4(A)에 나타난 것과 같이 1:5(pDNA: polymer, w/w)에서 pDNA의 밴드가 관찰되지 않았으며, 이는 R-H-GFLG-cG3의 양이온에 의해 정전기 상호작용으로 pDNA와 응축될 수 있음을 입증하였다. 따라서, R-H-GFLG-cG3와 pDNA에 의해 형성된 복합체는 표면에 양전하를 띠게 되며 음전하인 세포막을 투과하여 세포 내로 전달될 수 있음을 예상할 수 있다.8 세포막을 투과하여 전달된 복합체는 세포 내 적정 환경에서 유전자를 방출하여야 한다. R-H-GFLG-cG3는 고분자 중심에 이황화결합을 갖고 있으며 이는 GSH이나 DTT에 의해 두개의 티올(thiol)기로 분해될 수 있다. 또한, R-H-GFLG-cG3의 표면에 접합한 GFLG 펩타이드 서열은 카텝신 B에 의해 특이적으로 절단될 수 있다. 이러한 기능성을 확인하기 위해 DTT와 카텝신 B를 이용한 pDNA의 방출을 실험하였다. DTT에 의한 환원을 평가하기 위해 형성된 R-H-GFLG-cG3 복합체를 DTT(25 mM)로 10분간 처리하고 전기영동을 통해 확인하였다(Figure 4(b)).24 DTT를 처리하지 않은 복합체는 pDNA의 밴드가 관찰되지 않은 반면, DTT를 처리한 복합체는 pDNA 밴드가 검출되었다. R-H-GFLG-cG3 복합체는 pDNA의 밴드가 검출되어 중심의 디설파이드 결합이 분해된 것으로 예상되었으나 관찰된 pDNA의 밴드가 명확하지 않았다. 이것은 DTT에 의해 고분자 중심이 분해되고 잔여 R-H-GFLG 서열이 갖고 있는 표면 전하와 소수성 인력이 유지되어 pDNA의 일부와 상호작용하고 있는 것으로 예상된다.
다음으로, R-H-GFLG-cG3의 복합체를 카텝신 B 효소를 처리하여 pDNA의 방출을 평가하였다. Figure 4(c)에서, 카텝신 B를 처리한 복합체군에서 pDNA 밴드를 확인하였다(lane 2). 반면, GFLG 서열이 없는 R-H-cG3 복합체는 pDNA의 밴드가 나타나지 않았다(lane 1). 또한, R-H-GFLG-cG3와 R-H-cG3가 pDNA와 정상적으로 복합체를 형성하는 것을 확인하였으며 (lane 3,4), 이러한 결과는 'GFLG' 서열이 카텝신 B에 의해 특이적 절단되었음을 의미한다. 이는 GFLG 서열을 이용하여 표적부위에 특이적인 분해를 유도할 수 있음을 예상할 수 있다.19,20,25 이러한 결과로부터 R-H-GFLG-cG3는 양이온성에 의해 pDNA를 응축시켰고, DTT와 카텝신 B에 의해 pDNA를 방출할 수 있음을 확인하였다.
R-H-GFLG-cG3 복합체의 입자 크기를 관찰하기 위해 FE-SEM을 측정하였다. R-H-GFLG-cG3 복합체는 고분자량에 따라 서로 다른 크기 분포가 관찰되었으며, 모든 중량비에서 나노 입자가 형성됨을 확인하였다. Figure 5(a)에서 pDNA/R-H-GFLG-cG3 복합체는 1:5 중량비에서 약 800-900 nm 크기를 형성함을 관찰하였고, 1:10 중량비에서 1:5 중량비 보다 더 작은 크기로 형성됨을 확인하였다(Figure 5(b)). 동적광산란(Dynamic light scattering, DLS)을 이용한 수용액 상의 입자 측정 결과 또한 FE-SEM의 결과와 유사하게 나타났다. 1:5 중량비가 0.31의 PDI 값으로 측정되었으며 이는 다른 중량비에 비해 높은 값을 나타냄을 확인할 수 있다(Table 1). 이는 복합체의 직경이 다른 중량비에 분포도가 넓게 측정된 것을 의미하며, R-H-GFLG-cG3의 양이 증가함에 따라 복합체는 좁은 크기 분포와 낮은 PDI 값을 나타낸다. R-H-GFLG-cG3의 복합체는 1:15 및 1:20(w/w)에서 FE-SEM 측정 결과 200 nm 미만으로 관찰되었다(Figure 5(c), (d)). 특히, 1:20의 중량비가 균일한 크기를 나타냈으며 DLS 결과는 140.1±4.4 nm, PDI=0.26인 것으로 나타났다. 이 결과는 R-H-GFLG-cG3와 pDNA의 정전기적 상호작용이 안정적인 나노 크기를 형성함을 설명할 수 있다. 반면, 낮은 폴리머 비율은 DNA의 느슨한 응축을 형성하고 500 nm 이상의 직경을 관찰할 수 있었다. 추가적으로 R-H-GFLG-cG3의 표면전하를 제타전위를 이용하여 측정하였을 때(Table 1), R-H-GFLG-cG3 폴리플렉스의 모든 비율은 30 mV 이상의 양전하를 띠는 것을 측정하였다. 결론적으로 R-H-GFLG-cG3은 양이온성 나노입자를 형성함을 확인하였으며, 이는 효과적으로 세포 내로 함입될 가능성이 있음을 시사한다.8
R-H-GFLG-cG3의 세포독성 및 유전자 발현효율분석. R-H-GFLG-cG3의 세포 독성은 Hep G2와 SW480 세포주에서 WST-1 분석법으로 수행하였다. Figure 6(a)에서, 대조군 PEI 25 kD은 Hep G2 세포주에서 농도 증가에 따라 높은 독성을 나타내었다. 반면, R-H-GFLG-cG3는 모든 농도군에서 100% 생존율을 유지했으며 cG3, R-H-cG3도 Hep G2 세포주에서 매우 낮은 세포독성을 나타내었다. SW480 세포주에서도 R-H-GFLG-cG3는 25kD PEI에 비해 낮은 세포독성을 나타냈다. 위의 결과로 R-H-GFLG-cG3는 두 세포주에서 80% 이상의 생존율을 보였으며, 안전하고 독성이 고분자임을 입증하였다. R-H-GFLG-cG3의 유전자 전달율을 평가하기 위해 루시페라아제 분석으로 평가하였다. Luciferase 리포터 유전자(pCN-luc)를 HepG2 및 SW480에 R-H-GFLG-cG3와 복합체 상태로 처리하였다. 대조군으로는 PEI 25 kD와 비교하였다. Figure 6(b)에서 cG3 PAMAM은 낮은 유전자 발현율을 보였으며, R-H-cG3는 PEI 25 kD보다 낮지만 cG3 PAMAM 보다는 높은 발현율을 나타냈다. 이는 R-H-cG3가 His과 Arg에 의해 완충효과에 의한 엔도좀 탈출과 양이온성에 의한 세포 함입율 증가로 인해 pDNA를 효과적으로 세포 내로 전달했음을 의미한다.11-13 R-H-GFLG-cG3는 HepG2와 SW480 세포주에서 PEI 25kD와 동등한 유전자 발현 효율을 나타냄을 확인하였다. 이는 R-H-GFLG-cG3가 pDNA를 세포 내로 함입하고, 세포 내 환경에서 방출 시스템인 GFLG 서열과 디설파이드 코어에 의해 분해되어 pDNA를 효과적으로 전달한다는 것을 입증하였다.20 이러한 결과는 R-H-GFLG-cG3가 pDNA를 안정적으로 보호하여 세포 내에서 유전자의 분해시스템을 극복하고 또한 효소 작용 감응성 기능에 의해 pDNA를 세포질로 효과적으로 방출함을 나타낸다.
R-H-GFLG-cG3의 세포 내 분포도 확인. R-H-GFLG-cG3의 세포 내 분포도를 확인하기 위해 공초점 현미경을 이용하여 관찰하였다. R-H-GFLG-cG3는 Alexa 488을 사용하여 형광 표지하였고, 플라스미드 DNA(pCN-luc)는 Cyanine 3으로 표지하였다. Figure 7, SW480 세포주에서 R-H-GFLG-cG3의 녹색 형광은 pDNA의 적색 형광과 높게 분포되며 두 형광색이 겹쳐진 노란색 형광이 관찰되었다. cG3 PAMAM은 R-H-cG3에 비해 모두 낮은 형광색을 나타냈으며, R-H-GFLG-cG3의 녹색 형광이 R-H-cG3와 비교하였을 때 세포내부에서 비교적 넓게 분포됨을 확인하였다. 또한, R-H-GFLG-cG3의 형광은 세포질과 핵에서도 확인이 되었으며 이는 다른 대조군들과 다른 분포도를 보이는 것을 확인할 수 있었다. 이러한 결과는 R-H-GFLG-cG3의 기능적 부분들이 pDNA의 세포 흡수 및 방출에 중요하다는 것을 입증하는 것이며, R-H-GFLG-cG3는 낮은 독성과 안정적인 세포 내 유전자 전달율과 발현율을 보이는 것을 확인하였다.

|
Figure 3 Results of 1H NMR spectroscopy (300 MHz, D2O) of the polymers. (A) R-H-cG3; (B) R-H-GFLG-cG3. |

|
Figure 4 Characterization of R-H-GFLG-cG3 polyplexes using Gel electrophoresis. (a) Formation of polyplexes, lane 1: naked pDNA (pCN-luc, 0.25 ug), lane 2, 3, 4, 5: pDNA:R-H-GFLG-cG3 (1:5, 1:10, 1:15, 1:20 weight ratio, respectively); (b) Dithiothreitol (DTT) test, lane 1: naked pDNA, lane 2: R-H-GFLG-cG3 polyplexes (1:20), lane 3: pDNA + DTT, lane 4: R-H-GFLG-cG3 polyplexes (1:20) + DTT; (c) cathepsin B test, lane 1: pDNA + cathepsin B, lane 2: RH-cG3 + cathepsin B, lane 3: R-H-GFLG-cG3 polyplexes (1:20) + cathepsin B, lane 4: naked pDNA, lane 5: R-H-cG3 polyplexes (1:20), lane 6: R-H-GFLG-cG3 polyplexes (1:20). |

|
Figure 5 Diameter and morphology of pDNA/R-H-GFLG-cG3 polyplexes using Dynamic Light Scattering (DLS) and Field Emission Scanning Electron Microscope (FE-SEM). DLS results and FE-SEM images of the polyplexes at (a) 1:5; (b) 1:10; (c) 1:15; (d) 1:20 (pDNA: polymer, weight ratio). scale bar = 400 nm. |

|
Figure 6 (a) Evaluation of polymer cytotoxicity; (b) trasnfection efficiency using luciferase assay in HepG2 and SW480 cells. |

|
Figure 7 Internalization of R-H-GFLG-cG3 polyplexes in SW480 cells using confocal microscopy. cG3, R-H-cG3 and R-H-GFLG-cG3 were prepared with pDNA at a 1:20 (pDNA:polymer) weight ratio. |
|
Table 1 Zeta Potential and Diameter of R-H-GFLG-cG3 Polyplexes |

*DLS and Zeta potential values were measured at room temperature. All measurements were repeated three times. |
본 연구에서는 3세대 PAMAM 덴드리머의 시스타민 코어에효소 민감성 서열(GFLG)과 히스티딘, 아르지닌을 접합하여 높은 효율을 유전자 전달체를 합성하였다. R-H-GFLG-cG3 복합체는 GSH와 카텝신 B에 의해 분해되는 유전자 방출 시스템과 히스티딘에 의한 엔도좀 탈출효과와 아르지닌의 세포 침투 능력으로 인해 높은 유전자 전달 및 발현효율을 나타내었다.
또한, R-H-GFLG-cG3는 GFLG 서열이 없는 R-H-cG3에 비해 높은 세포 내재화 및 분포도를 관찰하였다. 이러한 결과를 통하여 R-H-GFLG-cG3이 pDNA 방출 및 유전자 발현을 효율적으로 제어함을 확인할 수 있다. R-H-GFLG-cG3는 잠재적인 가능성을 가진 유전자 전달 고분자이며 약물 전달, 암 표적화 외에도 질병의 치료를 위한 여러 의약바이오 연구 및 개발 분야에 응용될 수 있을 것으로 기대된다.
- 1. Baden, L. R.; El Sahly, H. M.; Essink, B.; Kotloff, K.; Frey, S.; Novak, R.; Diemert, D.; Spector, S. A.; Rouphael, N.; Creech, C. B.; McGettigan, J.; Khetan, S.; Segall, N.; Solis, J.; Brosz, A.; Fierro, C.; Schwartz, H.; Neuzil, K.; Corey, L.; Gilbert, P.; Janes, H.; Follmann, D.; Marovich, M.; Mascola, J.; Polakowski, L.; Ledgerwood, J.; Graham, B. S.; Bennett, H.; Pajon, R.; Knightly, C.; Leav, B.; Deng, W.; Zhou, H.; Han, S.; Ivarsson, M.; Miller, J.; Zaks, T.; Group, C. S., Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N. Engl. J. Med, 2021, 384, 403-416.
-

- 2. Zhang, P.; Wagner, E. History of Polymeric Gene Delivery Systems. Top Curr. Chem. 2017, 375, 26.
- 3. Mukalel, A. J.; Riley, R. S.; Zhang, R.; Mitchell, M. J. Nanoparticles for Nucleic Acid Delivery: Applications in Cancer Immunotherapy. Cancer Lett. 2019, 458, 102-112.
-

- 4. Ullah, I.; Muhammad, K.; Akpanyung, M.; Nejjari, A.; Neve, A. L.; Guo, J.; Feng, Y.; Shi, C. Bioreducible, Hydrolytically Degradable and Targeting Polymers for Gene Delivery. J. Mater. Chem. B, 2017, 5, 3253-3276.
-

- 5. Peng, L.; Wagner, E. Polymeric Carriers for Nucleic Acid Delivery: Current Designs and Future Directions. Biomacromolecules 2019, 20, 3613-3626.
-

- 6. Thomas, T. J.; Tajmir-Riahi, H. A.; Pillai, C. K. S. Biodegradable Polymers for Gene Delivery. Molecules 2019, 24, 3744.
-

- 7. Riley, M. K.; Vermerris, W. Recent Advances in Nanomaterials for Gene Delivery-A Review. Nanomaterials 2017, 7, 94.
-

- 8. Nie, X.; Zhang, Z.; Wang, C. H.; Fan, Y. S.; Meng, Q. Y.; You, Y. Z. Interactions in DNA Condensation: An Important Factor for Improving the Efficacy of Gene Transfection. Bioconjug Chem. 2019, 30, 284-292.
-

- 9. Peeler, D. J.; Sellers, D. L.; Pun, S. H. pH-Sensitive Polymers as Dynamic Mediators of Barriers to Nucleic Acid Delivery. Bioconjug Chem. 2019, 30, 350-365.
-

- 10. Vaidyanathan, S.; Chen, J.; Orr, B. G.; Banaszak Holl, M. M. Cationic Polymer Intercalation into the Lipid Membrane Enables Intact Polyplex DNA Escape from Endosomes for Gene Delivery. Mol. Pharm. 2016, 13, 1967-1978.
-

- 11. Son, S. J.; Yu, G. S.; Choe, Y. H.; Kim, Y.-J.; Lee, E.; Park, J.-S.; Choi, J. S. PAMAM Dendrimers Conjugated with L-arginine and γ-aminobutyric Acid as Novel Polymeric Gene Delivery Carriers. Bulletin Korean Chem. Society 2013, 34, 579-584.
-

- 12. Yang, B. S.; Mallick, S.; Kwon, Y. E.; Kim, Y. J.; Kim, G. H.; Choi, J. S. PAMAM Dendrimer Conjugated with Cell-penetrating Peptide-derived Oligopeptides for Enhanced Cell Uptake and Gene Delivery. Bulletin Korean Chem. Society 2015, 36, 2477-2483.
-

- 13. Yu, G. S.; Bae, Y. M.; Choi, H.; Kong, B.; Choi, I. S.; Choi, J. S. Synthesis of PAMAM Dendrimer Derivatives with Enhanced Buffering Capacity and Remarkable Gene Transfection Efficiency. Bioconjug Chem. 2011, 22, 1046-1055.
-

- 14. Gu, J.; Chen, X.; Ren, X.; Zhang, X.; Fang, X.; Sha, X. CD44-Targeted Hyaluronic Acid-Coated Redox-Responsive Hyperbranched Poly(amido amine)/Plasmid DNA Ternary Nanoassemblies for Efficient Gene Delivery. Bioconjug Chem. 2016, 27, 1723-1736.
-

- 15. Hu, H.; Wang, H.; Liang, S.; Li, X.; Wang, D. Synthesis and Characterization of a PAMAM Dendrimer Nanocarrier Functionalized by HA for Targeted Gene Delivery Systems and Evaluation In Vitro. J. Biomater Sci. Polym. Ed., 2021, 32, 205-228.
-

- 16. Erel-Akbaba, G.; Carvalho, L. A.; Tian, T.; Zinter, M.; Akbaba, H.; Obeid, P. J.; Chiocca, E. A.; Weissleder, R.; Kantarci, A. G.; Tannous, B. A. Radiation-Induced Targeted Nanoparticle-Based Gene Delivery for Brain Tumor Therapy. ACS Nano, 2019, 13, 4028-4040.
-

- 17. Lee, J.; Kwon, Y. E.; Kim, Y.; Choi, J. S. Enhanced Transfection Efficiency of Low Generation PAMAM Dendrimer Conjugated with the Nuclear Localization Signal Peptide Derived from Herpesviridae. J. Biomater Sci. Polym. Ed., 2021, 32, 22-41.
-

- 18. Smith, R. J.; Gorman, C.; Menegatti, S. Synthesis, Structure, and Function of Internally Functionalized Dendrimers. J. Polym. Sci. 2021, 59, 10-28.
-

- 19. Song, S. J.; Choi, J. S. Enzyme-Responsive Amphiphilic Peptide Nanoparticles for Biocompatible and Efficient Drug Delivery. Pharmaceutics 2022, 14, 143.
-

- 20. Lee, S.; Son, S. J.; Song, S. J.; Ha, T. H.; Choi, J. S. Polyamidoamine (PAMAM) Dendrimers Modified with Cathepsin-B Cleavable Oligopeptides for Enhanced Gene Delivery. Polymers 2017, 9, 224.
-

- 21. Gondi, C. S.; Rao, J. S. Cathepsin B as a Cancer Target. Expert Opinion on Therapeutic Targets 2013, 17, 281-291.
-

- 22. Terasawa, Y.; Hotani, T.; Katayama, Y.; Tachibana, M.; Mizuguchi, H.; Sakurai, F. Activity Levels of Cathepsins B and L in Tumor Cells are a Biomarker for Efficacy of Reovirus-mediated Tumor Cell Killing. Cancer Gene Ther 2015, 22, 188-197.
-

- 23. Isidro-Llobet, A.; Alvarez, M.; Albericio, F. Amino Acid-protecting Groups. Chem Rev 2009, 109, 2455-2504.
-

- 24. Park, H. W.; Yu, G. S.; Song, S. J.; Choi, J. S. Conjugation of Peptide to Cystamine Core Polyamidoamine with γ-aminobutyric Acid for Gene Delivery. Polymer-Korea 2015, 39, 727-732.
-

- 25. Lee, S.; Song, S. J.; Lee, J.; Ha, T. H.; Choi, J. S. Cathepsin B-Responsive Liposomes for Controlled Anticancer Drug Delivery in Hep G2 Cells. Pharmaceutics 2020, 12, 876.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(3): 340-347
Published online May 25, 2023
- 10.7317/pk.2023.47.3.340
- Received on Jan 10, 2023
- Revised on Feb 21, 2023
- Accepted on Mar 13, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Joon Sig Choi
-
Department of Biochemistry, Chungnam National University, 99 Daehak-ro, Daejeon 34134, Korea
- E-mail: joonsig@cnu.ac.kr
- ORCID:
0000-0002-8463-841X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.