- Gellan Gum/Polyvinyl Alcohol Hydrogels with Stress Relaxation Property for Application as Retinal Pigment Epithelial Cell Carrier
Seung Ho Choe*,#, Soo In Kim*,#, Se Eun Kim*, Seung Jae Kim*, Jin Sol Seo*, Sunjae Park*, Jeong Eun Song*, and Gilson Khang*, **, ***,†

*Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of PolymerNano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea- 망막색소상피 세포전달체로 응용하기 위한응력 완화 특성을 갖는 젤란검/폴리비닐알코올 하이드로젤
최승호*,# · 김수인*,# · 김세은* · 김승재* · 서진솔* · 박선재* · 송정은* · 강길선*, **, ***,†

*전북대학교 바이오나노융합공학과, **전북대학교 고분자나노공학과, ***전북대학교 고분자융합소재연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
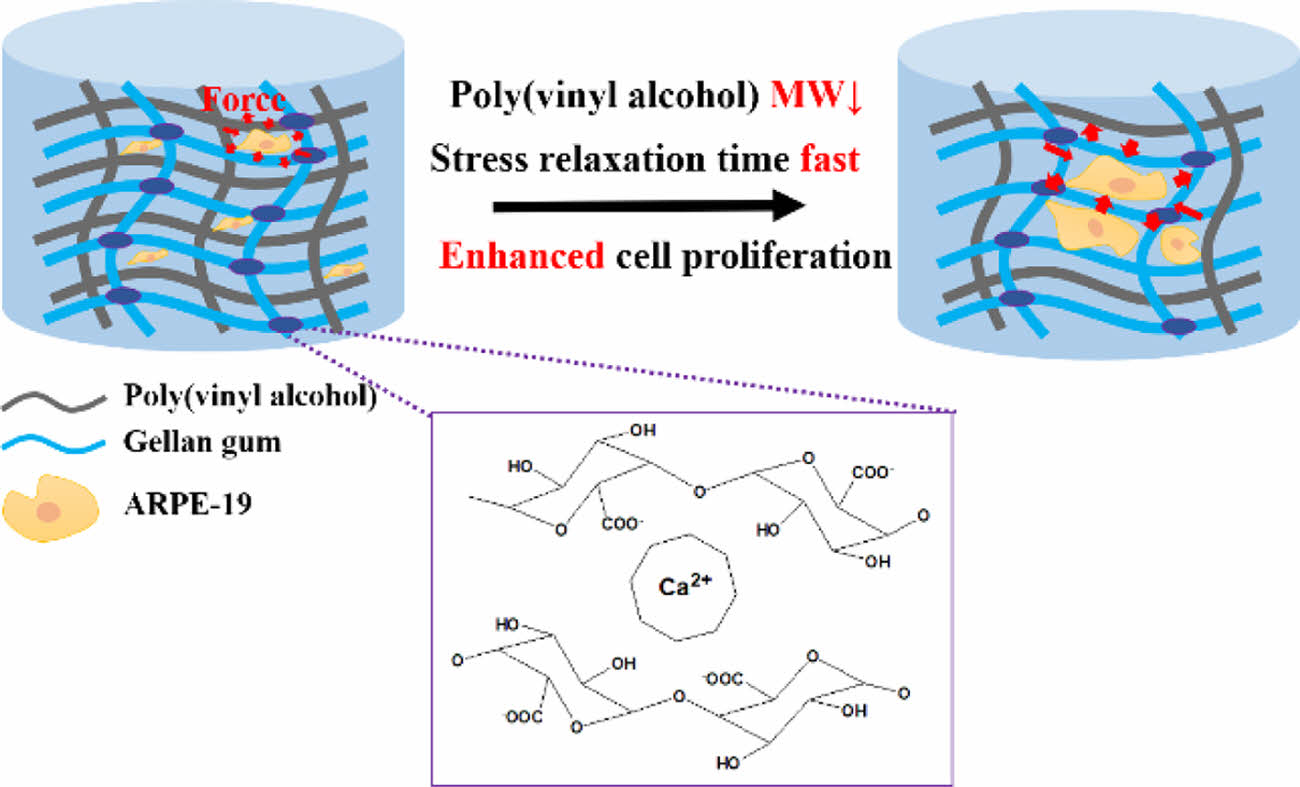
In this study, the stress relaxation of gellan gum (GG)/polyvinyl alcohol(PVA) hydrogel was evaluated according to the molecular weight of PVA. In addition, survival and proliferation of retinal pigment epithelium (RPE) were evaluated. After mixing GG with three molecular weights of PVA, Ca2+ was added to form a cross-link. The prepared viscoelastic hydrogels were designated as GG/PVA 146, GG/PVA 85, and GG/PVA 31 hydrogels. The physicochemical and mechanical properties of the GG/PVA hydrogel were evaluated, and in vitro experiments were conducted to confirm the effect of the GG/PVA hydrogel on the activity of ARPE-19 cells. As a result of the experiment, as the PVA molecular weight decreased, the hydrogel showed a high-water content, and we confirmed the fast stress relaxation property. In addition, rapid proliferation and spread were observed when ARPE-19 cells were cultured in gel. These results suggest that the applicability of the GG/PVA 31 hydrogel with fast stress relaxation as an ARPE-19 cell delivery system.
본 연구에서는 폴리비닐알코올(polyvinyl alcohol, PVA) 분자량에 따른 젤란검(gellan gum, GG)/PVA 하이드로젤의 응력 완화 평가와 이에 따른 망막색소상피 세포(retinal pigment epithelium, RPE)의 생존 및 증식을 평가하였다. GG를 세가지 분자량의 PVA에 각각 혼합한 후, Ca2+를 첨가하여 가교결합을 형성시켰다. 제조된 점탄성 하이드로젤은 GG/PVA 146, GG/PVA 85, GG/PVA 31 하이드로젤이라 명명하였다. GG/PVA 하이드로젤의 물리화학적 및 기계적 특성을 평가하였고, GG/PVA하이드로젤에서 ARPE-19 세포의 활성에 미치는 영향을 확인하기 위해 in vitro 실험을 하였다. 실험 결과, PVA 분자량이 감소할수록 높은 수분 함유량을 보였으며, 빠른 응력완화 특성을 확인하였다. 또한, 겔내 ARPE-19 세포 배양시 빠른 증식과 확산을 관찰하였다. 이러한 결과를 통해, 빠른 응력완화를 갖는 GG/PVA 31 하이드로젤의ARPE-19 세포전달체로 응용가능성을 확인하였다.
The gellan gum (GG)/polyvinyl alcohol (PVA) hydrogel showed a fast stress relaxation property as the PVA molecular weight decreased. As a result, rapid proliferation and spread of ARPE-19 cells were observed in the GG/PVA 31 hydrogel, confirming that it was applicable as an ARPE-19 cell delivery system.
Keywords: gellan gum, polyvinyl alcohol, stress relaxation, 3D cell culture, retinal pigment epithelium.
본 연구는 과학기술정보통신부의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업이다 (2020R1A2C2103089, 2020R1I1A1A01073657).
저자들은 이해상충이 없음을 선언합니다.
망막은 신경세포와 광수용기 세포들로 이루어져 있어, 빛을 감지하고 시각정보를 뇌에 전달한다.1,2 노화와 손상으로 인하여 망막색소변성증, 연령관련황반변성증, 망막 박리 등의 망막질환이 발생시, 현재 레이저 치료, 항체 주사, 줄기세포, 유전자 치료 등의 연구가 진행되고 있다.3
본 연구에서는 망막색소상피 세포를 안정적으로 전달하기 위하여 하이드로젤을 이용한 조직공학적 방법을 연구하였다.4,5 하이드로젤은 세포외 기질(extracellular matrix, ECM)과 유사하게 다량의 물 또는 생물학적 유체를 보존할 수 있는 3차원 고분자 네트워크 구조로 이루어져 있어, 세포의 성장, 증식, 분화를 지원할 수 있다. 이러한 특성으로 인해 조직공학 및 재생의학 분야에서 인공 ECM은 생체재료로 많은 분야에서 사용되고 있다.6,7 생물학적 ECM은 세포에 구조적 미세환경을 제공하며, 물리적 및 화학적 신호를 통해 세포의 행동과 운명을 조절한다.8,9 최근 연구에서 ECM의 기계적 특성이 세포의 확산, 이동, 증식, 분화에 중요한 역할을 한다는 사실이 밝혀졌다.10,11 즉, 동적 미세 환경을 갖는 천연 ECM은 점탄성 특성으로 하중이 가해질 때 시간 의존적인 에너지 소산을 보이며,12 이러한 역학 변화는 분화, 발달, 항상성, 재생과정 및 질병 진행을 조절하는데 핵심적인 역할을 한다는 것이다. 따라서 재생의학에서 ECM의 동적 환경을 모방하는 점탄성 하이드로젤 연구가 관심을 받고 있다.
현재, 알지네이트(alginate, ALG), 폴리에틸렌글리콜(poly (ethylene glycol), PEG), 히알루론산 (hyaluronic acid, HA), 콜라겐(collagen) 등과 같은 생체재료를 이용한 점탄성 하이드로젤 개발에 대한 연구가 활발히 진행되고있으며,13,14 점탄성 하이드로젤의 빠른 응력 완화 특성이 효과적인 세포 성장을 유도하는 것으로 나타났다. 점탄성 하이드로젤의 응력완화 특성은 하이드로젤의 공유 및 비공유 결합의 종류, 결합의 비율, 가교도와 상관관계가 있다.15 점탄성 하이드로젤은 가역적으로 결합이 끊어지고 재형성될 수 있는 고분자 네트워크 구조가 필요하다. 이러한 네트워크는 수소결합, 이온결합 및 소수성 결합과 같은 물리적인 결합을 통해 형성할 수 있다.16 물리적인 결합은 외부의 힘이 가해질 시 결합이 끊어지며 응력을 완화하고, 외부 힘이 제거된 후 결합을 재형성한다.17 또한 고분자의 분자량 감소를 통해 사슬의 이동성을 높여 빠른 응력완화 특성을 부여할 수 있다.18 따라서 본 연구에서는 Ca2+를 이용한 이온결합과 고분자의 분자량 조절을 통해 점탄성 하이드로젤을 개발하였다.
천연고분자인 로우아실 젤란검(low-acyl gellan gum, GG)은 우수한 생체 적합성, 생분해성, 무독성, 높은 열 및 산 안정성 등의 특성을 갖는다고 알려져 있으며,19 조직 공학 생체 재료로 최근 안구 약물 전달 시스템 연구에 이용되고 있다.20 GG는 열에 따른 겔화 특성으로 인해 냉각시 랜덤코일 구조가 이중 나선으로 변하며 3차원 네트워크 겔을 형성한다. 또한 Mg2+, Ca2+와 같은 양이온에 의해 물리적으로 가교가 가능하다.21-23 GG의 이온결합은 -CH3CO에 의해 방해될 수 있는데, low-acyl GG은 high-acyl GG보다 적은 아세틸기로 인해 이온결합이 잘 형성될 수 있다.24 하지만 높은 겔화 온도로 인해 생리적 온도(~37.5 ℃)에서 세포 캡슐화가 어렵다.25
폴리비닐알코올(polyvinyl alcohol, PVA)은 높은 수분 함량, 팽윤 특성, 기계적 안정성, 쉬운 화학구조 변형 및 우수한 내화학성으로 생물의학 분야에서 널리 사용되는 고분자이다. PVA는 수소결합을 통해 단독으로 또는 화학적 및 물리적 가교 결합을 통해 미세다공성 구조를 가지는 겔을 형성할 수 있다. 이러한 특성으로 인해 연골, 소프트 콘텍트 렌즈, 화상 드레싱 등에 사용되고 있다.26-29 그러나 높은 분자량의 PVA 하이드로젤은 고무와 같은 탄성 성질로 인해 천연 ECM의 점탄성 특성을 모방하지 못한다.30,31
본 연구에서는 Ca2+을 이용하여, GG과 PVA를 물리적 가교를 시키고, 3가지 다른 분자량을 가지는 PVA의 혼합을 통해 GG/PVA 하이드로젤을 제조하였다. PVA의 분자량에 따른 빠른 응력 완화 특성이 망막색소상피 세포(retinal pigment epithelium, RPE)의 성장, 증식, 확산에 미치는 영향을 확인하고자 하였다. 따라서, 제조한 하이드로젤의 물리화학적 특성평가, 기계적 특성평가, in vitro 실험을 진행하였다.
시약 및 재료. 본 실험에서는 하이드로젤 제조를 위해 PVA(87-89% hydrolyzed, Mw: 146-186 kDa), PVA(87-89% hydrolyzed, Mw: 85-124 kDa), PVA(87-89% hydrolyzed, Mw: 31-50 kDa)그리고 GG(GelzanTM CM, Mw: 1000000 g/mol)을 Sigma-Aldrich사로부터, CaCl2(calcium chloride)는 SHOWA로부터 구입하였다. 모든 재료는 정제없이 사용하였다.
GG/PVA하이드로젤 제조. GG/PVA 하이드로젤은 다음과 같이 제조하였다. 다른 분자량을 가지는 세 가지의 PVA 300 mg을 각각 10 mL의 증류수에 넣어 3%(w/v)가 되도록 넣은 후, 90 ℃에서 1시간 동안 교반하여 용액상태로 제조하였다. 그 다음 0.5%(w/v) GG을 넣어 1시간 동안 GG를 녹인 후, 15 mM CaCl2을 넣어 5분 더 교반 후 GG/PVA 하이드로젤 수용액을 제조하였다. 제조한 수용액은 페트리 디쉬(50 mm × 10 mm, SPL Life Sciences, South Korea)에 분주하여 10분간 굳힌 후, 6 mm biopsy punch(Kai Medical Biopsy Punch, Japan)를 사용하여, GG/PVA 하이드로젤(직경 6 mm, 높이 4 mm 크기)을 제조하였다. 제조한 하이드로젤은 PVA의 분자량에 따라 GG/PVA 146, GG/PVA 85, GG/PVA 31로 명명하였다.
FTIR 분석. 제조한 GG/PVA하이드로젤의 구조적인 변화를 관찰하기 위하여 적외선 분광 광도계(Fourier transform infrared spectroscope, FTIR, GX, Perkin Elmer, Connecticut, USA)를 이용하여 500-4000 cm-1 파장에서 분석하였다.
기공 구조 관찰. GG/PVA 하이드로젤의 내부 기공 구조는 주사전자현미경(scanning electron microscope, Bio-LV SEM, Model S-2250N, HITACHI, Tokyo, Japan)을 사용하여 확인되었다. 제조된 하이드로젤은 4, -20, -80 ℃에서 각각 4시간, 4, 24시간 보관 후 7일간 동결건조하였다. 완전 건조된 하이드로젤을 반으로 자른 후 아르곤 가스 하에서 plasma sputter (Emscope, Model SC500K, West Sussex, UK)를 이용하여 백금 코팅한 후 기공 구조를 관찰하였다. 기공크기는 Image J software(Java-based image software, LOCI, University of Wisconsin)로 측정되었다.
졸분율 측정. 제조된 하이드로젤의 졸비율과 가교도를 확인하기 위해, 하이드로젤을 2일간 동결건조시킨 후에 초기 무게(W0)를 측정한다. 하이드로젤이 잠길 정도로 증류수를 넣어 진탕기(shaker)에 1시간 방치한 후 다시 2일간 동결건조를 하여 후기 무게(W1)를 측정하였다. 졸 비율은 아래의 식으로 계산하였다.
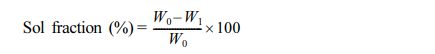
팽윤율 측정. GG/PVA 하이드로젤의 팽윤율을 분석하기 위해, 각각의 하이드로젤에 1 mL의 인산완충생리식염수(phosphate-buffered saline, PBS, pH 7, Gibco) 넣어 37 ℃에서 24시간 방치 후 초기 무게(W0)를 측정하였다. 남아있는 PBS를 제거하여 2일간 동결건조 후 후기 무게(W1)를 측정하였다. 팽윤율은 아래의 식으로 계산하였다.
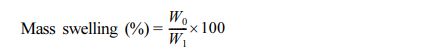
질량 감소 측정. 질량 감소는 각각의 하이드로젤에 1 mL의 PBS를 넣고 하루동안 담궈 놓고 꺼낸 뒤, 남아 있는 PBS제거 후 초기 무게(W0)를 측정하였다. 1일, 4일, 7일, 14일, 21일 마다 후기 무게(W1)를 측정하였으며, 3일마다 PBS를 교체하였다.
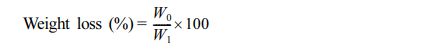
압축 강도 측정. 제조한 GG/PVA 하이드로젤의 압축 강도를 확인하기 위해 만능물성 측정기(TMS-Pro, Food Technology Corporation, Sterling, Virginia, USA)를 이용하여 압축 탄성률을 측정하였다. 모든 하이드로젤은 PBS에 넣어 하루 37 ℃에서 보관 후 측정되었다. 속도는 2 mm/min, 힘은 최대 10 N으로 설정하였다. 압축 탄성률은 0-5%의 변형률에서 계산되었다.
응력 완화 시간 측정. 하이드로젤의 응력 완화 정도는 만능물성측정기(TMS-Pro, Food Technology Corporation, Sterling, Virginia, USA)를 이용하여 측정하였다. 하이드로젤에 15%의 변형률을 가한 후, 5분간의 응력의 변화를 분석하였다.
하이드로젤 내의 세포 캡슐화. 본 실험에서는 human retinal pigment epithelial cell line(ARPE-19, ATCC catalog NO. CRL-2302)을 사용하였다. 세포는 Dulbecco’s modified eagle medium/nutrient mixture F-12(DMEM F-12, Gibco), 10% 우태아 혈청(fetal bovine serum, FBS, Gibco) 및 1% 항생제(antibiotic−antimycotic, Anti-Anti, 100 units/mL Gibco)을 첨가한 배양액에서 37 ℃, 5% CO2 조건에서 배양되었다. 배양액은 3일마다 교체하였다. 세포는 4 × 105 cells/mL 농도로 37 ℃에서 하이드로젤에 캡슐화되었다.
세포 형태 관찰. 세포 형태를 SEM을 통해 관찰하기 위해 GG/PVA하이드로젤에 ARPE-19 파종 후 3일, 21일째에 배양액을 제거 후 PBS로 세척하였다. 세포 고정을 위해 2.5% glutaraldehyde(Sigma-Aldrich, USA)로 처리하여 차광 후 상온에서 24시간 동안 방치하였다. 그 다음 기공구조 실험과 같은 과정을 통해 세포 형태를 관찰하였다.
Live & Dead. GG/PVA 하이드로젤의 생체 적합성은 하이드로젤에 ARPE-19 세포를 파종하여 분석하였다. Live & dead 염색 액체 시약인 Calcein AM(녹색)을 가루 시약인 Ethidium (적색)에 첨가하여 혼합하였다. 세포가 파종된 하이드로젤을 공초점 접시(세포 배양 처리, 멸균, SPL 생명과학㈜ 제조, 한국)에 하이드로젤을 절편으로 잘랐다. 절편으로 자른 하이드로젤 위에 Live & Dead 염색 시약을 하이드로젤에 넣어주었다. 염색된 하이드로젤을 37 ℃, 5% CO2 환경의 인큐베이터에서 30분동안 인큐베이션하였다. 염색된 세포는 초분해능 공초점 레이저 스캐닝 현미경(CLSM, LSM 880 with Airyscan, Germany)을 사용하여 관찰하였다. 살아있는 세포는 녹색으로 염색되었고, 죽은 세포는 적색으로 염색되었다. 형광세기(Fluorescence intensity)은 Image J software로 측정하였다.
세포 독성 분석. GG/PVA 하이드로젤의 세포 독성과 증식을 알아보기 위해 MTT(3-[4,-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide; thiazolyl blue, 5 mg/mL in PBS, Amresco, TX, USA)]용액을 사용하여 MTT 분석을 진행하였다.32 본 실험은 mouse embryo fibroblast cell line(NIH/3T3, National Institute of Health, KCLB21658) 세포를 사용했다. 먼저 NIH/3T3 세포를 96 웰 플레이트(well plate)에 2 × 103 cells/well 로 접종하여 RPMI (Gibco, USA), 10% 우태아 혈청(fetal bovine serum, FBS, Gibco) 및 1% 항생제(antibiotic−antimycotic, Anti-Anti, 100 units/mL Gibco)을 첨가한 배양액에서 37 ℃, 5% CO2 조건에서 배양하였다. 각각의 2.6 mL의 하이드로젤 용액을 만들어 세포배양접시(cell culture dish)에 100 μL씩 분주한 후 10분간 굳힌다. 굳은 하이드로젤은 10 mL의 세포 배양액에 넣은 후 37 ℃의 항온조에서 하루 담아놓은 후, 0.45 μm의 멸균 필터를 이용하여 필터링하였다. 세포가 부착된 후, 필터링한 배양액으로 교체를 한 후 1일, 2일, 3일 간 배양한다. 특정 날짜가 되면 MTT용액(5 mg/mL)을 세포 배양액에 1/10로 희석하여 희석한 MTT 용액을 각 well에 100 μL씩 분주한 후 2시간 동안 37 ℃, 5% CO2 조건에서 배양하였다. 기존의 배양액을 제거하고 100 mL의 디메틸설폭시드(dimethyl sulfoxide, DMSO, Samchun chemical, South Korea) 용액을 첨가하여 마이크로 리더(microplate reader, Synergy MX, Biotek, Vernusky, VT, USA)을 사용하여 570 nm의 흡광도로 측정하였다.
dsDNA 함량 분석. GG/PVA 하이드로젤에서 세포의 증식을 확인하기 위해 파종 후 7일, 14일째 세포의 dsDNA 함량을 측정하였다. 특정 날짜가 되면, 샘플을 상온에서 해동 후 PBS로 세척하였다. 프로토콜에 따라 SPINeasy DNA kit(MP biomedicals, USA)을 사용하여 dsDNA를 추출하였다. 유리 조직 분쇄기(glass tissue grinder, Wheaton, USA)와 Lysis buffer GD을 이용하여 세포 용해와 균질화를 유도하였다. dsDNA를 추출한 후, Quant-iT PicoGreen 시약(Life Technologies, USA)을 사용하여 dsDNA 함량을 측정하였다. 추출한 샘플과 Quanti-iT PicoGreen 시약을 1:1 비율로 96 웰 블랙 플레이트 (well black plate, Cell Culture Plate, SPL Life Sciences, South Korea)에 분주하여 상온에서 5분간 방치하였다. 마이크로 리더((Microplate Reader, Synergy MX, Biotek, Vernusky, VT, USA)를 사용하여 485/20 nm-528/20 nm 파장에서 dsDNA함량을 측정했으며, 표준곡선은 0-2 μg/mL 범위의 dsDNA 농도에서 그렸다.
통계 분석. 모든 데이터는 평균 ± 표준 편차 (SD)로 표기하였다. 정량적 수치의 유의성 평가는 GraphPad Prism 5.0 (GraphPad Software, La Jolla, CA, USA)으로 수행되었으며, one-way ANOVA (analysis of variance)의 Tukey’s 사후 검정법을 이용하여 수치를 통계적으로 분석하였다. 값의 차이는 p < 0.05(*), p < 0.01(**) 및 p < 0.001(***)에서 유의한 것으로 하였다.
FTIR 분석. 제조한 GG/PVA 하이드로젤의 화학적 구조를 확인하기 위해 FTIR을 수행하였다(Figure 1). 순수 PVA는 3336 cm-1, 2935 cm-1, 1086 cm-1에서 각각 -OH, C-H, C-O stretching 피크를 나타냈다.33 순수 GG는 3310 cm-1에서 넓은 -OH 진동을 나타냈으며, 2921 cm-1에서 C-H stretching, 1604 cm-1에서 COO-의 비대칭 stretching, 1029 cm-1에서 C-O stretching 피크를 나타냈다.34 3개의GG/PVA 하이드로젤에서 PVA와 GG의 각각의 피크의 중첩으로 모든 피크가 나타나지 않았으며, 새로운 피크의 형성이 발생하지 않았다. 따라서 화학적 결합이 형성되지 않았으며, Ca2+와 COO-간의 상호작용만 일어난 것으로 확인된다.26
하이드로젤의 기공 구조. 하이드로젤의 기공 크기는 영양소 공급과 세포 부착에 영향을 미치는 중요한 특성이다.35 동결건조한 GG/PVA의 기공크기는 PVA의 분자량이 감소할수록 작아지는 경향을 보였다(Figure 2). 기공 크기 분포는 GG/PVA 146과 GG/PVA 85는 50-100 μm, GG/PVA 31은 10-50 μm 값을 가지는 것으로 관찰되었다. CaCl2를 이용한 이온 가교를 통해 GG/PVA는 미세 다공성 구조를 형성하는데, 이때 고분자의 분자량이 작을수록 짧은 사슬 길이에 의해 더 작은 미세구조를 형성한다.26,36 따라서 PVA 분자량에 따라 다공크기가 달라진 것으로 판단된다.
물리화학적 특성 평가. GG/PVA 하이드로젤의 졸 분율 측정결과 GG/PVA 146, GG/PVA 85, GG/PVA 31이 각각 25.41±2.70%, 32.86±1.44%, 35.31±2.15% 로 분자량이 낮아질수록 높은 졸 분율을 보였다. 질량팽윤비(mass welling ratio) 측정결과, GG/PVA 146, GG/PVA 85, GG/PVA 31이 각각 50.66±1.65%, 53.50±4.20%, 61.16±4.01%로 분자량이 감소할수록 높은 수분 함유량을 보였다. 하이드로젤의 무게손실(weight loss)를 측정한 결과, 21일째에 GG/PVA 146, GG/PVA 85, GG/PVA 31는 각각 약 7%, 10%, 11%로, 14일째에 비해 약 1%, 3%, 4% 감소하였다.
고분자의 분자량이 증가되면, 높은 가교밀도로 인해 생물학적 유체를 함유, 확산할 수 있는 자유 부피가 감소한다고 알려져 있다. 따라서 PVA 분자량이 높은 GG/PVA 146하이드로젤은 가교밀도가 높아져, 낮은 졸 분율과 수분 함유량을 보인 것으로 사료된다.37-39 또한 수분확산이 적어 무게 손실양도 다른 군에 비해 적게 일어난 것으로 판단된다(Figure 3).40
기계적 특성 평가. 하이드로젤의 기계적 특성은 세포의 행동에 영향을 미치는 중요한 매개변수이다.41 제조한 GG/PVA의 기계적 물성을 확인하기 위해 압축 계수와 응력완화 시간을 측정하였다. 초기 탄성 계수는 GG/PVA 146, GG/PVA 85, GG/PVA 31이 각각 64.85±2.43 kPa, 55.30±2.10 kPa, 52.30± 1.53 kPa로 GG/PVA 31이 GG/PVA 146에 비해 약 12 kPa 낮았다. 이전 연구들에서 천연 망막의 압축 계수는 10-20 kPa로 확인되었다.42 따라서 GG/PVA 31이 천연 망막에 가장 가까운 강도를 나타냈다. GG/PVA 31은 낮은 가교밀도로 인해 높은 졸 분율과 높은 수분 함량을 보였으며, 이러한 특성으로 인해 낮은 기계적 강도를 가진다.43 PVA의 분자량이 낮아질수록 더 빠른 응력 완화를 나타냈다. 초기 응력 값이 절반으로 완화되는 시간은 GG/PVA 146, GG/PVA 85, GG/PVA 31이 각각 약 16초, 11초, 9초로 GG/PVA 31이 가장 빠른 응력완화를 보였다. 고분자는 분자량이 작아질수록 사슬의 길이가 짧아진다. 짧아진 사슬 길이로 인해 고분자 사슬의 얽힘(entanglement)이 감소하며 사슬의 이동성이 증가한다. 따라서 고분자의 분자량이 낮을수록 하중이 가해질 시 빠른 스트레스 완화 능력을 보인다. GG/PVA 31의 빠른 스트레스 완화 거동은 생체 내에서 세포의 성장과 증식을 개선할 가능성이 있다(Figure 4).14,18,44
세포 형태 관찰. GG/PVA 하이드로젤에 파종된 세포의 부착 및 형태를 관찰하기 위해 파종 후 3일, 21일째에 SEM 이미지를 촬영하였다(Figure 5). 파종 후 3일째에 모든 GG/PVA하이드로젤에서 부착된 세포가 분산되어 있는 것이 관찰되었다. 21일째에는 3일째에 비해 모
든 하이드로젤에서 세포가 성장하고 증식된 것이 확인되었다. 이는 제조된 GG/PVA 하이드로젤이 세포 성장에 적합한 미세환경을 제공함을 시사합니다.45 GG/PVA 하이드로젤의 응력완화에 따른 세포 성장과 증식은 SEM 이미지에서 뚜렷하게 관찰되지 않았다.
Live & Dead. GG/PVA 하이드로젤에서 세포의 생존도를 확인하기 위해 파종 28일 후 Live & Dead 염색을 하였다 (Figure 6). 모든 지지체에서 시간이 지남에 따라 세포가 성장했으며 점차적으로 퍼지며 증식했다. 파종 후 28일째에는 GG/PVA 146, GG/PVA 85, GG/PVA 31의 형광세기(fluorescence intensity)는 각각 9.76±0.94, 11.69±1.61, 14.25±0.84로 GG/PVA 31이 가장 높은 형광 강도를 보였다. 따라서 세가지 하이드로젤 중 GG/PVA 31이 APRE-19 세포에 더 적합한 응력 완화 특성을 보여 세포의 성장과 증식을 촉진한 것으로 보인다.46
dsDNA 함량 분석. 세포 파종 7일, 14일 후 dsDNA 함량을 정량화하였다. 정량화 결과 GG/PVA 146는 125.2±6.8 ng/mg, GG/PVA 85는 100.5±23.6 ng/mg, GG/PVA 31은 104±3.7 ng/mg으로 GG/PVA 146이 가장 높은 dsDNA 함량을 보였다. 반면 14일째에 모든 군에서 dsDNA 함량이 증가했지만, GG/PVA 31이 464.4±176.9 ng/mg으로 가장 높은 dsDNA 함량을 보였다. 이는 점탄성 성질을 가지는 GG/PVA 31하이드로젤이 APRE-19세포에 긍정적인 영향을 미치는 것으로 보인다. 이전의 많은 연구들에서 점탄성 하이드로젤의 응력완화 특성과 기존의 생체 조직과 유사한 기계적 특성이 세포 성장, 증식, 확산에 긍정적인 영향을 미친다고 밝혀졌다.47,48 따라서 점탄성 하이드로젤인 GG/PVA 31이 ARPE-19세포증식에에 적합한 미세환경을 제공한 것으로 사료된다(Figure 6).
세포 독성 분석. 제조한 하이드로젤의 세포 독성을 확인하기 위해 MTT assay를 시행하였다(Figure 7). 1일째에는 GG/PVA 146이 95.28±7.90%, GG/PVA 85는 91.37±3.78%, GG/PVA 31는 80.09±1.48%의 생존율을 나타냈다. 3일째에는 GG/PVA 146, GG/PVA 85, GG/PVA 31은 각각 97.78±3.62%, 94.92±5.13%, 92.22±3.04%의 세포 생존율을 나타냈다. 모든 군에서 80 %이상의 높은 세포 생존율을 보였다. 세포는 성장하면서 주변에 스트레스를 가하는데, 점탄성 하이드로젤은 빠른 응력완화를 통해 세포의 리모델링을 지원하여, 세포의 성장, 증식 및 분화를 촉진한다.13,18 GG/PVA 31에서 12%의 높은 세포 증식율을 나타냈는데, 이는 다른 실험군들에 비해 빠른 응력완화특성을 갖기 때문으로 판단된다.

|
Figure 1 FTIR spectroscopy of (a) PVA; (b) GG/PVA 146 hydrogel; (c) GG/PVA 85 hydrogel; (d) GG/PVA 31 hydrogel; (e) GG powder analyzed from 4000-400 cm-1. |

|
Figure 2 SEM micrographs of hydrogels: (a) GG/PVA 146; (b) GG/PVA 85; (c) GG/PVA 31; (d) the average pore diameter of hydrogel (scale bar = 300 μm). |

|
Figure 3 Physicochemical characterization of the hydrogels: (a) sol fraction (%) analysis; (b) mass swelling ratio (%); (c) weight loss ratio (%), analyzed for 28 days (values are mean ± SD (N = 4), p < 0.05(*), p < 0.01 (**) and p < 0.001 (***)). |

|
Figure 4 Mechanical analysis of the hydrogels: (a) compressive modulus at the slope of the stress - strain curve 5% strain; (b) stress relaxation analyzed at 15% strain; (c) stress relaxation time quantification (values are mean ± SD (N = 4), p < 0.05 (*), p < 0.01 (**) and p < 0.001 (***)). |

|
Figure 5 SEM imaging of ARPE-19 cells encapsulated in hydrogels analyzed on day 3 and 21 (scale bar = 100 μm) |

|
Figure 6 Cell viability test. (a) Live & Dead staining of ARPE-19 cells encapsulated hydrogels analyzed with the Z-stack mode for 28 days. (scale bar = 50 μm) (b) relative intensity of Live & Dead images evaluated with ImageJ software (scale bar = 50 μm) (c) dsDNA content of the ARPE-19 encapsulated in the hydrogels : analyzed on day 7 and 14 of cell culture (values are means ± SD, n = 4, p < 0.05 (*), p < 0.01 (**) and p < 0.001 (***)). |

|
Figure 7 Cytotoxicity test of the ARPE-19 encapsulated in the hydrogels: analyzed on day on 1, 2 and 3 of cell culture. (values are means ± SD, n = 4, p < 0.05 (*), p < 0.01 (**) and p < 0.001 (***)). |
본 연구에서는 이온결합과 PVA 분자량 조절을 이용해 GG/PVA 하이드로젤을 제조하여 ARPE-19 세포 성장, 확산, 증식에 미치는 영향을 연구하였다. Ca2+ 이용한 물리적 결합을 통해 GG와 PVA를 가교 하였으며, 3가지의 다른 분자량을 가지는 PVA를 사용하여 하이드로젤에 점탄성 특성을 부여하였다. 기계적 특성 분석을 통해 하이드로젤의 응력완화는 PVA 분자량이 감소함에 따라 빠르게 일어남을 확인했으며, in vitro 실험결과 PVA의 분자량이 감소할수록 세포 활성에 적합한 미세 환경을 제공하여 세포 성장, 확산 및 증식에 긍정적인 영향을 준다는 것을 확인하였다. Live & Dead와 dsDNA 함량 분석으로, GG/PVA 31하이드로젤에서 높은 세포 성장과 증식이 관찰되었으며, MTT assay를 통해 80% 세포 생존률을 확인하였다. 결론적으로 가장 낮은 PVA 분자량을 가지는 GG/PVA 31하이드로젤이 빠른 응력완화 특성으로 인해 ARPE-19 세포의 확산과 증식을 향상시키는 것을 관찰하였다. 따라서, ARPE-19 세포 전달체로써 GG/PVA 31하이드로젤의 응용 가능성을 확인하였다.
- 1. Stern, J. H.; Tian, Y.; Funderburgh, J.; Pellegrini, G.; Zhang, K.; Goldberg, J. L.; Ali, R. R.; Young, M.; Xie, Y.; Temple, S. Regenerating Eye Tissues to Preserve and Restore Vision. Cell Stem Cell. 2018, 22, 834-849.
-

- 2. Fronk, A. H.; Vargis, E.; Methods for Culturing Retinal Pigment Epithelial Cells: a Review of Current Protocols and Future Recommendations. J. Tissue Eng. 2016, 7, 2041731416650838.
-

- 3. Jager, R. D.; Mieler, W. F.; Miller, J. W. Age-related Macular Degeneration. N. Engl. J. Med. 2008, 358, 2606-2617.
-

- 4. Hunt, N. C.; Hallam, D.; Chichagova, V.; Steel, D. H.; Lako, M. The Application of Biomaterials to Tissue Engineering Neural Retina and Retinal Pigment Epithelium. Adv. Healthc. Mater. 2018, 7, 1800226.
-

- 5. Park, J.; Baranov, P.; Aydin, A.; Abdelgawad, H.; Singh, D.; Niu, W.; Kurisawa, M.; Spector, M.; Young, M. J. In situ Cross-linking Hydrogel as a Vehicle for Retinal Progenitor Cell Transplantation. Cell Transplant. 2019, 28, 596-606.
-

- 6. Laftah, W. A.; Hashim, S.; Ibrahim, A. N. Polymer Hydrogels: A Review. Polym.-Plast. Technol. Eng. 2011, 50, 1475-1486.
-

- 7. Li, Y.; Yang, H. Y.; Lee, D. S. Advances in Biodegradable and Injectable Hydrogels for Biomedical Applications. J. Control. Release 2021, 330, 151-160.
-

- 8. Ma, Y.; Han, T.; Yang, Q.; Wang, J.; Feng, B.; Jia, Y.; Wei, Z.; Xu, F. Viscoelastic Cell Microenvironment: Hydrogel-Based Strategy for Recapitulating Dynamic ECM Mechanics. Adv. Funct. Mater. 2021, 31, 2100848.
-

- 9. Rosales, A. M.; Anseth, K. S. The Design of Reversible Hydrogels to Capture Extracellular Matrix Dynamics. Nat. Rev. Mater. 2016, 1, 15012.
-

- 10. Ye, K.; Cao, L.; Li, S.; Yu, L.; Ding, J. Interplay of Matrix Stiffness and Cell–cell Contact in Regulating Differentiation of Stem Cells. ACS Appl. Mater. Interfaces 2016, 8, 21903-21913.
-

- 11. Ma, Y.; Lin, M.; Huang, G.; Li, Y.; Wang, S.; Bai, G.; Lu, T. J.; Xu, F. 3D Spatiotemporal Mechanical Microenvironment: a Hydrogel-based Platform for Guiding Stem Cell Fate. Adv. Mater. 2018, 30, 1705911.
-

- 12. Elosegui-Artola, A. The Extracellular Matrix Viscoelasticity as a Regulator of Cell and Tissue Dynamics. Curr. Opin. Cell Biol. 2021, 72, 10-18.
-

- 13. Lou, J.; Stowers, R.; Nam, S.; Xia, Y.; Chaudhuri, O. Stress Relaxing Hyaluronic Acid-collagen Hydrogels Promote Cell Spreading, Fiber Remodeling, and Focal Adhesion Formation in 3D Cell Culture. Biomaterials 2018, 154, 213-222.
-

- 14. Nam, S.; Stowers, R.; Lou, J.; Xia, Y.; Chaudhuri, O. Varying PEG Density to Control Stress Relaxation in Alginate-PEG Hydrogels for 3D Cell Culture Studies. Biomaterials 2019, 200, 15-24.
-

- 15. Yu, W.; Sun, W.; Chen, H.; Wang, J.; Xue, B.; Cao, Y. Gradual Stress-Relaxation of Hydrogel Regulates Cell Spreading. Int. J. Mol. Sci. 2022, 23, 5170.
-

- 16. Wang, H.; Heilshorn, S. C. Adaptable Hydrogel Networks with Reversible Linkages for Tissue Engineering. Adv. Mater. 2015, 27, 3717-3736.
-

- 17. Wang, C.; Deitrick, K.; Seo, J.; Cheng, Z.; Zacharia, N. S.; Weiss, R.; Vogt, B. D. Manipulating the Mechanical Response of Hydrophobically Cross-linked Hydrogels with Ionic Associations. Macromolecules 2019, 52, 6055-6067.
-

- 18. Chaudhuri, O.; Gu, L.; Klumpers, D.; Darnell, M.; Bencherif, S. A.; Weaver, J. C.; Huebsch, N.; Lee, H.-P.; Lippens, E.; Duda, G. N. Hydrogels with Tunable Stress Relaxation Regulate Stem Cell Fate and Activity. Nat. Mater. 2016, 15, 326-334.
-

- 19. Fisher, S.; Lee, H.; Kallos, M.; Hunter, C. Degradation and Mechanical properties of Gellan Gum for Musculoskeletal Tissue Engineering. In 57th Annual Meeting of the Orthopaedic Research Society, Long Beach, CA, Jan. 13-16, 2011.
- 20. Sun, J.; Zhou, Z. A Novel Ocular Delivery of Brinzolamide Based on Gellan Gum: in vitro and in vivo Evaluation. Drug Des. Dev. Ther. 2018, 12, 383.
-

- 21. Kirchmajer, D. M.; Steinhoff, B.; Warren, H.; Clark, R. in het Panhuis, M. Enhanced Gelation Properties of Purified Gellan Gum. Carbohydr. Res. 2014, 388, 125-129.
-

- 22. Takahashi, R.; Tokunou, H.; Kubota, K.; Ogawa, E.; Oida, T.; Kawase, T.; Nishinari, K. Solution Properties of Gellan Gum: Change in Chain Stiffness Between Single-and Double-stranded Chains. Biomacromolecules 2004, 5, 516-523.
-

- 23. Vilela, J. A. P.; Bonsanto, F. P.; Cunha, R. L. Mechanical Properties of Gellan Gum Beads Prepared with Potassium or Calcium Ions. J. Texture Stud. 2022, 53, 531-539.
-

- 24. Ismail, N. A.; Razali, M. H.; Amin, K. A. M. Mechanical and Physicochemical Properties Study on Gellan Gum Thin Film Prepared Using Film Casting Method. AIP Conf. Proc. 2017, 1885, 020045
-

- 25. Palumbo, F. S.; Federico, S.; Pitarresi, G.; Fiorica, C.; Giammona, G. Gellan Gum-based Delivery Systems of Therapeutic Agents and Cells. Carbohydr. Polym. 2020, 229, 115430.
-

- 26. Wang, F.; Wen, Y.; Bai, T. The Composite Hydrogels of Polyvinyl Alcohol–gellan Gum-Ca2+ with Improved Network Structure and Mechanical Property. Mater. Sci. Eng. C 2016, 69, 268-275.
-

- 27. Ma, W.; Zhang, P.; Zhao, B.; Wang, S.; Zhong, J.; Cao, Z.; Liu, C.; Gong, F.; Matsuyama, H. Swelling Resistance and Mechanical Performance of Physical Crosslink-Based Poly(Vinyl Alcohol) Hydrogel Film with Various Molecular Weight. J. Polym. Sci. Part B: Polym. Phys. 2019, 57, 1673-1683.
-

- 28. Hernández, R.; Sarafian, A.; López, D.; Mijangos, C. Viscoelastic Properties of Poly(vinyl alcohol) Hydrogels and Ferrogels Obtained Through Freezing–thawing Cycles. Polymer 2004, 45, 5543-5549.
-

- 29. Asran, A. S.; Henning, S.; Michler, G. H. Polyvinyl Alcohol–collagen–hydroxyapatite Biocomposite Nanofibrous Scaffold: Mimicking the Key Features of Natural Bone at the Nanoscale Level. Polymer 2010, 51, 868-876.
-

- 30. Baker, M. I.; Walsh, S. P.; Schwartz, Z.; Boyan, B. D. A Review of Polyvinyl Alcohol and Its Uses in Cartilage and Orthopedic Applications. J. Biomed. Mater. Res. Part B 2012, 100, 1451-1457.
-

- 31. Ngadiman, N. H. A.; Noordin, M.; Idris, A.; Shakir, A. S. A.; Kurniawan, D. Influence of Polyvinyl Alcohol Molecular Weight on the Electrospun Nanofiber Mechanical Properties. Procedia Manuf. 2015, 2, 568-572.
-

- 32. Salgado, A.; Coutinho, O. P.; Reis, R. L. Novel Starch-based Scaffolds for Bone Tissue Engineering: Cytotoxicity, Cell Culture, and Protein Expression. Tissue Eng. 2004, 10, 465-474.
-

- 33. Abureesh, M. A.; Oladipo, A. A.; Gazi, M. Facile Synthesis of Glucose-sensitive Chitosan–poly(vinyl alcohol) Hydrogel: Drug Release Optimization and Swelling Properties. Int. J. Biological Macromol. 2016, 90, 75-80.
-

- 34. Sebria, N. J. M.; Amin, K. A. M. Gellan Gum/ibuprofen Hydrogel for Dressing Application: Mechanical Properties, Release Activity and Biocompatibility Studies. Int. J. Appl. Chem 2016, 12, 483-498.
- 35. Toh, W. S.; Loh, X. J. Advances in Hydrogel Delivery Systems for Tissue Regeneration. Mater. Sci. Eng. C 2014, 45, 690-697.
-

- 36. Lin, S.; Sangaj, N.; Razafiarison, T.; Zhang, C.; Varghese, S. Influence of Physical Properties of Biomaterials on Cellular Behavior. Pharmaceutical Res. 2011, 28, 1422-1430.
-

- 37. McBath, R. A.; Shipp, D. A. Swelling and Degradation of Hydrogels Synthesized with Degradable Poly(β-amino ester) Crosslinkers. Polym. Chem. 2010, 1, 860-865.
-

- 38. Shamirzaei Jeshvaghani, E.; Ghasemi-Mobarakeh, L.; Mansurnezhad, R.; Ajalloueian, F.; Kharaziha, M.; Dinari, M.; Sami Jokandan, M.; Chronakis, I. S. Fabrication, Characterization, and Biocompatibility Assessment of a Novel Elastomeric Nanofibrous Scaffold: A Potential Scaffold for Soft Tissue Engineering. J. Biomedical Mater. Res. Part B: Appl. Biomaterials 2018, 106, 2371-2383.
-

- 39. Lee, S. Y.; Zhong, X.; Valtchev, P.; Dehghani, F. Synthesis of a Biodegradable Polymer in Gas Expanded Solution: Effect of the Process on Cytocompatibility. Green Chem. 2013, 15, 1280-1291.
-

- 40. Tanuma, H.; Saito, T.; Nishikawa, K.; Dong, T.; Yazawa, K.; Inoue, Y. Preparation and Characterization of PEG-cross-linked Chitosan Hydrogel Films with Controllable Swelling and Enzymatic Degradation Behavior. Carbohydr. Polym. 2010, 80, 260-265.
-

- 41. Vedadghavami, A.; Minooei, F.; Mohammadi, M. H.; Khetani, S.; Kolahchi, A. R.; Mashayekhan, S.; Sanati-Nezhad, A. Manufacturing of Hydrogel Biomaterials with Controlled Mechanical Properties for Tissue Engineering Applications. Acta Biomater. 2017, 62, 42-63.
-

- 42. Wang, P.; Li, X.; Zhu, W.; Zhong, Z.; Moran, A.; Wang, W.; Zhang, K.; Chen, S. 3D Bioprinting of Hydrogels for Retina Cell Culturing. Bioprinting 2018, 12, e00029.
-

- 43. Chen, J.; Park, K. Synthesis and Characterization of Superporous Hydrogel Composites. J. Controlled Release 2000, 65, 73-82.
-

- 44. Chaudhuri, O.; Gu, L.; Darnell, M.; Klumpers, D.; Bencherif, S. A.; Weaver, J. C.; Huebsch, N.; Mooney, D. J. Substrate Stress Relaxation Regulates Cell Spreading. Nat. Commun. 2015, 6, 1-7.
-

- 45. Kamoun, E. A.; Chen, X.; Eldin, M. S. M.; Kenawy, E.-R. S. Crosslinked Poly(vinyl alcohol) Hydrogels for Wound Dressing Applications: A Review of Remarkably Blended Polymers. Arabian J. Chem. 2015, 8, 1-14.
-

- 46. Zhao, X.; Huebsch, N.; Mooney, D. J.; Suo, Z. Stress-relaxation Behavior in Gels with Ionic and Covalent Crosslinks. J. Appl. Physics 2010, 107, 063509.
-

- 47. Chaudhuri, O. Viscoelastic Hydrogels for 3D Cell Culture. Biomaterials Sci. 2017, 5, 1480-1490.
-

- 48. Dey, K.; Agnelli, S.; Sartore, L. Dynamic Freedom: Substrate Stress Relaxation Stimulates Cell Responses. Biomaterials Sci. 2019, 7, 836-842.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(2): 233-240
Published online Mar 25, 2023
- 10.7317/pk.2023.47.2.233
- Received on Dec 2, 2022
- Revised on Jan 26, 2023
- Accepted on Jan 30, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
*Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of PolymerNano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea - E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.