- Injectable Thermogel/Microsphere Hybrid Formulation System for Intratympanic Delivery of Dexamethasone
Ji Hyun Park# , Geonho Kim*,#, Thi Phuc Le, Da Hae Kim, Eunyoung Seol*,†
 , and Kang Moo Huh†
, and Kang Moo Huh† 
Department of Polymer Science and Engineering, Chungnam National University, Daejeon 34134, Korea
*G2GBIO, Inc., Daejeon 34054, Korea- 덱사메타손의 고막 내 전달을 위한 주입형 써모젤/미립구 하이브리드 제형 시스템의 제조 및 약물방출 특성 평가
충남대학교 고분자공학과, *㈜지투지바이오
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Since conventional strategies for inner ear drug delivery accompany side effects and limited delivery and absorption efficiencies, there has been continuous need to develop a new safe and effective local delivery system. In this study, a new injectable thermogel/microsphere hybrid formulation system has been developed for efficient delivery and sustained release of dexamethasone, a representative anti-inflammatory agent. The injectable hybrid formulations were prepared by physical mixing of hexanoyl glycol chitosan (HGC) thermogel and poly(lactide-co-glycolide) (PLGA) microsphere and their physicochemical and controlled release properties were evaluated. The hybrid system demonstrated physicochemical and rheological properties suitable for injectable formulation and a sustained release for more than one month without any initial burst release.
내이 약물 전달을 위한 기존의 전신 전달 방법은 제한된 약물의 흡수 및 부작용으로 보다 효과적이고 안전한 새로운 국소 약물전달 시스템의 개발이 필요하다. 본 연구에서는 대표적인 항염증제인 덱사메타손(DEX)의 효율적 내이 전달과 방출제어를 위한 새로운 주입형 써모젤/미립구 하이브리드 제형 시스템을 개발하였다. 헥사노일 글리콜 키토산(HGC) 써모젤과 생분해성 poly(lactide-co-glycolide)(PLGA) 미립구와의 물리적 혼합을 통해 주입형 하이브리드 제형을 제조하였고, 물리화학적 및 방출제어 특성을 평가하였다. 결과적으로, 하이브리드 시스템은 주입형 제형으로서 적합한 물리화학적 및 유변학적 특성을 나타냈고, 초기 급격한 방출 현상없이 한 달 이상 서방형 약물 방출이 가능함을 확인하였다.
A new injectable hybrid formulation system has been developed for efficient delivery and sustained release of dexamethasone. The hybrid system was prepared by physical mixing of hexanoyl glycol chitosan (HGC) themogel and poly(lactide-coglycolide) (PLGA) microshphere. Hybrid systems have shown promising physicochemical properties for injectable delivery and a sustained release for more than one month without any initial burst release.
Keywords: injectable thermogel, microsphere, hybrid formulation, sustained release, dexamethasone.
본 연구는 한국연구재단 지역거점혁신형의사과학자공동연구사업(NRF-2019M3E5D1A02068573)과 기초연구실지원사업(NRF-2022R1A4A1028372)으로 지원된 연구결과입니다.
저자들은 이해상충이 없음을 선언합니다.
내이 질환 치료를 위해 일반적으로 사용되는 구강 투여, 정맥 투여, 근육 내 투여 등을 통한 전신 투여 방법은 고농도의 약물을 반복적으로 투여해야 함으로 부작용의 우려가 크고, 내이로의 약물 전달 및 흡수 효율이 낮아 치료 효과의 한계가 있다.1,2 반면, 최근 주목을 받고 있는 국소 투여 방법으로서 고막 내 투여(intratympanic injection)와 달팽이관 내 투여(intracochlear injection) 방법은 약물의 전신 노출을 최소화하면서 내이에서의 약물 흡수를 높일 수 있는 효과적인 방법으로 보고되고 있다.3 특히, 달팽이관 내 투여보다는 비교적 안전하고, 적용이 용이한 고막 내 투여 방법이 내이 약물 전달 방식으로 가장 선호되고 있다.4 고막 내 투여된 약물은 중이강(middle ear cavity)에 위치하게 되고, 중이와 내이를 구분하는 둥근 창 막(round window membrane, RWM)을 통한 확산(diffusion)에 의해 내이로 전달되게 된다.5 반면, 고막 내 투여된 수용액 제형의 약물은 유스타키오관을 통해 쉽게 조기 배출되어 내이로의 효과적인 전달을 어렵게 한다. 따라서 중이강에서의 유스타키오관을 통한 약물의 조기 배출을 억제하고, 약물의 체류 시간 및 RWM과의 접촉 시간을 연장하는 것이 내이로의 약물 전달 효율을 향상시키는 유망한 접근법으로 인식되고 있다.6-9 최근, 점탄성을 갖는 하이드로젤 제형이 유스타키오관을 통한 약물 배출을 막는데 효과적이고, 약물의 전달 효율을 향상시킬 수 있다고 보고되었다.10
생체 온도에 감응하여 졸-젤 상전이를 나타나는 써모젤은 다양한 바이오메디컬 응용분야에 유용한 생체재료로 활용되고 있으며, 특히 주입형 약물전달제형으로서 주목을 받아왔다.11 써모젤의 특성을 갖는 대표적인 고분자로는 poly(ethylene oxide)(PEO)와 poly(propylene oxide)(PPO)의 삼중-블록공중합체인 폴록사머(poloxamer)와 PEO와 생분해성 고분자(polylactide)(PLA), poly(lactide-co-glycolide)(PLGA), poly- caprolactone(PCL)의 이중- 또는 삼중-블록공중합체가 있으며, 생체 적합성 및 온도감응성에 기반하여 다양한 약물, 세포, 기타 생체활성물질의 주입형 전달체로 광범위하게 활용되고 있다.12-15 최근 수용성 키토산 유도체인 글리콜 키토산에 기반한 아실 글리콜 키토산이 새로운 써모젤 생체재료로서 개발되었다. 아실 글리콜 키토산 써모젤은 기존 합성고분자 기반의 써모젤과 비교하여 젤 안정성, 생체접합성, 생분해성, 점막부착성, 화학적 기능성 등의 우수한 특성을 보유하고 있으며, 아실기의 종류 및 치환율에 따라 온도감응성 및 물리화학적 특성을 용이하게 조절할 수 있다.16,18 또한, 이러한 써모젤은 고막 내 투여를 위한 주입형 약물전달체로 사용되었을 때, 중이강에서의 젤화를 통해 약물의 유스타키오관에 의한 배출을 억제하고 방출 제어가 가능하여 내이로의 약물 전달 효과를 향상시킬 수 있음을 보여주었다.19
한편, 써모젤을 포함한 하이드로젤 제형은 확산이 용이한 다공성 구조로 인하여 저분자 약물보다는 일반적으로 단백질과 같은 고분자 약물을 위한 약물전달제형으로 사용되어 왔다. 기존 써모젤 제형이 고막 내 투여용 주입형 약물전달체로서 약물전달 효율을 높일 수 있었음에도 불구하고, 하이드로젤 본연의 구조적 특성으로 저분자 약물의 서방형 방출을 효과적으로 구현하기에는 한계가 있다.20-22 이러한 하이드로젤의 방출제어 특성 한계를 극복하기 위해서, 최근 고분자 미셀이나 미립구와 같은 방출제어가 가능한 제형들과의 하이브리드화를 통해 기존의 하이드로젤 단독 제형으로는 적용이 어려웠던 소수성 약물의 제형화나 서방형 방출 제형이 가능하게 되었다. 대표적인 서방형 방출 제형인 생분해성 PLGA 미립구는 우수한 생체적합성과 생분해성을 기반으로 다양한 종류의 약물들을 수 주에서 수 개월 이상 약물의 방출속도를 조절할 수 있어 서방형 방출제형으로서 가장 광범위하게 활용되고 있다. 따라서, 이러한 서방형 방출제어가 가능한 PLGA 미립구를 써모젤과 혼합한 하이브리드 제형의 제조는 하이드로젤의 방출 특성 한계를 극복함과 동시에 입자형의 미립구 제형의 생체 내 잔류 특성을 향상시킬 수 있는 유용한 방법이 될 수 있을 것으로 기대된다.23-26
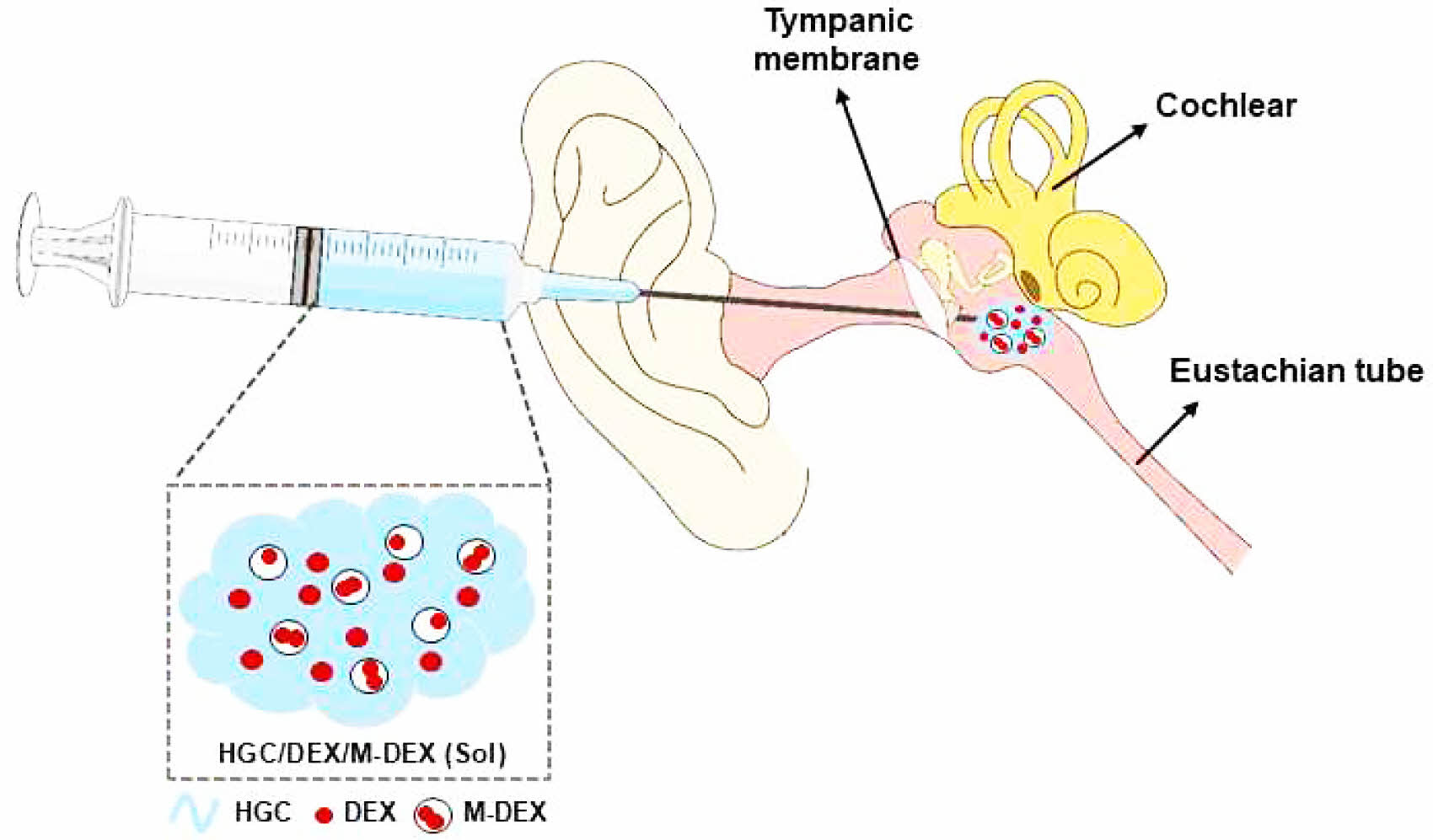
본 연구에서는 기존 써모젤로는 구현하기 어려웠던 서방형 방출제어가 가능한 주입형 써모젤 제형을 생분해성 PLGA 미립구 제형과의 하이브리드화를 통해 개발하였다. 아실 글리콜 키토산 써모젤의 한 종류인 헥사노일 글리콜 키토산(hexanoyl glycol chitosan, HGC)을 합성하여, 생분해성 (PLGA) 미립구와의 물리적 혼합을 통해 주입형 하이브리드 제형을 제조하였고, 물리화학적 및 방출제어 특성을 평가하였다. 내이 질환 치료를 위해 소수성 항염증제 약물로 덱사메타손을 모델 약물로 함유한 써모젤/미립구 하이브리드 제형을 제조하여(Scheme 1), 온도감응성, 점탄성, 생분해성 및 in vitro 약물 방출 거동을 비교 평가하였다.
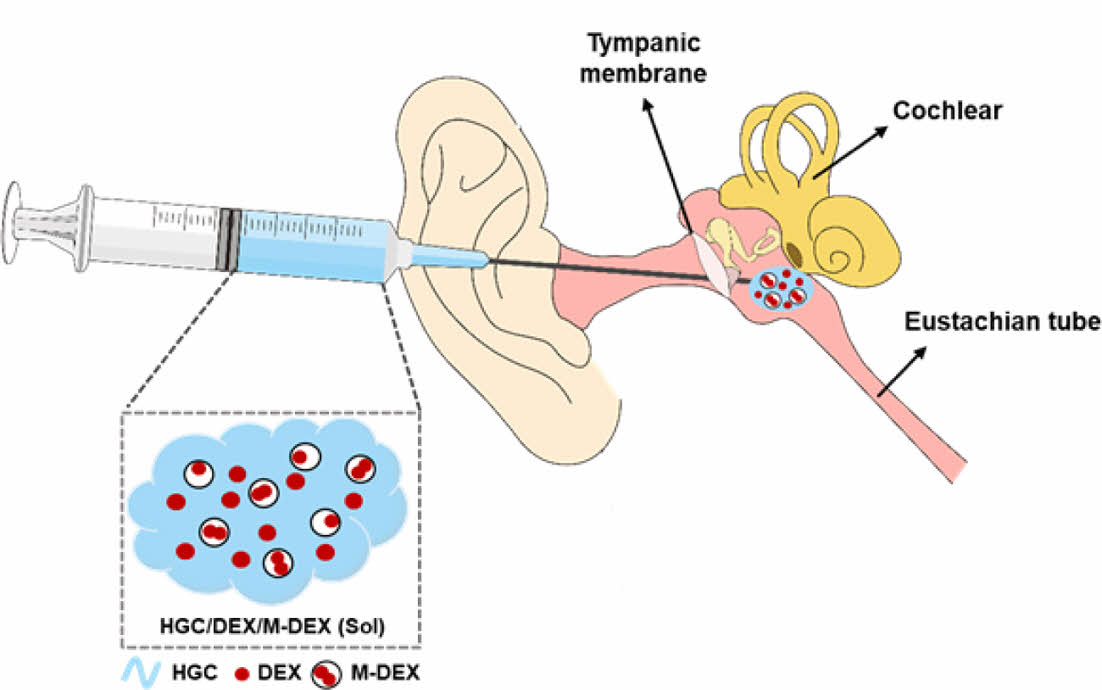
Scheme 1. Scheme for an injectable thermogel/microsphere hybrid formulation for inner ear drug delivery via intratympanic injection.
재료. 본 연구에서 글리콜 키토산(GC, DP≥200)은 Wako Pure Chemical Industries, Ltd.(일본)에서, hexanoic anhydride (>95%)는 Sigma-Aldrich(인도)에서 구입하여 사용하였다. 용매로는 3차 증류수와 메탄올(삼전화학, 한국)을 사용하였으며, 침전을 위한 용매로 아세톤(삼전화학, 한국)을 사용하였다. 투석막(molecular weight cut-off: 12-14 kDa)은 Spectrum Laboratories(미국) 제품을 사용하였다. Deuterium oxide(D2O) 및 Dulbeccos’ Phosphate Buffered Saline(PBS)는 Sigma-Aldrich(미국) 제품을 사용하였다. 약물인 덱사메타손(dexamethasone, DEX)은 Farmabios(이탈리아) 제품을 사용하였으며, 덱사메타손 인산이나트륨염(dexamethasone phosphaste disodium salt, DSP)은 Steraloids(미국) 제품을 사용하였다. 미립구 제조에 사용된 PLGA는 Evonik Operations GmbH(독일)에서 ResomerTM RG 502H(lactide:glycolide= 50:50, Mw 7000-17000 g/mol) 제품을 구입하여 사용하였다. Dichloromethane은 J.T. Baker(미국)에서 구입하였으며, poly(vinyl alcohol)(PVA)는 Mitsubishi Chemical Corporation (일본)에서 구입하여 사용하였다.
HGC의 합성 및 분석. 글리콜 키토산(GC) 3 g을 3차 증류수와 메탄올의 1:1 혼합용매 750 mL에 녹인 후, 1.1 mL의 hexanoic anhydride를 첨가하여 24시간 동안 실온에서 교반 하에 반응시켰다. 반응 용액을 아세톤에 침전시킨 후, 침전된 HGC를 필터하여 분리하였다. 이를 투석막(MWCO, 12-14 kDa)을 이용하여 2일 동안 3차 증류수에 투석하면서 잔류 용매와 미반응물을 제거한 후 동결 건조를 통해 파우더 형태의 HGC를 얻었다. HGC의 합성 과정을 Scheme 2에 나타내었다. 합성된 HGC는 1H NMR 분석을 통해 화학적 조성 분석을 수행하였다. 샘플을 D2O 용매에 0.5 wt%로 용해시킨 후 600 MHz NMR(AVANCE III 600 spectrometer, Bruck사, 독일)을 사용하여 1H NMR 스펙트럼을 얻었다. 또한 Nicolet iS 5(Thermo Scientific, 미국) 기기를 이용하여 파우더 형태의 고분자 샘플의 ATR-FTIR 스펙트럼을 분석하였다. 4000-750 cm-1 주파수 범위에서 4 cm-1의 분해능, 32회 스캔을 통해 측정하였다.27
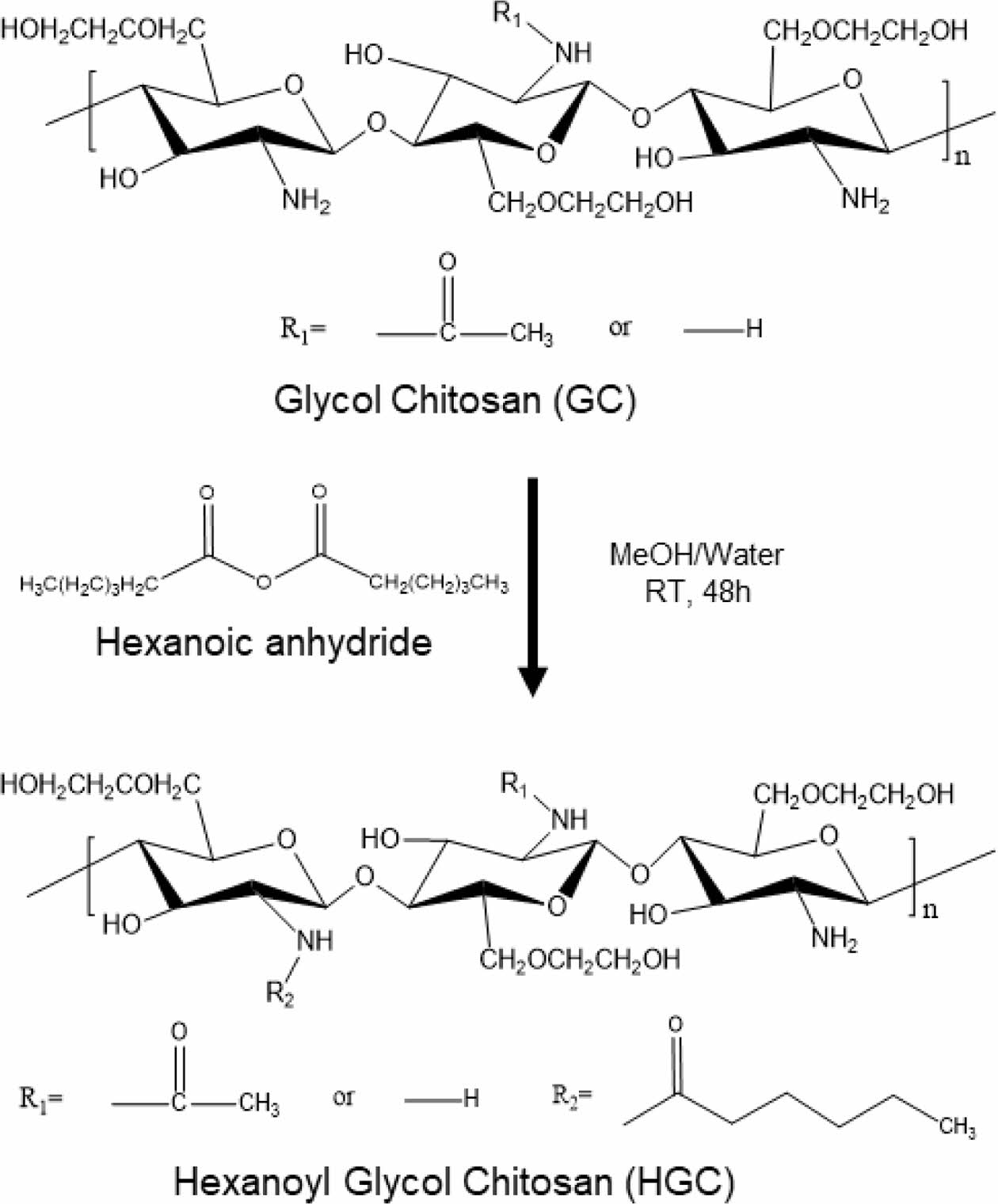
Scheme 2. Synthetic procedure of hexanoyl glycol chitosan (HGC).
덱사메타손(DEX) 봉입 미립구(M-DEX) 제조. 약물을 봉입한 미립구(M-DEX)는 막유화법을 통해 제조하였다(Scheme 3). 미립구 제조에는 chamber, paddle blade stirrer 및 micropore membrane으로 구성된 막유화장치(Model: LDC-1, Micropore technologies, 영국)를 사용하였으며, 제조 방법은 다음과 같다. 미리 칭량한 고분자를 다이클로로메테인에 충분한 시간동안 용해시킨 후, DEX를 현탁시켜 분산상을 제조하였다. 제조한 분산상을 폴리프로필렌 주사기에 옮겨 담고 주사기 펌프에 설치한 후, 주사기를 폴리테트라플루오로에틸렌(PTFE) 재질의 튜빙을 사용하여 막유화장치의 분산상 주입부와 연결하였다. 이후 연속상인 PVA 수용액(0.5% w/w)을 chamber에 적당량 공급하고, paddle blade stirrer 교반과 함께 분산상을 주입하여 에멀젼을 형성시킨다. 분산상 주입이 종료되면 형성된 에멀젼을 연속상과 함께 water circulation bath가 연결된 이중 자켓 비커에 옮겨 담고, 25 oC에서 30분 간 200 rpm으로 교반하여 안정화시킨다. 이 후 이중 자켓 비커를 45 oC로 가온하여 3시간 동안 유기용매를 제거한 뒤 25 oC로 다시 온도를 낮춘 다음, 고형화된 미립구를 증류수로 수회 반복 세척하고 20 μm pore mesh로 회수하였다. 회수한 미립구는 동결 건조하여 사용하기 전까지 냉장 상태(4 oC)에서 보관하였다.
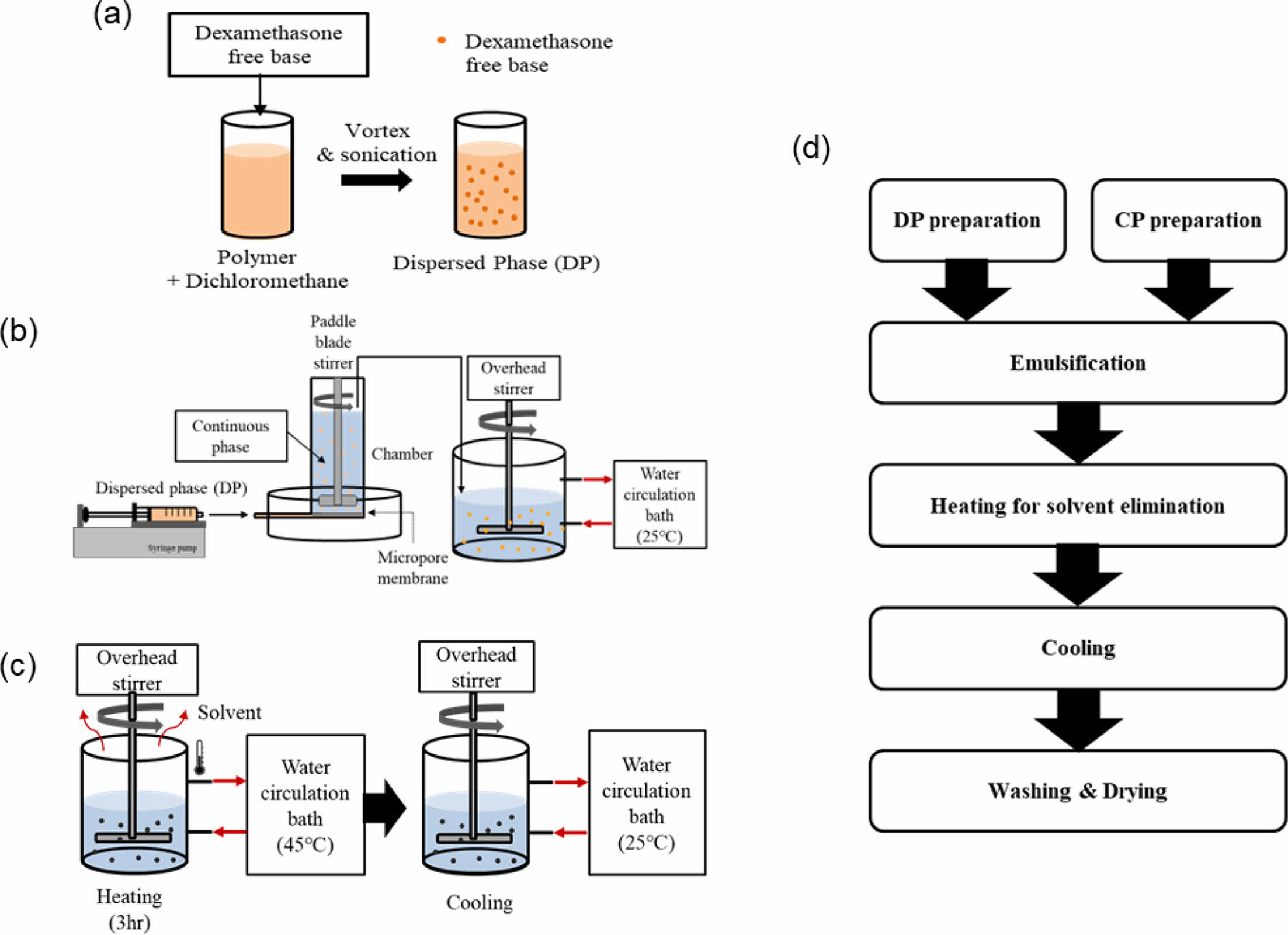
Scheme 3. (a) Dispersed phase (DP) preparation process; (b) emulsification process by membrane emulsification techniques; (c) hardening process; (d) flow diagram preparation of dexamethasone-loaded microspheres.
미립구 내 약물의 함량 및 봉입 효율 분석. 10 mg의 DEX를 1 mL DMSO에 넣어 녹인 후 50% acetonitrile(ACN)으로 희석한 것을 표준액으로 하고, 10 mg의 미립구를 1 mL DMSO에 넣어 녹이고 50% ACN으로 1250배 희석한 것을 검액으로 하여 3회 반복 측정하였다(미립구 기준 8 ppm). 이동상으로는 50% ACN을 사용하였으며, DEX의 함량 및 미립구 봉입효율은 HPLC(Model: CM5000, Hitachi, 일본)를 사용하여 254 nm에서 DEX의 흡광도를 측정하여 확인하였다. 미립구의 양 또는 미립구 제조에 사용한 DEX의 양을 검출된 약물의 양과 비교하여 다음과 같은 공식에 따라 함량 및 봉입 효율(EE, encapsulation efficiency)을 계산하였다.

미립구 입도 분석. 입자의 크기 및 분산은 레이저 입도 분산기(Model: PSA 990, Anton paar, 오스트리아)를 사용하여 측정하였다. 약 70 mg의 미립구를 9% Tween 20 수용액 1 mL에 분산시킨 다음, 분산액을 약 300 mL의 초순수가 포함된 레이저 입도 분석장치에 넣고 1분간 습식 측정하였다. 미립구의 입도 균일성은 다음과 같은 공식에 따라 계산하여 스팬값(span value)으로 나타내었다.

미립구의 모폴로지 분석 및 분해 거동 분석. 제조한 미립구의 크기와 형태를 SEM(Model: EM-30, Coxem, 한국)을 사용하여 확인하였다. SEM 이미지를 촬영하기 위하여 금속판 위에 카본 테이프를 붙인 후, 샘플을 소량 올려 고정시킨 다음 이온 코팅기(Model: SPT-20, Coxem, 한국)를 사용하여 5 mA로 5분간 플라즈마 코팅하여 시료를 준비하였다. 코팅이 완료된 시료는 전자현미경을 사용하여 10 kV에서 500 및 2000 배율로 관찰하였다. 또한, 미립구의 분해 거동을 확인하기 위하여 미립구 10 mg을 PBS(pH 7.4) 40 mL에 넣은 후 37 oC로 유지하며 28일 간 미립구를 회수 및 동결 건조하여 SEM을 통해 분해 정도를 관찰하였다.
써모젤 및 하이브리드 제형 제조. DEX 약물을 함유한 온도감응성 써모젤 제형(HGC/DEX), DEX 봉입 PLGA 미립구(M-DEX)를 함유한 하이브리드 제형(HGC/M-DEX), DEX 함유 써모젤과 M-DEX의 혼합에 의한 하이브리드 제형(HGC/DEX/M-DEX)을 각각 제조하였다(Table 1). PBS를 용매로 사용하여 모든 샘플은 HGC가 3 wt%, 약물의 농도가 2 wt%가 되도록 제조하였다. 하이브리드 제형인 HGC/DEX/M-DEX는 HGC 30 mg, DEX 10 mg 및 약물 함량이 33.3%인 M-DEX 30 mg(약물 함유량 10 mg)을 PBS에 녹여 샘플을 제조하였다. 또한 하이브리드 제형과 비교를 위해 같은 양의 약물을 함유한 써모젤(HGC/DEX)과 M-DEX 단독 제형들도 각각 같은 약물 농도로 제조하였다. 미립구가 존재하지 않는 HGC/DEX 제형은 HGC 30 mg와 DEX 20 mg을 분산시켜 제조하였고, HGC에 미립구만 넣어준 HGC/M-DEX 제형은 HGC 30 mg을 1 mL의 PBS에 녹인 후, HGC 수용액에 M-DEX 60 mg을 균일하게 분산시켜 제조하였다. 모든 제조된 제형 샘플들은 사용 전까지 4 oC 냉장고에서 보관하였다.
SEM 형태 분석. 약물이 함유된 써모젤 및 하이브리드 제형의 모폴로지 분석을 위한 제형의 단면과 내부를 SEM 분석을 통해 관찰하였다. 제조된 써모젤 제형들을 37 oC에서 1시간 동안 유지시켜 젤화상태에서 액체질소를 이용하여 급냉시킨 후, 3일간 동결 건조시켰다. 준비된 시료를 30초 동안 백금 코팅하고, 장방출 주사 전자 현미경(FE-SEM, S-4800, Hitachi, 일본)을 이용하여 하이브리드 제형의 모폴로지 특성과 약물 또는 미립구의 존재 및 분산 상태를 관찰하였다.
졸-젤 상전이 온도 측정. Tube-tilting 방법을 통해 합성된 써모젤과 하이브리드 제형의 졸-젤 온도를 측정하였다. 졸-젤 상전이 온도는 0.5 oC/min의 속도로 승온하면서 바이알을 기울였을 때, 30초 동안 흐름이 관찰되지 않을 때의 온도를 기준으로 측정하였다. Tube-tilting 방법을 사용하여 얻은 졸-젤 상전이 온도는 ±1 oC의 오차를 갖는 것으로 알려져 있다.
유변학적 특성 평가. 레오미터로 점도의 변화를 관찰하여 유변학적 특성을 분석하였다. 기기는 온도조절기가 장착된 티타늄 평형 플레이트(40 mm) 형태인 HR-10 Rheometer(TA Instruments, New Castle, DE, 미국)를 사용하여 측정하였다. 측정하고자 하는 고분자 수용액을 플레이트 사이에 위치시키고 플레이트 간격을 1.0 mm로 맞춘 다음 승온 속도 0.05 oC/min, 온도 범위 10-45 oC에서 진동수를 1 Hz로 고정하고 10 Pa의 일정한 힘으로 측정하였다. 또한 써모젤의 주입형 제형에 적합한 shear-thinning 거동 분석을 위해 shear strain을 0.1-100 s-1까지 변화시키면서 25 oC에서 점도 변화를 관찰하였다. thixotropic 거동 분석을 위한 rotational recoveries test는 200초 동안의 0에 가까운 낮은 전단 속도와 100초 동안의 높은 전단 속도를 반복적으로 적용하여 써모젤의 점도 회복 거동을 측정하였다. HGC의 강도는 frequency sweep test(0.3% strain, 0.1-10 rad/s frequency)를 통해 결정하였다.
젤 안정성 및 생분해성 평가. 젤 안정성과 생분해성 평가를 위한 조건은 보고된 문헌을 참고하여 수행하였다.28,29 0.5 mL의 써모젤을 5 mL 바이알에 준비하여 37 oC로 유지된 항온 수조 내에 정치하였다. 1시간 후 같은 온도의 PBS 2 mL을 분주된 바이알에 첨가하여 항온 수조에 정치하였으며, 일정한 시간 간격으로 PBS를 교환하였다. 24시간 마다 PBS를 교환하기 전 잔류하는 하이드로젤의 질량을 측정하여 처음 젤의 질량과 비교하여 백분율로 환산하였다. 생분해성 평가를 위해서 분해 효소인 리소자임(lysozyme)이 첨가된 PBS 용액에 써모젤 샘플을 넣고 37 oC로 유지된 항온 수조에서 시간에 따른 잔류 질량 변화를 측정하였다. 이때 샘플은 5 mL 바이알에 0.5 mL씩 준비하였다. 잔류 써모젤 무게(residual thermogel weight)를 다음 식을 이용하여 계산하였다.
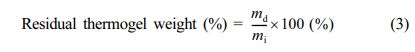
이 식에서 mi는 초기 써모젤의 무게이고, md는 시간에 따른 잔류 써모젤의 무게이다.
약물 방출 특성 분석. 약물 방출 평가를 위해 제조된 써모젤 및 하이브리드 제형 1 mL을 투석막(MWCO, 12-14 kDa)에 도입한 후, 50 mL의 PBS 용액을 함유한 conical tube에 넣었다. 37 oC, 100 rpm으로 설정한 항온조(LSB-130S, Lab Tech, 한국)에 conical tube를 넣고 방출 시험을 수행하였다. 정해진 시간 간격에 따라 투석막을 꺼내어 새로운 PBS 용액에 옮겨주었다. Conical tube에서 검액을 취해 UV-visible spectrophotometer(JASCO V-730, 일본)를 이용하여 242 nm에서 흡광도를 측정하여 약물의 누적 방출량을 산출하였다.
|
Table 1 Sol-Gel Transition Temperature of Thermogel Formulations |

a The sol-gel transition temperature determined by tube tilting method. |
HGC의 합성 및 분석. 온도감응성 하이드로젤인 HGC 써모젤은 Scheme 2에서와 같이 GC의 N-헥사노일화에 의해 합성하였다. 소수성 헥사노일기의 도입으로 HGC는 소수성 상호작용에 기반한 온도감응성 젤화 특성을 보이는 것으로 알려져 있다.18 합성된 HGC를 1H NMR과 ATR-FTIR 분석을 통해 화학적 조성을 확인하였다. Figure 1(a)에 GC와 HGC의 1H NMR 분석결과를 비교하였다. 용매로 사용된 D2O의 피크는 δ 4.8 ppm에서 관찰되며 이를 기준 피크로 사용하였다. δ 3.4-4.1 ppm에서 GC의 glucopyranosyl 고리 2번 수소부터 8번 수소까지의 특성 피크가 관찰되었다. 이에 더하여, HGC에서는 헥사노일기 도입에 따른 새로운 특성 피크가 δ 0.89 ppm(e)과 δ=1.3, 1.6, 2.3 ppm(a,b,c,d)에서 관찰되었고, 이는 헥사노일기의 메틸기와 메틸렌 피크에 각각 해당된다. 헥사노일기의 치환율(degree of hexanoylation, DH)은 glucopyranosyl 고리의 수소 피크 2-8과 헥사노일기 수소 피크의 적분값을 상대적으로 비교하여 계산하였다. 그 결과 DH가 39.12%인 HGC가 합성된 것을 확인하였다. HGC의 합성 결과는 또한 Figure 1(b)의 ATR-FTIR 분석결과를 통해서도 확인할 수 있었다. GC는 3350 cm-1 부근에서 -OH기의 신축 진동과 N-H의 신축 진동에 해당하는 피크가 겹쳐 나타났으며, 1586 cm-1 부근에 아민기의 N-H 피크가 관찰되었다. GC와 비교하여 HGC에서는 N-H 피크가 줄어들고, 1651 cm-1와1557 cm-1에서 HGC의 카보닐기 신축 진동과 amino acetyl group의 amide II 굽힘 진동에 상응하는 피크가 관찰되었다.
PLGA 미립구의 제조 및 분석. 막유화법을 사용하여 소수성 약물인 DEX를 봉입한 PLGA 미립구를 제조하였다(Scheme 3). 미립구 내 봉입된 DEX의 함량 및 봉입 효율을 HPLC를 통해 측정한 결과 약물의 함량은 33.3%이고, 봉입 효율은 83.3%로 계산되었다. 제조된 PLGA 미립구의 입도분석을 수행하였다. 본 연구에서는 주사 제형에 적합한 약 평균 50 μm 이하 크기의 균일한 미립구를 제조하고자 하였다. 레이저 입도 분석을 통해 제조한 미립구의 입도 분포를 확인한 결과, 입경이 작은 측으로부터의 체적 누적 50%에 상응하는 입경을 의미하는 평균 입도는 49.19 μm, 미립구의 입도 분포 정도를 나타내는 지표인 스팬값은 0.67로 목표로 하는 크기의 좁은 입도 분포를 가지는 미립구가 성공적으로 제조되었음을 확인하였다.
미립구의 모폴로지 분석 및 분해 거동 분석. SEM 관찰을 통해 DEX를 함유하는 미립구의 모폴로지 특성 및 수성 환경 하에서의 분해 거동을 관찰하였다(Figure 2). PLGA 미립구는 균일한 크기의 구형의 모양을 갖는 뚜렷한 마이크로 입자의 형태를 보였으며, 봉입된 약물의 입자가 미립구 표면에도 존재하는 것이 관찰될 수 있었다. 시간에 따른 생분해성 미립구의 가수분해 실험 결과, 7일 후에는 노출되어 있던 DEX가 사라지고 표면의 주름이 심화된 모습을 확인하였다. 14일 후에는 미립구 표면에 균열이 나타나기 시작하였고, 21일에서 28일까지 미립구의 표면 균열 및 분해 속도가 가속화되어 초기의 형태를 대부분 잃어버린 것으로 관찰되었다.
써모젤 및 하이브리드 제형의 제조 및 분석. HGC 써모젤, 약물 함유 HGC 써모젤(HGC/DEX) 제형, M-DEX 함유 써모젤 하이브리드 제형(HGC/M-DEX, HGC/DEX/M-DEX)을 각각 제조하여 SEM 분석을 통해 모폴로지 특성을 비교 분석하였다(Figure 3). HGC 써모젤은 하이드로젤 고유의 다공성 구조가 잘 관찰되었고, DEX 약물 함유 써모젤에서는 이러한 다공성 구조 표면에 미세한 약물 입자가 균일하게 분산되어 존재하고 있는 것을 관찰할 수 있었다. 한편, HGC/M-DEX와 HGC/DEX/M-DEX은 미세한 약물 입자의 분포에 더하여 표면과 단면에서 보여지듯이 다공성 망상 구조에 트랩되어 있는 미립구의 존재를 확인할 수 있었다.
유변학적 특성 평가. HGC 써모젤과 하이브리드 제형들의 온도감응성을 확인하기 위해 tube-tilting 방법과 레오미터를 통해 졸-젤 상전이 온도를 관찰한 결과를 Table 1에 나타내었다. HGC 써모젤과 모든 약물 함유 써모젤 및 하이브리드 제형들은 동일한 고분자 농도로 제조되었다. 약물을 함유하지 않은 HGC 써모젤의 경우 28 oC에서 졸-젤 상전이가 관찰된 반면, 약물이 함유된 써모젤과 하이브리드 제형들은 약간 낮은 24-26 oC에서 상전이가 관찰되었다. 이는 소수성인 약물과 PLGA 미립구의 도입으로 HGC 써모젤 구조 내 소수성 그룹 간의 상호작용이 보다 증진되어 온도감응 특성을 향상시킴으로서 더 낮은 온도에서 젤화가 관찰되는 것으로 사료된다. 보다 자세한 온도감응성 젤화 거동을 관찰하기 위해 레오미터를 이용하여 HGC, HGC/DEX, HGC/M-DEX, HGC/DEX/M-DEX의 온도에 따른 유변학적 특성을 분석하였다(Figure 4). 온도 상승에 따른 저장 탄성률(storage modulus, G' )과 손실 탄성률(loss modulus, G'' )의 변화를 관찰한 결과, 초기 낮은 온도 범위에서는 G' 이 G'' 보다 상대적으로 낮은 값을 보이지만, 특정 온도 이상에서 급격히 증가하여 G'' 과 교차하였다. 졸-젤 상전이 온도에 해당하는 G'과 G'' 의 교차 온도는 (a) 28.1 oC, (b) 26.9 oC, (c) 26.0 oC, (d) 26.9 oC로 각각 측정되었다. HGC의 온도감응성에 더하여 주입형 제형에 적합한 특성으로서 shear strain이 증가할수록 점도가 감소하는 shear-thinning 거동을 관찰하였다. Figure 5(a)에서 나타난 것과 같이 HGC 하이드로젤은 25 oC에서 shear strain이 증가함에 따라 점도가 감소하는 shear-thinning 거동을 뚜렷이 보이는 것을 확인하였다. 또한 주입 후 높은 전단력의 빠른 회복 특성을 의미하는 thixotropic 거동 분석을 한 결과, Figure 5(b)에서 나타난 바와 같이 0에 가까운 낮은 전단 속도와 높은 전단 속도 하에서의 반복적인 회복시험을 통해, HGC 써모젤은 우수한 탄성 회복을 나타냄으로서, 주입형 써모젤 및 하이브리드 제형으로서 유동하게 적용될 수 있음을 확인하였다.
젤안정성 및 생분해성 평가. 플록사머와 같은 일반적인 합성고분자 기반의 써모젤은 젤 형성농도(20 wt%)가 높기 때문에 수성 환경하에서의 사용이 제한된다. Figure 6의 결과에서 보여주듯이 HGC 써모젤은 초기 팽윤에 의해 무게가 증가되었다가 시간이 지남에 따라 점차 감소하는 경향을 나타내었지만, 15일 경과 후에도 약 70% 이상의 잔류무게를 유지할 수 있음을 확인할 수 있었다. 고농도의 폴록사머 써모젤의 경우 수시간 안에 젤이 용해되어 잔류하는 써모젤이 관찰되지 않는 반면, HGC 써모젤은 상대적으로 매우 낮은 농도(3 wt%)에서도 보다 오랫동안 젤을 유지할 수 있다. 또한, 폴록사머 써모젤의 경우 분해성이 결여되어 있지만, HGC 써모젤은 천연 다당류 골격으로 생분해성에 용이한 특성을 갖는다. 시간에 따른 분해 거동을 관찰한 결과, HGC는 분해 효소인 리소자임의 존재 하에서 거의 하루 안에 분해가 될 수 있는 효과적인 생분해성을 갖는 것으로 관찰되었다. 결과적으로 HGC 써모젤은 높은 젤안정성과 생분해성을 가지는 생체재료로서 유용하게 이용될 수 있을 것이라고 기대된다.
약물 방출 특성. 약물 함유한 써모젤 및 하이브리드 제형들의 약물 방출 거동을 30일에 걸쳐 관찰하였다(Figure 7). 대조군으로 사용된 수용성 약물 DSP의 수용액 제형의 경우 수 시간 안에 약물 방출이 빠르게 완료된 것으로 관찰되었다. 반면, 소수성 약물인 DEX 대조군은 DSP에 비해 서방형 방출 형태를 보이지만, 방출제어에 의한 결과보다는 난용성에 기인한 용해도 한계로 나타난 결과로 사료된다. 써모젤 제형인 HGC/DEX은 소수성 DEX 대조군보다 효과적인 방출거동을 보이는데, 이는 HGC의 가용화 효과에 기인한다.19 하이브리드 제형인 HGC/M-DEX와 HGC/DEX/M-DEX의 방출 거동은 HGC/DEX와 비교하여 유사한 방출 속도로 한달 정도의 서방출 거동을 보인다. PLGA 미립구 제형은 안정적이고, 조절 가능한 방출 거동을 보일 수 있다는 점에서 약물의 농도에 의존하는 방출 속도를 갖는 HGC/DEX 제형보다 서방형 방출 제어에 보다 유용할 것으로 기대된다. 한편, PLGA 미립구 단독 제형인 M-DEX 제형의 경우 40일 이상에서도 지속적으로 방출이 지속되는 것으로 관찰되었다. 본 결과를 통해, 써모젤 제형과 미립구 제형의 물리적 혼합을 통한 하이브리드 제형은 미립구 제형의 도입으로 높은 약물 봉입 효율 및 향상된 방출제어와 같은 우수한 제형 특성 뿐 아니라, 그 조성 및 미립구의 생분해성 조절에 따라 약물의 방출 속도를 수 주에서 수 개월까지 조절 가능할 수 있을 것으로 기대된다.

|
Figure 1 (a) 1 H NMR; (b) ATR-FTIR characterization of GC and HGC. |

|
Figure 2 ime-dependent degradation of M-DEX observed by SEM at magnification 500× (left); 2000× (right). |

|
Figure 3 FE-SEM images of DEX, HGC, HGC/DEX, HGC/M-DEX and HGC/DEX/M-DEX. |

|
Figure 4 Temperature dependent rheological behavior of (a) HGC; (b) HGC/DEX; (c) HGC/M-DEX; (d) HGC/DEX/M-DEX. |

|
Figure 5 (a) Shear-thinning; (b) recovery behaviors of HGC thermgel. |

|
Figure 6 In vitro gel stability and enzymic degradation of HGC thermogel. |

|
Figure 7 In vitro drug release profiles of thermogel, microsphere, and their hybrid formulations. |
본 연구에서는 소수성 약물인 DEX의 고막 내 주입을 통한 효과적인 내이 약물전달시스템 개발을 위해 새로운 주입형 써모젤/미립구 하이브리드 제형을 개발하였다. 온도감응성 졸-젤 전이 특성을 가지는 HGC 써모젤을 합성하여 높은 젤 안정성과 주입형 제형으로서의 특성을 확인하였다. 소수성 약물 DEX를 봉입한 생분해성 PLGA 미립구를 제조하여 높은 약물 봉입율, 균일한 크기, 분해성 등을 관찰하였다. 써모젤과 미립구의 물리적 혼합에 의한 하이브리드 제형을 제조하고, 온도감응성, 유변학적 특성, 서방형 방출제어 특성을 관찰하였다. 제조된 하이브리드 제형은 써모젤의 특성(온도감응성, 주입형 제형 특성, 체내 체류시간 향상)과 생분해성 미립구의 특성(높은 약물봉입능, 서방형 방출제어 등)을 기반으로 덱사메타손과 같은 소수성 약물의 주입형 국소적 전달을 통한 서방형 방출제어에 매우 유용할 것으로 기대된다.
- 1. Hao, J.; Li, S. K. Inner Ear Drug Delivery: Recent Advances, Challenges, and Perspective. Eur. J. Pharm. Sci. 2019, 126, 82-92.
-

- 2. Paulson, D. P.; Abuzeid, W.; Jiang, H.; Oe, T.; O’Malley, B. W.; Li, D. A Novel Controlled Local Drug Delivery System for Inner Ear Disease. Laryngoscope 2008, 118, 706-711.
-

- 3. Pararas, E. E.; Borkholder, D. A.; Borenstein, J. T. Current Strategies for Drug Delivery to the Inner Ear. Acta Pharm. Sin. B 2012, 3, 86-96.
-

- 4. Salt, A. N.; Plontke, S. K. R. Local Inner-ear Drug Delivery and Pharmacokinetics. Drug Discov. Today 2005, 10, 1299-1306.
-

- 5. Kechai, N. E.; Agnely, F.; Mamelle, E.; Nguyen, Y.; Ferrary, E.; Bochot, A. Recent Advances in Local Drug Delivery to the Inner Ear. Bochot, Int. J. Pharm. 2015, 494, 83-101.
-

- 6. Creber, N. J.; Eastwood, H. T.; Hampson, A. J.; Tan, Justin.; O’Leary, S. J. Adjuvant Agents Enhance Round Window Membrane Permeability to Dexamethasone and Modulate Basal to Apical Cochlear Gradients. Eur. J. Pharm. Sci. 2019, 126, 69-81.
-

- 7. McCall, A. A.; Swan, E. E.; Borenstein, J. T.; Sewell, W. F.; Kujawa, S. G.; McKenna, M. J. Drug Delivery for Treatment of Inner Ear Disease: Current State of Knowledge. Ear Hear. 2010, 31, 156-165.
-

- 8. Szeto, B.; Chiang, H.; Valentini, C.; Yu, M.; Kysar, J. W.; Lalwani, A. K. Inner Ear Delivery: Challenges and Opportunities. Laryngoscope Investigative Otolaryngology 2020, 5, 122-131.
-

- 9. Patel, J.; Szczupak, M.; Rajguru, S.; Balaban, C.; Hoffer, M. E. Inner Ear Therapeutics: An Overview of Middle Ear Delivery. Front. Comput. Neurosci. 2019, 13, 261.
-

- 10. Sreenivas, S. A.; Pai, K. V. Thiolated Chitosans: Novel Polymers for Mucoadhesive Drug Delivery – A Review. Trop. J. Pharm. Res. 2008, 7, 1077-1088.
-

- 11. Mader, K.; Lehner, E.; Liebau, A.; Plontke, S. K. Controlled Drug Release to the Inner Ear: Concepts, Materials, Mechanisms, and Performance. Hear. Res. 2018, 368, 49-66.
-

- 12. Schuetz, Y. B.; Gurny, R.; Jordan, O. A Novel Thermoresponsive Hydrogel Based on Chitosan. Eur. J. Pharm. Biopharm. 2008, 68, 19-25.
-

- 13. Sun, K.; Raghavan, S. R. Thermogelling Aqueous Fluids Containing Low Concentrations of Pluronic F127 and Laponite Nanoparticles. Langmuir 2010, 26, 8015-8020.
-

- 14. Jeong, B.; Kim, S. W.; Bae, Y. H. Thermosensitive Sol-gel Reversible Hydrogels. Adv. Drug Deliv. Rev. 2012, 64, 154-162.
-

- 15. Dethe, M. R.; A, P.; Ahmed, H.; Agrawal, M.; Roy, U.; Alexander, A. PCL-PEG Copolymer Based Injectable Thermosensitive Hydrogels. J. Control. Release 2022, 343, 217-236.
-

- 16. Park, S. G.; Li, M. X.; Eom, J. H.; Suh, E. Y.; Cho, W. K.; Joung, Y. K.; Huh, K, M. Synthesis and Charaterization of Gallic Acid Conjugated Glycol Chitosans for Tissue Adhesive Applications. Polym. Korea 2021, 45, 372-379.
-

- 17. Lee, K. Y.; Ha, W. S.; Park, W. H. Blood Compatibility and Biodegradability of Partially N-acylated Chitosan Derivatives. Biomaterials 1995, 16, 1211-1216.
-

- 18. Cho, I. S.; Oh, H. M.; Cho, M. O.; Jang, B. S.; Cho, J. K.; Park, K. H.; Kang, S. W.; Huh, K. M. Synthesis and Characterization of Thiolated Hexanoyl Glycol Chitosan as a Mucoadhesive Thermogelling Polymer. Biomater. Res. 2018, 22, 30.
-

- 19. Yang, Y.; Kim, D. H.; Suh, E. Y.; Kwon, H. C.; Le, T. P.; Kim, Y.; Shin, S. A.; Park, Y. H.; Huh, K. M. Injectable Glycol Chitosan Thermogel Formulation for Efficient Inner Ear Drug Delivery. Carbohydr. Polym. 2022, 278, 118969.
-

- 20. Hoare, T. R.; Kohane, D. S. Hydrogels in Drug Delivery: Progress and Challenges. Polymer 2008, 49, 1993-2007.
-

- 21. Li, J.; Mooney, D. J. Designing Hydrogels for Controlled Drug Delivery. Nat. Rev. Mater. 2016, 1, 16071.
-

- 22. Dang, Q.; Liu, C.; Wang, Y.; Yan, J.; Wan, H.; Fan, B. Characterization and Biocompatibility of Injectable Microspheres-loaded Hydrogel for Methotrexate Delivery. Carbohydr. Polym. 2016, 136, 516-526.
-

- 23. Zheng, Y.; Cheng, Y.; Chen, J.; Ding, J.; Li, M.; Li, C.; Wang, J. C.; Chen, X. Injectable Hydrogel-Microsphere Construct with Sequential Degradation for Locally Synergistic Chemotherapy. ACS Appl. Mater. Interfaces 2017, 9, 3487-3496.
-

- 24. Yang, J. PLGA Microsphere/P(NIPAAm-co-AAm) Hydrogel Combination Systems for Drug Delivery. IOP Conf. Ser.: Mater. Sci. Eng. 2019, 504, 012013.
-

- 25. Ghitman, J.; Biru, E. I.; Stan, R.; Iovu, H. Review of Hybrid PLGA Nanoparticles: Future of Smart Drug Delivery and Theranostics Medicine. Mater. Des. 2020, 193, 108805.
-

- 26. Zhang, W.; Ning, C.; Xu, W.; Hu, H.; Li, M.; Zhao, G.; Ding, J.; Chen, X. Precision-guided Long-acting Analgesia by Gel-immobilized Bupivacaine-loaded Microsphere. Theranostics 2018, 8, 3331-3347.
-

- 27. Lee, E. J.; Kang, E.; Kang, S. W.; Huh, K. M. Thermo-irreversible Glycol Chitosan/hyaluronic Acid Blend Hydrogel for Injectable Tissue Engineering. Carbohydr. Polym. 2020, 244, 116432.
-

- 28. Kim, D. E.; Oh, H. M.; Kang, S. W.; Huh, K. M. Preparation and Characterization of Acyl Glycol Chitosan-Containing Poloxamer Gels. Polym. Korea 2017, 6, 1033-1040.
-

- 29. You, H. S.; Cho, M. O.; Cho, I. S.; Li, Z.; Kim, N. H.; Jang, M. K.; Kang, S. W.; Huh, K. M. Synthesis of N-Acetylated Glycol Chitosans and Their Thermo-sensitive Sol-Gel Transition Properties. Polym. Korea 2016, 40, 328-335.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(1): 16-25
Published online Jan 25, 2023
- 10.7317/pk.2023.47.1.16
- Received on Aug 13, 2022
- Revised on Oct 23, 2022
- Accepted on Oct 27, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Eunyoung Seol* , and Kang Moo Huh
-
Department of Polymer Science and Engineering, Chungnam National University, Daejeon 34134, Korea
*G2GBIO, Inc., Daejeon 34054, Korea - E-mail: eunyoung.seol@g2gbio.com, khuh@cnu.ac.kr
- ORCID:
0000-0002-3788-4722, 0000-0002-2406-6659









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.