- N-type Photoanodes for Photoelectrochemical Water Splitting Using a Newly Synthesized Conjugated Polymer as an Additive
Division of Chemical Engineering, Dongseo University, Busan 47011, Korea
*LSTME Busan, Busan 46742, Korea- 전도성 고분자를 첨가제로 사용한 광전기화학 물 분해용 n-type 광양극
동서대학교 화학공학부, *LSTME Busan
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
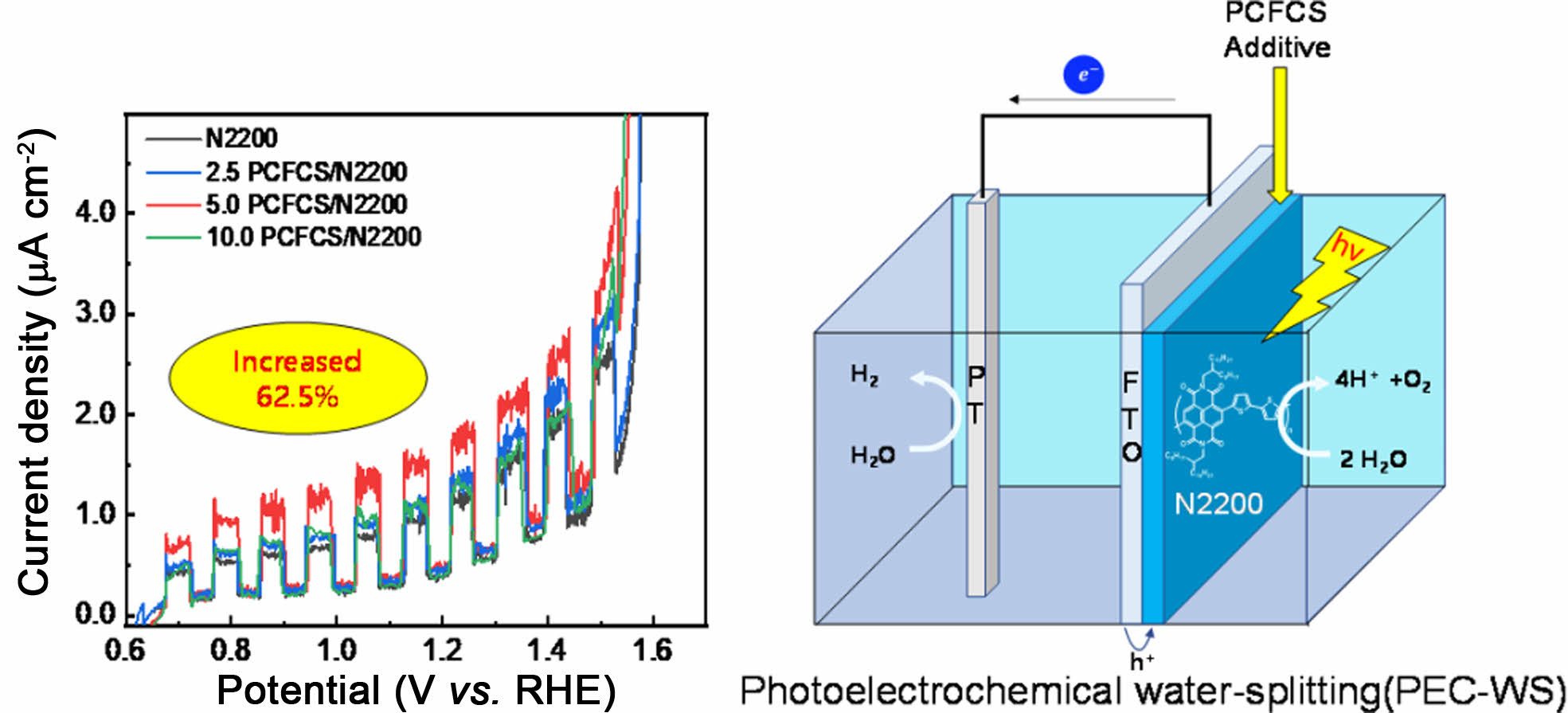
Replacing inorganic semiconductors with organic semiconductors for photoelectrochemical water-splitting (PEC-WS) has been challenging. In this study, a photoanode was fabricated by both n-type organic semiconductor, poly{[N,N'-bis(2-octyldodecyl)naphthalene-1,4,5,8-bis(dicarboximide)-2,6-diyl]-alt-5,5'-(2,2'-bithiophene)} (N2200) and a newly synthesized conjugated polymer, poly(4-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7-(4,4-dihexadecyl-6-(thiophen-2-yl)-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-5-fluorobenzo[c][1,2,5]thiadiazole) (PCFCS) as an additive and it has enhanced photocurrent density. Linear sweep voltammetry revealed that the addition of PCFCS (5.0 μg) increased the photocurrent density up to 62.5% (1.12 to 1.82 μA/cm2).
광전기화학 물 분해 시스템에서 사용하는 무기물질을 전도성 고분자로 직접 대체하여 유기광양극을 제조한 연구는 많이 진행되지 않았다. 따라서 본 연구는 광전류밀도를 증가시키기 위하여 n-type 유기반도체인 N2200과 신규 합성한 전도성 고분자인 PCFCS를 첨가제로 사용한 광양극을 제작하였다. 선형주사전위법으로 광전류밀도를 측정한 결과 PCFCS 첨가제를 포함하지 않은 광양극의 광전류밀도는 1.12 μA/cm2였다. 5.0 μg의 PCFCS를 N2200에 첨가제로 사용하였을 때 광전류밀도는 1.82 μA/cm2로 62.5% 증가한 값을 확인하였다.
A photoanode was fabricated both n-type organic semiconductor (N2200) and a newly synthesized conjugated polymer (PCFCS) as an additive to enhance the photocurrent density. Linear sweep voltammetry revealed that the addition of PCFCS (5.0 μg) increased the photocurrent density up to 62.5% (1.12 μA/cm2 to 1.82 μA/cm2).
Keywords: photoelectrochemical water splitting, conjugated polymer, additive, organic semiconductor, organic photoanode.
본 연구는 한국연구재단 이공분야기초연구사업-기본연구(NRF-2021R1F1A1051912)와 (NRF-2019R1F1A- 1043474)의해 지원되었고, 부산광역시 및 (재)부산인재평생교육진흥원의 BB21플러스 사업으로 지원되었음.
저자들은 이해상충이 없음을 선언합니다.
풍부하고 값이 저렴한 화석연료는 지구온난화와 같은 환경오염을 야기해왔다.1 심지어 화석연료는 점점 고갈되어가고 있기 때문에 화석에너지를 대체할 청정에너지의 개발은 반드시 필요하다.2,3 다양한 에너지원 가운데 수소는 환경오염 없이 전기를 생산할 수 있는 청정에너지원이다.4 수소는 탄화수소, 바이오매스, 물 등을 이용하여 생산할 수 있고, 물을 이용해 수소를 생산하는 방법에는 전기분해법, 열분해법, 그리고 빛을 이용하는 광전기화학 물 분해(photoelectrochemical water-splitting, PEC-WS)법 등이 있다.5
광전기화학 물 분해용 전극은 산/염기 전해질에서 높은 화학 안정성, 자외선과 가시광선에서의 적절한 전위차(2.1-3.3 eV)를 가지고 있고, 높은 태양-수소 변환효율(solar to hydrogen efficiency, STH)을 가지는 금속산화물과 같은 무기물질을 사용한다.6,7 광전기화학 물 분해 반응에서 n-type 금속산화물(TiO2, WO3, Fe2O3, BiVO4 등)은 빛을 흡수하여 정공을 만들고 정공은 계면으로 이동하여 물과 산화 반응을 일으킨 후 산소를 생성한다.8,9 또한 생성된 전자는 상대전극으로 이동해 물과 환원 반응을 일으켜 수소를 생산한다. 그러나 정공과 전자의 높은 재결합률(recombination rate), 낮은 전기전도도(electrical conductivity), 낮은 산소 발생반응(oxygen evolution reaction, OER)과 높은 소결(sintering) 온도는 금속산화물을 이용한 광전기화학 물 분해용 전극의 단점으로 지목되고 있다.10,11
전도성 고분자는 분자의 구조나 곁사슬을 제어하여 유기반도체의 결정성과 전기전도도 및 광학적 특성을 조절할 수 있기 때문에 광촉매로 사용하여 금속산화물의 단점을 보완할 수 있다.12-14 또한 전도성 고분자를 이용한 유기반도체는 저렴한 비용, 유연성, 용액 공정 처리의 용이함 등 다양한 장점을 가지고 있기 때문에 광전기화학 물 분해15,16 시스템뿐만 아니라 유기태양전지(organic photovoltaics,OPVs), 유기 전계효과 트랜지스터(organic field-effect transistor, OFETs)17 등 여러 분야에서도 사용한다. 유기반도체는 n-type, p-type, 양극성으로 나뉜다. N-type 유기반도체는 공기 중의 산소 및 수분 등에 의해 쉽게 산화되어 성능 저하로 이어지고, p-type 유기반도체에 비해 상대적으로 낮은 전하이동도를 보였기 때문에 지금까지 유기반도체 재료개발은 p-type 반도체가 n-type 반도체보다 더 많이 진행되었다.18-22 Naphthalenediimide(NDI),23 naphthodithiophenediimide(NDTI),24 isoindigo(IIG),25,26 diketo- pyrrolopyrrole(DPP)27 기반의 n-type 유기반도체가 개발되었고, 그 중 poly{[N,N'-bis(2-octyldodecyl)naphthalene-1,4,5,8-bis- (dicarboximide)-2,6-diyl]-alt-5,5'-(2,2'-bithiophene)}(N2200)은 대표적인 n-type 물질로써 전자를 잘 받아들일 수 있는 NDI구조를 가지고 있다. 또한 전자가 이동하기 쉬운 공액 구조를 가지고 있어 높은 전자이동도를 가진다.18,21,28 높은 전자이동도를 이용하여 N2200은 태양전지에서 전자수송층(electron-transporting layer)으로 사용된다.29,30 하지만, N2200은 높은 전자이동도에 비해서 상대적으로 매우 낮은 정공이동도가 보고되어 있다.23
본 실험에서는 광전기화학 물 분해에 사용하는 무기반도체를 대체하기 위해 N2200을 fluorine doped tin oxide(FTO) 유리 전극에 스핀 코팅하여 유기 고분자만 사용한 광양극을 제작하였고, 전도성 고분자 poly(4-(4,4-dihexadecyl-4H-cyclo- penta[1,2-b:5,4-b']dithiophen-2-yl)-7-(4,4-dihexadecyl-6-(thiophen-2-yl)-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-5-fluorobenzo[c][1,2,5]thiadiazole)(PCFCS)을 새롭게 합성하여 첨가제(additive)로 사용하였다. PCFCS는 전자공여체(donor)와 전자수용체(acceptor)로써 cyclopentaditiophene(CDT)과 5-fluorobenzo[c][1,2,5]thiadiazole(FBT)을 각각 교대로 사용하여 분자-분자 간 상호작용이 증가하는 푸시-풀(push-pull) 구조로 디자인하였다.31-34 또한 FBT의 불소(fluorine)와 CDT의 황(sulfur) 간의 비공유(non-covalent) 상호작용이 있고, 불소와 수소 사이에도 상호작용이 존재하기 때문에 구조적인 측면에서 편평한(planarity) 구조를 가지는 것으로 알려져 있다. 이러한 상호작용은 고분자 구조의 평면성을 향상시켜 π–π stacking을 높일 수 있다.35,36 이러한 분자구조 설계와 분자 간 상호작용은 정공의 이동도를 증가시킬 것으로 예상하였다. 신규로 합성한 PCFCS를 첨가제로 사용한 광양극은 첨가제로 사용하지 않은 광양극에 비해 광전류밀도(photocurrent density)가 62.5% 증가하는 결과를 보였다.
시약, 재료, 기기. 상업적으로 구매 가능한 반응 중간체 및 고분자 합성에 필요한 시약은 Sigma-Aldrich(St. Louis, Missouri, USA), Acros(Geel, Belgium), TCI(Tokyo, Japan), 그리고 Alfa Aesar(Ward Hill, Massachusetts, USA) 구매하였고, 추가 정제 없이 사용하였다. 그 중 반응 용매는 ACS 등급을 사용하였다. (4,4-dihexadecyl-4H-cyclopenta[1,2-b:5, 4-b']dithiophen-2-yl)trimethylstannane(M1)과 4,7-dibromo-5-fluorobenzo[c][1,2,5]thiadiazole(M2)은 문헌을 참고하여 각각 합성하였고37,38 2,5-bis(trimethylstannyl)thiophene(M3)은 Sigma-Aldich사에서 구매하였다. 4,9-Dibromo-2,7-bis(2-octyldodecyl)- benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetraone은 SunaTech Inc.(Jiangsu, China)에서 구매하였고, 추가 정제없이 사용하였다. 합성한 반응 중간체 및 고분자의 구조를 확인하기 위해 울산과학기술원 UCRF에 분석 의뢰하여 1H와 13C NMR을 400 MHz 퓨리에 변환 핵자기 공명 분광법(Fourier transform-nuclear magnetic resonance, FT-NMR) (AVANCE III HD, Bruker, USA)으로 측정하였다. 반응 중간체의 분자량은 말디토프 질량분석(MALDI-TOF MS)(Ultraflex III, Bruker, USA)을 사용하여 측정하였다. N2200과 PCFCS의 광학적 특성을 확인하기 위해 자외/가시광선 분광광도계(OPTIZEN POP, MECASYS, Korea)를 사용하였으며, chloro- form에 용해시킨 용액 상태와 석영판에 스핀코터(spin coater, EF-4op, 이플렉스, Korea)를 이용하여 코팅한 필름 상태를 각각 측정하였다. 고분자의 수 평균 분자량(Mn)과 다분산 지수(poly dispersity index, PDI)는 polystyrene을 기준으로 하고 tetrahydrofuran(THF)을 이동상으로 하여 젤 투과 크로마토그래피(gel permeation chromatography, GPC)(Agilent 1200S/miniDAWN TREOS, Agilent/Wyatt, USA)를 통해 측정하였다. 전기화학적 특성은 순환 전압전류법(cyclic voltammetry, CV)(Versa STAT3, AMETEK, USA)으로 측정하였다. 기준전극(Ag wire), 작업전극(탄소 디스크), 상대전극(백금선)으로 각각 사용하였으며, 스캔 속도는 100 mV/s로 측정하였다. 순환 전압전류법 측정을 위해 acetonitrile에 tetra-n-butylammonium hexafluorophosphate(n-Bu4NPF6)를 용해시켜 0.1 M의 전해질로 사용하였다. 기준전극(Ag wire)은 페로센/페로세늄(ferrocene/ferrocenium) 산화/환원 반응으로 교정하였고, 산화 전위는 진공수준일 때 -4.8 eV를 기준으로 설정하였다. 고분자의 highest occupied molecular orbital(HOMO)와 lowest unoccupied molecular orbital(LUMO) 준위는 HOMO(eV) = -(E(oxi)onset -E1/2 (Ferrocene) +4.8)와 LUMO(eV) = -(E(red)onset -E1/2(Ferrocene)+4.8) 의 식으로 각각 계산하였다. 고분자의 HOMO/LUMO 준위와 분자구조의 최적화를 확인하기 위해 밀도범함수 이론(density functional theory, DFT)(Gaussian 16W, Becke three-parameter Lee-Yang-Parr(B3LYP) function, 6-31G basis set)을 이용하여 계산하였다. 광양극의 광전류밀도 값 측정을 위해 Versa STAT3를 사용하여 측정하였고, AM(air mass) 1.5 솔라 시뮬레이터(PEC-L01, Peccell, Japan)로 태양광을 조사하였다.
중간체 및 고분자합성. 4,7-bis(4,4-dihexadecyl-4H-cyclo- penta[1,2-b:5,4-b']dithiophen-2-yl)-5-fluorobenzo[c][1,2,5]- thiadiazole (1)
M1(1.50 g, 1.90 mmol)과 M2(0.24 g, 0.76 mmol)를 anhydrous toluene(25 mL)에 완전히 용해시켰다. 혼합물이 들어있는 플라스크를 argon 분위기로 만든 후 bis(dibenzylideneacetone)- palladium(0)(13.27 mg, 23.0 μmol), tri(o-tolyl)phosphine(28.10 mg, 92.0 μmol)을 첨가하고 95 oC로 가열하며 하루 동안 교반하였다. 반응물은 온도를 상온으로 내린 후 증류수를 넣어서 반응을 종결하였다. 반응물은 chloroform을 이용하여 유기층을 추출하고 황산 마그네슘(MgSO4)을 이용하여 수분을 제거하였다. 감압여과장치를 이용하여 황산 마그네슘을 제거하고, 회전증발농축기(RE301, Yamato, Japan)를 이용하여 용매를 제거하고 진공오븐에서 완전히 건조하였다. 건조한 혼합물은 hexane과 chloroform을 사용한 실리카젤 칼럼 크로마토그래피(hexane과 chloroform의 부피 비: 100/0부터 95/5까지)로 분리 정제하여 화합물1을 0.70 g 얻었다(수득률: 66%). 1H NMR (CDCl3, 400 MHz) δ ppm 8.18 (s, 1H), 8.02 (s, 1H), 7.75 (d, J=13.6 Hz, 1H), 7.25 (d, J=4.8 Hz 1H), 7.23 (d, J=4.8 Hz, 1H), 6.98 (d, J=4.9 Hz, 2H), 1.96–1.84 (m, 8H), 1.33–1.14 (m, 104H), 1.07-0.99 (m, 8H), 0.87 (t, J=6.7 Hz, 12H). 13C NMR (CDCl3, 100 MHz) δ ppm 160.02, 159.48, 159.33, 159.22, 158.56, 157.51, 153.55, 153.44, 149.92, 140.29, 140.21, 140.06, 138.17, 136.87, 136.64, 133.15, 133.08, 126.52, 126.07, 125.73, 125.62, 124.56, 124.47, 122.75, 121.96, 115.41, 115.08 111.69, 111.54, 54.07, 53.95, 38.03, 32.15, 30.26, 29.91, 29.88, 29.83, 29.68, 29.61, 29.59, 24.82, 22.92, 14.35. MALDI-TOF m/z 1403.117 (C88H139FN2S5 calcd. for m/z 1402.953).
4,7-bis(6-bromo-4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-5-fluorobenzo[c][1,2,5]thiadiazole (2)
화합물1(4.20 g, 2.99 mmol)을 anhydrous THF(80 mL)에 완전히 용해시킨 후 n-bromosuccinimide(NBS)(1.17 g, 6.58 mmol)를 천천히 첨가하였다. 혼합물은 빛을 차단하여 24시간 동안 상온에서 반응시켰다. 반응물에 증류수를 넣고 반응을 종결한 후 methylene chloride를 이용하여 유기층을 분리하였다. 분리된 유기층은 황산마그네슘을 이용하여 수분을 제거하였고, 여과지를 이용하여 황산마그네슘을 제거한 후 회전증발농축기를 이용하여 유기용매를 제거하고 진공오븐에서 완전히 건조하였다. 건조한 혼합물은 hexane을 이용한 실리카젤 칼럼 크로마토그래피를 이용하여 분리 정제하여 3.50 g의 보라색 생성물을 얻었다(수득률: 75%). 1H NMR (CDCl3, 400 MHz) δ ppm 8.15 (s, 1H), 7.99 (s, 1H), 7.74 (d, J=13.5 Hz, 1H), 6.99 (s, 2H), 1.94-1.81 (m, 8H), 1.25-1.13p (m, 104H), 1.03-0.96 (m, 8H), 0.87 (t, J=6.7 Hz, 12H). 13C NMR (CDCl3, 100 MHz) δ ppm 159.99, 158.27, 158.04, 157.87, 157.64, 157.48, 153.37, 153.26, 149.76, 139.79, 139.71, 139.52, 138.62, 137.27, 137.03, 133.69, 133.62, 125.61, 125.50, 125.01, 124.38, 124.28, 122.53, 115.36, 115.04, 112.78, 112.24, 111.64, 111.49, 54.93, 54.83, 37.96, 32.16, 30.25, 29.94, 29.92, 29.89, 29.86, 29.60, 24.81, 22.93, 14.36. MALDI-TOF m/z 1561.987 (C88H137Br2FN2S5 calcd. for m/z 1560.772).
Poly(4-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithio- phen-2-yl)-7-(4,4-dihexadecyl-6-(thiophen-2-yl)-4H-cyclo- penta[1,2-b:5,4-b']dithiophen-2-yl)-5-fluorobenzo[c][1,2,5]- thiadiazole) (PCFCS).
화합물2(150 mg, 0.095 mmol), M3(38.9 mg, 0.095 mmol), bis(dibenzylideneacetone)dipalladium(0) (1.64 mg, 2.85 mmol)을 Schlenk flask에 넣고 anhydrous toluene(4 mL)에 완전히 용해시켰다. 혼합물은 argon 환경 내에서 tri(o-tolyl)phosphine (6.72 mg, 11.4 mmol)을 첨가하여 95 oC로 가열하며 교반을 진행하였다. 혼합물은 methanol(300 mL)에 침전시킨 후 마이크로 여과지를 이용하여 침전물을 분리하였다. 낮은 분자량과 불순물을 제거하기 위해서 속슬렛 추출(Soxhlet extraction)을 진행하였다. 속슬렛 추출은 methanol, acetone, 그리고 hexane에서 각각 24시간 동안 진행하였다. 이후 속슬렛 추출로 chloroform에 녹아 나온 용액을 농축한 후 methanol에 침전하여 여과지로 여과하고 진공오븐에서 건조하여 106.5 mg의 생성물을 얻었다(수득률: 71%). Mn=42.8 kDa, Mw=77.2 kDa, PDI=1.80. 1H NMR(CDCl3, 400 MHz, 348 K): δ ppm 8.20-8.14 (br, 1H), 8.06-7.97 (br, 1H), 7.79-7.73 (br, 1H), 7.13-7.04 (br, 2H), 6.80-6.70 (br, 2H), 2.06-1.99 (br, 8H), 1.42-1.15 (br, 112H), 0.91-0.79 (br, 12H).
광양극(Photoanode) 제작 및 측정.N2200/FTO, PCFCS/N2200 전극은 chlorobenzene 용매로 농도가 10 mg/mL인 N2200 용액을 만든 후 PCFCS를 각각 0, 2.5, 5.0, 10.0 μg을 넣고 완전히 용해시켰다. 용해된 각 농도의 용액을 FTO 유리 전극에 50 μL를 도포하고 3000 rpm으로 30초간 스핀 코팅하여 핫 플레이트(C-MAG HS7, IKA, Germany)에서 220 oC로 10분간 가열하였다. 고분자를 스핀 코팅한 FTO 유리 전극, Ag/AgCl 전극, 백금선은 각각 작업전극, 기준전극, 상대전극으로 사용하였다. 성능측정은 3전극을 pH가 13.6인 1 M 수산화나트륨(NaOH) 전해질에 넣어서 솔라 시뮬레이터를 이용하여 1 sun조건에서 빛을 조사하였을 때 생성되는 전류 값으로 측정하였다. ERHE는 Nernst방정식(ERHE =EAg/AgCl +0.0591×(pH)+0.1976 V)을 사용하여 계산하였다. J-V 곡선은 Versa STAT3기기에서 선형주사전위법을 사용하여 15 mV/s의 스캔 속도로 -0.5 V에서 0.8 V까지 측정하였다. 광전류 안정성 테스트는 Versa STAT3기기의 시간대전류법(chrono- amperometry)으로 AM 1.5에서 0.23 V의 고정 전위에서 생성된 광전류를 7분간 측정하였다. Mott-Schottky plot은 0.5 M 탄산나트륨(Na2CO3)이 포함된 pH 9.3의 붕산염 완충용액(borate buffer solution)에서 FTO 유리 전극, Ag/AgCl 전극, 백금선을 작업전극, 기준전극, 상대전극으로 이용한 3전극을 1000 Hz 조건으로 측정했으며, 전자수용체 밀도(donor density)를 계산하기 위해 다음과 같은 방정식으로 계산하였다.
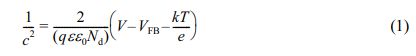
(C: 단위 면적당 커패시턴스(capacitance), q: 기본전하, ε: 계면 사이의 유전 상수, ε0: 진공 유전율, Nd: 전자수용체 밀도, V: 적용 전위, VFB: 플랫 밴드 전위, k: 볼츠만 상수, T: 온도)
중간체 및 고분자 합성. 반응 중간체 합성 및 고분자의 합성경로는 Scheme 1에 나타냈다. 자세한 합성과정은 실험부분의 2.2 고분자 및 중간체 합성에 정리하였다. M1과 M2를 2.5:1의 몰수비로 toluene에 녹여 팔라듐(Pd) 촉매 하에 Stille 크로스 커플링(Stille cross-coupling) 반응을 진행하여 수득률이 66%인 화합물1을 합성하였다. 화합물1, NBS, anhydrous THF를 사용하여 수득률이 75%인 보라색 화합물2를 합성하였다. 화합물2와 M3의 몰수비를 1:1 비율로 사용하고 팔라듐(Pd) 촉매 하에 Stille coupling 중합반응을 진행하여 71%의 수득률로 생성물 PCFCS를 합성하였다. N2200은 기존에 발표된 문헌을 참고하여 합성하였다.39 PCFCS와 N2200은 각각 선형과 가지형의 곁사슬이 치환되어 있어 chloroform, chlorobenzene 등의 유기 용매에 좋은 용해성을 보였다. 고분자의 중합도는 THF에 용해시켜 polystyrene을 기준으로 GPC를 측정하였다. PCFCS와 N2200의 Mn은 각각 42.8, 166.1 kg/mol이었고, PDI는 각각 1.80과 1.24였다. 합성한 중간체 및 고분자의 분자구조는 퓨리에 변환 핵 자기 공명 분광법(1H NMR, 13C NMR)으로 확인하였다.
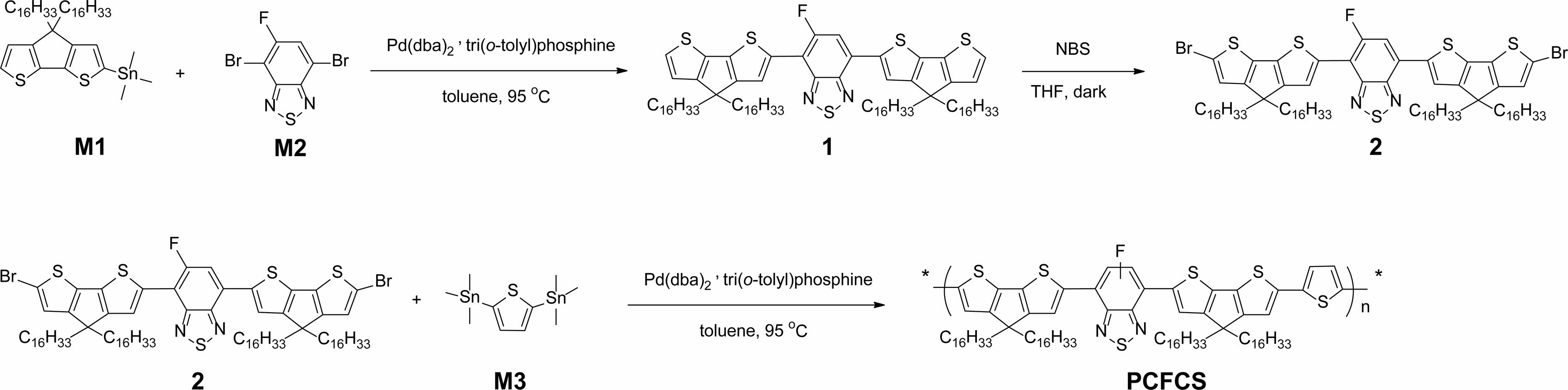
Scheme 1. Synthetic routes of PCFCS.
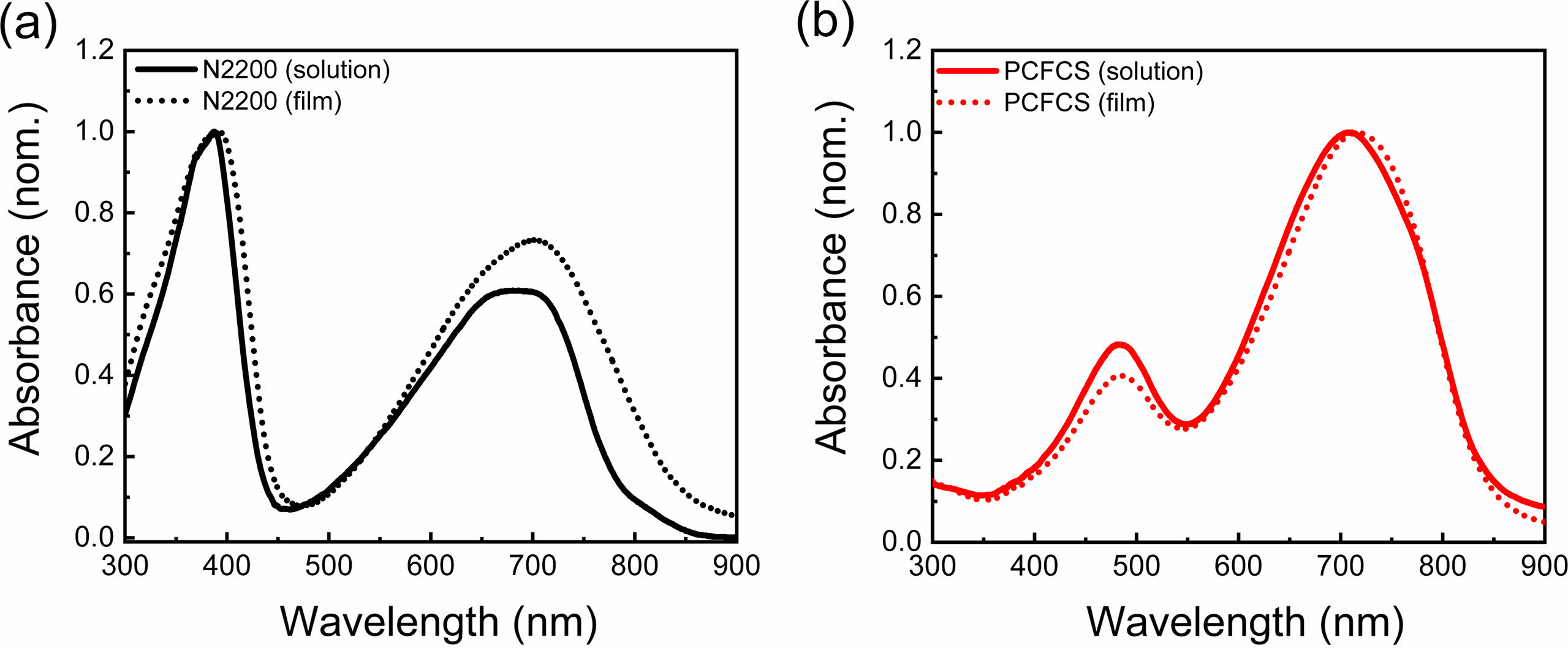
광학적 특성.N2200과 PCFCS의 광학적 특성을 확인하기 위해 자외/가시광선 분광광도계를 이용하여 chloroform에 녹인 용액 상태와 석영판에 스핀 코팅하여 제작한 필름 형태의 흡광도를 측정하였다. 측정한 그래프는 Figure 1에 나타내었다. 용액 상태는 전도성 고분자를 chloroform에 녹여 25 μg/mL로 측정하였고, 필름 상태는 chloroform에 전도성 고분자를 녹여 5 mg/mL 농도의 용액을 주사기와 주사기 필터(Ø30 mm, 0.45 μm)를 이용해 석영판에 도포한 후 3000 rpm으로 스핀 코팅하였다. N2200과 PCFCS의 최대 흡수파장(λmax)은 용액 상태에서 각각 387.5, 708.7 nm였고, 필름 상태에서 λmax는 392.3, 715.5 nm였다. PCFCS의 흡광도 그래프를 나타낸 Figure 1(b)에서는 용액 상태의 최대 흡수파장(708.7 nm)에서 필름에서의 λmax(715.5 nm)으로 적색 편이(red-shift)된 것을 확인할 수 있었다.40 이는 고체 상태에서 분자 간의 응집이 증가한 것을 나타내며, 분자 간의 강한 궤도결합을 유발하기 때문이다.41,42 광학적 전위차(optical band gap)는 PCFCS와 N2200 각각 1.44, 1.47 eV를 보였고, PCFCS와 N2200의 용액 상태와 필름 상태의 최대 흡수파장과 광학적 전위차는 Table 1에 정리하였다. PCFCS는 550-900 nm 파장에서 분자 내 전하 전달(intramolecular charge transfer)의 피크를 보였다. N2200은 π 궤도에서 π* 궤도로의 전하이동을 나타내는 피크가 300-450 nm 파장에서 나타났고, 분자 내 전하 전달 피크는 450-900 nm 파장에서 확인할 수 있었다.40,43-45 이는 전자수용체와 전자공여체가 반복되는 푸시–풀(push–pull) 구조의 특성을 보여준다.42
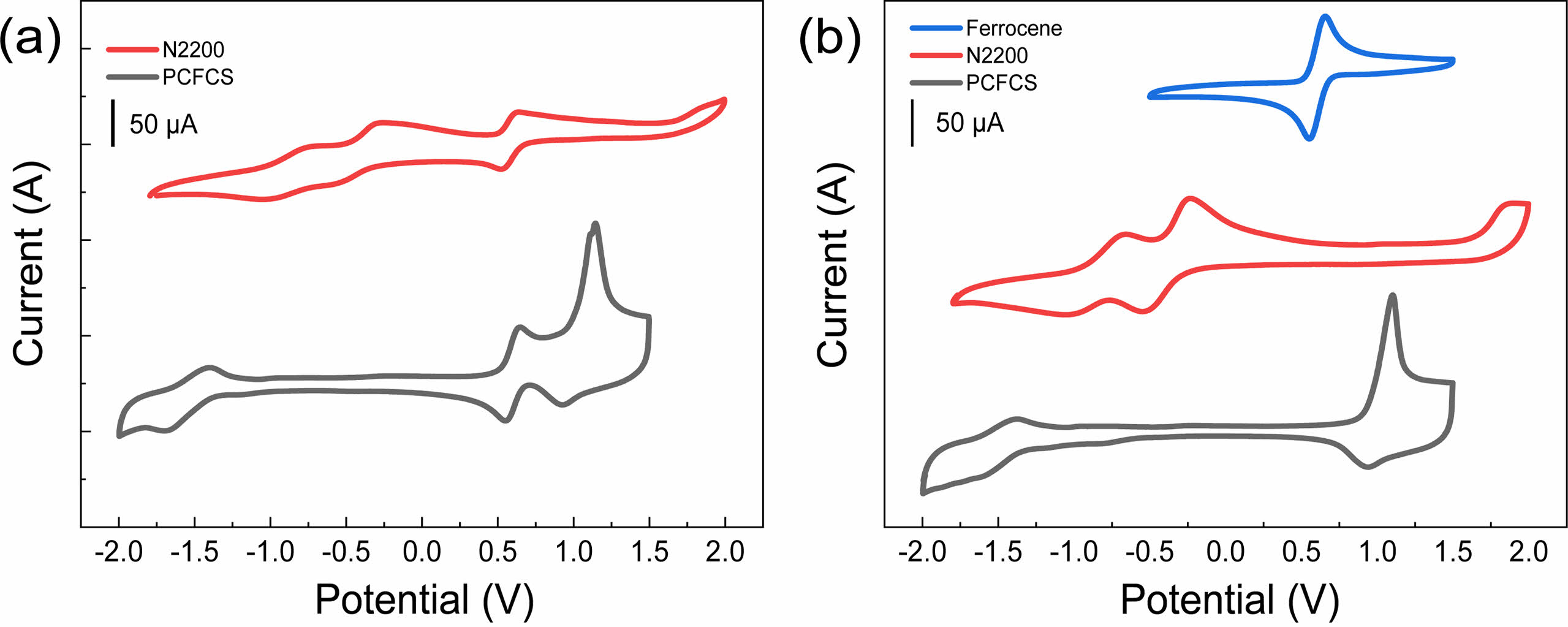
전기화학적 특성.PCFCS와 N2200의 전기화학적 특성을 확인하기 위해 순환 전압전류법을 이용하여 산화 전위와 환원 전위를 측정하였다. PCFCS와 N2200의 순환 전압전류곡선(cyclic voltammograms)은 Figure 2에 나타냈고, 각각의 HOMO, LUMO 준위는 Table 1에 정리하였다. 순환 전압전류곡선은 산화/환원 전위의 기준이 되는 물질인 ferrocene을 전해질에 넣어 고분자의 산화/환원 전위를 측정하는 internal standard method(Figure 2(a))와 ferrocene을 전해질에 넣지 않고 측정한 external standard method(Figure 2(b)) 모두 측정하였다. Internal standard method에서의 PCFCS와 N2200의 산화/환원 onset 전위는 1.00/-1.37 eV, 1.65/-0.29 eV이었고, external standard method에서 PCFCS와 N2200의 산화/환원 onset 전위는 0.93/-1.35 eV, 1.66/-0.26 eV이었다. 각 산화/환원 onset 전위 값을 이용한 HOMO, LUMO 준위는 HOMO 계산식((HOMO(eV)= -(E(oxi)onset-E1/2(Ferrocene) +4.8))과 LUMO계산식((LUMO(eV)= -(E(red)onset-E1/2(Ferrocene) +4.8))으로 구하였다. PCFCS의 internal standard method와 external standard method에서의 HOMO/LUMO 준위는 각각 -5.20/-2.83 eV, -5.12/-2.84 eV로 계산되었고, N2200의 internal standard method와 external standard method에서의 LUMO 준위는 각각 -3.92, -3.93 eV로 계산되었다. 이 결과는 기존에 보고된 논문과 일치하였다.28,40 PCFCS와 N2200의 internal standard method와 external standard method에서 각각의 HOMO, LUMO 준위는 거의 동일한 값을 보였다. 또한 PCFCS와 N2200의 전위차는 각각 1.95, 2.37 eV였고, N2200이 PCFCS보다 더 넓은 전위차를 가지고 있다. 광학적 특성에서 확인한 PCFCS와 N2200의 광학적 전위차는 각각 1.44, 1.47 eV였고, 전기화학적 특성에서 확인한 전위차와 광학적 전위차의 경향성이 일치함을 볼 수 있었다.
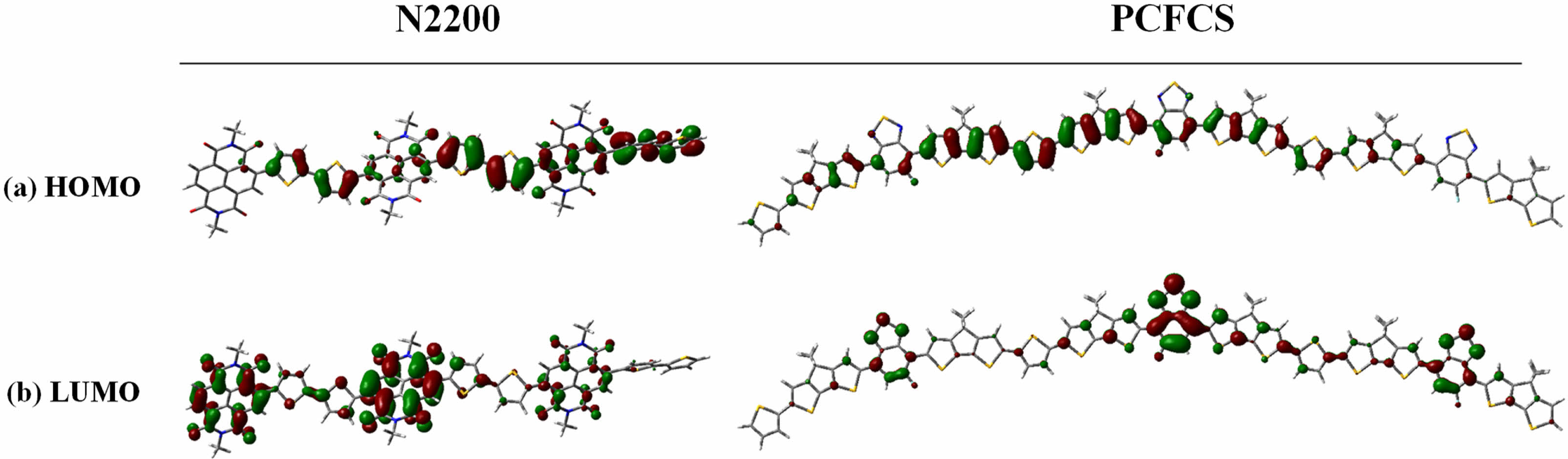
밀도범함수 이론(Density Functional Theory, DFT). N2200과 PCFCS의 바닥상태(ground state)에서의 전기적 특성과 분자 간 구조 최적화는 Gaussian 16W 프로그램의 DFT, B3LYP, 6-31G basis set으로 설정하여 계산하였다. 각 고분자의 DFT 계산결과에 있어 고분자의 선형과 가지형 곁사슬은 영향을 주지 않기 때문에 계산 시간을 줄이기 위해서 곁사슬은 메틸기로 치환하여 계산하였다. N2200과 PCFCS의 삼량체(trimer)의 HOMO와 LUMO에서 전하 밀도 분포(charge density distribution)와 최적화된 구조의 front view와 side view를 Figure 3과 Figure 4에 각각 나타내었다. PCFCS의 HOMO 전하 밀도 분포는 고분자 전체에 편재되어 있었고, LUMO의 전하 밀도 분포는 전자수용체인 FBT에 비편재화 되어있는 것을 확인하였다. N2200 또한 HOMO의 전자밀도는 고분자 전체에 편재화되어 있고, LUMO의 전자밀도는 전자수용체인 NDI 구조에 분포되어 있는 것을 확인할 수 있었다.
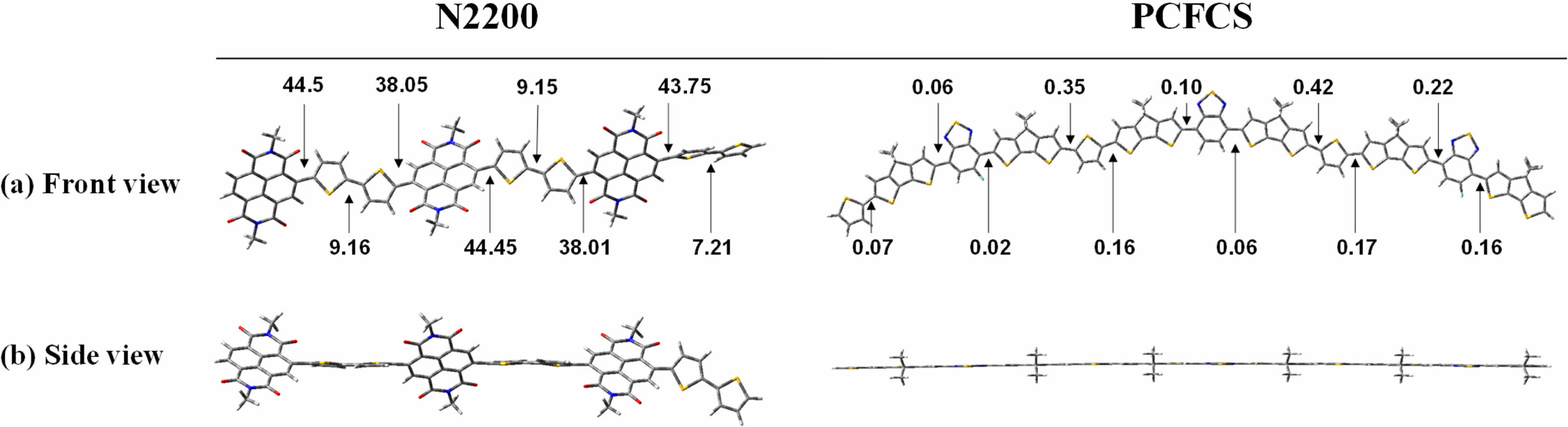
N2200과 PCFCS의 최적화된 구조에서의 비틀림 각도를 Figure 4에 나타내었다. N2200의 side view에서는 비틀림 각도가 38o 이상인 것을 확인할 수 있었고, PCFCS는 전자공여체와 전자수용체의 이면각이 거의 0o에 가까운 직선 형태인 것을 확인할 수 있었다(Figure 4(b)). PCFCS 의 편평한 구조는 전자공여체와 전자수용체 간의 F-S, H-F, H-N 비공유 상호작용과 π–π 궤도 간의 겹침에 의해서 나타난다.46-49 이러한 결과는 PCFCS가 조밀한 π–π stacking을 형성함으로써, 높은 전하이동도를 나타낼 것으로 예상된다.43
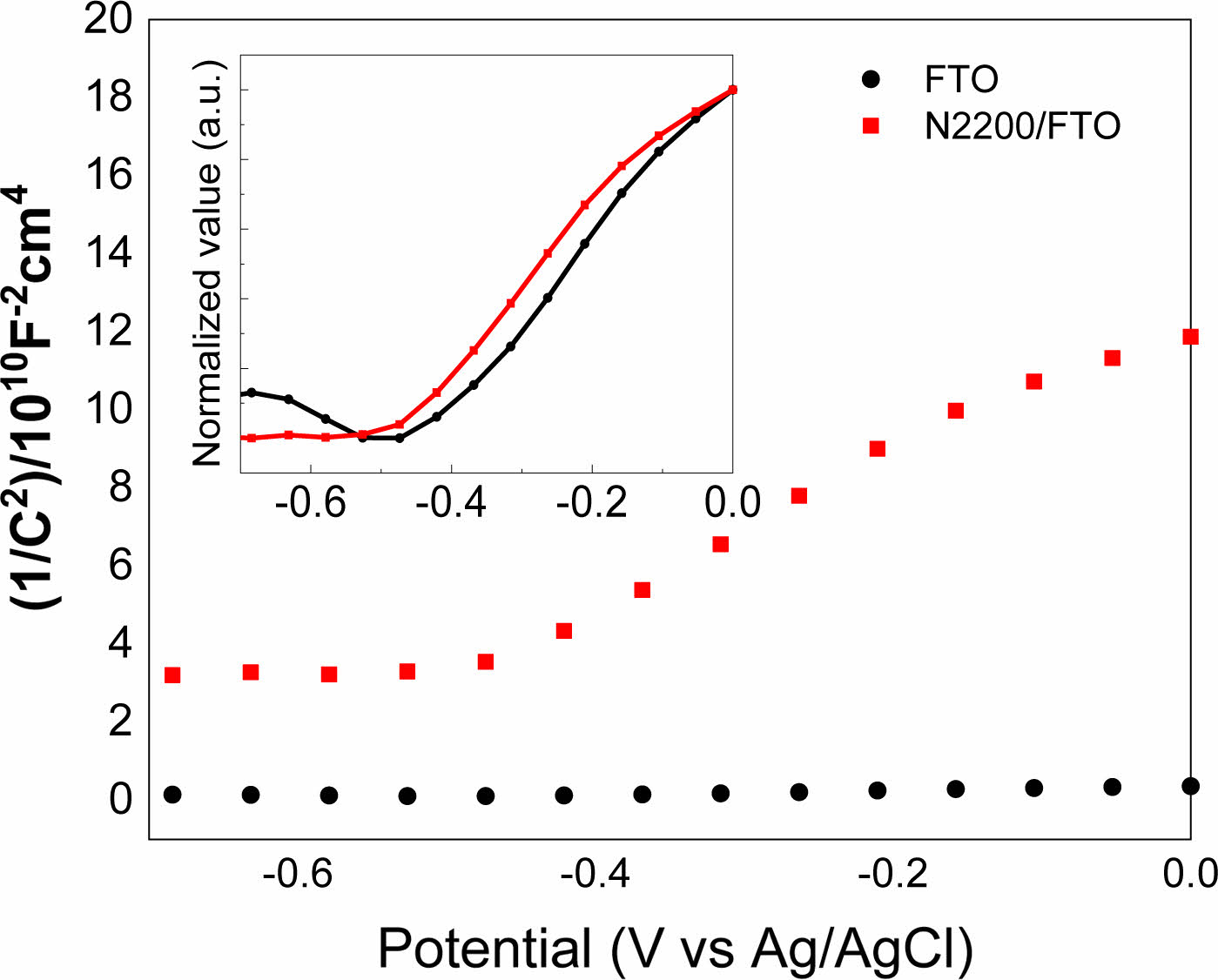
Mott-Schottky Plot.FTO 유리 전극 위에 N2200을 코팅한 후 전기화학적 특성을 확인하기 위해 Mott-Schottky plot을 측정하였고, Figure 5에 나타냈다. Mott-Schottky plot은 0.5 M 탄산나트륨이 포함된 pH 9.3의 붕산염 완충용액(borate buffer solution)에서 FTO 유리 전극, Ag/AgCl 전극, 백금선을 작업전극, 기준전극, 상대전극으로 이용한 3전극을 1000 Hz 조건으로 측정했으며, 전자수용체 밀도(donor density)를 계산하기 위해 방정식 (1)을 이용하여 계산하였다.
방정식에서 C 는 단위 면적당 커패시턴스(capacitance)를 나타내고, q는 기본전하, ε은 N2200(2.880) 및 FTO 유리 전극(2.133)에 대한 유전 상수,50 ε0는 진공 유전율, Nd는 전자수용체 밀도, V 는 적용 전위, VFB는 플랫 밴드 전위, k 는 볼츠만 상수, T는 온도를 나타낸다. 계산한 1/C2을 y축으로, x축을 potential로 설정한 Mott-Schottky 그래프에서 n-type 반도체는 양의 기울기를 나타내는 선형의 모양을 가진다. 그러므로 FTO 유리 전극에 N2200을 도포한 전극의 Mott-Schottky plot은 양의 기울기를 가지기 때문에 N2200이 n-type의 특성을 가지고 있음을 보여준다. FTO 유리 전극과 N2200을 FTO 유리에 도포한 전극의 flat band potential은 각각 -0.448, -0.508 V를 보였다. 또한 FTO 유리 전극과 N2200이 도포된 FTO 유리 전극의 전자밀도는 각각 2.80×1021 cm-3과 1.28×1020 cm-3이었다.
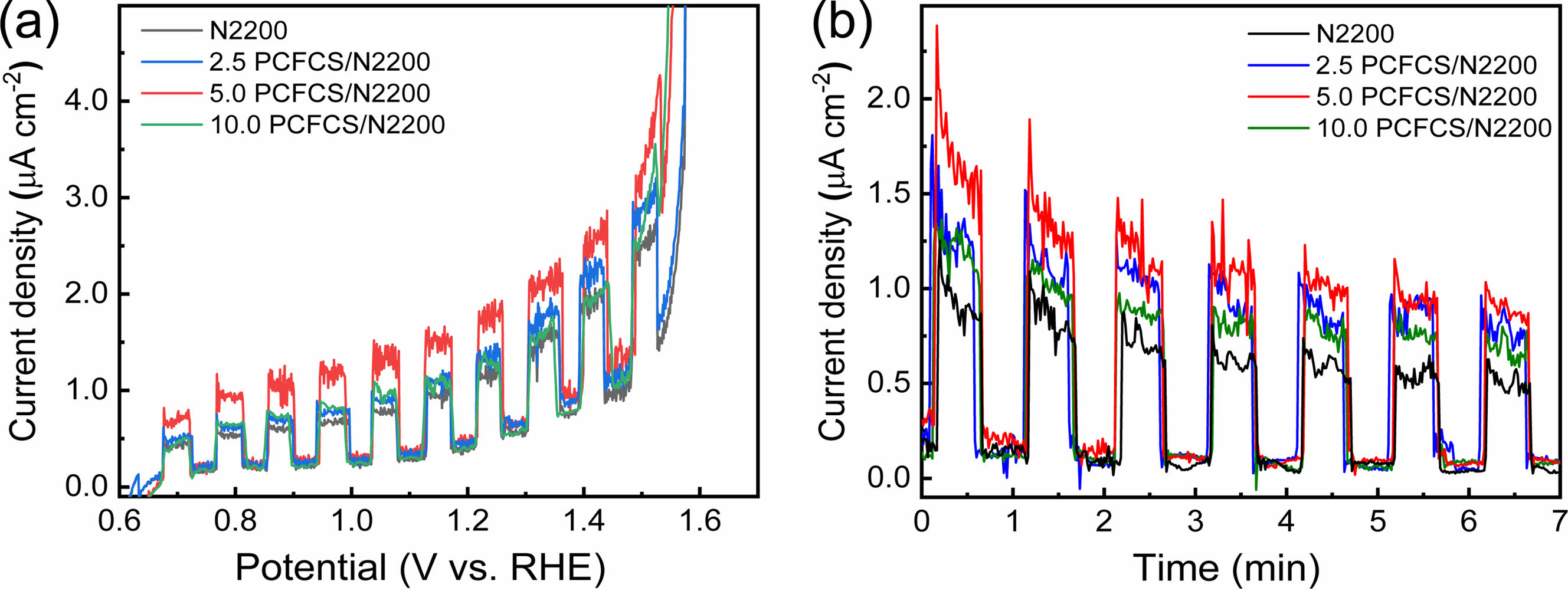
광전기화학 물 분해 효율 측정.PCFCS와 N2200에 대한 선형주사전위법의 측정에 있어서 N2200과 PCFCS/N2200 전극은 chlorobenzene을 용매로 이용하여 농도가 10 mg/mL인 N2200 용액을 만든 후 PCFCS를 각각 0, 2.5, 5.0, 10.0 μg을 넣고 5분간 교반하여 완전히 용해시켰다. 각 농도의 용액을 FTO 유리 전극에 50 μL를 도포하고 3000 rpm으로 30초간 스핀 코팅한 후 핫 플레이트에서 220 oC로 10분간 가열하여 제작하였다. 각 전극의 샘플명은 PCFCS가 첨가된 양에 따라 결정하였다. N2200, 2.5 PCFCS/N2200, 5.0 PCFCS/N2200, 10.0 PCFCS/N2200 전극은 고분자가 코팅된 FTO 유리 전극, Ag/AgCl 전극, 백금선을 각각 작업전극, 기준전극, 상대전극으로 사용하였다. 성능측정은 3전극을 pH가 13.6인 1 M 수산화나트륨 전해질에 넣어서 AM 1.5 솔라 시뮬레이터로 빛을 조사하였을 때 생성되는 전류 값을 측정하였다. 샘플에 대한 I-V 곡선의 모양은 Mott-Schottky plot에서 확인되는 광반응성을 가진 n-type 반도체와 일치하였다. 선형주사전위법을 이용하여 측정한 그래프는 Figure 6에서 나타냈고, 1.23 VRHE에서 측정한 N2200, 2.5 PCFCS/N2200, 5.0 PCFCS/N2200, 1.0 PCFCS/N2200 전극의 광전류밀도는 각각 1.12, 1.34, 1.82, 1.28 μA/cm2이었다. 5 μg의 PCFCS를 첨가제로 사용한 5.0 PCFCS/N2200의 광전류밀도 1.82 μA/cm2는 N2200만 사용한 전극의 광전류밀도 1.12 μA/cm2 보다 62.5% 더 높은 광전류밀도를 확인할 수 있었다. 이는 첨가제로 사용한 PCFCS로 인한 정공이동도의 증가와 빛에 의해 들뜬 전자–정공 쌍(electron–hole pairs, EHPs)의 재결합(charge recombination)을 감소시킨 것으로 보인다.9,51 그러나 PCFCS의 첨가제의 양이 5.0 μg 보다 적거나 많으면 광전류밀도가 감소하는 것을 확인하였다. 샘플의 안정성을 확인하기 위해 Figure 6(b)와 같이 1.23 VRHE의 고정 전압에서 시간에 따른 광전류밀도를 측정하였다. 모든 샘플의 초기 광전류밀도는 I-V 곡선의 광전류밀도와 일치하였다. 그러나 모든 전극은 알칼리 용액에서의 낮은 화학적 안정성과 광부식(photo-corrosion)으로 인해 광전류밀도가 감소하는 것을 확인하였다. 5.0 PCFCS/N2200의 광전류밀도는 7분 후 초기 값인 1.82 μA/cm2 보다 52.7% 감소한 값인 0.86 μA/cm2였다.
|
Figure 1 Optical properties of N2200 and PCFCS: UV-Vis spectrum of N2200 and PCFCS in (a) solution; (b) film, respectively. |
|
Figure 2 Electrochemical properties of N2200 and PCFCS: (a) internal; (b) external standard |
|
Figure 3 Calculated DFT-optimized geometries and charge–density isosurfaces for model trimer of N2200 and PCFCS; (a) HOMO and (b) LUMO levels |
|
Figure 4 (a) Front view; (b) side view of the DFT-optimized structures for model trimer of N2200 and PCFCS |
|
Figure 5 The Mott-Schottky plots of FTO glass and N2200/FTO. |
|
Figure 6 (a) Linear sweep voltammetry of N2200, 2.5 PCFCS/N2200, 5.0 PCFCS/N2200, and 10.0 PCFC/N2200 in 1 M NaOH electrolyte under 1 sun irradiation; (b) chronoamperometry of N2200, 2.5 PCFCS/N2200, 5.0 PCFCS/N2200, and 10.0 PCFCS/N2200 in 1 M NaOH electrolyte at 1.23 VRHE.; For samples of N2200, 2.5 PCFCS/N2200, 5.0 PCFCS/N2200, and 10.0 CFC/N2200 were added by 0 μg, 2.5 μg, 5.0 μg, and 10.0 μg of PCFCS additives to 10 mg/mL N2200 solution, respectively. |
|
Table 1 Optical and Electrochemical and Property of N2200 and PCFCS |
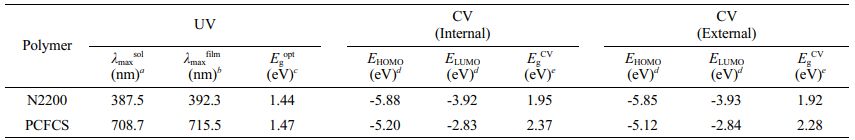
aChloroform Solution, bSpin-coated from Chloroform Solution, cCalculated from the Absorption Band Edge of the Polymer Film, Egopt=1240/λedgefilm, dCyclic Voltammetry Determined with (EHOMO=-(E(oxi)onset-E1/2(Ferrocene)+4.8 eV) and (ELUMO=-(E(red)onset-E1/2(Ferrocene)+4.8 eV), eEgCV=ELUMO-EHOMO. |
본 실험은 광전기화학 물 분해 시스템에서 사용하는 무기반도체를 대체하기 위해서 n-type 전도성 고분자인 N2200만을 도입한 광양극을 제작하였다. N2200 전극 내부의 정공이동도가 증가할 수 있게 디자인한 신규 전도성 고분자 PCFCS를 합성하여 첨가제로 사용한 광양극을 추가로 제작하였다. 광전극 제작에 사용한 N2200과 PCFCS의 광학적, 전기화학적 분석을 위해 자외/가시광선 분광광도계, 순환 전압전류법을 이용하였고, 분자구조의 최적화를 분석하기 위해 DFT계산을 하였다. N-type 반도체의 특징을 확인하기 위해 N2200필름으로 제작한 광양극은 Mott-Schottky plot, 선형주사전위법으로 전기화학적 분석을 사용하였고, 시간대전류법을 이용해 전해질에서의 낮은 화학적 안정성을 확인하였다. PCFCS에 의해 높아진 정공이동도는 광전기화학 물 분해 효율측정을 이용하여 간접적으로 확인하였다. 1 M 수산화나트륨 전해질에서 1.23 VRHE로 측정한 최적화된 광양극(5.0 PCFCS/N2200)의 광전류밀도는 1.82 μA/cm2였고, N2200 전극의 광전류밀도인 1.12 μA/cm2에 비해 62.5% 증가하였다. 본 연구는 광전기화학 물 분해 시스템에서 무기반도체를 대체할 수 있는 광양극의 개발 방법에 대한 가능성을 제안하며, 첨가제를 이용한 광전기화학 물 분해 성능의 향상 방법을 제시한다.
- 1. Perera, F. Pollution from Fossil-Fuel Combustion is the Leading Environmental Threat to Global Pediatric Health and Equity: Solutions Exist. Int. J. Environ. Res. Public Heal. 2018, 15, 1-17.
-

- 2. Bang, G.-W. Problems in Hydrogen Economy and the Need for the Development of New Energy Source. J. Korean Soc. Jungshin Sci. 2009, 13, 73-80.
- 3. Martins, F.; Felgueiras, C.; Smitkova, M.; Caetano, N. Analysis of Fossil Fuel Energy Consumption and Environmental Impacts in European Countries. Energies 2019, 12, 694-705.
-

- 4. Tarasco, J.-M.; Gratzel, M. Materials for Sustainable Energy; Dusastre, V., Ed.; Nature Publishing Croup: Singapole, 2011.
-

- 5. Ahmed, M.; Dincer, I. A Review on Photoelectrochemical Hydrogen Production Systems: Challenges and Future Directions. Int. J. Hydrogen Energy 2019, 44, 2474-2507.
-

- 6. Jang, Y. J.; Lee, J. S. Photoelectrochemical Water Splitting with P-Type Metal Oxide Semiconductor Photocathodes. ChemSusChem 2019, 12, 1835-1845.
-

- 7. Al-Resayes, S. I.; Chen, B.; Fu, L.; Fu, L.; Gao, L.; Ji, L.; Li, C.; Liu, X.; Liu, Z.; Nehdi, I. A.; Soltani, S.; Strunk, J.; Uchino, K.; Ree, T.; Wang, P.; Wang, J.; Wang, F.; Wang, Y.; Zhu, Y. Metal Oxides in Energy Technologies: Y. Wu; Amsterdam, Netherlands; 2018.
- 8. Yao, T.; An, X.; Han, H.; Chen, J. Q.; Li, C. Photoelectrocatalytic Materials for Solar Water Splitting. Adv. Energy Mater. 2018, 8, 1800210-1800246.
-

- 9. Steier, L.; Holliday, S. A Bright Outlook on Organic Photo- electrochemical Cells for Water Splitting. J. Mater. Chem. A 2018, 6, 21809-20826.
-

- 10. Barroso, M.; Pendlebury, S. R.; Cowan, A. J.; Durrant, J. R. Charge Carrier Trapping, Recombination and Transfer in Hematite (α-Fe2O3) Water Splitting Photoanodes. Chem. Sci. 2013, 4, 2724-2734.
-

- 11. Ahn, H. J.; Yoon, K. Y.; Kwak, M. J.; Jang, J. H. A Titanium-Doped SiOx Passivation Layer for Greatly Enhanced Performance of a Hematite-Based Photoelectrochemical System. Angew. Chem. Int. Ed. 2016, 55, 9922-9926.
-

- 12. Tsao, H. N.; Cho, D.; Andreasen, J. W.; Rouhanipour, A.; Breiby, D. W.; Pisula, W.; Müllen, K. The Influence of Morphology on High-Performance Polymer Field-Effect Transistors. Adv. Mater. 2009, 21, 209-212.
-

- 13. Bai, Y.; Hippalgaonkar, K.; Sprick, R. S. Organic Materials as Photocatalysts for Water Splitting. J. Mater. Chem. A 2021, 9, 16222-16232.
-

- 14. Dai, C.; Pan, Y.; Liu, B. Conjugated Polymer Nanomaterials for Solar Water Splitting. Adv. Energy Mater. 2020, 10, 2002474-2002481.
-

- 15. Namsheer, K.; Rout, C. S. Conducting Polymers: A Comprehen- sive Review on Recent Advances in Synthesis, Properties and Applications. RSC Adv. 2021, 10, 5659-5697.
-

- 16. Günes, S.; Neugebauer, H.; Sariciftci, N. S. Conjugated Polymer-Based Organic Solar Cells. Chem. Rev. 2007, 107, 1324-1338.
-

- 17. Yang, J.; Zhao, Z.; Wang, S.; Guo, Y.; Liu, Y. Insight into High-Performance Conjugated Polymers for Organic Field-Effect Transistors. Chem. 2018, 12, 2748-2785.
-

- 18. Anthony, J. E.; Facchetti, A.; Heeney, M.; Marder, S. R.; Zhan, X. N-Type Organic Semiconductors in Organic Electronics. Adv. Mater. 2010, 22, 3876-3892.
-

- 19. Quinn, J. T. E.; Zhu, J.; Li, X.; Wang, J.; Li, Y. Recent Progress in the Development of n-Type Organic Semiconductors for Organic Field Effect Transistors. J. Mater. Chem. C 2017, 5, 8654-8681.
-

- 20. Zhao, X.; Zhan, X. Electron Transporting Semiconducting Polymers in Organic Electronics. Chem. Soc. Rev. 2011, 40, 3728-3743.
-

- 21. Griggs, S.; Marks, A.; Bristow, H.; McCulloch, I. N-Type Organic Semiconducting Polymers: Stability Limitations, Design Considerations and Applications. J. Mater. Chem. C 2021, 9, 8099-8128.
-

- 22. Jia, H.; Lei, T. Emerging Research Directions for N-Type Conjugated Polymers. J. Mater. Chem. C 2019, 7, 12809-12821.
-

- 23. Wang, S.; Sun, H.; Erdmann, T.; Wang, G.; Fazzi, D.; Lappan, U.; Puttisong, Y.; Chen, Z.; Berggren, M.; Crispin, X.; Kiriy, A.; Voit, B.; Marks, T. J.; Fabiano, S.; Facchetti, A. A Chemically Doped Naphthalenediimide-Bithiazole Polymer for n-Type Organic Thermoelectrics. Adv. Mater. 2018, 30, 1801898-1801903.
-

- 24. Wang, Y.; Nakano, M.; Michinobu, T.; Kiyota, Y.; Mori, T.; Takimiya, K. Naphthodithiophenediimide-Benzobisthiadiazole-Based Polymers: Versatile n-Type Materials for Field-Effect Transistors and Thermoelectric Devices. Macromolecules 2017, 50, 857-864.
-

- 25. Grenier, F.; Berrouard, P.; Pouliot, J.-R.; Tseng, H.-R.; Heeger, A. J.; Leclerc, M. Synthesis of New n-Type Isoindigo Copolymers. Polym. Chem. 2013, 4, 1836-1841.
-

- 26. Wang, E.; Mammo, W.; Andersson, M. R. 25th Anniversary Article: Isoindigo-Based Polymers and Small Molecules for Bulk Heterojunction Solar Cells and Field Effect Transistors. Adv. Mater. 2014, 26, 1801-1826.
-

- 27. Yan, X.; Xiong, M.; Li, J. T.; Zhang, S.; Ahmad, Z.; Lu, Y.; Wang, Z. Y.; Yao, Z. F.; Wang, J. Y.; Gu, X.; Lei, T. Pyrazine-Flanked Diketopyrrolopyrrole (DPP): A New Polymer Building Block for High-Performance n-Type Organic Thermoelectrics. J. Am. Chem. Soc. 2019, 141, 20215-20221.
-

- 28. Yan, H.; Chen, Z.; Zheng, Y.; Newman, C.; Quinn, J. R.; Dötz, F.; Kastler, M.; Facchetti, A. A High-Mobility Electron-Transporting Polymer for Printed Transistors. Nature 2009, 457, 679-686.
-

- 29. Zhu, Z.; Chueh, C. C.; Zhang, G.; Huang, F.; Yan, H.; Jen, A. K. Y. Improved Ambient-Stable Perovskite Solar Cells Enabled by a Hybrid Polymeric Electron-Transporting Layer. ChemSusChem 2016, 9, 2586-2591.
-

- 30. Hou, W.; Xiao, Y.; Han, G.; Lin, J. Y. The Applications of Polymers in Solar Cells: A Review. Polymers 2019, 11, 143-188.
-

- 31. Morin, P.-O.; Bura, T.; Leclerc, M. Realizing the Full Potential of Conjugated Polymers: Innovation in Polymer Synthesis. Mater. Horizons 2016, 3, 11-20.
-

- 32. Zhang, M.; Tsao, H. N.; Pisula, W.; Yang, C.; Mishra, A. K.; Müllen, K. Field-Effect Transistors Based on a Benzothiadiazole-Cyclopentadithiophene. J. Am. Chem. Soc. 2007, 129, 3472-3473.
-

- 33. Wu, W.; Liu, Y.; Zhu, D. π-Conjugated Molecules with Fused Rings for Organic Field-Effect Transistors: Design, Synthesis and Applications. Chem. Soc. Rev. 2010, 39, 1489-1502.
-

- 34. Nketia-Yawson, B.; Lee, H.-S.; Seo, D.; Yoon, Y.; Park, W.-T.; Kwak, K.; Son, H. J.; Kim, B.; Noh, Y.-Y. A Highly Planar Fluorinated Benzothiadiazole-Based Conjugated Polymer for High-Performance Organic Thin-Film Transistors. Adv. Mater. 2015, 27, 3045-3052.
-

- 35. Yum, S.; An, T. K.; Wang, X.; Lee, W.; Uddin, M. A.; Kim, Y. J.; Nguyen, T. L.; Xu, S.; Hwang, S.; Park, C. E.; Woo, H. Y. Benzotriazole-Containing Planar Conjugated Polymers with Noncovalent Conformational Locks for Thermally Stable and Efficient Polymer Field-Effect Transistors. Chem. Mater. 2014, 26, 2147-2154.
-

- 36. Liu, X.; Sun, Y.; Hsu, B. B. Y.; Lorbach, A.; Qi, L.; Heeger, A. J.; Bazan, G. C. Design and Properties of Intermediate-Sized Narrow Band-Gap Conjugated Molecules Relevant to Solution-Processed Organic Solar Cells. J. Am. Chem. Soc. 2014, 136, 5697-5708.
-

- 37. Zhang, Y.; Chien, S.-C.; Chen, K.-S.; Yip, H.-L.; Sun, Y.; Davies, J. A.; Chen, F.-C.; Jen, A. K.-Y. Increased Open Circuit Voltage in Fluorinated Benzothiadiazole-Based Alternating Conjugated Polymers. Chem. Commun. 2011, 47, 11026-11028.
-

- 38. Ying, L.; Hsu, B. B. Y.; Zhan, H.; Welch, G. C.; Zalar, P.; Perez, L. A.; Kramer, E. J.; Nguyen, T. Q.; Heeger, A. J.; Wong, W. Y.; Bazan, G. C. Regioregular Pyridal[2,1,3]Thiadiazole π-Conjugated Copolymers. J. Am. Chem. Soc. 2011, 133, 18538-18541.
-

- 39. Lee, W.; Lee, C.; Yu, H.; Kim, D. J.; Wang, C.; Woo, H. Y.; Oh, J. H.; Kim, B. J. Side Chain Optimization of Naphthalenediimide-Bithiophene-Based Polymers to Enhance the Electron Mobility and the Performance in All-Polymer Solar Cells. Adv. Funct. Mater. 2016, 26, 1543-1553.
-

- 40. Sharma, S.; Kolhe, N. B.; Gupta, V.; Bharti, V.; Sharma, A.; Datt, R.; Chand, S.; Asha, S. K. Improved All-Polymer Solar Cell Performance of n-Type Naphthalene Diimide-Bithiophene P(NDI2OD-T2) Copolymer by Incorporation of Perylene Diimide as Coacceptor. Macromolecules 2016, 49, 8113-8125.
-

- 41. Liu, Q.; Surendran, A.; Feron, K.; Manzhos, S.; Jiao, X.; McNeill, C. R.; Bottle, S. E.; Bell, J.; Leong, W. L.; Sonar, P. Diketopyrrolopyrrole Based Organic Semiconductors with Different Numbers of Thiophene Units: Symmetry Tuning Effect on Electronic Devices. New J. Chem. 2018, 42, 4017-4028.
-

- 42. Vasimalla, S.; Senanayak, S. P.; Sharma, M.; Narayan, K. S.; Iyer, P. K. Improved Performance of Solution-Processed n-Type Organic Field-Effect Transistors by Regulating the Intermolecular Interactions and Crystalline Domains on Macroscopic Scale. Chem. Mater. 2014, 26, 4030-4037.
-

- 43. Nketia-Yawson, B.; Lee, H. S.; Seo, D.; Yoon, Y.; Park, W. T.; Kwak, K.; Son, H. J.; Kim, B.; Noh, Y. Y. A Highly Planar Fluorinated Benzothiadiazole-Based Conjugated Polymer for High-Performance Organic Thin-Film Transistors. Adv. Mater. 2015, 27, 3045-3052.
-

- 44. Lee, J.; Kang, S.-H.; Lee, S. M.; Lee, K. C.; Yang, H.; Cho, Y.; Han, D.; Li, Y.; Lee, B. H.; Yang, C. An Ultrahigh Mobility in Isomorphic Fluorobenzo[c][1,2,5]Thiadiazole-Based Polymers. Angew. Chem. Int. Ed. 2018, 57, 13629-13634.
-

- 45. Wang, M.; Ford, M.; Phan, H.; Coughlin, J.; Nguyen, T.-Q.; Bazan, G. C. Fluorine Substitution Influence on Benzo[2,1,3]- Thiadiazole Based Polymers for Field-Effect Transistor Applications. Chem. Commun. 2016, 52, 3207-3210.
-

- 46. Yum, S.; An, T. K.; Wang, X.; Lee, W.; Uddin, M. A.; Kim, Y. J.; Nguyen, T. L.; Xu, S.; Hwang, S.; Park, C. E.; Woo, H. Y. Benzotriazole-Containing Planar Conjugated Polymers with Noncovalent Conformational Locks for Thermally Stable and Efficient Polymer Field-Effect Transistors. Chem. Mater. 2014, 26, 2147-2154.
-

- 47. Zhou, H.; Yang, L.; Stuart, A. C.; Price, S. C.; Liu, S.; You, W. Development of Fluorinated Benzothiadiazole as a Structural Unit for a Polymer Solar Cell of 7% Efficiency. Angew. Chem. Int. Ed. 2011, 50, 2995-2998.
-

- 48. K, N.; Rout, C. S. Conducting Polymers: A Comprehensive Review on Recent Advances in Synthesis, Properties and Applications. RSC Adv. 2021, 11, 5659-5697.
-

- 49. McCullough, R. D. The Chemistry of Conducting Polythiophenes. Adv. Mater. 1998, 10, 93-116.
-

- 50. Li, J.; Du, J.; Xu, J.; Chan, H. L. W.; Yan, F. The Influence of Gate Dielectrics on a High-Mobility n-Type Conjugated Polymer in Organic Thin-Film Transistors. Appl. Phys. Lett. 2012, 100, 33301-33304.
-

- 51. Kosco, J.; Moruzzi, F.; Willner, B.; McCulloch, I. Photocatalysts Based on Organic Semiconductors with Tunable Energy Levels for Solar Fuel Applications. Adv. Energy Mater. 2020, 10, 2001935-20011950.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(3): 409-417
Published online May 25, 2022
- 10.7317/pk.2022.46.3.409
- Received on Feb 21, 2022
- Revised on Mar 15, 2022
- Accepted on Mar 15, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- yo-Jin Ahn* , and Junghoon Lee
-
Division of Chemical Engineering, Dongseo University, Busan 47011, Korea
- E-mail: hyo-jin.ahn@lstme.org, junghoonlee@gdsu.dongseo.ac.kr
- ORCID:
0000-0003-4283-8592, 0000-0003-2638-851X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.