- Cationic Ring-opening Polymerization of Cyclic Dithiocarbonates Enhanced by a Neighboring Sulfur Atom
Department of Chemistry Education, Pusan National University, 2, Busandaehak-ro, 63beon-gil, Geumjeong-gu, Busan 46241, Korea
- 고리형 디티오카보네이트의 양이온 개환 중합과 인접한 황에 의한 개환 유도 효과
부산대학교 화학교육과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Cationic ring-opening polymerization was investigated with three cyclic dithiocarbonates. Neighboring sulfide and ether groups stabilize a cationic intermediate appeared in the structural reorganization of cyclic monomers and suppress competitive isomerization, leading to a high polymer conversion. A heterocyclic substituent with sulfur and oxygen on a monomer changed to a smaller heterocycle in the corresponding polymer. A plausible mechanism for the ring contraction was proposed involving neighboring group participation. The polymerization exhibited the characteristics of living polymerization such as a narrow molecular weights distribution, which was controllable with initiator contents. The thermal stability of the prepared poly(dithiocarbonate) was enhanced by end-capping reaction.
3종의 고리형 디티오카보네이트 단분자를 사용하여 양이온 개환 중합반응을 진행하였다. 단분자로부터 생성된 개환반응 중간체의 안정화 효과를 통해 고분자 전환율을 증가시키고자 황과 산소가 도입된 단분자를 합성하였다. 황과 산소를 포함한 헤테로고리가 치환체로 도입된 경우, 고분자 반응과정에서 고리 크기가 감소하는 현상을 관찰하였다. 이를 설명하는 반응 메카니즘을 제안하고 인접기 효과를 확인하고자 한다. 양이온 중합반응 개시제로 사용된 MeOTf의 양을 조절하여 합성된 고분자의 분자량을 조절하고 좁은 분자량분포의 고분자 형성을 통해 리빙중합 특성을 확인하였다. 고분자 사슬의 말단 종결반응을 진행하여 생성된 고분자의 열안정성을 향상시킬 수 있었다.
MeOTf-initiated living polymerization of 5-cyclic dithiocarbonate occurred at room temperature through structural reorganization involving ring-opening and adjacent sulfide migration causing ring-contraction. The number of a repeating unit was controlled by feeding ratio of monomer to initiator. A reactive chain-end was deactivated by further functionalization, which improved the thermal stability of the prepared poly(dithiocarbonate).
Keywords: poly(dithiocarbonate), ring-opening polymerization, neighboring group participation, living polymerization.
이 논문은 부산대학교 기본연구지원사업(2년)에 의하여 연구되었음.
저자들은 이해상충이 없음을 선언합니다.
황을 포함하는 고분자는 전기적 절연성과 내열성 및 기계적 성질이 우수하고 특히, 광투명성과 높은 굴절율로 광학 재료로 꾸준히 사용되고 있다.1,2 금속에 대한 높은 점착성과 금속이온과의 강한 화학적 결합 특성은 소재의 응용성을 넓혔다.3 탄소에 결합된 황은 S, Sn, SO, SO2, SO3, SO4 등의 다양한 결합상태를 유지하고, 원자 상태로 결합된 작용기로 티오에스테르, 티오카보네이트, 티오아마이드, 티오우레탄 등과 같은 형태로 고분자에 도입된 구조가 일반적이다.4 타이어 제조로부터 안경렌즈, 이온 분리막 및 이온 전도성 재료, 생체적합 재료로 꾸준한 연구가 되고 있다.5 이들 황화물 고분자는 이중결합에 대한 클릭반응과6 에피설파이더의 개환반응,7 포스겐과 같은 카보닐 결합체 사용과 카보닐 치환반응 등으로8 합성될 수 있다. 천연가스와 황의 고열반응에 의해 대량 제조되는 CS2를 활용한 황화물 고분자 합성에 대한 흥미로운 연구가 많이 발표되고 있다. 에폭시 또는 에피설파이와 CS2의 공중합고분자 형성반응은 정교한 구조의 크롬 촉매에 의해 진행되고 고굴절 광특성을 갖는 폴리디티오카보네이트(poly(dithiocarbonate))와 폴리트리티오카보네이트(poly(trithiocarbonate))를 형성한다.7 디아민과 CS2의 중합반응으로 합성된 티오우레아 고분자는 수은과 같은 중금속 이온의 흡수 소재로 개발되었다(Figure 1).9,10
폴리카보네이트 유사구조로서 폴리디티오카보네이트는 개환반응을 통해 간단히 합성할 수 있다. 에폭시 단분자와 CS2를 사용한 단순한 공중합 반응은 어렵고 효과적이지 않다. 5-각환의 디티오카보네이트는 산 촉매하에서 폴리디티오카보네이트의 형성으로 고분자 반응이 잘 진행되는 것으로 알려져 있다. 이 반응은 양이온 개환 고분자 반응을 통해 진행되는 것으로 밝혀졌다.11 그러나 개환반응을 통한 고분자 사슬 성장과정에서 사슬 끊김 경쟁반응이 심각하게 진행되어 폴리디티오카보네이트의 분자량 증가에 한계가 있었다. 더구나, 출발물질인 단분자의 O/S 교환반응이 진행되어 반응성이 약한 이성질체가 다량 형성되고 이러한 결과 고분자 전환율이 매우 낮은 문제가 있다. 최근 발표된 연구에 따르면, 단분자 구조변경을 통해 사슬 성장을 향상시키고 이성질체 전환은 급격하게 억제되었다.12 개환반응에서 생성된 양이온 중간체를 안정시키는 인접기 도입으로 다양한 구조의 폴리디티오카보네이트를 합성할 수 있었다. 본 연구에서는 개환 중간체를 안정시킬 수 있는 작용기로 황과 산소 원자의 기여도에 대한 연구를 진행하고, 인접기 효과를 명확하게 확인할 수 있는 반응 생성물을 분리 분석하여 결과를 증명하고자 한다. 개환 중합반응의 리빙중합 특성을 이용하여 분자량 조절과 사슬말단의 비활성화 반응을 통해 고분자의 안정성을 향상시키고자 한다.

|
Figure 1 Polymers from CS2. |
시약 및 화학구조 분석. 본 실험에 사용된 모든 시약은 Sigma-Aldrich(USA) 사의 시약으로 별도의 정제 과정을 거치지 않고 그대로 사용하였다. 반응은 silica gel plate(Merk 5715, USA)를 사용한 thin layer chromatography로 추적하였으며 자외선 램프 및 p-anisaldehyde Sigma-Aldrich(USA)를 포함하는 발현용액에 의한 발색으로 확인하였다. 혼합물의 분리와 정제는 실리카젤(Merk, 250-430, USA)을 이용한 관 크로마토그래피로 진행하였다. 합성된 시료의 화학구조 해석은 VARIAN(USA) 사의 Mercury 400 MHz NMR을 사용하였으며, CDCl3를 용매겸 내부 기준 물질로 사용하여 측정하였다.
Spiro Epoxy(1) 합성. 1,2-Dihydroxybenzene(1.10 g, 10.0 mmol)과 methallyl dichloride(1.16 mL, 10.0 mmol)를 정제된 DMF(45 mL)에 녹인 후, sodium hydride(60%, 0.88 g, 22.0 mmol)를 상온에서 천천히 첨가하였다. 상온에서 1시간 교반 후 60 oC에서 12시간 반응시켰다. 상온으로 식힌 반응 용액에 증류수(150 mL)를 넣어 혼합하고 diethyl ether로 추출하였다. 분리된 유기층용액을 무수 MgSO4를 넣고 수분을 제거하고 고체를 분리한 후 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/20)로 생성물을 분리 정제하였다(78%). 1H NMR(400 MHz, CHCl3): δ 6.66-6.96 (m, 4H), 4.96(s, 2H), 4.73(s, 4H); 13C NMR(CHCl3): δ 149.6, 144.0, 123.0, 121.0, 111.8, 73.4.
이중 결합을 갖는 위 생성물(1.27 g)을 CHCl3(25 mL)에 녹인 후 m-chloroperoxybenzoic acid(mcpba)(1.92 g, 8.58 mmol)를 서서히 첨가하고 상온에서 12시간 교반하였다. 진공회전 증발기로 농축된 반응혼합물은 실리카젤 관 크로마토그래피 (EA/hexane, 1/20)로 생성물(1)을 분리하였다(90%). 1H NMR (400 MHz, CDCl3): δ 6.95(m, 4H), 4.26(dd, J=15 Hz, 27 Hz, 4H), 2.86(s, 2H); 13C NMR(CHCl3): δ 149.6, 123.5, 121.2, 73.6, 57.9, 50.8.
5-Cyclic Dithiocarbonate(2) 합성. 에폭시 물질(1)(0.89 g, 5.0 mmol)에 CS2(0.45 mL, 7.50 mmol)를 넣은 후 촉매량의 LiOtBu(40 mg, 0.50 mmol)를(혹은 THF 용매에 LiBr 촉매 사용) 첨가한 후 30 oC 질소조건에서 10시간 교반하였다. 반응 혼합물에 CH2Cl2(30 mL)를 넣어 묽힌 후 증류수로 씻어준다. 유기층을 분리한 후 무수 MgSO4로 처리한 뒤 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/20)로 생성물을 분리 정제하여 생성물(2)를 80% 수율로 얻었다. 1H NMR(400 MHz, CDCl3): δ 6.96(m, 4H), 4.13(s, 4H), 3.60(s, 2H); 13C NMR(100 MHz, CDCl3): δ 225.1, 150.4, 123.8, 121.1, 76.1, 73.1, 37.7.
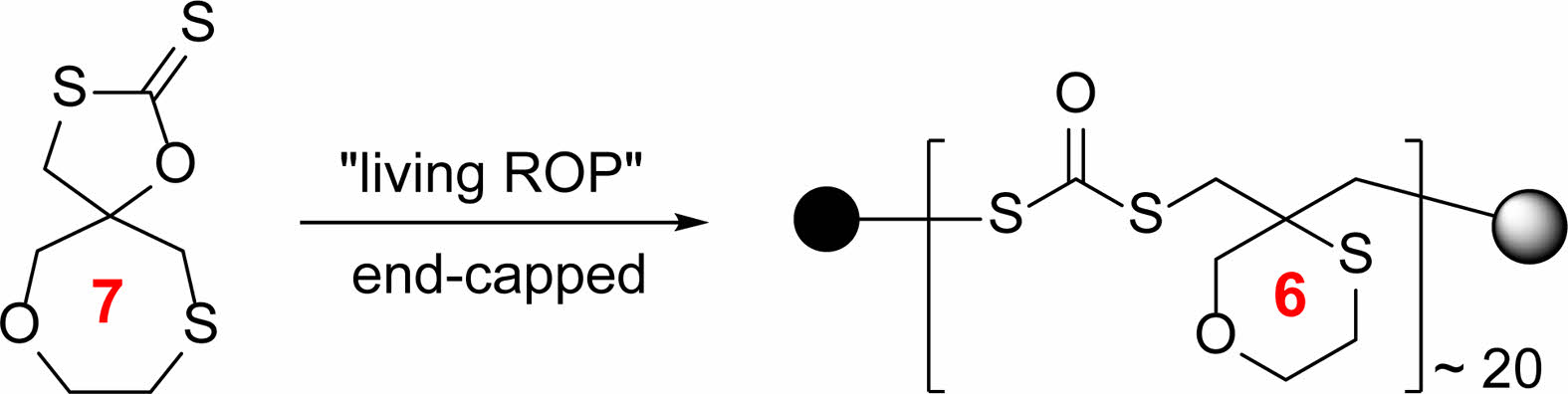
유사하게 단분자 5(88%)와 7(85%)을 합성하였다.
5:1H NMR(400 MHz, CDCl3): δ 4.26-4.22(m, 2H), 4.07 (d, J=20 Hz, 1H), 3.81(m, 1H), 3.60(s, 3H), 3.16(dd, 2H), 2.95(m, 1H), 2.76(m, 1H); 13C NMR(100 MHz, CDCl3): δ 210.5, 102.5, 76.0, 75.9, 40.6, 38.6, 36.7.
7:1H NMR(300 MHz, CDCl3): δ 5.20-5.11(m, 1H), 3.75-3.69(m, 1H), 3.60-3.53(m, 1H), 3.50-3.49(d, J=3 Hz, 1H), 3.28-3.20(d, J=24 Hz, 1H); 13C NMR(75 MHz, CDCl3): δ 223.7, 133.5, 130.7, 129.6, 127.7, 89.0, 38.5, 36.1.
Cyclic Ketone(3) 합성. Epichlorohydrine(3.92 mL, 50.0 mmol)과 2-mercaptoethanol(3.49 mL, 50.0 mmol)을 증류수 (100 mL)에 녹인 후 NaOH(0.20 g, 5 mmol)를 첨가하여 상온에서 4시간 교반하였다. 반응용액에 1 M-HCl을 첨가하여 중화한 후 EA로 생성물을 추출하여 약 6.0 g(70%)의 diol을 얻었다. 증류수(100 mL)에 이 물질을 다시 녹이고 온도를 50 oC로 유지하였다. NaOH(1.4 g)를 녹인 수용액 100 mL를 약 1시간 동안 천천히 첨가하였다. 1시간 교반 후 진한 HCl 2-3 방울을 첨가하여 반응용액을 중화시켰다. 최종 수용액을 EA로 추출하여 고리형 알코올을 포함하는 혼합물을 65%로 분리하였다. Oxalyl chloride(1.86 mL, 22 mmol)를 무수 CH2Cl2 (50 mL)에 녹인 후 -50 oC에서 무수 DMSO(3.44 mL, 44 mmol)를 천천히 첨가하였다. 앞서 생성된 알코올을 녹인 CH2Cl2 (50 mL) 용액을 -50 oC에서 천천히 첨가하였다. 10분간 교반 후 -50 oC에서 Et3N(15 mL)를 첨가하고 상온으로 온도를 올려 3시간 반응시켰다. 반응 용액에 NaHSO3(1 g)를 첨가하고 물을 넣어 교반하였다. 혼합용액을 CH2Cl2로 추출하고 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/10)로 생성물(3)를 60% 수율로 분리하였다. 1H NMR(300 MHz, CDCl3): δ 4.27(s, 2H), 4.111(t, 2H), 3.43(s, 2H), 2.87(t, 2H); 13C NMR(70 MHz, CDCl3): δ 206.6, 77.7, 77.5, 39.4, 35.1.
Spiro Epoxy(4) 합성. Trimethylsulfonium iodide(2.45 g, 12.0 mmol)을 무수 THF(30 mL)에 녹이고 KOtBu(98%, 1.35 g, 12.0 mmol)를 상온에서 첨가하고 10분간 교반한다. 케톤(3) (1.30 g, 10.0 mmol)을 THF(10 mL)에 녹여 서서히 첨가 하였다. 상온에서 6시간 교반한 후 증류수를 첨가하고 EA로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/10)로 생성물(4)를 분리하였다. 1H NMR (300 MHz, CDCl3): δ 4.2-5.81(m, 2H), 3.89(dd, J=12 Hz, 63 Hz, 2H), 3.00-2.72(m, 6H); 13C NMR(75 MHz, CDCl3): δ 76.4, 61.1, 53.0, 37.2, 36.6.
Epoxide(6) 합성.2-(2-(2-methoxyethoxy)ethoxy)ethanethiol (1.00 g, 5.55 mmol)을 1,4-dioxane(3 mL)에 녹인 후, KOH(0.62 g, 11.1 mmol)를 녹인 수용액(3 mL)을 첨가한다. 이 용액에 epichlorohydrine(0.65 mL, 8.33 mmol)을 주입하고 상온에서 12시간 동안 반응시켰다. 증류수를 넣어 반응을 종결하고 EA로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 제거하고 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/4)로 생성물(6)을 50% 수율로 분리하였다. 1H NMR(300 MHz, CDCl3) δ(ppm)=3.56-3.39(m, 10H), 3.23(s, 3H), 2.99(m, 1H), 2.68-2.45(m, 6H); 13C NMR(75 MHz, CDCl3): δ 71.7, 70.9, 70.3, 70.3, 70.0, 58.8, 51.6, 46.6, 34.3, 31.4.
개환 고분자반응.단분자 5(1.11 g, 5.0 mmol)를 포함하는 플라스크에 CHCl3(5 mL)를 넣어 만든 용액을 30 oC로 유지한다. 이 반응기에 MeOTf(methyl triflate)(28 mL, 0.25 mmol)를 빠르게 주입한 뒤 10시간 교반하였다. 농축시킨 후 실리카젤 관 크로마토그래피를 통해(EA/Hex=1/1, v/v) 고분자 이외의 물질을 제거하고 CHCl3와 THF를 순차적으로 사용하여 고분자 B를 분리하였다. 고분자 반응 후 반응기에 sodium diethyldithiocarbamate trihydrate(0.28 g)와 CH3CN(3 mL)를 첨가하고 추가로 5시간 교반하여 고분자 사슬 말단의 반응성을 종결시켰다.
Polymer A(75%): 1H NMR(300 MHz, CDCl3): δ 6.94(s, 4H), 4.05(s, 4H), 3.35(s, 2H).
Polymer B(95%, powder): 1H NMR(300 MHz, CDCl3): δ 3.47(s, 4H), 2.90(s, 2H), 2.85(s, 4H), 2.08(m, 2H); 13C NMR (75 MHz, CDCl3): δ 188.3, 54.2, 45.4, 38.4, 34.6, 32.9, 27.8.
Polymer C(65%) 1H NMR(300 MHz, CDCl3) δ 3.66-3.41 (m, 10H), 3.33(s, 3H), 3.24-2.91(m, 2H), 2.87-2.80(m, 1H), 2.75-2.70(m, 2H); 13C NMR(75 MHz, CDCl3) δ 188.7, 71.8, 70.9, 70.4, 70.3, 59.0, 46.0, 34.6, 34.1, 31.2, 30.2.
고분자 분해반응. 합성된 고분자 B(1.0 g)를 THF(5 mL)에 녹이고 KOH(0.1 g)를 녹인 메탄올(3 mL)을 첨가하고 상온에서 24시간 교반하였다. 증류수와 묽은 염산을 첨가하여 반응을 종결하고 EA로 추출하였다. 유기층을 무수 MgSO4로 처리 후 고체를 걸러내고 진공회전 증발기로 농축하였다. 실리카젤 관 크로마토그래피(EA/hexane, 1/10)로 생성물(5a)을 75% 수율로 분리하였다. 1H NMR(300 MHz, CDCl3): δ 3.94 (t, J=6 Hz, 2H), 3.84(s, 2H), 3.36(d, J=12 Hz, 2H), 3.13(d, J=12 Hz, 2H), 2.78(t, J=6 Hz, 2H); 13C NMR(75 MHz, CDCl3): δ 75.0, 68.4, 53.6, 47.7, 27.3.
5-Cyclic Dithiocarbonate 단분자 합성. 개환반응에 참여할 수 있는 인접한 작용기가 도입된 5-각환의 디티오카보네이트 3종을 설정하고 Figure 2에 정리된 방법으로 합성하였다. 2개의 산소원자가 동등한 위치에 결합된 스피로 에폭시 1은 오르토-카테콜과 methallyl dichloride로부터 고리화 반응과 이중결합의 산화반응으로 합성하였다. 에폭시기에 대한 CS2의 고리화 첨가반응은 LiBr나 LiOtBu 촉매하에서 잘 진행되었고 단분자구조인 2가 높은 수율로 생성되었다.13 Epichlorohydrine과 2-mercaptoethanol의 고리화 반응은 묽은 농도의 NaOH 수용액에서 진행되었다.14 Oxallyl chloride와 DMSO에 의한 선택적 산화반응으로, 고리화 반응 생성물이 갖는 2차 알코올을 산화시켜 케톤 3을 얻었다. Sulfonium ylide를 케톤과 반응시켜 에폭시 물질 4를 합성하였고 CS2와 고리화 첨가 반응을 통해 O, S가 동등한 위치에 결합된 단분자 5를 얻었다. Triethylene oxide가 황에 의해 결합된 곁사슬형 에폭시 6의 CS2 첨가반응을 통해 단분자 7이 합성하였다.
양이온 개환 고분자 반응. 고리형 디티오카보네이트는 산에 의해 고분자 반응이 잘 진행되는 물질이다. O-C=S가 S-C=O로 바뀌는 결합 안정화 효과와 개환에 따른 자유에너지의 이점이 이 반응의 추진력이다. 그러나, 형성된 고분자 폴리디티오카보네이트는 열적 안정성이 떨어지고 개환반응의 경쟁반응인 말단 사슬 끊김(back-biting) 반응으로 고분자 수율과 분자량 증가에 한계가 있었다. 또한, 단분자의 단순한 O/S 교환 반응을 통한 이성질화 현상이 경쟁반응으로 잘 진행되기 때문에 고분자 생성의 수율이 떨어지는 주 원인으로 지적되었다. 최근 개환 고분자반응에서 중간체를 안정시켜주는 인접 작용기 효과를 통해 고분자 생성 효율을 증가시킬 수 있다는 것이 알려졌다.12 양이온 개환반응 조건에서 반응생성 중간체로 양이온 구조가 생성됨으로써 인접한 황 원자의 참여는 안정한 episulfonium cation이 형성할 수 있고 이로부터 경쟁 반응을 억제할 수 있었다.
유사하게 산소가 인접할 경우, oxonium cation 형성을 통한 고분자 형성의 가능성을 조사하였다. 두 개의 산소가 고리형 구조로 인접한 단분자 2를 사용하여 고분자 반응을 진행하였다. 반응 개시제로 중성의 methyl triflate를 사용한 결과 Figure 3에 나타난 고분자 A가 얻어졌다. 형성된 고분자의 구조분석을 통해 두 개의 산소가 결합된 7-각환 구조는 단분자와 동일하게 유지되었다. 고분자 형성 과정에서 인접 산소의 영향에 대한 증거를 얻지 못하였다. 황과 산소원자가 도입된 단분자 5를 사용하여 반응시켰을 때 생성된 고분자의 구조는 B와 같은 구조로 밝혀졌다. 단분자의 7-각환이 6-각환 구조로 변화된 고리축소 현상이 관찰되었다. 이를 설명하기 위해 Figure 4에 반응 메카니즘을 제안하였다. Episulfonium과 oxonium 이온 중간체로 각각 G-1과 G-2의 형성은 개환반응에서 황과 산소의 안정화 기여를 설명할 수 있다. 결과적으로, 황에 의한 안정화가 진행되는 방향으로 반응이 일어났음을 알 수 있다. 고분자의 구조를 명확히 결정하기 위해 염기성 조건에서 고분자 분해반응을 진행하였다. 생성물 구조로 5a와 5b가 가능하지만 실제 5b는 형성되지 않았고 5a만 분리되었기에 고분자의 구조를 증명할 수 있었다. 분리된 5a의 구조는 1H NMR과 13C NMR에서 뚜렷하게 확인될 수 있었다. 유사하게 단분자 7의 반응은 episulfonium cation 형성을 통해 고분자 C를 생성하였다.
리빙 중합 고분자의 특성. 고리형 디티오카보네이트의 중합이 리빙중합 특성을 갖는 것을 분자량 조절을 통해 관찰하였다. 단분자와 개시제의 반응 당량비를 조절함으로써 분자량을 조절을 진행하였다. 고분자 B의 합성을 위해 반응 초기에 당량 비율을 20:1, 40:1, 60:1로 변화시켰고 이의 결과를 Table 1에 요약하였다. 개시제의 양이 줄어들수록 평균 분자량은 비례하여 늘어났고 GPC 분석 결과 분자량이 이론값에 근접하는 것으로 나타났다. 또한, 분자량 분포(M͞͞w/M͞͞n)가 매우 좁게 나타남으로써 리빙중합 특성이 있음을 확인하였다.
개시제의 사용량에 따라 합성된 고분자 B의 1H NMR 스펙트럼을 Figure 5에 비교하였다. 2.46 ppm의 수소는 반응 개시제(MeOTf)로부터 유래된 CH3가 결합된 고분자 말단의 CH3 이며, 2.75 ppm은 고리구조의 메틸렌 수소(CH2-S)의 특성 흡수 띠로 해석되고, 이 두 수소의 적분값을 비교함으로써 고분자 사슬의 평균 길이를 계산할 수 있었다. 이를 Table 1에 표시하였고, 측정된 분자량과 잘 일치하였다. 고분자 합성에서 단분자가 모두 소모된 후 사슬말단은 여전히 반응성을 갖고 있어 이를 작용기로 변화시키는 과정을 진행하였다. Sodium diethyl dithiocarbamate를 반응시킨 결과 사슬말단에 diethyl dithiocarbamate가 결합된 고분자를 얻을 수 있었다. Figure 5에서 1.20 ppm의 triplet은 carbamate의 결합을 의미하고, 적분값을 통해 고분자에 약 80%의 carbamate 치환효율이 나타났다.
폴리디티오카보네이트의 열안정성을 TGA 분석을 통해 관찰하였고 Figure 6에 도시하였다. 고분자 B는 130 oC에서 분해가 시작되는 열적 특성이 나타났다. Carbamate로 말단 치환된 고분자의 경우 안정성이 증가하였고 200 oC 이상까지 분해가 진행되지 않고 253 oC에서 10% 분해가 진행되는 현상을 보였다.

|
Figure 2 Preparation of 5-cyclic dithiocarbonate monomers. |

|
Figure 3 Polymers synthesized by cationic ring-opening polymerization of cyclic dithiocarbonate monomers. |

|
Figure 4 Proposed mechanism of cationic ring-opening polymerization via episulfonium and polymer degradation. |

|
Figure 5 1H NMR spectra of polymer B synthesized with varying monomer to initiator ratio. |

|
Figure 6 TGA analysis of polymer B end-capped by carbamate. |
|
Table 1 Average Molecular Weights of the Prepared Polymers |

aFeeding ratio of monomer to MeOTf. |
오각환 디티오카보네이트의 양이온 개환 중합반응을 연구하였고, 인접한 황과 산소의 효과에 대한 검정을 합성된 고분자의 구조분석을 통해 진행하였다. 고리축소 현상을 통해 황의 안정화 역할이 고분자반응에 크게 기여하였음을 관찰하였으나 산소에 의한 안정화 효과는 관찰되지 않았다. 양이온 개환 중합은 리빙중합 특성으로 진행되었고 개시제의 양에 따라 분자량을 조절할 수 있었다. 고분자 말단에 diethyl dithiocabamate를 결합시켜 고분자의 열안정성을 향상시킬 수 있었다.
- 1. Arslan, M.; Kiskan, B.; Yagci, Y. Recycling and Self-Healing of Polybenzoxazines with Dynamic Sulfide Linkages. Sci. Rep. 2017, 7, 5207.
-

- 2. Liu, J.; Ueda, M. High Refractive Index Polymers: Fundamental Research and Practical Applications. J. Mater. Chem. 2009, 19, 8907.
-

- 3. Cao, W.; Dai, F.; Hu, R.; Tang, B. Z. Economic Sulfur Conversion to Functional Polythioamides through Catalyst-Free Multicomponent Polymerizations of Sulfur, Acids, and Amines. J. Am. Chem. Soc. 2020, 142,978.
-

- 4. Sulfur-Containing Polymers: From Synthesis to Functional Materials, Zhang, X. H., Theato, P., Eds. Wiley: Hoboken, 2021.
-

- 5. Mutlu, H.; Ceper, E. B.; Li, X.; Yang, J.; Dong, W.; Ozmen, M. M.; Theato, T. Sulfur Chemistry in Polymer and Materials Science. Macromol. Rapid Commun. 2019, 40, 1800650.
-

- 6. Hoyle, C. E.; Lowe, A. B.; Bowman, C. N. Thiol-Click Chemistry: a Multifaceted Toolbox for Small Molecule and Polymer Synthesis. Chem. Soc. Rev. 2010, 39, 1355.
-

- 7. Nakano, K.; Tatsumi, G.; Nozaki, K. Synthesis of Sulfur-Rich Polymers: Copolymerization of Episulfide with Carbon Disulfide by Using [PPN]Cl/(salph)Cr(III)Cl System. J. Am. Chem. Soc. 2007, 129, 15116.
-

- 8. Berti, C.; Celli, A.; Marianucci, E. Sulfur Containing Polymers. Aromatic Polydithiocarbonates and Polythiocarbonates: Synthesis and Thermal Properties. Eur. Polym. J. 2002, 38, 1281.
-

- 9. Wu, S.; Luo, M.; Darensbourg, D. J.; Zuo, X. Catalyst-Free Construction of Versatile and Functional CS2-Based Polythioureas: Characteristics from Self-Healing to Heavy Metal Absorption. Macromolecules 2019, 52, 8596.
-

- 10. Tian, T.; Hu, R.; Tang, B. Z. Room Temperature One-Step Conversion from Elemental Sulfur to Functional Polythioureas through Catalyst-Free Multicomponent Polymerizations. J. Am. Chem. Soc. 2018, 140, 6156.
-

- 11. Ochiai, B.; Endo, T. Synthesis of Polymers from Carbon Dioxide and Carbon Disulfide. Prog. Polym. Sci. 2005, 30, 183.
-

- 12. Kim, C. G.; Son, M. J.; Do, J. Y. Cationic Living Polymerization of Cyclic Dithiocarbonates involving Sulfide-Migration. Eur. Polym. J. 2021, 156, 110611.
-

- 13. Diebler, J.; Spannenberg, A.; Werner, T. Atom Economical Synthesis of Di- and Trithiocarbonates by the Lithium tert-Butoxide Catalyzed Addition of Carbon Disulfide to Epoxides and Thiiranes. Org. Biomol. Chem. 2016, 14, 7480.
-

- 14. Dodd, J. H.; Henry, J. R.; Rupert, K. C.; Bullington, J. L.; Hall, D. A. Oxathiepino[6,5-b]dihydropyridines, and Related Compositions and Methods. US Patent 6,476,022 B1, 2002.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(3): 377-381
Published online May 25, 2022
- 10.7317/pk.2022.46.3.377
- Received on Jan 26, 2022
- Revised on Mar 10, 2022
- Accepted on Mar 17, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jung Yun Do
-
Department of Chemistry Education, Pusan National University, 2, Busandaehak-ro, 63beon-gil, Geumjeong-gu, Busan 46241, Korea
- E-mail: jydo@pusan.ac.kr
- ORCID:
0000-0003-4348-727X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.