- Fabrication and Characterization of Cell Spheroid Containing Porous Microparticles
Department of Nanobiomedical Science, Dankook University, Cheonan 31116, Korea
*Department of Physics, College of Science, Dankook University, Cheonan 31116, Korea- 다공성 미세입자가 포함된 세포 스페로이드의 제조 및 분석
단국대학교 나노바이오의과학과, *단국대학교 물리학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Although the extensive use of cell spheroids in various fields, cellular heterogeneity by insufficient diffusion of oxygen/nutrients and accumulation of metabolic wastes remains as a challenge. Herein, we developed a cell spheroid system containing porous polycaprolactone (PCL) microparticles. The PCL microparticles with leaf-stacked structure (LSS microparticles) were fabricated using a heating-cooling technique. Cells and LSS microparticles suspension were seeded into agarose-based micro-concave array to prepare Cell/LSS microparticle (Cell/LSS) spheroids with a size of about 500 μm. On the basis of in vitro cell culture, it was recognized that the LSS microparticles uniformly distributed in Cell/LSS spheroids can be micro-channel networks for sufficient supply of medium including oxygen/nutrients and removal of metabolic wastes, and thus prevent cellular heterogeneity in spheroids. Therefore, we suggest that the Cell/LSS spheroid system may be an alternative technique to overcome the limitations of conventional cell spheroids as well as promising platform system for various studies.
본 연구에서는 다공성의 낙엽적층구조 미세입자와 세포로 구성된 세포 스페로이드 시스템을 제조하였다. 본 연구팀이 고안한, 고분자 용액의 단순 가열-냉각 과정을 통해 낙엽적층구조를 가지는 다공성 미세입자를 제조하였고, 세포와 낙엽적층구조 미세입자 혼합 용액을 아가로스 기반의 micro-concave array에 분주하여 약 500 μm의 크기를 가지는 세포/미세입자 스페로이드를 제조하였다. In vitro 세포 실험을 통해, 세포/미세입자 스페로이드 형성을 위한 최적의 비율로 세포와 미세입자가 9/1(개수비)로 혼합된 군이 선정되었으며, 스페로이드 내부에 포함된 낙엽적층구조 미세입자는 산소와 자양분을 포함한 세포 배양액의 공급 및 세포 대사물질들의 배출을 위한 micro-channel networks로의 역할을 통해 스페로이드의 불균일한 세포 구성을 억제할 수 있는, 즉 기존 세포 스페로이드의 한계를 극복할 수 있는 하나의 해결책이 될 수 있음을 확인하였다.
A cell spheroid system containing polycaprolactone (PCL) microparticles with leaf-stacked-structure (LSS microparticles) was fabricated using cells and microparticles suspension in agarose-based micro-concave array. It was recognized that the LSS microparticles uniformly distributed in Cell/LSS spheroids can be micro-channel networks for sufficient supply of medium including oxygen/nutrients and removal of metabolic wastes, and thus prevent cellular heterogeneity in spheroids.
Keywords: cell spheroid, microparticle, tissue engineering, tissue regeneration, leaf-stacked structure.
이 연구는 2019년도 단국대학교 대학연구비의 지원으로 연구되었음.
저자들은 이해상충이 없음을 선언합니다.
의학 및 생명공학의 지속적인 발전은 불치병/난치병으로 생각되던 다양한 질병의 극복 및 이를 통한 인류의 삶을 획기적으로 변화시키고 있다. 하지만, 환경오염과 고령화 사회로의 진입은 인류가 극복해
야할 질환의 다양성과 심각성을 가중시키고 있으며, 특히, 임계 범위 이상의 기능을 상실한 조직/장기를 대체하기 위한 조직/장기 이식의 수요가 급격히 증가하고 있다. 그러나 이미 잘 알려져 있듯이, 공여되는 조직/장기에 비해 필요한 조직/장기의 수가 훨씬 많아 이식 대기중 사망자도 꾸준히 늘고 있는 실정이다.1,2 보건복지부 국립장기조직혈액관리원 자료에 따르면 2021년 10월 기준으로 등록된 국내 이식대기자가 42000여 명에 달하지만, 지난 1년 동안 이식 건수는 약 6000건에 불과하다고 보고되고 있다.3 이러한 문제점을 해결하기 위해, 생명과학과 공학의 기본 개념과 기술을 통합/응용하여 생체 조직의 구조와 기능 사이의 상관 관계를 이해하고 나아가서 생체조직의 대용품을 만들어 이식함으로써 우리 몸의 기능을 유지, 향상 또는 복원하는 것을 목적으로 하는 응용 학문인 조직공학이 태동되었다.4 환자의 몸에서 필요한 조직을 채취하고 세포를 분리한 후, 지지체(scaffold)와 함께 일정기간 체외 배양을 거친 다음, 다시 체내에 이식하는 일련의 과정이 조직공학의 기본 개념으로 이해되고 있다. 최근의 연구는 조직 재생에 적합한 특성을 가지는 3차원 형태의 지지체 개발, 조직 재건의 근원이 되는 세포 및 세포의 증식/분화를 조절하기 위한 신호전달인자(signaling molecules)의 서방형 방출에 집중되어 있다.5-7 특히, 다양한 (줄기)세포의 증식/분화 조절은 조직공학의 성패를 좌우하는 요인으로 인식되고 있다. 이러한 세포 연구를 위해, 취급용이성, 경제성 및 재현성이 우수한 2차원 세포 배양법이 널리 활용되고 있으나, 실제 체내 환경과의 차이에서 기인되는, 세포들의 기능 상실 및 원치 않는 세포로의 분화 등은 여전히 해결해야 할 문제로 남아있다.8,9 최근의 연구에 따르면, 3차원의 세포 배양만으로 형태학적으로 체내 세포와 유사한 환경제공 및 세포-세포외기질 간의 상호작용과 세포 간 생체신호 전달이 촉진되는, 즉, 체내에서의 세포 환경을 모사할 수 있음이 보고되고 있다.10,11 3차원 세포 배양법으로는 세포만을 이용한 scaffold-free 방식(세포 스페로이드, 오가노이드 등)과 세포외기질을 인공적으로 만들어 그 안에서 세포를 배양하는 scaffold 방식(다공성 지지체, 하이드로겔 등 활용)이 활발히 연구되고 있다.12,13 이들 중, Sutherland 등이 최초로 보고한 세포 스페로이드 시스템은 외부에서 가해지는 특별한 자극 없이 자발적으로 3차원 세포 응집체(cell aggregate)의 형성, 우수한 세포-세포 상호작용 및 체내 조직 유사 환경 제공 등의 특징을 지니고 있어 조직공학 영역에서 각광을 받고 있다.14-19 세포 스페로이드 제조에 있어 가장 기본적인 요구조건은 세포들이 특정 표면에 점착되지 않고 세포들끼리의 응집을 유도하는 것이며, 이를 위해, 현적 배양(hanging-drop), 마이크로몰딩(micromolding), 펠렛 배양(pellet culture), 교반 배양(spinner culture), 미세유체기술(microfluidics), 자기 부상 또는 자기 바이오프린팅(magnetic levitation or magnetic bioprinting)등의 방법이 활용되고 있다.15,18,20-22 이렇게 형성된 세포 스페로이드는 조직공학적 응용 외에도, 암 연구, 약물 개발, 정밀의료 등 다양한 연구 분야에도 활발히 활용되고 있다.18,23-26 세포 스페로이드의 생성초기에는 세포들이 조밀하게 밀집된 혈관이 없는 조직(avascular dense tissue)으로 100-150 μm 이내의 제한된 범위 내에서 세포 배양액 혹은 체액의 확산에 의해 세포 생존에 필요한 물질(산소, 자양분, 신호전달인자 등)들의 공급 및 대사물이 배출된다. 하지만, 취급 용이성 및 임상 적용을 위해서는 이보다 더 큰 크기의 세포 스페로이드가 필요하므로, 실제 연구되고 있는 세포 스페로이드 내부 및 중심부로 생존에 필요한 물질들의 공급이 제한적이라고 알려져 있다. 따라서, 세포 스페로이드는 외부로부터 내부로 산소/자양분의 농도 구배(concentration gradient)가 발생하며, 이에 따라 불균일한 세포의 구성[괴사(necrotic zone), 휴지기(quiescent zone), 그리고 증식(proliferative zone)]이 불가피하게 형성된다.18,27-29 이러한 문제점을 해결하기 위해, 최근 산소 투과성 막(oxygen permeable membrane)을 이용한 세포 스페로이드 배양법, 스페로이드 내부에 미세 채널(micro-channel networks)을 형성시키는 방법 및 하이드로겔 미세입자가 포함된 스페로이드 등이 개발되어 연구되고 있다.27,30,31
최근 본 연구팀에서는 고분자 용액의 간단한 가열-냉각 과정을 통해, 낙엽적층구조(leaf-stacked structure; LSS)를 갖는 폴리카프로락톤(polycaprolactone, PCL) 미세입자를 제조하였으며, 이 미세입자의 표면이 세포와의 점착성이 우수함은 물론 높은 다공성을 가짐을 보고하였다.32 이에 본 연구에서는, 이러한 미세입자와 세포를 혼합하고 이를 세포 점착이 억제된 표면에서 배양하여 다공성 미세입자가 함유된 세포 스페로이드를 제조하고자 하였다. 이렇게 제조된 세포 스페로이드는 미세입자의 높은 세포 점착성 및 다공성 미세 채널을 통한 산소/자양분의 원활한 공급에 의해 스페로이드의 구조적 안정성 및 세포의 불균일성을 해결할 수 있는 새로운 세포 스페로이드 시스템이 되리라고 기대하였다. 이를 위해, 25-53 μm 크기를 가지는 낙엽적층구조 미세입자를 제조하였고, 모델 세포로 다양한 물질에 대한 독성 및 점착 거동 분석에 널리 활용되는 섬유아세포가 사용되었다.33 다양한 비율로 혼합된 세포/미세입자 용액(세포:미세입자 비율; 10.0:0.0, 9.5:0.5, 9.0:1.0 및 8.0:2.0)을 아가로스 몰드에 분주하여 세포와 미세입자가 균일하게 혼합된 세포 스페로이드를 형성하였으며, 세포와 미세입자의 비율에 따른 세포 스페로이드 형성여부, 시간에 따른 세포 스페로이드의 크기변화, 세포의 생존율/활성화도 및 배양액의 침투 정도 평가를 통해, 기존 세포 스페로이드의 한계를 극복할 수 있는 최적의 미세입자 함유 세포 스페로이드 시스템을 개발하고자 하였다.
실험재료. 낙엽적층구조를 가지는 미세입자를 제조하기 위해 생체적합성/생분해성을 가지는 폴리카프로락톤(PCL; MW 80000 Da, Evonik, 미국)과 용매로 테트라글리콜(tetraglycol, Sigma-Aldrich, 미국)이 사용되었다. 모든 실험에서 사용된 물은 초순수 제조기(비바젠, 한국)로 정제한 증류수가 사용되었다. 세포 스페로이드의 제조 및 배양을 위한 micro-concave array를 제조하기 위해 아가로스 분말(UltraPureTM Agarose; Invitrogen, 미국)이 사용되었으며, micro-concave array를 만들기 위한 몰드(mold)는 Advanced Bio Micro(ABM) Scientific (한국)에 주문 제작하여 사용하였다.
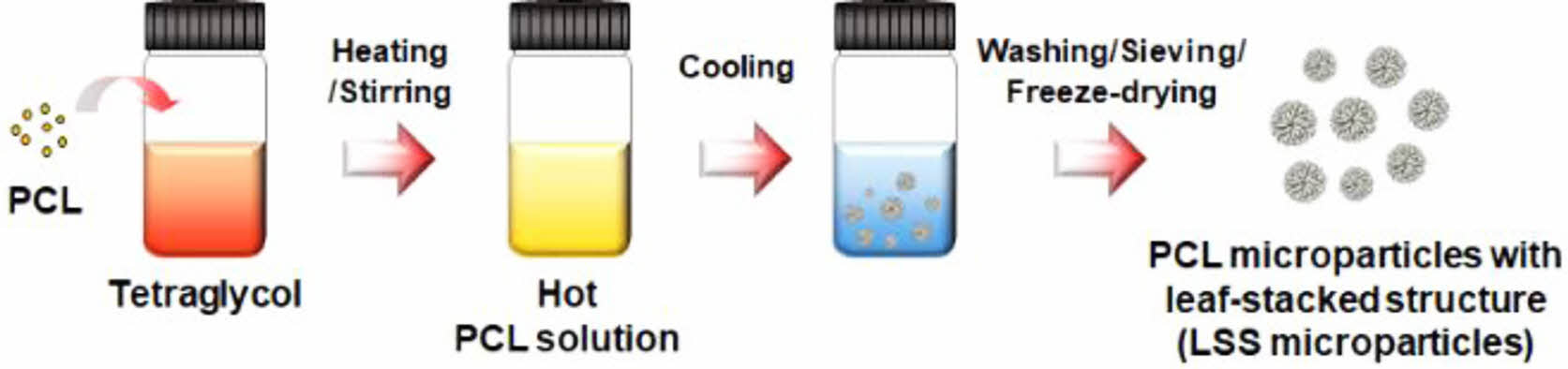
낙엽적층구조를 가지는 미세입자의 제조 및 분석. 전체가 낙엽적층구조를 가지는 PCL 미세입자(PCL LSS)는 본 연구팀의 선행 연구로 개발된 가열-냉각법(heating-cooling technique)으로 간단하게 제조하였다.32 구입한 PCL 분말을 테트라글리콜에 15 wt%가 되도록 정량하여 넣은 후, 90 oC에서 15분 동안 가열하여 용액 상태로 제조하였다. 뜨거운 상태의 고분자 용액을 4 oC에서 1시간 동안 냉각시켜 고분자의 침전을 유도하였으며(투명한 고분자 용액이 불투명하게 변함), 여기에 증류수를 과량 첨가하고 세척/체질/동결건조하여 25-53 μm 크기의 낙엽적층구조를 가지는 미세입자를 제조하였다(Figure 1). 제조된 낙엽적층구조 미세입자의 형태는 단국대학교 바이오의료공학 핵심연구지원센터의 전계방출형 주사전자현미경(FE-SEM; model S-4300, Hitachi, 일본)을 이용하여 관찰하였다. 세포 실험을 위한 낙엽적층구조 미세입자는 산화 에틸렌 멸균 장치(ethylene oxide gas sterilizer)를 이용하여 멸균 후 사용하였다.
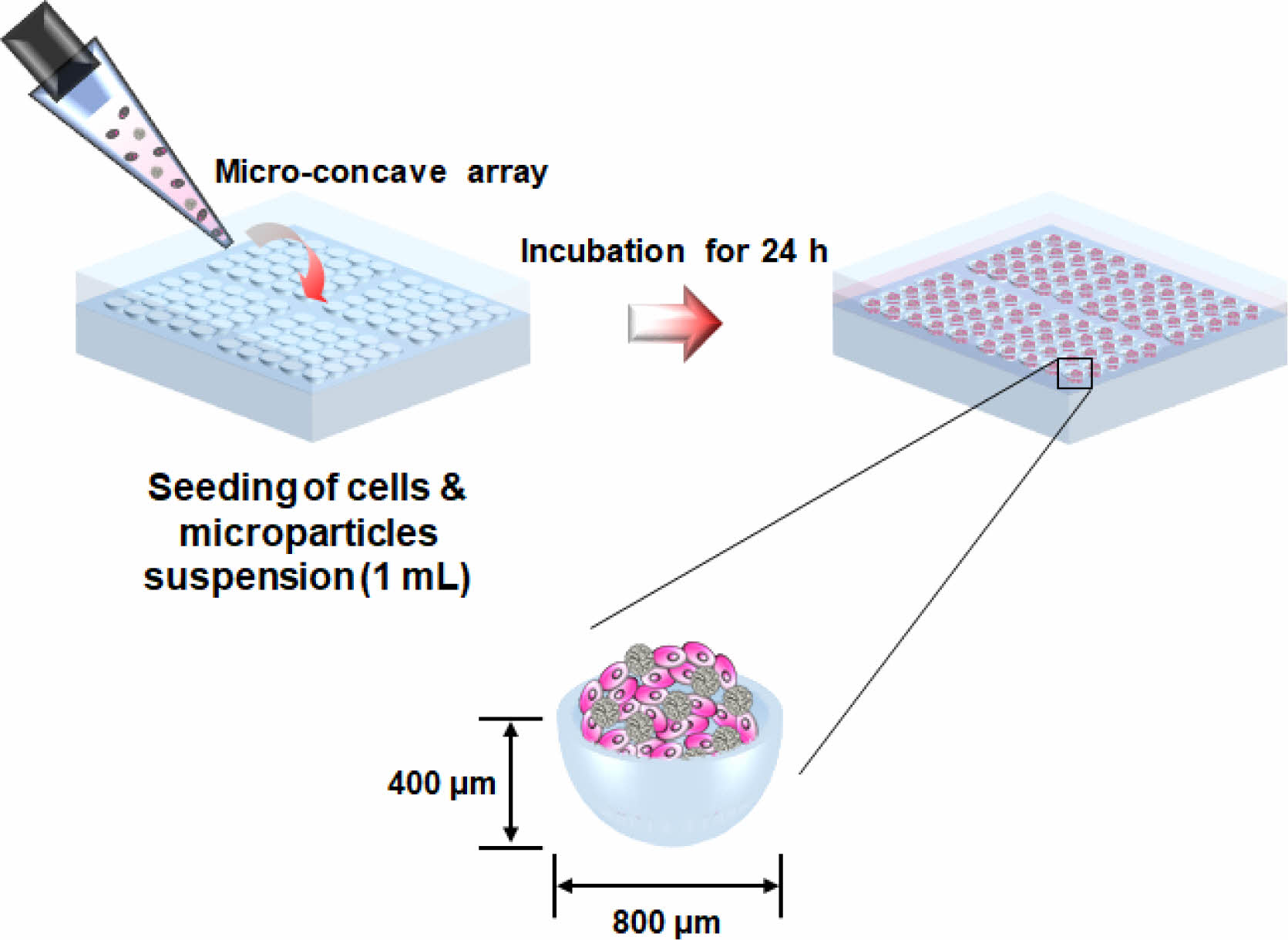
낙엽적층구조 미세입자를 이용한 세포 스페로이드의 제조. 세포 스페로이드 제조용 아가로스 기반의 10×10 micro-concave array(concave well: 직경 800 μm, 깊이 400 μm)를 제조하기 위해, 3D 프린팅으로 제조된 몰드를 이용하였다. 유리 바이알에 담겨진 아가로스 분말에 증류수를 추가하여 5% 아가로스 분산 수용액이 되도록 만들고, 이를 고압증기 멸균(autoclave)을 통해 멸균된 아가로스 수용액을 제조하였다. 이 수용액을 곧바로 상기 몰드에 부어 10분간 굳혀서 아가로스 micro-concave array를 준비하였다. 다양한 비율로 혼합된 세포/낙엽적층구조 미세입자 스페로이드를 제조하기 위해[세포:미세입자 비율(개수비); 10.0:0.0, 9.5:0.5, 9.0:1.0 및 8.0:2.0], 섬유아세포(NIH3T3, mouse embryonic fibroblasts, 한국세포주은행, 한국)와 낙엽적층구조 미세입자의 수를 hemocytometer를 이용하여 측정하고, 이들을 일정 비율로 균일하게 혼합하여 아가로스 micro-concave array에 1 mL을 분주하였다(Figure 2). 이때 세포와 미세입자는 모두 세포 배양액[DMEM (high glucose, 웰진, 한국), 10% FBS(fetal bovine serum, 웰진, 한국), 1% penicillin-streptomycin(웰진, 한국)]에 분산되어 있었으며, micro-concave array에 분주되는 세포와 미세입자의 총 합은 모두 3×106개가 되도록 하였다. 이후 세포 스페로이드의 형태를 광학현미경과 주사전자현미경으로 관찰하였으며, 분주 후 2주 동안 세포/낙엽적층구조 미세입자 스페로이드의 형성여부, 형성된 스페로이드들의 표면/내부 형태, 배양 시간에 따른 스페로이드의 크기변화(구조적 안정성), 스페로이드를 구성하는 세포들의 생존율/활성화도 및 스페로이드 내부로 배양액의 침투 정도 등이 평가되었다.
세포/낙엽적층구조 미세입자 스페로이드의 세포 생존 분석. 배양 0, 2주 후, 세포/미세입자 스페로이드 내에 존재하는 세포의 생존율을 평가하였다. 모든 실험군에서 30개의 스페로이드를 회수하여 1.5 mL 마이크로 튜브에 옮겨 담고, 인산완충생리식염수(phosphate buffered saline; PBS)를 이용하여 세포 배양액을 세척하였다. 이후, 0.5% trypsin-EDTA 용액(웰진, 한국)을 50 μL를 첨가하여 단일 세포로 풀어주고, trypan blue 염색을 통해 세포 생존율을 평가하였다.
세포/낙엽적층구조 미세입자 스페로이드의 조직학적 관찰. 배양 2주 후, 스페로이드를 회수하여 스페로이드 내/외부 세포들의 분포 및 증식 여부를 H&E 염색과 Ki-67 면역조직화학적 염색을 통해 관찰하였다. Ki-67은 세포의 핵에 발현하는 단백질로 세포의 증식상태를 나타내는 표지자로 알려져 있다.34 모든 군에서 각 스페로이드를 회수하여 1.5 mL 마이크로 튜브에 위치시키고 PBS를 이용하여 세척한 후, 4% 파라포름알데히드(paraformaldehyde, PFA)를 이용하여 4 oC에서 20분간 보관하였다. 이들을 optimal cutting temperature (OCT) compound 내에서 냉동시키고, 냉동조직절편기를 이용하여 두께 10 μm의 절편을 제조한 후, H&E 염색과 Ki-67 면역조직화학 염색을 진행하였다. 염색이 완료된 시료들은 광학 현미경(CKX41, Olympus, 일본)을 이용하여 관찰하였다.
세포/낙엽적층구조 미세입자 스페로이드 내부의 물질 침투능 평가. 산소/자양분 등 세포 생존에 필수적인 물질들을 포함하는 세포 배양액의 세포 스페로이드 내부로의 침투에 미세입자가 미치는 영향을 평가하기 위해, 세포 염색 시약인 CM-DiI(Thermo Fisher Scientific, 미국)을 이용하였다. 세포/미세입자 혼합 용액을 아가로스 micro-concave array에 분주 24시간 후, 세포 배양액을 CM-DiI가 5 μL/mL의 농도로 포함된 새로운 세포 배양액으로 교체하였다. CM-DiI 처리 후, 1, 3, 6, 12, 그리고 24시간 마다 스페로이드 시료를 회수하여 고정/냉동절편을 통해 10 μm의 두께를 가지는 절편을 제조하였다. 스페로이드의 고정 및 절편 제조 과정은 조직학적 관찰을 위해 제조한 시편들과 동일 과정을 거쳐 제조되었다. 추가적인 세포 핵 염색을 위해, DAPI(4',6-diamidino-2-phenyl- indole)염색이 진행되었고, 형광 현미경(Nikon ECLIPSE Ps2R, Nikon, 일본)을 이용하여 CM-DiI의 스페로이드 내부로의 침투 정도를 평가하였다.
통계학적 분석. 각 실험의 결과는 평균±표준 편차 표현되었고, 통계 분석은 IBM SPSS Statistics 22(IBM, 미국)를 사용하여 수행되었다. 결과값은 일원 분산 분석[one-way analysis of variance(ANOVA)]을 통해 평가되었으며, p 값이 0.05 미만인 경우를 통계적으로 유의미한 것으로 간주하였다.
|
Figure 1 Schematic diagram showing the fabrication of the porous PCL microparticles with leaf-stacked structure (LSS microparticles) using a heating-cooling technique. |
|
Figure 2 Schematic diagram showing the agarose-based microconcave array and cell culture procedure to fabricate cell spheroids. |
낙엽적층구조 미세입자의 형태학적 분석. 90 oC로 가열된 PCL 용액(테트라글리콜에 용해)을 4 oC에서 냉각하는 간단한 방법(heating-cooling technique)을 통해 낙엽적층구조를 가지는 미세입자를 제조하였다. 제조된 미세입자는 전체 형태가 마치 얇고 길쭉한 낙엽이 쌓인 듯한 구조를 가지고 있어서 낙엽적층구조 미세입자(LSS microparticles)라고 명명하였다(Figure 3).32 이 독특한 형태의 낙엽적층구조는 가열된 고분자 용액의 냉각(침전)과정에서 고분자 사슬들의 초기 응집 및 추가 결정화로 설명될 수 있다. 테트라글리콜은 상온에서 PCL을 용해시킬 수 있는 good solvent가 아니므로, 온도를 가하여 PCL의 테트라글리콜에 대한 용해도 높여 투명한 PCL 용액을 제조할 수 있었다. 이 용액의 온도를 다시 낮추면, 용액 내에서 PCL의 용해도가 낮아져 자연스럽게 고분자의 침전이 발생하게 된다. 이때, 반결정성(semi-crystalline)의 PCL의 결정성 부분(crystalline region)끼리 먼저 응집(aggregation 혹은 crystallization)하게 되고, 이 응집이 구형으로 성장(spherical growth)하면서 미세입자를 형성하게 된다.32,35,36 본 연구팀의 선행 연구를 통해 이러한 낙엽이 적층된 것과 같은 구조(pillar-like structure)의 거친 표면과 넓은 표면적으로 인해 세포 부착 및 증식에 유리한 환경을 제공함을 확인할 수 있었으며, 이러한 현상은 타 연구팀의 연구에서도 이미 잘 알려진 사실이다.32,36,37 따라서 이러한 낙엽적층구조 미세입자를 세포와 혼합하여 스페로이드 형태로 만든다면, 세포-미세입자의 높은 친화력에 의한, 세포 스페로이드의 형태적 안정성을 부여할 수 있으리라 판단되었다. 또한, 미세입자의 다공들은 스페로이드의 외부와 내부를 연결하는 채널(channel)로의 역할, 즉 세포 생존에 필수적인 인자들을 세포 스페로이드 내에 균일하게 전달 및 세포 대사물질을 외부로 방출하여 기존 세포 스페로이드의 가장 큰 한계인‘불균일한 세포의 구성’문제를 해결할 수 있는 새로운 시스템으로 적용이 가능하리라 기대되었다.
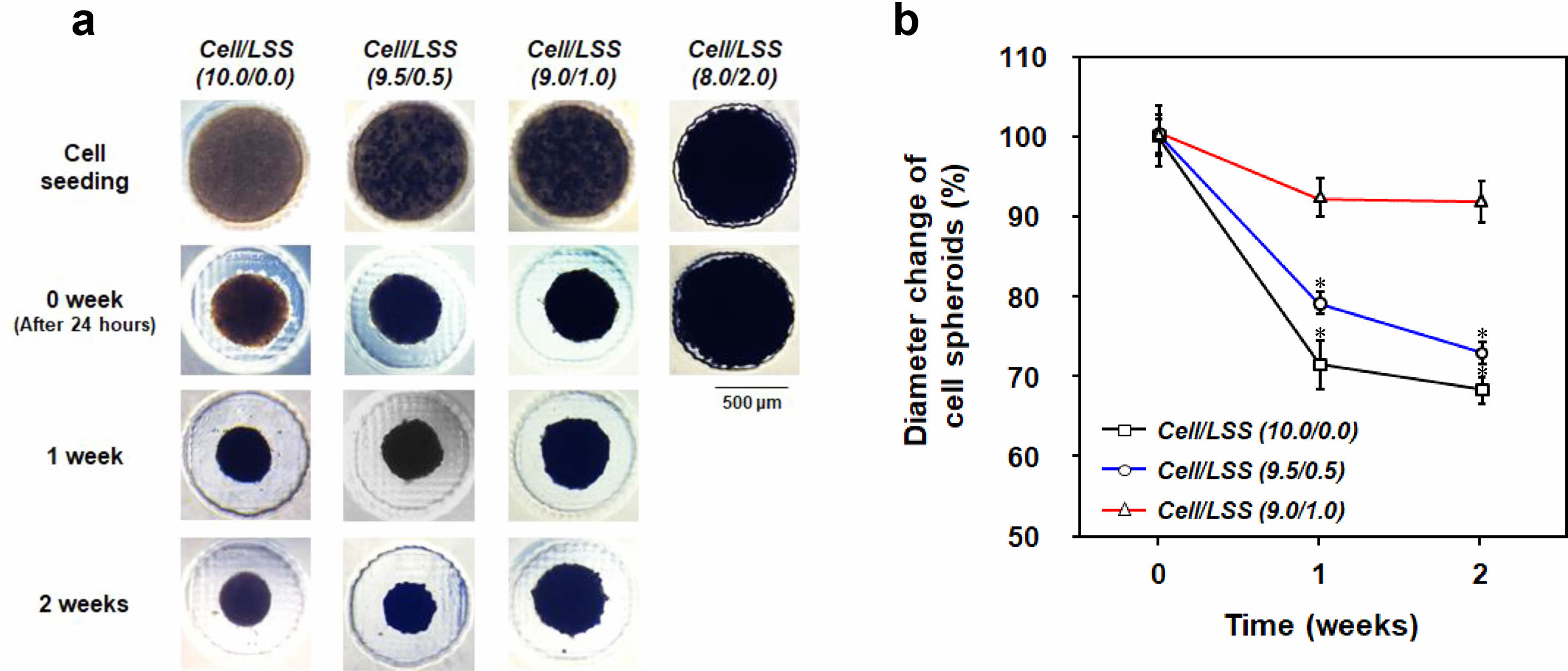
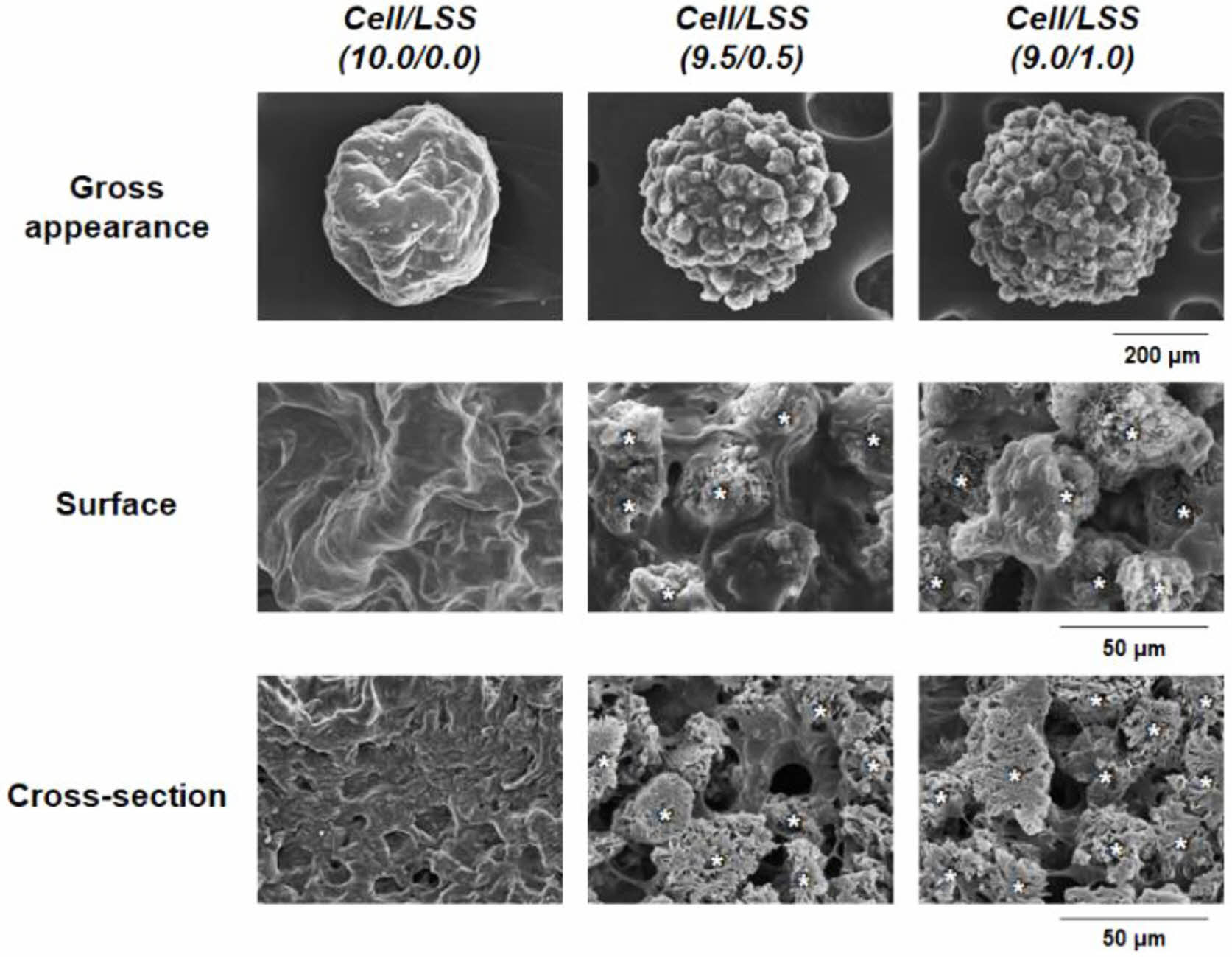
세포/낙엽적층구조 미세입자 스페로이드의 제조. 세포/낙엽적층구조 미세입자의 혼합비율에 따른 세포 스페로이드의 형성 여부 및 배양 시간에 따른 세포 스페로이드의 크기변화(형태 안정성)를 평가하기 위해, 다양한 비율로 혼합된 세포와 낙엽적층구조 미세입자의 혼합 용액을 micro-concave array에 분주하고 배양 시간에 따른 형태를 광학현미경과 주사전자현미경을 이용하여 관찰하였다. Figure 4에서 확인할 수 있듯이, 세포 수를 기준으로 미세입자가 0, 5, 10%의 비율로 혼합된 군[Cell/LSS(10.0/0.0), Cell/LSS(9.5/0.5), Cell/LSS(9.0/1.0)]에서는 그 비율에 상관없이 분주 후 24시간(0주)에서 약 500 μm의 크기를 가지는 구형의 세포 스페로이드가 잘 형성됨을 관찰할 수 있었다. 이는 아가로스 기반의 micro-concave array 표면의 세포 점착 억제 특성 및 micro-concave의 바닥에 모인 세포와 세포와의 점착 특성을 가지는 낙엽적층구조 미세입자의 자발적인 응집현상으로 이해될 수 있다. 즉, 본 연구에 사용된 아가로스 기반의 micro-concave array가 세포/미세입자 스페로이드 형성을 위한 적절한 환경을 제공함을 확인할 수 있었다. 하지만, 20% 이상의 비율로 미세입자가 포함된 경우, 시간이 지나도 스페로이드가 형성되지 않고, micro-
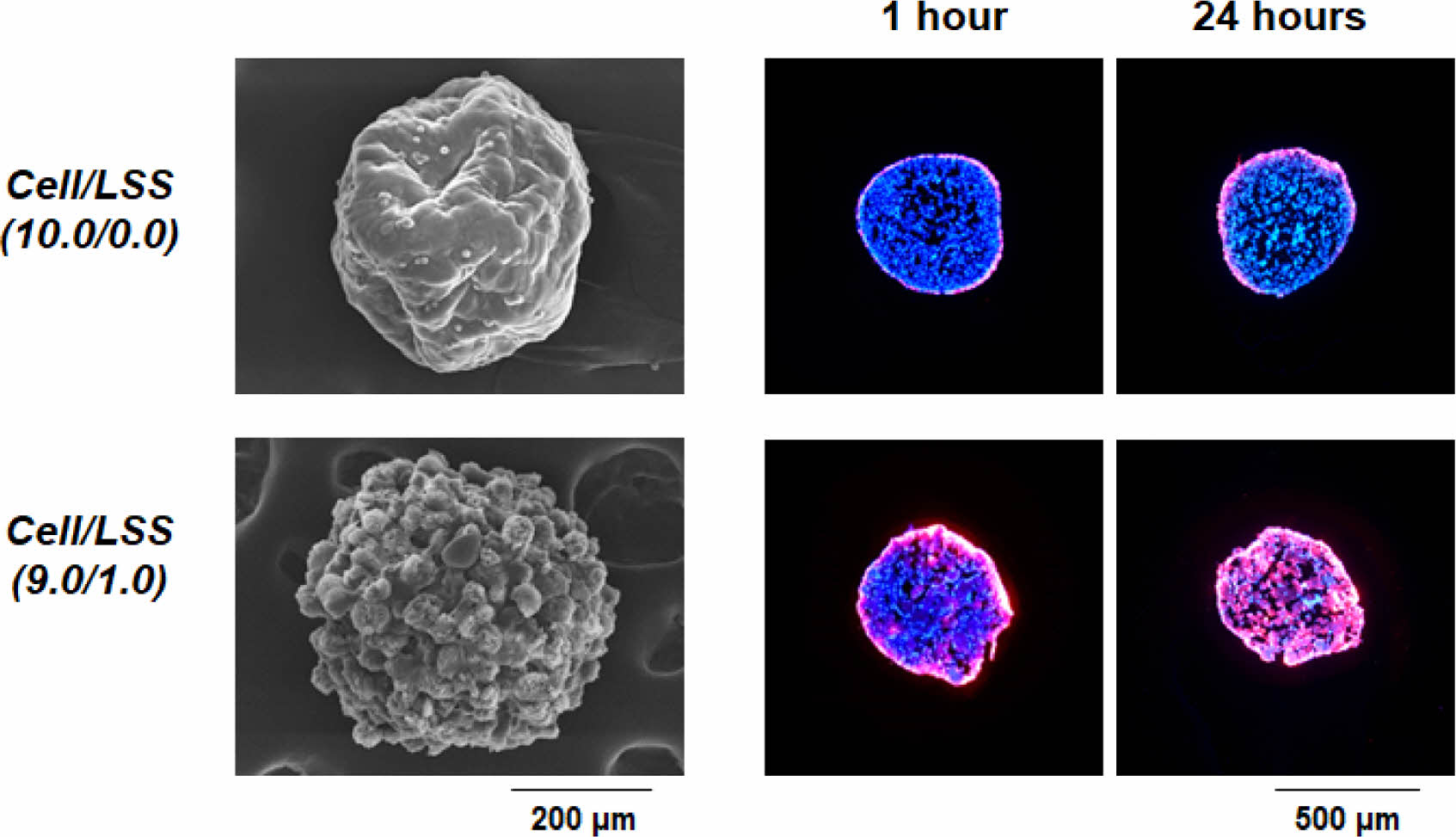
concave 바닥 면 전체에 분포되어 있음을 확인하였다. 세포/미세입자 스페로이드의 형성은 세포-세포 및 세포-미세입자 간의 상호작용이 중력을 극복할 수 있는 수준일 때 가능한 것이나, 미세입자의 비율이 높아질수록 세포 수가 줄어들고, 이에 따라 세포-세포 및 세포-미세입자 간의 상호작용이 감소되어 스페로이드를 형성시키지 못한다고 판단되었다. 또한, 배양 시간에 따라, Cell/LSS(10.0/0.0) 및 Cell/LSS(9.5/0.5) 군에서는 스페로이드의 크기가 현저히 감소함을 관찰하였으나, Cell/LSS(9.0/1.0) 군에서는 크기가 다소 감소하나 그 차이는 유의하지 않음도 확인할 수 있었다. 다양한 비율로 혼합된 세포/미세입자 용액을 micro-concave array에 분주하고, 24시간 후에 형성된 스페로이드의 내/외부 형태를 주사전자현미경으로 관찰한 결과를 Figure 5에 나타내었다. 앞에서 언급되었듯이, 세포만으로 형성된 스페로이드[Cell/LSS(10.0/0.0)]는 내/외부가 세포들로 조밀하게 밀집되어 있어 세포 생존에 필수적인 산소/자양분을 포함한 세포 배양액 혹은 체액이 외부에서 내부로의 전달이 어려운 구조를 가지고 있음을 관찰하였다. 하지만, 낙엽적층구조 미세입자가 포함된 군[Cell/LSS (9.5/0.5) 그리고 Cell/LSS(9.0/1.0)]에서는 다공성 미세입자가 스페로이드의 내/외부에 균일하게 존재하며, 다공성 미세입자 혹은 미세입자 사이의 공간이 세포배양액 혹은 체액의 효율적인 전달을 위한 채널로써의 역할을 할 수 있을 것이라 기대되었다. 또한, 낙엽적층구조 미세입자의 표면에 세포들이 잘 펼쳐져 있는(spreading) 즉,
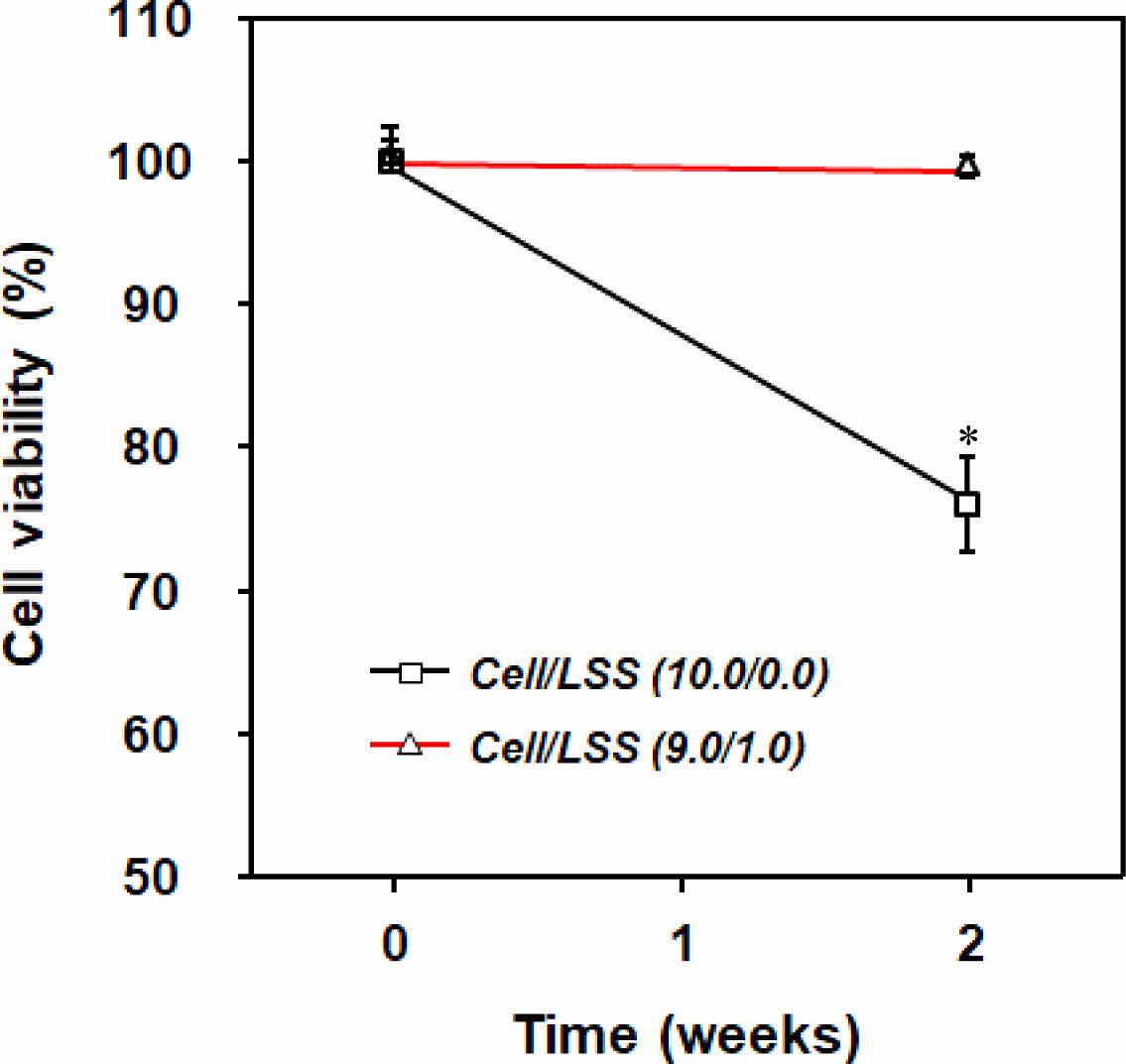
낙엽적층구조가 세포의 점착에 유리한 환경을 제공함을 확인할 수 있었다. 이러한 세포-미세입자 간의 상호작용[i.e., cell-extracellular matrix (ECM) interaction]을 통해 스페로이드의 형태적 안정성이 부여될 것이라고 기대되었다. 상기의 세포 스페로이드 형태 분석을 통해, 세포 스페로이드 내부로 세포 생존에 필수적인 물질들의 보다 효과적인 공급 및 형태 유지를 위한, 가장 많은 미세입자를 포함하는 Cell/LSS(9.0/1.0)군을 세포/미세입자 스페로이드 최적조건으로 선정하였으며, 이후의 실험에서는 Cell/LSS (10.0/0.0)군과 Cell/LSS(9.0/1.0)군의 비교를 통해 세포 스페로이드에 포함된 낙엽적층구조 미세입자의 역할을 평가하였다. Figure 6에는 미세입자의 포함 여부에 따른 스페로이드 내 세포 생존율 평가 결과를 나타내었다. Cell/LSS(10.0/0.0)군에서는 2주 동안의 배양기간 동안 세포의 생존율이 급격히 감소함을 관찰할 수 있었다. 이는 조밀한 구조의 세포만으로 구성된 스페로이드 내부로 산소/자양분의 원활치 못한 공급과 세포 스페로이드 내 세포들이 배출하는 대사 노폐물들의 축적에 따른 중심부 세포들의 사멸에 의한 결과라고 판단된다.18,27-29 선행 연구들에 따르면, 중심부의 세포 괴사를 방지할 수 있는 세포 스페로이드의 최적 직경은 약 100-150 μm이고, 약 300 μm의 세포 스페로이드는 배양 시간에 따라 그 크기가 점점 작아진다고 보고되고 있으며, 이러한 결과는 상기와 동일한 원인(조밀 구조, 불충분한 산소/자양분의 공급 및 대사 노폐물의 축적)에 의한 결과로 설명하고 있다.38,39 이에 비해, 낙엽적층구조 미세입자가 포함된 군[Cell/LSS(9.0/1.0)]에서는 세포배양 2주 후에도 0주차의 세포수가 유의미하게 변하지 않음을 관찰할 수 있었다. 이는 Figure 5에서 관찰된, 미세입자에 의해 형성된 다공들이 세포 배양액의 효과적인 이동 통로로써의 역할을 충실히 수행하고 있기 때문이라 판단된다.
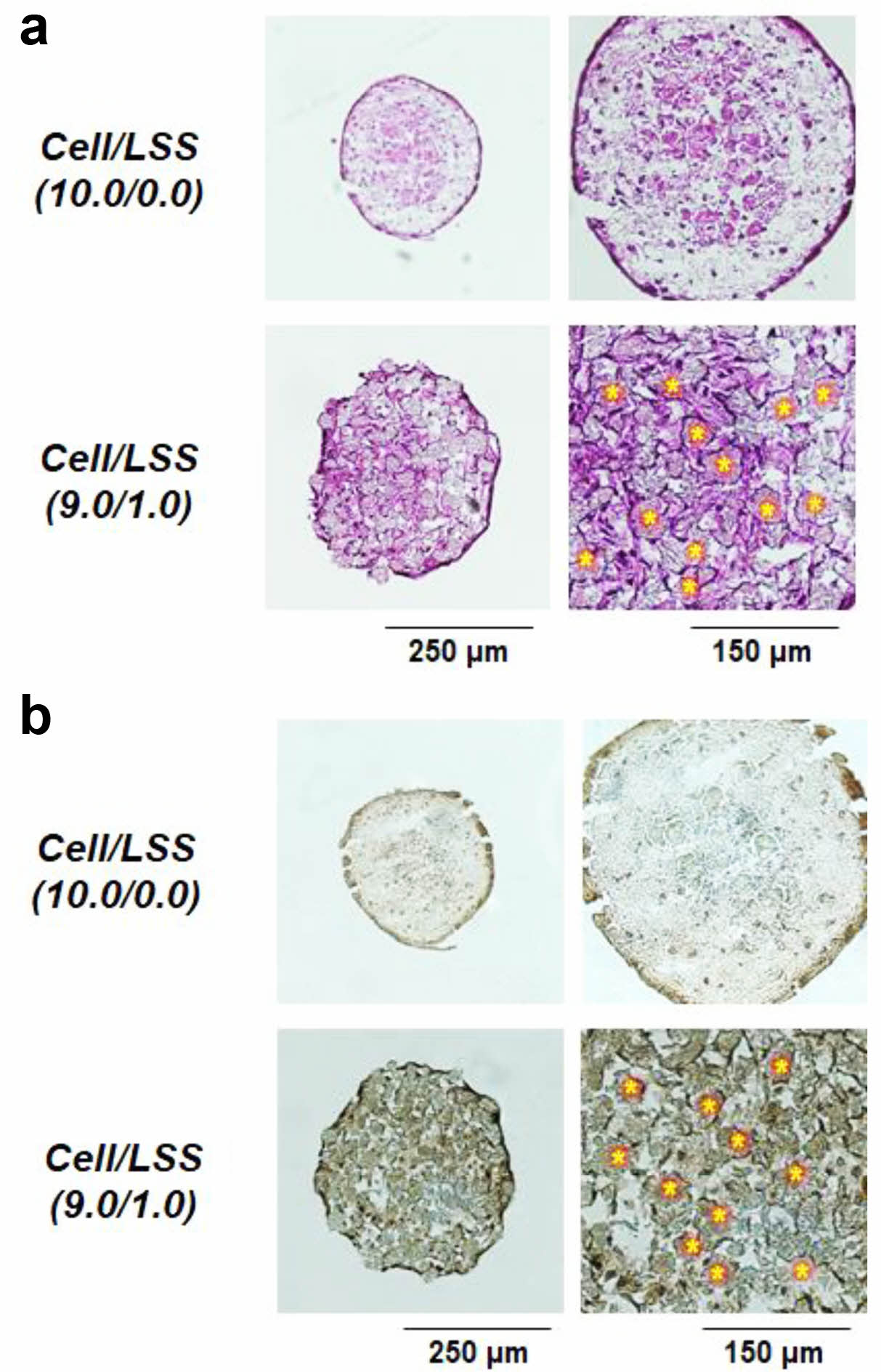
세포/낙엽적층구조 미세입자 스페로이드의 조직학적 관찰. Figure 7에는 세포로만 구성된 세포 스페로이드[Cell/LSS (10.0/0.0)]와 낙엽적층구조 미세입자가 포함된 세포 스페로이드[Cell/LSS(9.0/1.0)]에서의 세포 구성 및 활성도(증식)를 비교·평가하기 위한 조직학적 결과를 나타내었다. H&E 염색 결과에서 확인할 수 있듯이, Cell/LSS(10.0/0.0)군에서는 스페로이드의 외곽부(peripheral region)에서 세포핵과 세포질이 진하게 염색이 되나, 내부에는 염색이 선명하지 않은, 즉, 내부의 세포들이 정상적인 상태가 아님을 예측할 수 있었다. 또한, 세포의 증식(활성) 표지자(marker)인 Ki-67 염색에서도 스페로이드 외부에 존재하는 세포들에서만 증식이 관찰되고, 내부에서는 세포의 증식(활성)이 현저히 감소함을 관찰할 수 있었다. 이러한 현상은 이미 앞에서 언급되었던, 세포 스페로이드 내부로 산소/자양분의 불충분한 공급과 세포 대사 노폐물들의 축적에 따른 세포 사멸 및 활성 감소의 명확한 증거라 판단된다. Ki-67은 세포주기 중에서 G1기를 제외한 모든 주기에서 세포의 핵에 발현하는 단백질로 세포의 증식상태를 나타내는 표지자로 잘 알려져 있다.34 이와는 달리, 낙엽적층구조 미세입자가 포함된 Cell/LSS(9.0/1.0)군에서는 세포들이 스페로이드 전체를 통해서 균일하게 존재할 뿐 아니라, 그 세포들의 활성도가 스페로이드 전체를 통해 잘 유지하고 있음을 관찰할 수 있었다. 또한, 낙엽적층구조 미세입자가 스페로이드 내에 균일하게 존재하고, 이 미세입자 표면에 세포들이 잘 점착되어 있을 뿐만 아니라, 다공성의 미세입자들이 스페로이드 내부에서 산소/자양분 및 대사물질들의 효율적인 교환을 위한 공간(채널)으로 작용할 수 있음도 확인할 수 있었다.
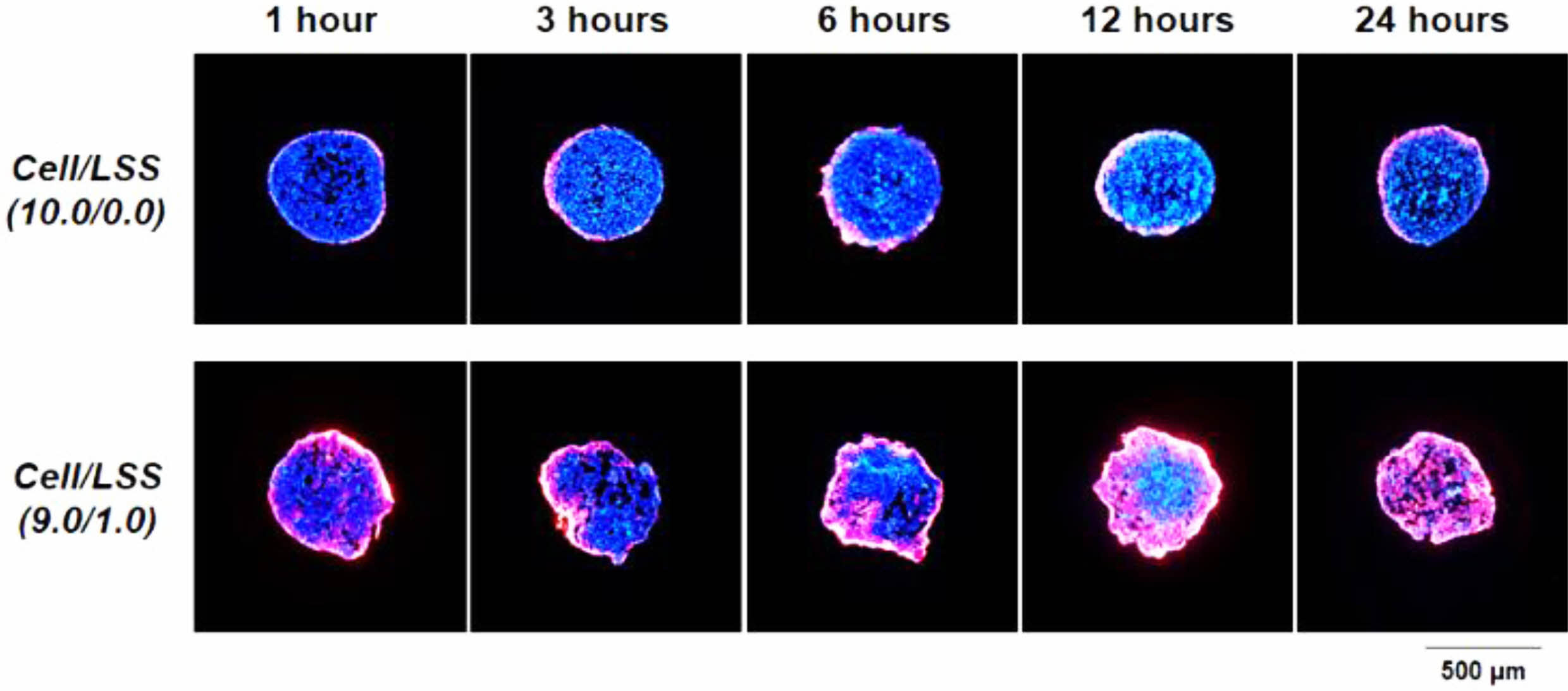
세포/낙엽적층구조 미세입자 스페로이드의 물질 침투능 평가. 세포/낙엽적층구조 미세입자 스페로이드에 존재하는 다공성 미세입자가 스페로이드에서 물질의 공급/배출을 위한 micro-channel networks의 역할을 수행할 수 있는지 여부를 확인하기 위해, CM-DiI가 포함된 세포 배양액을 이용하여 이들의 스페로이드 내부로의 침투능을 평가하였다. CM-DiI은 thiol 반응성 chloromethyl moiety를 함유하고 있어 세포의 thiol과 공유 결합을 형성한다고 알려져 있다.40 따라서, CM-DiI가 침투된 깊이까지의 세포와 반응하고 이들이 형광을 발현하므로, 세포 스페로이드 내로의 세포 배양액의 침투 정도를 명확하게 확인할 수 있다. 세포/낙엽적층구조 미세입자 혼합 용액을 micro-concave array에 분주하고 24시간 후, 각 스페로이드에 CM-DiI을 포함한 세포 배양액을 도입하고 1, 3, 6, 12, 24시간 동안 CM-DiI의 침투 정도를 형광현미경으로 관찰하였다. 세포 배양 1주 혹은 2주에서는 두 군 간의 스페로이드 크기 차이가 현저하므로 물질 침투능 비교/평가 시험에 활용하지 않았다(Figure 4 참조). Figure 8에서 확인할 수 있듯이, 스페로이드에 낙엽적층구조 미세입자가 포함되어 있는 군[Cell/LSS(9.0/1.0)]에서는 CM-DiI가 배양 시간에 따라 스페로이드의 중심부로 천천히 이동하며, 24시간 후에는 스페로이드의 중심부까지 침투되고 있음을 확인할 수 있었다. 이러한 결과는, 스페로이드 내에 균일하게 존재하고 있는 다공성 미세입자들이 산소/자양분을 포함한 세포배양액의 효과적인 전달 및 세포 대사물질들의 배출을 위한 micro-channel networks로의 역할을 효과적으로 수행하고 있음을 보여주는 명확한 증거라고 사료된다. 하지만, 세포만으로 구성된 스페로이드 군[Cell/LSS(10.0/0.0)]에서는, 기존에 보고된 바와 같이, 세포 배양액에 포함된 물질들이 스페로이드 내로 깊이 전달되지 못하고 겉표면에만 얇게 침투됨을 확인할 수 있었다. Kojima 등의 연구에서도,30 세포 스페로이드 내에 micro-channel networks가 존재하면, 이 채널 구조를 통한 물질 공급/배출이 원활해지고, 이를 통해 스페로이드 내부에 존재하는 세포들의 저산소 환경 개선 및 활성이 촉진된다고 보고하고 있다. 이상의 결과와 문헌들을 기초로, 본 연구에서 개발한 낙엽적층구조 미세입자는 세포 스페로이드의 형성 및 형태적 안정성을 부여함은 물론, 스페로이드 내부에 형성된 micro-channel networks를 통한 원활한 물질 공급/배출로 기존 세포 스페로이드의 한계인 임계 크기 이상에서 나타나는 내부 괴사 현상을 극복하여 불균일한 세포 구성을 억제할 수 있는 하나의 첨가제로 활용이 가능하리라 기대되었다.

|
Figure 3 Gross appearance and surface morphology of the LSS microparticles |
|
Figure 4 Characterization of cell spheroids [Cell/LSS (10.0/0.0), Cell/LSS (9.5/0.5), Cell/LSS (9.0/1.0), and Cell/LSS (8.0/2.0)]: (a) Representative images of cell spheroids and (b) quantitative analysis of temporal variation in the size of cell spheroids [n=3 (1=30 spheroid s); *p<0.05, compared to the result of 0 week]. |
|
Figure 5 Gross appearance, surface and cross-sectional images of each cell spheroid at 24 hours of cell culture (*, LSS microparticles). |
|
Figure 6 Number of viable cells in each cell spheroid group during cell culture up to 2 weeks [n=3 (1=30 spheroids); *p<0.05, compared to the result of 0 week]. |
|
Figure 7 (a) H&E staining; (b) Ki-67, staining of cell spheroids [Cell/LSS (10.0/0.0) and Cell/LSS (9.0/1.0)] at 2 weeks of cell culture (*, LSS microparticles). |
|
Figure 8 Infiltration behavior of cell culture medium containing CM-DiI into cell spheroids over time (red, CM-DiI-stained cells; blue, cell nucleus). |
본 연구에서는 세포 점착성을 가지는 다공성의 낙엽적층구조 미세입자와 세포로 구성된 세포 스페로이드 시스템을 활용하여 기존 세포 스페로이드 시스템의 한계를 극복하고자 하였다. 폴리카프로락톤 용액의 단순 가열-냉각 과정을 통해 낙엽적층구조를 가지는 다공성 미세입자를 제조하였고, 세포와 낙엽적층구조 미세입자 혼합 용액을 아가로스 기반의 micro-concave array에 분주하여 약 500 μm의 크기를 가지는 세포/낙엽적층구조 미세입자 스페로이드를 제조하였다. In vitro 세포 실험을 통해, 세포/낙엽적층구조 미세입자 스페로이드 형성을 위한 최적의 비율로 세포와 미세입자가 9/1(개수비)로 혼합된 군이 선정되었다. 또한, 스페로이드 내부에 포함된 낙엽적층구조 미세입자는 산소와 자양분을 포함한 세포 배양액의 공급 및 세포 대사물질들의 배출을 위한 micro-channel networks로의 역할을 통해 임계 크기 이상에서 나타나는 스페로이드 내부의 괴사 현상을 극복하여 불균일한 세포 구성을 억제할 수 있는, 즉 기존 세포 스페로이드의 시스템의 문제를 극복할 수 있음을 관찰하였다. 이러한 결과로부터 본 연구에서 개발된 세포/낙엽적층구조 미세입자 스페로이드 시스템은 다양한 조직 재생을 위한 조직공학적 응용, 암 연구, 약물 개발 및 정밀의료 등에 널리 활용될 수 있으리라 기대된다.
- 1. Rim, N. G.; Lee, Y. B.; Kim, S. J.; Shin, H. S. Current Status and Prospect of Biomaterials as Tissue Substitutes in Regenerative Medicine. Korean Ind. Chem. News. 2010, 13, 2-17.
- 2. Mandrycky, C.; Phong, K.; Zheng, Y. Tissue Engineering Toward Organ-Specific Regeneration and Disease Modeling. MRS Commun. 2017, 7, 332-347.
-

- 3. Registration status by registration institution wishing to donate and registration status of those wishing to donate by region. [Online], 2022, Center of Korean Network for Organ Sharing [KONOS] (Ministry of Health and Welfare). https://www.konos.go.kr/konosis/common/bizlogic.jsp (accessed January 14, 2022).
- 4. Langer, R.; Vacanti, J. P. Tissue Engineering. Science 1993, 260, 920-926.
-

- 5. Berthiaume, F.; Maguire, T. J.; Yarmush, M. L. Tissue Engineering and Regenerative Medicine: History, Progress, and Challenges. Annu. Rev. Chem. Biomol. Eng. 2011, 2, 403-430.
-

- 6. Jin, H. R. Tissue Engineered Human Cartilage. Korean J. Otolaryngol. 2003, 46, 355-363.
- 7. Shafiee, A.; Atala, A. Tissue Engineering: Toward a New Era of Medicine. Annu. Rev. Chem. Biomol. Eng. 2017, 68, 29-40.
-

- 8. Thiemicke, A.; Jashnsaz, H.; Li, G.; Neuert, G. Generating Kinetic Environments to Study Dynamic Cellular Processes in Single Cells. Sci. Rep. 2019, 9, 1-10.
-

- 9. Costa, E. C.; Moreira, A. F.; de Melo-Diogo, D.; Gaspar, V. M.; Carvalho, M. P.; Correia, I. J. 3D Tumor Spheroids: An Overview on the Tools and Techniques Used for Their Analysis. Biotechnol. Adv. 2016, 34, 1427-1441.
-

- 10. Langhans, S. A. Three-dimensional In Vitro Cell Culture Models in Drug Discovery and Drug Repositioning. Front. Pharmacol. 2018, 9, 1-14.
-

- 11. Sooriyaarachchi, D.; Minière, H. J.; Maharubin, S.; Tan, G. Z. Hybrid Additive Microfabrication Scaffold Incorporated with Highly Aligned Nanofibers for Musculoskeletal Tissues. Tissue Eng. Regen. Med. 2019, 16, 29-38.
-

- 12. Fang, Y.; Eglen, R. M. Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS Discov. 2017, 22, 456-472.
-

- 13. Cui, X.; Hartanto, Y.; Zhang, H. Advances in Multicellular Spheroids Formation. J. R. Soc. Interface 2017, 14, 20160877.
-

- 14. Inch, W. R.; McCredie, J. A.; Sutherland, R. M. Growth of Nodular Carcinomas in Rodents Compared with Multi-Cell Spheroids in Tissue Culture. Growth 1970, 34, 271-282.
- 15. Białkowska, K.; Komorowski, P.; Bryszewska, M.; Miłowska, K. Spheroids as a Type of Three-Dimensional Cell Cultures-Examples of Methods of Preparation and the Most Important Application. Int. J. Mol. Sci. 2020, 21, 6225.
-

- 16. Ravi, M.; Paramesh, V.; Kaviya, S. R.; Anuradha, E.; Solomon, F. P. 3D Cell Culture Systems: Advantages and Applications. J. Cell Physiol. 2015, 230, 16-26.
-

- 17. Liao, W.; Wang, J.; Xu, J.; You, F.; Pan, M.; Xu, X.; Weng, J.; Han, X.; Li, S.; Li, Y.; Liang, K.; Peng, Q.; Gao, Y. High-Throughput Three-Dimensional Spheroid Tumor Model Using a Novel Stamp-Like Tool. J. Tissue Eng. 2019, 10, 1-15.
-

- 18. Ryu, N. E.; Lee, S. H.; Park, H. Spheroid Culture System Methods and Applications for Mesenchymal Stem Cells. Cells 2019, 8, 1620.
-

- 19. Edmondson, R.; Broglie, J. J.; Adcock, A. F.; Yang, L. Three-Dimensional Cell Culture Systems and Their Applications in Drug Discovery and Cell-Based Biosensors. Assay Drug Dev. Techn. 2014, 12, 207-218.
-

- 20. Park, J. H. Recent Advances in Three-Dimensional Multicellular Spheroid Formation for Biomedical Research. Korean J. Otorhinolaryngol-Head Neck Surg. 2020, 63, 245-251.
-

- 21. Wang, A.; Madden, L. A.; Paunov, V. N. Advanced Biomedical Applications Based on Emerging 3D Cell Culturing Platforms. J. Mater. Chem. B 2020, 8, 10487-10501.
-

- 22. Chaicharoenaudomrung, N.; Kunhorm, P.; Noisa, P. Three-Dimensional Cell Culture Systems as an In Vitro Platform for Cancer and Stem Cell Modeling. World J. Stem Cells 2019, 11, 1065-1083.
-

- 23. Tseng, T. C.; Wong, C. W.; Hsieh, F. Y.; Hsu, S. H. Biomaterial Substrate‐Mediated Multicellular Spheroid Formation and Their Applications in Tissue Engineering. Biotechnol. J. 2017, 12, 1700064.
-

- 24. Laschke, M. W.; Menger, M. D. Life is 3D: Boosting Spheroid Function for Tissue Engineering. Trends Biotechnol. 2017, 35, 133-144.
-

- 25. Jeon, J. H.; Yun, B. G.; Lim, M. J.; Kim, S. J.; Lim, M. H.; Lim, J. Y.; Park, S. H.; Kim, S.W. Rapid Cartilage Regeneration of Spheroids Composed of Human Nasal Septum Derived Chondrocyte in Rat Osteochondral Defect Model. Tissue Eng. Regen. Med. 2020, 17, 81-90.
-

- 26. Kim, J. H.; Lee, J. Y. Multi-Spheroid-Loaded Human Acellular Dermal Matrix Carrier Preserves Its Spheroid Shape and Improves In Vivo Adipose-Derived Stem Cell Delivery and Engraftment. Tissue Eng. Regen. Med. 2020, 17, 271-283.
-

- 27. Curcio, E.; Salerno, S.; Barbieri, G.; De Bartolo, L.; Drioli, E. A. Bader, Mass Transfer and Metabolic Reactions in Hepatocyte Spheroids Cultured in Rotating Wall Gas Permeable Membrane System. Biomaterials 2007, 28, 5487-5497.
-

- 28. Gilazieva, Z.; Ponomarev, A.; Rutland, C.; Rizvanov, A.; Solovyeva, V. Promising Applications of Tumor Spheroids and Organoids for Personalized Medicine. Cancers 2020, 12, 2727.
-

- 29. Cesarz, Z.; Tamama, K. Spheroid Culture of Mesenchymal Stem Cells. Stem Cells Int. 2016, 2016, 9176357.
-

- 30. Kojima, N.; Takeuchi, S.; Sakai, Y. Fabrication of Microchannel Networks in Multicellular Spheroids. Sensor. Actuat. B Chem. 2014, 198, 249-254.
-

- 31. Lee, J.; Lee, S.; Ahmad, T.; Perikamana, S. K. M.; Lee, J.; Kim, E. M.; Shin, H. Human Adipose-Derived Stem Cell Spheroids Incorporating Platelet-Derived Growth Factor (PDGF) and Bio-minerals for Vascularized Bone Tissue Engineering. Biomaterials 2020, 255, 120192.
-

- 32. Kim, H. Y.; An, B. S.; Kim, M. J.; Jeoung, Y. J.; Byun, J. H.; Lee, J. H.; Oh, S. H. Signaling Molecule-Immobilized Porous Particles with a Leaf-Stacked Structure as a Bioactive Filler System. ACS Biomater. Sci. Eng. 2020, 6, 2231-2239.
-

- 33. Zhao, P.; Chen, L.; Shao, H.; Zhang, Y.; Sun, Y.; Ke, Y.; Ramakrishna, S.; He, L.; Xue, W. Cytotoxic and Adhesion-associated Response of NIH-3T3 Fibroblasts to COOH-Functionalized Multi-walled Carbon Nanotubes. Biomed. Mater. 2016, 11, 015021.
-

- 34. Sun, X.; Kaufman, P. D. Ki-67: More than a Proliferation Marker. Chromosoma 2018, 127, 175-186.
-

- 35. Kim, H. Y.; Lee, J. H.; Lee, H. A. R.; Park, J.-S.; Woo, D. K.; Lee, H.-C.; Rho, G.-J.; Byun, J.-H.; Oh, S. H. Sustained Release of BMP-2 from Porous Particles with Leaf-Stacked Structure for Bone Regeneration. ACS Appl. Mater. Interfaces 2018, 10, 21091-21102.
-

- 36. Kim, M. J.; Lee, J. H.; Kim, J.-S., Kim, H. Y.; Lee, H.-C.; Byun, J.-H.; Lee, J.-H.; Kim, N.-H.; Oh, S. H. Intervertebral Disc Regeneration Using Stem Cell/Growth Factor-Loaded Porous Particles with a Leaf-Stacked Structure. Biomacromolecules 2020, 21, 4795-4805.
-

- 37. Kuo, C. W.; Chueh, D. Y.; Chen, P. Investigation of Size Dependent Cell Adhesion on Nanostructured Interfaces. J. Nanobiotechnol. 2014, 12, 54.
-

- 38. Park, S. G.; Li, M. X.; Eom, J. H.; Suh, E. Y.; Cho, W. K.; Joung, Y. K.; Huh, K. M. Synthesis and Characterization of Gallic Acid Conjugated Glycol Chitosans for Tissue Adhesive Applications. Polym. Korea 2021, 45, 372-379.
-

- 39. Curcio, E.; Salerno, S.; Barbieri, G.; De Bartolo, L.; Drioli, E. A. Bader, Mass Transfer and Metabolic Reactions in Hepatocyte Spheroids Cultured in Rotating Wall Gas Permeable Membrane System. Biomaterials 2007, 28, 5487-5497.
-

- 40. Lee, G. H.; Lee, J. S.; Oh, H. J.; Lee, S. H. Reproducible Construction of Surface Tension Mediated Honeycomb Concave Microwell Arrays for Engineering of 3D Microtissues with Minimal Cell Loss. PLoS One 2016, 11, e0161026.
-

- 41. Weir, C.; Morel-Kopp, M.-C.; Gill, A.; Tinworth, K.; Ladd, L.; Hunyor, S. N.; Ward, C. Mesenchymal Stem Cells: Isolation, Characterisation and In Vivo Fluorescent Dye Tracking. Heart Lung Circ. 2008, 17, 395-403.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(3): 369-376
Published online May 25, 2022
- 10.7317/pk.2022.46.3.369
- Received on Jan 25, 2022
- Revised on Mar 4, 2022
- Accepted on Mar 4, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Se Heang Oh
-
Department of Nanobiomedical Science, Dankook University, Cheonan 31116, Korea
- E-mail: seheangoh@dankook.ac.kr
- ORCID:
0000-0002-4635-6809










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.