- Biodegradation of Aliphatic Polyesters Under Composting and Seawater Conditions
Yujin Hyun*, Hyo Won Kwak**, ***,†
 , and Hyoung-Joon Jin*, ****,†
, and Hyoung-Joon Jin*, ****,†
*Program in Environmental and Polymer Engineering, Inha University, Incheon 22212, Korea
**Department of Agriculture, Forestry and Bioresources, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Korea
***Research Institute of Agriculture and Life Sciences, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Korea
****Department of Polymer Science and Engineering, Inha University, Incheon 22212, Korea- 생분해성 지방족 폴리에스테르의 퇴비 및 해수 환경 생분해도 평가
*인하대학교 고분자환경융합공학전공, **서울대학교 농림생물자원학부, ***서울대학교 농업생명과학연구원, ****인하대학교 고분자공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
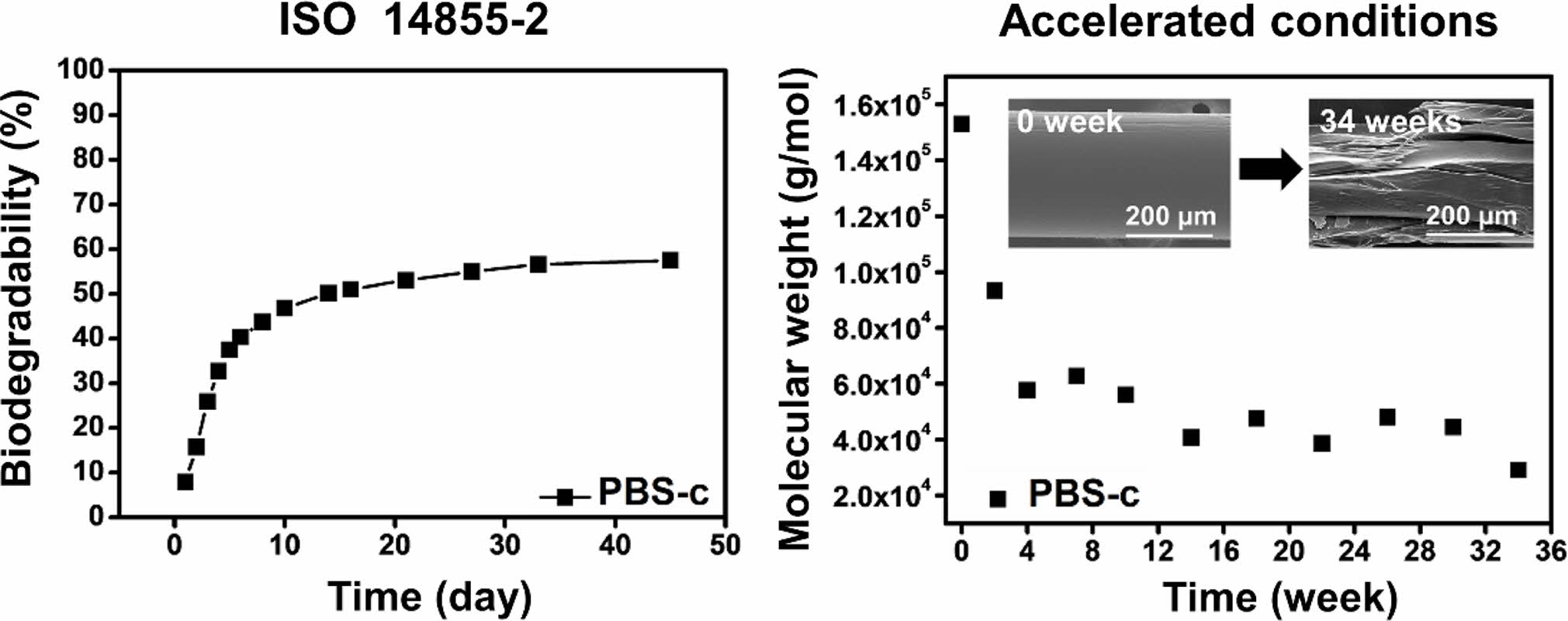
To determine the optimal evaluation method for the degradation of poly(butylene succinate) copolymer (PBS-c) under seawater conditions, biodegradability under composting conditions was determined according to ISO 14855-2, the most general biodegradation test method for composting conditions, and the results were compared with those obtained under seawater conditions. Under composting conditions, after 45 days, the biodegradation of PBS-c reached 57% and the weight average molecular weight of PBS-c decreased from the initial 153000 g/mol to 44000 g/mol. Meanwhile, under seawater conditions, the weight average molecular weight of PBS-c decreased to 94000 g/mol after 34 weeks. Although no significant changes in the chemical and crystal structure of PBS-c were observed after 34 weeks in seawater, the surface of the sample became rougher, as observed using scanning electron microscopy. The significantly slower biodegradation occurring under seawater conditions than under composting conditions can be attributed to the lower concentration of microorganisms in seawater at the lower test temperature. Therefore, a PBS-c degradation test was performed under accelerated conditions in seawater. Under accelerated conditions, the weight average molecular weight of PBS-c deceased to 29000 g/mol and substantial cracking and damage occurred on the surface of the PBS-c sample as a result of degradation.
본 연구에서는 해수에서 진행된 poly(butylene succinate) copolymer(PBS-c) 생분해도 측정 결과의 신뢰성 확인을 위해, 일반적 퇴비화 조건인 ISO 14855-2 평가법에 따라 생분해도를 측정하였으며 그 결과를 비교하였다. 퇴비화 조건에서는 측정 시작 45일 이후 PBS-c의 생분해도는 57%로 나타났으며, PBS-c의 무게 평균 분자량은 초기 153000 g/mol에서 44000 g/mol로 감소하였다. 한편 해수 조건에서 PBS-c의 무게 평균 분자량은 분해 34주차에 94000 g/mol로 감소하였다. 34주 동안 PBS-c의 화학 구조 및 결정 구조에는 큰 변화가 나타나지 않았지만, 분해가 진행될수록 시료 표면의 거칠기가 다소 증가하였다. 해수 조건에서 진행된 생분해도의 경우 퇴비화 조건 보다 긴 분해 기간에도 불구하고 분해도가 낮게 나타났으며, 이는 해수에 존재하는 미생물의 농도와 측정 온도가 낮기 때문에 나타나는 현상으로 사료된다. 따라서 해수 가속화 조건으로 진행하였을 때 PBS-c의 무게 평균 분자량은 29000 g/mol까지 감소하였으며 시료의 표면에서 크랙 및 시료 손실이 크게 발생하였다. 이를 통해 해수에서도 가속화 조건으로 진행했을 때, 퇴비화 조건과 비슷한 생분해도를 갖는 것을 확인하였다.
To evaluate the reliability of the biodegradability tests under seawater conditions, the biodegradability was measured according to ISO 14855-2 and the results were compared with those obtained under seawater conditions. After 45 days, the biodegradability of poly(butylene succinate) copolymer (PBS-c) reached 57% and the weight average molecular weight of PBS-c decreased from the 153000 g/mol to 44000 g/mol. When biodegradation test was conducted under accelerated conditions, the weight average molecular weight of PBS-c decreased to 29000 g/mol and cracking occurred on the surface of the PBS-c fibers.
Keywords: biodegradation, aliphatic polyesters, seawater, compost, poly(butylene succinate).
이 논문은 인하대학교의 지원에 의하여 연구되었음.
저자(들)는 이해상충이 없음을 선언합니다.
플라스틱은 우리의 삶과 밀접하게 관련되어 있으며, 가볍고 견고한 특성 때문에 물병,1 포장재,2 농업용 필름,3 의류4 그리고 건축자재5 등으로 사용되고 있다. 하지만 poly(ethylene),6 poly(propylene),7 poly(ethylene terephthalate)8 등과 같은 석유 기반 합성고분자들은 오랜 기간 동안 분해되지 않기 때문에, 소각 및 매립을 통해 처리하는 폐플라스틱의 양은 매년 증가하고 있으며, 이로 인해 발생하는 환경 문제가 크게 대두되고 있다. 매년 480-1270만 톤의9 폐플라스틱이 바다로 직접 버려지거나, 바람과 강을 통해 바다로 유입되고 있으며, 특히 어업용 어구의 경우, 분해되지 않고 원상태를 유지하여 ‘ghost fishing’을 일으키거나, 자외선 또는 파도와 같은 물리화학적 작용에 의해 작은 조각으로 분해되어 미세플라스틱10 문제를 야기한다. 이러한 문제점으로 인해 2014년과 2016년 유엔환경총회(United Nations Environment Assembly)에서는 ‘해양플라스틱 쓰레기와 미세 플라스틱에 관한 결의안’을 채택하였다. 이러한 문제를 해결하기 위해, 생분해성 고분자가 주목받고 있으며, 생분해성 고분자는 자연환경의 미생물에 의해 최종적으로 이산화탄소로 분해되는 고분자를 뜻한다.11 생분해성 고분자의 종류에는 미생물에 의해 생합성되는 poly(hydroxyalkanoates),12 유기 합성으로 제조되는 poly(ε-caprolactone),13 poly(lactic acid)14 등이 있으며, 생분해성 고분자 중 하나인 poly(butylene succinate)(PBS)는15 지방족 폴리에스테르 중 하나로 1,4-butanediol과 succinic acid의 축합 중합을 통해 합성되며, 1931년 Carothers에16 의해 처음 합성되어졌다. PBS는 초기 낮은 분자량으로 인해 약하고, 깨지기 쉬운 단점이 있었지만,16 이를 극복하기 위해 Showa denko (Japan)에서는 hexamethylene diisocyanate를 chain-coupling agent, Hexing chemical(China)에서는 direct melt polyconden- sation 방법을 이용하여 높은 분자량의 PBS를 합성하였다. 이외에도 기계적 물성을 향상시키기 위해 PBS는 adipic acid,17 terephthalic acid,18 2,2-dimethyl succinic acid19 등과의 공중합을 통해 poly(butylene succinate-co-adipate),20 poly(butylene succinate-co-terephthalate),21 poly(butylene succinate-co-butylene 2-methyl succinate)22 등을 합성하였으며, 이를 바탕으로 PBS는 일회용품,23 포장재,24 농업용 필름 등으로25 사용되고 있다. 최근 국립수산과학원에서는 나일론 어구를 대체하기 위해 poly(butylene succinate) 공중합체(copolymer) (PBS-c) 개발 및 자망으로 제작하여 제주 어민들에게 보급하였다. 생분해성 고분자의 생분해도에 미치는 요소는 다양하다. 화학 구조, 결정화도, 분자량, 소수성, 모양 및 크기와 같은 고분자의 내적 요인과26,27 함께 자연환경에 존재하는 미생물의 양, UV 노출, 온도, pH와 같은 외부적인 요소가28 있다. 일반적으로 플라스틱에 대한 생분해도 평가법은 국제표준 기구(International Organization for Standardization)에서 통합하고 있으며, 플라스틱의 생분해도 측정 방법으로는 수계 배양액에서 생분해도를 측정하는 ISO 14851(폐쇄 호흡계를 이용한 산소소비량 측정),29 14852(폐쇄 호흡계를 이용한 이산화탄소 발생량 측정),30 제어된 퇴비화 조건에서 생분해도를 측정하는 ISO 14855-1,31 14855-2(이산화탄소 발생량 측정).2 그리고 토양 조건인 ISO-17556(이산화탄소 발생량 또는 산소소비량 측정)이33 있다. 국내에서는 플라스틱 재료의 생분해도를 측정하기 위해 ISO 14855를 채택하여, 2007년 KS M ISO 14855-1을34 제정하였다. 현재까지 진행된 대부분의 생분해성 고분자의 생분해도 측정은 토양 조건 및 퇴비화 조건에서 진행되었으며, 실제 해수를 이용한 분해도 측정은 거의 진행되지 않았다. 해수에서 생분해도 측정은 토양 및 퇴비에 비해 낮은 온도, 낮은 미생물 농도 등과 같은 환경적인 요인에 의해 낮은 분해도를 나타내기 때문에, 정확한 생분해도 측정이 제한된다. Kasuya 등의 연구에 따르면, PBS는 바다에서 28일 동안 2%의 낮은 생분해도를 나타냈다.35 이전 연구에서 채취한 해수를 이용하여 부유 상태 환경으로 설정하였으며 이를 해수 조건으로 명명하였다.36 또한 해수 조건 PBS-c 섬유 생분해도 측정법과 해수 가속화 조건 PBS-c 섬유 생분해도 측정법을 제시하였으며, 그 결과는 다음과 같다. PBS-c 섬유는 분해가 진행됨에 따라 무게 평균 분자량, 인장강도, 인장 신도의 감소가 나타났으며, 특히 해수 가속화 조건에서 분해되었을 때 크게 나타났다. 본 연구는 이전 연구에서 제시한 해수 및 해수 가속화 조건에서 측정한 PBS-c 생분해도 측정 결과의 신뢰성을 평가하기 위해, 국제표준화기구에서 제정한 ISO 14855-2 평가법을 통해 측정한 PBS-c 생분해도 측정 결과와 비교하는 연구를 진행하였다. 그 결과는 겔 투과 크로마토그래피, 푸리에 변환 적외선 분광기, X-선 회절 분석기, 주사전자현미경, 시차주사열량계를 이용하여 분석하였다. 이 연구를 통해, 해수 및 해수 가속화 조건을 통하여 측정한 PBS-c 생분해도의 신뢰성을 확인할 수 있을 것으로 판단된다.
시약 및 재료. Paenibacillus sp.는 국립수산과학원(Busan, Korea)으로부터 제공받았으며, Bacillus subtilis가 포함된 퇴비(스테비아골드)는 KG케미칼(Ulsan, Korea)에서 구매, 해수는 월미도에서 채취하였다. 미세결정 셀룰로오스(MCC, 20 μm), 한천, Tween 80은 Sigma-Aldrich Chemical Co. (Seoul, Korea)에서, sodium hydroxide on support(soda talc)는 Merck KGaA(Seoul, Korea)에서, soda lime은 medicon (Seoul, Korea)에서, sea sand(10-20 mesh), 염화 칼슘(>98%), 실리카 겔(5-10 mesh), 황산(>95%), 메틸 레드 용액(0.1%)은 Daejung(Seoul, Korea)에서 구입하였으며 토끼사료(하겐토끼펠렛)는 Rokf C. Kagen Inc(Baie-D'Urfé, Canada)에서 구입하였다. 본 연구에 사용된 PBS-c(M͞͞w=153000)는 butylene succinate, butylene adipate, ethylene succinate, ethylene adipate의 반복단위의 공중합으로 제조되었으며, 섬유 및 분말 형태로 Ankor bioplastic(Wonju, Korea)으로부터 제공받았다.
퇴비 발효. Bacillus subtilis가 포함된 퇴비 140 g을 4 mm채로 거른 후, 토끼 사료 260 g, sea sand 1600 g을 함께 혼합한 뒤, 증류수를 첨가하여 함수율을 70%로 맞춰주었다. 이후, 30 oC 인큐베이터(IL-11, JEIO tech, Korea)에서 14일 동안 발효를 진행하였으며, 발효 기간 동안 함수율은 60%로 유지하였다.
ISO 14855-2 평가법. ISO 14855-2 평가에 따른 생분해도 측정은 microbial oxidative degradation analyzer(MODA-4, Saida ums, Japan) 장비를 이용하여 진행하였다. 표준시료, MCC와 측정시료, PBS-c 10 g을 각각 400 g의 퇴비와 혼합한 뒤, 바탕 퇴비 400 g과 함께 3개의 반응 용기에 넣어주었다. ISO 14855-2 평가 동안 퇴비의 함수율은 60%로 유지하였으며, 각각의 칼럼에 증류수와 2N-황산 용액 400 g, 실리카 겔, 염화 칼슘, soda talc 60 g 넣은 후, 나머지를 soda lime으로 채워주었다. 칼럼을 모두 채운 후, 공기의 유속은 10 mL/min으로 조절하였으며, 생분해도 측정은 58±2 oC에서 45일 동안 진행하였다. MCC 및 PBS-c가 분해되면서 발생하는 이산화탄소를 정량하여 생분해도를 계산하였으며, 표준시료와 측정시료, MCC와 PBS-c는 분말 형태로 ISO 14855-2 평가를 진행하였다. 분해도 계산은 아래의 식 (1), (2)을 이용하였다.
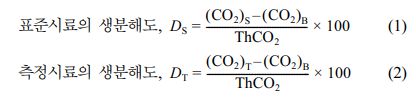
DS(%)는 표준시료의 생분해도를 나타내며, (CO2)S(g)는 표준시료에서 발생한 CO2의 양을 나타낸다. DT(%)는 측정시료의 생분해도를 나타내며, (CO2)T(g)는 측정시료에서 발생한 CO2의 양을 나타낸다. 그리고 (CO2)B(g)은 바탕 시험에서 발생한 CO2의 양을 나타내고 ThCO2는 이론적 CO2 발생량을 나타낸다. 이론적 CO2 발생량은 아래의 식 (3)을 이용하였다.
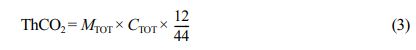
MToT(g)은 퇴비에 첨가된 시료의 총 양을 나타내며, CTOT(g/g)은 시료속에 포함된 유기탄소의 비율을 나타낸다. 그리고 44/12는 이산화탄소 분자량과 탄소의 분자량을 나타낸다.
해수 조건 PBS-c 섬유 분해도 측정법. 110 mm 직경의 여과지(Toyo Roshi Kaisha, LTD, Japan)를 이용해 해수의 불순물을 거른 후, 고압증기멸균기(AC-12, JEIO tech, Korea)를 이용해 121 oC에서 15분 동안 멸균하였다. 이후, 한천 1.5 wt% 넣고, 100 oC에서 2시간 동안 가열 및 교반시킨 뒤, 다시 고압멸균기를 이용해 이전과 같은 조건으로 멸균하였다. 멸균된 용액을 광구병에 100 mL 넣어 고체 배지를 제조한 뒤, 배지 표면에 Paenibacillus sp. 100 μL 접종 후, PBS-c 섬유를 넣어주었다. 이후, 30 oC 인큐베이터에서 34주 동안 분해를 진행하였으며, 분석 시료는 0, 2, 4, 7, 10, 14, 18, 22, 26, 30, 34주마다 채취하였다. 채취한 시료는 1분간 0.5 M NaOH 용액에 침지 후, 에탄올을 이용해 3번 세척하였으며, 이후, 60 oC 진공 오븐(OV-11, JEIO tech, Korea)에서 12시간 동안 건조하였다.
해수 가속화 조건 처리. 254 nm UV-C 램프를 이용하여 PBS-c 시료의 한 면을 15일간 조사한 뒤, 뒤집어 15일 동안 조사하였다. 이때 램프의 강도는 4.9 W, 시료와의 거리는 30 cm이었다. UV-C 처리 이후, PBS-c 섬유를 1 wt% Tween 80 용액에 7일 동안 침지 후, 60 oC 오븐에서 1일 동안 건조하였다. 이 때 평균 온도는 21.6 oC이었다.
특성 분석. 발효 기간 동안 퇴비의 pH를 pH meter(F-71G, horiba, Japan)이용하여 측정하였으며, 퇴비와 증류수를 1:10 비율로 혼합하여 측정하였다. MCC 및 PBS-c 분말의 모양 및 크기는 optical microscope(BX51, Olympus, Japan)을 이용하여 측정하였으며, PBS-c의 무게 평균 분자량은 gel permeation chromatography(GPC; Tosoh-ecoSEC HLC-8320 GPC, Tosoh bioscience, Japan)을 이용하여 측정하였고, 표준시료는 polystyrene을 이용하였다. PBS-c의 화학 구조 변화를 분석하기 위해 Fourier transform infrared spectroscopy(FTIR; Nicolet iS5 FTIR spectrometer, Nicolet Analytical Instruments, Madison, WI)를 attenuated total reflectance(ATR) mode로 scan resolution of 8 cm-1, 32 scans 조건 하에 4000-700 cm-1 범위를 스캔하여 측정하였다. X-ray diffractometer(XRD; Rigaku DMAX 2500, Rigaku, Japan)를 이용하여 PBS-c의 결정 구조를 분석하였으며, differential scanning calorimetry (DSC; DSC200F3, Netzsch, Germany)를 이용해 시료의 열적 성질을 분석하였다. DSC는 시료 10 mg을 질소 조건하에 -40 oC부터 10 oC/min의 속도로 200 oC까지 승온하였으며, 이후 -40 oC까지 10 oC/min 속도로 냉각하였다. 시료의 결정화도(Xc, %)는 다음 식 (4)를37 이용해 계산하였다.

∆Hom은 100% 결정성을 갖는 PBS의 용융 엔탈피이며, 그 값은 200 J/g이다.37 ∆Hm은 시료의 용융 엔탈피이다. PBS-c의 열분해 온도를 측정하기 위해 thermogravimetric analyzer (TGA; TG 209, Netzsch, Germany)를 이용하였으며, N2 분위기로 측정되었다. 시료의 양은 10 mg이었으며, 30 oC에서 600 oC까지 10 oC/min로 승온하였다.
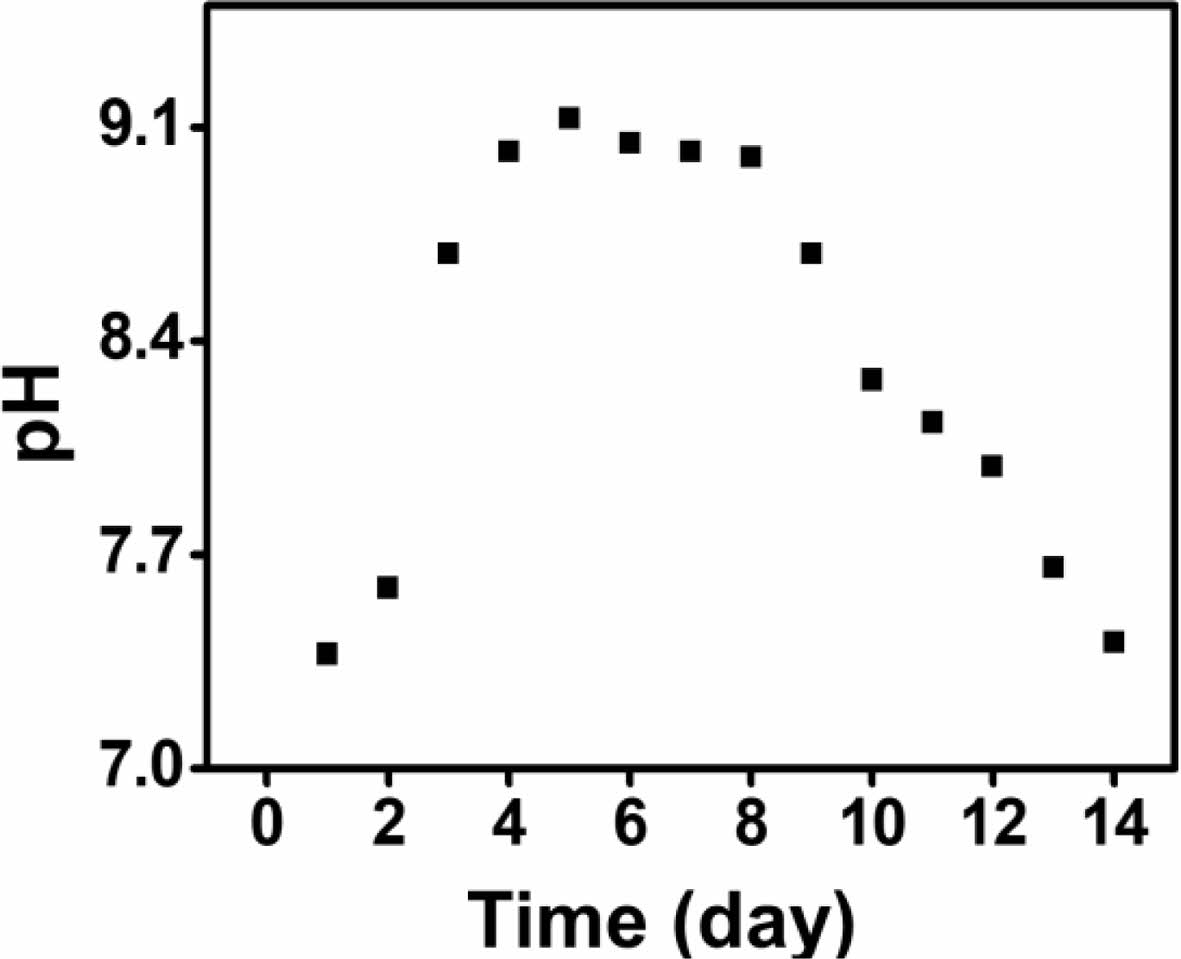
퇴비 발효. ISO 14855-2 평가는 제어된 퇴비화 조건에서 플라스틱의 호기성 생분해도를 측정하는 방법이며, 플라스틱이 분해되는 동안 발생하는 이산화탄소를 정량하여 생분해도로 계산한다. ISO 14855-2 평가를 통해 생분해도를 측정하기 위해선, 퇴비 안에 존재하는 미생물들이 고분자 시료를 이산화탄소로 분해할 수 있는 능력을 갖도록, 퇴비의 호기적 발효 과정이 필요하다. 퇴비의 발효 과정을 통해, 퇴비 내 유해균 외의 병원균 사멸, 퇴비 내 유효균의 농도가 증가한다. 특히, ISO 14855-2 평가에서 사용된 Bacillus subtilis는 전분, 단백질, 지방을 급속히 분해할 수 있는 능력을 갖고 있다.38 다음 Figure 1에 퇴비의 발효 기간 동안 나타나는 pH 변화를 나타내었다. 퇴비의 초기 pH는 7.12였으며, 발효 기간이 늘어날수록 값은 증가하여 활성화 시작 5일만에 최고 값인 9.12를 나타내었다. 이후, pH는 감소하여 최종 14일에는 pH 7.41까지 감소하였다. 이 현상은 발효 과정에서 퇴비안에 존재하는 셀룰로오스가 Bacillus subtilis의 대사과정을 통해 분해되어 암모니아가 발생하기 때문에 나타난다.
시료의 형태. 시료의 모양이나 크기에 따라 생분해도는 변하기 때문에 측정시료의 모양과 크기는 표준시료와 동일해야 한다. 비표면적이 늘어날수록 분해 속도는 빨라지는데, 이 결과는 Altaee 등의39 연구 결과를 통해 알 수 있다. ISO 14855-2 평가의 표준시료는 셀룰로오스로 명시되어 있으며,11 이번 ISO 14855-2 평가에서 표준시료는 MCC를 사용하였다. PBS-c 및 MCC의 모양과 크기를 광학 현미경으로 촬영하여 Figure 2에 나타냈다. Figure 2(a)에서 PBS-c는 불규칙한 모양과 크기를 나타내고 있으며, 이와 반대로 Figure 2(b)을 통해 MCC는 전반적으로 크기가 고르고, PBS-c보다 더 작은 크기를 갖는 것을 알 수 있다. 이를 통해 MCC가 PBS-c보다 더 높은 분해도를 나타낼 것을 예상할 수 있다.
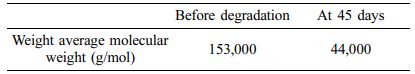
ISO 14855-2 평가. 생분해는 퇴비 내에 존재하는 미생물의 대사 과정을 통해 일어나며, 최종적으로 이산화탄소로 분해된다. 생분해도는 분해 기간 동안 발생하는 시료의 무게 감소율을 통해 측정할 수 있지만, 분해가 진행될수록 시료는 작은 조각들로 분해되기 때문에 정확한 생분해도 측정이 제한된다. 본 연구에서 사용한 ISO 14855-2 기반 평가는 제어된 퇴비화 조건에서 플라스틱 물질의 생분해도를 측정하는 방법이며, 분해 동안 발생하는 이산화탄소를 정량하여, 분해도로 계산하기 때문에, 정확한 생분해도 측정이 가능하다. ISO 14855-2 평가법에 따라 생분해도를 측정하기 위해선, 바탕 퇴비가 필요로 하는데, 이는 퇴비 내에서도 이산화탄소가 발생하기 때문에, 이를 제외하기 위함이다. MCC 및 PBS-c의 이론적 CO2 발생량은 식 (3)을 통해 얻을 수 있으며, 결과값은 각각 16.29 g, 20.48 g이다. MODA의 메커니즘은 다음과 같다. 먼저 시료에서 발생하는 순수한 이산화탄소의 양을 측정하기 위해, MODA로 유입되는 공기는 soda lime으로 채워진 칼럼을 통과하면서 이산화탄소가 제거된다. 두번째로, 물을 통과하면서 반응 용기에 수분을 공급, 평가 기간 내 퇴비의 함수율을 60%로 유지시킨다. 세번째로 반응 용기에서 이산화탄소, 암모니아, 물이 발생하는데, 암모니아는 2N-황산 용액, 물은 실리카 겔 및 염화 칼슘을 통과하면서 제거되며, 이산화탄소는 soda talc/lime과 아래의 식 (5)와 같이 반응한다.
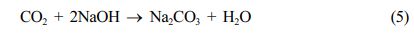
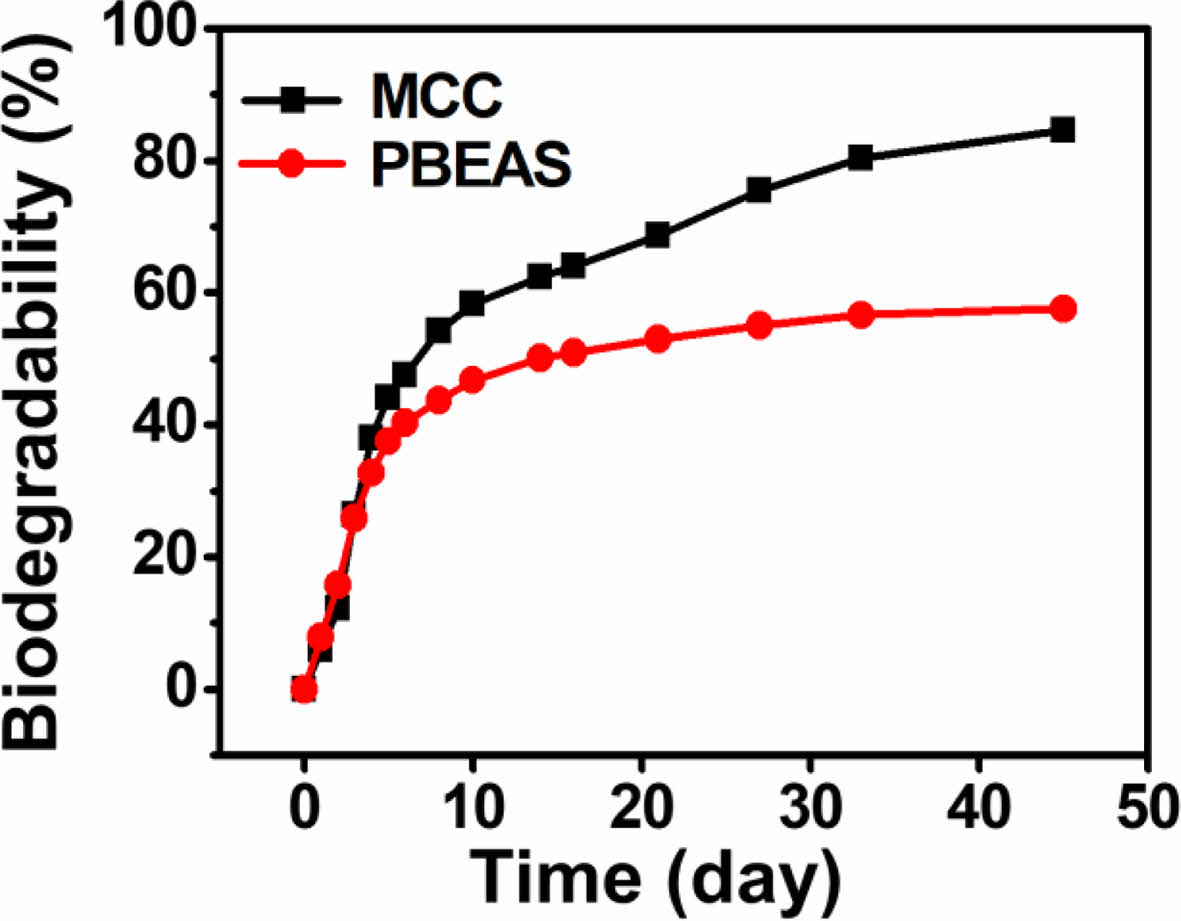
위의 반응에 의해 생성된 물은 다시 염화 칼슘에 흡수된다. 일정 기간마다 soda talc/lime 및 염화 칼슘 칼럼 무게를 측정하고 식 (1), (2)을 이용하여 표준시료 및 측정시료의 생분해도를 계산한다. Figure 3 그래프에 ISO 14855-2 평가를 통해 측정한 MCC 및 PBS-c의 생분해도를 나타내었다. 먼저 표준시료, MCC는 20일 이전에 생분해도가 60%까지 도달하였으며, 20일 이후로 분해 곡선은 점차 완만한 곡선을 그리며 45일에는 85%를 나타냈다. PBS-c의 분해 곡선을 살펴보면, 20일에 53%에 도달하였으며, 이후 MCC와 마찬가지로 분해 곡선은 완만하게 진행되어 45일에는 57%를 나타냈다. MCC 및 PBS-c 모두 초기 20일 동안 빠른 분해 속도를 나타냈는데, 이는 올리고머 및 저분자가 빠르게 분해되고, 고분자가 느리게 분해되기 때문에 나타나는 현상이다. 이와 같은 결과로, Pan 등은40 각기 다른 분자량을 갖는 PBS의 분해 연구를 진행한 결과, 가장 작은 분자량을 가지는 PBS가 20시간 이내 완전히 분해되었으며, 분자량이 커질수록 분해 기간이 늘어나는 것을 확인하였다. 생분해 과정에서 무게 감소가 발생하게 되는데, 이를 확인하기 위해, 퇴비 내 잔존하는 PBS-c를 채취하여, 무게 감소율을 확인하였다. ISO 14855-2 평가 후, 클로로포름을 이용해 퇴비 내 PBS-c를 용해시킨 뒤, 직경 110 mm 여과지 및 0.45 μm TF 필터를 이용해 불순물을 제거해 주었다. PBS-c는 클로로포름 용액을 solution casting 방법을 이용해 채취하였다. 다음 그 결과를 Figure 4에 나타내었다. 초기 PBS-c의 중량은 10 g이었지만 ISO 14855-2 평가 후 4.8 g으로, 총 52% 감소하였다. 이전 연구에서36 PBS-c 섬유는 퇴비화 조건에서 짧은 기간 동안 무게 평균 분자량 감소가 크게 나타나는 것을 확인하였으며, 본 연구에서도 PBS-c의 무게 평균 분자량 감소를 확인하기 위해, ISO 14855-2 평가 전, 후의 PBS-c의 무게 평균 분자량을 Table 1에 나타냈다. 초기 PBS 무게 평균 분자량은 153000 g/mol이었지만 분해 이후 44000 g/mol까지 감소하여, 총 71% 감소하였다. 퇴비화 조건은 높은 온도와 높은 미생물 농도로 인해 분해 속도가 빠르고, 높은 생분해도를 얻을 수 있음으로, 가장 일반적인 분해 조건으로 사용된다. KS M ISO 14855-1 평가에서는 생분해도의 유효성을 얻기 위해 45일 이내 표준시료의 생분해도가 70% 이상을 나타내야 한다. ISO 14855-2 평가에서 표준시료, MCC의 생분해도는 대략 85%를 나타냈으며, 이를 통해 ISO 14855-2 평가를 통해 측정한 PBS-c의 생분해도는 유효성을 갖는 것을 알 수 있다.
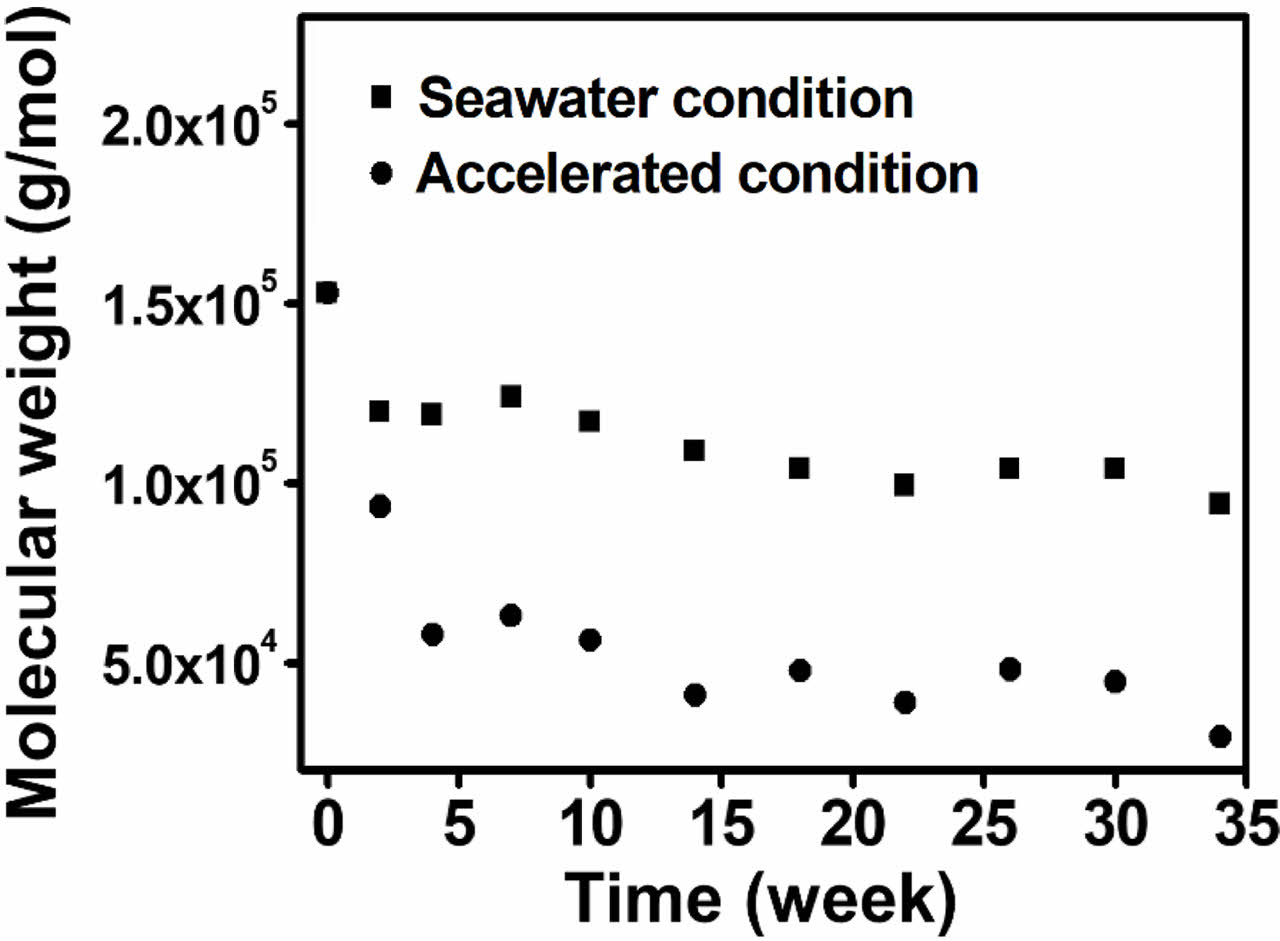
해수 및 해수 가속화 조건에서의 PBS-c 섬유 분해도 측정. 해수 및 수계 환경에는 다양한 미생물이 존재하고 있지만, 그 농도는 토양 및 퇴비 환경보다 확연히 낮으며, 미생물이 호흡하기 위해 필요한 산소도 수심이 깊어질수록 줄어든다. 더욱이 온도 또한 다른 환경 조건에 비해 낮으며, 특히 PBS의 경우 해수 및 수계에서 분해는 매우 느리거나, 거의 일어나지 않기 때문에, 무게 감소율을 이용한 분해도 계산은 매우 제한적이다. 생분해도 측정 방식에는 무게 감소율뿐만 아니라 분자량을 이용해 측정할 수 있으며, 본 연구에서는 PBS-c 섬유를 해수 및 해수 가속화 조건에서 34주 동안 분해하여, 각각 0, 2, 4, 7, 10, 14, 18, 22, 26, 30, 34주에 PBS-c 섬유를 채취, 무게 평균 분자량을 측정하였다. 해수 및 해수 가속화 조건에서 분해된 PBS-c 섬유의 무게 평균 분자량 변화를 Figure 5에 그래프로 나타내었다. 모든 시료에서 분해 기간이 길어질수록 무게 평균 분자량이 감소하였으며, 해수 조건에서 분해된 PBS-c의 경우, 초기 무게 평균 분자량 153000 g/mol에서 분해 34주에는 94000 g/mol로 39%의 낮은 감소율을 나타냈다. 이 결과를 ISO 14855-2 평가 후 측정한 PBS-c의 무게 평균 분자량 감소율과 비교해 보면, 해수 조건에서 PBS-c 섬유는 34주의 긴 분해 기간에도 불구하고 퇴비화 조건보다 더 낮은 분해도를 나타낸다. 이 현상은 해수에 존재하는 미생물의 농도와 온도가 퇴비화 조건보다 낮기 때문에 나타나는 것으로 사료된다. 이와 반대로 해수 가속화 조건에서 분해를 진행하였을 때, 무게 평균 분자량이 153000 g/mol에서 29000 g/mol까지 감소하여 81%의 높은 감소율을 나타내었다. 특히, 초기 5주 이내 분자량이 153000 g/mol에서 57000 g/mol까지 빠르게 감소하였는데, 이 현상은 UV-C 처리로 인해 발생하는 광산화41 반응으로 인해 PBS-c 사슬 내에서 무작위 사슬 절단이 일어나 올리고머 및 저분자가 형성되고, 앞서 언급했듯이40 저분자들이 빠르게 분해되어 나타나는 현상이다. 더욱이 비이온성 계면활성제, Tween 80을 첨가한 경우, Tween 80을 적용한 Albertsson 등의41 연구 결과와 동일하게 Paenibacillus sp.의 활동성에는 영향을 주지 않으며 PBS-c 섬유 표면의 친수성을 높여주어 분해를 가속화하였다. 해수 가속화 조건에서 측정한 PBS-c의 무게 평균 분자량 감소율과 ISO 14855-2 평가 후 측정한 PBS-c의 감소율을 비교해보면, 최소 14주 분해가 진행되었을 때, 퇴비화 조건과 비슷한 무게 평균 분자량 감소가 나타나는 것을 알 수 있으며, 이를 통해 해수 조건에서도 해수 가속화 처리 후 분해를 진행했을 때, ISO 14855-2 평가를 통해 측정한 생분해도와 비슷한 생분해도를 갖는 것을 알 수 있다.
PBS-c 화학 구조 분석. 화학 구조 변화를 살펴보기 위해, ISO 14855-2 평가 후, 측정한 PBS-c의 FTIR 그래프와 해수 그리고 해수 가속화 조건에서 분해한 PBS-c FTIR 그래프를 Figure 6에 나타내었다. Phua 등의23 연구 결과에 따르면, PBS는 1144-1152 cm-1에서 사슬 내 존재하는 에스터 그룹의 C-O-C 신축 진동 피크가 나타나며, 1330 cm-1 그리고 2945 cm-1에서 각각 CH2의 대칭 및 비대칭 변형 진동에 해당하는 피크가 나타난다. 그리고 에스터 그룹의 C=O 신축 진동 피크가 1710-1713 cm-1에서 나타난다. 그래프를 살펴보면, 모든 시료에서 피크의 위치나 모양은 변하지 않으며, 이는 분해가 일어나도 화학 구조에는 변화가 없음을 뜻한다.
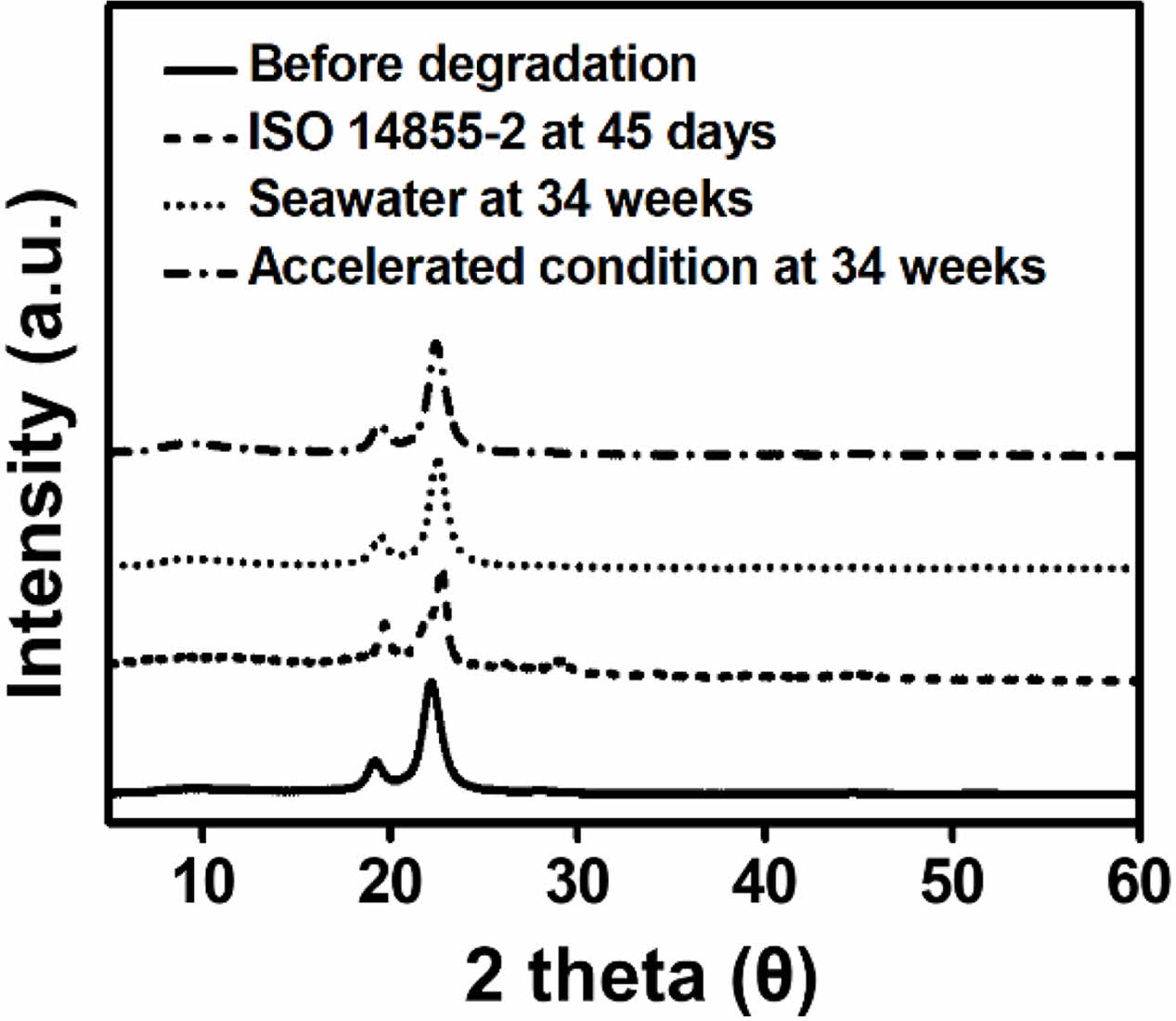
PBS-c 결정 구조 분석. 생분해 메커니즘에는 두 가지 단계가 있으며, 다음과 같다. 먼저 미생물이 분비하는 효소에 의해서 저분자 또는 올리고머가 빠르게 분해되고, 그 후 고분자들이 가수분해에 의해 느리게 분해된다. 가수분해가 전반적인 분자량 감소를 발생시킴으로, 고분자의 친수성 및 결정화도가 분해 속도에 관여하는 중요한 요소이다. PBS-c는 PBS와42 마찬가지로 19.7, 21.9, 22.8o에서 (020), (021), (110)에 해당하는 피크가 나타난다. ISO 14855-2 평가 후, 측정한 PBS-c의 XRD 그래프와 해수 그리고 해수 가속화 조건에서 분해된 PBS-c의 XRD 그래프를 Figure 7에 나타내었다. 본 그래프에서 PBS-c의 분해 전, 후의 피크의 위치나 모양은 변하지 않으며, 이는 Figure 3, Table 1 그리고 Figure 5에서 보았듯이 생분해가 진행됨에도 불구하고 결정 구조는 변하지 않는 것을 의미한다. 일반적으로 생분해는 비결정성 영역이 결정성 영역보다 먼저 분해되며,43 이는 비결정성 영역이 결정성 영역보다 유연하여 효소의 활성 부위로 쉽게 구부러져 들어갈 수 있기 때문에 나타나는 현상이다.44 Figure 6과 Figure 7을 살펴보면, 분해가 진행되어도 화학 구조와 결정 구조는 변화하지 않는다. 이는 시료의 표면에서 분해가 일어나고, 분해되어 형성된 올리고머 또는 저분자는 시료의 표면에서 배지로 빠져나가기 때문이다.43
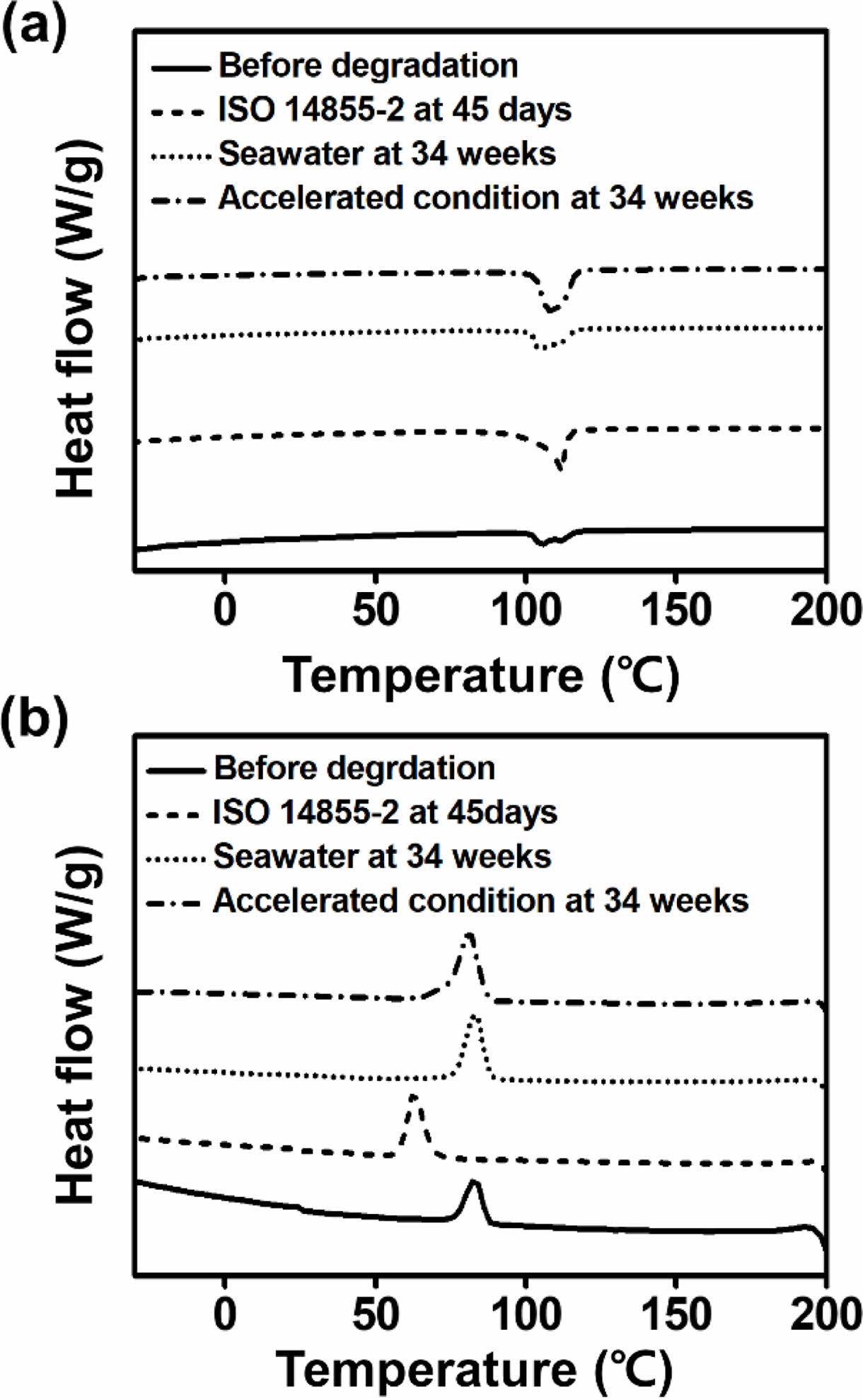
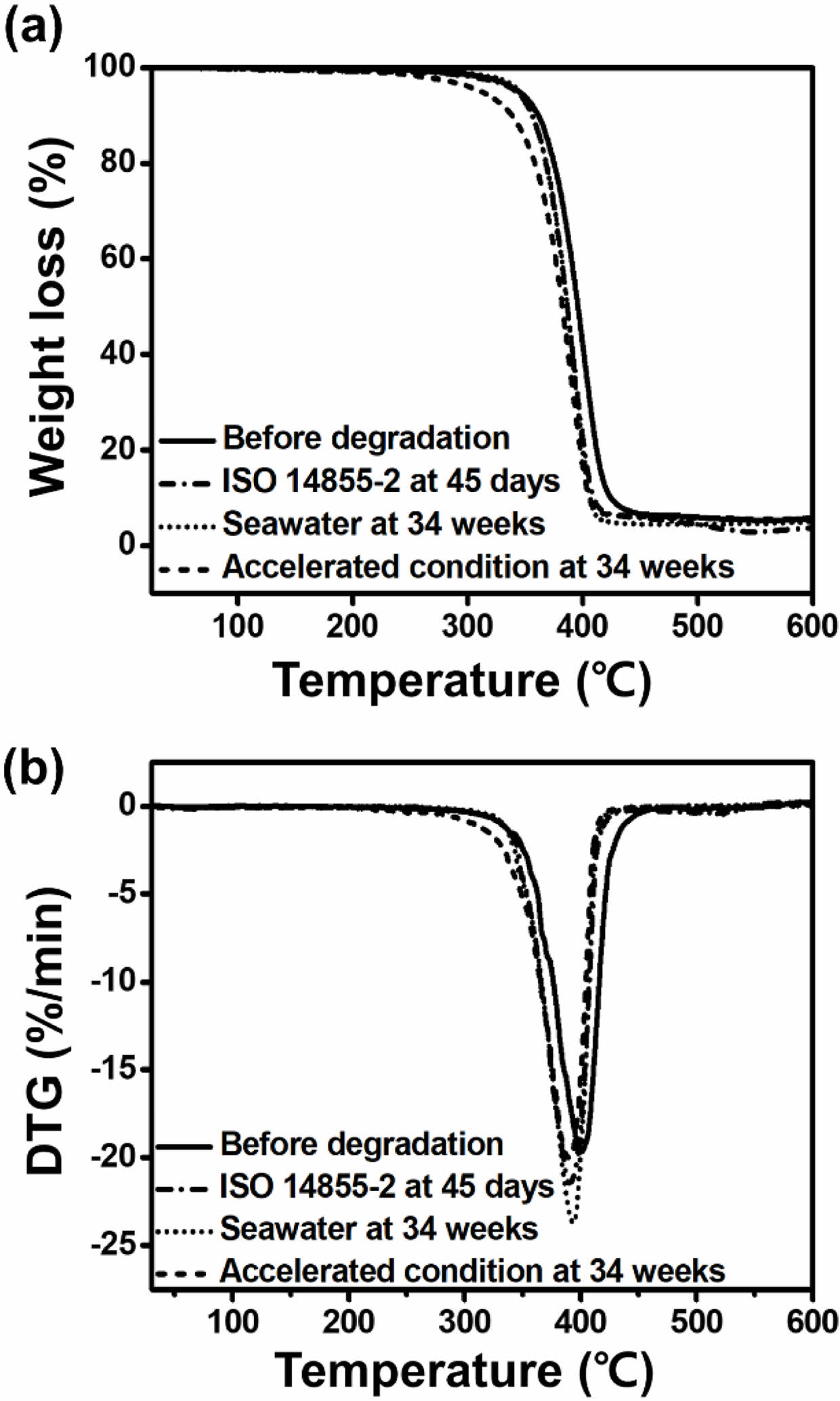
PBS-c 열적 성질 분석. ISO 14855-2 평가 후, 측정한 PBS-c의 승온 및 냉각 그래프, 해수 그리고 해수 가속화 조건에서 분해된 PBS-c의 승온, 냉각 그래프를 Figure 8에 나타냈으며, 결과는 Table 2에 정리하였다. 분해 전, PBS-c 섬유의 Tm과 Tc는 각각 105 oC와 83 oC이며, 해수 및 해수 가속화 조건에서 분해를 진행하였을 때, Tm과 Tc는 각각 106, 107 oC 및 83, 81 oC로 큰 변화는 나타나지 않았다. 하지만 ISO 14855-2 평가 후, PBS-c의 경우 Tm은 111 oC까지 증가하였으며, 특히, Tc는 63 oC로 큰 감소가 나타났다. 이 현상은 분해로 인해 형성된 저분자가 고분자들보다 낮은 온도에서45 결정화를 하기 때문에 나타난다. 결정화도를 살펴보면 분해 전 PBS-c의 결정화도는 47%이지만, 분해가 진행될 수록 결정화도 값은 증가하였으며, 이는 비결정성 영역에서 분해가 먼저 진행되어 나타나는 현상이다. 다음 Figure 9(a), (b)에 ISO 14855-2 평가 전과 후, 해수 및 해수 가속화 조건에서 분해된 PBS-c의 열 무게 분석 결과를 나타내었다. Figure 9(a)에서 PBS-c의 열 분해는 한단계로 진행되며, 분해 전 PBS-c의 열 분해 시작 온도는 345.2 oC, ISO 14855-2 측정 후, 해수 조건 분해 후의 PBS-c의 열분해 시작 온도는 각각 342.1, 344.3 oC로 생분해가 진행되어도 열 분해 시작 온도는 크게 변하지 않는다. 그러나 해수 가속화 조건에서 분해된 PBS-c의 경우 더 낮은 온도 311.5 oC에서 열 분해가 시작되는데, 이는 UV-C 처리 과정 중 발생하는 광산화로 인해 분자량이 감소되었기 때문에 나타나는 현상이다.46 또한 Figure 9(b) 그래프에서도 해수 가속화 조건에서 분해된 PBS-c의 열 분해 시작 온도는 낮아졌으며 이를 통해 해수 가속화 처리를 진행한 경우 열적 안정성이 낮아지는 것을 알 수 있다.
PBS-c 섬유의 모폴로지 분석. 생분해는 시료의 표면에서부터 발생하기 때문에 시료의 모폴로지 변화를 관찰하는 것이 중요하다. 해수 및 해수 가속화 조건에서 분해된 PBS-c 섬유에 대한 모폴로지 변화를 Figure 8에 나타냈다. Figure 10(a)와 (b)는 각각 해수 및 해수 가속화 조건에서 분해된 PBS-c 섬유의 표면을 나타낸다. Figure 10(a)는 분해 전, 비교적 균질하고 조밀한 표면을 갖으며, 분해가 진행되어도 표면의 모폴로지 변화는 크게 발생하지 않음을 알 수 있다. 이와 반대로 해수 가속화 조건에서 분해된 PBS-c 섬유의 경우, 분해 4주만에 표면에서 크랙이 발생하였으며, 분해 30주부터 시료의 손실이 크게 나타나는 등 두드러진 변화가 나타났다. 이는 UV-C 처리 중 발생하는 광산화로 인해 PBS-c 섬유의 표면에서 크랙이 발생하고,47 이로 인해 표면적 및 친수성을 증가시켜 Paneibacillius sp.의 흡착이 증가하여 분해가 가속화되기 때문에 나타난다.
|
Figure 1 Changes of the pH of the compost during the activation period. |

|
Figure 2 Optical microscope images: (a) PBS-c; (b) MCC. |
|
Figure 3 Biodegradability of MCC and PBS-c using MODA. |

|
Figure 4 Photography of PBS-c: (a) before; (b) after ISO 14855-2 |
|
Figure 5 Change of weight average molecular weight of PBS-c fibers during degradation under seawater and accelerated condition. |
|
Figure 6 FTIR spectra of PBS-c before and after degradation under ISO 14855-2, seawater and accelerated condition. |
|
Figure 7 XRD spectra of PBS-c before and after degradation under ISO 14855-2, seawater and accelerated condition. |
|
Figure 8 DSC scans of PBS-c before and after degradation under ISO 14855-2, seawater and accelerated condition (a) heating; (b) cooling. |
|
Figure 9 (a) TGA; (b) DTG curves of PBS-c before and after degradation under ISO 14855-2, seawater and accelerated condition. |

|
Figure 10 Morphological changes of PBS-c fibers under (a) seawater; (b) accelerated condition. |
|
Table 2 DSC Data of PBS-c Before and After Degradation |
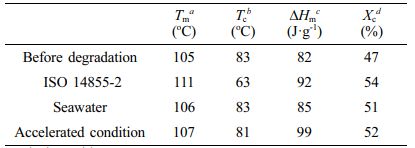
aTm is the melting temperature. |
본 연구는 이전 연구에서 제시한 해수 및 해수 가속화 조건 생분해도 측정 결과의 신뢰성을 확인하기 위해, 국제표준화기구에서 제정한 ISO 14855-2 평가를 통해 측정한 생분해도와 비교하는 연구를 진행하였다. 시료는 PBS-c를 이용하였으며, 총 45일간 ISO 14855-2 평가를 통해 측정된 표준시료 MCC와 측정시료 PBS-c의 생분해도는 각각 85%와 57%를 나타냈으며, PBS-c의 경우 초기 153000 g/mol부터 44000 g/mol까지의 무게 평균 분자량 감소가 나타났다. 총 34주 동안 해수 및 해수 가속화 조건으로 분해를 진행한 PBS-c 섬유의 경우 무게 평균 분자량이 94000, 29000 g/mol로 각각 39, 81% 감소하였으며, 해수 조건에서 분해된 PBS-c 섬유의 표면에선 모폴로지 변화가 크게 나타나지 않았으나, 해수 가속화 조건에서 분해 4주 만에 크랙이 발생하였으며 분해 30주부터 시료의 손실이 크게 나타났다. ISO 14855-2 평가 후 측정된 PBS-c에서 결정화 온도가 크게 감소하는 것을 확인할 수 있었지만 화학 구조, 결정구조에서 큰 변화는 나타나지 않았다. ISO 14855-2 평가를 통해 측정한 PBS-c 생분해도를 기준으로, 해수 및 해수 가속화 조건을 통해 측정한 PBS-c 섬유의 생분해도를 비교하였을 때, 해수 조건에서는 34주 동안 분해됨에도 불구하고, 더 낮은 생분해도가 나타났다. 반면, 해수 가속화 처리를 진행했을 때, 해수 조건에서도 ISO 14855-2 평가를 통해 측정한 생분해도와 비슷한 값을 얻을 수 있었다.
- 1. Alabi, O. A.; Ologbonjaye, K. I.; Awosolu, O.; Alalade, O. E. Public and Environmental Health Effects of Plastic Wastes Disposal: A Review. J. Toxicol. Risk Assess. 2019,5, 21.
-

- 2. Emadian, S. M.; Onay, T. T.; Demirel, B. Biodegradation of Bioplastics in Natural Environments. Waste Manage 2017, 59, 526-536.
-

- 3. Gao, H.; Yan, C.; Liu, Q.; Ding, W.; Chen, B.; Li, Z. Effects of Plastic Mulching and Plastic Residue on Agricultural Production: A Meta-analysis. Sci. Total Environ. 2019, 651, 484-492.
-

- 4. Sudesh, K.; Iwata, T. Sustainability of Biobased and Biodegradable Plastics. Clean-Soil Air Water 2008, 36, 433-422.
-

- 5. Awoyera, P. O.; Adesina, A. Plastic Wastes to Construction Products: Status, Limitations and Future Perspective. Case Stud. Constr. Mater 2020, 12, e00330.
-

- 6. Appiah, J. K.; Berko-Boateng, V. N.; Tagbor, T. A. Use of Waste Plastic Materials for Road Construction in Ghana. Case Stud. Constr. Mater 2017, 6, 1-7.
-

- 7. Maddah, H. A. Polypropylene as a Promising Plastic: A Review. Am. J. Polym. Sci. 2016, 6, 1-11.
-

- 8. Kong, Y.; Hay, J. N. Multiple Melting Behavior of Poly(ethylene terephthalate) Polymer 2003, 44, 623-633.
-

- 9. Jambeck, J.; Geyer, R.; Wilcox, C.; Siegler, T. R.; Perryman, M.; Andrady, A. L.; Narayan, R.; Law, K. L. Plastic Waste Inputs from Land into the Ocean. Science 2015, 347, 768-77.
-

- 10. Wang, G. X.; Huang, D.; Völker, C.; Wurm, F. M. Seawater-degradable Polymers-fighting the Marine Plastic Pollution. Adv. Sci. 2020, 8, 2001121.
-

- 11. Funabashi, M.; Ninomiya, F.; Kunioka, M. Biodegradability Evaluation of Polymer by ISO 14855-2. Int. J. Mol. Sci. 2009, 10, 3635-3654.
-

- 12. Chen, G. Q.; Wu, Q. The Application of Polyhydroxyalkanoates as Tissue Engineering Materials. Biomaterials 2005, 26, 6565-6578.
-

- 13. Woodruff, M. A.; Hutmacher, D. W. The Return of a Forgotten Polymer-polycaprolactone in the 21st Century. Prog. Polym. Sci. 2010, 35, 1217-1256.
-

- 14. Farah, S.; Andreson, D. G.; Langer, R. Physical and Mechanical Properties of PLA, and Their Functions in Widespread Applications-a Comprehensive Review. Adv. Drug. Deliv. Rev. 2016, 107, 367-392.
-

- 15. Phua, Y.; Lua, N.; Sudesh, K.; Chow, W.; Ishak, Z. Biodegradability Studies of Poly(butylene succinate)/(organo-montmorillonite Nanocomposites Under Controlled Compost Soil Conditions: Effects of Clay Loading and Compatibilizer. Polym. Degrad. Stab. 2006, 91, 31-43.
-

- 16. Xu, J.; Guo, B. H. Microbial Succinic Acid. Its Polymer Poly(butylene succinate), and Applications. In Plastics from Bacteria: Natural Functions Applications; Chen, G.Q., Ed., Springer: Heidelberg, New York, 2010; pp 347-388.
-

- 17. Ahn, B. D.; Kim, S. H.; Kim, Y. H.; Yang, J. S. Synthesis and Characterization of the Biodegradable Copolymers from Succinic Acid and Adipic Acid with 1,4-Butanediol. J. Appl. Polym. Sci. 2001, 82, 2808-2826.
-

- 18. Nagata, M.; Goto, H.; Sakai, W.; Tsutsumi, N. Synthesis and Enzymatic Degradation of Poly(tetramethylene succinate) Copolymers with Terephthalic Acid. Polymer 2000, 44, 4373-4376.
-

- 19. Han, J.; Shi, J.; Xie, Z.; Xu, J.; Guo, B. Synthesis, Properties of Biodegradable Poly(butylene succinate-co-butylene 2-methyl- succinate) and Application for Sustainable Release. Materials 2019, 12, No 150720.
-

- 20. Puchalski, M.; Szparaga, G.; Biela, T.; Gutowska, A.; Sztajnowski, S.; Krucińska, I. Molecular and Supramolecular Changes in Polybutylene Succinate (PBS) and Polybutylene Succinate Adipate (PBSA) Copolymer During Degradation in Various Environmental Conditions. Polymers 2018, 10, 1-12.
-

- 21. Honda, N.; Taniguchi, I.; Miyamoto, M.; Kimura, Y. Reaction Mechanism of Enzymatic Degradation of Poly(butylene succinate-co-terephthalate) (PBST) with a Lipase Originated from Pseudomonas cepacia. Macromol. Biosci. 2003, 3, 189-197.
-

- 22. Park, J. W.; Kim, D. K.; Im, S. S. Crystallization Behaviour of Poly(butylene succinate) Copolymer. Polym. Int. 2002, 51, 239.
-

- 23. Kim, H. S.; Yang, H. S.; Kim, H. J. Biodegradability and Mechanical Properties of Agro-flour-filled Polybutylene Succinate Biocomposites. J. Appl. Polym. Sci. 2005, 97, 1513-1521.
-

- 24. Vytejckova, S.; Vapenka, L.; Hradecky, J.; Dobias, J.; Hajslova, J.; Loriot, C. Testing of Polybutylene Succinate-based Films for Poultry Meat Packaging. Polym. Test. 2017, 60, 357-364.
-

- 25. Ayu, R. S.; Khalina, A.; Harmaen, A. S.; Zaman, K.; Mohd Nurrazi, N.; Isma, T.; Lee, C. H. Effect of Empty Fruit Brunch Reinforcement in PolyButylene-succinate/modified Tapioca Starch Blend for Agricultural Mulch Films. Sci. Rep. 2020, 10, 1-7.
-

- 26. Volova, T. G.; Boyandin, A. N.; Vasil'ev, A. D.; Karpov, V. A.; Kozhevnikov, I. V.; Prudnikova, S. V.; Rudnev, V. P.; Xuån, B. B.; Ding, V. V.; Gitel'zon, I. I. Biodegradation of Polyhydroxyalkanoates (PHAs) in the South China Sea and Identification of PHA-degrading Bacteria. Microbiology 2011, 80, 252-260.
-

- 27. Göpferich, A. Mechanisms of Polymer Degradation and Erosion. Biomaterials 1996, 17, 103-144.
-

- 28. Voinova, O.; Gladyshev, M.; Volova, T. G. Comparative Study of PHA Degradation in Natural Reservoirs Having Various Types of Ecosystems. Macromol. Symp. 2008, 269, 34-97.
-

- 29. Massardier-Nageotte, V.; Pestre, C.; Cruard-Pradet, T.; Bayard, R. Aerobic and Anaerobic Biodegradability of Polymer Films and Physico-chemical Characterization. Polym. Degrad. Stab. 2006, 91, 620-627.
-

- 30. Guo, W.; Tao, J.; Yang, C.; Zhao, Q.; Song, C.; Wang, S. The Rapid Evaluation of Material Biodegradability Using an Improved ISO 14852 Method with a Microbial Community. Polym. Test. 2010, 29, 832-839.
-

- 31. Weng, Y. X.; Wang, X. L.; Wang, Y. Z. Biodegradation Behavior of PHAs with Different Chemical Structures Under Controlled Composting Conditions. Polym. Test. 2011, 30, 372-380.
-

- 32. Hoshino, A.; Tsuji, M.; Momochi, M.; Mizutani, A.; Sawada, H.; Kohnami, S.; Nakagomi, H.; Ito, M.; Saida, H.; Ohnishi, M.; Hirata, M.; Kunioka, M.; Funabash, M.; Uematsu, S. Study of Determination of the Ultimate Aerobic Biodegradability of Plastic Materials Under Controlled Composting Conditions. J. Polym. Environ. 2007, 15, 275-280.
-

- 33. Ardisson, G. B.; Tosin, M.; Barbale, M.; Degli-Innocenti, F. Biodegradation of Plastics in Soil and Effects on Nitrification Activity. A Laboratory Approach. Front. Mirobiol. 2014, 5, 1-7.
-

- 34. Jung, J.; Raghavendra, G. M.; Kim, D.; Seo, J. One-step Synthesis of Starch-silver Nanoparticle Solution and its Application to Antibacterial Paper Coating. Int. J. Biol. Macromol. 2018, 107, 2285-2290.
-

- 35. Kasuya, K.; Takagi, K.; Ishiwatari, S.; Yoshida, Y.; Doi, Y. Biodegradabilities of Various Aliphatic Polyesters in Natural Waters. Polym. Degrad. Stab. 1998, 59, 327-332.
-

- 36. Hyun, Y. J.; Park, S. B.; Kwak, H. W.; Jin, H. J. Biodegradation Behavior of Polybutylene Succinate Fibers in Simulated Seawater with Accelerating Degradation Conditions. Polym. Korea 2021, 45, 398-405.
-

- 37. Wu, C.; Zhang, X.; Wang, X.; Gao, Q.; Li, X. Surface Modification of Cellulose Nanocrystal Using Succinic Anhydride and its Effects on Poly(butylene succinate) Based Composites. Cellulose 2019, 26, 3167-3181.
-

- 38. Jeon, S. B.; Oh, H. H.; Uhm, T. B.; Cho, J. Y.; Yang, H. J.; Jeong, D. Y. Characteristic Study and Isolation of Bacillus subtilis SRCM 101269 for Application of Cow Manure. Korean J. Microbiol. 2016, 52, 74-83.
-

- 39. Altaee, N.; El-Hiti, G. A.; Fahdil, A.; Sudesh, K.; Yousif, E. Biodegradation of Different Formulations of Polyhydroxy Butyrate Films in Soil. Springerplus 2016, 5, Article 762.
-

- 40. Pan, W. J.; Bai, Z. H.; Su, T. T.; Wang, Z. Y. Enzymatic Degradation of Poly(butylene succinate) with Different Molecular Weights by Cutinase. Int. J. Biol. Macromol. 2018, 111, 1040-1046.
-

- 41. Albertsson, A. C.; Karlsson, S. Increased Biodegradation of LDPE-Matrix in Starch-Filled LDPE Materials. Abstr. Pap. Am. Chem. Soc. 1992, 204, 158-PMSE.
-

- 42. Wang, X. H.; Zhou, J. J.; Li, L. Multiple Melting Behavior of Poly(butylene succinate). Eur. Polym. J. 2007, 43, 3163-3170.
-

- 43. Mochizuki, M.; Hirami, M. Structural Effects on the Biodegradation of Aliphatic Polyesters. Polym. Adv. Technol. 1997, 8, 203.
-

- 44. Lee, C. W.; Kimura, Y.; Chung, J. D. Mechanism of Enzymatic Degradation of Poly(butylene succinate). Macromol. Res. 2008, 16, 651-658.
-

- 45. Madbouly, S. A.; Schrader, J. A.; Srinivasan, G.; Liu, K.; McCabe, K. G.; Grewell, D.; Graves, W. R.; Kessler, M. R. Biodegradation Behavior of Bacterial-based Polyhydroxyalkanoate (PHA) and DDGS Composites. Green Chem. 2014, 16, 1911-1920.
-

- 46. Clarizia, G.; Bernardo, P.; Gorrasi, G.; Zampino, D.; Carroccio, S. C. Influence of the Preparation Method and Photo-oxidation Treatment on the Thermal and Gas Transprot Properties of Dense Films Based on a Poly(ether-block-amide) Copolymer. Materials 2018,11, 1326-1342.
-

- 47. França, D. C.; Morais, D. D.; Bezerra, E. B.; Araúj, E. M.; Wellen, R. M. R. Photodegradation Mechanisms on Poly(ε-caprolactone) (PCL). Mater. Res. 2018, 24.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(3): 318-326
Published online May 25, 2022
- 10.7317/pk.2022.46.3.318
- Received on Aug 10, 2021
- Revised on Nov 12, 2021
- Accepted on Nov 12, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hyo Won Kwak**, ***, and Hyoung-Joon Jin*, ****
-
*Program in Environmental and Polymer Engineering, Inha University, Incheon 22212, Korea
**Department of Agriculture, Forestry and Bioresources, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Korea
***Research Institute of Agriculture and Life Sciences, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Korea
****Department of Polymer Science and Engineering, Inha University, Incheon 22212, Korea - E-mail: bk0502@snu.ac.kr. hjjin@inha.ack.kr
- ORCID:
0000-0003-1630-7210, 0000-0002-1763-9455









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.