- Docetaxel Nanocrystals Producedvia an Amorphous Precursor
Insil Choi, Hee-Jin Kim, Kab Sig Kim*, Yong Suk Jin*, Eun Yong Lee*, Joo Won Park*, Young-Je Kwark**, Yun Sang Lee***, Jae Hyun Jeong†
 , and Il Won Kim†
, and Il Won Kim† 
Department of Chemical Engineering, Soongsil University, Seoul 06978, Korea
*Bio-Synectics, Inc., Seoul 08501, Korea
**Department of Organic Materials and Fiber Engineering, Soongsil University, Seoul 06978, Korea
***Department of Physics, Soongsil University, Seoul 06978, Korea- 무정형 전구체를 통한 도세탁셀 나노결정의 형성
숭실대학교 화학공학과, *(주)바이오시네틱스, **숭실대학교 유기신소재·파이버공학과, ***숭실대학교 물리학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Docetaxel is an anti-cancer medication in the taxane family administered intravenously due to its low aqueous solubility and gastrointestinal permeability. The current commercial formulation contains a substantial amount of solubilizing excipients that could cause systemic anaphylaxis and cardiovascular side effects. Nanocrystal formulation is an ideal alternative to circumvent excipient-related problems, and it could also take advantage of the defective vascular architecture of solid tumors through enhanced permeability and retention. In the present study, we combined phase separation and high-pressure homogenization processes to generate docetaxel nanocrystals (ca. 200 nm). The initial phase separation of docetaxel from the solution with 1-tetradecanol produced an amorphous nano-precursor in the presence of poly(vinyl pyrrolidone), which was subsequently transformed into the nanocrystals during the high-pressure homogenization. The nanocrystals exhibited a promising anti-cancer effect with minimal damage to normal tissue when tested with a chicken chorioallantoic membrane model.
Taxane계 항암제인 도세탁셀은 낮은 용해도와 투과도로 인해 유기 용매에 녹인 형태로 정맥 주사에 사용된다. 높은 함량의 부형제는 전신 과민증, 심혈관 부작용 등을 유발할 수 있어서, 부형제 함량을 줄이는 나노결정 제제가 연구되고 있다. 본 연구의 도세탁셀 나노입자 제조에서 입자 크기와 크기 분포를 기준으로 최적화된 공정은 상분리와 고압균질화를 결합한 형태였다. 도세탁셀을 1-tetradecanol 매트릭스에 poly(vinyl pyrrolidone)과 같이 녹인 후 냉각 상분리하여 무정형 나노 전구체를 얻었으며, 전구체를 고압균질화를 통해 수분산하여 약 200 nm의 나노결정을 제조하였다. 암세포 cluster가 도입된 chicken chorioallantoic membrane을 활용하여 도세탁셀 나노입자를 시험한 결과, 주변 정상 조직에 대한 확연한 손상을 보이지 않으면서 암 조직 크기의 유의미한 감소가 관측되었다.
Docetaxel nanocrystals (ca. 200 nm) were produced by combining phase separation and high-pressure homogenization processes. The nanocrystals exhibited a promising anti-cancer effect with minimal damage to normal tissue when tested with a chicken chorioallantoic membrane model.
Keywords: docetaxel, nanocrystal, amorphous precursor, poly(vinyl pyrrolidone), enhanced permeability and retention.
이 연구는 정부(교육부) 재원인 한국연구재단의 기초연구사업(NRF-2015R1D1A1A01058116)과 2019년도 숭실대학교 교내연구비의 지원으로 수행되었음.
저자들은 이해상충이 없음을 선언합니다.
Taxane계 항암제인 도세탁셀(docetaxel)은 여러 종류의 암에 대한 치료에 사용되고 있으나, 생물약제학적 분류체계 (biopharmaceutical classification system) 계열(class) IV에 해당하는 낮은 투과도와 용해도 특성을 보인다.1,2 즉, 도세탁셀은 낮은 위장관 투과도로 인해서 정맥 주사(intravenous injection)로 투여되고 있으며, 물에 대한 낮은 용해도로 인해서 유기 용매에 녹인 형태로 사용되고 있다. 도세탁셀 주사제인 Sanofi사의 Taxotere 중 생리식염수나 포도당 수액에 바로 희석하여 사용할 수 있는 제형의 경우, 도세탁셀이 polysorbate 80/ethanol=1:1(v/v) 용매에 용해된 형태(20 mg/1 mL)로 판매되고 있다.3 하지만 이렇게 다량(docetaxel/polysorbate 80=1:27 w/w) 사용하는 부형제에서 기인하는 전신 과민증(systemic anaphylaxis), 심혈관 부작용(cardiovascular side effect) 등이 보고되어 왔으며, 고체 분산체, 리포좀, 나노 입자 등과 같은 제형을 개발하여 부형제의 사용을 줄이고 효과적으로 약물을 목표 부위에 전달하는 방법들이 연구되고 있다.4,5
한편, 약물 자체로 이루어진 결정 입자는 전달체를 사용하지 않기 때문에, 분산을 위한 부형제만 최소로 사용하여 약물의 적재율을 극대화시킬 수 있는 장점이 있다. 이때 나노 스케일로 결정 입자가 형성되면 표면적의 증가에 따라 용출 성능의 개선이 일반적으로 관측되며, Rapamune®, Emend®, Tricor® 등이 이러한 기술을 이용한 제품으로 출시되어 있다.6 항암제의 경우에는 100-300 nm 크기의 나노 결정 형태로 제조하면, 종양의 불완전한 혈관 구조 등에 기인한 enhanced permeability and retention(EPR) 효과를 기대할 수 있다.7-9 Taxane계 항암제인 paclitaxel과 docetaxel에 대해서 다양한 방법으로 제조한 나노 결정이 보고되었으며, 크게 밀링(milling)이나 고압균질화(high pressure homogenization, HPH)와 같은 top-down 방법과 침전이나 상분리와 같은 bottom-up 방법으로 나누어 분류할 수 있다.10-13
본 연구에서는 bottom-up 방법인 상분리와 top-down 방법인 고압균질화를 결합하여, EPR 효과를 기대할 수 있는 크기의 도세탁셀 나노결정 입자를 제조하는 것을 목표로 하였다. 고압균질화의 사전단계로서 상분리 공정과 고분자 첨가제인 poly(vinyl pyrrolidone)의 유무 등에 따라 생성되는 결정 입자를 분석하였으며, 최적화된 공정에서 도세탁셀 나노결정 입자의 생성 메커니즘을 연구하였다. 특히, 상분리 과정에서는 독성이 있는 유기 용매 대신에 부형제나 식품첨가제로도 사용되는 지방 알코올인 myristyl alcohol(1-tetradecanol)을 사용하고, 상분리 후에 초임계 이산화탄소 추출법을 이용하여 이를 제거하였다.13-15 최종적으로 제조한 도세탁셀 나노결정 입자의 EPR 효과와 독성에 대한 예비 평가를 암세포 cluster가 도입된 chicken chorioallantoic membrane(CAM)을 ex vivo 모델로 활용하여 진행하였다.
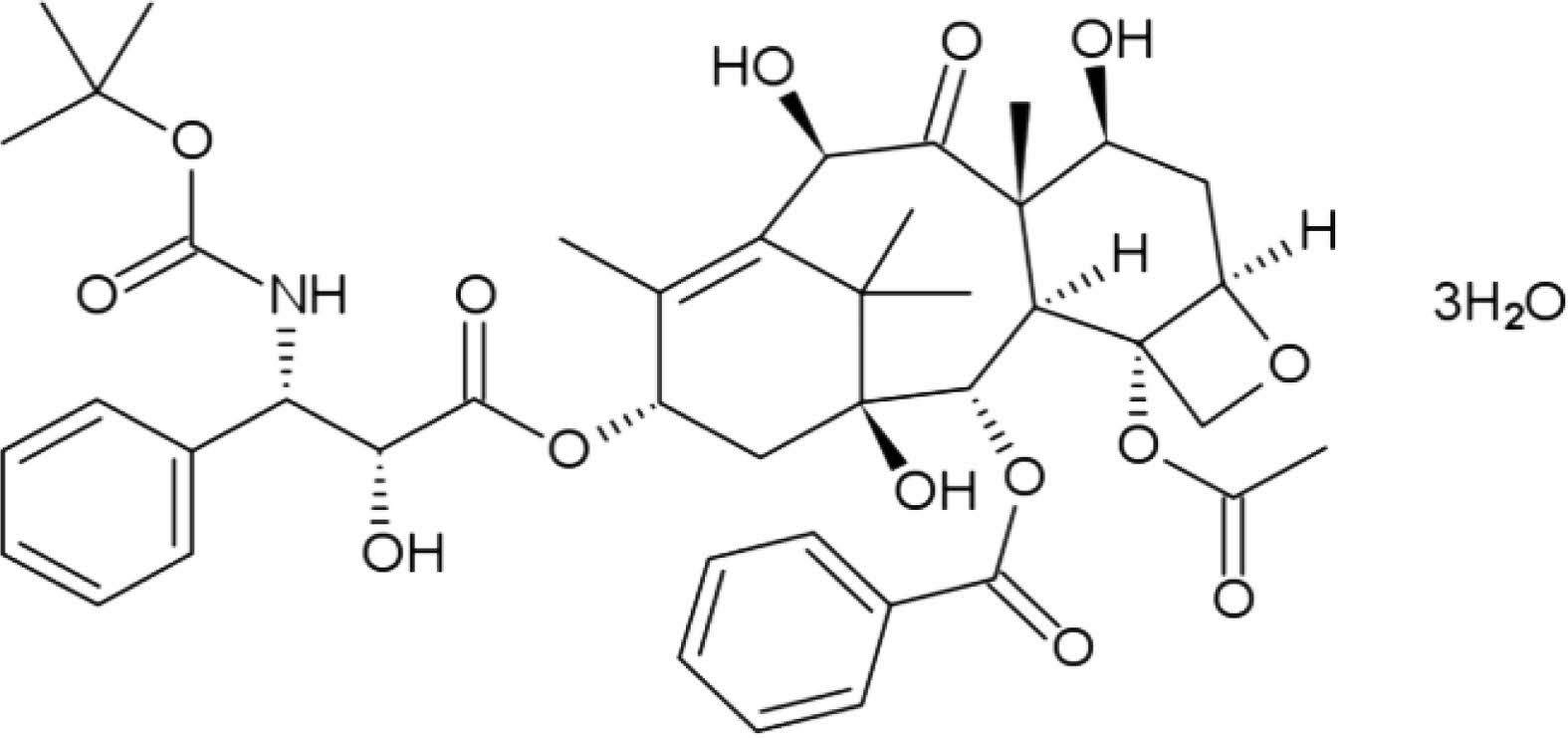
시약.Docetaxel trihydrate(DTX: 순도 98.4%, Figure 1)는 중국 Shanghai Jinhe Bio-Technology에서 구입하였으며, 1-tetradecanol(TD)은 미국 Fluka에서 구입하였다. Poly(vinyl pyrrolidone) (PVP: Kollidon 17PF)과 poloxamer 188(P188: Kolliphor P188)은 독일 BASF에서 구입하였고, polyoxyethyl- ene(40) stearate (PST)과 arginine(ARG)는 각각 영국 Croda와 일본 Tokyo Chemical Industry의 제품을 이용하였다.
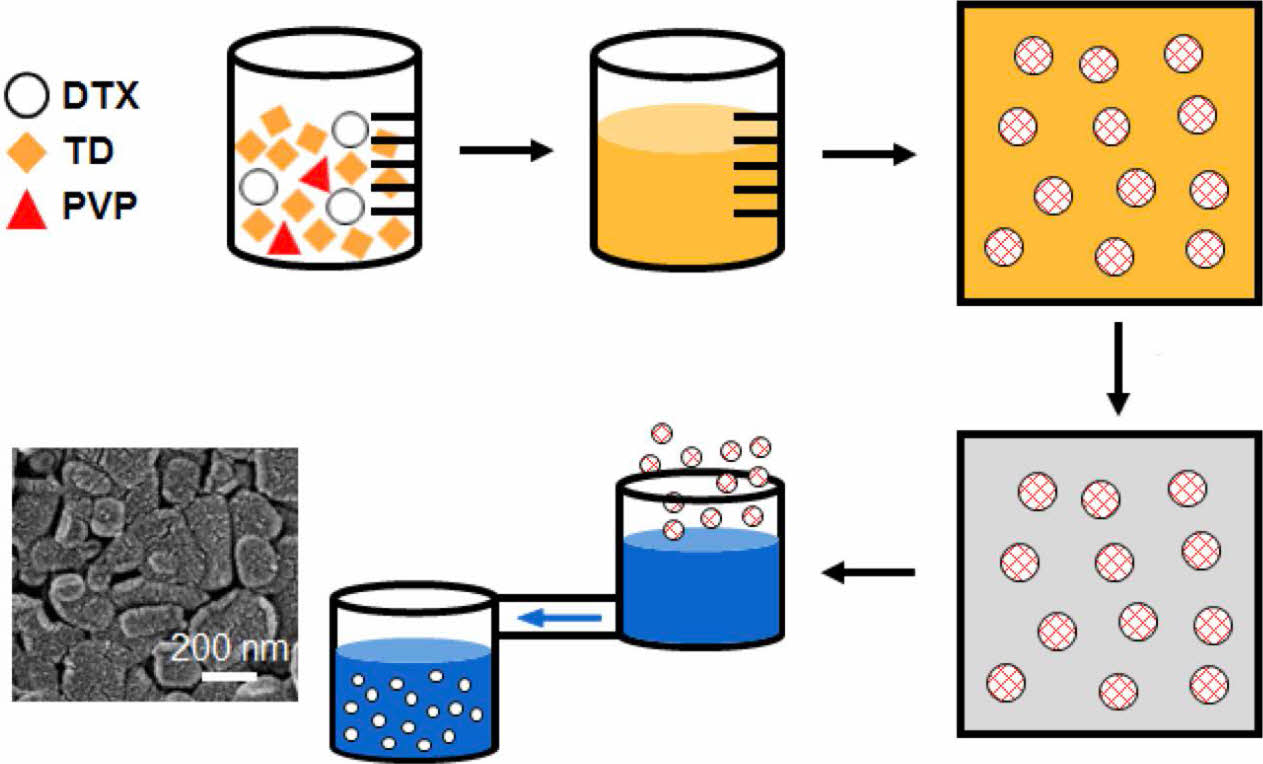
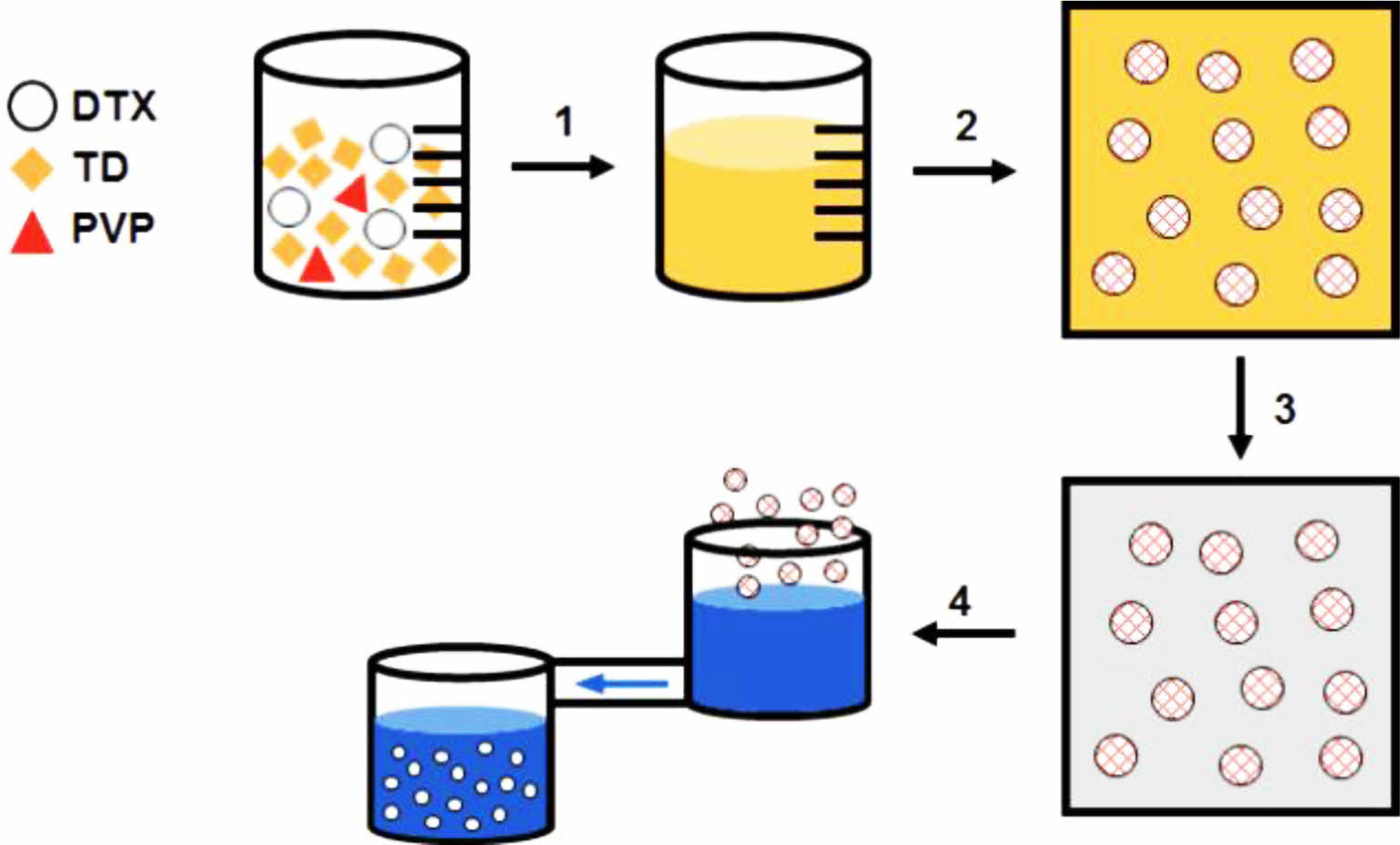
도세탁셀 결정의 제조. 수분산된 DTX 결정을 제조하기 위해서는 고압균질기(일신오토클레이브, ISA-N-10M)를 이용하였으며, TD를 이용하여 DTX를 미리 분산시킨 경우에는 사용한 TD를 초임계 이산화탄소 유체(바이오시네틱스사)를 이용하여 제거하였다. Table 1에 TD 매트릭스의 이용 여부, PVP 첨가 여부 등에 따라 제조된 여러 제형의 명명법과 조건을 간단히 표시하였고, 제조 공정 모식도는 Figure 2에 제시하였다. 예를 들어 DTX-pM-H의 경우, (i) M은 매트릭스인 TD를 이용하여 DTX를 미리 분산시켰음을 의미하며, (ii) pM은 PVP를 매트릭스인 TD와 같이 혼합시켰음을 뜻하고, (iii) H는 최종 단계로 고압균질기를 이용하였음을 나타낸다. Figure 2에서 고형화 직후의 DTX 속 붉은 선은 PVP가 DTX에 녹아있음을 의미한다. 이때 TD와 PVP는 DTX/TD/PVP=1:10:0.8의 무게 비율로 이용하였다. TD 매트릭스를 이용하는 경우에는 100 ºC에서 혼합물을 완전히 녹인 후 상온에서 24시간 고형화한 후에, TD를 초임계 이산화탄소 유체를 이용하여 제거하였다. 고압균질기는 DTX를 초순수에 5 mg/mL로 분산시켜 이용하였는데, 600 bar에서 1-2 cycle, 900 bar에서 3-4 cycle, 1100 bar에서 5-21 cycle을 수행하였으며 온도는 수조를 통해 55 ºC 이하로 유지하였다. 순차적인 압력 증가와 수조를 통한 온도 조절은 고압균질화 공정에 수반되는 온도 상승과 그에 따른 약물의 변화를 최소화하기 위한 것이었다. 이때 DTX/PST/P188/ARG=1:0.15:0.05:0.05의 비율로 분산 첨가제를 이용하였다.
도세탁셀 결정의 분석. 수분산된 DTX 결정의 크기와 zeta potential은 영국 Malvern사의 Zetasizer Nano ZS90(523 nm He-Ne laser) 기기를 이용하여 25 ºC에서 분석하였다. 또한 수분산된 시료를 track-etched polycarbonate 멤브레인(pore size 100 nm)을 통해 여과한 후에 초순수로 세척하고 데시케이터에서 24시간 건조하여 얻은 DTX 결정도 살펴 보았다. 주사전자현미경(SEM) 분석은 독일 Carl Zeiss사의 Sigma를 이용하였는데, sputter coater(독일 Leica사 EM AC200)를 이용하여 샘플을 Pt로 코팅한 후에 가속전압 2-3 kV를 사용하여 측정하였다. X-ray 회절분석(XRD)은 미국 Bruker사의 D2 PHASER를 이용하였는데, CuKα radiation(λ=1.5406 Å)을 사용하여 6-40º의 2θ 영역을 스캔하였다.
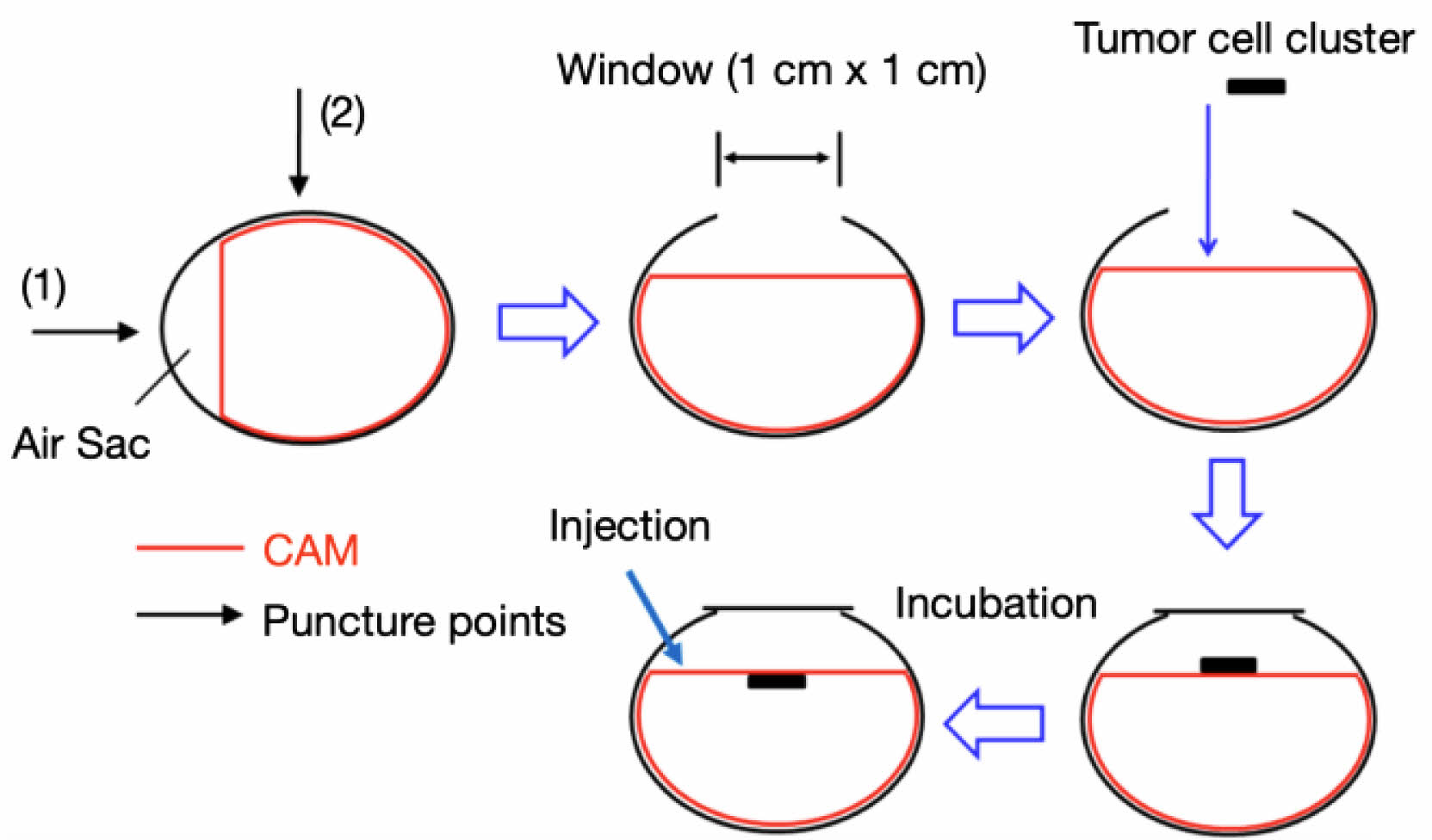
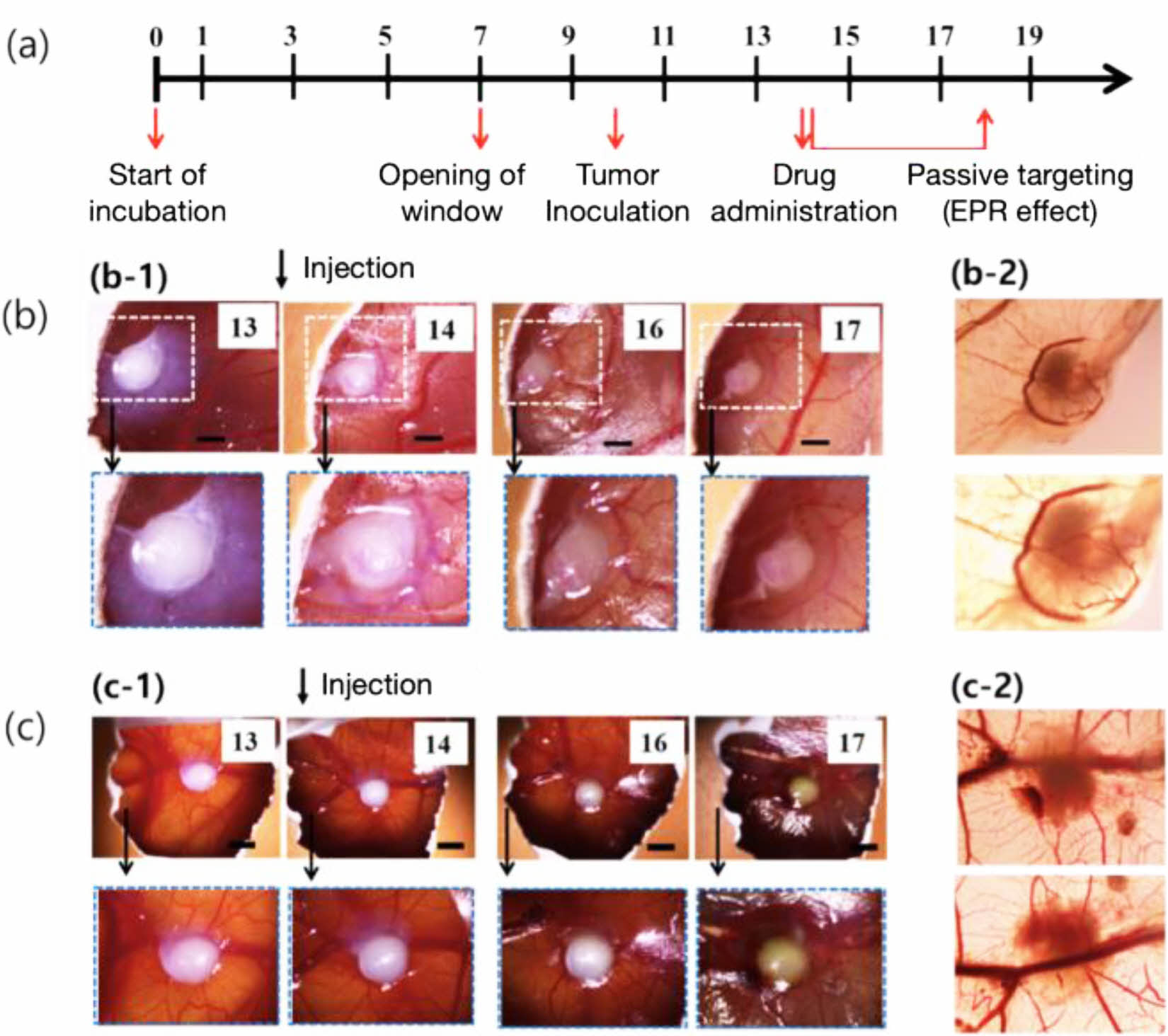
Ex Vivo CAM 분석. DTX 결정의 항암 효과와 정상세포에 대한 독성 평가는 폐선암세포(Calu-3, ATCC) cluster가 도입된 CAM 모델을 제조하여 ex vivo 투여 실험을 수행하였다.16 먼저, 폐선암세포를 75 cm2 flask에서 Eagle’s minimum essential medium(EMEM, ATCC, 미국)에 10% fetal bovine serum(FBS, Biowest, 프랑스)과 1% penicillin-streptomycin (P/S, Biowest, 프랑스)을 첨가한 배양액을 사용하여 37 ºC, 5% CO2 환경에서 배양하였다. 배양한 폐선암세포는 hanging drop method를 사용하여 tumor cell cluster로 제조하였다.17 이때 각 cluster 액적에 tumor necrosis factor alpha(TNF-α, Sigma, 미국)를 30 ng/mL의 농도로 첨가해 주었다. 이후, 50 μL 콜라겐 용액(collagen solution, 6 mg/mL, Advanced Bio Matrix, 미국)에 6.25 μL reconstructing solution(0.22 g NaHCO3 (Sigma), 0.477 g HEPES(Sigma), 0.4 mL 1 N NaOH(Sigma) in deionized water)을 적용하여 tumor cell cluster를 콜라겐 세포외기질로 봉입하였다. Ex vivo CAM 모델 구축 및 DTX 결정 투여 실험 과정을 Figure 3에 모식도로 나타냈다.
먼저, 유정란을 상대습도 50%, 37 ºC 환경의 배양기에서 7일 동안 배양하였다. 7일차에 각 유정란에 작은 구멍(window, 1 cm×1 cm)을 내고 CAM 혈관 형성을 관찰하였다. 혈관 형성이 충분히 진행된 11일차에 콜라겐 세포외기질로 봉입한 tumor cell cluster를 CAM에 이식하였다. CAM 위에서 암 조직 형성 및 신생 혈관 생성이 확인된 14일차에 DTX 나노결정을 20 μg/kg 농도로 투여하고 CAM에 발현된 암 조직의 변화를 관찰하였다. 대조군 실험으로는 도세탁셀을 ethanol/polysorbate 80(1:1 v/v)에 녹여 제조한 용액을 PBS(phosphate buffered saline)에 희석하여 같은 농도로 투여하였다. 관찰이 끝난 CAM은 18일차에 4% 포름알데하이드(formaldehyde in PBS, Sigma) 용액으로 고정시켰다. 고정 후 유정란에서 CAM을 가위로 절제하여 샘플링하고 H&E 염색(hematoxylin & eosin staining)을 통한 조직분석을 수행하였다.
|
Figure 1 Chemical structure of docetaxel trihydrate (DTX) |
|
Figure 2 Schematic of DTX nanocrystal formation: (1) melting; (2) cooling; (3) TD extraction; (4) HPH. |
|
Figure 3 Schematic of CAM-based ex vivo tumor essay. |
|
Table 1 Sample Names Based on the Manufacturing Processes and Materials (Weight ratio) |
a TD was removed using supercritical CO2 before high pressure homogenization. |
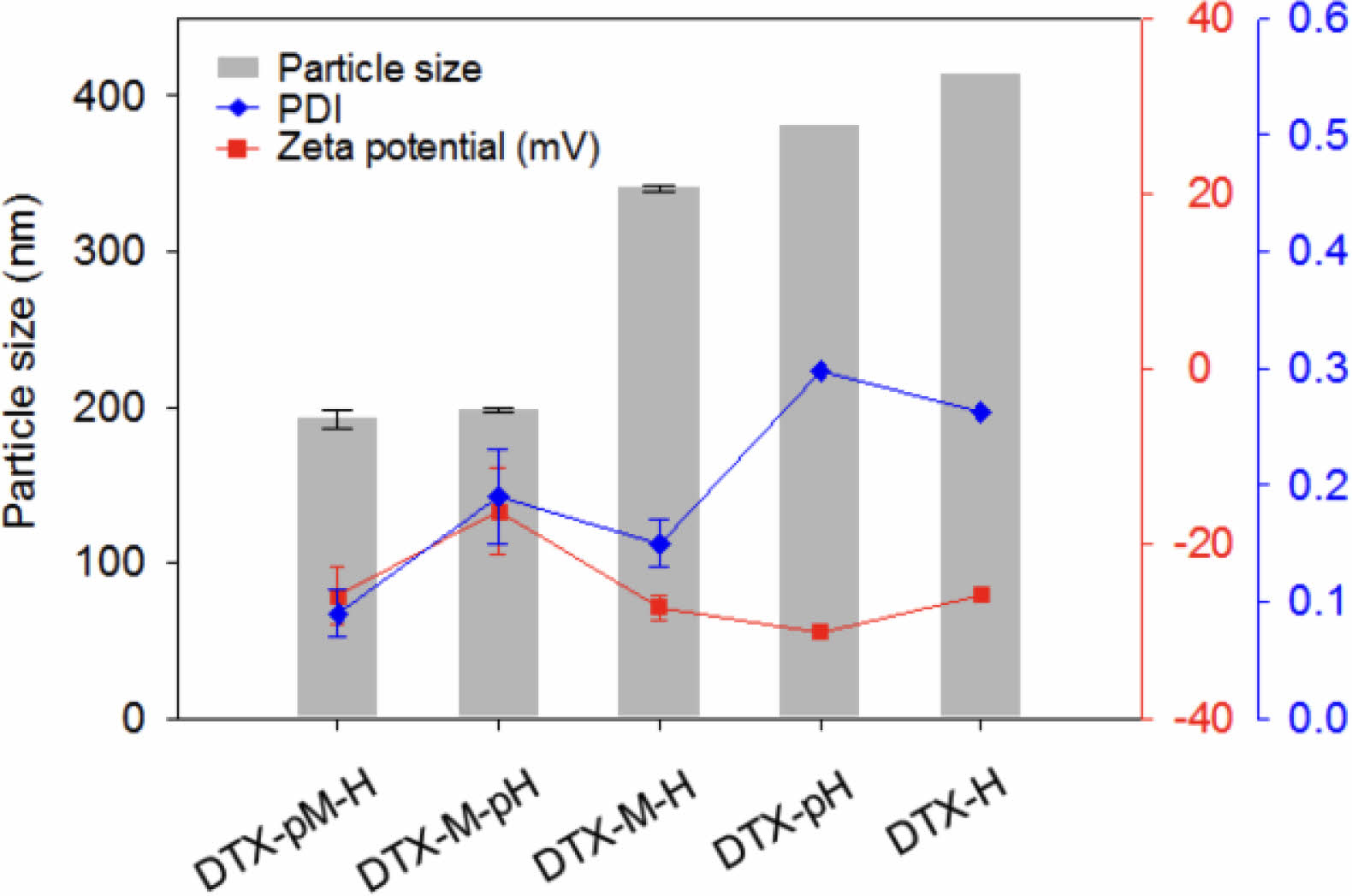
도세탁셀 결정 입자와 공정 변수. Table 1에 제시된 공정 조건 변화에 따라 제조된 DTX 결정의 입자 크기(particle size), 다분산지수(polydispersity index, PDI), 제타전위(zeta potential)를 Figure 4에 나타내었다. 입자 크기는 DTX-pM-H이 192.8 nm로 가장 작았으며, DTX-M-pH, DTX-M-H, DTX-pH, DTX-H의 순서대로 증가하여 각각 198.0, 340.7, 381.3, 414.1 nm 크기를 보였다. 다분산지수 또한 DTX-pM-H가 0.09로 가장 작은 값을 가지며, DTX-M-pH, DTX-M-H, DTX-pH, DTX-H는 각각 0.19, 0.15, 0.26, 0.30의 값을 보였다. 제타 전위의 경우 DTX-M-pH을 제외한 모든 경우에 -25 mV보다 작은 값을 보였으므로, 대체적으로 안정적인 분산이 이루어진 것으로 평가할 수 있었다. 참고로 DTX-pM-H, DTX-M-pH, DTX-M-H의 경우에는 세 번의 독립적인 실험 결과에 따른 표준편차를 각 물성값에 대해서 표시하였다. DTX-pH와 DTX-H의 경우에는 입자 크기와 다분산지수가 목표값보다 모두 현저히 커서 1회 실험 후 최적화 후보에서 제외하였다. 결론적으로 DTX-pM-H의 경우에 가장 작고 균일한 DTX 결정 입자가 생성되었으며, 1년 후에 입자 크기를 재측정한 결과 196.0 nm의 값을 보여 장기보관 안정성 또한 확인하였다.
도세탁셀 결정 입자의 형태와 결정학적 분석. 수분산된 시료를 여과한 후 초순수로 세척하고 건조하여 얻은 결정을 SEM으로 분석한 결과를 Figure 5에 나타내었다. DTX 원료 (Figure 5(a)) 입자는 둥근 모서리를 지닌 판 형태를 지니고 있으며 입자 크기 분포가 매우 큰 것을 알 수 있었다. DTX-pM-H(Figure 5(b)) 입자는 원료와 비슷한 모양으로 200 nm 정도의 크기를 지니며 분포가 상당히 균일하였다. DTX-M-pH(Figure 5(c)) 입자 또한 약 200 nm의 크기였으나, 입자 사이의 응집이 많은 부분에서 관찰되었다. 이러한 경향은 Figure 4의 입도 분석 결과와 일치하는 양상이다. DTX-M-H, DTX-pH, DTX-H(Figure 5(d)-(f)) 입자들은 상당히 큰 크기와 크기 분포를 지니고 있는데, 역시 입도 분석 결과와 일치하는 양상이다.
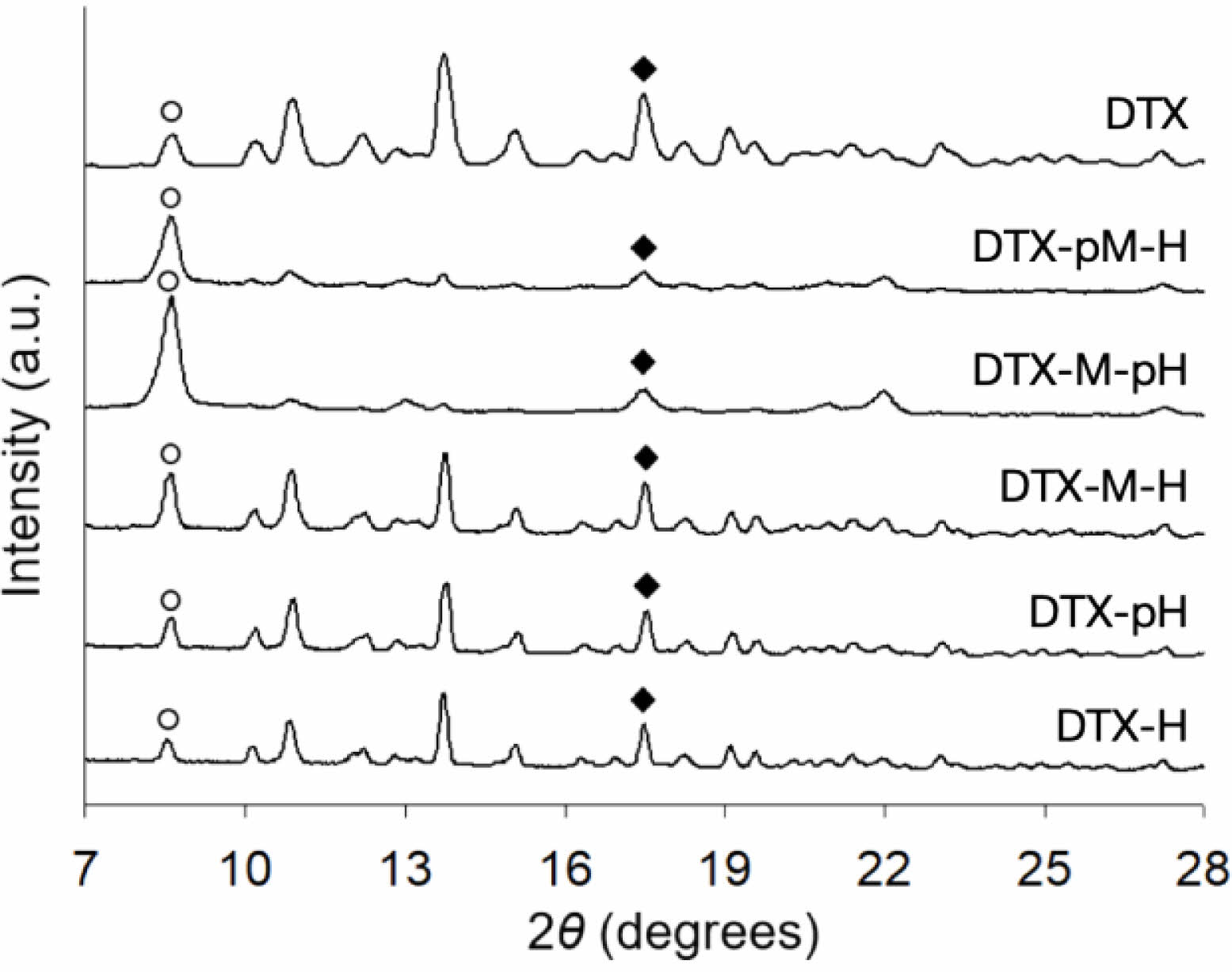
수분산된 시료를 여과한 후 초순수로 세척하고 건조하여 얻은 결정을 XRD로 분석한 결과를 Figure 6에 나타내었다. 전반적으로 회절 피크의 위치에는 변화가 없으므로 결정형은 원료인 도세탁셀 삼수화물이 그대로 유지되는 것을 알 수 있다. 하지만 회절 피크의 상대적인 크기는 원료와 상당한 차이를 보이는데, 특히, 8.6도의 (400)면 회절 피크와 17.5도의 (121)면 회절 피크의 크기 변화를 통해 결정 형태와의 상관 관계를 분석할 수 있다.18,19 8.6도의 (400)면 회절 피크는 얇은 판상의 모양을 지닌 DTX-pM-H와 DTX-M-pH에서 상대적으로 강하게 나타났으므로, 형성되는 DTX 결정의 평평한 면이 결정 구조의 a축에 수직한 것으로 판단할 수 있다. 또한 17.5도의 (121)면 회절 피크는 (400)면과 약 83도의 각도로 엇갈려 있고 두께 관측이 상대적으로 용이한 DTX 원료, DTX-M-H, DTX-pH, DTX-H 등에서 강하게 나타났기 때문에 결정의 두께와 비교적 평행한 것으로 추정할 수 있다.18 결국 XRD 회절 피크의 상대적인 크기 변화는 SEM을 통해서 관측한 결정의 모양과 일치하는 경향을 보였다.
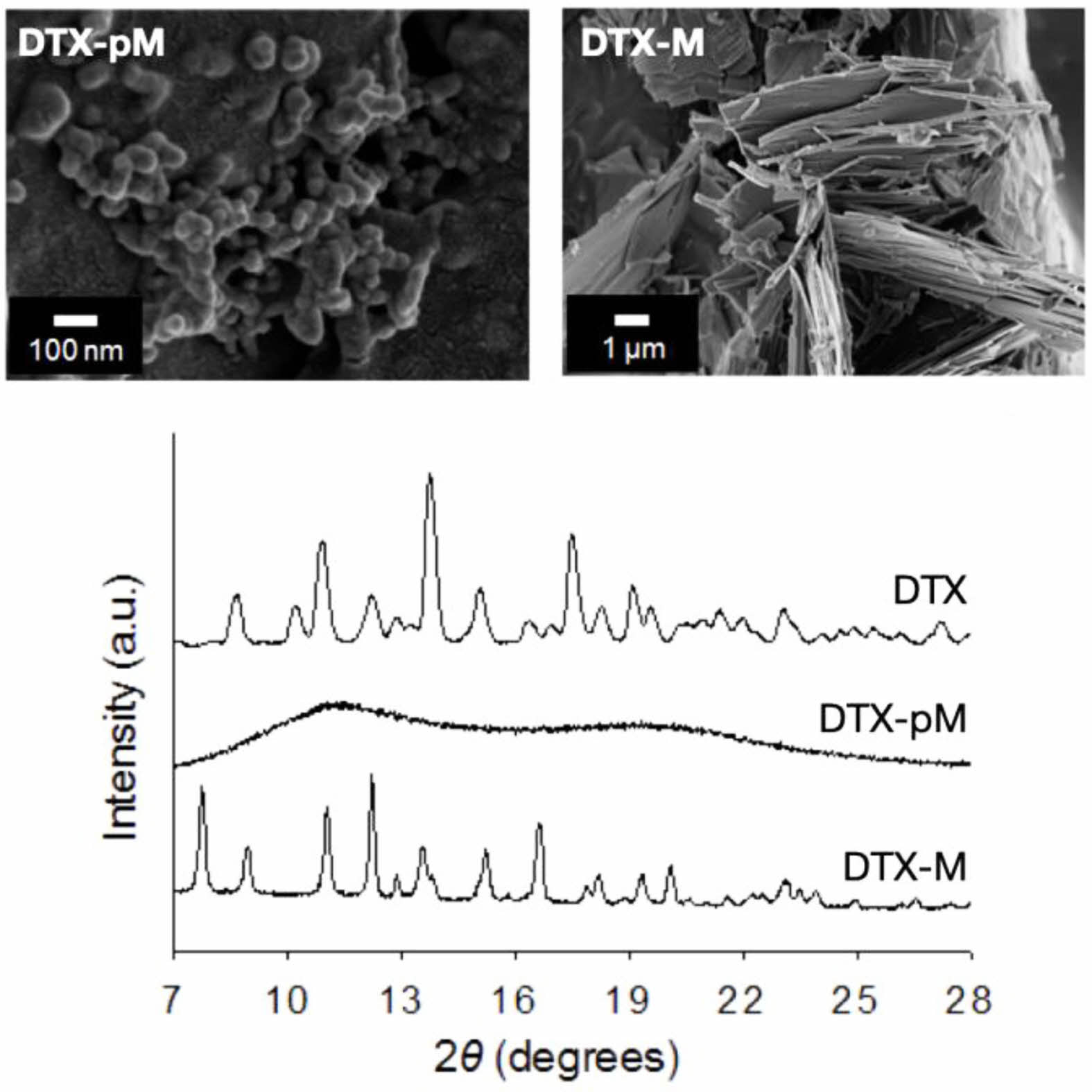
도세탁셀 무정형 전구체. 본 실험의 제한 조건 내에서 최적으로 판단할 수 있는 DTX-pM-H 입자 형성 과정을 살펴 보기 위해서, HPH를 이용한 수분산 직전의 DTX-pM과 DTX-M 상태를 비교 분석하였다. 두 샘플은 TD 매트릭스에 DTX를 녹일 때 PVP 존재 유무가 차이이며, 초임계 이산화탄소 유체를 이용하여 TD를 제거한 상태이다. Figure 7에 두 샘플의 SEM 및 XRD 분석 결과를 나타내었다. 형태학적으로 DTX-pM은 수십 나노미터 크기의 구형으로 관찰되었으며, DTX-M은 수 마이크로미터 크기의 판상 모양으로 관측되었다. 또한 XRD 분석을 통해 DTX-pM은 amorphous halo를 보이는 무정형이며, DTX-M은 삼수화물인 DTX 원료에서 물 분자가 제거된 무수물(anhydrous) 도세탁셀임을 확인할 수 있었다. 결국 TD 매트릭스에 DTX를 녹일 때 PVP가 존재하면 냉각 고형화 중 진행되는 상분리 과정에서 무정형 전구체가 생기며, PVP가 존재하지 않는 경우에는 무수물 도세탁셀 결정이 생성되었다. DTX-pM 무정형 나노 전구체는 수분산 과정에서 용해되며 물 환경에서 안정한 삼수화물 DTX로 재결정화되는 과정을 거치게 되는데, 재결정화 과정과 고압균질기의 작용이 결합되어 상대적으로 크기가 작고 균일한 DTX 결정이 최종 형성되는 것으로 추정할 수 있다.
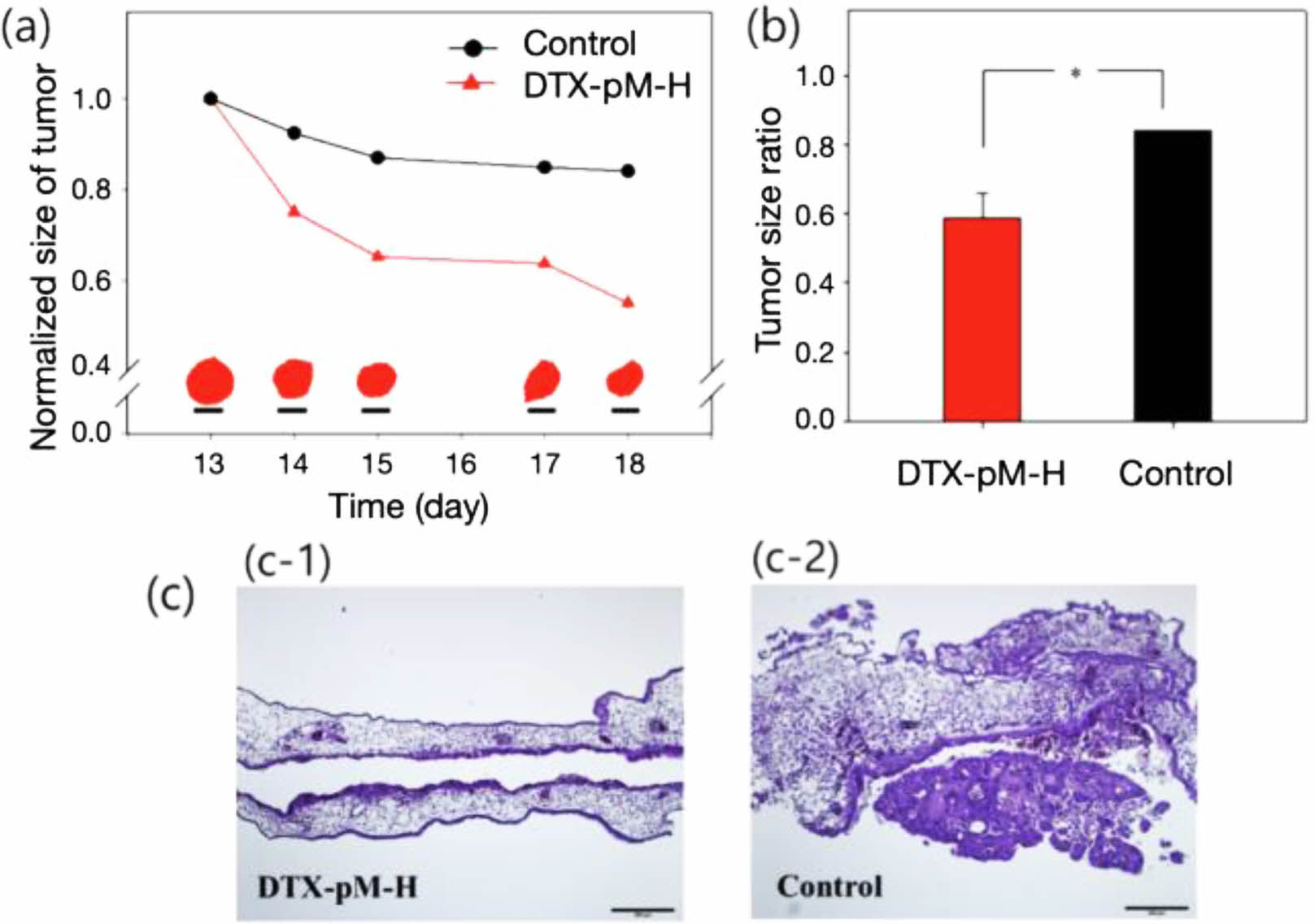
도세탁셀 결정의 Ex Vivo 특성 평가. DTX-pM-H 결정 입자의 항암 효과와 정상세포에 대한 독성 평가를 폐선암세포 cluster가 도입된 CAM을 이용한 ex vivo 모델로 평가하였다. 전반적인 과정은 다음 순서로 요약할 수 있다: (1) hanging drop method를 사용하여 암세포 cluster 제조; (2) 암세포 cluster 주변을 세포외기질 환경으로 조성하기 위해 콜라겐 젤로 봉입; (3) 유정란을 배양하여 CAM에 혈관을 형성시킨 후 콜라겐 젤로 봉입한 암세포 cluster를 유정란 배양 11일차에 이식; (4) CAM 위에 암조직 형성과 신생혈관 생성을 확인한 후, 암세포 cluster 이식 전에 존재하던 성숙한 정상혈관에 수분산된 DTX 결정을 투여(유정란 배양 14일차)하고 실체현미경 관측; (5) DTX 투여 4일 후 샘플을 포름알데하이드로 고정하고 H&E 염색을 통해 조직 분석(Figure 8(a)). 그 결과로 Figure 8에서 DTX-pM-H 결정입자(b) 및 대조군 약물(c) 투여에 따른 CAM에 이식한 암 조직의 시간에 따른 변화를 보여주었다. 실체현미경으로 관측한 암 조직 크기의 변화(Figure 9(a))는 ANOVA 분석을 통해 유의미한(p<0.05) 차이(Figure 9(b))를 보이는 것을 확인하였으며, H&E 염색을 통한 조직 분석(Figure 9(c))에서도 대조군의 경우 상당한 크기의 암 조직이 남아 있는 것을 확인하였다. 또한 주변 정상 조직에 대한 손상 여부도 상당한 차이가 발견되었는데, DTX-pM-H의 경우(Figure 8(b)) 확연한 손상이 발견되지 않은 반면 대조군의 경우(Figure 8(c)) 손상된 부분을 쉽게 발견할 수 있었다. 이러한 결과를 통해 DTX-pM-H 결정 입자의 EPR(enhanced permeability and retention) 효과를 간접적으로 추정할 수 있었다. 다만 본 ex vivo 모델은 체계적인 in vivo 실험을 위한 사전 예비 실험의 과정으로 진행한 것이고, in vivo 이미징 등을 통한 나노결정의 이동경로 관찰 등이 후속연구로 필요하다.
|
Figure 4 Particle size, PDI, and zeta potential of DTX nanocrystals. |

|
Figure 5 SEM images of (a) raw DTX; (b) DTX-pM-H; (c) DTXM-pH; (d) DTX-M-H; (e) DTX-pH; (f) DTX-H. |
|
Figure 6 XRD patterns of DTX raw and nanocrystals: empty circle (400); filled diamond (121). |
|
Figure 7 SEM images and XRD patterns of DTX-pM and DTX-M. |
|
Figure 8 (a) Procedure of the CAM-based ex vivo tumor assay. The images of tumor on CAM after injection of (b) DTX-pM-H; (c) control. The implant sites were further magnified on the backside of the CAM (b-2 and c-2). The scale bars represent 2 mm. |
|
Figure 9 Tumor size with time after injection of (a) DTX-pM-H and control; (b) tumor size ratio. The tumor size was normalized with that before injection. (c) The cross-section stained with the standard Hematoxylin & Eosin (H&E) for histological analysis |
DTX 나노결정이 수분산된 제형을 제조하기 위하여, TD 매트릭스를 이용한 상분리 공정과 고압균질화 공정을 결합하여 이용하였다. TD 매트릭스에서 상분리되는 도세탁셀을 나노 수준으로 분산시키기 위해서는 PVP 첨가제가 필수적임을 확인하였으며, 이때 분산되는 도세탁셀은 무정형이었다. 무정형 나노 전구체는 고압균질화와 결부된 수분산과정에서 안정한 삼수화물인 DTX로 재결정화되었는데, EPR 효과가 기대되는 약 200 nm의 판상 입자가 형성되었다. 최종 수분산된 제형은 도세탁셀과 부형제의 비율이 약 1:1이었으며, 1년 후에도 입자 크기가 거의 변하지 않는 장기보관 안정성을 보였다. 또한 암세포 cluster가 도입된 CAM 모델을 활용한 ex vivo 시험 결과, 주변 정상 조직에 대한 확연한 손상을 보이지 않으면서 암 조직 크기의 유의미한 감소가 관측되었다. 따라서 본 연구에서 최적화된 DTX-pM-H는 보다 체계적으로 in vivo EPR 효과 분석이 필요한 유망한 후보 제형으로 결론지을 수 있다.
- 1. Sulkes, A.; Smyth, J.; Sessa, C.; Dirix, L. Y.; Vermorken, J. B.; Kaye, S.; Wanders, J.; Franklin, H.; LeBail, N.; Verweij, J. Docetaxel (TaxotereTM) in Advanced Gastric Cancer: Results of a Phase II Clinical Trial. Br. J. Cancer 1994, 70, 380-383.
-

- 2. Fossella, F. V.; Lee, J. S.; Shin, D. M.; Calayag, M.; Huber, M.; Perez-Soler, R.; Murphy, W. K.; Lippman, S.; Benner, S.; Glisson, B. Phase II Study of Docetaxel for Advanced or Metastatic Platinum-refractory Non-small-cell Lung Cancer. J. Clin. Oncol. 1995, 13, 645-651.
-

- 3. Sanofi. Taxotere®: Prescribing Information. https://products.sanofi.us/Taxotere/taxotere.html (accessed Dec 20, 2021).
- 4. Engels, F. K.; Mathot, R. A. A.; Verweij, J. Alternative Drug Formulations of Docetaxel: A Review. Anti-Cancer Drugs 2007, 18, 95-103.
-

- 5. Naguib, Y. W.; Rodriguez, B. L.; Li, X.; Hursting, S. D.; Williams III, R. O.; Cui, Z. Solid Lipid Nanoparticle Formulations of Docetaxel Prepared with High Melting Point Triglycerides: In Vitro and In Vivo Evaluation. Mol. Pharmaceutics 2014, 11, 1239-1249.
-

- 6. Couillaud, B. M.; Espeau, P.; Mignet, N.; Corvis, Y. State of the Art of Pharmaceutical Solid Forms: From Crystal Property Issues to Nanocrystals Formulation. ChemMedChem 2019, 14, 8-23.
-

- 7. Maeda, H.; Wu, J.; Sawa, T.; Matsumura, Y.; Hori, K. Tumor Vascular Permeability and the EPR Effect in Macromolecular Therapeutics: A Review. J. Control. Release 2000, 65, 271-284.
-

- 8. Taurin, S.; Nehoff, H.; Greish, K. Anticancer Nanomedicine and Tumor Vascular Permeability; Where Is the Missing Link?. J. Control. Release 2012, 164, 265-275.
-

- 9. Hollis, C. P.; Weiss, H. L.; Leggas, M.; Evers, B. M.; Gemeinhart, R. A.; Li, T. Biodistribution and Bioimaging Studies of Hybrid Paclitaxel Nanocrystals: Lessons Learned of the EPR Effect and Image-guided Drug Delivery. J. Control. Release 2013, 172, 12-21.
-

- 10. Liu, F.; Park, J.-Y.; Zhang, Y.; Conwell, C.; Liu, Y.; Bathula, S. R.; Huang, L. Targeted Cancer Therapy with Novel High Drug-Loading Nanocrystals. J. Pharm. Sci. 2010, 99, 3542-3551.
-

- 11. Fuhrmann, K.; Pozomska, A.; Aeberli, C.; Castagner, B.; Gauthier, M. A.; Leroux, J.-C. Modular Design of Redox-Responsive Stabilizers for Nanocrystals. ACS Nano. 2013, 7, 8243-8250.
-

- 12. Pawar, V. K.; Gupta, S.; Singh, Y.; Meher, J. G.; Sharma, K.; Singh, P.; Gupta, A.; Bora, H. K.; Chaurasia, M.; Chourasia, M. K. Pluronic F-127 Stabilised Docetaxel Nanocrystals Improve Apoptosis by Mitochondrial Depolarization in Breast Cancer Cells: Pharmacokinetics and Toxicity Assessment. J. Biomed. Nanotechnol. 2015, 11, 1747-1763.
-

- 13. Choi, J.; Ko, E.; Chung, H.-K.; Lee, J. H.; Ju, E. J.; Lim, H. K.; Park, I.; Kim, K.-S.; Lee, J.-H.; Son, W.-C.; Lee, J. S.; Jung, J.; Jeong, S.-Y.; Song, S. Y.; Choi, E. K. Nanoparticulated Docetaxel Exerts Enhanced Anticancer Efficacy and Overcomes Existing Limitations of Traditional Drugs. Int. J. Nanomed. 2015, 10, 6121-6132.
-

- 14. Galichet, L. Y. Myristyl alcohol. In Handbook of Pharmaceutical Excipients, 6th ed.; Rowe, R. C., Sheskey, P. J., Quinn, M. E., Eds.; Pharmaceutical Press: London, 2009; pp 456-457.
- 15. Code of Federal Regulations Title 21: Food and Drugs. https://www.ecfr.gov/cgi-bin/text-idx?SID=c1b0922b68214656303fe9df50bdf10d&mc=true&node=se21.3.172_1864&rgn=div8 (accessed Dec 20, 2021).
- 16. Jeong, J. H.; Chan, V.; Cha, C.; Zorlutuna, P.; Dyck, C.; Hsia, K. J.; Bashir, R.; Kong, H. Living Microvascular Stamp for Patterning of Functional Neovessels; Orchestrated Control of Matrix Property and Geometry. Adv. Mater. 2012, 24, 58-63.
-

- 17. Weiswald, L. B.; Bellet D.; Vorginie D. M. Spherical Cancer Models in Tumor Biology. Neoplasia 2015, 17, 1-15.
-

- 18. Zaske, L.; Perrin, M.-A.; Daiguebonne, C.; Guillou, O. Docetaxel (Taxotere® Trihydrate) Forms: Crystal Structure Determination from XRPD & XRSCD Data. Mater. Sci. Forum 2004, 443-444, 411-414.
-

- 19. Kim, I. W.; Robertson, R. E.; Zand, R. Selected Polymorphs of CaCO3 through Epitaxy with Inorganic Substrates Aligned with an Electric Field. Adv. Mater. 2003, 15, 709-712.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(2): 275-280
Published online Mar 25, 2022
- 10.7317/pk.2022.46.2.275
- Received on Dec 21, 2021
- Revised on Dec 21, 2021
- Accepted on Jan 7, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jae Hyun Jeong , and Il Won Kim
-
Department of Chemical Engineering, Soongsil University, Seoul 06978, Korea
- E-mail: nfejjh@ssu.ac.kr, iwkim@ssu.ac.kr
- ORCID:
0000-0003-4263-408X, 0000-0001-8507-5279









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.