- In Situ Photo-crosslinkable Biodegradable Tissue Adhesive for Wound Healing
Hyeseon Lee#
 , Keum-Yong Seong#
, Keum-Yong Seong#  , Sodam Kim, Ajeesh Chandrasekharan,
, Sodam Kim, Ajeesh Chandrasekharan,
Dae Youn Hwang, Young Ki Hahn*, **, Moon-Chang Baek**, ***, Jun Lee****,† , and
, and
Seung Yun Yang†
Department of Biomaterials Science (BK21 Four Program), College of Natural Resources & Life Science, Pusan National University, Miryang 50463, Korea
*Department of Biomedical Convergence Science and Technology, School of Convergence,
Kyungpook National University, Daegu 41566, Korea
**Cell and Matrix Research Institute, School of Medicine, Kyungpook National University, Daegu 41566, Korea
***Department of Molecular Medicine, School of Medicine, Kyungpook National University, Daegu 41566, Korea
****Department of Oral and Maxillofacial Surgery, School of Dentistry, College of Dentistry,
Wonkwang University, Iksan 54538, Korea- 창상 치유를 위한 생체고분자 기반 광가교형 조직접착제 개발
이혜선#
 · 성금용#
· 성금용#  · 김소담 · 아지시찬드라세카란 · 황대연 · 한영기*, ** · 백문창**, *** · 이 준****,†
· 김소담 · 아지시찬드라세카란 · 황대연 · 한영기*, ** · 백문창**, *** · 이 준****,†  · 양승윤†
· 양승윤† 
부산대학교 생명자원과학대학 바이오소재과학과, *경북대학교 융합학부 의생명융합공학과, **경북대학교 의과대학 세포·기질연구소,***경북대학교 의과대학 분자의학교실,****원광대학교 치과대학 구강악안면외과학교실
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Tissue adhesives are widely used in various medical fields for tissue bonding and wound closure. Existing glue-type tissue adhesives have disadvantages such as low biocompatibility or a long reaction time to achieve firm tissue adhesion. Herein we developed photocurable tissue adhesives by introducing photocrosslinkable methacrylate (MA) groups into biodegradable hyaluronic acid (HA) that enables strong tissue adhesion and wound sealing. The photocurable tissue adhesive formed a stable hydrogel layer with good tissue adhesion following short UV exposure (<5 s). By controlling the substitution rate of MA and polymer concentration, the mechanical properties and adhesion strength of the tissue adhesive could be easily manipulated. From the incisional wound animal model, the HA-based tissue adhesive used in this study showed better tissue adhesion and faster wound healing efficacy compared to commercial glues. Considering the high biocompatibility and biodegradability of HA, this photocurable adhesive would be useful in wound healing of various soft tissues.
조직접착제는 조직의 결합 및 상처 봉합의 목적으로 다양한 의료 분야에서 사용되고 있다. 기존의 액상 조직접착제는 생체적합성이 낮거나 우수한 접착력을 달성하기 위해 반응 시간이 오래 걸린다는 단점이 있다. 본 연구에서는 생분해성을 가진 히알루론산(hyaluronic acid, HA)에 광가교성 메타크릴레이트(methacrylate, MA) 그룹을 도입하여, 빛에 의해 빠르게 경화되어 상처 부위를 즉각적으로 봉합할 수 있는 광가교형 조직접착제를 개발하였다. 광경화형 조직접착제는 5초 이내의 짧은 UV 조사 후 조직에 높은 접착력을 보이면서 안정적인 하이드로젤 층을 형성하였다. MA의 치환도 및 고분자의 농도를 변화시켜, 접착제의 기계적 물성과 조직접착력도 손쉽게 조절할 수 있었다. 창상 동물모델 실험에서 HA 기반 조직접착제는 기존 상용 접착제에 비해 우수한 조직접착력 및 빠른 상처 회복을 보였다. HA의 높은 생체적합성과 생분해성을 고려할 때, HA 기반 광가교형 조직접착제는 다양한 연조직의 상처 치료에 활용도가 높을 것으로 예상된다.
A photo-crosslinkable tissue adhesive for wound closure was developed by introducing photosensitive methacrylate (MA) groups into hyaluronic acid (HA). The mechanical and adhesive properties of the tissue adhesive were optimized by controlling the substitution rate of MA and polymer concentrations. The HA-based photo-crosslinkable adhesive exhibited firm tissue adhesion and wound sealing under safe curing conditions.
Keywords: photo-crosslinking, hyaluronic acid, wound healing, tissue adhesive.
이 논문은 부산대학교 국립대학육성사업(2020-2021)의 지원을 받아 연구되었음.
저자들은 이해상충이 없음을 선언합니다.
상처부위의 보호 및 지혈 등을 위해 사용되는 조직접착 기술에는 의료용 봉합사와 스테이플을 이용하는 기계적 봉합법,1 시아노아크릴레이트(cyanoacrylate) 계열의 순간접착제와 같이 화학적인 반응에 의해 조직을 접착하는 화학적 의료용 조직접착제 등이 있으며,2 다양한 의료 환경에서 널리 사용되고 있다. 봉합사와 스테이플은 병원에서 장기의 부착이나 외과수술 후 피부 봉합까지 가장 보편적으로 사용되는 방법이지만, 사용에 장시간과 높은 숙련도가 요구되고 적용부위에 따라 추가적인 손상 및 감염의 가능성이 있으며, 시급히 조직을 부착하거나 봉합을 위해서 적용하기에는 어려움이 있다.3-5
의료용 조직접착제는 기존의 기계적 봉합법인 봉합사나 스테이플을 대신하여 혈관이나 장기의 접착 및 연결부터 외과 수술 후 피부 봉합까지 손상된 생체조직의 화학적인 접합을 통해 조직의 구조와 기능을 복구하는 목적으로 널리 사용되고 있다.3,6 사용의 편의성으로 글루(용액) 타입 의료용 접착제의 임상으로서의 적용이 증가하는 추세이나,7 현존하는 조직접착제에는 통제불가능한 경화시간을 비롯하여 다음과 같은 한계점이 존재한다. 시아노아크릴레이트 계열의 화학접착제는 높은 조직접착성을 보여주지만, 젖은 조직에서 성능을 제대로 발휘하지 못할 뿐만 아니라, 분해 시 포름알데히드(formaldehyde)와 같은 독성 물질을 생성하여 염증반응을 유발하는 사례가 보고된 바 있다.5,8,9 혈액의 응고과정을 모방하여 제작된 피브린 글루는 생체 내에서 거부반응이나 조직 독성이 거의 없는 것으로 알려져 있으나,10 접착강도가 약하고 접착에 비교적 장시간이 소요되기 때문에 넓은 면적이나 움직임이 심한 부위에 적용하기에는 한계가 있다.11
기존 의료용 접착제의 단점을 극복하기 위하여 광가교성 생체고분자를 이용한 창상 치료용 하이드로젤에 관한 연구가 진행되고 있다.12-14 생분해성 고분자의 일종인 젤라틴에 광가교성 작용기를 도입한 젤마(GelMA)는 상처에 도포된 접착제를 적정하게 성형한 후, 적시에 경화를 진행할 수 있으나 일반적으로 고농도의 광개시제와 장시간의 광노출이 필요하다.15
따라서, 상처회복과정을 촉진하면서 임상에서 신속하게 적용할 수 있는 이상적인 조직접착제를 개발하기 위해서는 다음과 같은 조건을 충족해야 한다. i) 높은 생체적합성을 가져야 하며, ii) 조직 특성을 고려한 기계적 강도를 가지고, iii) 젖은 조직이나 동적 환경에서도 높은 접착력을 유지할 수 있어야 한다.16
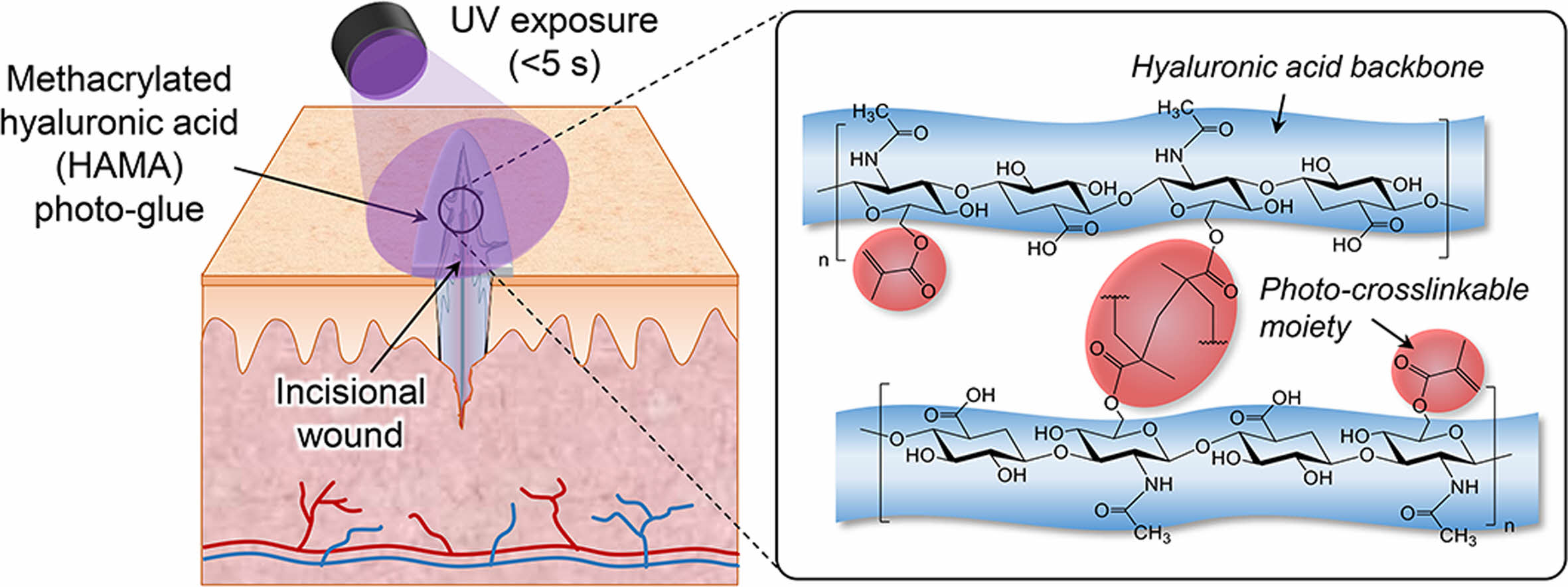
본 연구에서는 신체의 구성성분이며 생분해성을 가진 생체고분자인 히알루론산(hyaluronic acid, HA)에 UV에 의해 10초 내로 가교되면서 조직접착성을 높일 수 있는 광가교성 그룹을 도입하여, 상처부위를 즉각적으로 봉합할 수 있는 광가교형 조직접착제를 개발하였다(Figure 1). 합성한 광가교성 생체고분자의 치환율에 따른 물성의 변화에 대하여 분석하였고, 조직접착제로서의 성능을 확인하고자 접착 실험 및 동물실험을 통한 조직재생 효능을 평가하였다.

|
Figure 1 Schematic illustration of methacrylated hyaluronic acid-based tissue adhesive. |
생체고분자 기반 광가교성 생체고분자의 합성 및 제조.UV에 의한 생체고분자의 광가교가 가능하도록 HA 고분자 사슬에 메타아크릴레이트(methacrylate, MA) 그룹을 도입하였다.17,18 100 kDa의 분자량을 가진 HA(SNvia, Korea)를 탈이온수에 일정량 녹인 후, NaOH를 이용하여 pH를 8-10로 조절하였다. HA 수용액에 methacrylic anhydride(Sigma Aldrich, USA)를 HA 이당류 유닛 대비 1.4 또는 4 당량을 추가하여 HA 사슬 내 -OH 그룹을 MA 그룹으로 치환하고자 하였다. 이때, 반응온도를 5 oC로 조절하여, methacrylic anhydride의 가수분해를 최소화하면서 MA의 치환도를 높일 수 있었다. 합성한 광가교성 HA(HAMA)는 24시간 동안의 투석 과정을 통해 불순물을 제거하였으며, 정제된 HAMA는 동결건조 과정을 거쳐 분말형태로 조제하였다. HAMA는 Deuterium oxide (Sigma Aldrich, USA)에 용해되어 1H NMR 분석기(Agilent 600 MHz NMR, Agilent, USA)를 통한 1H NMR 스펙트럼 분석으로 HA 분자 내 MA의 치환율을 확인하였다. HAMA 용액은 0.1% lithium phenyl-2,4,6-trimethylbenzoylphosphinate (Sigma Aldrich, USA) 수용액에 농도별(5, 10, 15%)로 용해하여 제조하였다.
광가교형 조직접착제의 경화 거동 분석.HAMA의 MA 그룹 DS에 따른 경화 거동 차이를 분석하기 위해 레오미터(MCR 302, Anton Paar, Austria)를 이용한 유변학적 분석을 진행하였다. 변형률 1%, 주파수 1 Hz에서 60초간 안정화 과정을 거친 후, UV 광원(320-500 nm, 230 mW/cm2)을 이용하여 시간 의존적 거동을 확인하였다. 저장 탄성률(G'' )이 손실 탄성률(G' )을 역전하는 교차점을 졸/젤 전이가 시작되는 경화지점으로 판단하였다.19-21
광가교형 조직접착제의 기계적 물성 분석.HAMA의 기계적 물성을 분석하기 위해 인장 강도 시험을 진행하였다. 아령형 몰드에 200 μL의 HAMA 용액을 도포하고 광경화 장비(OmniCure S1500, Excelitas Technologies, USA)를 이용하여 320-500 nm 파장대의 광을 5초간 조사하여(230 mW/cm2) HAMA 하이드로젤을 제조하였다. 제조된 HAMA 하이드로젤 시편의 양 끝단을 물성시험기(AND-210, AND, Korea)의 인장 지그를 이용하여 고정하였다. 시험은 1 mm/min의 인장을 통하여 시편의 파단이 발생할 때까지의 변화를 측정하였다.17
광가교형 조직접착제의 전단 강도 분석.HAMA의 접착력을 분석하기 위해 조직접착제의 인장하중에 의한 강도특성에 대한 표준시험 방법인 ASTM F2255-05를 따라 전단 강도를 측정하였다.22 20 wt%의 돼지 유래 젤라틴 용액(삼미, 한국)으로 코팅 후 건조된 슬라이드 글라스 기판 위에 DS 및 농도에 따른 40 μL의 HAMA 용액을 도포하였다. 기계적 물성 분석에 사용된 광경화 방법과 동일한 조건으로 광경화 장비를 이용하여 광경화한 후, 1 mm/min의 인장을 통하여 전단 접착 강도를 측정하였다.17,22
광가교형 조직접착제의 봉합 접착강도 분석.창상 부위에 적용된 접착제의 밀봉과 접착성능을 확인하고자 상처 봉합 강도를 ASTM F2458-05에 따라 측정하였다. 5×15 mm의 크기로 가공한 돼지 피부 조직을 6 mm의 간격을 둔 채, 슬라이드 글라스에 양 끝단을 부착하였다. 피부 조직의 정중앙을 단면도를 이용하여 절단한 후에, 절단면에 DS 및 농도에 따른 HAMA 용액을 40 μL 도포하였다. 도포된 HAMA 용액은 앞에서 언급한 방법과 동일하게 5초간 광경화한 후 1 mm/min의 인장조건에서 접착 강도를 측정하였다.15,17
광 조사 시간 및 광개시제 농도에 따른 세포 독성 평가. 광 조사 조건 및 광개시제 농도에 따른 안전성을 확인하기 위하여 섬유아세포(fibroblast, NIH-3T3)를 이용한 세포독성 평가를 진행하였다. 섬유아세포는 광(UV) 처리시간(0, 5, 10, 20, 40, 60초)과 사용한 광개시제의 농도(0, 0.01, 0,03, 0.05, 0.07, 0.1, 0.3, 0.5%)에 따라 10% FBS, 1% 항생제가 첨가된 고농도 글루코스 DMEM 배지에서 배양되었다. 세포생존율은 Ez-Cytox 세포생존율 분석 kit(Ez-1000, DoGen)를 이용한 WST assay를 실시하여 평가하였다.
동물모델을 이용한 광가교형 조직접착제의 창상 치유 효능 평가.본연구에 수행된 동물실험은 부산대학교 동물실험윤리위원회(PNU-IACUC)의 동물실험 윤리성과 과학성에 대한 검토를 승인(승인번호: 2020-0065)받아 수행하였다. ICR mouse(암컷, 7주령)는 샘타코(한국)에서 구입하여 멸균 처리된 사료를 자유 급식하도록 하였고, 부산대학교 청정실험동물센터(온도 22±1 oC, 상대습도 50±5%)에서 사육하였다. 마우스의 등부 피부에 수술용 시저를 이용해 절개하여 창상을 유발한 뒤,23-25 창상 부위에 HAMA 용액을 도포하고 광경화하여 하이드로젤을 형성하였다. 창상치유 효능을 비교하기 위해, 아무것도 처리하지 않은 그룹(no treatment), 봉합사를 처리한 그룹(suture), 상업용 글루를 도포한 그룹(commercial glue)과 비교하였다. 1, 3, 7일 차에 마우스 등부의 상처 부위를 촬영하여 크기의 감소를 분석하였고, 실험종료 후 창상이 유발되었던 부위의 피부 조직을 적출하여 조직접착력 평가를 진행하였다. 실험은 적출된 피부조직을 물성시험기에 고정하여 피부조직의 파단이 일어나는 최대 지점을 비교 측정하였다.26,27
통계분석.본연구의 통계분석은 Student’s t-test와 ANOVA를 통하여 검증하였으며, p값이 0.05 미만일 경우, 통계적으로 유의미한 결과로 간주하였다.
생체고분자 기반 광가교성 생체고분자의 합성. 광가교성 HA(HAMA)를 합성하기 위해 HA의 -OH 그룹에 광경화할 수 있는 MA 그룹을 도입하였고(Figure 2(a)), 1H NMR 분석을 통해 HA 사슬에 결합한 MA 그룹의 비율을 분석하고자 하였다. Figure 2(b)의 MA 양성자(3, 4)에서 유래한 5.6 ppm과 6.1 ppm의 피크 적분의 평균값과 HA의 methyl 양성자(1)에서 유래한 1.9 ppm에서의 피크 적분 값의 비율로 HA 분자 내 DS가 계산되었다.17,28 MA 그룹의 DS는 50%(low DS)로 측정되었으며, 반응 과정에서 가수분해 조건을 조절한 추가 실험을 통해 MA 그룹의 DS를 최대 180%(high DS)까지 향상시키는 결과를 얻었다.
광가교형 조직접착제의 경화 시간 분석.MA 그룹의 DS와 고분자의 농도에 따른 경화 거동은 레오미터를 이용한 시간 의존적 경화시험을 통하여 진행되었다. High DS 실험군과 low DS 실험군의 경화지점은 2.3-2.4초와 2.8-3.3초로, DS와 경화지점은 반비례하는 경향을 나타내었다(Figure 3(a)). 또한, HAMA 고분자의 농도가 증가함에 따라서 경화 거동이 빨라지는 거동이 관찰되었으며, 모든 실험군이 실험 경화조건(10초) 이내에 경화가 시작됨을 확인하였다(Figure 3(b)).
광가교형 조직접착제의 기계적 물성 분석.HAMA의 MA 그룹 DS와 고분자 농도에 따른 기계적 물성은 아령형으로 가공된 시편을 인장강도 시험을 통해 확인하였다(Figure 4(a)). MA 그룹의 DS와 고분자의 농도가 증가함에 따라, 인장 탄성계수, 인장 강도, 인성이 비례하여 증가하였다(Figure 4(b)-(f)). 일반적으로 가교도가 높아질수록, 연신율은 감소하는 경향이 나타난다. 따라서, DS와 고분자 농도가 증가하면서 HAMA 하이드로젤 내의 가교도가 높아짐에 따라, 연신율과 반비례 관계를 형성하게 된다. Low DS 5% 시편은 취약한 물성으로 인하여 시험 초기 지점에서 모든 시편이 파단되어 경향성을 따르지 않았으나, 이를 제외한 모든 그룹은 이론적인 경향성을 따라 감소하는 추세를 보였다. 위의 결과를 토대로, high DS 10% HAMA 조직접착제는 기존에 보고된 피부층의 기계적 물성과 유사한 범주(~300 kPa)에16 속해 있는 것으로 판단되며, MA 그룹의 DS와 고분자 농도를 통해 피부 이외의 적용조직에도 특성을 고려하여 물성을 조절할 수 있을 것으로 예상된다.
광가교형 조직접착제의 전단 강도 분석. HAMA 농도에 따른 광가교형 조직접착제의 접착 성능을 평가하기 위하여 전단강도를 분석하였다(Figure 5(a)). Low DS HAMA는 농도가 5%의 경우 13.7±7.1 kPa, 10%의 경우 17.4±5.1 kPa, 15%의 경우 21.87±3.7 kPa로 측정되었다. High DS HAMA의 경우 농도에 따라 각각 47.9±7.6, 56.9±15.3, 70.6±17.9 kPa로 나타났다(Figure 5(b), (c)). DS와 고분자의 농도에 비례하여 전단접착강도가 증가하는 추세를 보였다.
광가교형 조직접착제의 봉합 접착강도 분석. Figure 6(a)와 같이 HAMA 조직접착제의 실제 조직에서 봉합 접착강도를 확인한 결과, 앞선 전단 강도 결과와 유사하게 치환율과 고분자의 농도가 증가할수록 봉합강도가 증가하는 것을 확인하였다. Low DS HAMA는 5%에서 0.5±0.2 kPa, 10%에서 1.4±0.2, 1.5±0.2 kPa로 측정되었고, high DS HAMA는 5%에서 2.0±0.4 kPa, 10%에서 5.4±2.4 kPa, 15%에서 7.4±1.5 kPa로 나타났다(Figure 6(b), (c)). Low DS의 모든 실험군과 high DS 5%에서는 비교적 낮은 증가세를 보였으나, high DS HAMA 10%에서 접착강도가 유의적으로 증가하였다.
UV 조사 시간 및 광개시제 농도에 따른 세포 독성 평가. 피부에 분포하는 섬유아세포(NIH 3T3)에서 UV 조사시간과 광개시제 농도에 따른 세포독성평가를 실시하였다. UV 조사시간에 비례하여, 처리 후 24시간이 지났을 때 세포의 성장에 독성영향을 끼치는 것으로 확인되었다(Figure 7(a)). 또한, 광가교성 생체고분자인 HAMA를 조직접착제로 가교하기 위해 첨가되는 광개시제의 농도가 0.3% 이상의 구간에서 세포생존율이 급격히 감소하여 세포 독성이 발생하는 것으로 확인되었다(Figure 7(b)). 이를 토대로 광가교형 조직접착제 적용 시 UV를 10초 이내로 조사하고, 광개시제의 농도를 0.1% 이하로 설정한다면 잠재적인 세포독성으로부터 벗어날 수 있을 것으로 판단된다.
동물모델을 이용한 광가교성 HA의 창상 치유 효능 평가. 앞선 in vitro 실험결과를 통하여 조직 특성과 유사한 물성을 지니며, 상처부위에 발림성이 우수하며, 접착성능을 유지하는 것으로 판단되는 10% high DS HAMA 용액을 이용하여 실험을 진행하였다. 마우스 등부의 피부에 절개형 창상을 유발한 후 봉합사, 상업용 글루, HAMA 용액을 적용하였다. HAMA 그룹의 경우, Figure 8(a)와 같이 HAMA 용액을 도포한 후 5초간 광경화하였다. 창상유발 당일에서 창상유발 후 7일 경과 시점까지 대조군(no treatment)과 실험군(suture, commercial glue, HAMA)의 창상부분을 촬영하여 육안적으로 창상 치유 효능을 평가하였다(Figure 8(b)). 창상유발 당일에는 no treatment 그룹을 제외한 실험군에서 창상 부위의 접합이 확인되었으나, 시간이 지남에 따라 HAMA 그룹에 비해 commercial glue 그룹에서 실험동물의 움직임에 의한 결손이 관찰되었다. 또한, 7일 후 창상부위에서 HAMA 그룹의 창상 수복 및 치유 효능이 비교적 우수한 것으로 관찰되었다.
창상유발 후 7일 경과 시점에서 조직접착력을 평가하기 위해, 마우스로부터 창상이 유발되었던 부위의 피부를 적출하여 물성시험기 통해 조직접착력 평가하였다(Figure 8(c), (d)). Suture 그룹과 commercial glue 그룹의 경우 각각 130.1±3.3 kPa, 108.6±47.9 kPa의 접착력을 나타냈으며 no treatment 그룹(108.2±27.9 kPa)과 유사한 수치를 나타내었다. 이에 반해 HAMA 그룹에서는 164.5±16.26 kPa로 no treatment 그룹뿐만 아니라 suture 그룹과 비교하였을 때에도 우수한 접착 및 회복 성능을 갖는 것을 확인하였다. 기존 보고된 문헌에 따르면 HA는 세포외기질의 주요 구성성분일 뿐만 아니라, 조직 재생 과정에서도 주요한 역할을 수행하는 것으로 알려져 있다.29-31 따라서, HA 기반 광가교형 조직접착제는 창상 부위에서의 안정적인 봉합 성능을 제공할 수 있으며, 치유되는 동안 상처의 벌어짐과 같은 우려로부터 벗어나도록 도와줄 수 있을 것으로 예상된다.

|
Figure 2 (a) Reaction scheme for the synthesis of HAMA; (b) representative 1 H NMR spectrum of HAMA. Peaks correspond to methacrylate proton (3,4) and methyl proton (1,2). |

|
Figure 3 Rheological analysis of HAMA with different degree of substitution and concentrations: (a) storage modulus (G' ) and loss modulus (G'' ) of time-dependent analysis; (b) gelation point of HAMA. *p<0.05, **p<0.01, ***p<0.001. |

|
Figure 4 Tensile test of HAMA hydrogel: (a) Photographs of specimen preparation and tensile test; (b) representative tensile strain-stress curves; (c) Young’s modulus; (d) tensile strength; (e) elongation; (f) toughness. *p<0.05, **p<0.01, ***p<0.001. |

|
Figure 5 Shear strength determined using lap shear test: (a) scheme of lap shear test; (b) representative force-displacement curve; (c) Maximum shear strength depending on degree of substitution and concentrations. *p<0.05, **p<0.01, ***p<0.001. |

|
Figure 6 Wound closure strength determined using wound closure test: (a) scheme of wound closure test; (b) representative force-displacement curve; (c) maximum wound closure strength depending on degree of substitution and concentrations. *p<0.05, **p<0.01, ***p<0.001. |

|
Figure 7 Cell viability test of fibroblast under: (a) UV exposure; (b) photointiator treatment. |

|
Figure 8 (a) Photographs showing the experimental procedures for wound closure test of ICR mouse; (b) photographs for visual inspection of wound healing at day 1, day 3 and day 7; (c) representative force-displacement profiles of wound closure adhesion strength test; (d) maximum adhesion strengths. |
생분해성을 가진 생체고분자에 빛(UV)에 의해 가교되면서 조직접착성을 높일 수 있는 그룹을 도입하여, 상처부위를 즉각적으로 봉합할 수 있는 광가교형 조직접착제를 개발하고자 하였다. 본 연구에서는 생체고분자인 HA에 광가교할 수 있는 메타크릴레이트 그룹을 도입하여 5초 내에 빠르게 가교 가능한 광가교형 조직접착제를 제작하였다. 광가교형 조직접착제의 전단강도 및 조직접착력의 경우 광가교성 HA(HAMA)의 농도가 증가함에 따라 강도가 높아지는 경향을 보였다. 또한, 광가교형 조직접착제를 경화시키기 위한 UV 조사 시간 및 광 개시제의 농도에 따른 세포 독성 평가를 실시한 결과 0.1% 이하의 광개시제 농도와 UV를 10초 동안 조사하여도 세포 독성이 없는 것으로 확인되었다. 창상 동물 모델에서 광가교형 조직접착제의 상처 치유 효능을 평가하였을 때, 기존에 상업적으로 판매하는 글루와 비교해도 상처 수복이 잘 이루어지는 것을 확인할 수 있었다. 본 연구에서 제안하는 HA 기반 광가교형 조직접착제는 피부 조직뿐만 아니라 눈의 각막 등과 같이 습윤한 연조직용 조직접착제로서도 활용 가치가 높을 것으로 판단된다.
- 1. Cimador, M.; Castagnetti, M.; Milazzo, M.; Sergio, M.; De Grazia, E. Suture Materials: Do They Affect Fistula and Stricture Rates in Flap Urethroplasties? Urol. Int. 2004, 73, 320-324.
-

- 2. Vote, B. J.; Elder, M. J. Cyanoacrylate Glue for Corneal Perforations: A Description of a Surgical Technique and a Review of the Literature. Clin. Exp. Ophthalmol. 2000, 28, 437-442.
-

- 3. Al-Mubarak, L.; Al-Haddab, M. Cutaneous Wound Closure Materials: An Overview and Update. J. Cutan. Aesthet. Surg. 2013, 6, 178-188.
-

- 4. Artzi, N. Sticking with the Pattern for a Safer Glue. Sci. Transl. Med. 2013, 5, 205ec161.
-

- 5. Edmiston, C. E., Jr.; Krepel, C. J.; Marks, R. M.; Rossi, P. J.; Sanger, J.; Goldblatt, M.; Graham, M. B.; Rothenburger, S.; Collier, J.; Seabrook, G. R. Microbiology of Explanted Suture Segments from Infected and Noninfected Surgical Patients. J. Clin. Microbiol. 2013, 51, 417-421.
-

- 6. Ge, L.; Chen, S. Recent Advances in Tissue Adhesives for Clinical Medicine. Polymers (Basel) 2020, 12, 939.
-

- 7. Bouten, P. J. M.; Zonjee, M.; Bender, J.; Yauw, S. T. K.; van Goor, H.; van Hest, J. C. M.; Hoogenboom, R. The Chemistry of Tissue Adhesive Materials. Prog. Polym. Sci. 2014, 39, 1375-1405.
-

- 8. Edmonson, M. B. Foreign Body Reactions to Dermabond. Am. J. Emerg. Med. 2001, 19, 240-241.
-

- 9. Mehdizadeh, M.; Yang, J. Design Strategies and Applications of Tissue Bioadhesives. Macromol. Biosci. 2013, 13, 271-288.
-

- 10. Anema, J. G.; Morey, A. F.; Harris, R.; MacPhee, M.; Cornum, R. L. Potential Uses of Absorbable Fibrin Adhesive Bandage for Genitourinary Trauma. World J. Surg. 2001, 25, 1573-1577.
-

- 11. Bitton, R.; Josef, E.; Shimshelashvili, I.; Shapira, K.; Seliktar, D.; Bianco-Peled, H. Phloroglucinol-based Biomimetic Adhesives for Medical Applications. Acta Biomater. 2009, 5, 1582-1587.
-

- 12. Lang, N.; Pereira, M. J.; Lee, Y.; Friehs, I.; Vasilyev, N. V.; Feins, E. N.; Ablasser, K.; O’Cearbhaill, E. D.; Xu, C.; Fabozzo, A.; Padera, R.; Wasserman, S.; Freudenthal, F.; Ferreira, L. S.; Langer, R.; Karp, J. M.; Nido, P. J. del. A Blood-Resistant Surgical Glue for Minimally Invasive Repair of Vessels and Heart Defects. Sci. Transl. Med. 2014, 6, 218ra6.
-

- 13. Wang, T.; Nie, J.; Yang, D. Dextran and Gelatin Based Photo- crosslinkable Tissue Adhesive. Carbohydr. Polym. 2012, 90, 1428-1436.
-

- 14. Soucy, J. R.; Shirzaei, S. E.; Portillo, L. R.; Diaz, D.; Dias, F.; Weiss, A. S.; Koppes, A. N.; Koppes, R. A.; Annabi, N. Photo- crosslinkable Gelatin/Tropoelastin Hydrogel Adhesives for Peripheral Nerve Repair. Tissue Eng. Part A 2018, 24, 1393-1405.
-

- 15. Shirzaei, S. E.; Kheirkhah, A.; Rana, D.; Sun, Z.; Foulsham, W.; Sheikhi, A.; Khademhosseini, A.; Dana, R.; Annabi, N. Sutureless Repair of Corneal Injuries Using Naturally Derived Bioadhesive Hydrogels. Sci. Adv. 2019, 5, eaav1281.
-

- 16. Taboada, G. M.; Yang, K.; Pereira, M. J. N.; Liu, S. S.; Hu, Y.; Karp, J. M.; Artzi, N.; Lee, Y. Overcoming the Translational Barriers of Tissue Adhesives. Nat. Rev. Mater. 2020, 5, 310-329.
-

- 17. Chandrasekharan, A.; Seong, K.-Y.; Yim, S.-G.; Kim, S.; Seo, S.; Yoon, J.; Yang, S. Y. In situ Photocrosslinkable Hyaluronic Acid-based Surgical Glue with Tunable Mechanical Properties and High Adhesive Strength. J. Polym. Sci. A Polym. Chem. 2019, 57, 522-530.
-

- 18. Kim, S.; Yim, S.-G.; Chandrasekharan, A.; Seong, K.-Y.; Lee, T. W.; Kim, B.; Kim, K.; Choi, S.; Yang, S. Y. On-site Fabrication of Injectable 131I-labeled Microgels for Local Radiotherapy. J. Control Release. 2020, 322, 337-345.
-

- 19. Zhou, M.; Lee, B. H.; Tan, Y. J.; Tan, L. P. Microbial Transglutaminase Induced Controlled Crosslinking of Gelatin Methacryloyl to Tailor Rheological Properties for 3D Printing. Biofabrication. 2019, 11, 025011.
-

- 20. Hong, Y.; Zhou, F.; Hua, Y.; Zhang, X.; Ni, C.; Pan, D.; Zhang, Y.; Jiang, D.; Yang, L.; Lin, Q.; Zou, Y.; Yu, D.; Arnot, D.; Zou, X.; Zhu, L.; Zhang, S.; Ouyang, H. A Strongly Adhesive Hemostatic Hydrogel for the Repair of Arterial and Heart Bleeds. Nat. Commun. 2019, 10, 2060.
-

- 21. Higham, A. K.; Bonino, C. A.; Raghavan, S. R.; Khan, S. A. Photo-activated Ionic Gelation of Alginate Hydrogel: Real-time Rheological Monitoring of the Two-step Crosslinking Mechanism. Soft Matter. 2014, 10, 4990-5002.
-

- 22. Annabi, N.; Zhang, Y.-N.; Assmann, A.; Sani, E. S.; Cheng, G.; Lassaletta, A. D.; Vegh, A.; Dehghani, B.; Ruiz-Esparza, G. U.; Wang, X.; Gangadharan, S.; Weiss, A. S.; Khademhosseini, A. Engineering a Highly Elastic Human Protein-based Sealant for Surgical Applications. Sci. Transl. Med. 2017, 9, eaai7466.
-

- 23. Peng, B.; Lai, X.; Chen, L.; Lin, X.; Sun, C.; Liu, L.; Qi, S.; Chen, Y.; Leong, K. W. Scarless Wound Closure by a Mussel-Inspired Poly(amidoamine) Tissue Adhesive with Tunable Degradability. ACS Omega. 2017, 2, 6053-6062.
-

- 24. Moon, Y. J.; Yoon, S.-J.; Koo, J.-H.; Yoon, Y.; Byun, H. J.; Kim, H. S.; Khang, G.; Chun, H. J.; Yang, D. H. β-Cyclodextrin/Triclosan Complex-Grafted Methacrylated Glycol Chitosan Hydorgel by Photocrosslinking via Visible Light Irradiation for a Tissue Bio-Adhesive. Int. J. Mol. Sci. 2021, 22, 700.
-

- 25. Guo, Y.; Wang, Y.; Zhao, X.; Li, X.; Wang, Q.; Zhong, W.; Mequanint, K.; Zhan, R.; Xing, M.; Luo, G. Snake Extract-laden Hemostatic Bioadhesive Gel Cross-linked by Visible Light. Sci. Adv. 2021, 7, eabf9635.
-

- 26. Bellare, A.; Epperly, M. W.; Greenberger, J. S.; Fisher, R.; Glowacki, J. Development of Tensile Strength Methodology for Murine Skin Wound Healing. MethodsX 2018, 5, 337-344.
-

- 27. Selvaraj, T. K. R.; Thiruselvi, T.; Sailakshmi, G.; Shanmugam, G.; Gnanamani, A. Rejoining of Cut Wounds by Engineered Gelatin-keratin Glue. Biochim. Biophys. Acta. 2013, 1830, 4898.
-

- 28. Snyder, T.; Madhavan, K.; Intrator, I.; Dregalla, R.; Park, D. A Fibrin/Hyaluronic Acid Hydrogel for the Delivery of Mesenchymal Stem Cells and Potential for Articular Cartilage. J. Biol. Eng. 2014, 8, 10.
-

- 29. Zhu. Z.; Wang, Y.-M.; Yang, J.; Luo, X.-S. Hyaluronic Acid: A Versatile Biomaterial in Tissue Engineering. Plast Aesthet Res. 2017, 4, 219-227.
-

- 30. Collins, M. N.; Birkinshaw, C. Hyaluronic Acid Based Scaffolds for Tissue Engineering-A Review. Carbohydr. Polym. 2013, 92, 1262-1279.
-

- 31. Rao, N. V. 22-Hyaluronic Acid-Based Hydrogels for Tissue Engineering. In Biomaterials for Organ and Tissue Regeneration; Vrana, N. E.; Knopf-Marques, H.; Barthes, J.; Woodhead Publishing: Cambridge, 2020; pp 551-565.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(2): 216-222
Published online Mar 25, 2022
- 10.7317/pk.2022.46.2.216
- Received on Nov 11, 2021
- Revised on Dec 30, 2021
- Accepted on Jan 5, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jun Lee**** , and Seung Yun Yang
-
Department of Biomaterials Science (BK21 Four Program), College of Natural Resources & Life Science, Pusan National University, Miryang 50463, Korea
****Department of Oral and Maxillofacial Surgery, School of Dentistry, College of Dentistry,
Wonkwang University, Iksan 54538, Korea - E-mail: omslee@wku.ac.kr, syang@pusan.ac.kr
- ORCID:
0000-0001-6398-8122, 0000-0002-1233-8960









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.