- Fabrication of Bilayered Porous Membranes for Controlling Tissue Regeneration
*Department of Biomedical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea
**School of Advanced Materials and Chemical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea- 조직재생 속도 조절을 위한 이중층 구조 다공성 멤브레인 제조
*대구가톨릭대학교 의공학과, **대구가톨릭대학교 신소재화학공학부
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
The use of bilayered membranes has attracted great attention in guided bone regeneration applications because they closely simulate the major features of the natural extracellular matrix (ECM) of bone tissue. In this study, bilayered porous membranes were prepared by using freeze-drying and electrospinning for significantly improved prevention of soft tissue infiltration and regeneration of bone tissue through controlling the cell growth of soft and bone tissues. The resulting porous membranes exhibited three-dimensionally interconnected pore structures. The results of cytocompatibility tests assessed with soft and bone tissue cells revealed that collagen nanofiber layer promoted more rapid proliferation and differentiation of cells compared with GEAL51 membrane layer. These results suggest that bilayered porous membranes can stimulate cell growth to exhibit similar regeneration of soft and bone tissues.
이중층 구조를 가진 멤브레인은 자연 상태 골조직의 세포외기질(extracellular matrix, ECM)과 유사한 구조를 가지고 있기 때문에 골유도재생술에서 많은 관심을 받고 있다. 본 연구에서는 동결건조법과 전기방사법을 이용하여 연조직과 골조직의 재생 속도를 조절함에 의해서 연조직 차단 효과와 골조직 재생능을 극대화할 수 있는 이중층 구조를 가진 다공성 멤브레인을 제조하였다. 제조된 이중층 구조 다공성 멤브레인은 삼차원 네트워크 구조의 상호연결된 기공구조를 보였다. 다공성 멤브레인의 연조직 및 골조직 세포의 성장에 미치는 영향을 조사한 결과 콜라겐 나노섬유층이 GEAL51 멤브레인층보다 세포 성장 및 분화를 더욱 촉진시켰다. 또한 이중층 구조 다공성 멤브레인을 사용할 경우 연조직과 골조직의 재생 속도가 비슷하게 조절될 수 있는 가능성이 확인되었다.
Bilayered porous membranes were prepared by using freeze-drying and electrospinning for significantly improved prevention of soft tissue infiltration and regeneration of bone tissue through controlling the cell growth of soft and bone tissues. The resulting porous membranes exhibit three-dimensionally interconnected pore structures and can stimulate cell growth to exhibit similar regeneration of soft and bone tissues.
Keywords: bilayer, porous membrane, tissue regeneration, freeze drying, electrospinning.
이 결과물은 2020년도 대구가톨릭대학교 학술연구비 지원에 의한 것임.
저자들은 이해상충이 없음을 선언합니다.
종양 절제, 외상, 감염 및 선천성 기형 등으로 유발된 골 결손부의 재건을 위해서는 골전도성(osteoconductive) 지지체, 골형성 전구체 세포 및 골유도성(osteoinductive) 성장인자가 필요하며, 또한 골결손부에서 선천성 무섬유소원혈증(congenital afibrinogenemia)에 의한 출혈장애도 정밀하게 제어될 수 있어야 한다.1,2 골결손부위의 복원을 위해서 자가골이식이 가장 이상적인 방법으로 알려져 있다. 그러나 공여할 수 있는 자가골의 양이 적고 또한 공여부위에 새로운 골결손을 유발하므로 큰 부위의 골결손을 재생시키기 위해서는 자가골이식을 대
체할 수 있는 새로운 골이식재 또는 지지체의 개발이 필요하다.3,4 특히 3차원구조의 골재생용 지지체의 경우 우수한 생체적합성과 골전도성을 보임으로 인해서 최근 자가골이식을 대체할 수 있는 재료로서 많은 관심을 받고 있다.5,6 이들 지지체는 세포 부착과 3차원적인 조직 형성 유도에 도움을 줄 수 있는 세포외기질(extracellular matrix, ECM)과 유사한 기능을 하도록 만들어져야 하고, 또한 자연 상태 골조직의 ECM과 구조 및 화학적으로 유사한 특성을 보여야 한다.
지지체를 이용한 골유도재생술은 골결손으로 인해 손상된 조직의 기능과 구조 재건에 효과적인 방법으로 알려져 있다.7 골유도재생술은 지지체를 골결손부위와 결합조직 사이에 삽입하여 재생 속도가 빠른 연조직이 상대적으로 재생 속도가 느린 골결손부위로 침투하는 것을 차단시킴과 동시에 새로운 골조직의 재생을 촉진시키는 방법이다.8 따라서 골유도재생술에 사용되는 지지체는 적절한 기계적 강도와 생체적합성뿐만 아니라 영양분, 산소 및 대사산물의 이동이 가능하도록 다공성 구조를 가져야 한다.9 특히 이상적인 지지체는 골결손부위에 잘 고정되어서 지지체가 움직이지 않아야 하며, 이로 인해서 골결손부위의 골조직이 완전히 재생될 때까지 독립적인 미세환경인 골형성 공간을 제공하고 연조직의 침투를 효과적으로 차단하여야 한다.10
현재 임상에서는 단일층으로 이루어진 멤브레인 형태의 다양한 지지체들이 사용되고 있으나 모든 요구조건을 만족하는 지지체는 없으며, 특히 단일층 구조의 멤브레인 형태는 골재생을 위한 미세환경 제공 및 연조직 침투 차단 효과가 충분하지 않은 문제점을 보이고 있다. 따라서 이러한 문제점을 해결하기 위해서 최근에는 우수한 골재생능과 연조직 차단능을 보이는 이중층 구조의 멤브레인 지지체 개발이 많은 관심을 받고 있다.10-12 그러나 이들 이중층 구조의 멤브레인 지지체 개발에서도 지지체의 일반적인 기능인 연조직 침투 차단 및 골조직 재생 효과에 대해서는 연구가 진행되었지만 연조직과 골조직의 재생 속도 조절이 골재생능에 미치는 영향에 대한 연구는 전무한 상태이다.
골조직 재생용 다공성 멤브레인 지지체를 제조하기 위해 동결건조법, 전기방사법 및 용매건조법(solvent casting method) 등과 같은 다양한 방법들이 시도되고 있다.9-12 이들 다공성 구조의 멤브레인 지지체는 밀도가 높은 필름형태의 멤브레인에 비해서 개선된 영양분 또는 산소 투과성을 보인다. 다양한 다공성 멤브레인 지지체 제조법 중에서 전기방사법은 나노크기의 고분자 필라멘트로 이루어진 다공성 멤브레인을 효율적으로 만들 수 있는 섬유 제조방식이다. 이렇게 제조된 멤브레인은 ECM의 구조와 유사한 3차원적으로 연결된 기공구조를 보이며, 세포의 부착, 성장 및 분화에 많은 영향을 준다.13 그러나 느슨한 섬유 구조는 세포의 성장 및 골형성은 촉진시키지만 연조직의 차단에는 효과적이지 않다. 또한 낮은 기계적 강도는 독립적인 미세환경인 골형성 공간을 장시간 유지하는 것도 불가능하게 한다. 따라서 전기방사법과 동결건조법을 조합할 경우 전기방사법에 의해서 제조된 다공성 멤브레인의 단점을 보완하여 우수한 골조직 재생용 다공성 멤브레인 지지체를 제조하는 실용적인 방법이 될 수 있다.
골유도재생술에 사용되는 지지체는 기본적으로 효과적인 연조직 차단 및 골조직 재생 촉진 능력 요구된다. 따라서 본 연구에서는 연조직과 골조직의 재생 속도를 유사하게 조절함에 의해서 연조직 차단 효과와 골조직 재생능을 극대화할 수 있는 이중층 구조의 다공성 멤브레인 지지체를 제조하였다. 이들 지지체의 생체적합성을 높이기 위해서 천연고분자인 알지네이트, 젤라틴 및 콜라겐을 이용하였고, 전기방사법과 동결건조법을 이용하여 멤브레인 지지체의 고분자 조성과 미세구조를 조절하였다. 제조된 이중층 구조의 다공성 멤브레인 지지체의 표면 형태 및 특성 변화에 대해서 조사하였고, 고분자 조성 및 미세구조가 세포 성장 및 분화에 미치는 영향을 평가하였다.
시약 및 재료. 냉수성어류(cold water fish)의 어피(fish skin)에서 추출한 젤라틴, 알지네이트(sodium alginate), poly(ethylene glycol)-block-poly(propylene glycol)-block-poly(ethylene glycol) (PEG-PPG-PEG triblock copolymer(Pluronic F-68, Mn=8400), calcium chloride(CaCl2), alizarin red s(ARS), cetylpyridinium chloride, 글루탈알데히드, 글리신(glycine), dimethyl sulfoxide (DMSO), 1,1,1,3,3,3-hexafluoro-2-propanol(HFIP)과 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazoliumbromide(MTT)는 Sigma-Aldrich Co.(USA) 제품을 구입하여 사용하였다. 돈피(porcine skin)에서 추출한 아텔로콜라겐(atelocollagen, type 1)은 현대바이오랜드(한국)에서 구입하였다. Minimum essential medium alpha(MEM-α), Dulbecco’s modified Eagle’s medium (DMEM), fetal bovine serum(FBS), penicillin-streptomycin과 Dulbecco’s phosphate buffered saline(DPBS, pH 7.4)은 Gibco BRL(USA)에서 구입하였다. Mouse calvaria preosteo- blast cell line(MC3T3-E1)과 human skin fibroblast(CCD-986Sk)는 American Type Culture Collection(ATCC, USA)에서 구입하였고, QuantiChromTM alkaline phosphatase(ALP) assay kit(DALP-250)은 BioAssay Systems(USA)에서 구입하여 사용하였다. 그 외의 사용된 시약과 용매는 일반 회사에서 구입하였으며, 추가적인 정제과정 없이 사용하였다.
이중충 구조 다공성 멤브레인 제조. 골조직 재생용 이중층 구조 다공성 멤브레인 지지체를 제조하기 위해서 먼저 젤라틴과 알지네이트 혼합 용액을 이용하여 동결건조법으로 다공성 멤브레인층을 만들었다. 먼저 젤라틴과 알지네이트를 증류수에 섞어서 40 oC에서 24시간 동안 교반하여 천연고분자의 최종농도가 10 wt%인 혼합용액을 제조하였다. 이 때 젤라틴/알지네이트를 1:3, 1:1, 3:1 및 5:1로 혼합하였고, 멤브레인에 다공성을 부여하기 위해서 수용성고분자인 Pluronic F-68을 천연고분자 무게 대비 10 wt%를 혼합용액에 추가하였다. 이들 고분자가 완전히 용해된 후에 균질기를 이용하여 10분동안 균질화반응을 진행하였고, 이 고분자 용액을 유리 재질의 페트리 디쉬에 붓고 0.1 M의 CaCl2 용액을 이용하여 6시간 가교반응을 진행하였다. 반응 완료 후에 초음파 세척과 동결건조를 통하여 젤라틴/알지네이트 멤브레인층을 제조하였다.
계속해서 이중층 구조의 멤브레인 지지체를 제조하기 위해서 전기방사법에 사용한 전기방사장치는 0-40 kV의 전압공급이 가능한 고전압 공급장치(high voltage DC power supply unit, 청파 EMT, 한국), 평판형태(200×200 mm, stainless steel)의 집전판(collector), 고분자용액을 일정하게 토출해 줄 수 있는 주사기펌프(syringe pump, KDS100, USA), 주사기(gastight and needle lock type 10 mL, Hamilton, USA), 금속주사기바늘(ID=0.41 mm) 등으로 구성하였다. 콜라겐 나노섬유층의 제조를 위해서 먼저 아텔로콜라겐을 HFIP에 완전히 녹여서 7 wt%의 방사용액을 제조하였다. 집전판에 먼저 제조한 젤라틴/알지네이트 멤브레인을 붙이고 여기에 콜라겐 용액을 방사하여 최종 이중층 구조 다공성 멤브레인 지지체를 제조하였다. 콜라겐 나노섬유 제조조건은 방사거리 10 cm, 인가전압 18 kV, 유체속도 1 mL/h로 고정시키고, 실온에서 상대습도 60% 이하의 조건에서 행하였다. 방사 완료 후에 집전판에 모여 있는 이중층 구조 다공성 멤브레인 지지체를 수거하여 콜라겐 나노섬유층의 약한 기계적 강도 및 수용성을 개선하기 위해서 글루탈알데히드 증기를 이용하여 10분 동안 가교반응을 진행하였다. 반응 후 0.6 M의 글리신 용액과 증류수를 이용하여 반복적으로 세척하여 잔존하는 미반응 글루탈알데히드를 완전히 제거하고 동결건조를 통해서 최종 멤브레인 지지체를 제조하였다.
이중충 구조 다공성 멤브레인 특성 분석.이중층 구조 다공성 멤브레인 지지체의 표면 특성은 field-emission scanning electron microscope(FE-SEM, S-4300, Hitachi, Japan)과 이미지 분석 프로그램(Image-Pro Plus, Media Cybernetics Inc., USA)을 이용하였다. 먼저 FE-SEM을 통해 얻어진 다공성 멤브레인 지지체의 사진 이미지를 이미지 분석 프로그램을 이용하여 평균직경, 표준편차 등을 얻어내었다. FE-SEM을 이용하여 다공성 멤브레인 지지체의 표면을 관찰하기 전에 백금(Pt)을 이용하여 다공성 멤브레인 지지체의 표면을 60초 동안 코팅하였고, 관찰 시에 가속전압을 15.0 kV로 고정하여 관찰하였다. FE-SEM 분석에 사용한 동일한 샘플을 이용하여 다공성 멤브레인 지지체의 표면 원소분석을 energy disperse X-ray spectroscopy(EDX)를 이용하여 진행하였다. 또한 다공성 멤브레인 지지체의 표면 화학구조는 attenuated total reflectance Fourier transform infrared(ATR-FTIR, ALPHA, Bruker Optics, USA)와 X-ray photoelectron spectroscopy(XPS, Quantera SXM, ULVAC-PHI Inc., Japan)를 이용하여 분석하였다. ATR-FTIR은 분광 해상도(spectral resolution)를 4 cm-1로 고정하고 파수(wavenumber)를 400-4000 cm-1 범위에서 조사하였다. XPS에 사용된 X-ray 에너지는 monochromated Al Kα radiation(1486 eV)이고, survey scan은 샘플 대비 45°의 각도로 기록되었다. 다공성 멤브레인 지지체의 비표면적(specific surface area) 분석은 specific surface area analyzer (ASAP 2020, Micromeritics, USA)를 이용하였고, 기공도(porosity)는 다공성 멤브레인 지지체의 전체 부피 대비 기공의 부피 비율로 계산되며 porosimeter(Autopore IV 9520, Micromeritics, USA)를 이용하여 측정하였다. 이중층 구조 다공성 멤브레인 지지체의 기계적 특성은 10 kN 용량의 load cell이 장착되어 있는 인장시험기(AGS-X, Shimadzu, Japan)를 이용하여 측정하였다. 50×10 mm2 크기의 시료를 5회 반복 측정하여 평균값을 사용하였으며 인장 속도는 5 mm/min으로 고정하여 측정하였다.
세포 성장속도 측정. 이중층 구조 다공성 멤브레인 지지체에서의 연조직과 골조직 세포의 성장속도를 알아보기 위해서 조골세포인 MC3T3-E1 세포와 섬유아세포인 CCD-986Sk를 사용하였다. 조골세포 배양에는 10% FBS와 0.5% penicillin-streptomycin을 함유하고 있는 MEM-α를 사용하였고, 섬유아세포의 배양에는 10% FBS와 0.5% penicillin-streptomycin을 함유하고 있는 DMEM을 사용하여 다공성 멤브레인 지지체에서의 세포 성장속도를 MTT assay를 이용하여 분석하였다. 세포배양 전에 다공성 멤브레인 지지체를 자외선을 이용하여 3시간 동안 멸균시키고, 계속해서 DPBS와 DMEM을 이용하여 각 3회씩 세척하였다. 그 후 세포배양용 24-well plate에 다공성 멤브레인 지지체를 넣어 주고, 여기에 MC3T3-E1 또는 CCD-986Sk 세포를 5×104 cells/well로 파종하여 37 oC에서 7일 동안 배양시켰다. 세포 성장속도를 평가하기 위해서 MTT 용액을 각각의 다공성 멤브레인 지지체 상에서 배양된 세포에 넣어 주고 4시간 추가 배양하였다. 상층액을 제거하고 침전물을 DMSO로 용해시켜서 마이크로플레이트 리더기(OPSYS-MR, Dynex Technology Inc., USA)를 이용하여 570 nm에서의 흡광도를 측정하여 평가하였다.
조골세포의 세포 분화능 및 광물화 반응 평가. 이중층 구조 다공성 멤브레인 지지체 상에서 조골세포의 분화능을 알아보기 위해서 초기 조골세포 분화 표지로서 alkaline phosphatase(ALP) 활성화도를 ALP assay kit를 이용하여 측정하였다. MC3T3-E1 세포(5×104 cells/well)를 14일간 배양한 후에 세포층만 회수하여 0.2% Triton X-100을 이용하여 녹이고, 이 용액을 4 oC 및 5000 rpm의 조건으로 10분간 원심분리하여 상층액 만을 분리하였다. 분리된 샘플의 상층액에 존재하는 ALP와 기질인 p-nitrophenyl phosphate를 반응시킬 경우 ALP에 의해서 p-nitrophenyl phosphate가 p-nitrophenol로 변환된다. 이 때 생성되는 p-nitrophenol의 농도를 405 nm에서 측정하여 ALP 활성화도를 평가하였다. 또한 이중층 구조 다공성 멤브레인 지지체 상에서의 MC3T3-E1 세포 성장 후의 광물화 반응 정도를 ARS 염색법을 이용하여 평가하였다. MC3T3-E1 세포(5×104 cells/well)를 20일간 배양한 후에 배지를 제거하고 DPBS를 이용하여 3회 세척하였다. 그 후 4% paraformaldehyde 용액으로 15분간 고정화 작업을 행하고 ARS 용액(40 mM, pH 4.2) 1 mL를 각 well에 넣고 항온진탕배양기에서 20분간 반응시켰다. 반응 종료 후에 미반응 ARS 용액을 세척하고 10 w/v% cetylpyridinium chloride 용액으로 1시간 동안 반응시킨 후에 이들 용액의 흡광도 변화를 540 nm에서 측정하여 광물화 반응 정도를 평가하였다.
통계처리. 모든 실험 결과는 평균±표준오차로 나타내었고, 2개의 서로 다른 샘플의 통계적 비교는 SigmaPlot 13.0(Systat Software Inc., USA)을 이용하여 one-way analysis of variance (Turkey’s test) 방법으로 분석되었다. 대조군에 대한 샘플의 유의한 차이는 *p<0.05의 수준에서 분석하였다.
젤라틴/알지네이트 멤브레인층 형상 관찰. 이중층 구조의 멤브레인 지지체가 우수한 골재생능과 연조직 차단능을 보이는 것으로 보고되고 있고, 특히 전기방사법으로 제조된 나노섬유는 구조적으로 결합조직의 ECM과 유사하기 때문에 골조직뿐만 아니라 연조직의 재생도 현저히 촉진시키는 것으로 보고되고 있다.9-12,14 따라서 본 연구에서는 이중층 구조의 다공성 멤브레인을 제조하기 위해서 동결건조법을 이용하여 젤라틴/알지네이트 멤브레인층을 먼저 만들었다. 이때 젤라틴/알지네이트 멤브레인층을 만들기 위해서 사용된 젤라틴/알지네이트의 비율은 1:3(GEAL13), 1:1(GEAL11), 3:1(GEAL31) 및 5:1(GEAL51)이다. 동결건조법으로 제조한 젤라틴/알지네이트 멤브레인층의 표면 형상을 SEM을 이용하여 관찰한 결과 3차원적으로 연결된 기공구조를 가지고 있었고, 알지네이트의 사용량이 줄어들수록 기공의 크기가 작아지고 더욱 균일한 구조를 보였다(Figure 1). 이는 알지네이트의 사용량이 많을수록 2가 금속이온인 칼슘이온(Ca2+)과의 가교반응으로 만들어지는 불용성의 알긴산 칼슘이 기공이 없는 필름 형상을 이루기 때문이라고 판단되어진다.15
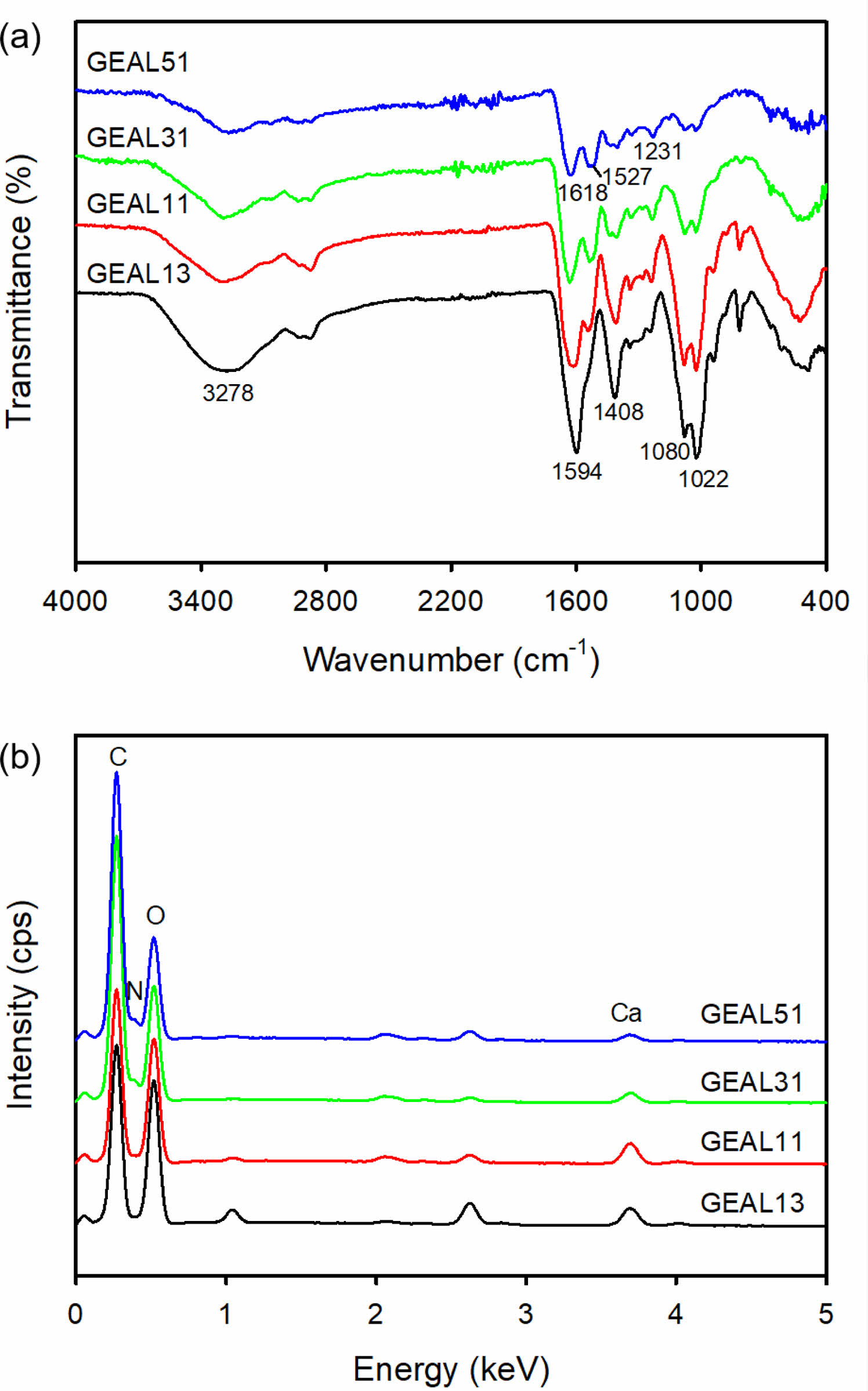
젤라틴/알지네이트 멤브레인층의 물리화학적 특성 분석. 젤라틴/알지네이트 다공성 멤브레인층의 천연고분자 조성변화에 따른 표면 특성 변화를 ATR-FTIR을 이용하여 400-4000 cm-1 범위에서 분석하였다. Figure 2(a)에서 볼 수 있는 것처럼 알지네이트의 함량이 높은 GEAL13에서는 알지네이트의 -OH 그룹과 젤라틴의 -NH 그룹의 stretching vibration에 기인하는 특성피크가 3278 cm-1 부근에서 관찰되었다.16 또한 1594와 1408 cm-1 부근에서 알지네이트의 -COO 그룹의 asymmetric과 symmetric stretching에 기인하는 피크가 관찰되었고, 1022 cm-1 부근에서는 알지네이트 다당 구조의 C-O-C stretching에 기인하는 흡수피크가 관찰되었다. 그러나 다공성 멤브레인층에 젤라틴 함량이 높아질수록 알지네이트에 기인하는 특성피크는 강도가 약해지고, 젤라틴에 기인하는 피크가 강하게 나타났다. 젤라틴의 함량이 가장 높은 GEAL51에서는 1618, 1527과 1231 cm-1에서 젤라틴의 amide 결합에 의한 amide I, amide II 및 amide III 피크가 관찰되었으며, 이들 특성피크는 C=O 결합의 stretching vibration, C-N 결합의 stretching 및 N-H 결합의 bending에 기인한다.17
젤라틴/알지네이트 다공성 멤브레인층의 천연고분자 사용량에 따른 표면의 원소조성 변화를 EDX를 이용하여 분석하였다. 그 결과 젤라틴의 사용량이 증가하고 알지네이트의 사용량이 감소할수록 칼슘(Ca)에 기인하는 피크는 강도가 약해지고 질소(N)에 기인하는 피크가 조금씩 증가하는 것이 관찰되었다(Figure 2(b)).
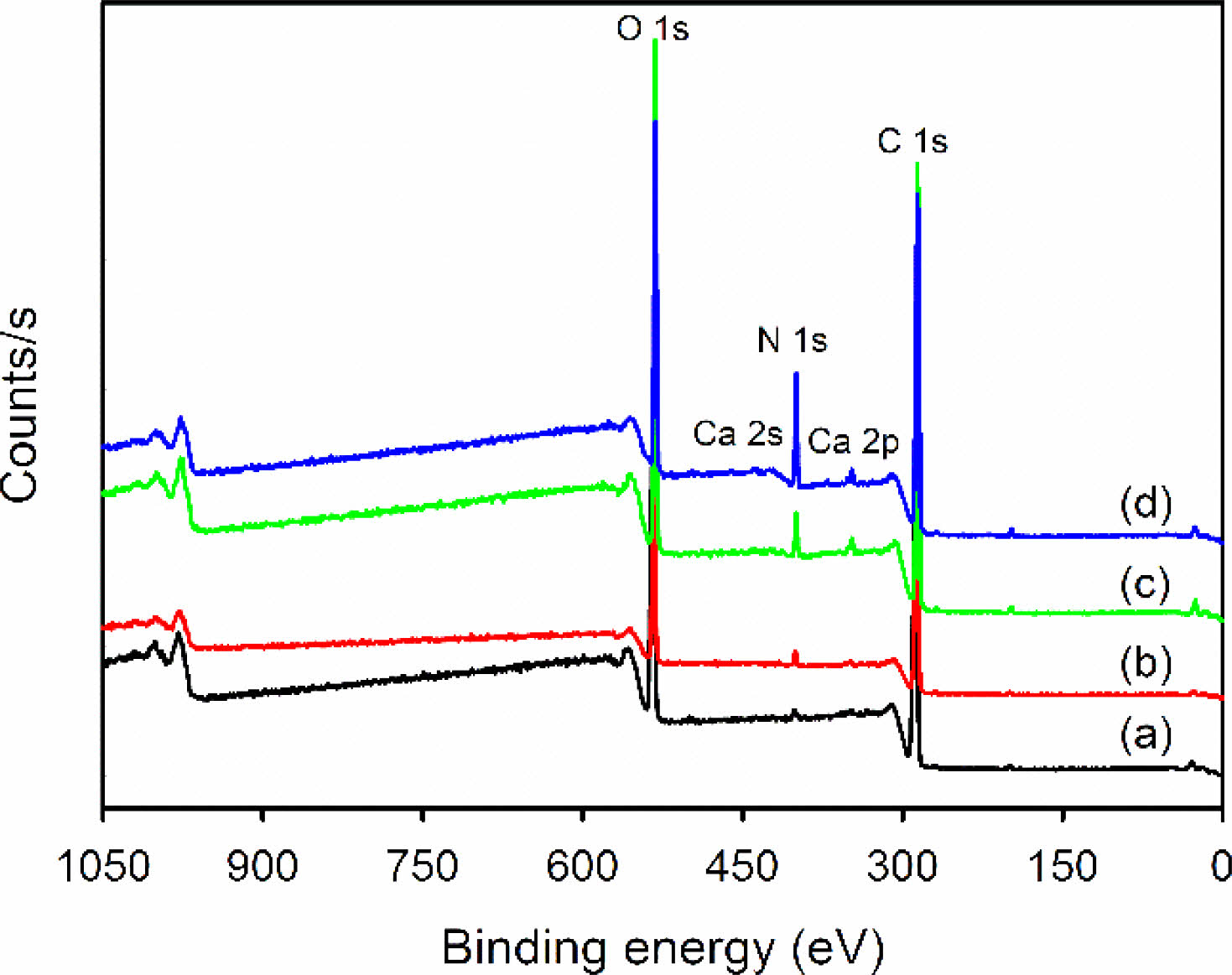
젤라틴/알지네이트 다공성 멤브레인층의 화학적 조성은 XPS를 이용하여 다시 확인하였고, 그 결과 모든 샘플에서 젤라틴과 알지네이트에 기인하는 5개의 분리된 피크가 534 eV(O 1s), 438 eV(Ca 2s), 401 eV(N 1s), 349 eV(Ca 2p) 및 285 eV(C 1s)에서 관찰되었다. 이들 피크 중에서 젤라틴에 기인하는 N 1s 피크는 젤라틴의 사용량이 많아 질수록 증가하는 경향을 보였다(Figure 3).
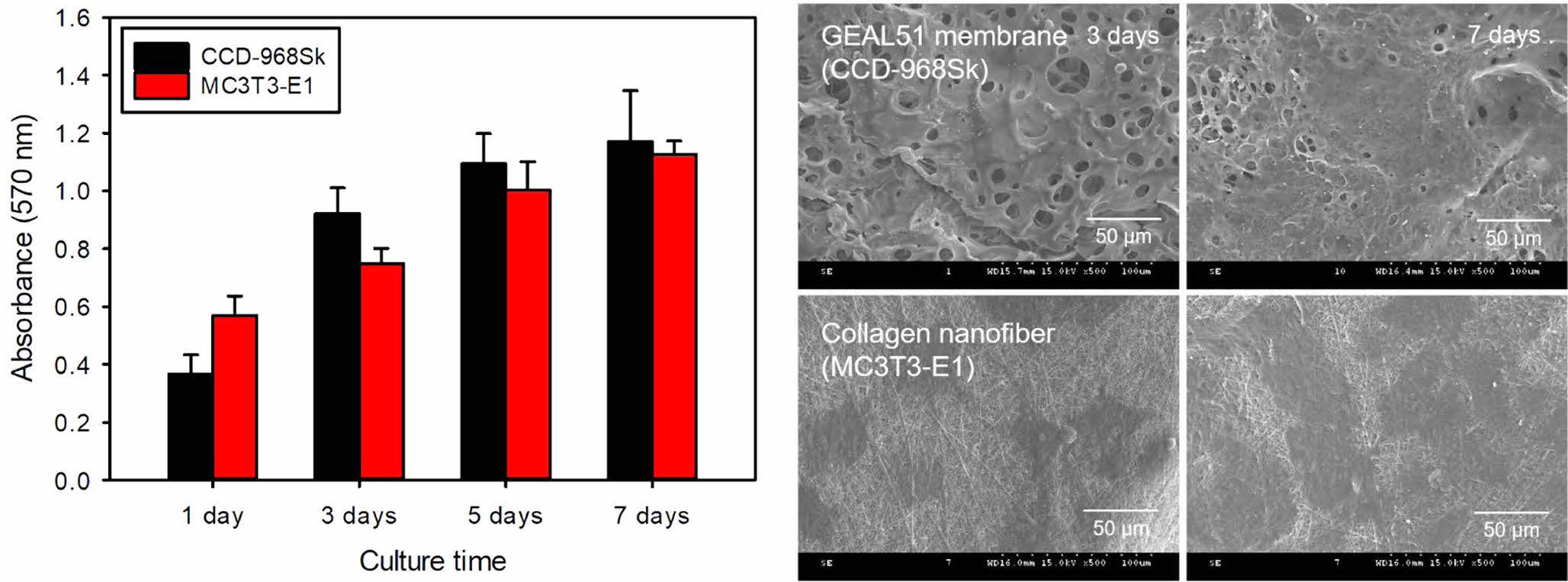
이중층 구조 다공성 멤브레인의 표면 및 기계적 특성 분석.동결건조법을 이용하여 제조한 젤라틴/알지네이트 멤브레인에 계속해서 전기방사법을 이용하여 콜라겐 나노섬유층을 제조함에 의해서 이중층 구조의 다공성 멤브레인을 제조하였다. 이 때 젤라틴/알지네이트 멤브레인은 기공의 크기가 작고 균일한 기공구조를 보이며, 멤브레인 제조 시에 기공 형성의 재현성이 우수한 GEAL51 멤브레인을 사용하였다. 이렇게 제조된 이중층 구조 다공성 멤브레인의 표면형상을 SEM을 이용하여 관찰한 결과 Figure 4(a)에서 볼 수 있는 것처럼 콜라겐으로 제조된 나노섬유 층은 GEAL51 멤브레인층보다 더욱 작고 균일한 기공을 가지는 3차원적으로 연결된 다공성 구조를 보였다. 이들 나노섬유의 평균 직경은 588±23 nm로 균일한 섬유 형상을 보였다. 계속해서 최종 멤브레인 지지체의 횡단면 SEM 사진에서 얇은 멤브레인이 다층으로 적층되면서 3차원적으로 연결된 기공구조를 형성한 것과 같은 형태의 이중층 구조 다공성 멤브레인 지지체가 성공적으로 제조되었다는 것을 확인하였다(Figure 4(b)).
골유도재생술에 사용되는 지지체는 적절한 기계적 강도를 가짐에 의해서 골결손부위의 골조직이 완전히 재생될 때까지 독립적인 골형성 공간을 제공하여야 하고, 영양분과 산소의 이동이 충분히 가능하도록 미세환경을 제공하여야 할 뿐만 아니라 연조직의 침투를 효과적으로 차단하여야 한다.9,10 그러나 골유도재생술에 연조직의 침투를 효과적으로 차단하기 위해서 밀도가 높은 필름 형상의 지지체도 사용되고 있으나 낮은 기공도로 인해서 충분한 영양분의 공급이 어렵기 때문에 골조직 재생능은 다소 억제될 수 있다. 또한 세포의 부착, 성장 및 분화 등은 지지체 표면의 구조, 친수성, 표면전하 등에 영향을 받는다.18 그 중에서도 특히 비표면적이 넓을수록 세포의 부착과 확산(spreading)이 촉진되고, 기공도가 높을수록 영양분의 공급이 활발해 지므로 세포가 빠르게 성장할 수 있다. 따라서 비표면적 및 기공도와 같은 표면 구조는 지지체의 매우 중요한 특징이라 할 수 있다. 이중층 구조 다공성 멤브레인의 비표면적를 조사한 결과 GEAL51 멤브레인층은 2.0±0.16 m2/g의 비표면적을 보였고, 콜라겐 나노섬유층은 4.5±0.29 m2/g의 비표면적을 보이는 것과 같이 나노섬유층이 매우 높은 비표면적을 보였다. 기공도 조사 결과에서는 GEAL51 멤브레인층과 콜라겐 나노섬유층이 각각 82.8%와 81.2%로 거의 비슷한 값을 보였다.
또한 이중층 구조 다공성 멤브레인의 기계적 특성 변화를 알아보기 위해서 응력-변형 측정을 기초로 하여 인장강도(tensile strength)와 파단신율(elongation at break)을 측정한 결과 인장강도는 2.5±0.3 MPa를 보였고, 파단신율은 38.6±2.8%를 보였다.
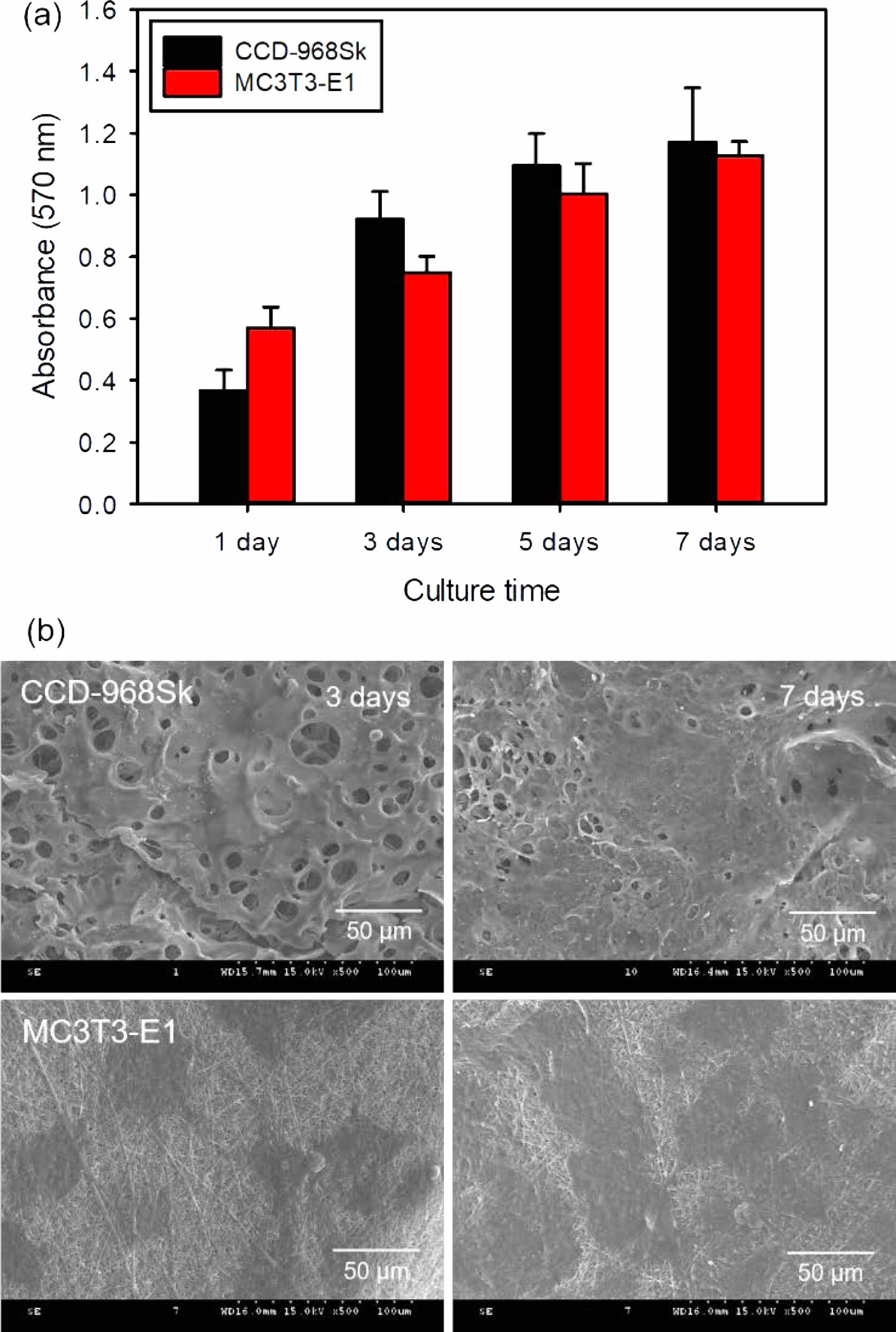
이중층 구조 다공성 멤브레인에서의 세포성장 거동. 이중층 구조 다공성 멤브레인이 연조직과 골조직 세포의 성장에 미치는 영향을 알아보기 위해서 사람 피부 유래 섬유아세포인 CCD-986Sk와 마우스 두개관 유래 조골세포인 MC3T3-E1을 이용하여 이중층 구조 다공성 멤브레인 상에서의 성장거동을 MTT assay 방법으로 조사하였다. Figure 5에서 볼 수 있는 것처럼 GEAL51 멤브레인층과 콜라겐 나노섬유층 모두에서 시간에 따라 섬유아세포와 조골세포가 성장되고 있음이 확인되었고, 그 중에서도 콜라겐 나노섬유층에서 모든 세포들이 더 빠르게 성장하고 있음을 알 수 있었다. 이는 콜라겐이 ECM을 구성하는 주성분이며 우수한 생체적합성을 보이기 때문이다.19 또한 콜라겐에는 리신, 아르기닌 등과 같이 양전하를 가지고 있는 염기성 아미노산 잔기가 많이 존재하기 때문에 일반적으로 음전하를 가지는 세포 표면과 서로 강하게 끌어당기는 상호작용을 한다. 그 결과 콜라겐은 세포의 부착, 이동, 분화 및 성장을 촉진시키는 효과가 있는 것으로 생각되어진다. 특히 콜라겐 나노섬유층은 GEAL51 멤브레인층에 비해서 높은 비표면적을 가지기 때문에 세포의 부착, 성장 및 분화를 더욱 촉진시킬 수 있을 것으로 판단된다.
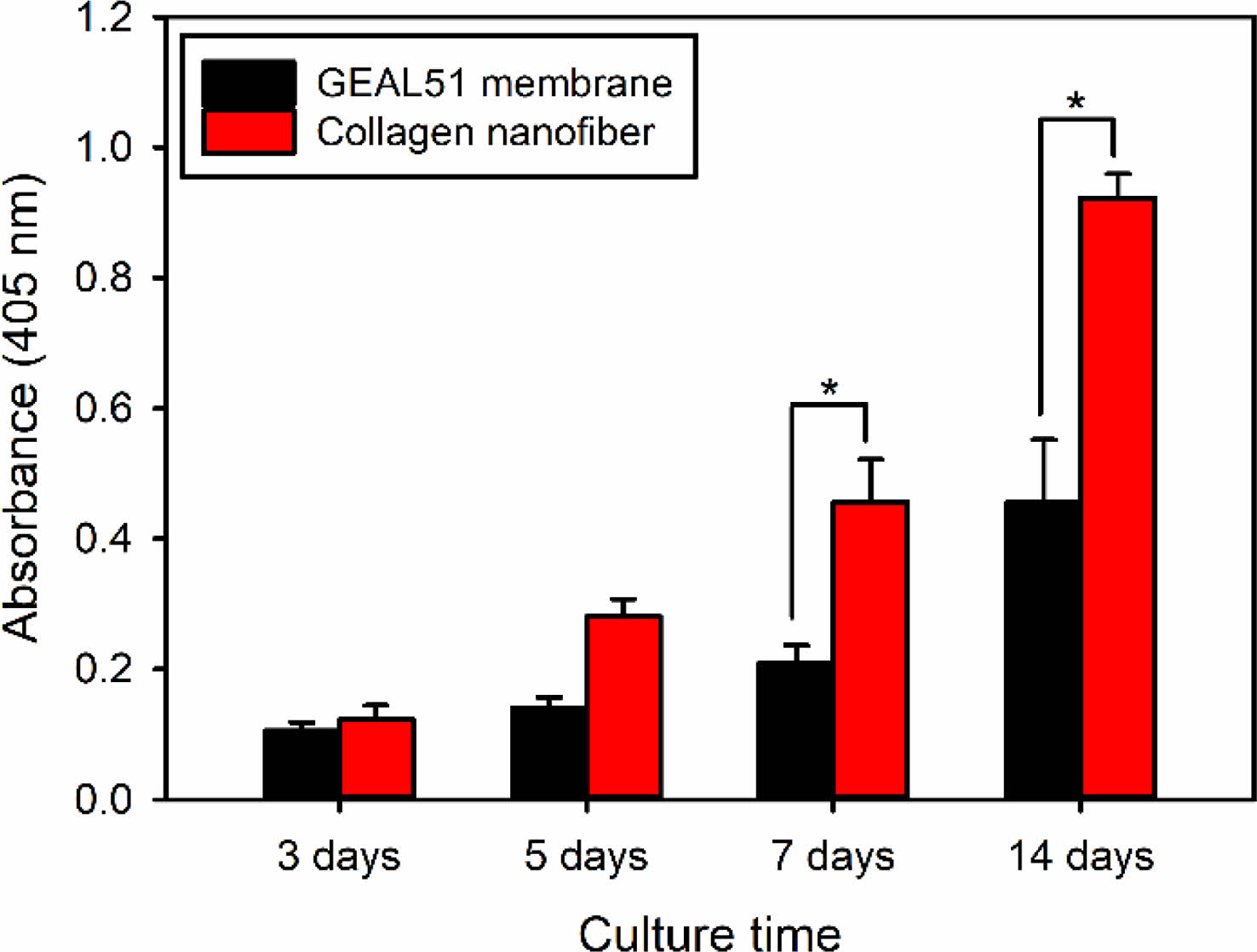
세포 분화능 및 광물화 반응.ALP는 뼈의 광물질 형성에 중요한 역할을 하기 때문에 ALP 활성화도는 초기 조골세포 분화 표지로서 일반적으로 사용이 된다.20 따라서 이중층 구조 다공성 멤브레인이 조골세포인 MC3T3-E1 세포의 분화에 미치는 영향을 조사하기 위해서 ALP 활성화도를 평가하였다. 그 결과 GEAL51 멤브레인층보다 콜라겐 나노섬유층에서 배양된 세포에서 모든 배양시간에서 높은 ALP 활성을 보였다(Figure 6). 이는 콜라겐에 의한 세포의 성장이 촉진됨에 따라서 높은 골분화 현상이 나타나는 것으로 판단된다.19
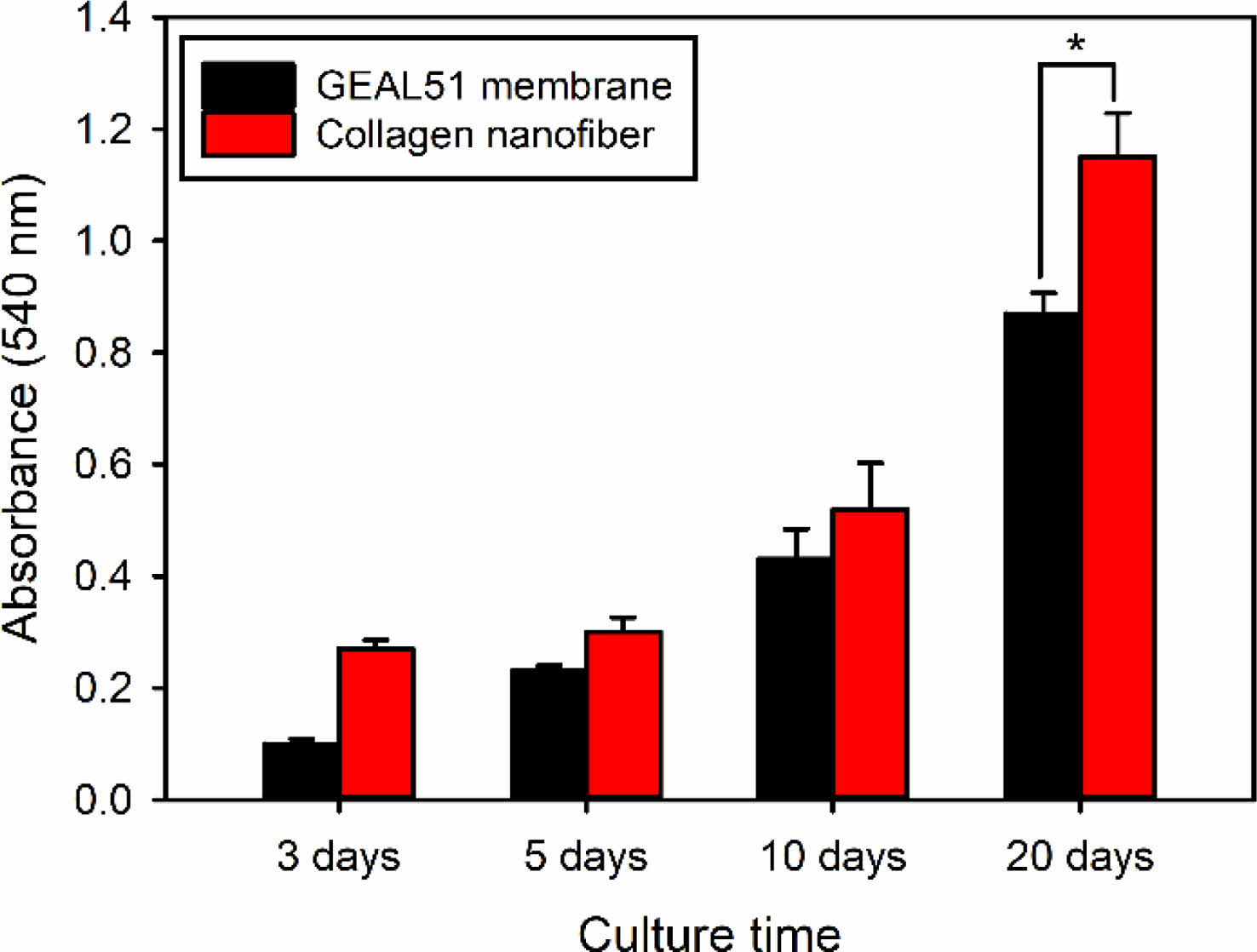
조골세포는 분화한 후에 ECM의 광물화를 위한 반응을 시작하므로 이중층 구조의 다공성 멤브레인에서의 조골세포인 MC3T3-E1 세포의 분화능을 골형성 능력의 지표가 되는 광물화 반응 정도를 조사함에 의해서 평가하였다. 광물화 반응 정도는 광물화 반응 과정에서 생성되는 2가 금속이온인 칼슘이온과 선택적으로 반응할 수 있는 ARS를 이용한 염색법으로 정량하였다. 그 결과 Figure 7에서 볼 수 있는 것처럼 ALP 활성화도 측정 결과와 유사하게 GEAL51 멤브레인층보다 콜라겐 나노섬유층에서 배양된 세포에서 모든 배양시간에서 높은 광물화 반응을 보였다. 이들 결과로부터 GEAL51 멤브레인층보다 콜라겐 나노섬유층이 골조직 재생을 더욱 효과적으로 촉진시킨다는 것을 확인할 수 있었다.
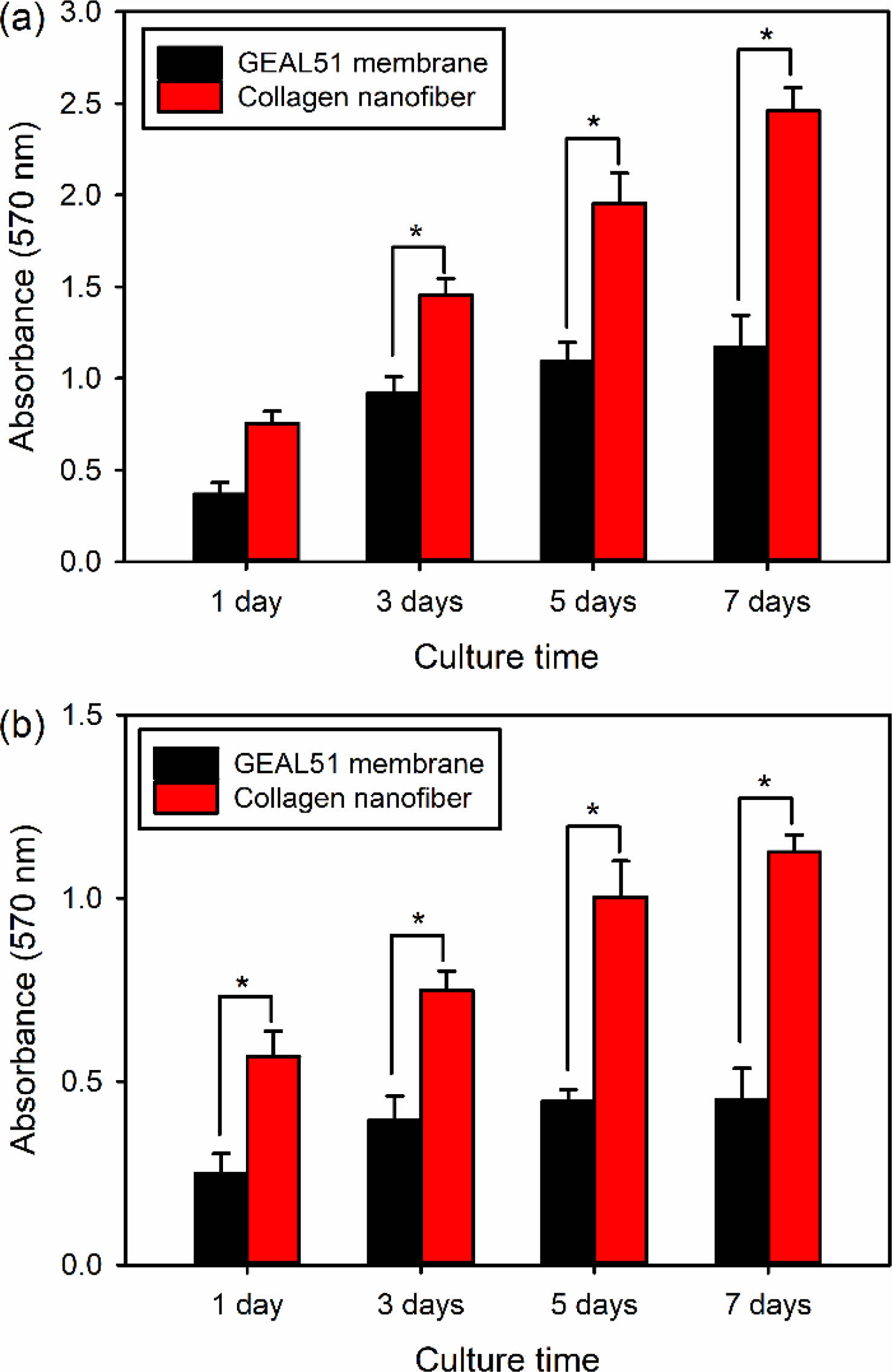
이중층 구조 다공성 멤브레인에서의 세포 성장속도 조절. 연조직과 골조직의 재생속도를 유사하게 조절하기 위해서 MTT assay 결과(Figure 5)를 이용한 연조직과 골조직 세포의 이중층 구조 다공성 멤브레인에서의 성장거동을 분석하였다. 그 결과 세포의 성장속도가 빠른 연조직 세포를 상대적으로 세포 성장에 영향을 적게 주는 GEAL51 멤브레인층에서 배양하고, 세포의 성장속도가 느린 골조직 세포를 세포의 성장을 더욱 촉진시키는 콜라겐 나노섬유층에서 배양할 경우 세포의 초기 점착속도는 양전하성 아미노산을 많이 가진 콜라겐 나노섬유에서 더 빠르게 일어났지만, 계속해서 배양할 경우 연조직과 골조직 세포의 성장속도가 유사하게 유지되었다(Figure 8(a)). 또한 ALP 활성화도 및 광물화 반응 평가 결과에서도 콜라겐 나노섬유층에서 조골세포의 분화능이 더 높다는 것이 확인되었다.
이중층 구조 다공성 멤브레인의 GEAL51 멤브레인층에서의 연조직 세포의 성장거동과 콜라겐 나노섬유층에서의 골조직 세포의 성장거동을 확인하기 위해서 SEM을 이용하여 세포와 멤브레인 사이의 상호작용을 관찰하였다. Figure 8(b)에 나타낸 것처럼 GEAL51 멤브레인층과 콜라겐 나노섬유층 모두에서 세포의 부착과 확산이 잘되고 있고, 또한 배양 시간에 따른 세포 성장이 관찰되었으며 이는 이중층 구조 다공성 멤브레인의 우수한 생체적합성에 기인하는 것으로 판단된다. 특히 7일간의 배양 후에 이중층 구조 다공성 멤브레인 표면의 대부분이 섬유아세포 또는 조골세포로 채워져 있는 것이 관찰되었으며, 이는 MTT assay 결과와도 잘 일치하는 것이다. 이들 결과를 종합해보면 GEAL51 멤브레인층이 연조직과 접하고 콜라겐 나노섬유층이 골조직과 접촉하도록 이중층 구조의 다공성 멤브레인을 골유도재생술용 지지체로 사용할 경우 연조직과 골조직의 재생 속도가 유사하게 조절되어 연조직 침투 차단 효과와 골조직 재생능이 더욱 개선될 것으로 판단된다.

|
Figure 1 SEM micrographs: (a) GEAL13; (b) GEAL11; (c) GEAL31; (d) GEAL51 porous membrnaes fabricated via a freeze drying of gelatin/sodium alginate. |
|
Figure 2 (a) ATR-FTIR; (b) EDX spectra of porous membranes fabricated via a freeze drying of gelatin/sodium alginate. |
|
Figure 3 XPS spectra: (a) GEAL13; (b) GEAL11; (c) GEAL31; (d) GEAL51 porous membranes. |

|
Figure 4 SEM micrographs: (a) surface; (b) cross-section of bilayered porous membrane. |
|
Figure 5 Proliferation behavior: (a) CCD-986Sk; (b) MC3T3-E1 cells incubated on bilayered porous membranes as a function of culture time (n=5). *p<0.05 for comparison between two treatment groups. |
|
Figure 6 ALP activity as a function of culture time for MC3T3-E1 cells incubated on bilayered porous membranes (n=5). *p<0.05 for comparison between two treatment groups |
|
Figure 7 Calcium deposition for MC3T3-E1 cells incubated on bilayered porous membranes (n=5). *p<0.05 for comparison between two treatment groups. |
|
Figure 8 (a) Proliferation behavior (n=5); (b) SEM micrographs of CCD-986Sk cells cultured on GEAL51 membrane layer and MC3T3-E1 cells cultured on collagen nanofiber layer in bilayered porous membranes for different periods of time. *p<0.05 for comparison between two treatment groups. |
최근 우수한 골재생능과 연조직 차단능을 부여하기 위해 기공구조가 조절된 이중층 구조의 멤브레인 지지체 개발이 골조직 재생을 위해서 많이 연구되고 있다. 본 연구에서는 연조직과 골조직의 재생 속도를 유사하게 조절함에 의해서 연조직 차단 효과와 골조직 재생능을 극대화할 수 있는 이중층 구조의 다공성 멤브레인 지지체를 동결건조법과 전기방사법을 이용하여 제조하였다. 제조된 이중층 구조 다공성 멤브레인은 세포의 균일한 분포와 산소 및 영양분의 투과가 가능하도록 하는 상호연결된 기공구조를 가지고 있었다. 이중층 구조의 각 층의 제조에 사용된 천연고분자의 종류와 비표면적이 연조직과 골조직 세포의 성장에 영향을 주었다. 또한 콜라겐 나노섬유층에서 GEAL51 멤브레인층에서보다 섬유아세포와 조골세포의 성장이 더 빨랐고, 특히 조골세포의 분화 및 광물화반응이 콜라겐 나노섬유층에서 더 촉진되었다. 따라서 이중층 구조의 다공성 멤브레인을 사용할 경우, 즉 콜라겐 나노섬유층에서 조골세포가 자라게 하고 GEAL51 멤브레인층에서 섬유아세포가 성장하도록 한다면 연조직과 골조직의 재생 속도가 유사하게 조절될 가능성이 있다. 이들 결과로부터 이중층 구조 다공성 멤브레인의 제조는 새로운 골유도재생술용 지지체의 개발에 많은 도움이 될 것으로 기대된다.
- 1. Aki, D.; Ulag, S.; Unal, S.; Sengor, M.; Ekren, N.; Lin, C.-C.; Yılmazer, H.; Ustundag, C. B.; Kalaskar, D. M.; Gunduz, O. 3D Printing of PVA/Hexagonal Boron Nitride/Bacterial Cellulose Composite Scaffolds for Bone Tissue Engineering. Mater. Des. 2020, 196, 109094.
-

- 2. Simurda, T.; Kubisz, P.; Dobrotova, M.; Necas, L.; Stasko, J. Patient with Congenital Afibrinogenemia During Revision Total Hip Arthroplasty. Semin. Thromb. Hemost. 2016, 42, 689-692.
- 3. Du, X.; Wei, D.; Huang, L.; Zhu, M.; Zhang, Y.; Zhu, Y. 3D Printing of Mesoporous Bioactive Glass/Silk Fibroin Composite Scaffolds for Bone Tissue Engineering. Mater. Sci. Eng. C 2019, 103, 109731.
-

- 4. Baptista, R.; Guedes, M. Morphological and Mechanical Characterization of 3D Printed PLA Scaffolds with Controlled Porosity for Trabecular Bone Tissue Replacement. Mater. Sci. Eng. C 2021, 118, 111528.
-

- 5. Liu, X.; Smith, L. A.; Hu, J.; Ma, P. X. Biomimetic Nanofibrous Gelatin/Apatite Composite Scaffolds for Bone Tissue Engineering. Biomaterials 2009, 30, 2252-2258.
-

- 6. Whited, B. M.; Whitney, J. R.; Hofmann, M. C.; Xu, Y.; Rylander, M. N. Pre-osteoblast Infiltration and Differentiation in Highly Porous Apatite-coated PLLA Electrospun Scaffolds. Biomaterials 2011, 32, 2294-2304.
-

- 7. Park, J.-Y.; Jung, I.-M.; Kim, Y.-K.; Lim, H.-C.; Lee, J.-S.; Jung, U.-W.; Choi, S.-H. Guided Bone Regeneration Using 1-ethyl-3-(3-dimethylaminopropyl) Carbodiimide (EDC)-cross-linked Type-1 Collagen Membrane with Biphasic Calcium Phosphate at Rabbit Calvarial Defects. Biomater. Res. 2015, 19, 15.
-

- 8. Cai, Y.; Guo, J.; Chen, C.; Yao, C.; Chung, S.-M.; Yao, J.; Lee, I.-S.; Kong, X. Silk Fibroin Membrane Used for Guided Bone Tissue Regeneration. Mater. Sci. Eng. C 2017, 70, 148-154.
-

- 9. Ke, R.; Yi, W.; Tao, S.; Wen, Y.; Hongyu, Z. Electrospun PCL/Gelatin Composite Nanofiber Structures for Effective Guided Bone Regeneration Membranes. Mater. Sci. Eng. C 2017, 78, 324-332.
-

- 10. Rad, M. M.; Khorasani, S. N.; Ghasemi-Mobarakeh, L.; Prabhakara, M. P.; Foroughi, M. R.; Kharaziha, M.; Saadatkish, N.; Ramakrishna, S. Fabrication and Characterization of Two-layered Nanofibrous Membrane for Guided Bone and Tissue Regeneration Application. Mater. Sci. Eng. C 2017, 80, 75-87.
-

- 11. Li, P.; Li, Y.; Kwok, T.; Yang, T.; Liu, C.; Li, W.; Zhang, X. A Bi-layered Membrane with Micro-nano Bioactive Glass for Guided Bone Regeneration. Colloids Surf. B Biointerfaces 2021, 205, 111886.
-

- 12. Tamburaci, S.; Tihminlioglu, F. Development of Si Doped Hydroxyapatite Reinforced Bilayer Chitosan Nanocomposite Barrier Membranes for Guided Bone Regeneration. Mater. Sci. Eng. C 2021, 128, 112298.
-

- 13. Huang, Y.; Song, J.; Yang, C.; Long, Y.; Wu, H. Scalable Manufacturing and Applications of Nanofibers. Mater. Today 2019, 28, 98-113.
-

- 14. Lee, J. B.; Ko, Y.-G.; Cho, D.; Park, W. H.; Kwon, O. H. Modification and Optimization of Electrospun Gelatin Sheets by Electron Beam Irradiation for Soft Tissue Engineering. Biomater. Res. 2017, 21, 14.
-

- 15. Seo, H.-J.; Jun, S.-J.; Lee, W.-S.; Park, J.-H.; Son, T.-W. Preparation and Antimicrobial Zinc Calcium Alginate Films According to Concentration. Polymer(Korea) 2014, 38, 580-587.
-

- 16. Chen, K.; Pan, H.; Yan, Z.; Li, Y.; Ji, D.; Yun, K.; Su, Y.; Liu, D.; Pan, W. A Novel Alginate/Gelatin Sponge Combined with Curcumin-loaded Electrospun Fibers for Postoperative Rapid Hemostasis and Prevention of Tumor Recurrence. Int. J. Biol. Macromol. 2021, 182, 1339-1350.
-

- 17. Xing, J.; Dang, W.; Li, J.; Huang, J. Photo/Thermal Response of Polypyrrole-modified Calcium Alginate/gelatin Microspheres Based on Helix-coil Structural Transition and the Controlled Release of Agrochemicals. Colloids Surf. B Biointerfaces 2021, 204, 111776.
-

- 18. Seo, D.-E.; Jeong, S. I.; park, J.-S.; Gwon,-J.; An, S.-J.; Lee, B. H.; Im, D.-S.; Shin, H. S.; Lim, Y.-M. Preparation and Characterization of AEMA Grafted PCL Nanofibers Using Gamma-ray Irradiation. Polymer(Korea) 2017, 41, 143-150.
-

- 19. Ma, C.; Wang, H.; Chi, Y.; Wang, Y.; Jiang, L.; Xu, N.; Wu, Q.; Feng, Q.; Sun, X. Preparation of Oriented Collagen Fiber Scaffolds and its Application in Bone Tissue Engineering. Appl. Mater. Today 2021, 22, 100902.
-

- 20. Luo, Y.; Li, Y.; Qin, X.; Wa, Q. 3D Printing of Alginate/Gelatin Scaffolds with Homogenous Nano Apatite Coating for Bone Tissue Engineering. Mater. Des. 2018, 146, 12-19.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(2): 208-215
Published online Mar 25, 2022
- 10.7317/pk.2022.46.2.208
- Received on Nov 9, 2021
- Revised on Dec 4, 2021
- Accepted on Dec 10, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Young-Jin Kim
-
*Department of Biomedical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea
**School of Advanced Materials and Chemical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea - E-mail: yjkim@cu.ac.kr
- ORCID:
0000-0002-1153-1304










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.