- Development of Metformin Hydrochloride-Linagliptin Controlled Release Tablet Using Hydrophilic Polymers for Type 2 Diabetes in Asians
Sunjae Park*, Pil Yun Kim*, Na Eun Kim*, Youngeun Song*, Ga Young Jeon*, Nomin-Erdene Tumursukh*, Jeong Eun Song*, and Gilson Khang*, **, ***,†

*Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of Polymer Nano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea- 아시아인의 제2형 당뇨병 치료를 위한 친수성 고분자를 사용한 메트포르민 염산염-리나글립틴 방출제어형 정제 개발
박선재* · 김필윤* · 김나은* · 송영은* · 전가영* · 투무르수흐너밍에르덴* · 송정은* · 강길선*, **, ***,†

*전북대학교 바이오나노융합공학과, **전북대학교 고분자나노공학과, ***전북대학교 고분자융합소재연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Metformin hydrochloride, used for treatment of type 2 diabetes, is a drug belonging to the biopharmaceutical classification system III and has a high solubility in water. Therefore, hypoglycemia occurs in Asians who have lower weight and body fat than Westerners because of the rapid initial release. Accordingly, a hydrophilic polymer was used to reduce the risk of hypoglycemia due to the rapid increase in blood concentration of the drug, and a combination of metformin hydrochloride and linagliptin fixed -dose triple -layer tablet was prepared through a wet granulation process. The crystallinity and inclusion of drugs were evaluated through X-ray diffractometer (XRD), and chemical changes were confirmed through Fourier transform infrared spectroscopy (FTIR). Finally, tablets prepared by inducing a sustained release pattern and Trajenta duo tablets were analyzed by comparative dissolution test and confirmed to be available as type 2 diabetes treatments suitable for Asians.
제2형 당뇨병 치료제 메트포르민 염산염은 생물약제학적 분류체계 III에 속하는 약물로 물에 대한 용해도가 높다. 따라서 초기 방출이 급격하게 일어나기 때문에 서구인에 비해 낮은 체중과 체지방을 가진 아시아인들에게는 저혈당증이 발생한다. 이에 급격한 약물 혈중농도 증가에 의한 저혈당증 위험의 발생률을 낮출 수 있도록 친수성 고분자를 사용하였고, 습식과립공정을 통하여 메트포르민 염산염과 리나글립틴 고정 용량 조합 삼중층 정제를 제조하였다. X-ray diffractometer(XRD)를 통해 약물의 결정성 및 포접을 평가했고, Fourier transform infrared spectroscopy (FTIR)을 통해 물리·화학적 변화를 확인하였다. 최종적으로, 본 연구의 서방정제와 트라젠타듀오정과의 비교용출 시험을 수행하여, 아시아인들에 적합한 제2형 당뇨병 치료제로 개발 가능함을 확인하였다.
Metformin hydrochloride, a type 2 diabetes treatment, is a drug belonging to the biopharmaceutical classification system III and has a high solubility in water. Therefore, hypoglycemia occurs in Asians who have lower weight and body fat than Westerners because of the rapid initial release. Accordingly, a hydrophilic polymer was used to reduce the risk of hypoglycemia due to the rapid increase in blood concentration of the drug, and a combination of metformin hydrochloride and linagliptin fixed-dose triple -layer tablet was prepared through a wet granulation process.
Keywords: metformin hydrochloride, linagliptin, wet granulation, poly(ethylene oxide), sustained release.
본 연구는 과학기술정보통신부의 재원으로 한국연구재단의 지원(NRF-2019K2A9A1A06098563)을 받아 수행된 국제화기반조성사업이다.
저자(들)는 이해상충이 없음을 선언합니다.
제2형 당뇨병(type 2 diabetes mellitus, T2DM)은 췌장 베타세포의 비활성화, 인슐린 저항성 증가 등을 특징으로 하는 질환이다. 나이가 들수록, 비만도가 심해질수록 발병하기 쉬운 것으로 알려져 있다. 정상 체중 유지를 위해 규칙적인 운동이나 식습관 개선을 통해 예방할 수 있지만, 약물로 치료가 필요한 경우 메트포르민 염산염(metformin hydrochloride)이 주로 사용되고 있다.1
최근 T2DM의 발병률이 서구권뿐만 아니라 아시아권에서도 꾸준히 증가하고 있다. 그럼에도 불구하고 T2DM에 대한 혈당 강하 치료는 서구권에 맞춰서 연구되고 있다. 아시아인들은 서양인에 비해 평균적으로 낮은 체중과 체지방으로 인해 혈압약물로 인한 저혈당증 발생률이 높기 때문에 아시아인에 맞는 치료 방법에 대한 연구가 필요하다.2
또한 메트포르민 염산염 단독으로는 일일 최대 허용 용량을 투여했음에도 불구하고 효과적인 혈당 조절이 이루어지지 않는다는 연구 보고가 있다. 따라서 dipeptidyl peptidase-4(DDP-4) 억제제 계열 약물과 메트포르민 염산염을 같이 처방하는 방법이 많이 채택되어 사용되고 있다.3
DDP-4 억제제 약물은 혈당 의존적으로 인슐린을 분비하는 인크레틴(incretin)을 분해하는 DDP-4를 억제하여 인슐린 분비를 증가시켜 혈당을 조절한다.4
DDP-4 억제제 약물 중 글립틴 계열의 리나글립틴을 본 연구에서는 메트포민과 다층정으로 제제화하였다. 리나글립틴은 정상 혈당 수치에서는 인슐린 분비를 유도하지 않기 때문에 저혈당의 위험이 낮아 아시아인에 맞는 T2DM 치료법이 될 수 있다. 또한 용량 조절 없이 단일 용량을 복용할 수 있어 편리하고 특히 간에서 대사를 거치지 않는다. 그리고 위장관을 통해 배출되기 때문에 신기능 저하 등의 부작용이 없는 장점을 가지고 있다.5
병용투여를 해야하는 경우의 복합제는 고정 용량 복합제로의 제제화를 필요로 한다. 고정 용량 복합제란 동일한 제형에 두가지 이상의 원료 의약품을 고정 비율로 제제화 하는 것을 말한다. 고정 용량 복합제를 적절히 사용하였을 때는 여러 기전에 의한 혈압 상승 경로를 효과적으로 막을 수 있다는 장점이 있다. 본 연구에서는 메트포르민 염산염과 리나글립틴 고정 용량 복합제를 만들어 저혈압 위험이 감소하고 아시아인에 적합한 T2DM 치료제를 개발하고자 하였다. 또한 약물의 급격한 혈중농도 증가에 의한 저혈당증 위험 가능성을 낮출 수 있도록 서방형 방출패턴을 유도하고자 하였다.
경구 서방성 제형 디자인에 사용되는 고분자 재료 중 폴리 에틸렌 옥사이드(PEO)는 독성이 낮고 팽윤성을 지닌 고분자이다. PEO는 -CH2-, CH2-O-의 반복 단위로 구성되며 PEO는 폴리(카복실산)과 복합체를 형성하는 것으로 알려져 있다.6
카보폴(Carbopol, CP)은 일종의 폴리(카복실산)이며 생체에 적합한 점증제이고 경구용 정제에서는 제어 방출 매트릭스로 사용한다.7
본 연구에서는 PEO:CP 비율과 PEO의 분자량을 변경하며 약물 방출 속도를 확인하였다.
수용성 고분자를 이용해 메트포르민 염산염-리나글립틴 복합정제를 만드는 방법으로는 습식 과립화 공정을 통해 제조하였다. 습식과립화 공정은 결합액을 통해 약물을 과립화 하기 때문에 유동성을 개선시킬 수 있는 장점이 있다.8
메트포르민 염산염은 과립 자체가 유동성 및 압축성이 낮은 특성이 있어서 습식 과립화 공정을 통해 개선하고자 하였다.
메트포르민 염산염과 리나글립틴 복합정제 연구는 기존 연구에서 많이 이루어졌지만, 흐름성이 낮은 메트포르민 염산염의 단점을 개선하고 메트포르민 염산염의 급격한 약물 방출을 느리게 함으로써 아시아인에게 효과적인 T2DM 치료제 개발을 가능케 하고자 실험을 진행하였다.
시약 및 재료. 본 연구에 사용된 원약물인 메트포르민 염산염(Chemical Industry, 일본), 리나글립틴(한국), 고분자인 polyvinylpyrrolidone(PVP) K-30 Showa(일본), PEO 900K, 4000K, 8000K Sigma-Aldrich(미국), Cabopol 940은 Making Cosmetics(미국), Lactose Sigma-Aldrich(미국), microcrystalline cellulose(MCC) JRS Pharma(일본), 시판제 트라젠타듀오정 2.5/500 Boehringer Ingelheim(독일)에서 구입하여 사용하였다. 그 외 사용한 모든 시약은 high performance liquid chromato- graphy(HPLC) 등급을 사용하였다.
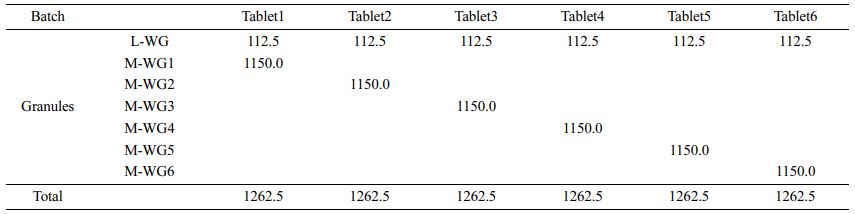
과립의 제조. 메트포르민 염산염, 리나글립틴을 함유하는 과립제의 제조는 Table 1의 조성처럼 습식과립공정을 통하여 제조하였다. 모든 시약 및 재료들은 사용 전 250 mm 크기를 갖는 체에 걸러낸 후 사용하였다. 메트포르민 염산염의 경우에는 PEO를 각 분자량에 따라, Cabopol 940의 유무에 따라 제조하였고 리나글립틴의 경우 PVP K-30을 결합제로써 사용하여 과립화하였다. 또한 두 원료의약품 배치들 모두 동일하게 표와 같이 칭량하여 혼합하고 각각의 혼합물에 증류수를 미세 분무하며 조립하였다. 제조된 조립물들을 열풍건조기에서 30분간 건조 후 250 mm 크기를 갖는 체를 통해 입도를 균일하게 정립하였다. 수득된 과립들은 시험 전까지 데시케이터에 보관하였다.
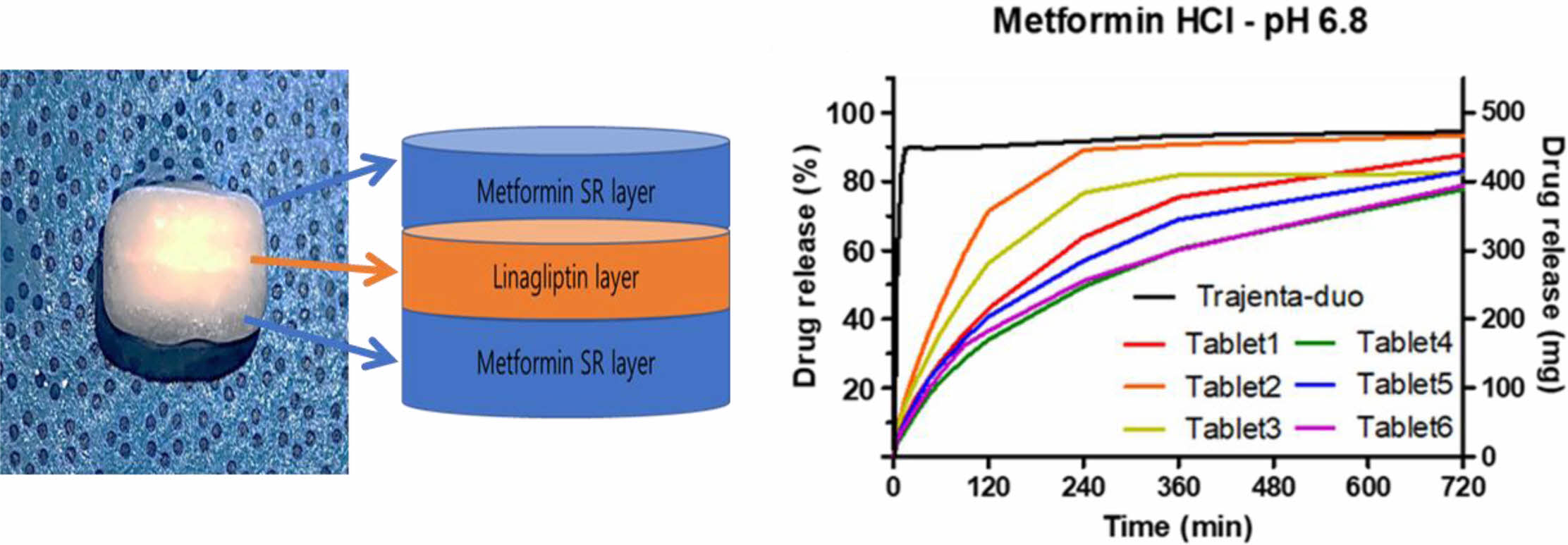
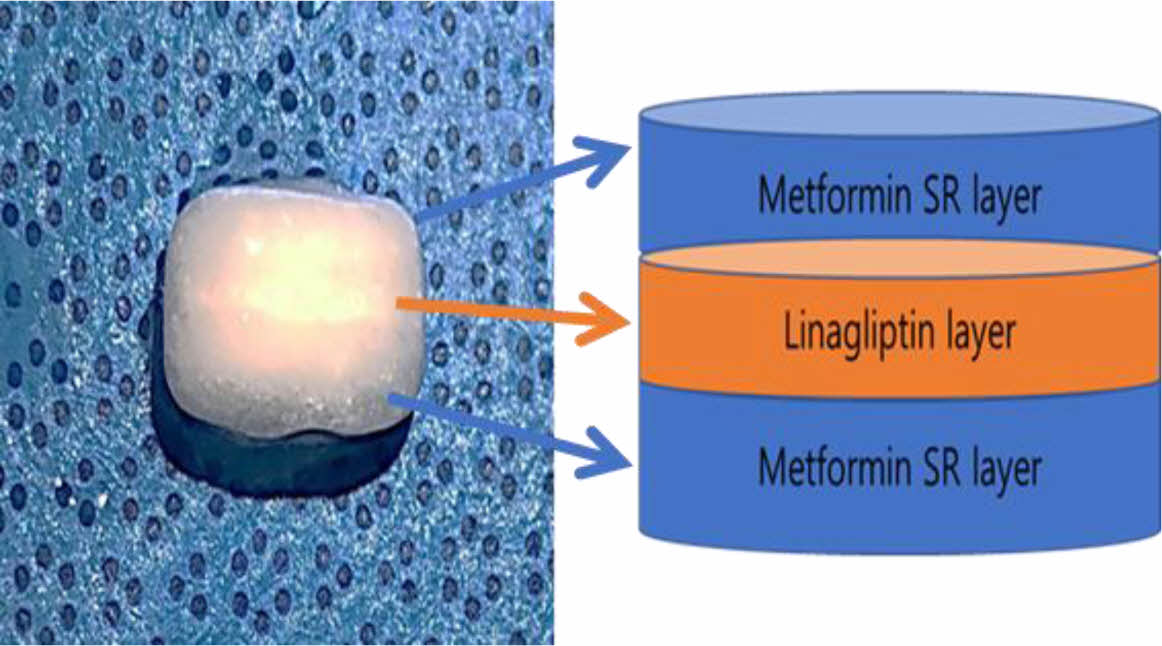
정제의 제조. Figure 1과 같이 메트포르민 염산염이 함유된 서방성 과립물과 리나글립틴이 함유된 과립물을 제조하였다. 정제는 압축 성형 프레스(MH 50Y CAP 50 ton, Japan)를 사용하여 1분 동안 10 kg/cm2의 압력을 가하여 Table 2의 조성으로 제조하였다. 이후 정제는 시험 전까지 데시케이터에 보관 후 사용하였다.
원료의약품과 과립물의 유동 특성분석.원료의약품들과 과립들의 유동 특성을 측정하기 위해서 대한약전 겉보기밀도 및 탭밀도 측정법 제1법 정질량법으로 실시하였고 Hausner Ratio, Carr’s Index 지표로 유동성특성을 판단했다.
과립물의 구조학적 특성분석.메트포민 염산염, 리나글립틴, 각 고분자들 그리고 과립들의 분자구조를 분석하고 공정간 화학 결합이 발생했는지 확인하기 위하여 Fourier transform infrared spectroscopy(FTIR)(GX, Perkin Elmer, Waltham, Massachusetts, USA)로 분석하였다. 측정방식은 ATR법을 사용하였으며 측정 범위는 4000-500 cm-1에서 측정되었다.
과립물의 결정학적 특성분석. 고분자에 원약물인 메트포르민 염산염, 리나글립틴이 포접이 잘 이루어졌는지 확인하기 위해 X-ray diffractometer(XRD, MAX 2500, 일본)로 결정성을 분석하였다. 선 회절은 0.3 mm의 투명한 유리 기관에 일정량의 샘플을 충분히 적층시켜 배향이 발생하지 않도록 하였고 이를 30 mA, 40 KV의 조건으로 측정하였다. 분석 시작각과 종료각은 각각 5, 50°로 하였으며, step size는 2°/min로 설정하여 진행하였다.
정제의 생체 외 방출거동.제조된 과립물과 트라젠타 듀오 500/2.5 mg(Boehringer Ingelheim, 독일) 및 삼중층 정제들의 용출시험은 USP dissolution apparatus II(paddle method)로 실시하였다. 용출액은 인공장액(pH 6.8)으로 United States Pharmacopeia(USP Method A Acid stage, Buffer stage)에 따라 제조하였으며 용출기는 DTS-8(Lab House, 한국)을 사용하였고, 속도는 100 rpm, 용출액의 온도는 37±5 oC의 조건으로 실험하였다. 용출액의 양은 900 mL로 싱크상태를 설정하였으며 검액추출시점은 메트포르민 염산염의 경우 5, 10, 15, 30, 45, 60, 90, 120, 240, 360, 720분으로 하였으며, 리나글립틴의 경우 5, 10, 15, 30, 45, 60, 90, 120, 240, 360분으로 진행하였다. 취한 검액은 0.45 mm polytetrafluoroethylene (PTFE) 필터로 여과한 후 HPLC를 이용하여 측정하였다. HPLC는 NS-4000(Futecs, 한국)을 사용하여 측정하였다. 사용된 칼럼의 종류는 Intersil® OSD-3 C18(4.6×150 mm, 5 mm, GL Science Inc)을 사용하였다. 유속은 1.0 mL/min, 시료 주입량은 40 μL로 분석하였으며 컬럼의 온도는 37±5 oC 검출파장은 UV 250 nm을 사용하였고 이동상은 아세트 나이트릴, 0.1 M 인산완충액 pH 6.0(60:40)을 제조하여 사용하기 전 초음파분쇄기로 탈기하여 사용하였다.
|
Figure 1 Scheme of metformin-linagliptin tablet. |
|
Table 1 The Formulation of Active Pharmaceutical Ingredient (API) with Polymers, Excipients Using Wet Granulation (WG) (Unit : mg) |
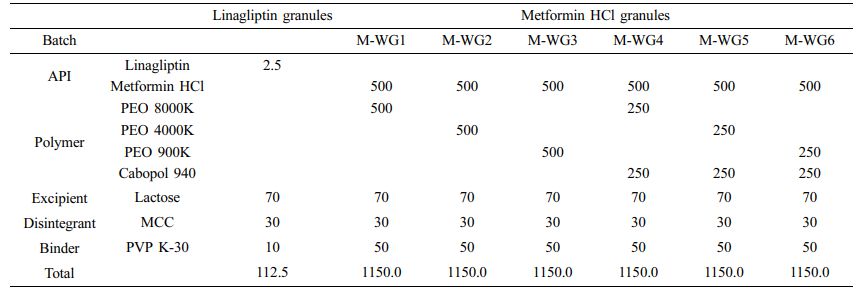
*L-WG: Wet granule with linagliptin, M-WG: Wet granules with metformin HCl. |
원료의약품과 과립물의 유동 특성 분석.원료의약품들과 과립물들의 유동성 특성을 아래와 같이 측정하였고 Table 3에 나타내었다. 원료의약품 메트포르민 염산염과 리나글립틴의 경우 Hausner Ratio 지수, Carr’s Index 지수 각각 poor와 very very poor 등급이 나와 흐름성이 매우 좋지 않다는 것을 확인할 수 있었다.9
이에 반해 습식 과립 공정을 거친 두 과립물들의 흐름성 특성은 모두 excellent 등급이 나와 흐름성이 현저히 개선되었음을 확인하였다. 과립물의 Carr’s index 지수가 excellent 등급을 띄기 때문에 입자간 상호 작용이 적어 공정과정에서 분말의 규칙성 있는 흐름에 따라 균일한 무게의 정제를 제조할 수 있음을 시사한다.
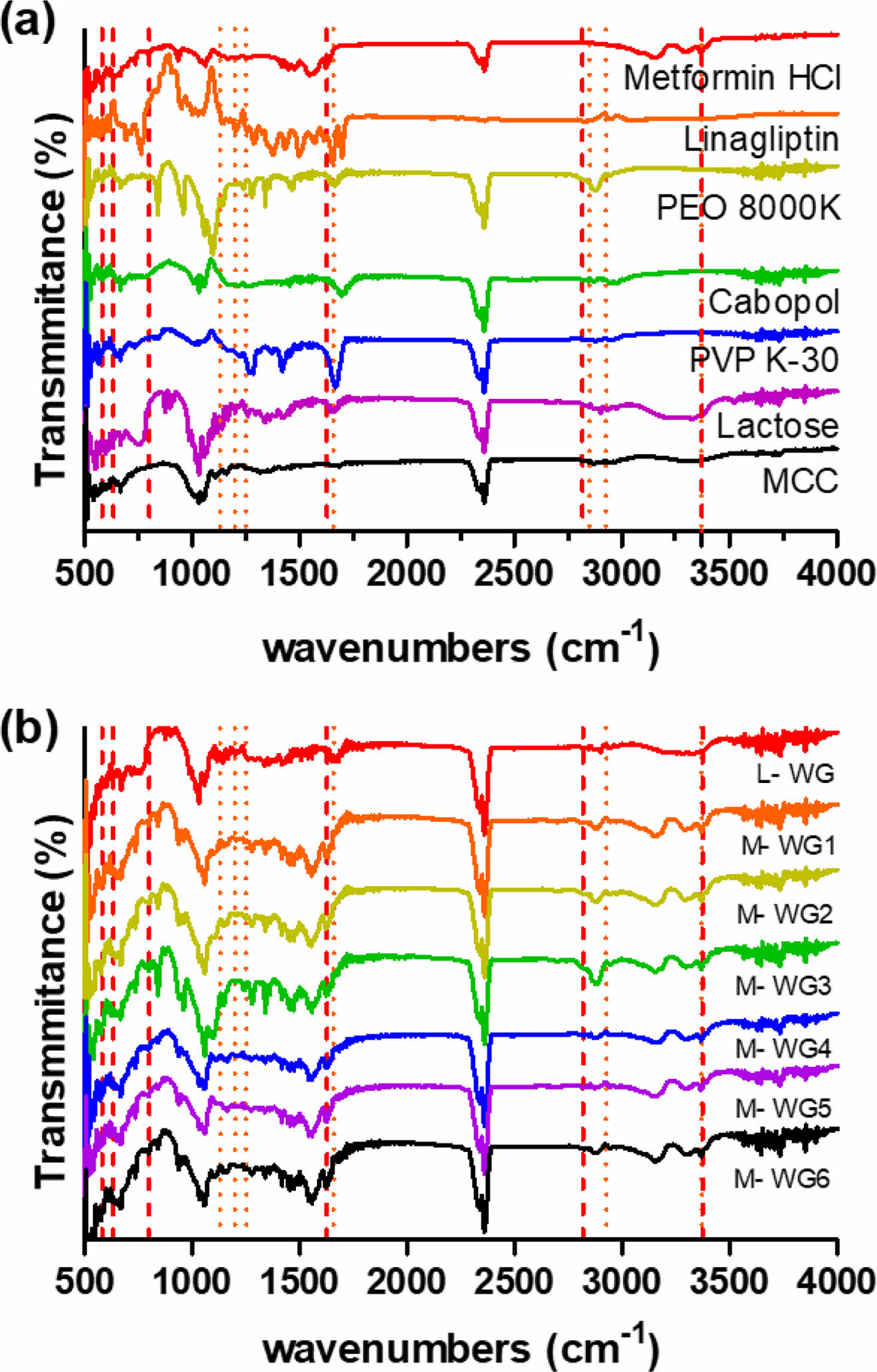
과립물의 구조학적 특성분석.메트포르민 염산염과 리나글립틴 그리고 다른 각각의 고분자들의 물리 화학·구조적 변화를 FTIR을 통해 분석하고 Figure 2에 나타내었다. 과립물들의 FTIR의 결과는 Figure 2(b)에 나타내었다. Figure 2(a)의 원료 의약품들의 고유 특성 피크가 Figure 2(b)의 과립물들과 비교 하였을 때 변화가 없는 것을 보아 공정 중 원료 의약품과 다른 부형제들과의 물리 화학·구조적 변화가 없다고 판단할 수 있다.10
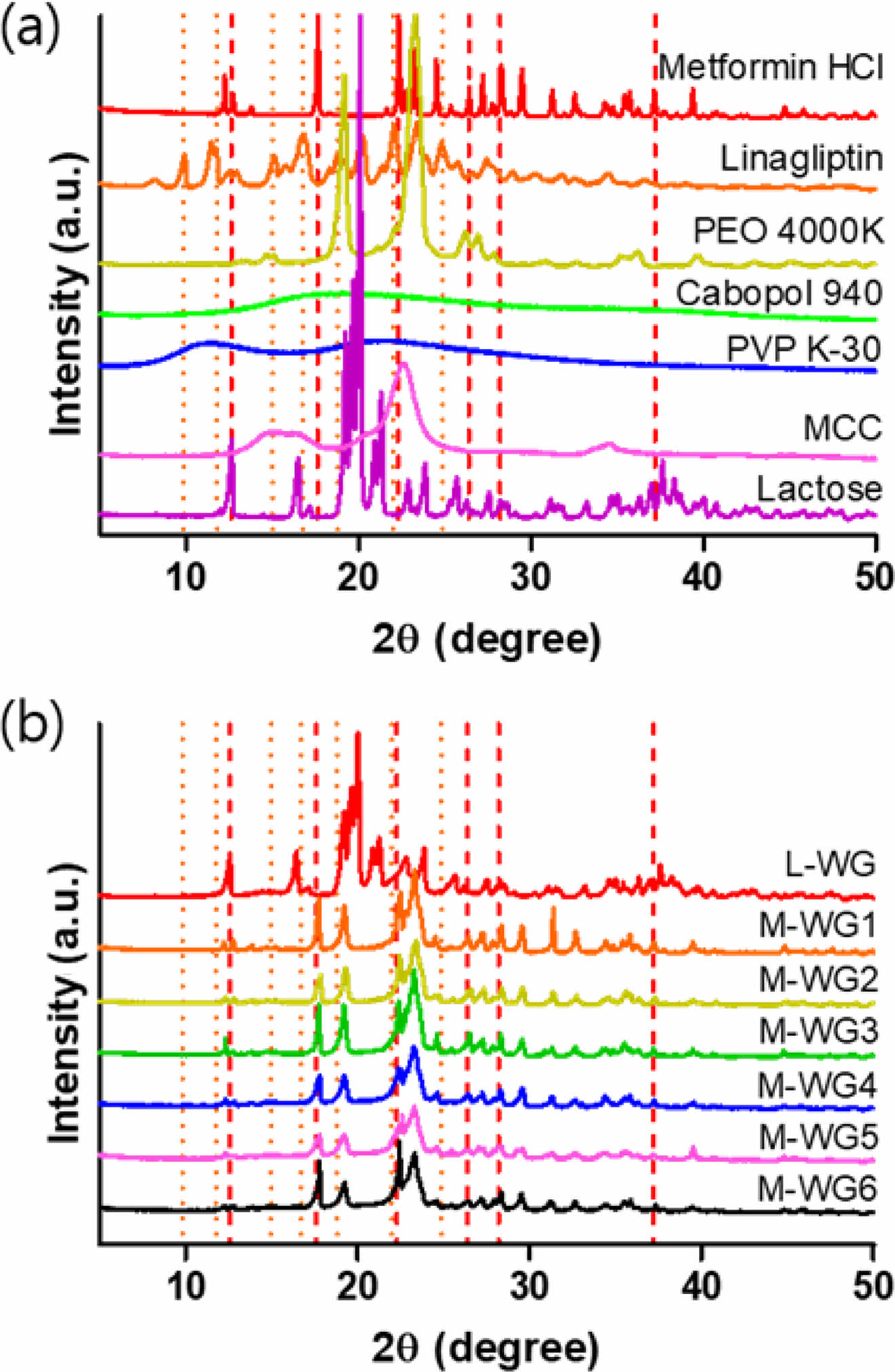
과립물의 결정학적 특성분석. 메트포르민 염산염, 리나글립틴과 각 고분자들 그리고 과립물들을 XRD로 분석한 결과를 Figure 3에 나타내었다. 메트포르민 염산염은 12.6, 17.6, 22.3, 26.2, 28.2, 37.2°에서, 리나글립틴은 9.832, 11.793, 14.892, 16.426, 18.785, 21.987, 25.084°에서 특징적인 회절 피크를 갖는 결정성 물질들임을 확인할 수 있다. PEO, MCC, Lactose 또한 특징적인 회절피크를 갖는 결정 물질이며 이에 반해 PVP K-30과 Carbopol 940은 특징적인 회절피크가 없는 것을 보아 무정형물질임을 확인하였다. Figure 3(b)에 리나글립틴과 메트포르민 염산염이 함유된 과립물들의 XRD 분석 결과를 보면 원약물들이 가지고 있던 특정 피크들이 상당히 줄어들거나 없어진 것을 확인하였다. 이는 수용성 고분자들에 원약물들이 효과적으로 포접되었음을 시사한다. 또한 약물의 포접은 점도가 높을수록, 카보머의 함유량이 높을수록 효과적인 것을 확인하였다.11
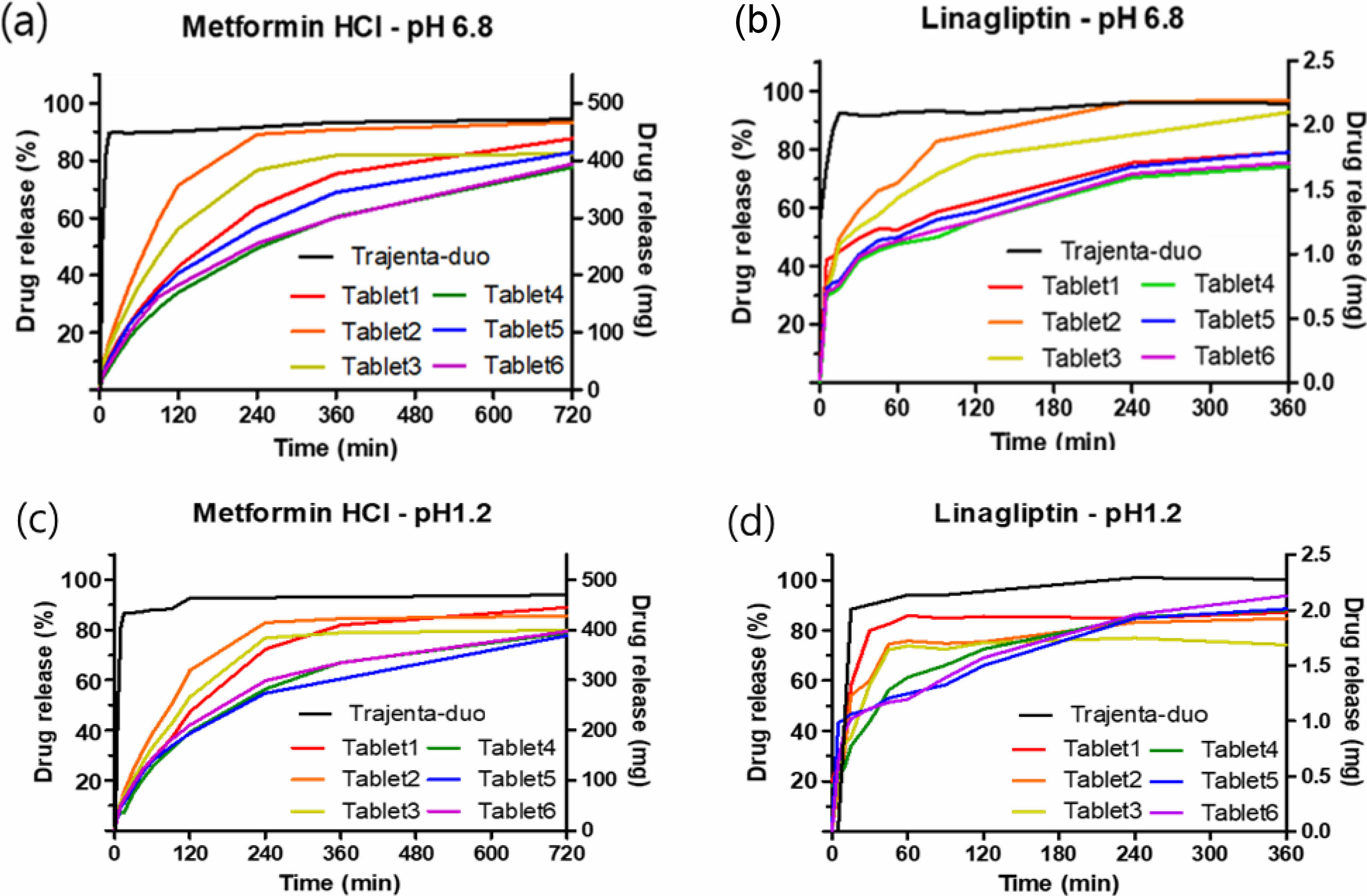
정제의 생체 외 방출거동.시판제인 트라젠타 듀오500/2.5® 및 고분자의 종류와 함량을 변수로 습식과립 제조방법에 의해 제조한 과립물로 삼중층 타정 후 USP시험법에 따라 제조된 용출액 pH 6.8으로 용출 시험한 결과를 Figure 4에 나타냈다. 메트포르민 염산염의 용출결과인 Figure 4(a)을 보면 pH 6 트라젠타 듀오 500/2.5®는 1시간 이내에 90% 이상의 용출률을 나타내는 반면,12 수용성 고분자와 원약물을 습식 과립공정을 통해 만든 정제들은 6시간 이후 약 60% 이상의 용출률을 나타내었다. 이는 수용성 고분자가 메트포르민 염산염의 빠른 용출을 방지해 서방형 방출을 유도하는 것을 확인하였다. 그 중, Carbopol 940이 함유된 Tablet 4, 5, 6의 방출 패턴이 더 지속적인 방출 패턴을 보이고 있음을 확인하였다. 리나글립틴의 용출 결과 또한 트라젠타 듀오500/2.5®보다 습식 과립공정을 통해 만든 정제들에서의 약물 방출이 느려짐을 확인하였다. 종합해볼 때 모든 정제들이 시판제인 트라젠타 듀오500/2.5®와 비교했을 때 더 느린 약물 방출 양상을 보임로써 서방형 용출패턴을 보여주고 있다.
|
Figure 2 FTIR spectra of (a) API, polymers, excipient; (b) glanules. |
|
Figure 3 X-ray diffraction patterns of (a) API, polymers, excipient, disintegrant, binder; (b) glanules. |
|
Figure 4 In vitro dissolution profile of metformin HCl and linagliptin of Trajenta duo 500/2.5® and tablets 1-6 at pH 6.8 and 1.2. |
본 연구는 메트포르민 염산염과 리나글립틴의 빠른 방출을 지연해 아시아인들에 맞는 고혈압 치료제 개발을 위해 수용성 고분자를 사용하여 습식과립법으로 삼중층 정제를 제조하였다.
FTIR을 통하여 공정과정 중 원료의약품들이 다른 부형제들과 물리∙화학적 상호작용이 없다는 것을 확인하였고 XRD를 통해서 원료의약품이 고유 결정성을 잃은 것으로 포접을 확인하였는데, 특히 PEO의 점도가 높을수록, 카보머가 존재할수록 효과적인 포접이 이루어졌음을 확인하였다.
습식과립 공정법으로 제조된 과립물들은 Hausner ratio와 Carr’s index평가에 의하여 모두 excellent 등급을 갖는 것을 확인하였다. 이는 원료의약품의 낮은 흐름성을 개선시킨 것으로 입자간의 상호 작용이 감소하여 공정상 다양한 이점을 갖는다.
마지막으로 삼중층 정제의 생체 외 용출시험을 통하여 메트포르민 염산염의 용출률이 6시간 이후 약 60% 이상이며 12시간 이후에는 약 80% 이상이었다. 특히, Carbopol 940이 함유된 배치인 Tablet 4, 5, 6의 경우에는 지속적이고 긴 용출패턴을 갖는 것을 확인할 수 있었다. 이 또한 Carbopol 940의 존재로 인해 약물의 서방출이 유도되는 것으로 사료된다. 따라서 메트포르민 염산염의 빠른 방출을 지연하고 리나글립틴과 병용하여 기존 제제에 비해 아시아인에 더 효과적인 T2DM 치료제로 개발할 수 있음을 확인하였다.
- 1. Inzucchi, S. E.; Bergenstal, R. M.; Buse, J. B.; Diamant, M.; Ferrannini, E.; Nauck, M.; Matthews, D. R. Medical Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy: A Consensus Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009, 32, 193-203.
-

- 2. Li, X.; Zhang, Q.; Zhou, X.; Guo, S.; Jiang, S.; Zhang, Y.; Liao, L. The Different Hypoglycemic Effects Between East Asian and Non-Asian Type 2 Diabetes Patients when Treated with SGLT-2 Inhibitors as an add-on Treatment for Metformin: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Aging 2021, 13, 12748
-

- 3. Zinman, B., Initial Combination Therapy for Type 2 Diabetes Mellitus: Is It Ready for Prime Time? Am. J. Med. 2011, 124, S19-S34.
-

- 4. Boer, G. A.; Holst, J. J. Incretin Hormones and Type 2 Diabetes-Mechanistic Insights and Therapeutic Approaches. Biology 2020, 9, 473.
-

- 5. Liu, S. C.; Lee, C. C.; Chuang, S. M.; Sun, F. J.; Zeng, Y. H. Comparison of Efficacy and Safety of Empagliflozin vs Linagliptin Added to Premixed Insulin in Patients with Uncontrolled Type 2 Diabetes: A Randomized, Open-label Study. Diabetes & Metabolism 2021, 47, 101184.
-

- 6. Hadi, M. A.; Babu, V. L.; Pal, N. Formulation and Evaluation of Sustained Release Matrix Tablets of Glimepiride Based on Combination of Hydrophilic and Hydrophobic Polymers. J. Appl. Pharm. Sci. 2012, 2, 101-107.
-

- 7. Deb, P. K.; Kokaz, S. F.; Abed, S. N.; Paradkar, A.; Tekade, R. K. Pharmaceutical and Biomedical Applications of Polymers. In Basic Fundamentals of Drug Delivery. Elsevier: Amsterdam, 2019; pp 203-267.
- 8. Shanmugam, S. Granulation Techniques and Technologies: Recent Progresses. BioImpacts: BI 2015, 5, 55.
-

- 9. Hansen, J.; Kleinebudde, P. Improving Flowability and Reducing Storage Agglomeration of Metformin Hydrochloride Through QESD Crystallization. Eur. J. Pharm. Biopharm. 2021, 159, 170-176.
-

- 10. Gumieniczek, A.; Berecka-Rycerz, A.; Mroczek, T.; Wojtanowski, K. Determination of Chemical Stability of Two Oral Antidiabetics, Metformin and Repaglinide in the Solid State and Solutions Using LC-UV, LC-MS, and FT-IR Methods. Molecules 2019, 24, 4430.
-

- 11. Ozeki, T.; Yuasa, H.; Kanaya, Y. Controlled Release from Solid Dispersion Composed of Poly(ethylene oxide)-Carbopol® Interpolymer Complex with Various Cross-Linking Degrees of Carbopol®. J. Control. Release 2000, 63, 287-295.
-

- 12. Fliszar, K. A.; Foster, N. Examination of Metformin Hydrochloride in a Continuous Dissolution/HDM System. Int. J. Pharm. 2008, 351, 127-132.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(2): 159-164
Published online Mar 25, 2022
- 10.7317/pk.2022.46.2.159
- Received on Oct 13, 2021
- Revised on Dec 7, 2021
- Accepted on Dec 14, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
*Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of Polymer Nano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea - E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.