- Preparation and Gene Silencing Efficiency of Chitosan-based siRNA Nano-carriers
Eunsun Lee*, **, Wheemoon Cho*, Jae Ho Lee***, Sang Jun Park*, Yong-Hee Kim**, and Chun-Ho Kim*,†

*Laboratory of Tissue Engineering, Korea Institute of Radiological and Medical Science, 75, Nowon-gil, Nowon-gu, Seoul 01812, Korea
**Department of Bioengineering, Institute for Bioengineering and Biopharmaceutical Research, Hanyang University, 222, Wangsimni-ro, Seongdong-gu, Seoul 04763, Korea
***Research Institute for Molecular-Targeted Drugs, Konkuk Institute of Technology, Konkuk University, 120, Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea- 키토산 기반 siRNA 나노전달체 제조 및 유전자 억제 효율
*한국원자력의학원 방사선의학연구소, **한양대학교 공과대학 생명공학과, ***건국대학교 질병분자표적신약연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
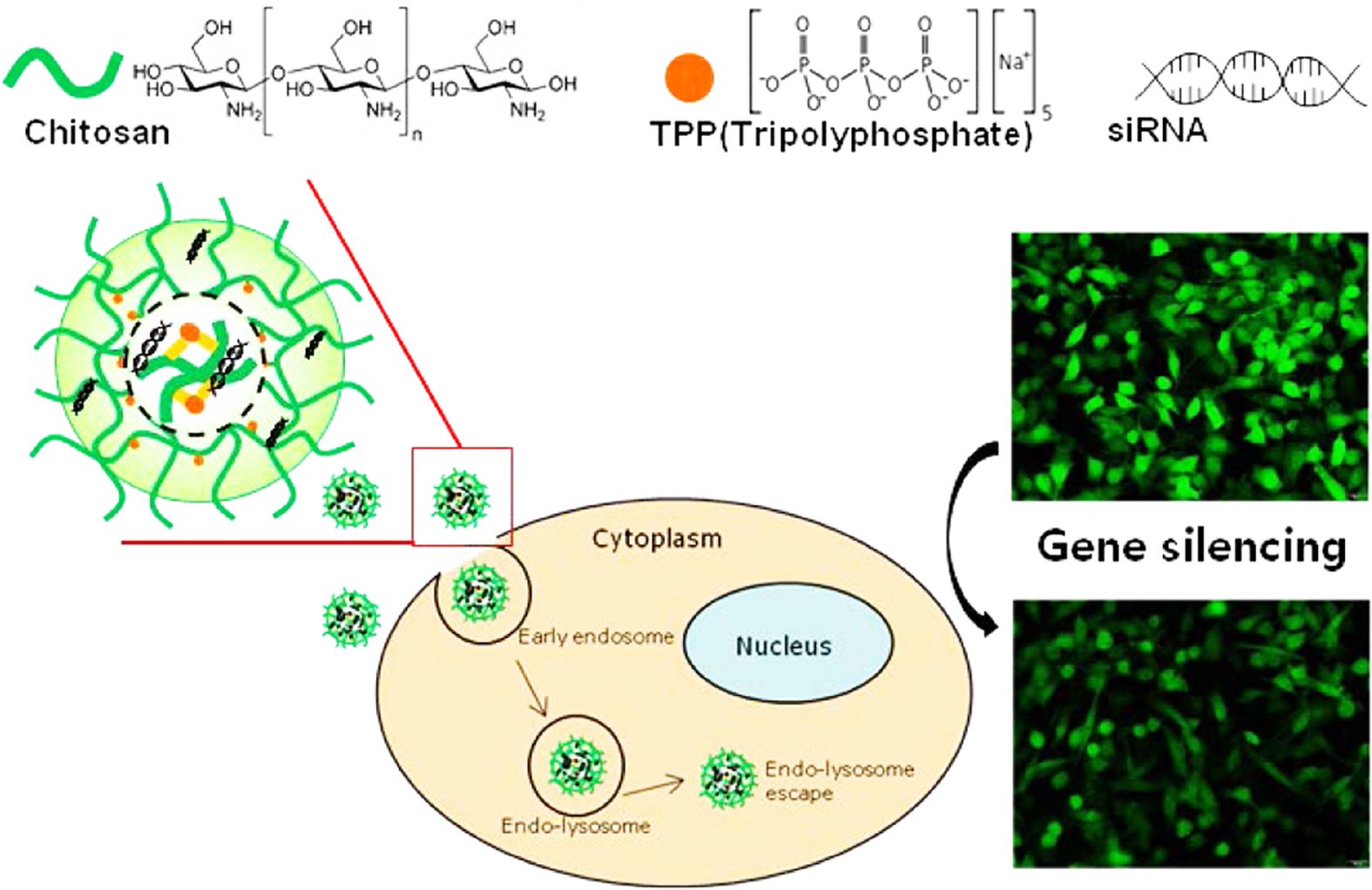
This study is to prepare chitosan-based siRNA nano-carriers (Chi-TPP-siRNA) using ionic gelation between cationic chitosan and anionic tripolyphosphate (TPP) for delivery of siRNA to cytoplasm. We studied the effect of the molecular weight of chitosan and the mole ratio of chitosan/TPP on the physicochemical properties of Chi-TPP nanoparticles by using dynamic light scattering and electron microscopy. The siRNA encapsulation was evaluated by using electrophoresis. The biological properties of Chi-TPP-siRNA on MDA-MB-231 cells were evaluated by using confocal laser microscopy. The resulting Chi-TPP-siRNAs, using control siRNA, were formed in sphere shape. The diameter and the PdI value of Chi-TPP-siRNA were 223.5 nm and 0.229, respectively. The cell viability of Chi-TPP-siRNA at the concentration of 500 μg/mL was above 88%. Green fluorescent protein (GFP) silencing effect of Chi-TPP-siGFP was evaluated to be 48.1%. In conclusion, the biocompatible nano-carrier, Chi-TPP-siRNA, could be used in various gene therapy.
세포질로의 siRNA 전달을 위해, 본 연구는 양이온성의 키토산과 음이온성인 tripolyphosphate(TPP)의 이온결합을 이용하여 유전자 나노전달체(Chi-TPP-siRNA)를 제조하였다. 키토산의 분자량 및 키토산과 TPP의 몰비에 따른 나노입자(Chi-TPP)의 물리화학적 특성을 동적광산란기(DLS)와 전자 현미경(EM)으로 확인하였다. siRNA 담지 효과는 전기영동으로 확인하였다. MDA-MB-231에 대한 나노전달체의 생물학적 특성을 공초점현미경으로 확인하였다. 모델 siRNA 담지 Chi-TPP-siRNA 나노전달체는 직경과 다분산도가 각각 223.5 nm, 0.229인 구형으로 형성되었다. 나노전달체 처리군(500 μg/mL)에서의 세포 생존율은 88% 이상이었다. siGFP를 담지한 나노전달체(Chi-TPP-siGFP)는 48.1%의 green fluorescent protein(GFP) 유전자 억제 효율을 보였다. 결과적으로 생체친화성의 Chi-TPP-siRNA 나노전달체는 다양한 유전자 치료에 이용될 수 있다.
Chitosan-based siRNA nano-carriers (Chi-TPP-siRNA) carriers were prepared using cationic chitosan and anionic tripolyphosphate (TPP) and siRNA. The biocompatibilities of Chi-TPP-siRNA carriers were confirmed using MDA-MB-231 breast cancer cell line.
Keywords: molecular weight of chitosan, tripolyphosphate, siRNA carrier, monodispersity.
본 연구는 과학기술정보통신부의 첨단방사선융합 치료기술 개발(방사선 감응 미세환경추적 나노약물전달체 개발, NRF-2020M2D9A3094178), KIRAMS(방사선 반응제어 의생명연구, 50531-2021) 연구결과로 이에 감사 드립니다.
유전자 치료는 질병의 치료에 요구되는 단백질을 생성 또는 억제하는 유전자를 세포 내로 이입하여 질병을 치료하는 방법이다.1,2 그 중에서도 RNA 간섭(RNA interference, RNAi)는 21-23개의 뉴클레오타이드가 결합된 double-stranded small interfering RNA(siRNA)를 이용하여 messenger RNA (mRNA)를 분해하고, 질병을 일으키는 단백질의 발현 정도를 낮춰 질병을 치료하는 기술이다.3,4 이러한 RNAi 분야는 이론적으로 모든 유전자의 발현을 억제시킬 수 있기 때문에 기존의 약물 치료가 어려웠던 질병에 대해 다른 치료 기술보다 훨씬 더 큰 잠재력을 지닌다.5 RNAi 치료 기술은 다양한 질병의 치료에 효과적인 적용이 가능함에도 불구하고, siRNA의 생체 내 불안정성, 전달의 비효율성 등의 문제점으로 인해 치료제로서의 개발이 제한 받고 있는 상황이다.6
이러한 문제점을 해결하기 위하여 양이온성 인지질이나 생체 고분자를 이용하여 siRNA를 세포 내로 전달하는 연구가 다수 이루어지고 있다.6,7 그 중에서도 양이온성 고분자인 polyethylenimine(PEI), poly-L-lysine(PLL) 및 키토산 등이 제안되고 있다.8-10 이러한 양이온성 고분자는 음이온성 siRNA와 이온결합이 가능하고, 혈중 존재하는 RNase로부터 siRNA를 보호하는 역할을 한다.11,12 또한 세포막과 정전기성 상호작용을 통해 효과적인 세포 내 이입이 가능하다.4,10,13
특히 양이온성 고분자 중에서도 키틴의 탈아세틸화물인 키토산은, N-acetyl-D-glucosamine과 D-glucosamine의 공중합체이다.14-17 키토산은 생분해성, 생체 적합성, 항균성, 지혈능 등을 지닌 천연 고분자 물질로,18-22 중성 조건에서는 녹지 않지만, 약산성 조건에서는 D-glucosamine group이 양전하를 띄면서 용해된다.23-26 따라서 키토산과 siRNA와의 정전기적 결합을 이용한 전달체가 보고되었지만,24,27 키토산/siRNA 복합체는 생리학적 pH 조건에서의 낮은 용해도 및 전달 효율을28 갖기 때문에, 이를 해결하기 위하여 키토산 유도체29-32 및 PEGylation33 등을 이용한 연구가 현재까지 보고되고 있다.34 하지만 이러한 키토산 유도체의 구조와 생리 활성 사이의 관계가 불명확하다는 한계점이 있기 때문에,8 키토산과 siRNA 사이의 직접적인 정전기적 상호작용을 조절할 수 있는 tripolyphosphate(TPP) 또는 disulfide 등과 같은 이온성 가교제를 이용하여 세포 적합성을 가지는 siRNA 전달체로 활용하려는 연구가 다수 보고되고 있다.1,35 Katas 등은 CHO K1 세포의 생존율이 약 60-70%인 수용성 키토산-TPP 나노입자를 보고하였고,34 Rafa 등은 가교제 종류에 따라 DLD-1 세포의 생존율이 약 75-85%로 다소 개선됨을 보고하였지만, 제조된 siRNA 담지 키토산 나노입자의 분산도가 0.3 이상으로,35 아직 해결해야 할 문제가 남아있다.
이를 위해 본 연구에서는 먼저 키토산의 분자량 및 음이온성 가교제인 TPP와의 몰비에 따른 키토산 기반 나노입자의 분산성을 확인한 다음, siRNA가 도입된 키토산 기반의 siRNA 전달체의 물리화학적 특성을 분석하였다. 또한 유방암 치료 연구에서 널리 이용되는 삼중 음성 유방암 세포주인 MDA-MB-23136,37을 대상으로 세포친화성 및 유전자 억제 효율 등으로 나노전달체의 생물학적 특성을 평가하였다.
시약 및 재료.키토산 (Chi; 점도=80 cps. 탈아세틸화도=98%)은 Ara-bio(Korea)에서 구매하였으며, Tripolyphosphate (TPP)는 Merck(Germany)에서 구매하였다. 실험에 이용한 siRNA는 Bioneer(Korea)에서 구매하였으며, 총 3종류이다. siRNA 담지 여부 확인에 이용한 siRNA는 Bioneer에서 판매되는 control siRNA이며, green fluorescent protein(GFP) 유전자 억제 실험에 이용한 siGFP의 시퀀스는 다음과 같다. Sense: 5’-AAG CUG ACC CUG AAG UUC AUC-3’, 및 antisense: 5’-GAU GAA CUU CAG GGU CAG CUU-3’. 세포 내 이입을 확인하기 위한 siRNA는 5번 말단에 형광물질이 표지된 siRNAFITC (fluorescein-labeled 5’ sense strand)를 이용하였다. 실험에 이용한 MDA-MB-231 세포는 American Type Culture Collection (ATCC, USA)에서 구매하였으며, 세포 실험에 이용되는 Roswell Park Memorial Institute Medium 1640(RPMI 1640), fetal bovine serum(FBS), 및 antibiotic antimycotic solution(penicillin/streptomycin, P/S)는 Welgene (USA)에서 구매하여 이용하였다.
Chi-TPP-siRNA 나노전달체 제조.키토산은 1% 아세트산에 1 mg/mL 농도로 용해한 후, Ultra cell(Sonics, USA)을 이용한 초음파처리를 통해 점도를 조절하였으며, 조절된 키토산의 점도는 AR 2000ex(TA instruments, USA)을 이용하여 확인하였다. 초음파 처리는 ice bath 하에서 진행하였으며, pulse는 on/off=1/1 sec으로 진행하였다.
점도가 조절된 키토산을 1% 아세트산에 1 mg/mL 농도로 용해하여 준비하고, TPP를 증류수에 0.45, 0.90, 1.35, 1.80, 및 2.25 mg/mL의 농도로 용해하였다. 준비한 TPP 수용액 4 mL을 상온에서 10 mL의 키토산 용액에 천천히 떨어트리며 700 rpm으로 1시간 동안 magnetic stirrer을 이용해 교반하여 Chi-TPP 나노입자를 제조하였다. 제조된 Chi-TPP 나노입자는 4 oC에서 20000 g로 15분간 원심 분리하여 상층액을 제거하고 증류수에 10 mg/mL 농도로 분산시켜 수득하였다.
Chi-TPP-siRNA 나노전달체의 경우, TPP 수용액 4 mL에 siRNA를 50, 75, 및 100 nmol 첨가하였으며 위와 같은 방법으로 제조하였다.
Chi-TPP-siRNA 나노전달체의 동역학분석 및 전자현미경 확인.제조한 Chi-TPP-siRNA 나노전달체를 증류수에 0.1 mg/mL 농도로 희석하여 입자의 크기, 분산도 및 표면전하를 동적광산란 분석기인 zetasizer(Nano ZS, Malvern, UK)를 이용하여 측정하였다.
Chi-TPP-siRNA 나노전달체의 형태를 확인하기 위하여 1 mg/mL로 증류수에 분산한 나노전달체를 carbon coating grid (TED PELLA, USA)에 20 μL 떨어트린 후, 20분간 상온에서 건조시켜 시료를 준비하였다. 준비한 시료를 투과주사현미경(TEM)인 JEM1010(JEOL, USA)를 이용하여 관찰하였으며, 전자주사현미경(SEM)의 경우에는 SPT20(COXEM, Korea) gold coating 장비를 이용하여 준비한 시료의 gold coating을 진행한 후, Chi-TPP-siRNA 나노전달체의 형태를 CX-200TM(COXEM, Korea)으로 관찰하였다.
Chi-TPP-siRNA 나노전달체의 siRNA 담지 효율 확인.Chi-TPP-siRNA 나노전달체(10 mg/mL) 10 μL에 6Х loading dye(Thermo scientific, USA) 2 μL를 혼합한다. 이 혼합액을 1% 아가로오스 젤(Bio-Rad, USA)을 이용하여 0.5Х TAE 버퍼 하에서 100 V로 20분간 전기영동을 진행한다(Invitrogen, USA). 전기영동을 끝난 후, 젤을 TopRed nucleic acid (Biopure, Korea)를 사용하여 염색하고, UV-illumination sys tem (Thermo scientific, USA)을 이용하여 젤에 존재하는 siRNA를 감지하였다.
세포 배양.유방암 세포주인 MDA-MB-231를 10%(v/v) FBS와 1%(v/v) P/S가 첨가된 RPMI 1640로 배양하여 37 oC, 5% CO2 환경을 유지하며 실험에 이용하였다.
세포 생존율 확인.MDA-MB-231 세포를 6.4 mm 96 well plates(Corning, USA)에 2×104 cells/well 농도로 접종하고, 37 oC, 5% CO2 배양기에서 24시간 배양하였다. 그 후, 배지에 분산한 Chi-TPP-siRNA 나노전달체를 50-500 μg/mL 농도로 처리하여 배양기에서 24시간 배양하였다. 나노전달체의 세포 생존율 평가를 위한 비교군으로는 Lipofectamine2000 (Lipo2000; ThermoFisher, USA)을 이용하였다. 이후 10 μL의 CCK-8 reagent(Dogen, Korea)를 처리하고 4시간 추가 배양하고, Chi-TPP-siRNA 나노전달체의 독성 여부를 UV-vis spectroscopy(SpectraMax M2e, USA)를 이용하여 확인하였다.
세포 내 이입 확인.MDA-MB-231 세포를 25 mm 6 well plates(Corning, USA)에 1×106 cells/well 농도로 접종하고, 37 oC, 5% CO2 배양기에서 24시간 배양하였다. 그 후, 배지에 분산한 Chi-TPP-siRNAFITC 나노전달체를 50, 100 μg/mL 농도로 처리하여 배양기에서 4시간 배양하고, LysoTracker (Thermofisher, USA)를 50 nM 농도로 처리하고 배양기에서 30분간 추가 배양하였다. 이후 4% p-formaldehyde를 이용하여 고정하고, DAPI(Vectashield, VECTOR Lab., USA)를 이용하여 핵을 염색하였다. 이를 공초점현미경(LSM880, ZEISS, Germany)을 이용하여 Chi-TPP-siRNA 나노전달체의 세포 내 이입 여부를 확인하였다.
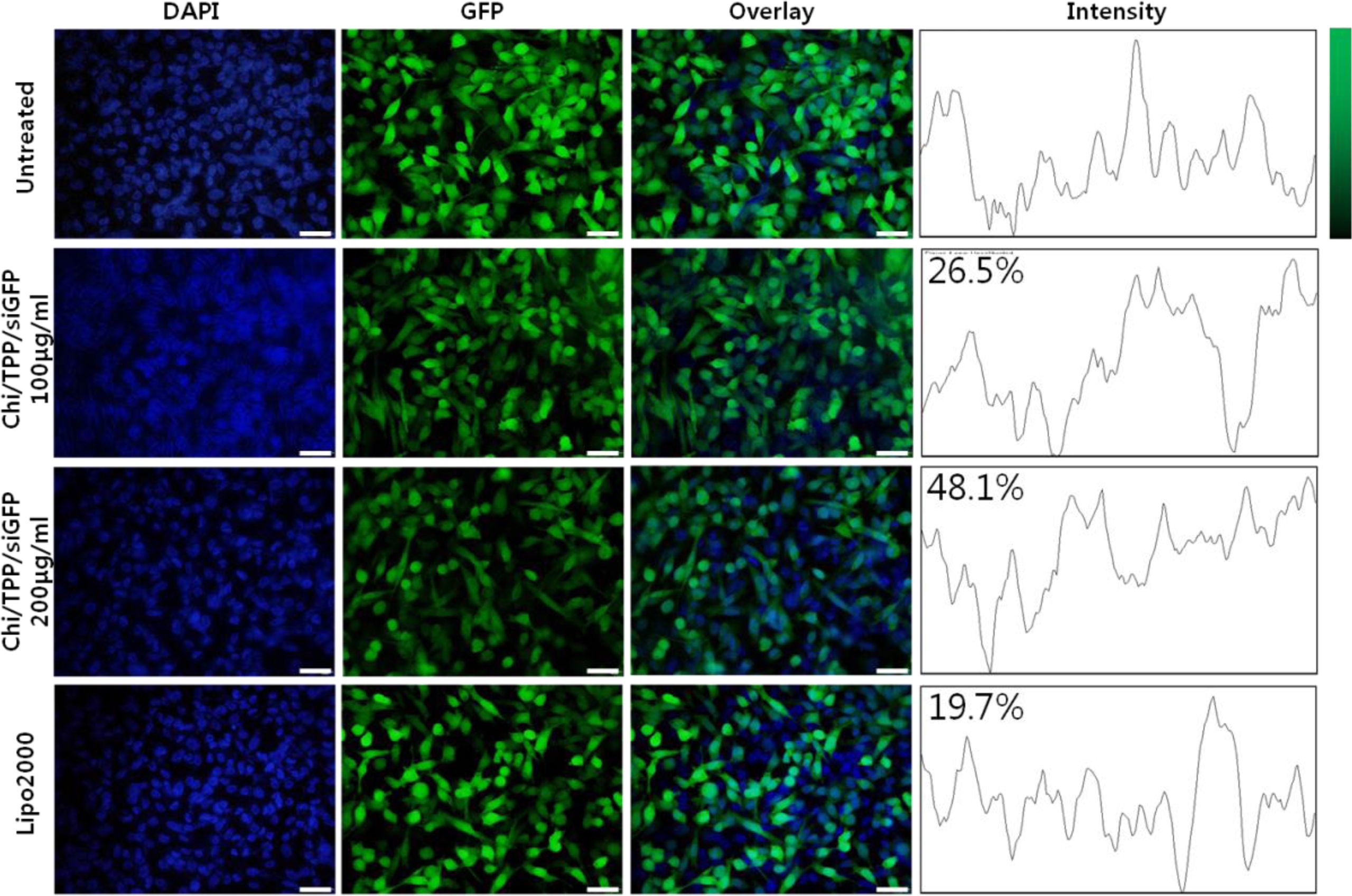
유전자 억제 효율 확인.GFP가 발현을 유도하는 pEGFP-N1(Takara, Japan)을 유전자 전달체인 Lipofectamine 3000 (ThermoFisher, USA)과 결합하여 MDA-MB-231 세포주에 처리하였다. pEGFP-N1의 세포 내 이입이 일어나지 않은 세포를 제거하기 위하여, 항생제의 일종인 G418(ThermoFisher, USA)을 200 μg/mL 농도로 첨가한 배지를 이용하여 14일간 배양하였다. 최종적으로 GFP가 발현된(MDA-MB-231/GFP) 세포주를 FACSAria III Cell Shorter(BD bioscience, USA)를 이용하여 선별하여 수득하였다.
MDA-MB-231/GFP 세포주를 25 mm 6 well plates(Corning, USA)에 1×106 cells/well 농도로 접종하고, 37 oC, 5% CO2 배양기에서 24시간 배양하였다. 그 후, 배지에 분산한 Chi-TPP-siGFP 나노전달체를 100, 200 μg/mL 농도로 처리하였으며, 대조군으로 Lipo2000을 처리하였다. 나노전달체 또는 Lipo2000이 처리된 세포를 배양기에서 24시간 배양하고, 4% p-formaldehyde를 이용하여 고정한 후 DAPI를 이용하여 핵을 염색하였다. 이후 Chi-TPP-siGFP 나노전달체의 GFP 발현 억제 효율을 공초점 현미경을 이용하여 확인하였으며, Image J를 이용하여 GFP의 발현 정도를 정량화하였다.
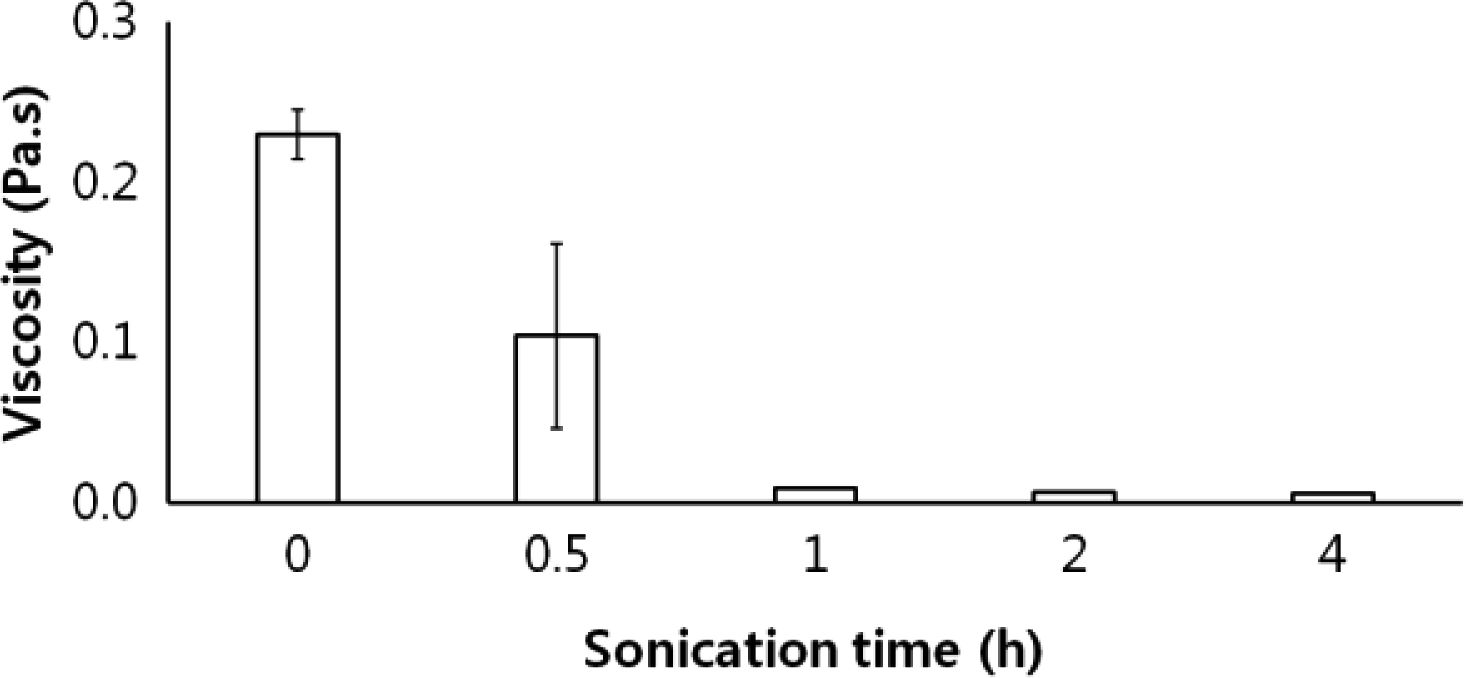
Chi-TPP 나노전달체 및 Chi-TPP-siRNA 나노전달체의 크기 및 형태 확인.키토산 기반의 나노입자 제조에 있어서 형태학적 성질과 단분산도는 키토산의 구조적인 성질, 특히 분자량, 탈아세틸화도 및 가교제의 농도에 영향을 받는 것으로 알려져 있다.34,35,38,39 본 연구에서는 키토산의 점도 및 TPP의 농도에 따른 Chi-TPP 나노입자의 특성을 먼저 확인하였다(Figure 1, Table 1). 키토산의 점도는 초음파 처리 시간에 따른 점성도 변화로 확인하였다. 초음파 처리하지 않은 키토산의 점도는 약 230 mPa·s로 측정되었으며, 초음파 처리 시간에 따라 키토산의 점도는 감소하는 것을 확인하였다. 키토산의 점도는 30분 초음파 처리를 하였을 때에 약 104 mPa·s로 감소하였으며, 1시간 이상 초음파 처리를 하였을 때에는 10 mPa·s 이하로 측정되었다. 초음파 처리 1시간 이후에는 점도의 차이가 크지 않기 때문에 1시간을 최적 초음파 처리 시간으로 선정하였다. 이 결과에 따라 본 실험에서는 1시간 초음파 처리 후 점도를 확인하고, 점도가 10 mPa·s 이하인 키토산을 이용하여 나노입자를 제조하였다.
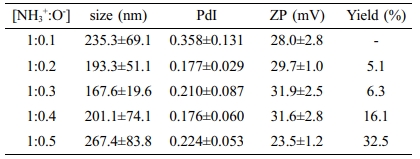
위의 초음파 처리한 키토산과 5가지 다른 농도의 TPP를 이용하여 Chi-TPP 나노입자를 제조하였으며 그 농도는 키토산의 아민그룹(NH3+)과 TPP의 수산화그룹(O-)의 비율에 따라 결정하였다(Table 1). TPP 농도가 높아질수록 전체적으로 나노입자의 크기가 작아지는 경향을 보이지만 키토산과 TPP의 비율이 [NH3+: O-]=1:0.5의 경우에는 나노입자의 응집이 일어나며 입자의 크기가 커지는 것을 확인하였다. 또한 표면전하인 zeta-potential의 경우에도 [NH3+: O-]=1:0.5에서 현저히 낮아지는 것을 확인할 수 있었다. 반면 나노입자의 단분산도를 나타내는 지표인 PdI 값은 [NH3+: O-]=1:0.2 이상의 비율에서는 0.3 이하로 단분산성 나노입자가 수득됨을 확인하였으며, [NH3+: O-]=1:0.4 이상일 경우, 16%의 수득률을 보였다. 이와 같은 특징을 고려하여 단분산도 및 높은 수득률을 갖는 제조 조건인 [NH3+: O-]=1:0.4의 조건을 최적 조건으로 선정하였다.
상기 조건을 기반으로 siRNA가 담지된 Chi-TPP-siRNA 나노전달체를 제조하고 나노전달체의 특성을 확인하였다(Figure 2). Chi-TPP-siRNA 나노전달체의 크기는 약 223.5 nm 정도로 형성되었으며, 분산도는 0.229로 단분산성을 확인하였다. 또한 나노전달체의 zeta-potential은 31.2 mV를 갖는 것을 확인하였다. 또한 Chi-TPP-siRNA 나노전달체의 형태를 TEM과 SEM을 이용하여 균일한 구의 형태를 갖는 것을 확인하였다.
Chi-TPP-siRNA 나노전달체의 siRNA 담지 효율확인.Chi-TPP 나노입자와 siRNA 사이의 상호작용을 확인하기 위하여 키토산의 amine 부분과 siRNA의 phosphate 기의 비율인 N:P ratio를 300:1, 450:1, 600:1이 되도록 siRNA을 담지 하였으며, 담지 여부를 전기영동을 이용하여 확인하였다. Figure 3의 전기영동 결과를 보면, Chi-TPP-siRNA 나노전달체가 아가로오스 젤의 담지 부분에서 확인되는데, 이는 siRNA가 안정적으로 Chi-TPP 나노입자에 담지되어 있음을 의미한다. siRNA의 양이 늘어날수록 발현되는 밴드의 강도가 강해지는 것을 통해 siRNA가 안정적으로 나노전달체에 담지 되었음을 알 수 있다. 반면 음성 대조군으로 이용한 Chi-TPP 나노입자에서는 band가 나타나지 않는 것으로 보아 siRNA가 특이적으로 나타남을 확인하였다. 결과적으로 소량의 나노전달체를 이용하여 다량의 siRNA 전달하기 위하여 N:P=300:1의 비율이 최적임을 확인하였으며 이는 본 연구에서 제조한 Chi-TPP 나노입자의 siRNA 전달체로써의 이용 가능성 보여주었다.
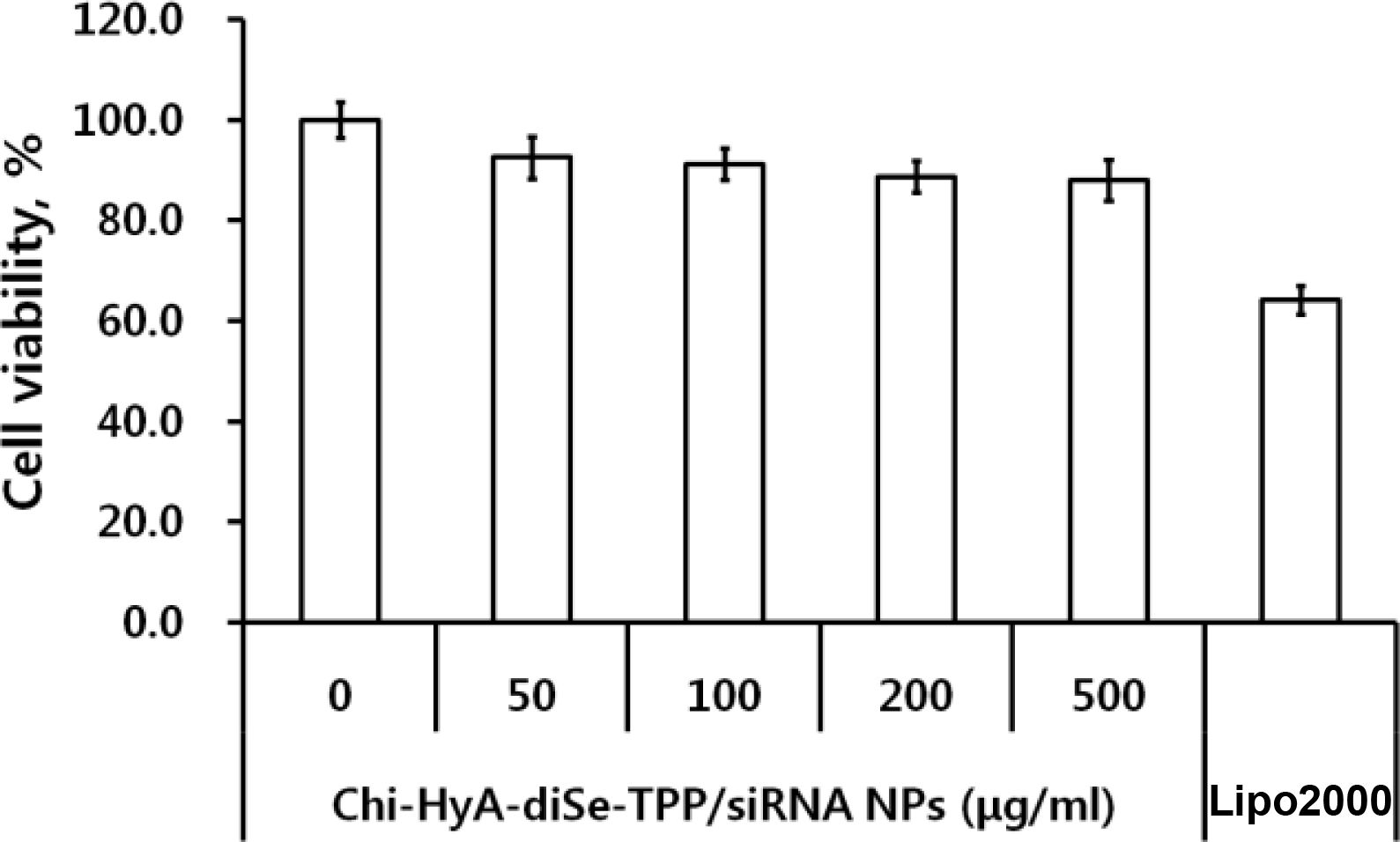
Chi-TPP-siRNA 나노전달체의 세포 생존율 확인. Chi-TPP-siRNA 나노전달체 제조에 이용된 키토산, siRNA는 독성이 없는 물질로 이미 알려져는 반면,40 TPP의 경우 단독으로 이용했을 경우, 0.39 mg/mL 이상의 농도에서 세포 독성이 나타난다.41 하지만 본 논문에서 제조한 Chi-TPP-siRNA 나노전달체는 500 μg에 함유되어 있는 TPP의 양이 0.06 mg 수준이다. 이러한 소량의 TPP가 함유된 Chi-TPP-siRNA 나노전달체의 세포 안전성 확인을 위하여 Chi-TPP-siRNA 나노전달체를 MDA-MB-231 세포에 처리한 후 세포 미토콘드리아의 활성을 CCK-8 assay를 통해 확인하였다. Figure 4 결과를 보면, Chi-TPP-siRNA 나노전달체를 50, 100, 200 및 500 μg/mL 농도로 처리하였을 때, 세포 생존율이 각각 92.5, 91.2, 88.7 및 88.1%로 나타났으며, 이는 비교군으로 이용한 Lipo2000의 세포 생존율을 64.2%인 것과 비교하였을 때 모두 1.4배 이상 높은 수치이다. 이러한 결과는 본 연구에서 제조한 Chi-TPP-siRNA 나노전달체의 생체 적합성을 나타내며 이는 화학적 항암 요법에 있어 부작용 감소와 적용가능성을 시사한다.
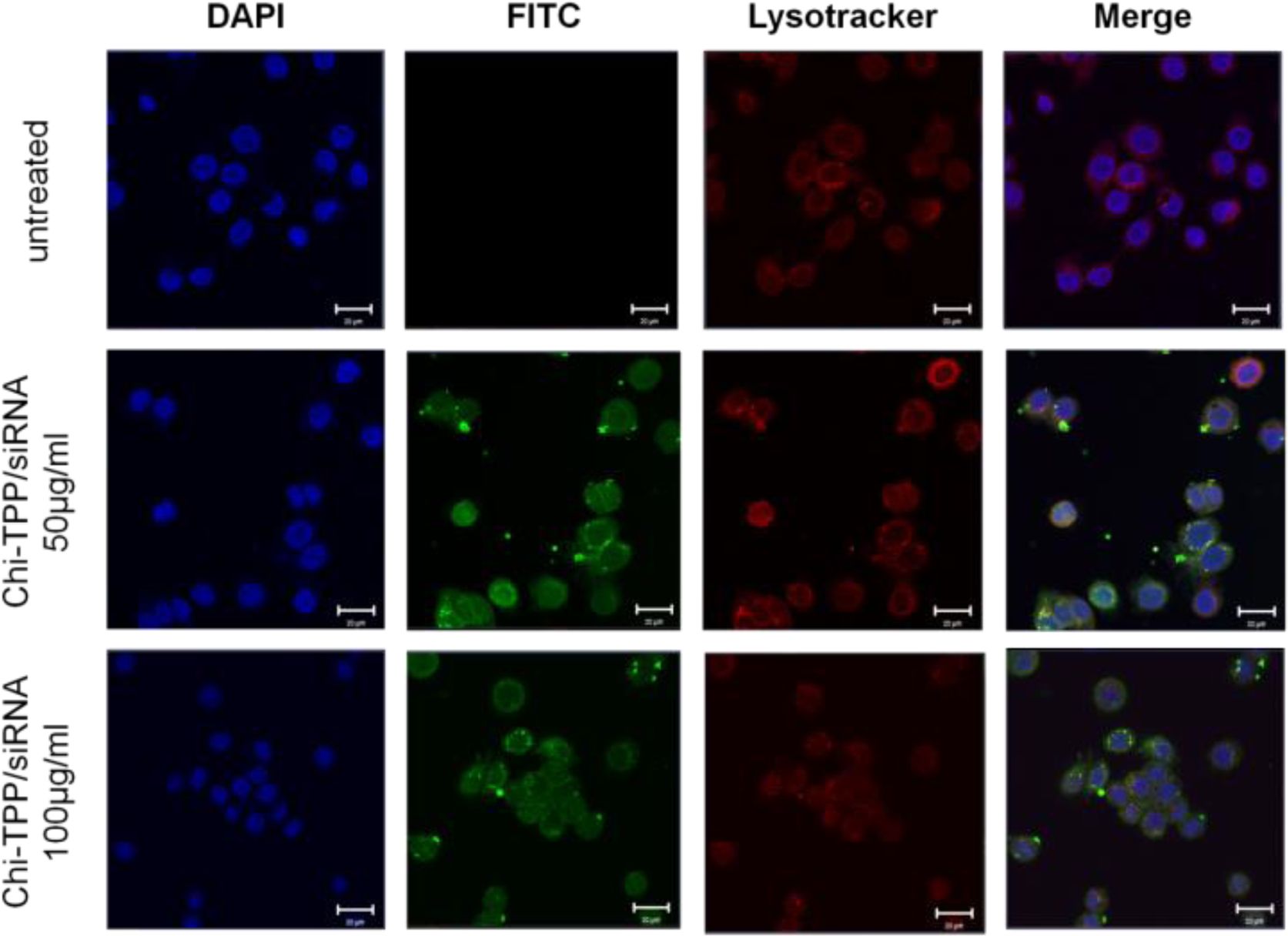
Chi-TPP-siRNA 나노전달체의 세포 내 이입 확인.Chi-TPP-siRNA 나노전달체의 세포 내 이입을 확인하기 위하여 siRNA의 말단에 FITC 형광이 결합되어 있는 siRNAFITC를 이용한 Chi-TPP-siRNAFITC 나노전달체를 제조하였다. 제조된 나노전달체를 세포 생존율 결과에 기인하여 90% 이상의 생존율을 보이는 50 μg/mL과 100 μg/mL 농도로 MDA-MB-231 세포주에 처리한 후, 세포 내 이입을 공초점현미경을 이용하여 확인하였다. Figure 5의 결과를 보면, Chi-TPP-siRNAFITC 나노전달체는 녹색형광으로 나타나며 세포의 라이소좀은 적색형광으로 나타난다. 나노전달체를 처리하지 않은 군은 녹색 형광이 나타나지 않고, 적색 형광이 세포질 전체에 고르게 분포하는 것으로 보아 라이소좀의 염색이 제대로 되었음을 알 수 있다. 또한 Chi-TPP-siRNAFITC 나노전달체를 처리한 군에서는 녹색 형광과 적색형광이 같은 위치에 나타나는 것으로 보아 나노전달체가 세포 내에 효율적으로 이입된 것을 알 수 있으며, 이는 나노전달체의 농도가 50 μg/mL일 때보다 100 μg/mL 일 때 더욱 많은 부분에서 나타나는 것으로 보아 나노전달체의 농도에 비례하여 세포 내 이입이 늘어나는 것을 알 수 있다. 이러한 결과는 본 연구에서 제조한 Chi-TPP-siRNA 나노전달체는 세포 내 이입효율이 높고 이입효율은 나노전달체의 농도에 비례하였다.
Chi-TPP-siRNA 나노전달체의 유전자 억제 효율 확인.유방암 세포주인 MDA-MB-231에 대한 유전자 억제 효율은 GFP 억제 siRNA인 siGFP가 도입된 Chi-TPP-siGFP 나노전달체를 제조하여 농도에 따른 영향을 평가하여 Figure 6에 나타내었다. Figure 6(a)에서 FACSAria III Cell Shorter(BD bioscience, USA)를 이용하여 수득한 MDA-MB-231/GFP 세포주에서 GFP의 발현을 확인하였다. Figure 6(b), (c) 그리고 (d)에서 각각 Chi-TPP-siGFP 나노전달체(100 μg/mL와 200 μg/mL) 및 200 μg/mL의 Chi-TPP-siGFP 나노전달체 중에 함유되어 있는 siGFP와 동일 siRNA 농도를 가지는 Lipo2000를 처리하여 이들의 GFP의 발현 정도를 비교 분석하였다. Image J를 이용하여 수치적으로 확인한 결과, 100 μg/mL의 나노전달체를 처리하였을 경우에는 GFP의 발현이 미처리군 대비 26.5% 억제되었다. 나노전달체를 200 μg/mL의 농도로 처리했을 때 48.1%의 GFP 유전자 억제 효율을 확인하였지만, 비교군으로 동일 siRNA 농도를 함유하고 있는 Lipo2000의 경우 19.7% 만이 억제됨을 확인할 수 있었다. 따라서, 본 연구를 통해 제조된 Chi-TPP-siGFP 나노전달체는 처리 농도가 증가됨에 따라 GFP 유전자 억제 효율이 증가되고, 상용화된 유전자 전달체인 Lipo2000에 비하여 2.4배 이상의 GFP 유전자 억제 효율을 확인하였다. 따라서, 본 연구를 통해 제조된 Chi-TPP-siRNA 나노전달체는 효율적으로 siRNA를 전달하여 유전자 억제 효율을 높일 수 있는 키토산 기반 siRNA 나노전달체임을 확인할 수 있었다.
|
Figure 1 Viscosity of chitosan according to sonicated time. |

|
Figure 2 Physical properties of Chi-TPP-siRNA carriers: (a) the size distribution; (b) SEM and TEM (inset) of Chi-TPP-siRNA carriers (SEM scale bar=1 μm; TEM scale bar=200 nm). |

|
Figure 3 The encapsulation of siRNA with Chi-TPP-siRNA carriers using 1% agarose gel: lane (a) Chi-TPP-siRNA carriers (N:P=300:1); lane (b) Chi-TPP-siRNA carriers (N:P=450:1); lane (c) Chi-TPP-siRNA carriers (siRNA N:P=600:1); lane (d) Chi-TPP carriers 20 μL. |
|
Figure 4 MDA-MB-231 cell viability after treatment with ChiTPP-siRNA carriers or lipofectamine 2000 (positive control) for 24 h. |
|
Figure 5 Cellular uptake of Chi-TPP-siRNA carriers into MDAMB-231 cells. Laser confocal microscopy was used to translocation of Chi-TPP-siRNAFITC (50 or 100 μg/mL) and Lysotracker (50 nM) (scale bar=10 μm). |
|
Figure 6 GFP knockdown of Chi-TPP-siGFP carriers (100 or 200 μg/mL) into GFP transgenic MDA-MB-231 using laser confocal microscopy (scale bar=100 μm). |
|
Table 1 Particles Size, PdI, Zeta-potential, and Yield of ChiTPP Nanoparticles Prepared at Different TPP Concentrations, (n=4) |
본 연구에서는 지금까지 키토산 나노입자의 문제점인 분산성 및 생체적합성을 개선하기 위해, Chi-TPP-siRNA 나노전달체의 제조 조건을 최적화하고 물리화학적 및 생물학적 특성을 분석하였다. 초음파를 이용하여 10 mPa·s 이하의 점도로 조절된 키토산과 이온결합되는 TPP 및 siRNA의 몰비는 각각 1:0.4의 [NH3+:O-] 및 300:1의 N:P ratio 조건에서 최적의 나노전달체를 제조할 수 있었다. 세포친화성이 88.1% 이상인 Chi-TPP-siRNA 나노전달체는 siRNA를 안정적으로 담지한 단분산성의 siRNA 나노전달체임을 확인하였다. Chi-TPP-siRNA 나노전달체의 MDA-MB-231 세포주 내 이입효과를 확인하였고, Chi-TPP-siGFP를 이용한 GFP 유전자 억제 효율은 Lipo2000 보다 2.4배 이상의 결과를 보였다. 결론적으로 본 연구를 통해 제조된 Chi-TPP-siRNA 나노전달체는 안전한 유전자 치료제로써의 가능성을 확인할 수 있었다.
- 1. Dehousse, V.; Garbacki, N.; Jaspart, S.; Castagne, D.; Piel, G.; Colige, A.; Evrard, B. Comparison of Chitosan/siRNA and Trimethylchitosan/siRNA Complexes Behaviour in vitro. Int. J. Biol. Macromol. 2010, 46, 342-349.
-

- 2. Han, J. H.; Han, S.; Jeong, I. S.; Cheon, S. H.; Kim, S. W. Minicircle‐based GCP‐2 ex vivo Gene Therapy Enhanced the Reepithelialization and Angiogenic Capacity. J. Tissue Eng. Regen. M. 2020, 14, 829-839.
-

- 3. Lee, J. E.; Lee, K.; Nam, J. A.; Kim, A.; Lee, S. Y.; Lee, M. S.; Kim, N. W.; Yin, Y.; Park, J. W.; Park, S. Y. Cellular Delivery of siRNA Using Poly(2-dimethylaminoethyl methacrylate)-Function- alized Graphene Oxide Nano-Wrap. Macromol. Res. 2018, 26, 1115-1122.
-

- 4. Jayakumar, R.; Chennazhi, K.; Muzzarelli, R.; Tamura, H.; Nair, S.; Selvamurugan, N. Chitosan Conjugated DNA Nanoparticles in Gene Therapy. Carbohyd. Polym. 2010, 79, 1-8.
-

- 5. Hoang, Q. T.; Heo, T.-Y.; Choi, D. G.; Choi, S.-H.; Shim, M. S. Guanidinium-Incorporated Micelleplexes for Low Toxic and Efficient siRNA Delivery. Macromol. Res. 2020, 28, 1160-1165.
-

- 6. Ahn, H.; Park, J.-H. Liposomal Delivery Systems for Intestinal Lymphatic Drug Transport. Biomaterials Res. 2016, 20, 36.
-

- 7. Sung, Y. K.; Kim, S. W. Recent Advances in Polymeric Drug Delivery Systems. Biomaterials Res. 2020, 24, 12.
-

- 8. Qin, Y.; Li, P.; Guo, Z. Cationic Chitosan Derivatives as Potential Antifungals: A Review of Structural Optimization and Applications. Carbohyd. Polym. 2020, 236, 116002.
-

- 9. Lee, E.; Park, H.-C.; Lee, D.; Park, S. J.; Kim, Y.-H.; Kim, C.-H. Synthesis and Cellular Affinity of a Water-soluble Sulfated Diselenide Compound as a H2O2-responsive Ionic Cross-linker. J. Ind. Eng. Chem. 2020, 83, 181-188.
-

- 10. Chenthamara, D.; Subramaniam, S.; Ramakrishnan, S. G.; Krishnaswamy, S.; Essa, M. M.; Lin, F.-H.; Qoronfleh, M. W. Therapeutic Efficacy of Nanoparticles and Routes of Administration. Biomaterials Res. 2019, 23, 20.
-

- 11. Plianwong, S.; Opanasopit, P.; Ngawhirunpat, T.; Rojanarata, T., Chitosan Combined with Poly-L-arginine as Efficient, Safe, and Serum-insensitive Vehicle with RNase Protection Ability for siRNA Delivery. Biomed. Res. Int. 2013, 2013, 574136.
-

- 12. Perche, F.; Biswas, S.; Wang, T.; Zhu, L.; Torchilin, V. Hypoxia ‐targeted siRNA Delivery. Angew. Chem. 2014, 126, 3430-3434.
-

- 13. Shen, L.; Li, Y.; Lu, Q.; Qi, X.; Wu, X.; Zhou, Z.; Shen, J. Directed Arrangement of siRNA via Polymerization-induced Electrostatic Self-assembly. Chem. Commun. 2020, 56, 2411-2414.
-

- 14. Jung, B. O.; Kim, C. H.; Choi, K. S.; Lee, Y. M.; Kim, J. J. Preparation of Amphiphilic Chitosan and Their Antimicrobial Activities. J. Appl. Polym. Sci. 1999, 72, 1713-1719.
-

- 15. Kim, C. H.; Choi, K. S. Synthesis and Antibacterial Activity of Quaternized Chitosan Derivatives Having Different Methylene Spacers. J. Ind. Eng. Chem. 2002, 8, 71-76.
- 16. Yang, H. M.; Won, Y. H.; Yoon, H. Y.; Kim, C. H.; Goo, Y. T.; Chang, I. H.; Choi, Y. W. Screening of Polymer Additives in Poloxamer 407 Hydrogel Formulations for Intravesical Instillation: Evaluation of Mechanical Properties, Gel-forming Capacity, and Drug Release. Polym. Korea 2020, 44, 817-826.
- 17. Sun, M. T.; O’Connor, A. J.; Milne, I.; Biswas, D.; Casson, R.; Wood, J.; Selva, D. Development of Macroporous Chitosan Scaffolds for Eyelid Tarsus Tissue Engineering. Tissue Eng. Regen. Med. 2019, 16, 595-604.
-

- 18. Kim, C. H.; Choi, J. W.; Chun, H. J.; Choi, K. S. Synthesis of Chitosan Derivatives with Quaternary Ammonium Salt and Their Antibacterial Activity. Polym. Bull. 1997, 38, 387-393.
-

- 19. Gu, B. K.; Park, S. J.; Kim, M. S.; Kang, C. M.; Kim, J.-I.; Kim, C.-H. Fabrication of Sonicated Chitosan Nanofiber Mat with Enlarged Porosity for Use as Hemostatic Materials. Carbohyd. Polym. 2013, 97, 65-73.
-

- 20. Park, S. J.; Cho, W.; Kim, M. S.; Gu, B. K.; Kang, C. M.; Khang, G.; Kim, C. H. Substance‐P and Transforming Growth Factor‐β in Chitosan Microparticle‐pluronic Hydrogel Accelerates Regenerative Wound Repair of Skin Injury by Local Ionizing Radiation. J. Tissue Eng. Regen. M. 2018, 12, 890-896.
-

- 21. Abarca-Cabrera, L.; Fraga-García, P.; Berensmeier, S. Bio-nano Interactions: Binding Proteins, Polysaccharides, Lipids and Nucleic Acids onto Magnetic Nanoparticles. Biomater. Res. 2021, 25, 1-18.
-

- 22. Mou, D.; Yu, Q.; Zhang, J.; Zhou, J.; Li, X.; Zhuang, W.; Yang, X. Intra-articular Injection of Chitosan-Based Supramolecular Hydrogel for Osteoarthritis Treatment. Tissue Eng. Regen. Med. 2021, 18, 113-125.
-

- 23. Wang, J. J.; Zeng, Z. W.; Xiao, R. Z.; Xie, T.; Zhou, G. L.; Zhan, X. R.; Wang, S. L. Recent Advances of Chitosan Nanoparticles as Drug Carriers. Int. J. Nanomed. 2011, 6, 765.
-

- 24. Ragelle, H.; Riva, R.; Vandermeulen, G.; Naeye, B.; Pourcelle, V.; Le Duff, C. S.; D'Haese, C.; Nysten, B.; Braeckmans, K.; De Smedt, S. C. Chitosan Nanoparticles for siRNA Delivery: Optimizing Formulation to Increase Stability and Efficiency. J. Contol. Release 2014, 176, 54-63.
-

- 25. Kim, C.-H.; Park, S. J.; Yang, D. H.; Chun, H. J. Chitosan for Tissue Engineering. Novel Biomed. Regen. Med. 2018, 475-485.
-

- 26. Jun, G. Y.; Ko, Y.-G.; Kim, D.; Kwon, O. K.; Kim, W. I.; Chung, H. Y.; Kwon, O. H. Characterization of Chitosan-Poly(epsilon-caprolactone) Hybrid Nanofiber Sheets Containing Insulin for Wound Dressings. Polym. Korea 2020, 44, 549-558.
-

- 27. Liao, Z.-X.; Ho, Y.-C.; Chen, H.-L.; Peng, S.-F.; Hsiao, C.-W.; Sung, H.-W. Enhancement of Efficiencies of the Cellular Uptake and Gene Silencing of Chitosan/siRNA Complexes via the Inclusion of a Negatively Charged Poly(γ-glutamic acid). Biomaterials 2010, 31, 8780-8788.
-

- 28. Mao, S.; Sun, W.; Kissel, T. Chitosan-based Formulations for Delivery of DNA and siRNA. Adv. Drug Deliver. Rev. 2010, 62, 12-27.
-

- 29. Hong, W.-G.; Nah, J.-W.; Jeong, G.-W. Preparation and Characterization of Tropolone-encapsulated Chitosan Nanoparticle for Application as Cosmetic Preservatives. Polym. Korea 2020, 44, 535-541.
-

- 30. Yang, D. H.; Seo, D. I.; Lee, D.-W.; Bhang, S. H.; Park, K.; Jang, G.; Kim, C. H.; Chun, H. J. Preparation and Evaluation of Visible-light Cured Glycol Chitosan Hydrogel Dressing Containing Dual Growth Factors for Accelerated Wound Healing. J. Ind. Eng. Chem. 2017, 53, 360-370.
-

- 31. Jeong, S. Y.; Kim, E.; Park, W. H. Gelation Behavior and Self-healing Property of Glycol Chitosan with Catechol Functionality. Polym. Korea 2020, 44, 225-232.
-

- 32. Kim, C. H.; Chun, H. J. A synthesis of O-diethylaminoethyl Chitosan and its Binding Ability of Cholate and Deoxycholate Anion in vitro. Polym. Bull. 1999, 42, 25-32.
-

- 33. Salimifard, S.; Kiani, F. K.; Eshaghi, F. S.; Izadi, S.; Shahdadnejad, K.; Masjedi, A.; Heydari, M.; Ahmadi, A.; Hojjat-Farsangi, M.; Hassannia, H. Codelivery of BV6 and anti-IL6 siRNA by Hyaluronate-conjugated PEG-chitosan-lactate Nano- particles Inhibits Tumor Progression. Life Sci. 2020, 260, 118423.
-

- 34. Katas, H.; Alpar, H. O. Development and Characterisation of Chitosan Nanoparticles for siRNA Delivery. J. Contol. Release 2006, 115, 216-225.
-

- 35. Raja, M. A. G.; Katas, H.; Wen, T. J. Stability, Intracellular Delivery, and Release of siRNA from Chitosan Nanoparticles Using Different Cross-linkers. PloS ONE 2015, 10, e0128963.
-

- 36. Li, Y.; Upadhyay, S.; Bhuiyan, M.; Sarkar, F. H. Induction of Apoptosis in Breast Cancer Cells MDA-MB-231 by Genistein. Oncogene 1999, 18, 3166-3172.
-

- 37. Zhou, K.; Xie, L.; Peng, X.; Guo, Q.; Wu, Q.; Wang, W.; Zhang, G.; Wu, J.; Zhang, G.; Du, C. CXCR4 Antagonist AMD3100 Enhances the Response of MDA-MB-231 Triple-negative Breast Cancer Cells to Ionizing Radiation. Cancer Lett. 2018, 418, 196-203.
-

- 38. Lallana, E.; Rios de la Rosa, J. M.; Tirella, A.; Pelliccia, M.; Gennari, A.; Stratford, I. J.; Puri, S.; Ashford, M.; Tirelli, N. Chitosan/hyaluronic Acid Nanoparticles: Rational Design Revisited for RNA Delivery. Mol. Phrm. 2017, 14, 2422-2436.
-

- 39. Ragelle, H.; Vanvarenberg, K.; Vandermeulen, G.; Préat, V. Chitosan Nanoparticles for SiRNA Delivery in vitro. In SiRNA Delivery Methods; Shum, K., Rossi, J., Eds.; Springer: New York, 2016; pp 143-150.
- 40. Songsurang, K.; Praphairaksit, N.; Siraleartmukul, K.; Muangsin, N. Electrospray Fabrication of Doxorubicin-chitosan-tripoly- phosphate Nanoparticles for Delivery of Doxorubicin. Arch. Pharm. Res. 2011, 34, 583.
-

- 41. Palmeira-de-Oliveira, R.; Palmeira-de-Oliveira, A.; Gaspar, C.; Silvestre, S.; Martinez-de-Oliveira, J.; Amaral, M.; Breitenfeld, L. Sodium Tripolyphosphate: An Excipient with Intrinsic in vitro anti-Candida Activity. Int. J. Pharm. 2011, 421, 130-134.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(5): 697-703
Published online Sep 25, 2021
- 10.7317/pk.2021.45.5.697
- Received on Mar 12, 2021
- Revised on Jun 7, 2021
- Accepted on Jun 24, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Chun-Ho Kim*
-
*Laboratory of Tissue Engineering, Korea Institute of Radiological and Medical Science, 75, Nowon-gil, Nowon-gu, Seoul 01812, Korea
- E-mail: chkim@kirams.re.kr
- ORCID:
0000-0001-9737-9202









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.