- Development of Sprayable Gelatin Hydrogel Wound Dressings Using Enzymatic Crosslinking Reaction
Gwijae Kim, Young-Gwang Ko, Hyeyoung Lee, Ho Yun Chung*, and Oh Hyeong Kwon†

Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
*Department of Plastic and Reconstructive Surgery, CMRI, School of Medicine, Kyungpook National University, Daegu 41944, Korea- 효소촉매 가교반응을 이용한 스프레이형 젤라틴 하이드로젤 창상피복제의 개발
금오공과대학교 고분자공학과, *경북대학교 의과대학 성형외과, 세포기질연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
The gelatin hydrogel modified with tyramine (Gel-Tyr) was prepared an enzymatic crosslinking reaction to develop a sprayable wound dressing that is easy to use and hygienic on broad and complicate wound area with biocompatibility, wound healing ability, and comfortable wearing. The substitution rate of Gel-Tyr was calculated through 1H NMR. And the gelation time according to the concentration of gelatin, horseradish peroxidase (HRP) and H2O2, rheological properties, swelling ratio, biodegradation behavior, in vitro cytotoxicity, cell viability was evaluated. The hydrogel with rapid gelation rate and optimum performance as a wound dressing was selected as a sample prepared with a compound concentration of Gel-Tyr 3 wt%, HRP 3.50 units/mL, and H2O2 0.2 μL/mL. In the in vivo full-thickness wound model animal experiment and histological evaluation, the Gel-Tyr hydrogel showed an accelerated wound healing rate and dermal regeneration compared to the control group. It is expected to be used as a sprayable wound dressing in medical treatment, conveniently.
생체적합성, 창상치유능 및 피부밀착성을 가지는 동시에 광범위하고 굴곡진 창상부에 간편하고 위생적으로 적용할 수 있는 스프레이형 창상피복제를 개발하고자 효소촉매 가교반응을 이용하여 티라민으로 개질된 젤라틴(Gel-Tyr) 하이드로젤을 제조하였다. Gel-Tyr의 개질률은 1H NMR을 통해 산출하였고 젤라틴, horseradish peroxidase (HRP) 및 H2O2의 농도에 따른 하이드로젤의 젤화시간, 유변학적 특성, 팽윤도, 생분해도, in vitro 세포독성, 세포생존거동을 평가하였다. 신속한 젤화속도와 창상피복제로서의 최적성능 조건의 하이드로젤은 배합농도 Gel-Tyr 3 wt%, HRP 3.50 units/mL 및 H2O2 0.2 μL/mL로 제조된 시료로 선정하였다. In vivo 전층창상모델 동물실험 및 조직학적 평가에서 Gel-Tyr 하이드로젤은 대조군보다 촉진된 창상회복속도와 진피재생능을 보여주었으며, 의료현장에서 편리하게 사용할 수 있는 스프레이형 창상피복제로의 활용이 기대된다.
The sprayable hydrogel wound dressing was developed with gelatin-tyramine using enzymatic crosslinking reaction. The wound healing ability of the gelatin hydrogels with optimized formulation demonstrated accelerated healing rate and dermal regeneration.
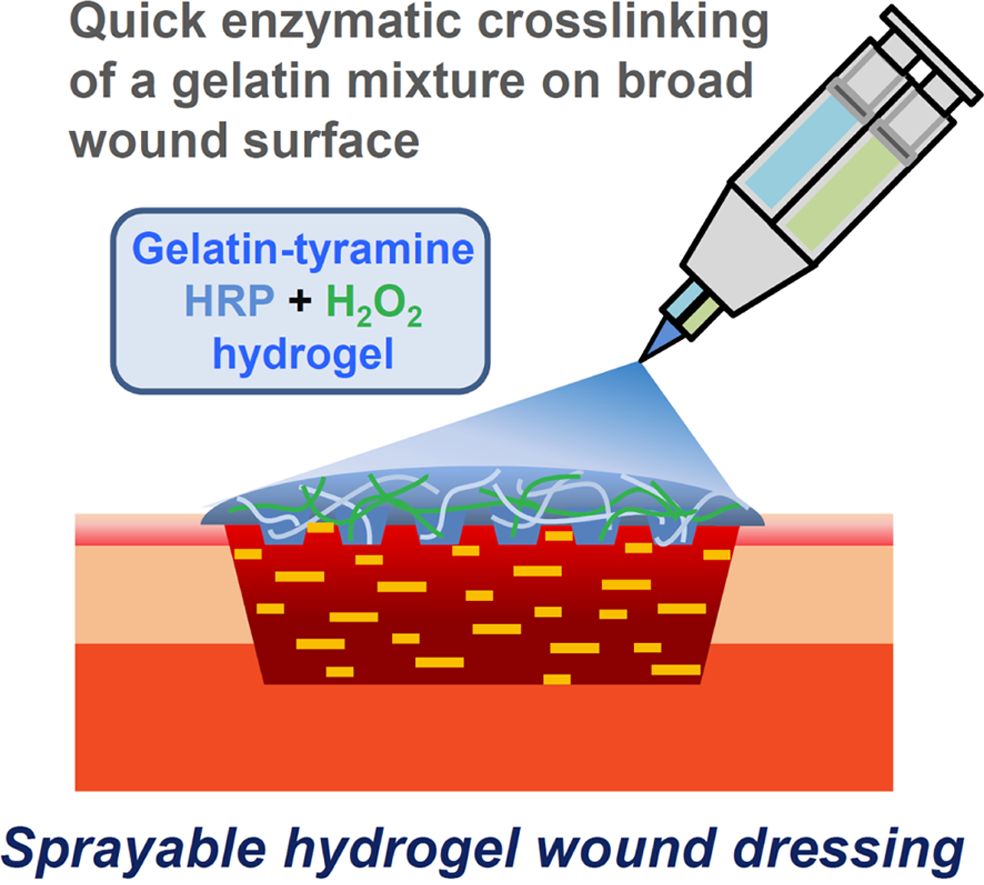
Keywords: gelatin, tyramine, sprayable hydrogel, enzymatic crosslinking, wound dressing.
이 연구는 금오공과대학교 학술연구비에 의하여 지원된 논문임.
인간의 건강한 삶을 위해 의학적 기술발전은 꾸준히 지속되고 있고, 그와 더불어 조직공학 및 의료용 소재분야의 기술도 눈부신 발전을 이어가고 있다. 현대 조직공학 분야에서는 다양한 인공 생체조직을 개발하고 있으며, 손상된 장기와 조직을 효과적으로 재생시킬 수 있는 생체재료에 대한 연구가 진행되고 있다.1-3 인체에서 가장 큰 표면적을 차지하는 피부는 크게 표피층, 진피층, 피하지방층으로 이루어져 있고, 외부의 환경으로부터 내부기관들을 보호하는 역할을 하는 조직이다. 따라서, 피부는 물리적인 자극에 강하고, 탄력성이 있어야 하며, 인체가 생명을 유지하는 동안 충분히 그 기능을 수행해야 한다. 일상생활에서의 피부손상은 창상, 욕창, 화상 등 다양한 형태로 발생된다. 그 중 창상이 가장 빈번히 발생하고, 외부환경에 직접적으로 노출된 상태로 자연적인 창상치유과정을 거치게 되면 오염에 의한 염증발생 우려가 있고, 치유속도가 지체되고 흉터가 발생하기 때문에 이를 예방하고, 신속하게 치료하는 것이 중요하다. 창상피복제는 피부손상을 치유하기 위하여 습윤환경 유지, 상처부위 보호, 삼출물의 흡수, 흉터억제 등의 효능을 가지는 의료용 제제이다.4-7 면역반응에 대한 문제가 전혀 없는 창상피복용 드레싱제로는 폼형, 반투과성 필름형, 하이드로젤형 등 다양한 형태로 제품화되어 사용되고 있으며 상처의 깊이와 분비물의 양에 따라 적합한 형태의 창상피복제가 활용되고 있다. 특히, Winter의 연구에 따르면 상피세포가 습윤환경에서 더 빠르게 성장하여 상처치유를 촉진시킨다는 연구를 발표하였고, 그 이후로 상처에 습윤환경을 줄 수 있는 창상피복제가 중점적으로 연구되어, 다양한 습윤형 창상피복제가 개발되었다.8 하이드로젤은 친수성 고분자 사슬이 가교결합을 이루어 3차원 망상구조의 고분자 복합체 내부에 물을 머금고 있는 형태이며 세포배양용 코팅, 콘텍트렌즈, 조직공학용 스캐폴드 등 다양한 분야에서 활용되고 있다.9-16 특히, 하이드로젤형 창상피복제의 경우 신축성이 뛰어나고, 거즈, 폼 및 반투과성 필름형태의 창상피복제보다 긴밀한 점착성을 가진다. 하이드로젤형 창상피복제는 다른 형태의 피복제와 비교하여 불규칙하고 광범위한 면적의 창상표면에 균일하고 수월하게 도포할 수 있다.9,10 또한 창상에서 방출되는 삼출물과 하이드로젤 내부의 수분이 균형상태를 이루어 장시간 습윤환경을 유지할 수 있으며, 그 창상치유능력이 입증되어 창상피복제 연구분야에서 새롭게 적용되고 있다.11
젤라틴은 동물 체내로부터 얻은 콜라겐에서 추출해낸 천연 고분자로서 생분해성, 생체적합성, 비면역성 고분자이다.3 또한 젤라틴은 건조환경에서는 잘 부서지고 습윤 환경에서는 탄성적인 성질을 띄기 때문에 조직공학 뿐 아니라 다양한 의료용 소재로 연구되고 있다. 하지만 젤라틴은 온도에 따라 coil-to-helix transition에 의해 물리적인 가역적 젤화거동을 보이기 때문에 기계적 및 화학적 형태안정성이 낮은 단점이 있다.17 따라서 다양한 가교반응을 통해 안정성을 확보시키는 절차가 필수적이다.18-21
본 연구에서는 젤라틴을 주재료로 한 하이드로젤 창상피복제를 개발하고자 생체적합성이 뛰어난 젤라틴을 아민기 (-NH2)와 페놀기(ArOH)를 동시에 가지고 있는 티라민(tyramine)으로 개질하여 효소촉매 가교반응 좌석(site)을 형성하였다. 가교제로 과산화수소(H2O2), 촉매로 horseradish peroxidase(HRP)를 사용하였다. HRP는 서양 고추냉이에서 추출해낸 효소로 생화학 응용분야에서 광범위하게 사용된다.22,23 특히, 과산화수소와 같이 사용하게 되면 HRP에 있는 철(Fe)원자와 H2O2가 반응하여 산화라디칼 형성에 의해 가교반응이 진행되어 기계적 성질을 보완할 수 있다. 이러한 특성을 이용하여 개질된 젤라틴 및 가교제인 HRP와 H2O2의 최적비율을 젤화시간, 팽윤도 등을 고려하여 선정하였고, 스프레이형태로 분사와 동시에 가교반응이 진행되도록 하였다. 또한 창상피복제로서의 활용가능성을 확인하기 위해 기계적 물성, in vitro 세포배양 및 in vivo 동물실험 평가결과를 정리하였다.
젤라틴-티라민(Gel-Tyr) 스펀지 제조 및 개질률 분석. 본 연구의 기본재료인 Gel-Tyr은 젤라틴(87500 g/mol, type A, 300 bloom, Sigma, USA)에 티라민(Sigma, USA)을 도입하는 커플링 반응을 통하여 합성하였으며 미반응물 제거 후, 스펀지 형태로 수득하여 실험에 사용하였다.14-16 간단히 서술하면, 먼저 젤라틴 1 g을 정제수에 충분히 용해되도록 45 ºC, 180 rpm으로 2시간 동안 교반시키고 상온이 될 때까지 충분히 냉각 후, 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydro- chloride(EDC, TCI, Japan)와 N-hydroxysuccinimide(NHS, Sigma, USA)를 젤라틴의 카복시기와 1:1로 반응하도록 투입하여 30분간 180 rpm으로 교반하였다. 그 후, 티라민 0.168 g을 투입하고 12시간 동안 교반시켜 젤라틴의 개질반응을 진행하였다. 반응이 종결된 후, 용액 내의 불순물과 커플링제인 미반응 EDC와 NHS를 제거하기 위해 100 mM NaCl 용액, 25% 에탄올, 정제수를 순차적으로 사용하여 2일, 1일, 1일간 투석(매 8시간 용매교환)을 진행하였다. 투석을 완료한 Gel-Tyr 용액은 3일간 동결건조하여 스펀지 형태로 수득하여 냉장밀봉상태로 보관하였다.
EDC/NHS 반응에 의한 Gel-Tyr 스펀지의 개질여부 및 정량적인 개질률을 산출하기 위하여 proton nuclear magnetic resonance spectrometer(1H NMR, Bruker Biospin, Advance III, 400 MHz, Germany)를 이용하여 반응 전후 및 커플링제의 투입량에 따른 시료들의 특성피크 적분값을 산출하였다. 각 시료는 deuterium oxide(D2O, Sigma, USA)에 용해하였고, 온도에 의한 젤라틴의 물리적 가교가 발생하지 않도록 37 ºC 조건에서 측정하였다.
Gel-Tyr 하이드로젤의 제조. Gel-Tyr 용액은 동결건조된 Gel-Tyr 스펀지를 1-6 wt% 농도로 37 ºC의 인산완충생리식염수(PBS, pH 7.2, Gibco, USA) 용액으로 용해시켜 준비하였다. 효소촉매 가교반응을 통한 하이드로젤화는 완전히 용해된 Gel-Tyr 용액에 HRP(horseradish peroxidase, specific activity 147 units/mg, Amresco, USA)와 H2O2(30%, Daejung, Korea)를 혼합하여 진행하였다. Gel-Tyr 용액에 HRP와 H2O2를 동시에 첨가할 경우, 가교반응이 즉각적으로 진행되기 때문에 넓은 창상표면의 균일한 도포가 어렵다. 이를 보완하기 위해 이액형 스프레이(5×5 mL EVICEL®, USA)에 HRP를 첨가한 Gel-Tyr 용액과 H2O2 를 첨가한 Gel-Tyr 용액을 각각 투입하여 효소촉매반응에 의한 즉각적인 가교를 방지하고 mixing nozzle(EVICEL®, USA)을 사용하여 분무와 동시에 혼합되면서 가교반응을 개시하는 하이드로젤화 방식을 사용하였다.
팽윤비(Swelling Ratio) 분석. 하이드로젤의 팽윤도에 따른 가교밀도 특성을 분석하기 위해 팽윤비를 측정하였다. 지름 10 mm, 깊이 5 mm의 실리콘 몰드에 HRP와 H2O2가 각각 첨가된 젤라틴 용액을 동시에 분사하여 하이드로젤 디스크 형태로 가교시키고, 동결건조를 진행하였다. 스폰지형태의 Gel-Tyr 디스크의 건조중량을 측정한 뒤, 50 mL PBS 용액에 넣어 37 ºC 조건에서 15, 30, 45분 동안 방치한 후, 중량을 측정하여 다음과 같은 식으로 계산하였다. Ws는 팽윤된 하이드로젤의 무게, Wd는 동결건조된 하이드로젤의 무게이다.
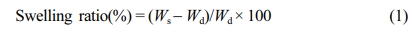
젤화시간 분석. 스프레이형 하이드로젤로 활용되기 위해서는 혼합용액이 분사된 후 신속하게 가교되어 창상부 표면에 균일하게 도포 및 점착되어야 한다. 따라서, 하이드로젤의 젤화시간을 tube inversion 방법을 이용하여 분사된 하이드로젤이 가교되면 더 이상 흐르지 않게 되는 시점을 측정하였다.16 Gel-Tyr 및 HRP, H2O2의 농도에 따른 하이드로젤 젤화시간을 각각 조사하였다.
유변학적 특성 분석. Gel-Tyr의 농도에 따른 유변학적 특성을 분석하기 위하여 레오미터(TA instruments, USA)를 이용하여 저장탄성률(G' )을 측정하였다. 25 ºC에서 gap을 1 mm로 고정하고, 20 mm인 parallel-plate geometry를 사용하여 Gel-Tyr의 각 농도별 하이드로젤 디스크의 G' 을 dynamic fre- quency 모드를 이용하여 측정하였다.
생분해거동 분석. 하이드로젤의 생분해거동 분석용 시료는 모두 클린벤치에서 제조하였고, 실험에 사용하는 기구들은 고압증기멸균기, 70% 에탄올과 UV 조사를 통하여 멸균처리하였다. 하이드로젤 시료는 지름 10 mm, 깊이 5 mm의 실리콘 몰드를 이용하여 디스크 형태로 제조하였다. Gel-Tyr 3 wt%, H2O2 0.2 μL/mL로 고정하고 HRP의 농도를 2.63, 3.50, 4.38 units/mL로 시료를 제조하였다. 제조된 시료를 50 mL conical tube에 넣고, PBS 용액 25 mL를 넣어주었다. 준비된 시료를 shaking bath(37 °C, 180 rpm)에서 실험을 진행하였다. 시간경과에 따라 시료를 회수하여 하이드로젤 시료의 중량을 측정하였다.
세포독성 분석. 효소촉매 반응을 통하여 가교된 젤라틴 하이드로젤이 가지는 생체적합성을 파악하기 위해 in vitro 세포독성평가를 진행하였다. 먼저, ISO 10993-5 in vitro 세포독성 시험법에 따라 배양액 5 mL에 하이드로젤 디스크 시료의 표면적 6.25 cm2가 되도록 준비하여 72시간(37 °C) 동안의 용출액을 준비하였다. 세포주는 섬유아세포(NIH3T3, 1×104 cells/mL, 한국세포주은행)를 96 well plate에 파종 후, 24시간 동안 배양하였다(37 °C, 5% CO2). 96 well plate에 24시간 동안 배양된 세포의 배양액을 준비된 용출액으로 교체하였다. 용출액 조건에서 추가로 24시간 동안 배양한 세포를 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT, Sigma, USA) 용액으로 4시간 동안 반응하였다. 염색된 세포를 dimethyl sulfoxide(DMSO, Daejung, Korea)로 용해하어 microplate reader를 이용하여 540 nm의 흡광도를 측정하였다. 실험군은 Gel-Tyr, HRP 및 H2O2 농도별로 시료를 제조하여 용출법을 통해 진행하였고, 대조군은 세포배양액에서 실험군과 동일한 48시간 동안 배양한 세포를 사용하였다.
Live/Dead 염색을 통한 세포생존거동 분석. 가교된 젤라틴 하이드로젤에 노출된 세포의 생존거동을 조사하기 위하여 Live/Dead 염색을 이용하였다. 35 mm TCPS dish에 섬유아세포(NIH3T3, 1×105 cells/mL, 한국세포주은행)를 파종하고, 4시간 배양하여 세포를 생착시켰다. 그 위에 하이드로젤 디스크(5×10 mm)를 올려두어 직접적으로 세포와 접촉하게 하였다. 그 후, 1, 5일간 배양하여 세포생존거동을 관찰하였다(37 ºC, 5% CO2). Live/Dead 염색은 2 μM calcein AM, 4 μM ethidium homodimer-1 용액을 사용하여 30분간 염색한 뒤, 형광현미경을 사용하여 염색된 세포를 각각 515, 635 nm의 흡광도를 이용하여 관찰하였다. 실험군은 HRP 농도별로 하이드로젤 디스크를 제조하여 이미 생착된 세포 위에 올려두어 직접적인 세포생존율을 확인하였고, 대조군은 무처리 배양액에서 실험군과 동일한 시간 동안 배양한 세포를 관찰하여 진행하였다.
In vivo 창상치유거동 및 조직학적 평가. 본 연구에서 제조된 Gel-Tyr 하이드로젤의 창상치유효과를 평가하기 위해 실험대상으로 male Sprague Dawley(SD) rat(8주령, 250~300 g, 효창사이언스, Korea)을 이용하여 피부전층창상모델 실험을 진행하였다. 동물실험은 경북대학교병원 동물실험윤리위원회의 시행규정 및 승인(동물윤리 승인번호: 2017-0131)에 의해 진행하였다. SD rat의 수술을 시행하기 전 일주일 동안 항온항습 사육실(온도 22±5 ºC, 습도 50±5%)에서 적응시켰다. 대조군으로는 멸균된 거즈를 사용하였고, 실험군은 Gel-Tyr 하이드로젤을 드레싱제로 사용하였다. 동물실험은 마취된 SD rat의 등부분에 직경 2 cm 원판형의 피부전층창상을 유발하여 각각의 창상에 시료를 두고 시간 경과 후 대조군과 실험군의 창상치유거동을 확인하였다. 본 실험에서는 총 14일 동안 2일 간격으로 창상부위를 관찰하였으며 영상분석프로그램(i-Solution Lite, Korea)을 이용하여 창상면적을 측정하여 산출하였다. 또한 창상피복제 도입 후 7, 14일이 지난 시점의 창상부위 조직을 채취하여 hematoxylin-eosin(H&E) 및 Masson's trichrome 염색을 통하여 피부세포의 증식과, 진피 및 상피조직의 재생여부를 분석하였다.
통계분석. 정량적인 측정수치의 유의성 평가는 통계분석 소프트웨어(KyPlot version 2.0, KyensLab, Inc., Japan)를 사용하여 분석하였다. 각 수치는 평균±표준편차로 표기하였으며 significance level은 parametric Student’s t-test와 one-way ANOVA(analysis of variance)의 Tukey’s 사후검증법으로 판별하였다. 통계적 유의성은 p < 0.05의 값으로 설정하였다.
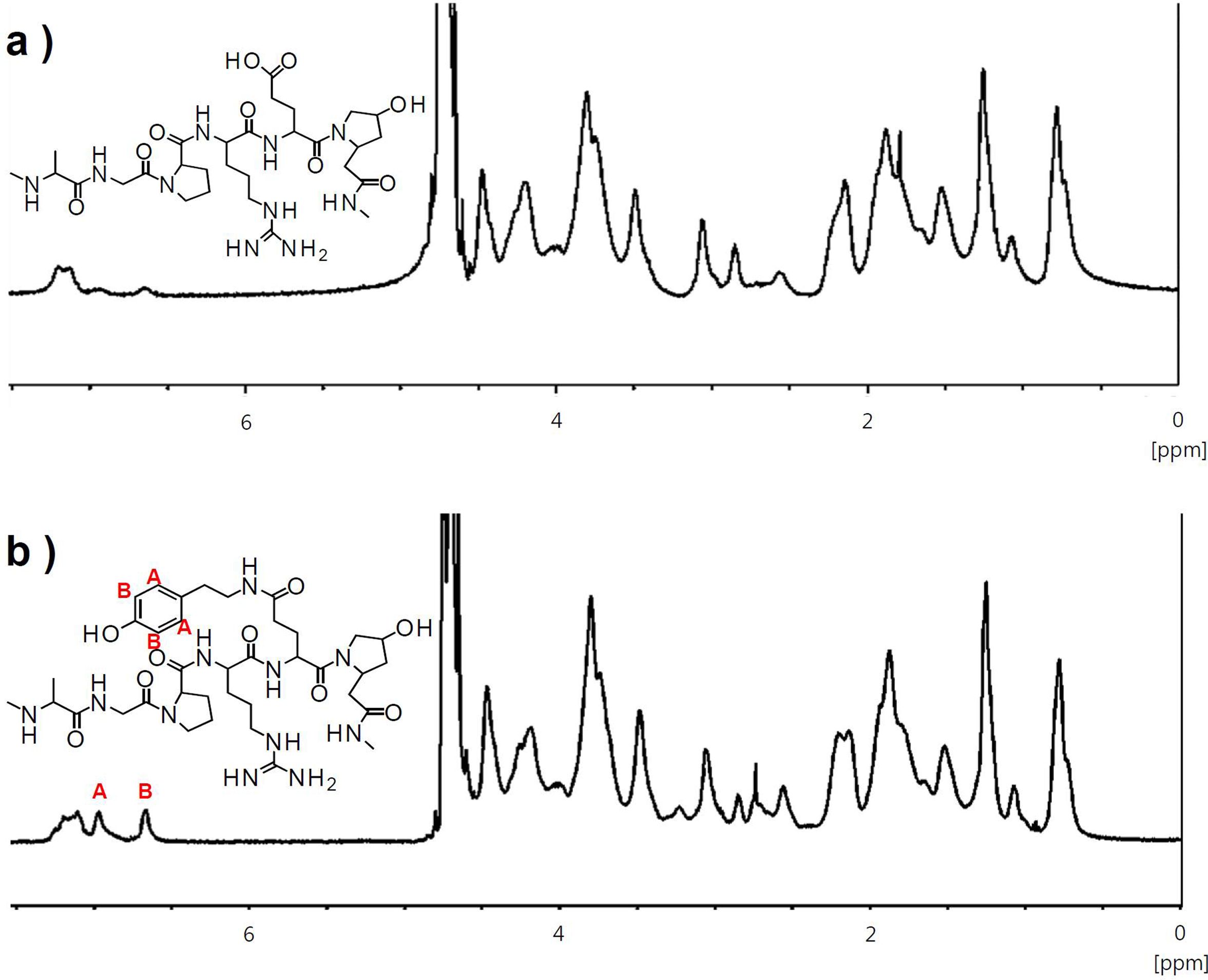
Gel-Tyr의 개질률. 일반적으로 고분자 원재료의 화학적 가교반응도는 곁사슬기의 치환 개질법을 통하여 제어할 수 있으며, 개질률의 검증은 개질된 고분자 하이드로젤의 물리화학적 특성을 규명하는 기본적인 과정이다. 효소촉매 반응을 통해 가교되는 젤라틴 하이드로젤을 제조하기 위해서는 HRP와 H2O2에 반응하기 위한 페놀기가 존재해야 한다. 이에 따라 EDC/NHS 반응을 통하여 젤라틴에 티라민기를 도입하는 개질단계가 선행되었다. 젤라틴 분자에는 카르복실기가 존재하며, EDC/NHS 반응으로 카르복실기와 티라민의 1차 아민이 서로 공유결합하여 아마이드기를 형성한다. 개질조건을 설정할 때 젤라틴 1 g당 존재하는 카복실기의 몰수(1.54×10-3 mol)를 계산하여 젤라틴에 도입할 수 있는 이론적인 티라민의 양(0.168 g)을 계산하였고, 과량의 티라민을 투입하여 개질 후 동결건조를 함으로써 스펀지 형태의 Gel-Tyr 시료를 얻었다. 천연고분자인 젤라틴의 카복실기에 티라민의 페놀기 도입에 의한 개질여부는 1H NMR을 이용하여 확인하고, 개질반응에서의 EDC 및 NHS의 첨가량에 따른 정량적 개질률을 산출하였다(Table 1). 개질을 하지 않은 젤라틴은 6.68 및 6.95 ppm에서 약한 강도의 특성피크가 검출되었으나, 이는 젤라틴을 구성하는 아미노산 중 극소량 포함된 티로신에 의한 것으로 보인다(Figure 1). 반면, EDC/NHS 반응을 통하여 젤라틴에 티라민이 도입된 시료의 경우, 젤라틴과 달리 티라민의 특성피크가 6.68 및 6.95 ppm에서 뚜렷하게 증가된 적분값을 나타내었다. 개질반응 시 첨가된 EDC 및 NHS의 양에 따라 개질률이 비례적으로 증가하는 경향을 보였으며, EDC 및 NHS의 초기 첨가량의 5배일 때 개질률은 3.4%에서 22.9%로 약 7배 증가하였다. 본 연구에서 개발하고자 하는 스프레이형 하이드로젤은 신속한 젤화속도와 생체적합성에 영향을 미치는 가교반응 첨가물을 최소화할 수 있도록 Gel-Tyr 개질률을 23%로 설정하여 후속실험에 사용하였다.
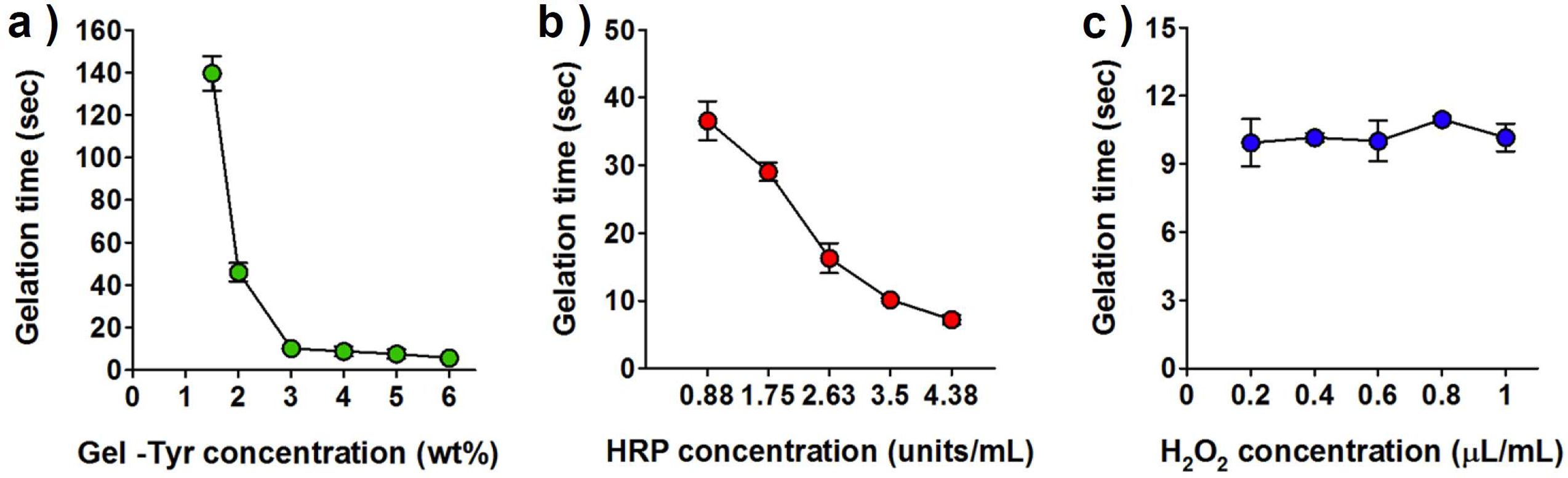
젤화시간 최적화. 하이드로젤 형태의 소재를 스프레이형 창상피복제로 적용하기 위해서는 젤화시간의 제어 및 최적화가 요구된다. 젤화시간의 측정을 위해 동결건조된 Gel-Tyr 시료를 PBS에 용해하여 Gel-Tyr 액상시료를 제조하고, 다양한 HRP, H2O2의 농도에 따라 Gel-Tyr 용액을 혼합 후 이액형 분사기를 사용하여 하이드로젤을 제조하였다. Figure 2(a)를 보면 HRP의 농도를 3.50 units/mL, H2O2의 농도를 0.2 μL/mL로 고정하였을 때, Gel-Tyr의 농도가 높아짐에 따라 젤화시간이 단축됨을 알 수 있다. 이는 Gel-Tyr의 농도가 높아질수록 가교반응을 할 수 있는 작용기의 수도 증가하기 때문에 같은 양의 효소촉매가 첨가되더라도 더 신속한 가교속도를 보이는 것으로 사료된다. 이를 통해, 스프레이형 하이드로젤 창상피복제로 활용하기 위해서는 약 15초 이내에 젤화가 가능한 3 wt% 이상의 농도를 사용해야 함을 확인하였다.
Gel-Tyr의 농도를 3 wt%, H2O2의 농도를 0.2 μL/mL로 고정하고, HRP의 농도를 점진적으로 증가시킴에 따라 젤화시간이 점차 단축되었다(Figure 2(b)). 이는 HRP가 효소촉매로 작용하여 라디칼을 형성시키기 때문에 HRP의 농도가 가교속도와 직접적으로 연관되어 젤화속도가 증가하는 것으로 판단된다. 이를 통해 약 15초 이내에 젤화가 될 수 있도록 HRP 3.50 units/mL 이상의 농도를 사용해야 함을 확인하였다.
촉매인 H2O2의 농도에 따른 젤화시간을 Figure 2(c)에 나타내었다. Gel-Tyr의 농도를 3 wt%, HRP의 농도를 3.50 units/mL로 고정하고, H2O2의 농도를 점진적으로 증가시킴에도 0.2 μL/mL 이상의 농도에서는 젤화시간의 현저한 증감경향이 관찰되지 않았다. 이는 H2O2의 농도(0.2 μL/mL)는 이미 초과로 존재하여 H2O2를 산화시켜 라디칼로 만드는 효소촉매나 가교 반응기의 수와 직접적으로 연관되는 고분자 농도가 가교속도에 있어서 더욱 주요하게 작용한다고 판단하였다. 따라서 가교가 진행되지 않는 0.1 μL/mL 이하의 농도는 제외하고 0.2 μL/mL 이상의 농도를 사용하였다. 즉, 15초 이내의 젤화시간을 가지는 Gel-Tyr 하이드로젤은 3 wt% 이상의 고분자농도, 3.50 units/mL 이상의 HRP 농도, 0.2 μL/mL 이상의 H2O2 농도가 요구된다고 사료된다.
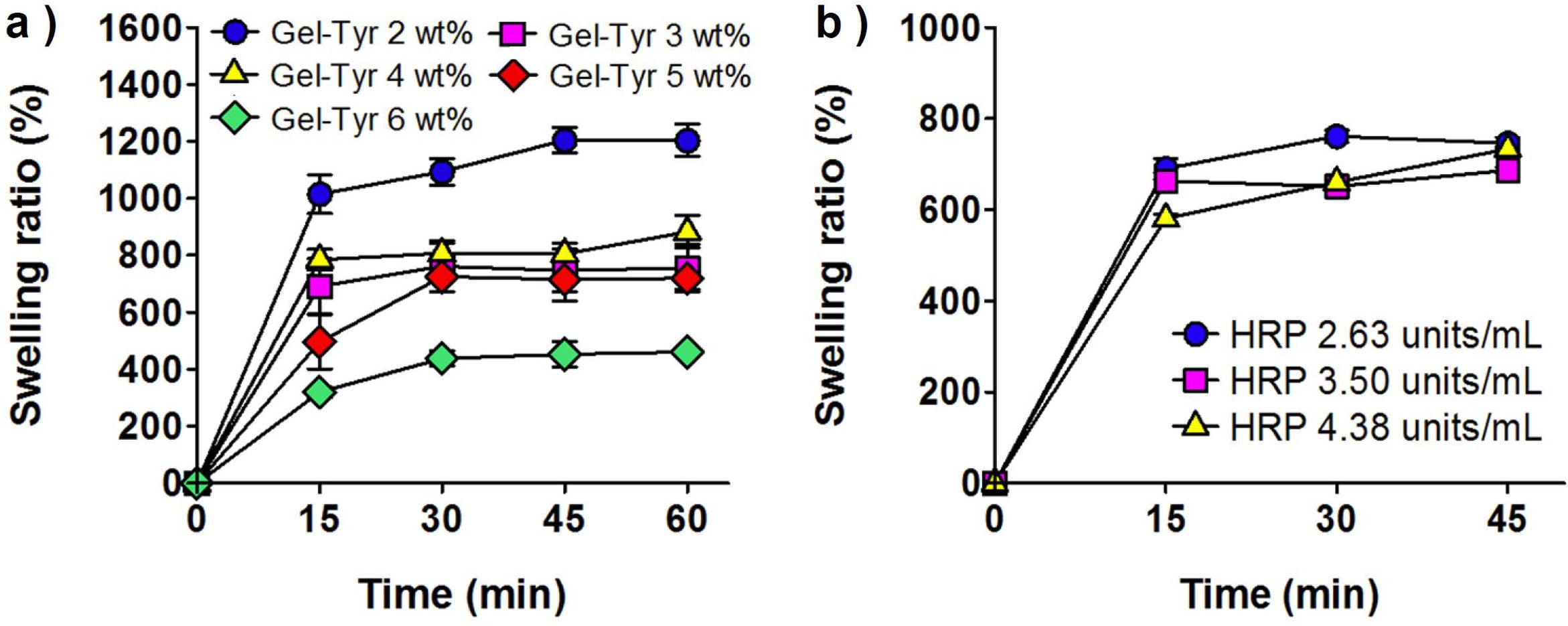
팽윤비. 물흡수에 의한 Gel-Tyr 하이드로젤의 중량증분을 산출하여 시간에 따른 팽윤비 거동을 분석할 수 있으며, 이를 통하여 하이드로젤의 가교밀도를 간접적으로 평가할 수 있다. HRP와 H2O2의 농도를 고정하고, Gel-Tyr의 농도가 증가함에 따라 팽윤비는 일관적으로 감소하는 경향을 보였다. 또한 하이드로젤 농도별로 15분 또는 30분 정도에 팽윤이 최대에 도달함을 확인하였다(Figure 3(a)). 이는 Gel-Tyr의 농도가 높을수록 젤라틴이 가지는 친수성보다 티라민에 의한 가교도의 증가가 더 큰 영향임을 알 수 있다. 또한 가교도가 증가하여 하이드로젤 내부의 3차원적 그물망이 더욱 조밀해지고 고분자 사슬 간의 결합력을 더욱 강하게 만들기 때문에 팽윤비가 감소하였다고 사료된다.
HRP 농도에 따른 팽윤비를 평가하기 위해 Gel-Tyr, H2O2의 농도를 고정하여 팽윤비를 평가하였다. HRP 농도가 증가함에 따라 팽윤비가 약간 감소하였으며, 15분이 경과하였을 때 팽윤이 최대에 도달할 만큼 빠른 팽윤거동을 보였다(Figure 3(b)). 이는 HRP 농도가 높을수록 하이드로젤의 가교도가 증가하여 팽윤비가 감소되었을 것으로 판단되며, Gel-Tyr 농도변수에 의한 영향에 비하여 미미한 수준으로 사료된다.
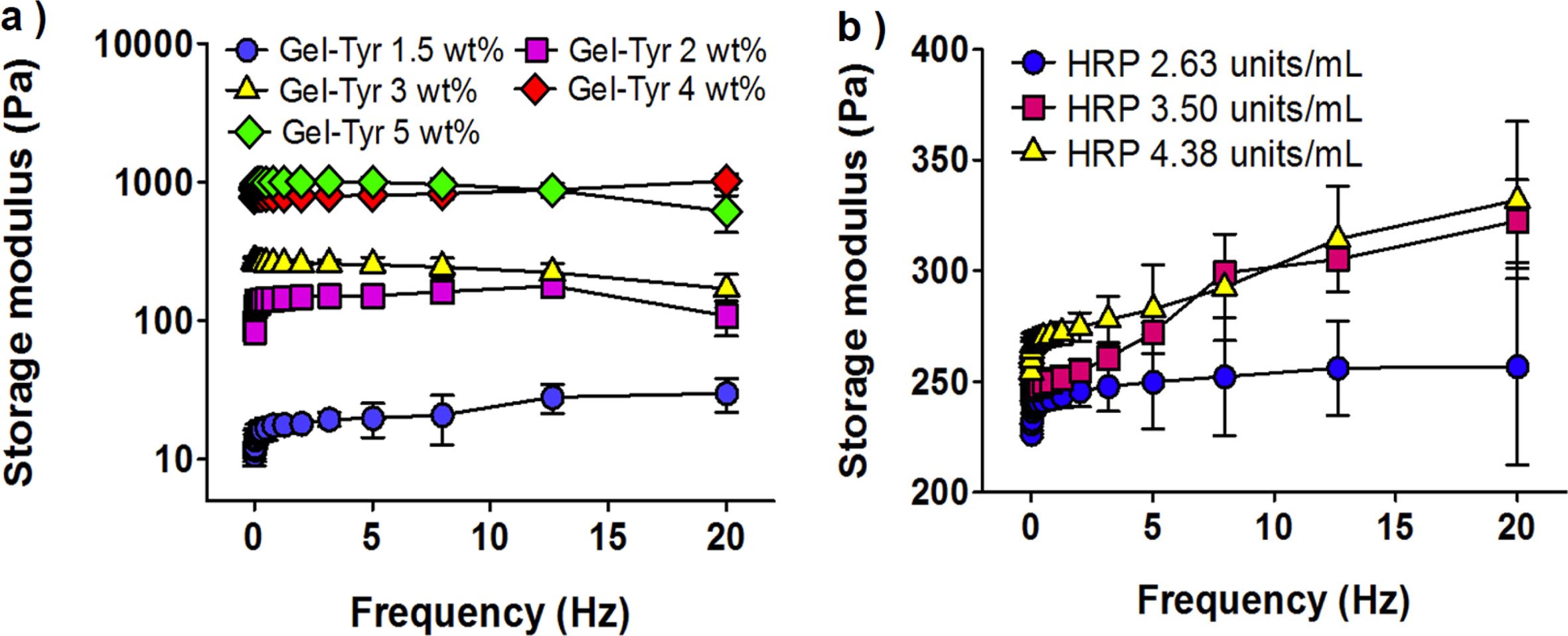
유변학적 평가. 의료용 창상피복제로 하이드로젤을 적용하기 위해서는 피부조직과 유사한 점탄성을 가질수 있도록 고려하여 제조해야 한다. 시료의 저장탄성률을 분석할 수 있는 유변학적 평가는 하이드로젤의 점탄성을 평가할 수 있으며 Gel-Tyr 및 HRP의 농도에 따라 Gel-Tyr 하이드로젤의 저장탄성률을 측정하였다. HRP의 농도를 3.50 units/mL, H2O2의 농도를 0.2 μL/mL로 고정하였을 때, Gel-Tyr의 농도가 증가함에 따라 저장탄성률의 현저한 증가를 확인하였다(Figure 4(a)). 이는 하이드로젤을 구성하는 주성분인 Gel-Tyr의 농도가 높아짐에 따라 하이드로젤이 더욱 높은 밀도로 이루어져 낮은 농도일 때보다 저장탄성률이 높음을 알 수 있다. 또한, 농도가 높아질수록 가교반응기의 단위수도 비례하여 증가하므로 가교도 증가에 따른 하이드로젤의 물리적 성질을 확인할 수 있다. Kiselioviene의 연구에 따르면 피부조직의 창상피복제는 400-600 Pa 정도의 탄성률이 적합하다는 연구결과를 바탕으로 3 wt%의 Gel-Tyr 농도가 적합하다고 판단하였다.24
Gel-Tyr의 농도를 3 wt%, H2O2의 농도를 0.2 μL/mL로 고정하고 측정한 결과 HRP의 농도가 높아짐에 따라 저장탄성률이 증가함을 Figure 4(b)에 나타내었다. 이는 하이드로젤의 가교도에 영향을 미치는 HRP의 농도가 증가함으로써 산화 라디칼의 수가 많아지고 이에 따라 하이드로젤의 저장탄성률이 상승하였다고 판단하였다.15 따라서 피부조직에 적용할 창상피복용 Gel-Tyr 하이드로젤의 고분자 농도는 3 wt%, H2O2는 0.2 mL/mL, HRP는 3.50 units/mL 이상의 조성이 적합하다고 판단하였다.
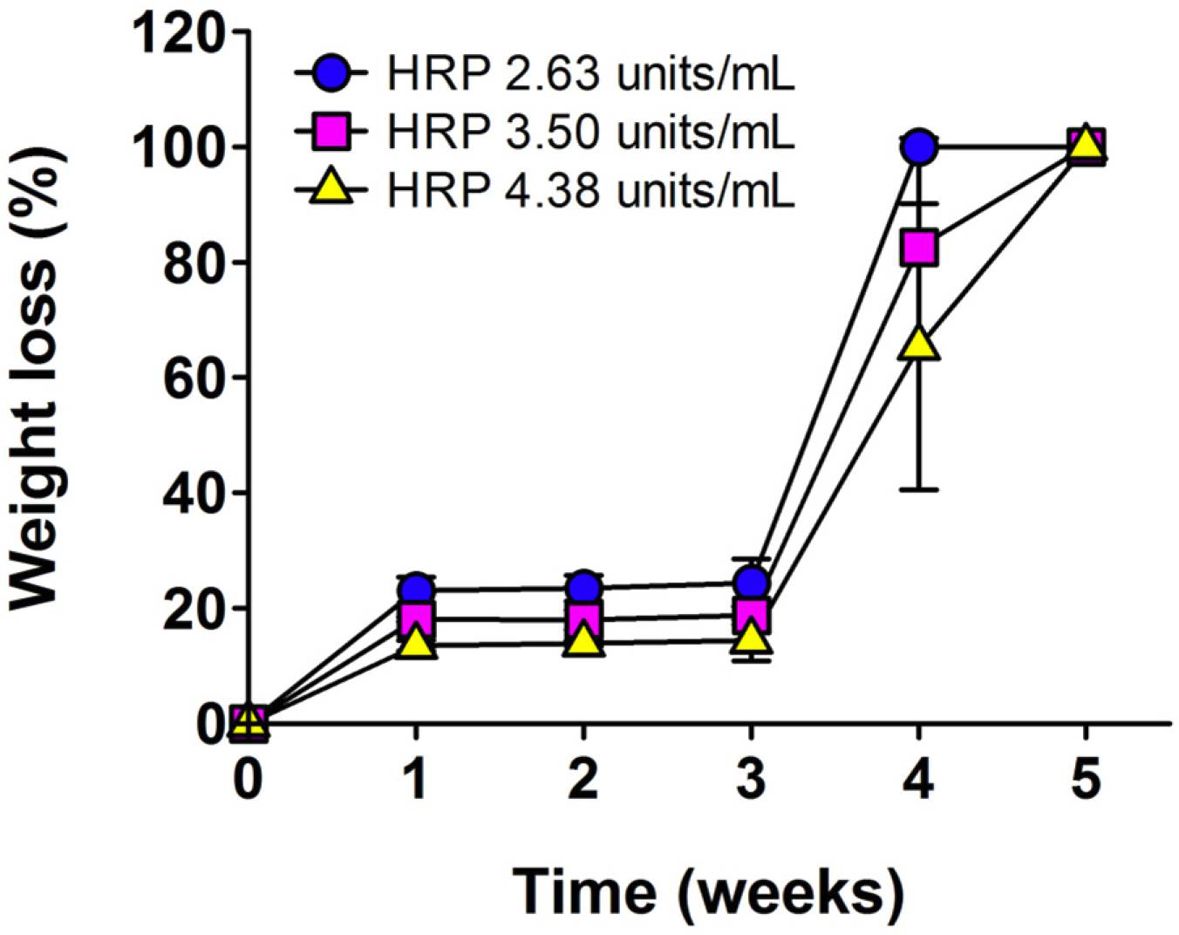
생분해성 평가. 젤라틴기반의 소재는 일정한 기간경과에 따라 효소적 가수분해가 진행된다. 특히, 효소촉매 가교반응으로 제조된 Gel-Tyr 하이드로젤의 생분해 속도는 다른 화학적 가교반응으로 제조된 하이드로젤과 비교하여 분해기간이 단축될 수 있으므로, 중량감소 측정을 이용한 가수분해 거동의 분석 및 고찰이 필요하다. 본 실험에서는 in vitro 환경에서의 생리식염수에 의한 가수분해 거동에 초점을 두고 분석하고자 하였다. Gel-Tyr 3 wt%, H2O2 0.2 μL/mL로 농도를 고정하였을 때, HRP의 농도증가에 따른 하이드로젤 디스크의 중량감소를 5주간 측정하여 분석을 진행하였다(Figure 5). 3주차까지의 결과를 보면 HRP의 함유량이 높아질수록 Gel-Tyr 하이드젤의 중량감소가 낮아지는 경향을 보였으며, 20% 이하의 수치를 나타내었다. 이는 HRP의 농도가 증가할수록 하이드로젤의 가교도가 높아 생분해 속도에 영향을 미치는 가수분해가 충분히 이루어지지 않는 것으로 사료된다. 반면, 4주차부터 모든 시료에서 급격한 중량감소를 보였다. 또한 HRP의 농도가 2.63 units/mL인 하이드로젤의 경우 4주차에 완전히 분해되어 가장 빠른 생분해성을 보였고, HRP 3.50, 4.38 units/mL인 하이드로젤은 82.6, 65.3%의 중량감소율을 보이고, 5주차에는 모든 시료가 완전히 분해되었음을 확인하였다. 이를 통해 3주차에 도달하였을 때 하이드로젤의 3차원 망상구조의 가교점이 느슨해지면서 표면적이 증가하고, 물의 침투가 가속화되어 생분해 속도가 급격히 증가하는 것으로 사료된다.
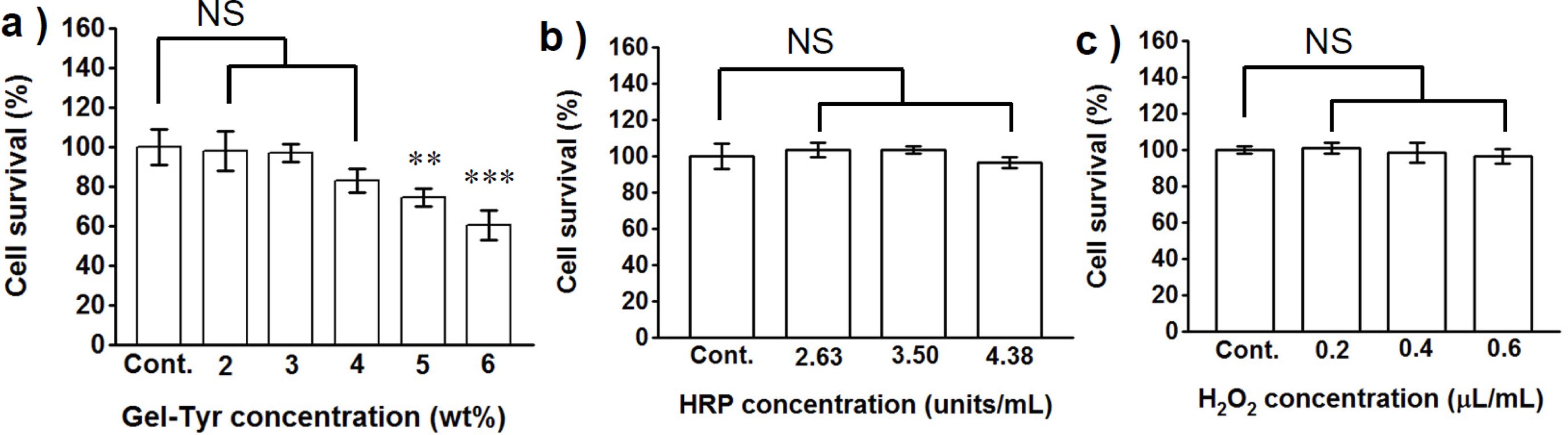
세포독성 평가. 하이드로젤 창상피복제가 도입되었을 때 창상부위에서의 정량적 세포독성을 평가하고자, 먼저 HRP 3.50 unit/mL, H2O2의 농도를 0.2 μL/mL로 고정하고 Gel-Tyr의 농도에 따른 영향을 측정하였다(Figure 6(a)). 고분자 농도가 증가할수록 세포생존율이 감소하는 경향을 보였으나, Gel-Tyr 4 wt% 이하의 농도에서는 대조군과의 통계학적 차이가 없으며 82.8%로 나타났다. 따라서, Gel-Tyr 2~4 wt% 농도범위의 하이드로젤은 창상피복제로 적합하다고 판단하였다.
Gel-Tyr 3 wt%, H2O2의 농도를 0.2 μL/mL로 고정하고, HRP의 농도를 증가시키면서 세포독성을 측정한 결과 HRP의 농도가 증가함에 따라 세포생존율은 감소되었지만 모든 시료의 세포생존율은 95% 이상으로 세포독성 1등급의 수치임을 확인하였다(Figure 6(b)). 이를 통해 세포독성이 낮은 2.63, 3.50 units/mL가 의료용 창상피복제로 활용하기에 유리하다고 판단하였다.
Gel-Tyr 3 wt%, HRP의 농도를 3.50 units/mL로 고정하고 H2O2의 농도를 증가시켜 세포독성을 측정하여 Figure 6(c)에 나타내었다. 그 결과 H2O2의 농도가 증가함에 따라 세포생존율이 감소하는 경향을 보였으나 대조군과의 통계학적 차이가 없으므로 세포독성은 미미한 수준임을 확인할 수 있었다. 따라서 세포독성이 상대적으로 낮은 0.2 μL/mL가 적용하기에 적합하다고 판단하였다.
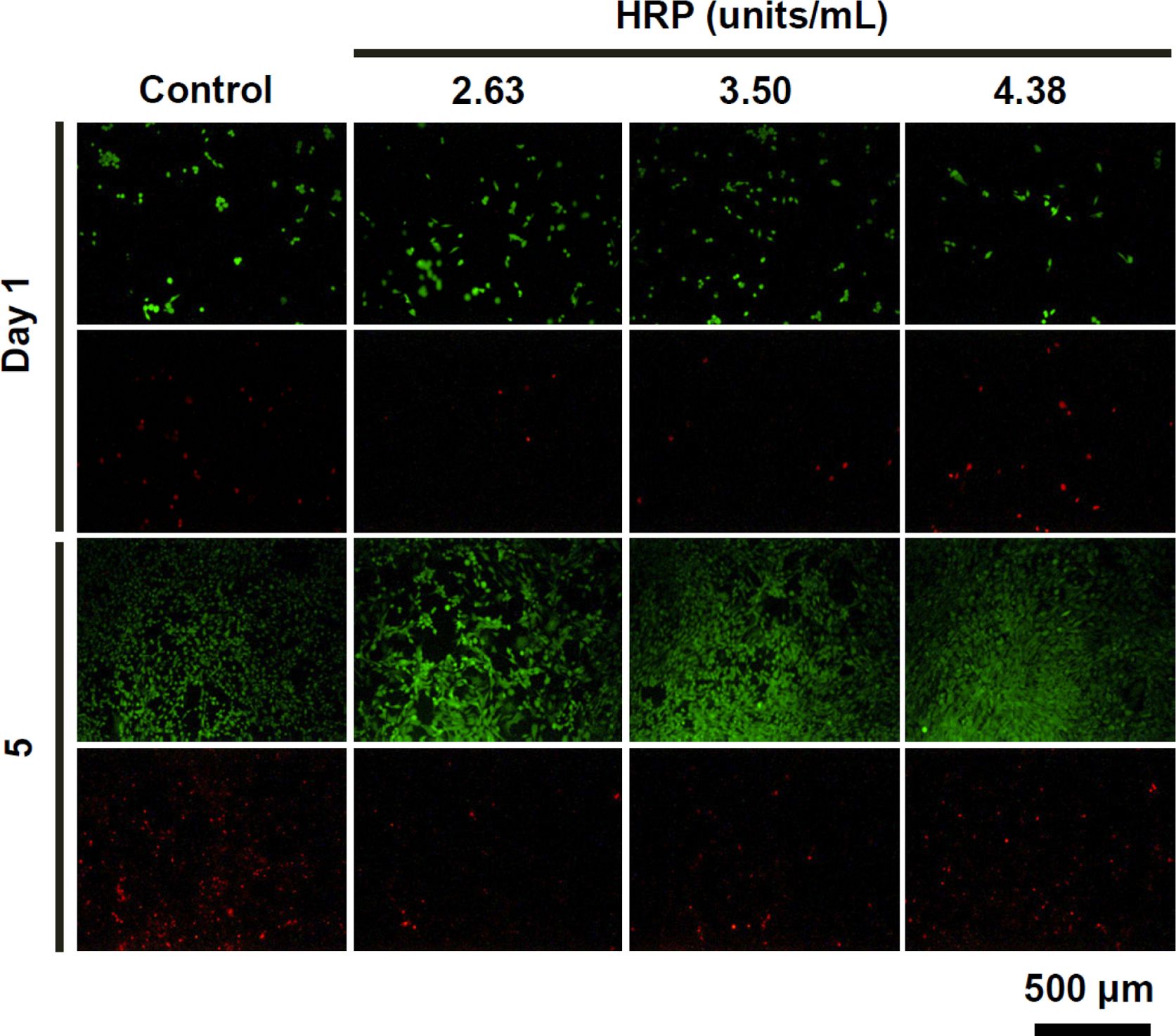
세포생존거동 평가. 종래의 드레싱제와 비교하여 하이드로젤 창상피복제는 창상면에 노출된 진피 혹은 상피세포와 더욱 직접적으로 접촉된다. 그러므로, 하이드로젤 창상피복제 표면에 파종된 세포의 생존거동을 검토할 필요성이 있다. 이를 위해, 시료의 용출물에 의한 정량적인 세포독성평가에 더하여 시료의 직접적인 접촉에 의한 Gel-Tyr 하이드로젤에서의 섬유아세포의 생존능을 Live/Dead 형광염색실험을 통하여 시각화하였다. Gel-Tyr 3 wt%, H2O2의 농도를 0.2 μL/mL로 고정하고, HRP의 농도를 증가시키면서 세포를 관찰한 결과를 Figure 7에 나타내었다. 세포파종 후 1일차에서, 녹색으로 염색된 생존세포를 보았을 때, 하이드로젤, 대조군에서의 차이가 미미하였다. 또한 HRP의 농도가 증가함에 따라 생존세포수의 차이는 미미하여 HRP의 농도가 세포생존에 미치는 영향은 크지 않음을 알 수 있었다. 이는 Figure 6(b)의 통계분석 결과와 유사한 경향을 보였다. 5일차에서의 결과에서 관찰된 생존 및 사멸세포를 보았을 때, 대조군에서의 사멸세포의 수가 다소 관찰되었으나, 일반적인 세포증식 사이클에 의한 모든 그룹에서의 증식된 생존세포의 수가 증가하였으며, HRP의 농도증가에 따른 현저한 사멸세포의 증가는 확인할 수 없었다. 이를 통해 HRP의 농도가 증가하여도 세포의 생존거동에 미치는 영향은 미미한 것을 알 수 있었으며, Figure 6(b)의 결과를 보완하는 결과로써, Gel-Tyr 하이드로젤의 직접적인 상처표면에의 접촉에도 안전한 것으로 사료된다.
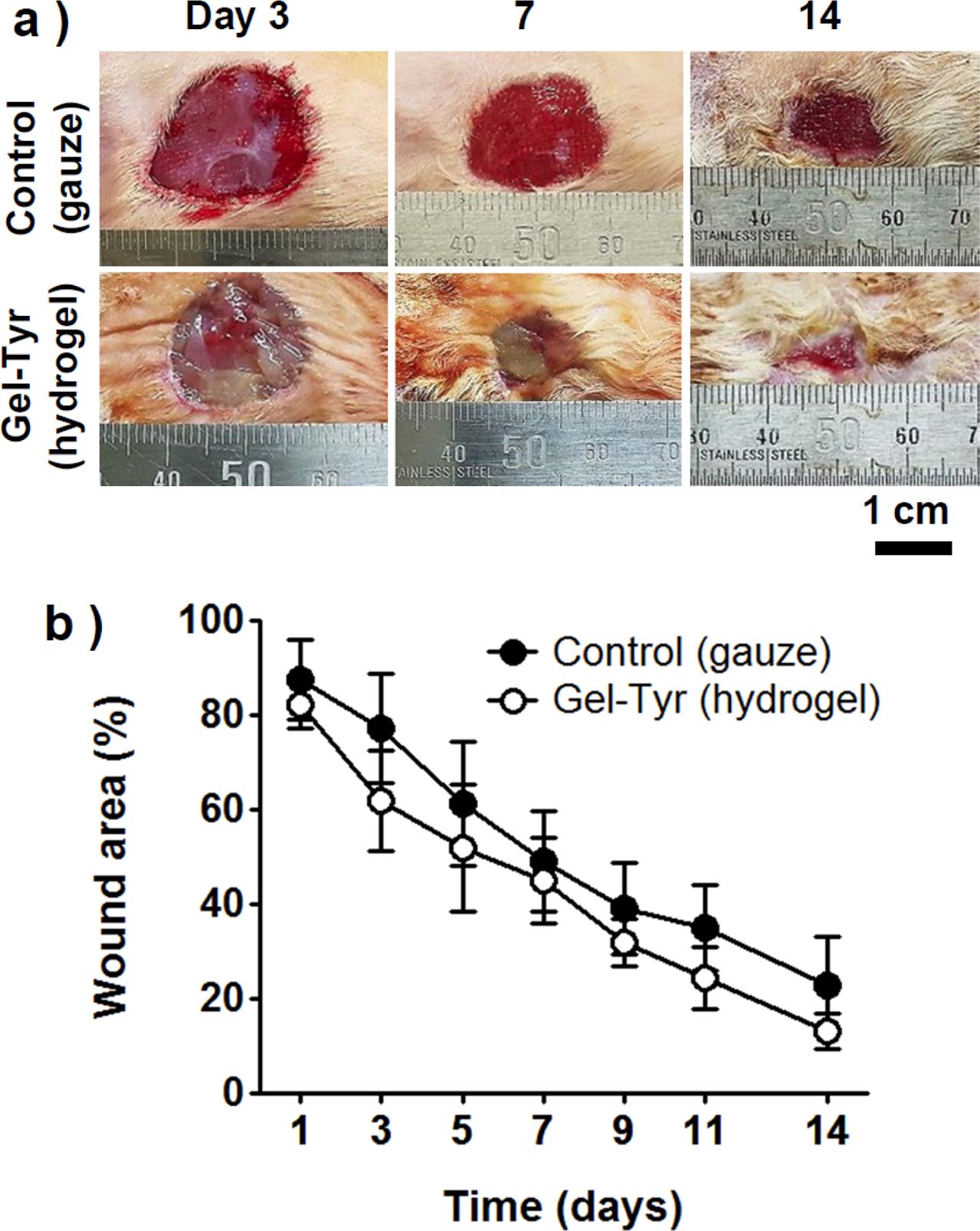
In vivo 창상치유능. 하이드로젤 형태의 창상피복제는 부직포, 폼, 필름 형태의 소재와 달리 포화상태의 수분을 포함하고 있는 피부밀착성 습윤창상피복제이며, 젤라틴 기반의 생체적합성 창상치료제의 활용가능성을 검토하기 위해서는 in vivo 창상치유능 평가실험이 필수적이다. 대조군은 거즈, 실험군은 Gel-Tyr 하이드로젤로 설정하였고, 창상의 면적변화를 측정하여 창상회복률을 산출하였다. Figure 8을 보면, 초기의 창상면적을 측정해두고 2일마다 재측정하여 2주간 창상의 면적을 분석한 결과 Gel-Tyr 하이드로젤 창상피복제를 도입한 실험군이 일관적으로 우세한 창상회복률을 보였으며, 14일차 결과, 실험군은 86.7%, 대조군은 77.2%의 창상회복률을 보여주었다. Gel-Tyr 하이드로젤이 창상에 습윤환경을 유지해주고, 상처부위를 밀착하여 보호함으로써 창상치유속도를 증가시킨 것으로 판단된다.
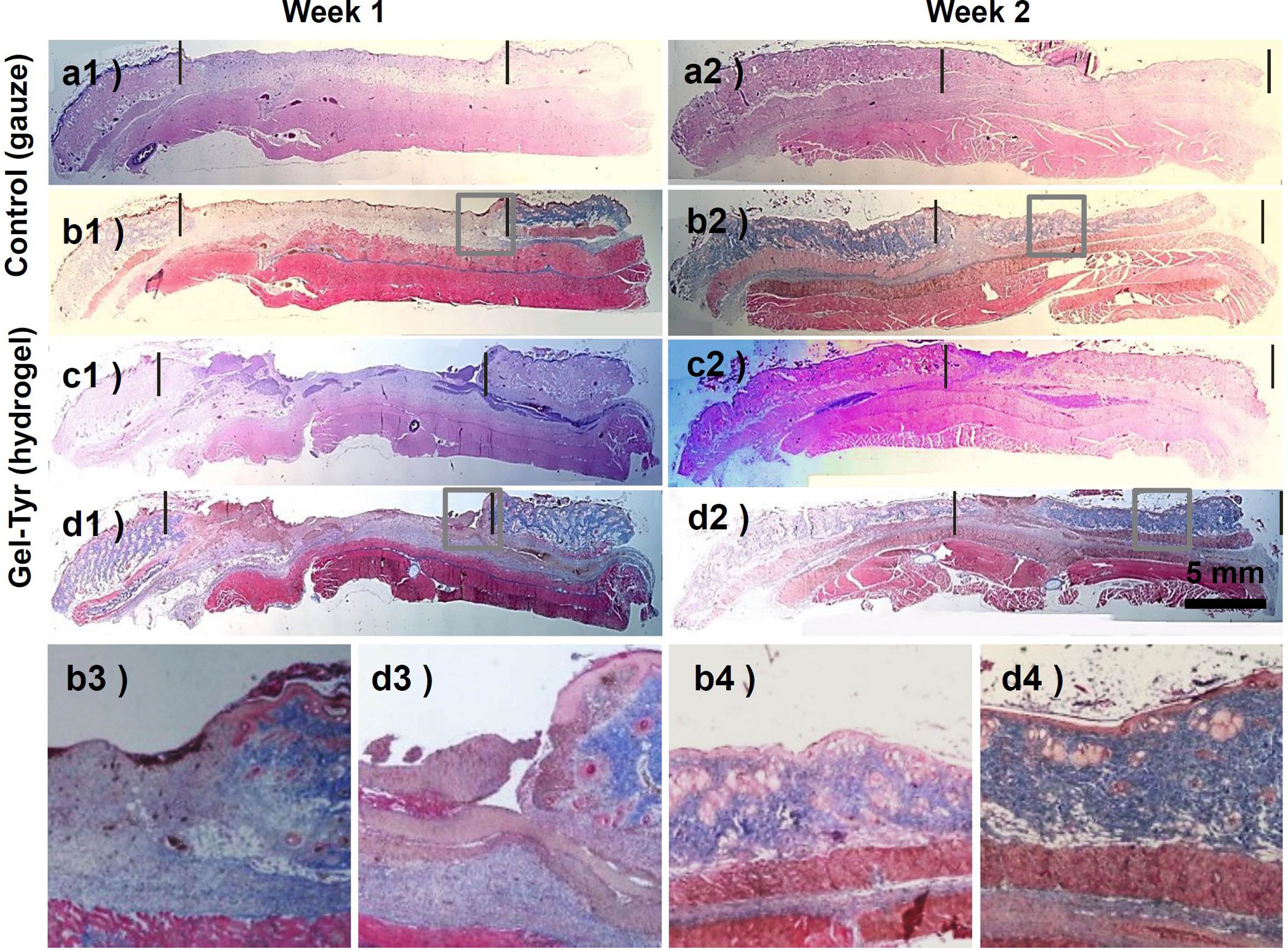
조직학적 평가. 창상치유과정은 결손된 조직의 염증단계, 상피화단계, 증식단계, 성숙단계로 진행되지만 각 단계의 명확한 경계가 없이 연속적이다. 창상치유과정에서는 염증단계가 가장 중요하므로 초기의 신속하고 위생적인 창상피복제의 처치는 세균감염 및 염증세포의 증식을 억제하고, 후속적인 창상치유단계로의 진입을 촉진시키는 역할을 할 수 있다. 조직학적 평가를 위해 전층창상모델에 창상피복제 도입 1주와 2주 후, 대조군과 실험군의 피부조직을 채취하여 hematoxylin-eosin 및 Masson's trichrome염색을 진행하고, 광학현미경으로 결손부 조직의 진피와 상피의 재생형태 및 염증세포의 분포를 관찰하였다. Figure 9의 염색결과에서와 같이 창상치유 1주차의 조직에서는 두 그룹에서 거의 복원되지 않은 상피의 결손이 관찰되었고, 절반 정도 차오른 진피의 상부를 중심으로 염증세포가 분포되어 있었다(Figure 9(b3), 9(d3)). 반면, 2주차의 조직에서는 하이드로젤 창상피복제를 도입한 실험군의 경우 두터운 진피조직과 선명한 상피조직이 관찰되었으며, 거즈를 사용했던 대조군보다 피부조직을 구성하는 데 중요한 콜라겐이 더욱 많이 증식되었음을 관찰할 수 있었으며 선명한 상피세포 및 적갈색으로 염색된 근섬유들을 관찰할 수 있었다(Figure 9(b4), 9(d4)). 하이드로젤 창상피복제를 도입한 피부조직에서 더욱 선명한 적갈색을 나타내는 것으로 보아 거즈보다 smooth muscle cell이 더욱 증식되는 것으로 판단된다. 본 연구에서 제조된 Gel-Tyr 하이드로젤은 창상부에 균일하게 밀착하여 염증반응을 감소시키고 극대화된 습윤환경을 제공하여 섬유아세포의 증식촉진 및 촉진된 상피조직 재생에 기여한 것으로 사료된다.
|
Figure 1 1H NMR spectra of (a) the gelatin; (b) gelatin-tyramine (Gel-Tyr) compound. |
|
Figure 2 Gelation time of Gel-Tyr hydrogels as a function of (a) Gel-Tyr (at HRP 3.50 units/mL, H2O2 0.2 μL/mL); (b) HRP (at Gel-Tyr 3 wt%, H2O2 0.2 μL/mL); (c) H2O2 (at Gel-Tyr 3 wt%, HRP 3.50 units/mL) concentration, respectively. |
|
Figure 3 Swelling ratio of Gel-Tyr hydrogels as a function of (a) Gel-Tyr (at HRP 3.50 units/mL, H2O2 0.2 μL/mL); (b) HRP (at Gel-Tyr 3 wt%, H2O2 0.2 μL/mL) concentration, respectively. |
|
Figure 4 Storage modulus of Gel-Tyr hydrogels as a function of (a) Gel-Tyr (at HRP 3.50 units/mL, H2O2 0.2 μL/mL); (b) HRP (at GelTyr 3 wt%, H2O2 0.2 μL/mL) concentration, respectively. |
|
Figure 5 iodegradation of Gel-Tyr hydrogels as a function of HRP (at Gel-Tyr 3 wt%, H2O2 0.2 μL/mL) concentration. |
|
Figure 6 Cytotoxicity of hydrogels as a function of (a) Gel-Tyr (at HRP 3.50 units/mL, H2O2 0.2 μL/mL); (b) HRP (at Gel-Tyr 3 wt%, H2O2 0.2 μL/mL); (c) H2O2 (at Gel-Tyr 3 wt%, HRP 3.50 units/mL) concentration, respectively. (NS means not significant, **p<0.01, ***p<0.001). |
|
Figure 7 Fluorescent microscopic images of cells after contact with Gel-Tyr hydrogels as a function of HRP (at Gel-Tyr 3 wt%, H2O2 0.2 μL/mL) concentration. |
|
Figure 8 (a) Photographs; (b) wound area as a function of time of wounds treated with gauzes and Gel-Tyr hydrogels. |
|
Figure 9 Histological observation of defected skin layers with hematoxylin-eosin (a, c: pink; cytoplasm, dark blue; nuclei) and Masson's trichrome (b, d: dark red; keratin and muscle fibers, pink; cytoplasm, blue; collagen, dark blue; nuclei) staining by (a, b) treating gauzes; (c, d) Gel-Tyr hydrogels as wound dressings. Inflammatory cells and epidermal tissues were confirmed at (b3, d3) 1 week; (b4, d4) 2 weeks after surgery. |
|
Table 1 Substitution Rate of Gelatin-tyramine (Gel-Tyr) Compounds as a Function of EDC and NHS Amounts |
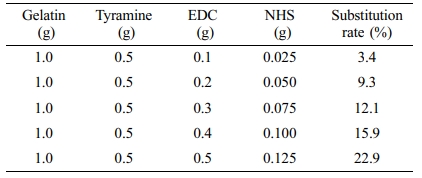
EDC 및 NHS의 첨가량에 따른 티라민이 도입된 젤라틴(Gel-Tyr)의 개질률은 23%로 설정하였다. 개질된 Gel-Tyr 및 HRP, H2O2 혼합용액의 농도에 따른 효소촉매 가교반응으로 제조된 하이드로젤의 젤화시간, 유변학적 거동, 팽윤도, 생분해도의 종합적인 평가결과, Gel-Tyr 3 wt%, HRP 3.50 units/mL, H2O2 0.2 μL/mL의 농도배합이 스프레이형 창상피복제로서 요구되는 최적의 물리화학적 특성을 보여주었다. 믹싱노즐이 부착된 이액형 스프레이기의 각 실린더에 Ge-Tyr/HRP와 Gel-Tyr/H2O2 용액을 각각 주입하여 분사 후 15초 이내의 젤화반응을 확인하였다. Gel-Tyr 4 wt% 이하 및 모든 HRP, H2O2의 농도에서 제조된 하이드로젤의 생체적합성을 확인하였다. In vivo 동물실험을 통하여 Gel-Tyr 하이드로젤이 대조군(거즈)과 비교하여 신속한 창상회복률을 보였으며, 조직학적 분석결과로부터 피부세포 증식과 콜라겐의 재생촉진을 확인하였다. 본 연구에서 제조된 스프레이형 Gel-Tyr 하이드로젤 창상피복제는 젤화가 신속하고 피부밀착성 및 생체적합성을 지니며, 우수한 창상치유능을 보여주었으며 특히, 광범위하고 불균일한 창상면의 신속한 처치가 필요한 환경에서의 활용이 기대된다.
- 1. Langer, R.; Vacanti, J. P. Tissue Engineering. Science 1993, 260, 920-926.
-

- 2. Hollister, S. J. Porous Scaffold Design for Tissue Engineering. Nat. Mater. 2006, 4, 518-524.
-

- 3. Hubbell, J. A. Biomaterials in Tissue Engineering. Nat. Biotechnol.1995, 13, 565-576.
-

- 4. Hanna, J. R.; Giacopelli, J. A. A Review of Wound Healing and Wound Dressing Products. J. Foot Ankle Surg. 1997, 36, 2-14.
-

- 5. Zeng, D.; Shen, S.; Fan, D. Molecular Design, Synthesis Strategies and Recent Advances of Hydrogels for Wound Dressing Appli- cations. Chin. J. Chem. Eng. 2021, 30, 308-320.
-

- 6. Zhang, M.; Zhao, X. Alginate Hydrogel Dressings for Advanced Wound Management. Int. J. Biol. Macromol. 2020, 162, 1414-1428.
-

- 7. Ngece, K.; Aderibigbe, B. A.; Ndinteh, D. T.; Fonkui, Y. T.; Kumar, P. Alginate-Gum Acacia Based Sponges as Potential Wound Dressings for Exuding and Bleeding Wounds. Int. J. Biol. Macromol. 2021, 172, 350-359.
-

- 8. Winter, G. D. Formation of the Scab and the Rate of Epithe- lization of Superficial Wounds in the Skin of the Young Domestic Pig. Nature 1962, 193, 293-294.
-

- 9. Cheng, H.; Shi, Z.; Yue, K.; Huang, X.; Xu, Y.; Gao, C.; Yao, Z.; Zhang, Y. S.; Wang, J. Sprayable Hydrogel Dressing Accelerates Wound Healing with Combined Reactive Oxygen Species-Scavenging and Antibacterial Abilities. Acta Biomater. 2021, 124, 219-232.
-

- 10. Amirsadeghi, A.; Jafari, A.; Hashemi, S.-S.; Kazemi, A.; Ghasemi, Y.; Derakhshanfar, A.; Shahbazi, M.-A.; Niknezhad, S. V. Sprayable Antibacterial Persian Gum-Silver Nanoparticle Dressing for Wound Healing Acceleration. Mater. Today Commun. 2021, 27, 102225.
-

- 11. Dauton, C.; Kothari, S.; Smith, L.; Steele, D. A. History of Materials and Practices for Wound Management, Wound Practice and Research 2012, 20, 174-186.
-

- 12. Varaprasad, K.; Raghavendra, G. M.; Jayaramudu, T. A Mini Review on Hydrogels Classification and Recent Developments in Miscellaneous Applications. Mater. Sci. Eng. C 2017, 79, 958-971.
-

- 13. Ullah, F.; Othman M. B. H.; Javed, F.; Ahmad, Z.; Akil, H. M. Classification, Processing and Application of Hydrogels: A Review. Mater. Sci. Eng. C 2015, 57, 414-433.
-

- 14. Bang, S.; Lee, E.; Ko, Y.-G.; Kim, W. I.; Kwon, O. H. Injectable Pullulan Hydrogel for the Prevention of Postoperative Tissue Adhesion. Int. J. Biol. Macromol. 2016, 87, 155-162.
-

- 15. Lee, F.; Chung, J. E.; Kurisawa, M. An Injectable Enzymatically Crosslinked Hyaluronic Acid-Tyramine Hydrogel System with Independent Tuning of Mechanical Strength and Gelation Rate. Soft Matter 2008, 4, 880-887.
-

- 16. Bang, S.; Ko, Y.-G.; Kim, W. I.; Cho, D.; Park, W. H.; Kwon, O. H. Preventing Postoperative Tissue Adhesion Using Injectable Carboxymethyl Cellulose-Pullulan Hydrogels. Int. J. Biol. Macromol. 2017, 105, 886-893.
-

- 17. Martinez-Diaz, G. J.; Nelson, D.; Crone, W. J.; Kao, W. J. Mechanical and Chemical Analysis of Gelatin-Based Hydrogel Degradation. Macromol. Chem. Phys. 2003, 204, 1898-1908.
-

- 18. Kim, Y.-H.; Cho, C.-S.; Kang, I.-K.; Kim, S. Y.; Kwon, O. H. Crosslinked Gelatin Nanofibers and Their Potential for Tissue Engineering. Key Eng. Mater. 2007, 342, 169-172.
-

- 19. Zhao, X.; Lang, Q.; Yildirimer, L.; Lin, Z. Y.; Cui, W.; Annabi, N.; Ng, K. W.; Dokmeci, M. R.; Ghaemmaghami, A. M.; Khademhosseini, A. Photocrosslinkable Gelatin Hydrogel for Epidermal Tissue Engineering. Adv. Healthc. Mater. 2016, 5, 108-118.
-

- 20. Sakai, S.; Hirose, K.; Taguchi, K.; Qgushi, Y.; Kawakami, K. An Injectable, In Situ Enzymatically Gellable, Gelatin Derivative for Drug Delivery and Tissue Engineering. Biomaterials 2009, 30, 3371-3377.
-

- 21. Akkara, J. A.; Senecal, K. J.; Kaplan, D. L. Synthesis and Characterization of Polymers Produced by Horseradish Peroxidase in Dioxane. J. Polym. Sci.: A Polym. Chem. 1991, 29, 1561-1574.
-

- 22. Ghasempur, S.; Torabi, S. F.; Siadat, S. O. R.; Heravi, M. J.; Ghami, N.; Khajeh, K. Optimization of Peroxidase-Catalyzed Oxidative Coupling Process for Phenol Removal from Wastewater Using Response Surface Methodology. Environ. Sci. Technol. 2007, 41, 7073-7079.
-

- 23. Linh, N. T. B.; Abueva, C. D. G.; Lee, B.-T. Enzymatic In Situ Formed Hydrogel from Gelatin–Tyramine and Chitosan-4-Hydr- oxylphenyl Acetamide for the Co-Delivery of Human Adipose-Derived Stem Cells and Platelet-Derived Growth Factor Towards Vascularization. Biomed. Mater. 2017, 12, 015026.
-

- 24. Kiselioviene, S.; Baniukaitiene, O.; Harkavenko, V.; Babenko, N. A.; Liesiene, J. Cellulose Hydrogel Sheets for Wound Dressings. Cellulose Chem. Technol. 2016, 50, 915-923.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(4): 610-619
Published online Jul 25, 2021
- 10.7317/pk.2021.45.4.610
- Received on Mar 28, 2021
- Revised on Apr 21, 2021
- Accepted on Apr 29, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Oh Hyeong Kwon
-
Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
- E-mail: ohkwon@kumoh.ac.kr
- ORCID:
0000-0002-7160-0105









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.