- Synthesis and Characteristic of Cross-linked Hyaluronic Acid Hydrogels with Putrescine under the Neutral pH Condition
Yu Rim Je*, **, So Ra Bang*, Il Keun Kwon**, Sang Jun Park*, and Chun-Ho Kim*,†

*Laboratory of Tissue Engineering, Korea Institute of Radiological Medical Sciences, Seoul 01812, Korea
**Department of Dentistry, Graduate School, Kyung Hee University, 26 Kyungheedae-ro, Dongdaemum-gu, Seoul 02447, Korea- Putrescine의 존재 하에 중성 pH 조건에서의 가교 히알루론산 하이드로젤의 합성 및 특성
*한국원자력의학원 방사선의학연구소, **경희대학교 치과대학 치의학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study is to fabricate hyaluronic acid (HyA) hydrogels under the neutral pH condition in order to minimize the degradation of HyA during the cross-linking reaction. Two kinds of HyA hydrogels (HPDM or HPEN), were prepared with 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride (DMTMM) or 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC)/N-hydroxysuccinimide (NHS) as cross-linking agents, respectively, in the presence of putrescine as a diamine. Amide bond formation of hydrogels in the presence of putrescine was confirmed by FT-IR analysis. The morphology and rheological property of the hydrogels were studied through a scanning electron microscope and a rheometer, respectively. The swelling property and the degradation behavior of the hydrogels were affected by the two kinds of cross-linking agents and the molar ratio of the putrescine/cross-linking agents. Cytocompatibility of these hydrogels on human dermal fibroblast was confirmed by MTT assay. In conclusion, the cross-linking efficiency and the biocompatibility of HPDM cross-linked by DMTMM were better than those of HPEN cross-linked by EDC/NHS.
본 연구는 히알루론산의 가교 반응 중 분해를 최소화하기 위해, 중성 pH 조건에서 히알루론산 하이드로젤을 제조하는 것이다. 가교 반응은 diamine인 putrescine의 존재 하에, 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride(DMTMM) 및 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide(EDC)/N-hydroxysuccinimide(NHS)를 각각 가교제로 사용하여 2종류의 히알루론산 하이드로젤을 제조하였다(HPDM 및 HPEN). FTIR 분석을 통해 두 가교제 모두 putrescine의 존재 하에, 아마이드기를 형성했음을 확인하였다. 반응에 따른 하이드로젤의 형태 및 유변학적 특성을 주사전자현미경 및 레오미터를 통해 확인하였다. 제조된 하이드로젤의 팽윤 특성 및 분해 거동은 가교제의 종류 및 putrescine/가교제의 몰비에 직접적인 영향을 받았다. 하이드로젤에서의 인체 섬유아세포에 대한 세포 적합성은 MTT assay를 통해 확인하였다. 결론적으로, DMTMM으로 가교한 HPDM의 가교 효율 및 생체 적합성이 EDC/NHS으로 가교한 HPEN 보다 더 우수하였다.
The cross-linking efficiency and the biocompatibility of HPDM cross-linked by 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride (DMTMM) were better than those of HPEN cross-linked by 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC)/N-hydroxysuccinimide (NHS).
Keywords: neutral pH condition, putrescine, hyaluronic acid, 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride, 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide/N-hydroxysuccinimide.
본 연구는 과학기술정보통신부의 첨단 방사선융합 치료기술 개발(방사선 감응 미세환경추적 나노약물전달체 개발, NRF-2020M2D9A3094178), KIRAMS(방사선 반응제어 의생명연구, 50531-2021), 산업통상자원부의 산업소재핵심기술개발 사업(콜라겐 재생 섬유 제조기술 개발, 20000519) 연구결과로 이에 감사 드립니다.
히알루론산은 피부, 각막, 연골, 세포 외 기질의 주요 구성 성분으로 N-acetylglucosamine와 D-glucuronic acid의 반복구조로 구성되어 있는 비황화 천연 생체 재료이다.1 히알루론산은 친수성, 생체 적합성, 생분해성, 보습성, 점탄성, 비면역원성 등의 특징을 가지고 있기 때문에 관절/골조직 형성을 돕는 윤활제,2-4 상처 치유용 드레싱,5 그 외에도 약물 전달 시스템이나,6,7 콘텍트 렌즈로 이용하는 등8 생의학 및 조직공학 응용분야에서 광범위하게 사용되고 있다. 하지만 히알루론산은 라디칼 또는 hyaluronidase 등 생물학적 효소에 의해 쉽게 분해되기 때문에 생체에 적용하기 위해 기계적 특성을 향상시켜야 한다.9,10 이를 위해 히알루론산의 카복실기 및 하이드록실기를 butanedioldiglycidyl ether, divinyl sulfone, glutar- aldehyde 등과 반응시켜 히알루론산을 가교시키는 연구가 보고되고 있다.11-16
Carbodiimide 반응은 dicyclohexylcarbodiimide(DCC)와 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide(EDC)/N-hydr- oxysuccinimide(NHS) 등으로 히알루론산의 카복실기를 활성화하여 아민기의 존재 하에 아마이드기를 형성하는 화학적 반응으로, 다른 화학적 가교 방법 보다 간단하고 반응 시 제어가 쉽다는 장점이 있다.17-19 이때, 비수성 합성에 주로 사용되는 DCC시약 보다 EDC가 히알루론산 같은 친수성 재료를 가교하는데 적합하다고 판단할 수 있다. 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride(DMTMM)의 경우, 카복실기를 활성화하여 N-methylmorpholinium을 방출하고 아민기와의 반응을 통해 아마이드기를 형성하는 등 EDC/NHS에 의한 carbodiimide 반응과 유사하다.20-22 DMTMM을 이용한 가교법은 EDC/NHS를 이용한 가교법에 비해 수용상에서 안정적이라 보고되고 있다.23 그러나 아마이드 형성을 통한 안정적인 가교를 위해서는 DMTMM 및 EDC/NHS와 함께 diamine의 사용이 필수적이며, 이때 산성 또는 알칼리성의 pH 조절이 필요한 것으로 알려져 있다. 히알루론산의 경우, 연속적인 화학반응으로 가교반응 중 히알루론산의 분해가 유발되기 때문에 이를 최소화시키는 반응 조건이 필요하다. 또한, 생체적합성이 우수한 하이드로젤을 제조하기 위해 인체 유해성이 적은 diamine을 이용하여야 한다. Putrescine은 아미노산의 분해에 의해 형성되는 diamine으로 쥐에 대한 경구 투여 실험 결과, 하루에 180 mg/kg(rat)까지는 특별한 부작용이 나타나지 않는 것으로 보고되고 있으며,24 유기체 내에서 세포 성장, 분화 및 생장 등 다양한 대사 기능에 관여한다.25
따라서, 본 연구는 히알루론산의 가교반응 중 히알루론산의 분해를 최소화하고, 생체적합성이 뛰어난 히알루론산 하이드로젤을 제조하기 위해 중성 pH 조건에서 안전한 diamine인 putrescine을 이용하여 가교제인 DMTMM 및 EDC/NHS를 이용해 가교반응을 수행하였다. 제조된 두 종류의 히알루론산 하이드로젤의 물리/화학적 물성 및 생체적합성 등을 비교 분석하여 최적의 반응 조건을 확립하였다.
재료. 히알루론산 나트륨(Mw: 1500 kDa, Lot No. 53747), putrescine diHCl, N-hydroxysuccinimide(NHS) 및 hyaluroni- dase(Lot No. H3884)는 Sigma Aldrich사(USA)에서, 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide(EDC)는 대정화금㈜ (Korea)에서 구매하였다. 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride(DMTMM)은 FUJIFILM Wako Chemicals(Japan)에서 구매하였다. Fetal bovine serum(FBS), penicillin-streptomycin solution(PS) 및 trypsin ethylene-dia- minetetraacetic acid(trypsin-EDTA)는 Welgene(USA)에서 구매하였으며, Dulbecco’s modified Eagle’s medium(DMEM)은 Gibco(USA)에서 구매하였다.
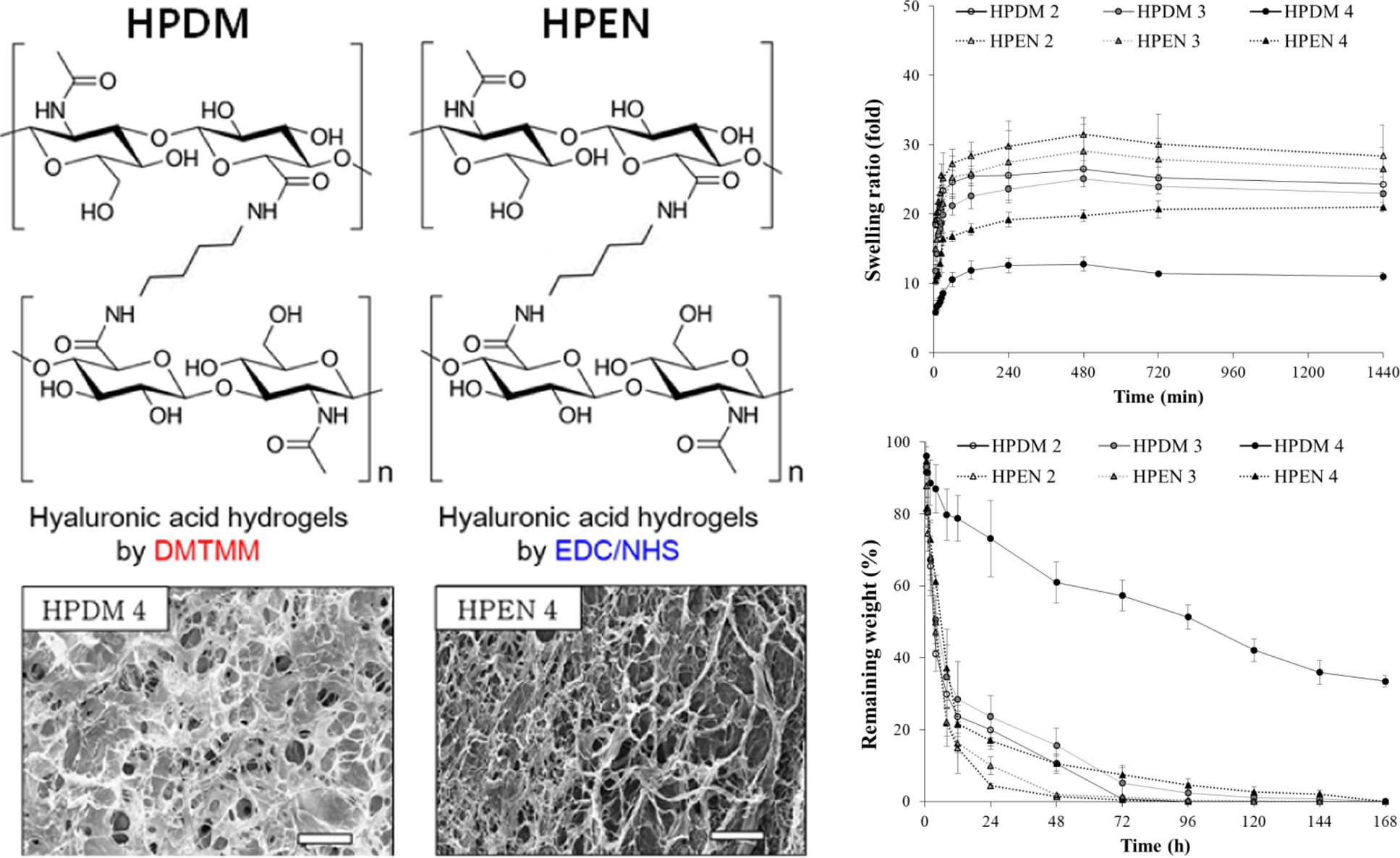
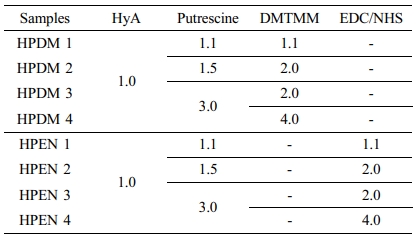
히알루론산 하이드로젤의 제조. 200 mg의 히알루론산을 9 mL의 증류수에 4 °C에서 rotary shaker(FINEPCR, Korea)를 사용하여 용액이 투명해질 때까지 완전히 녹여주었다. 9 mL의 putrescine diHCl를 1.1, 1.5, 3.0의 몰비로 히알루론산 수용액에 첨가하여, 4 °C에서 rotary shaker를 사용하여 잘 섞어주었다. 혼합 용액에 1.1, 2.0, 4.0의 몰비의 가루형 DMTMM 또는 EDC, NHS를 순서대로 천천히 넣어주고 상온(20 °C) 에서 반응시켰다. 정해진 시간 이후, 반응물을 80% EtOH (Merck, Germany)과 1x PBS(phosphate buffered saline, WelGene Inc., Korea)로 3회 반복 세척한 후에, -80 °C에서 overnight 동안 동결하였다. 동결된 하이드로젤은 4일간 동결 건조하여 이후 실험에 사용하였다(Table 1, DMTMM 또는 EDC/NHS에 위해 제조된 하이드로젤은 각각 HPDM, HPEN으로 명명).
세포적합성 비교 시험을 위한 염산 처리 HPEN 시료의 경우, 각 하이드로젤을 동결하기 전에 1 mM HCl(pH 3.0) 수용액으로 옮겨 상온에서 orbital shaker(BioFree, Korea)를 이용하여 1시간 처리한 후, 각 하이드로젤을 1x PBS로 옮겨 3회 반복 세척하였다. 세척된 각 하이드로젤을 -80 °C에서 overnight 동안 동결하고, 4일간 동결 건조하여 70% EtOH 세척 후 세포적합성 실험에 사용하였다.
Fourier Transform Infrared Spectroscopy(FTIR) 분석.히알루론산 하이드로젤의 가교반응에 의한 화학적인 결합 구조를 확인하기 위해 동결건조 완료된 하이드로젤 또는 가루 형태의 히알루론산을 iD5 ATR spectrometer(Thermo sci- entific, USA)를 사용하여 32 scans 조건에서 측정하였다.
유변학적 분석. pH의 영향에 따른 히알루론산의 zero shear viscosity를 확인하기 위해, 1%(w/w) 히알루론산 수용액을 분석에 사용하였다. 히알루론산 수용액은 평균적으로 pH 6.6-6.7로 측정되었고(Orion StarTM, Thermo scientific, USA), 10 mM HCl 용액으로 각각 pH 5.5, 6.5로 조절하여 하이드로젤 제조 시 반응 조건인 상온(20 °C)에서 1, 3일 동안 두고 실험에 사용하였다. Rheometer(AR 2000, TA Instruments, USA) 기기를 사용하여 지름 40 mm 1° cone-plate, 온도 25 °C, gap 27 mm 조건에서 shear rate 0.001~1000(1/s)에 관한 zero shear viscosity를 측정하였다. 히알루론산 하이드로젤의 가교 조건에 따른 modulus를 확인하기 위해 시약의 반응시간 및 몰비별로 준비한 하이드로젤을 각각 분석에 사용하였다. Rheometer(AR 2000, TA Instruments, USA) 기기를 사용하여 지름 40 mm 1° cone-plate, 온도 25 °C, gap 27 mm 조건에서 0.1-100(rad/s) angular frequency에 관한 modulus를 측정하였다.
Scanning Electron Microscopy(SEM) 분석.히알루론산 하이드로젤의 전체적인 내부 구조 및 형태적 특성을 확인하기 위해, 동결건조 완료된 하이드로젤을 분석에 사용하였다. SPT-20(COXEM, Korea) 기기를 사용하여 4 mA, 240초 동안 Au로 하이드로젤을 코팅하였다. 시료는 carbon tape를 이용해 plate에 고정시켰고, CX 200TM(COXEM, Korea) 기기를 사용하여 이미지를 확보하였다.
팽윤 거동 실험. 히알루론산 하이드로젤의 PBS(WelGene Inc., Korea)에 대한 팽윤 거동을 확인하기 위해, 동결건조 완료된 하이드로젤의 무게(W0)를 측정한 후 6 well plate (Corning, USA)에 옮겨주었다. 약 1 g의 하이드로젤이 완전히 잠길 정도로 각 well에 1x PBS(pH 7.4)를 5 mL씩 넣어주고, parafilm을 이용해서 잘 밀봉한 후, 37 °C water bath (JEIO TECH, Korea)에서 정치하였다. 24시간까지, 특정 time point에 하이드로젤의 무게를 측정하였고 아래의 식 (1)로 팽윤 거동을 평가하였다.
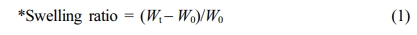
where, W0; 동결건조된 하이드로젤 무게
Wt; 특정 time point에서의 하이드로젤 무게
분해 거동 실험. 히알루론산 하이드로젤의 hyaluronidase에 대한 분해 거동을 확인하기 위해, 동결건조 완료된 하이드로젤 약 1 g을 6 well plate(Corning, USA)에 옮겨주었다. 하이드로젤이 완전히 잠길 정도로 각 well에 1x PBS(pH 7.4)를 5 mL씩 넣어주고, parafilm을 이용해서 잘 밀봉한 후, 37 °C water bath(JEIO TECH, Korea)에서 정치하였다. 팽윤된 하이드로젤이 완전히 잠길 정도로 1x PBS에 녹인 50 U/mL hyaluronidase 용액을 넣어주고, parafilm을 이용해서 잘 밀봉해주었다. Water bath를 이용하여 37 °C에서 hyaluronidase에 의한 하이드로젤의 in vitro 분해 거동을 확인하였다. Hyaluronidase 용액은 매일 교체하면서, 7일까지 특정 time point에 하이드로젤의 무게를 측정하였고 식 (2)로 분해 거동을 평가하였다.
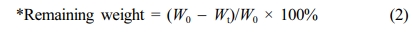
where, W0; 팽윤된 하이드로젤 무게
Wt; 특정 time point에서의 하이드로젤 무게
세포 적합성 실험. 히알루론산 하이드로젤의 세포 적합성을 평가하기 위해, ISO 10993[의료기기의 생물학적 안전에 관한 공통기준규격] 가이드라인을 참조하여 MTT assay에 의한 용출물 실험을 진행하였다. 먼저 10% FBS와 1% PS를 포함한 DMEM 배지에서 human dermal fibroblasts(HDFs, Modern cell and tissue technologies, Korea)를 배양하였다. 배양된 HDFs를 Dulbecco’s phosphate buffered saline(DPBS, WelGene Inc., Korea) 10 mL로 세척하고, trypsin-EDTA를 처리하여 떼어낸 뒤, 96 well
cell culture plate(Corning, USA) 에 1 × 104 cells/well의 농도로 주입하였다. 세포에 처리할 용출물을 준비하기 위해 동결건조 완료된 히알루론산 하이드로젤 0.2 g을 각각 glass vial에 담아준 뒤, DMEM 2 mL을 넣고 하이드로젤에 충분히 스며들게 상온에 두었다. 2시간 뒤에 기존의 DMEM을 제거해주고 새 DMEM 2 mL을 하이드로젤이 담겨있는 glass vial에 넣어주었다. Parafilm을 이용해서 glass vial을 잘 밀봉해주고 37 °C water bath(JEIO TECH, Korea)에서 80 rpm으로 24시간 동안 용출하였다. 24시간 이후, cell strainer(40 mm, FALCON, USA)로 필터한 용출물만 수득하여 세포가 배양되어 있는 well당 100 mL 씩 처리해주고, 37 °C CO2 incubator에서 배양하였다. 24시간, 48시간 후 용출물을 제거해주고, 흡광도 측정을 위해 EZ-cytox kit(EZ-3000, Dogen, Korea) 시약을 처리한 후, 37 °C CO2 incubator에서 반응시켜주었다. 3시간 뒤에, 반응이 끝난 시약을 기포가 생기지 않게 주의하며 96 well UV plate(Corning, USA)에 well당 100 mL 씩 옮겨주었다. Spectramax M2(Molecular device, USA) 기기를 이용하여 450 nm에서 흡광도를 측정하였다.
|
Table 1 Summary of Hyaluronic Acid Hydrogels Prepared with Putrescine and DMTMM or EDC/NHS under Neutral pH Condition (Unit : mol) |
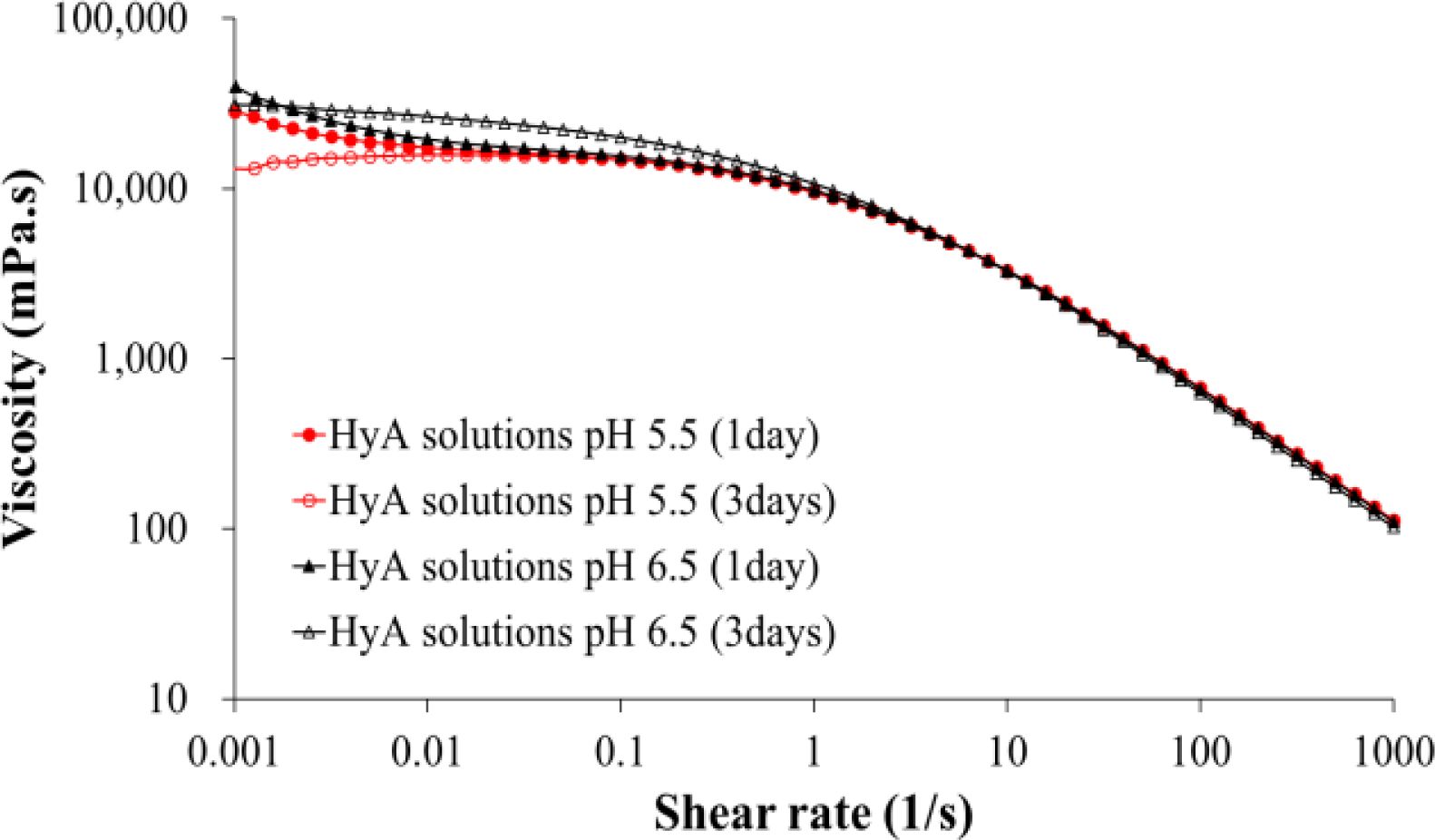
pH의 영향에 따른 히알루론산의 Zero Shear Viscosity. 가교반응 중 pH의 영향에 따른 히알루론산의 분해 거동을 zero shear viscosity로 비교하였다(Figure 1). pH 6.5의 조건에서 3일간 상온에서 유지된 히알루론산 수용액의 zero shear viscosity 값은 경과되어도 큰 변화를 보이지 않은 반면에, 산성 pH의 5.5의 조건으로 3일간 유지된 히알루론산 수용액의 zero shear viscosity 값은 상온에서 3일 후의 값은 상당히 감소되었음을 보여주었다. Zero shear viscosity 값의 감소는 분자량의 저하에 기인한 것으로, 산성 pH 조건에서는 히알루론산의 분자량 저하가 유발됨을 확인하였다. 이후 shear rate가 증가되면 히알루론산 수용액의 일반적인 shear thinning 거동을 두 조건 모두에서 확인할 수 있었다. 따라서 히알루론산 하이드로젤의 제조를 위한 가교반응 중 히알루론산의 분자량 저하를 최소화시키기 위해 중성 pH 조건으로 히알루론산의 가교반응을 수행하였다.
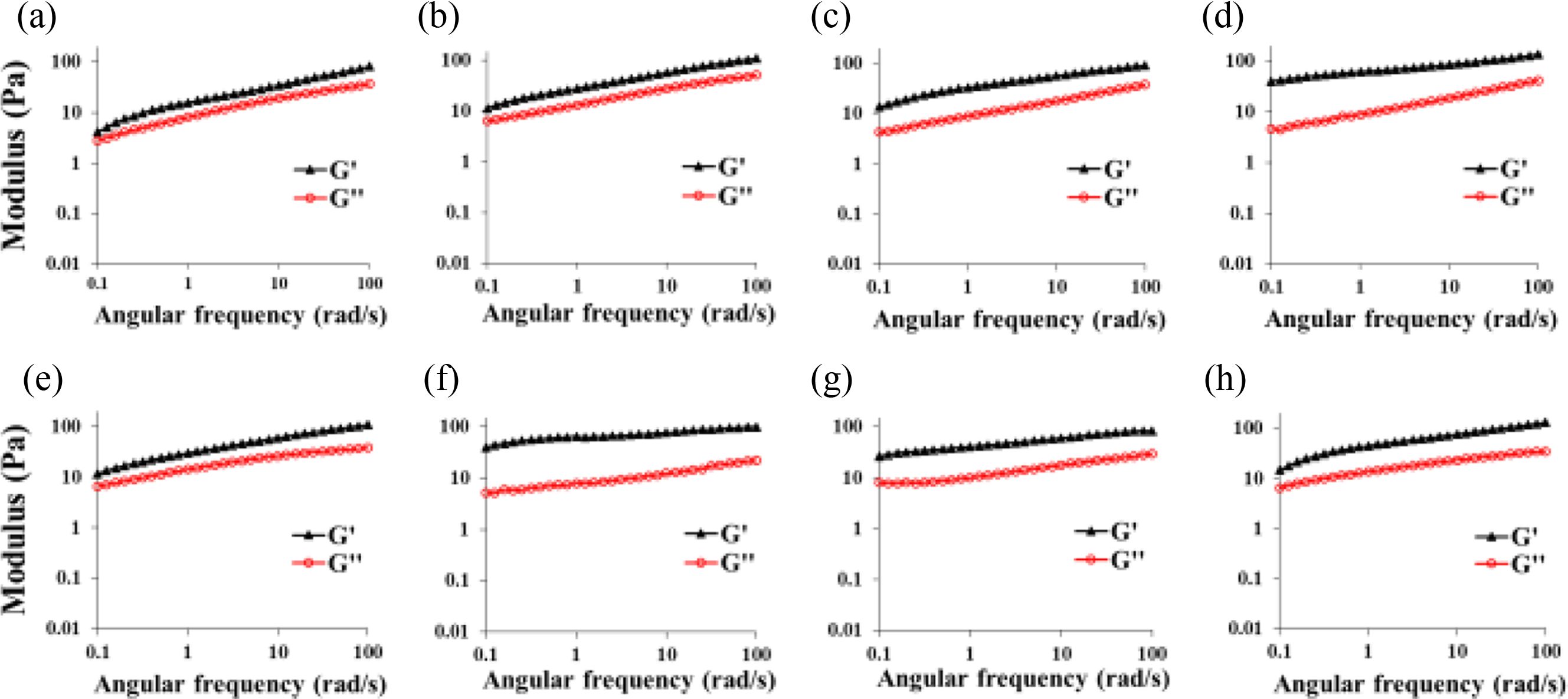
반응시간에 따른 히알루론산 하이드로젤의 젤화특성. 가교 반응시간에 따른 히알루론산 하이드로젤의 가교에 따른 젤의 형성 유무를 G’(storage modulus)와 G’’(loss modulus)로 확인하기 위해, putrescine과 가교제 종류에 따라 중성 pH 조건에서 히알루론산:putrescine:가교제를 1.0:3.0:4.0 몰비로 가교 반응시간에 따른 하이드로젤을 제조하였다(Figure 2). 유변학적 분석에서 G’값이 G’’값 보다 높을 경우, 젤의 특성을 나타내는 것으로 알려져 있다. Figure 2(a-d)에서 볼 수 있듯이 DMTMM에 의해 가교된 하이드로젤의 경우, 1일 후에도 G’값이 G’’값 보다 높아 젤이 형성되었음을 알 수 있었으며, G’값이 4.12 Pa에서 2일, 3일 및 5일에 각각 11.5, 13.7, 40.1 Pa로 점점 증가하는 것이 확인되어 가교 반응이 서서히 진행되고 있음을 확인할 수 있었다. 그러나, Figure 2(e-h)에서 볼 수 있듯이 EDC/NHS에 의해 가교된 하이드로젤의 경우, 초기 1일 및 2일 가교 반응 후에 G’값이 각각 11.56 Pa 및 39.5 Pa로 DMTMM에 의한 가교 보다 높은 값을 나타내었다. 흥미롭게도 3일 및 5일 후에는 G’값이 26.11 Pa 및 14.8 Pa로 반응 시간에 따라 오히려 감소하였다. 이를 통해 중성 pH 조건에서 putrescine을 diamine으로 사용한 반응에서, EDC/NHS에 의한 가교 반응이 DMTMM에 의한 가교 반응보다 훨씬 빨리 진행됨을 알 수 있었다. 따라서, 두 가교제에 의한 히알루론산 하이드로젤의 물성을 비교하기 위해 반응 시간을 2일로 하여 이후 실험을 진행하였다.
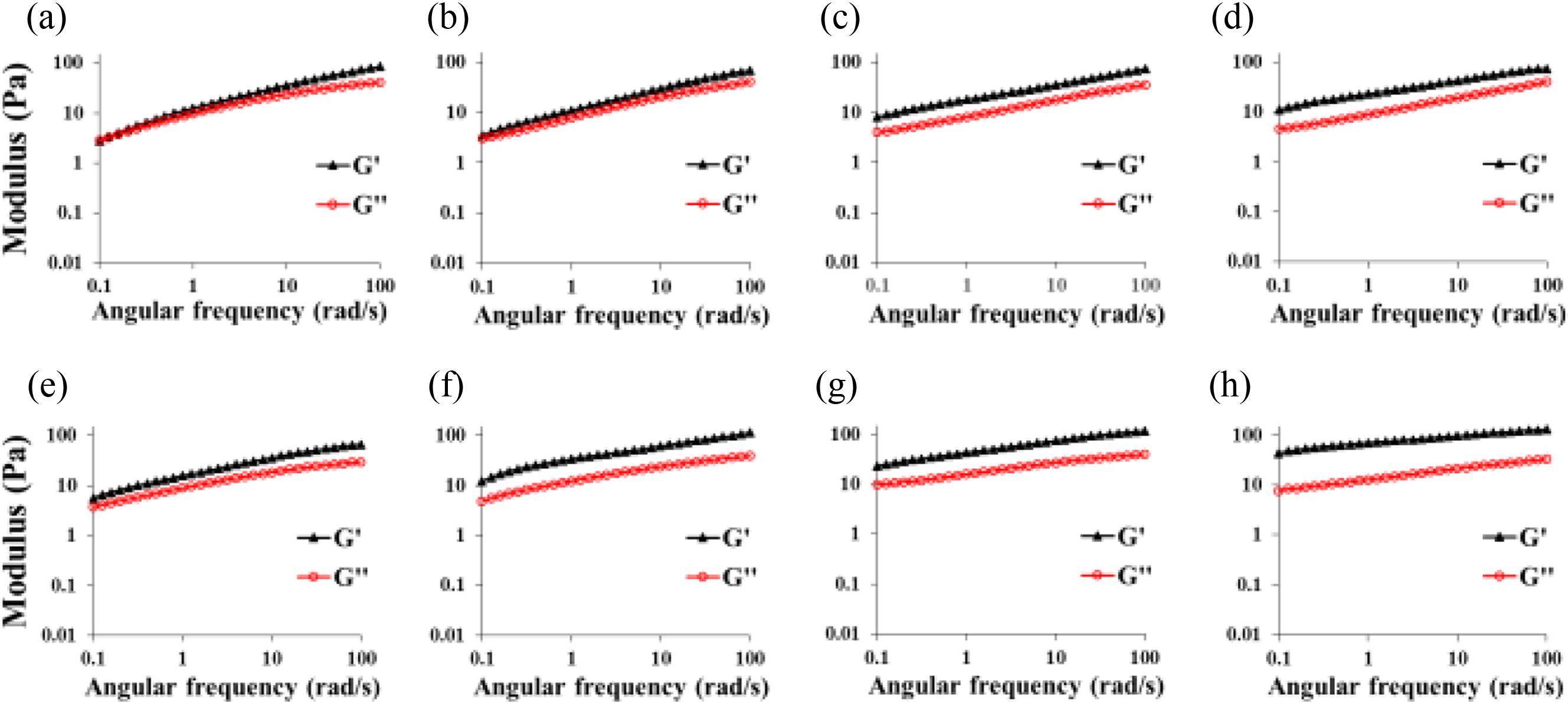
가교 반응 몰비에 따른 히알루론산 하이드로젤의 modulus 분석. Figure 3(a)에서 1.0:1.1:1.1 몰비로 제조한 HPDM 1의 경우, G’값이 2.83 Pa로 G’’값인 3.26 Pa보다 낮은 졸의 특성을 나타내, 가교 반응에 의한 하이드로젤화가 충분하지 않음을 확인할 수 있었다. Figure 3(b-d)에서 나타나는 것처럼, 히알루론산:putrescine:가교제의 몰비가 1.0:1.1:1.1인 HPDM 1 외는 모두 G’값이 G’’값 보다 커지는 것으로 젤의 형성을 확인할 수 있었다. Figure 3(e-h)에서 나타나는 것처럼, HPEN의 경우, 모두 G’값이 G’’값 보다 높아 젤의 형성을 확인할 수 있었다. 특히, HPDM 1-4의 G’값은 각각 2.83 Pa/3.42 Pa/8.02 Pa/11.02 Pa, HPEN 1-4의 G’값은 각각 5.68 Pa/12.02 Pa/22.83 Pa/43.63 Pa로 모든 히알루론산 하이드로젤의 modulus는 몰비에 따라 증가하였다. HPDM은 diamine의 농도에 따라, HPEN은 가교제의 농도에 따라 크게 변화하는 것을 알 수 있었다. 전체적으로 HPEN의 G’값이 HPDM의 G’값 보다 2-3배 높은 값을 나타냄을 알 수 있었으며, 이는 Figure 2에서의 실험결과와 유사하였다.
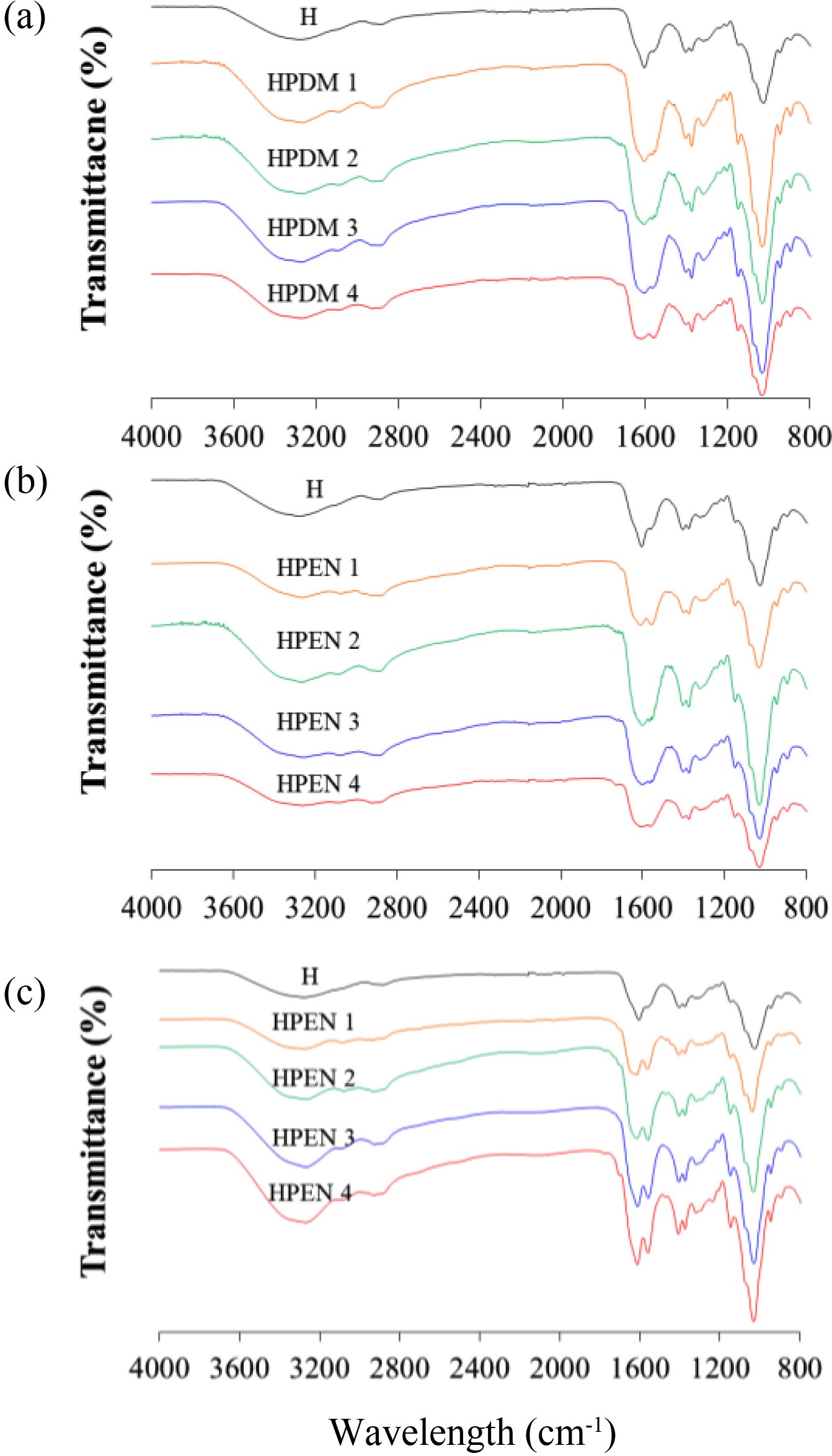
히알루론산 하이드로젤의 화학적 결합 분석(FTIR). 제조한 히알루론산 하이드로젤의 화학적 결합은 FTIR 분석을 통해서 확인하였다. 가교를 하지 않은, 히알루론산과 비교를 해보았을 때, HPDM과 HPEN 등 모든 하이드로젤에서 아마이드 I 및 II에 기인한 1580-1620 cm-1에서의 피크를 확인할 수 있었다. 그러나 HPDM 1의 경우, 1580 cm-1에서의 피크가 약하게 나타나 가교 반응이 완전히 이루어지지 않았음을 알 수 있었고, 이는 Figure 3의 modulus 결과와 같은 경향을 보였다. D’Este 등은 diamine으로 adipic acid dihydrazide의 존재하에 DMTMM 및 EDC/NHS를 이용하여 히알루론산 하이드로젤을 제조할 때, 과잉의 1.0:12:4.0 몰비로 diamine을 사용하였지만,24 본 실험에서 putrescine을 사용한 경우, adipic acid dihydrazide에 비해 diamine의 몰비를 1/8 이상으로 줄여도 반응이 잘 진행되었음을 확인할 수 있었다. 추가적인 1 mM HCl로 처리된 HPEN군의 경우, 처리 후에서도 FTIR에서 큰 변화가 관찰되지 않았다.
Putrescine과 DMTMM 및 EDC/NHS를 사용하여 히알루론산 하이드로젤을 제조한 내용을 Scheme 1에 나타내었다.24 Putrescine과 DMTMM에 의한 히알루론산 하이드로젤의 경우, 히알루론산의 D-glucuronic acid에 존재하는 카복실기는 DMTMM에 의해서 반응 및 활성화되어, 1차적으로 N-methylmorpholinium을 방출하고 활성 ester를 형성한다. 활성 ester는 putrescine의 아민기와 반응하여 4,6-dimethoxy-1,3,5-triazin-2-ol를 방출하면서 아마이드기를 형성하는데,21 이 아마이드 기 간의 결합에 의해 최종적으로 고분자 사슬에 의한 3차원 네트워크 구조가 형성이 된다(Scheme 1(a)).
Putrescine과 EDC/NHS에 의한 히알루론산 하이드로젤의 경우, 히알루론산의 D-glucuronic acid에 존재하는 카복실기는 EDC와 NHS에 의해서 활성화되어, isourea 부산물을 방출하고 NHS ester를 형성한다. NHS ester는 putrescine의 아민기와 반응하여 아마이드기를 형성하는데,19 이 아마이드기 간의 결합에 의해 최종적으로 고분자 사슬에 의한 3차원 네트워크 구조가 형성이 된다(Scheme 1(b)). Figure 4
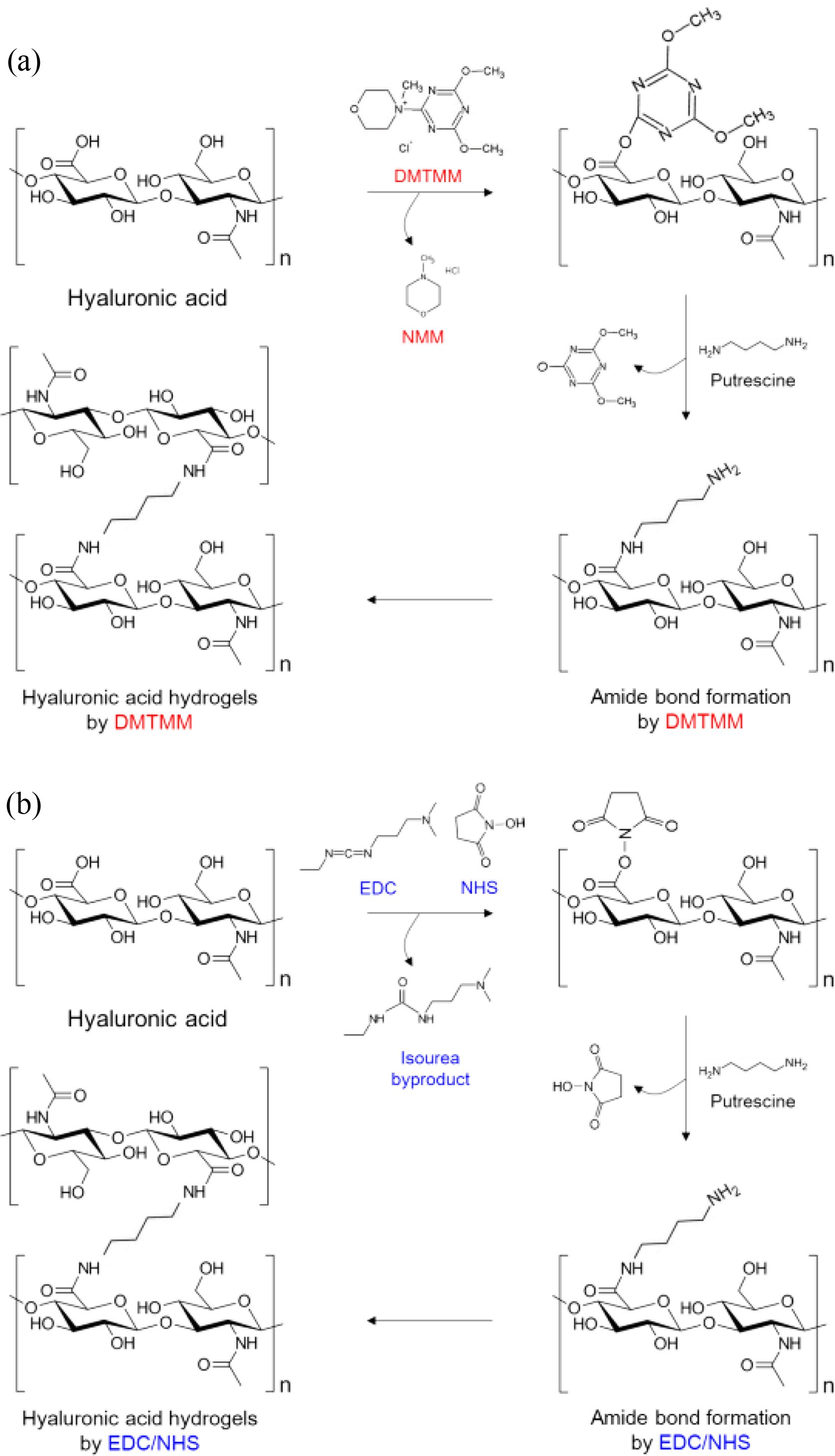
Scheme 1. The synthesis of hyaluronic acid hydrogels prepared with putrescine and DMTMM or EDC/NHS under the neutral pH condition.
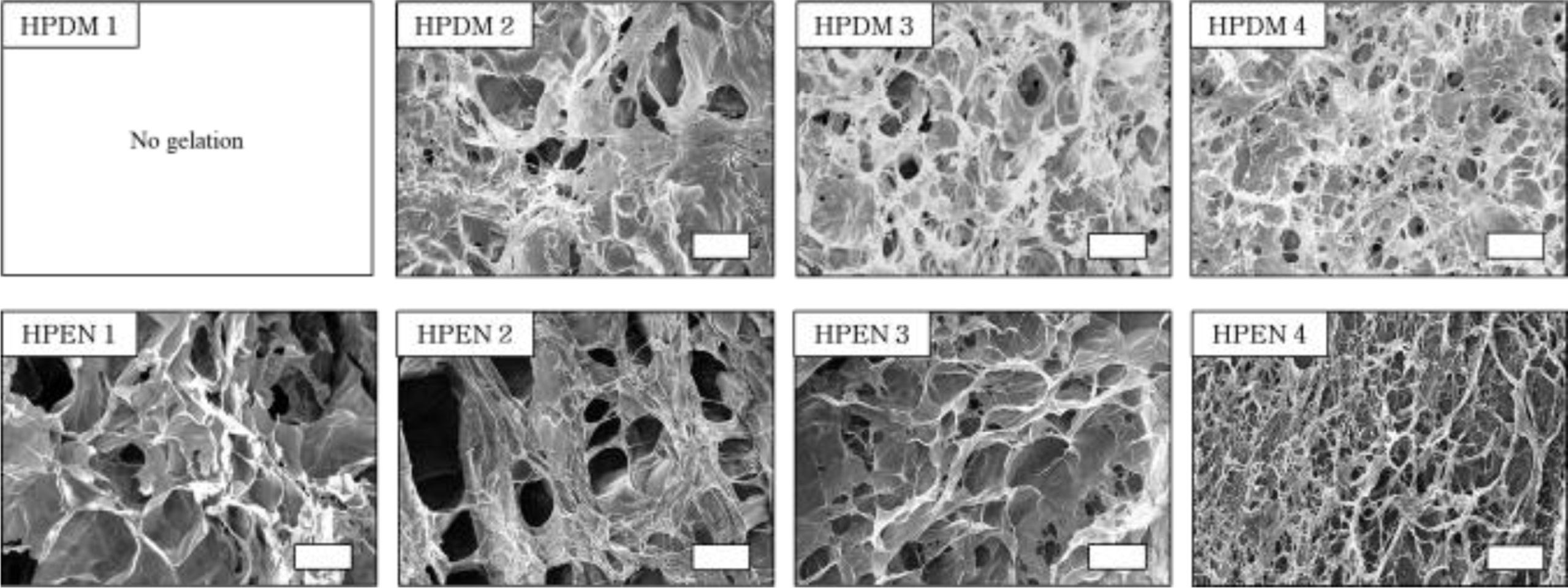
히알루론산 하이드로젤의 형태 확인. 3차원 다공성 스캐폴드에서 기공의 크기 및 연결성은 스캐폴드 내외부의 물질 교환에 중요한 역할을 하며, 세포의 증식 및 생리 조절에 큰 영향을 미친다.26 Figure 5의 SEM에서 볼 수 있듯이, 생체 내에 존재하는 안전한 diamine인 putrescine과 가교제 종류에 따라 제조한 히알루론산 하이드로젤인 HPDM 및 HPEN이 그물망과 같은 다공성 네트워크를 형성한 것을 관찰할 수 있었다. Putrescine과 가교제의 몰비가 증가할수록, HPDM 및 HPEN의 기공의 크기가 작아지는 것으로 보아 가교 정도가 하이드로젤의 기공 크기에 영향을 주는 것을 확인할 수 있었다.
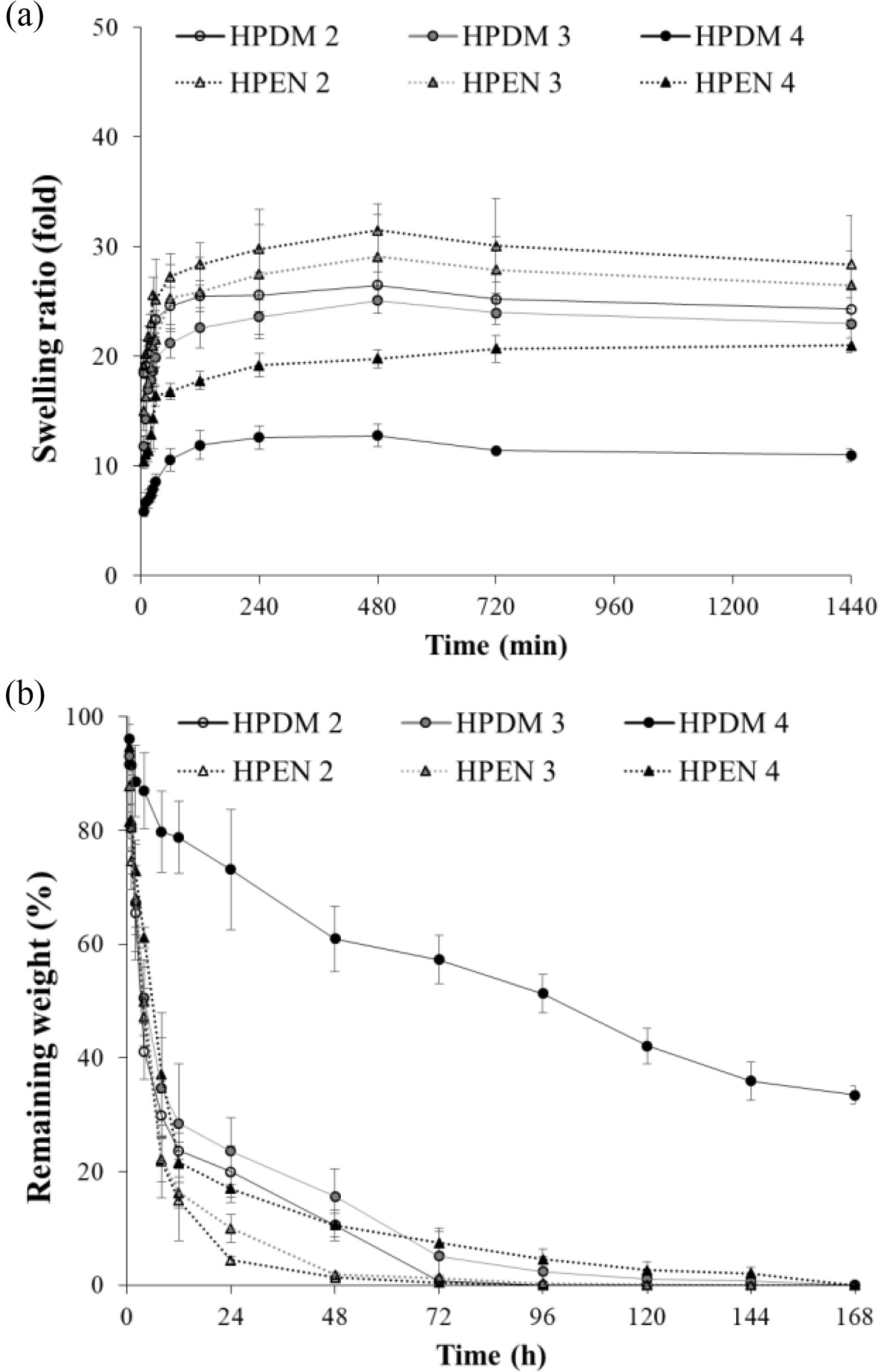
히알루론산 하이드로젤의 팽윤 및 분해 거동 확인. Figure 6(a)에서 볼 수 있듯이 모든 하이드로젤은 약 2시간 만에 팽윤의 평형 값에 도달했고, putrescine과 가교제의 몰비가 높을수록 팽윤 값이 감소했다. 이는 가교에 의한 고분자 사슬이 더 많이 형성되었기 때문이며 팽윤 거동은 하이드로젤의 가교 정도에 영향을 받는다는 사실을 알 수 있었다.
생체 내 분해 정도를 hyaluronidase에 대한 히알루론산 하이드로젤의 분해속도로 확인하여 Figure 6(b)에 나타내었다. EDC/NHS로 가교된 HPEN 2 및 HPEN 3는 효소 처리 후 48시간 이내, HPEN 4는 48시간 후에 약 87%의 질량 감소가 일어났고, 72시간 후에는 분해가 거의 완료되었다. DMTMM으로 가교된 HPDM 2 및 HPDM 3는 효소 처리 후 72시간 이내에 약 80%의 질량 감소가 일어났고, 오히려 HPEN 4와 유사한 경향을 보였다. HPDM 4를 제외한 대부분의 하이드로젤은 72시간 이후에 거의 분해되었다. HPDM 4는 168시간 후에 초기 질량의 35% 이상을 유지하고 있음을 확인하였다. 즉, 히알루론산에 대한 시약의 몰비가 높을수록 가교가 많이 진행되어 hyaluronidase와 같은 효소분해에 대한 저항성을 가졌지만, 전체적으로 HPDM의 분해속도가 HPEN에 비해 지연됨을 확인할 수 있었다. 이와 같은 결과는 EDC/NHS에 의한 가교 반응에서 중성 pH 조건임에도 불구하고, 아마이드기의 형성뿐만 아니라 상대적으로 불안정한 에스테르기의 형성이 동반되기 때문에27 팽윤 및 분해 거동 실험 중 물에 의한 에스테르기의 분해가 먼저 진행되어 하이드로젤의 분해를 촉진하기 때문으로 판단된다.
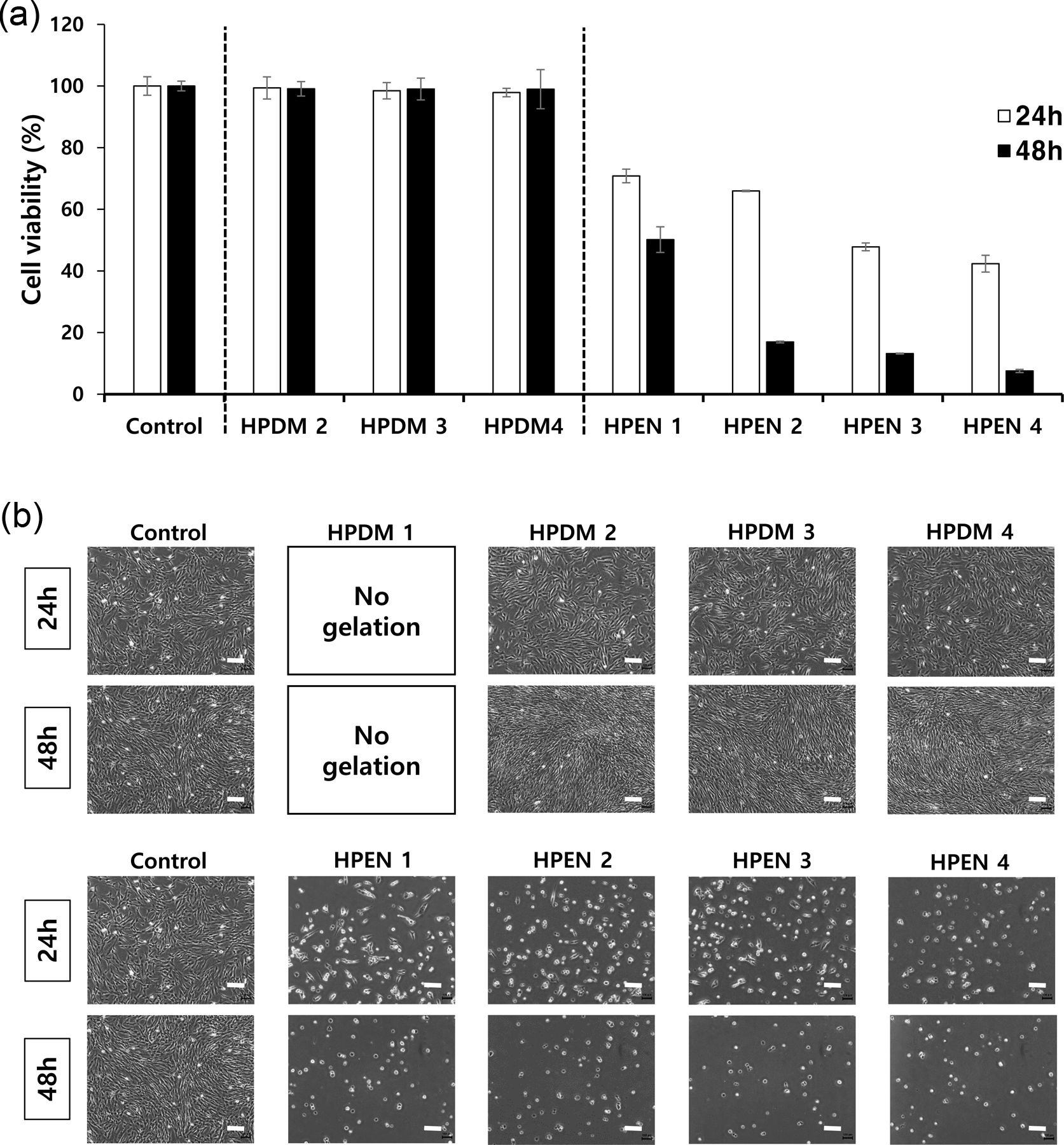
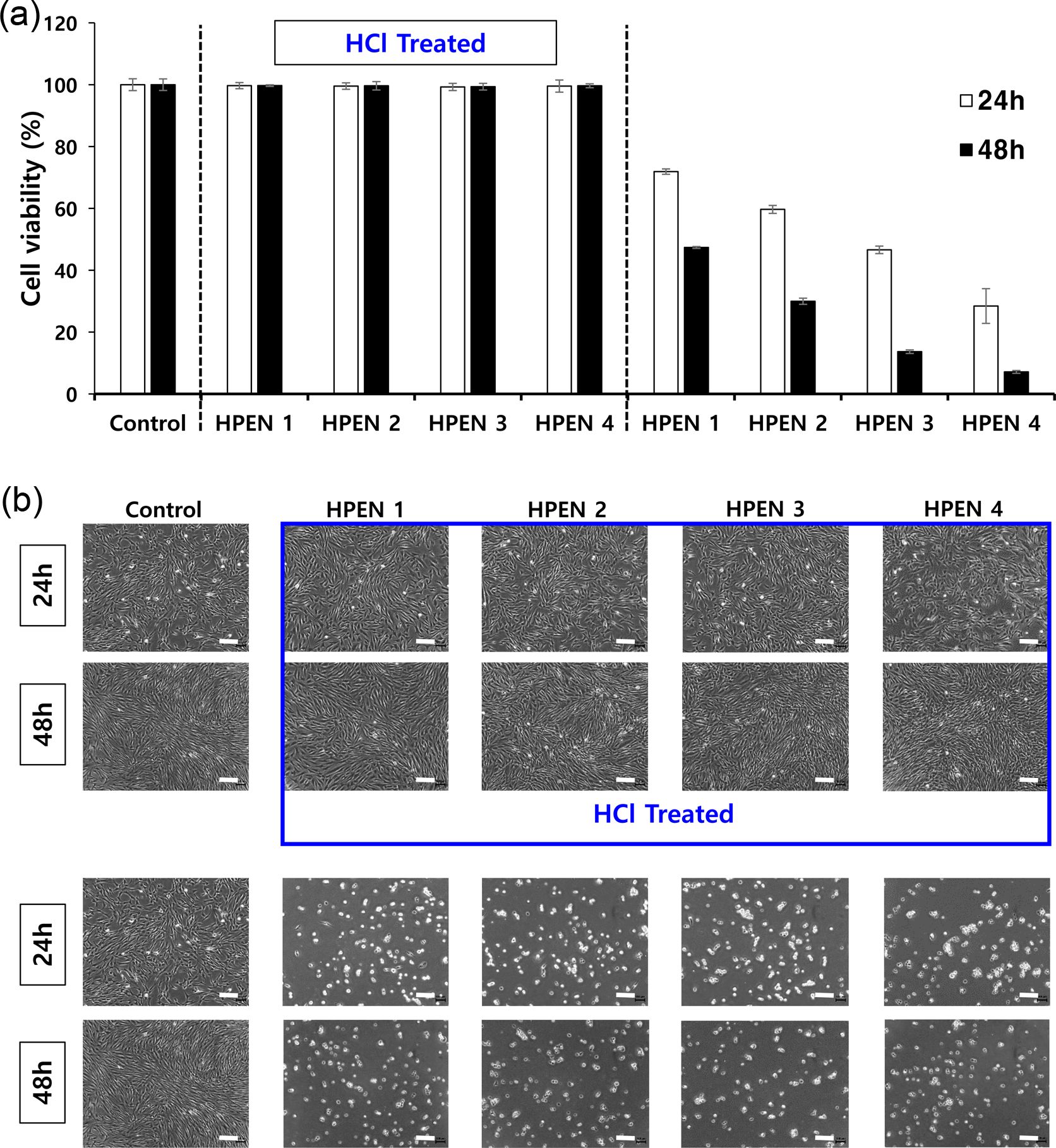
히알루론산 하이드로젤의 세포 적합성 확인. Figure 7(a)의 MTT assay 결과는 용출물을 처리하지 않은 control군과 비교를 하였을 때, HPDM 용출물에서의 HDFs의 생존율이 90% 이상으로, HPDM의 세포 적합성을 나타내었다. 반면에, HPEN 용출물에서의 HDFs의 경우, 세포 생존율이 70% 이하로, HPEN의 성분이 세포의 성장을 저해하는 것을 확인하였다. Figure 7(b)는 각각 24시간, 48시간 동안 하이드로젤 용출물과 함께 배양한 HDFs의 사진으로, HPDM 용출물에서의 HDFs의 경우, control과 유사한 형태인 반면, HPEN 용출물 중에서의 HDFs는 전체적으로 둥근 형태를 나타냈다. 이는 제거가 되지 않은 미반응물 때문으로 판단하여, HPEN를 1 mM HCl 수용액으로 처리하여 미반응물을 제거하고 용출물에 의한 세포 적합성을 MTT assay로 비교 평가하였다. Figure 8(a)의 MTT assay 결과는 용출물을 처리하지 않은 control군과 비교를 하였을 때, 1 mM HCl 처리된 HPEN 용출물에서의 HDFs의 생존률이 90% 이상으로 높아지는 결과를 확인할 수 있었다. Figure 8(b)에서 볼 수 있는 것처럼 하이드로젤 용출물과 함께 배양한 HDFs의 형태는 약산 처리 전의 결과에 비해(Figure 7(b)), 48시간 배양 이후에도 정상 세포의 형태를 유지하고 있었다. 따라서, MTT assay의 결과를 통해서 생체 내에 존재하는 물질인 putrescine과 DMTMM로 제조한 히알루론산 하이드로젤은 90% 이상의 세포 적합성을 가졌고, putrescine과 EDC/NHS로 제조한 하이드로젤과 달리 약산에 의한 미반응물 제거 공정이 필요하지 않음을 확인할 수 있었다.
|
Figure 1 Effect of pH condition on the zero shear viscosity of hyaluronic acid aqueous solutions. Note that the values of viscosity are plotted on log-log scale. |
|
Figure 2 Rheological properties of hyaluronic acid hydrogels prepared with different reaction time. HPDM 4 or HPEN 4 were reacted at room temperature: (a) and (e) 1day; (b) and (f) 2days; (c) and (g) 3days; (d) and (h) 5days; All hyaluronic acid hydrogels were synthesized with neutral pH condition. |
|
Figure 3 Rheological properties of hyaluronic acid hydrogels prepared with different molar ratio of putrescine and DMTMM or EDC/NHS: (a) HPDM 1; (b) HPDM 2; (c) HPDM 3; (d) HPDM 4; (e) HPEN 1; (f) HPEN 2; (g) HPEN 3; (h) HPEN 4. All hyaluronic acid hydrogels were synthesized with neutral pH condition. |
|
Figure 4 FTIR spectra of hyaluronic acid hydrogels (a) HPDM; (b) HPEN; (c) HCl treated HPEN. |
|
Figure 5 SEM image of hyaluronic acid hydrogels. Scale bar = 200 μm. |
|
Figure 6 (a) Swelling behavior of hyaluronic acid hydrogels in 1x PBS; (b) Degradation behavior of hyaluronic acid hydrogels in 50 U/mL hyaluronidase (n=4). |
|
Figure 7 Cytocompatibility test of HPDM and HPEN: (a) MTT assay; (b) HDFs morphology after 24 h, 48 h of culture. Scale bar = 200 μm (n=4). |
|
Figure 8 Cytocompatibility test of HCl treated HPEN and HPEN: (a) MTT assay; (b) HDFs morphology after 24 h, 48 h of culture. Scale bar = 200 μm (n=4). |
DMTMM 및 EDC/NHS를 이용한 가교 반응 중 히알루론산의 분해를 최소화하기 위해, 중성의 pH 조건에서 diamine인 putrescine의 존재 하에 히알루론산 하이드로젤을 제조하고 이들의 물성을 비교 분석하였다. DMTMM 및 EDC/NHS 모두 putrescine의 존재 하에 아마이드기를 형성하였고, putrescine과 가교제의 몰비에 따라 하이드로젤의 가교 정도를 조절할 수 있었다. Putrescine과 가교제의 몰비가 높을수록 hyaluronidase에 대한 분해 저항성을 가졌지만, HPEN의 경우, HPDM에 비해서 상대적으로 분해에 대한 저항성이 떨어졌다. HPDM에서의 용출물 실험 결과, HDFs 생존률은 48시간 동안 90% 이상으로 우수한 세포 적합성을 나타냈지만, HPEN의 경우 약산 처리 공정 이후 HPDM와 비슷한 세포 적합성을 보였다. 이상의 실험을 통해, 중성의 pH에서도 putrescine을 이용하여 생체친화성이 우수한 히알루론산 하이드로젤을 제조할 수 있음을 확인할 수 있었다.
- 1. Collins, M. N.; Birkinshaw, C. Hyaluronic Acid Based Scaffolds for Tissue Engineering-A Review. Carbohyd. Polym. 2013, 92, 1262-1279.
-

- 2. Jung, S. W.; Oh, S. H.; Lee, I. S.; Byun, J.-H.; Lee, J. H. In situ Gelling Hydrogel with Anti-bacterial Activity and Bone Healing Property for Treatment of Osteomyelitis. Tissue Eng. Regen. Med. 2019, 16, 479-490.
-

- 3. Im, G.-I. Perspective on Intra-articular Injection Cell Therapy for Osteoarthritis Treatment. Tissue Eng. Regen. Med. 2019, 1-7.
-

- 4. Lyu, H.-Z.; Lee, J. H. The Efficacy of rhBMP-2 Loaded Hydrogel Composite on Bone Formation Around Dental Implants in Mandible Bone Defects of Minipigs. Biomaterials Res. 2020, 24, 5.
-

- 5. Choi, J.-S.; Oh, S. H.; Kim, Y.-M.; Lim, J.-Y. Hyaluronic Acid/alginate Hydrogel Containing Hepatocyte Growth Factor and Promotion of Vocal Fold Wound Healing. Tissue Eng. Regen. Med. 2020, 17, 651-658.
-

- 6. Min, S.-J.; Kim, S.-W.; Lee, T.-H.; Kwon, I.-K.; Son, T.-I. Preparation of Injectable Hydrogels Immobilized with FGF Using UV-curable Hyaluronic Acid Derivatives. Polym. Korea 2020, 44, 451-458.
-

- 7. Sung, Y. K.; Kim, S. W. Recent Advances in Polymeric Drug Delivery Systems. Biomaterials Res. 2020, 24, 1-12.
-

- 8. Yang, J.-M.; Kim, H.-J.; Cho, B.-K. Preparation of Antioxidant Hydrogel Contact Lenses Based on Interpenetrating Hyaluronic Acid Network, Polym. Korea 2020, 44, 21-29.
-

- 9. Hong, B. M.; Park, S. A.; Park, W. H. Effect of Photoinitiator on Chain Degradation of Hyaluronic Acid. Biomaterials Res. 2019, 23, 1-8.
-

- 10. Xu, X.; Jha, A. K.; Harrington, D. A.; Farach-Carson, M. C.; Jia, X. Hyaluronic Acid-based Hydrogels: from a Natural Polysaccharide to Complex Networks. Soft Mater. 2012, 8, 3280-3294.
-

- 11. Khunmanee, S.; Jeong, Y.; Park, H. Crosslinking Method of Hyaluronic-based Hydrogel for Biomedical Applications. J. Tissue Eng. 2017, 8, 2041731417726464.
-

- 12. Yang, B.; Guo, X.; Zang, H.; Liu, J. Determination of Modification Degree in BDDE-modified Hyaluronic Acid Hydrogel by SEC/MS. Carbohyd. Polym. 2015, 131, 233-239.
-

- 13. Shimojo, A. A.; Pires, A.; Lichy, R.; Santana, M. H. The Performance of Crosslinking with Divinyl Sulfone as Controlled by the Interplay between the Chemical Modification and Conformation of Hyaluronic Acid. J. Brazil. Chem. Soc. 2015, 26, 506-512.
-

- 14. Ibrahim, S.; Kang, Q. K.; Ramamurthi, A. The Impact of Hyaluronic Acid Oligomer Content on Physical, Mechanical, and Biologic Properties of Divinyl Sulfone‐crosslinked Hyaluronic Acid Hydrogels. J. Biomed. Mater. Res. A 2010, 94, 355-370.
-

- 15. Calles, J. A.; Ressia, J. A.; Llabot, J. M.; Vallés, E. M.; Palma, S. D. Hyaluronan–itaconic Acid–glutaraldehyde Films for Biomedical Applications: Preliminary Studies. Sci. Pharm. 2016, 84, 61-72.
-

- 16. Kirk, J. F.; Ritter, G.; Finger, I.; Sankar, D.; Reddy, J. D.; Talton, J. D.; Nataraj, C.; Narisawa, S.; Millán, J. L.; Cobb, R. R. Mechanical and Biocompatible Characterization of a Cross-linked Collagen-hyaluronic Acid Wound Dressing. Biomatter 2013, 3, e25633.
-

- 17. Cao, W.; Sui, J.; Ma, M.; Xu, Y.; Lin, W.; Chen, Y.; Man, Y.; Sun, Y.; Fan, Y.; Zhang, X. The Preparation and Biocompatible Evaluation of Injectable Dual Crosslinking Hyaluronic Acid Hydrogels as Cytoprotective Agents. J. Mater. Chem. B 2019, 7, 4413-4423.
-

- 18. Nakajima, N.; Ikada, Y. Mechanism of Amide Formation by Carbodiimide for Bioconjugation in Aqueous Media. Bioconjugate Chem. 1995, 6, 123-130.
-

- 19. Bulpitt, P.; Aeschlimann, D. New Strategy for Chemical Modification of Hyaluronic Acid: Preparation of Functionalized Derivatives and Their Use in the Formation of Novel Bio- compatible Hydrogels. J. Biomed. Mater. Res. A 1999, 47, 152-169.
-

- 20. Kunishima, M.; Kawachi, C.; Monta, J.; Terao, K.; Iwasaki, F.; Tani, S. 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-Morpho- linium Chloride: An Efficient Condensing Agent Leading to the Formation of Amides and Esters. Tetrahedron 1999, 55, 13159-13170.
-

- 21. Farkaš, P.; Bystrický, S. Efficient Activation of Carboxyl Polysaccharides for the Preparation of Conjugates. Carbohyd. Polym. 2007, 68, 187-190.
-

- 22. Raw, S. A. An Improved Process for the Synthesis of DMTMM-Based Coupling Reagents. Tetrahedron Lett. 2009, 50, 946-948.
-

- 23. D’este, M.; Eglin, D.; Alini, M. A Systematic Analysis of DMTMM vs EDC/NHS for Ligation of Amines to Hyaluronan in Water. Carbohyd. Polym. 2014, 108, 239-246.
-

- 24. Til, H.; Falke, H.; Prinsen, M.; Willems, M. Acute and Subacute Toxicity of Tyramine, Spermidine, Spermine, Putrescine and Cadaverine in Rats. Food Chem. Toxicol. 1997, 35, 337-348.
-

- 25. Farriol, M.; Segovia-Silvestre, T.; Castellanos, J. M.; Venereo, Y.; Orta, X. Role of Putrescine in Cell Proliferation in a Colon Carcinoma Cell Line. Nutrition 2001, 17, 934-938.
-

- 26. Seliktar, D. Designing Cell-compatible Hydrogels for Biomedical Applications. Science 2012, 336, 1124-1128.
-

- 27. Tomihata, K.; Ikada, Y. Crosslinking of Hyaluronic Acid with Water‐soluble Carbodiimide. J. Biomed. Mater. Res. B 1997, 37, 243-251.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(4): 601-609
Published online Jul 25, 2021
- 10.7317/pk.2021.45.4.601
- Received on Mar 18, 2021
- Revised on Apr 16, 2021
- Accepted on Apr 21, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Chun-Ho Kim
-
Laboratory of Tissue Engineering, Korea Institute of Radiological Medical Sciences, Seoul 01812, Korea
- E-mail: chkim@kcch.re.kr
- ORCID:
0000-0001-9737-9202









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.