- Dissolution Properties of Controlled Release Capsules Containing Quetiapine Fumarate
Pil Yun Kim, Jun Jae Jung, Nam Yeong Kim, Jin Woo Kim, Jeong Min Choi, Won Chan Lee, Jeong Eun Song, and Gilson Khang†

Department of BIN Convergence Technology, Department of Polymer Nano Science & Technology and Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Jeonju 54896, Korea
- 쿠에티아핀 푸마르산을 함유하는 방출제어 캡슐제의 용해특성
전북대학교 BIN융합공학과, 고분자나노공학과, 고분자융합소재연구소
Quetiapine fumarate (QF) is a
BCS CLASS II with low solubility and high permeability, which has a problem of
low bioavailability. It has also been reported that Quetiapine possesses two
hydroxyl groups, so it has a higher solubility under acidic conditions. The
solubility is low in the range of pH 4 or higher and it is high
when pH is 2, and it decreases when the pH is lower than 2 which is due to ion
effect. Therefore, capsules were prepared using immediate-release and
sustained-release granules to improve the solubility of QF and induce constant
release even with a change in pH. XRD and DSC were used to evaluate the
crystallinity and inclusion of drugs, SEM was used for morphological analysis,
and FTIR was used to analyze chemical changes. In addition, fluidity was
evaluated to confirm that it was improved by granulation process. Finally, the
solubility patterns of solid dispersions and capsules were analyzed by a
solubility test.
쿠에티아핀 푸마르산(quetiapine
fumarate, QF)은 낮은 용해도와 높은 투과성을 갖는 BCS CLASS Ⅱ로 생체이용률이
낮은 문제가 있다. 또한 쿠에티아핀은 2개의 수산화기를 보유하여, 산성 조건 하에서 더 높은 용해도를 갖는다고 보고되어 있다. 즉, pH 4 이상의 범위에 대해서는 용해도가 낮고, pH 2에서 높은
용해도를 보이며, pH 2 미만에서는 이온 효과로 인하여 용해도가 감소한다. 따라서 QF의 용해도를 향상시키고
pH의 변화에도 일정한 방출을 유도하기 위해 속방 및 서방성 과립물을 이용한 캡슐을 제조하였다.
XRD와 DSC를 사용하여 약물의 결정성과 포접을 평가,
SEM을 통해 형태학적인 분석, FTIR 분석을 수행하여 화학적 변화를 분석하였다. 또한 습식과립공정을 통해 유동성이 개선된 것을 확인하기 위해 유동성 평가를 하였으며 최종적으로, 용해도 시험으로 고체 분산체 및 캡슐제의 용해도 패턴을 분석하였다.
Capsules were prepared using immediate-release and
sustained-release granules to improve the solubility of QF and induce constant
release even with a change in pH.
Keywords: quetiapine fumarate, immediate release, sustained release, controlled release, rotary evaporation, spray dry solid dispersion
본 연구는 과학기술정보통신부의
재원으로 한국연구재단의 지원(NRF-2017K1A3A7A03089427)을 받아 수행된 국제화기반조성사업이다.
정신분열병의 약물
치료분야에서 항정신병 효과가 우수하면서 부작용이 적고, 장기적인 적응성이 우수한 약을 개발하는 연구가 1980년대 이후부터 현재까지 계속되고 있다. 조현병, 조울증 등의 치료제로 사용되는 푸마르산 쿠에티아핀(quetiapine
fumarate, QF)은 도파민, 세로토닌 및 아드레날린성 길항제로 세로토닌성(5-HT1A) 수용체와 도파민 D2 수용체에 강하게 작용하는 비정형적
항정신병제제이다.1,2
또한 QF는 6-7시간의 짧은 반감기를 갖고, 치료 지수가 높으며, 음식에 의해 흡수가 영향을 받지 않아 이상적인 서방형제제로
사용된다.3,4
그러나 QF는 낮은
용해도와 높은 투과성을 갖는 BCS CLASS II로 생체이용률이 낮은 문제가 있다.4
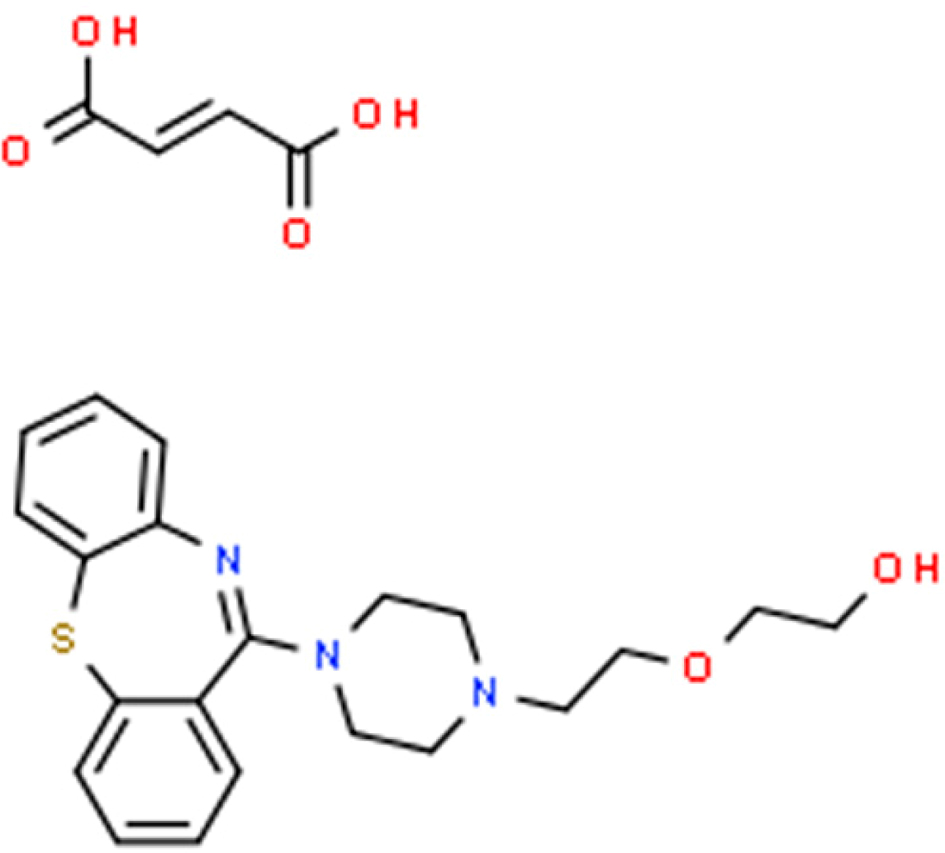
이는 QF가 2개의 수산화기를 보유하기 때문이며(Figure 1), 이에 따라 pH
4 이상의 범위에서는 용해도가 낮고, pH 2에서 높은 용해도를 보이며, pH 2 미만에서는 이온 효과로 인하여 용해도가 감소된다.5
따라서 QF의 용해도를
향상시키고, pH의 변화에도 일정한 방출을 유도하기 위해 속방 및 서방성 고체분산체를 이용하여 방출제어 캡슐을 제조하였다.
고체분산은 고분자
사슬 속에 원약물의 입자
크기를 감소 시켜 표면적을 극대화하고 높은 적심성 및 높은 다공성을 갖게 하여 분산시키는 기술으로써 용해도를 향상시키는데 사용될 수 있다.6-9
이는 약물의 용해도에 관한 Noyes-Whiney 식 (1)을 통해 확인할 수 있다.

(dC/dt:
용해도, A: 용해가능한 표면적, D: 약물의 확산계수, Cs: 용해 물질 내에서의 약물의 용해도, C:
임의시간 t에서의 약물의 농도, h: 약물 표면 확산경계층의 두께)
고체분산화기술 중
일반적으로 용매증발법이 사용되며, 용매증발법 중에서도 분무 건조법은 고속 분무 및 고온 및 고압 하에서 건조시켜 약물의 크기를 감소시킨다.10
분무 건조의 장점으로는 대량생산 가능성과 재현성이며 입자 크기를 제어할 수 있다.11
또 다른 고체분산화 공정인 회전 증발법은 일반적으로 대량생산이 어려워 소규모 실험실에서
사용된다.12
그러나 이러한 분무건조된
고체분산체 제조 기술은 입자크기를 줄여 큰 비표면적으로 인하여 흐름성을 낮추는 단점이 있다.13
이를 개선하기 위하여 락토즈(lactose)와 미결정 셀룰로오스(microcrystalline
cellulose, MCC)를 이용한 습식과립 공정을 도입하여 캡슐 충전 전 혼합 분말의 흐름성 및 균질성을 개선하였다.14
부형제인 락토스와 붕해제인 MCC의 혼합사용은 습식과립화 공정에서 과립 강도를 증가시키고
과립형성을 도와주기 때문이다.15,16
그리고 pH 변화에도 독립적으로 일정한 방출을 유도하기위해, 친수성
고분자인 하이드록시프로필 메틸셀룰로오스 (hydroxypropyl methyl cellulose, HPMC)를 이용하여 서방화를 유도했다.17
HPMC는 비독성 특성과 제조 용이성을 가지며, 락토스와의 혼합비율로 방출제어가 가능한 것으로 보고된다.18-20
따라서 서방화기제인
HPMC를 점도 별, 농도 별로 나노단위 크기의 고체분산체를 제조하여 약물의 서방화를 목표로 서방화의 정도를 비교하였다.
그러나 일반적으로
약물이 서방화가 되면 약물의 유효 혈중 농도도달 시간이 길다는 단점이 있다. 이를 단축하기 위해 서방화 공정은 동일하나, 높은 가용화 효과를 보이는
가용화제인 폴리비닐피롤리돈(polyvinylpyrrlidone, PVP) K30을 담체로 하는 고체분산체를 만들어 습식과립 공정 후 속방성 과립물을
캡슐에 혼합하여 초기에는 빠르게 용출되어 유효약물농도까지 도달하고 후기에는 서방형 약물이 서서히 용출되어 반감기에 저항하는 방출조절의 용출패턴을
유도하였다.21,22
|
Figure 1 Chemical structure of quetiapine fumarate. |
시약 및 재료. 본 연구에 사용된 원약물인 QF(한국), 고분자인
PVP K-30은 Showa(일본)에서, Lactose는 Sigma-Aldrich (미국)에서, MCC는 JRSPharma(일본), HPMC K4M, K15M, K100M은
화원약품(한국), 시판제 쿠에타핀정은 환인제약(한국)에서 구입하여 사용하였다. 그 외 사용한 모든 시약은 HPLC 등급을 사용하였다.
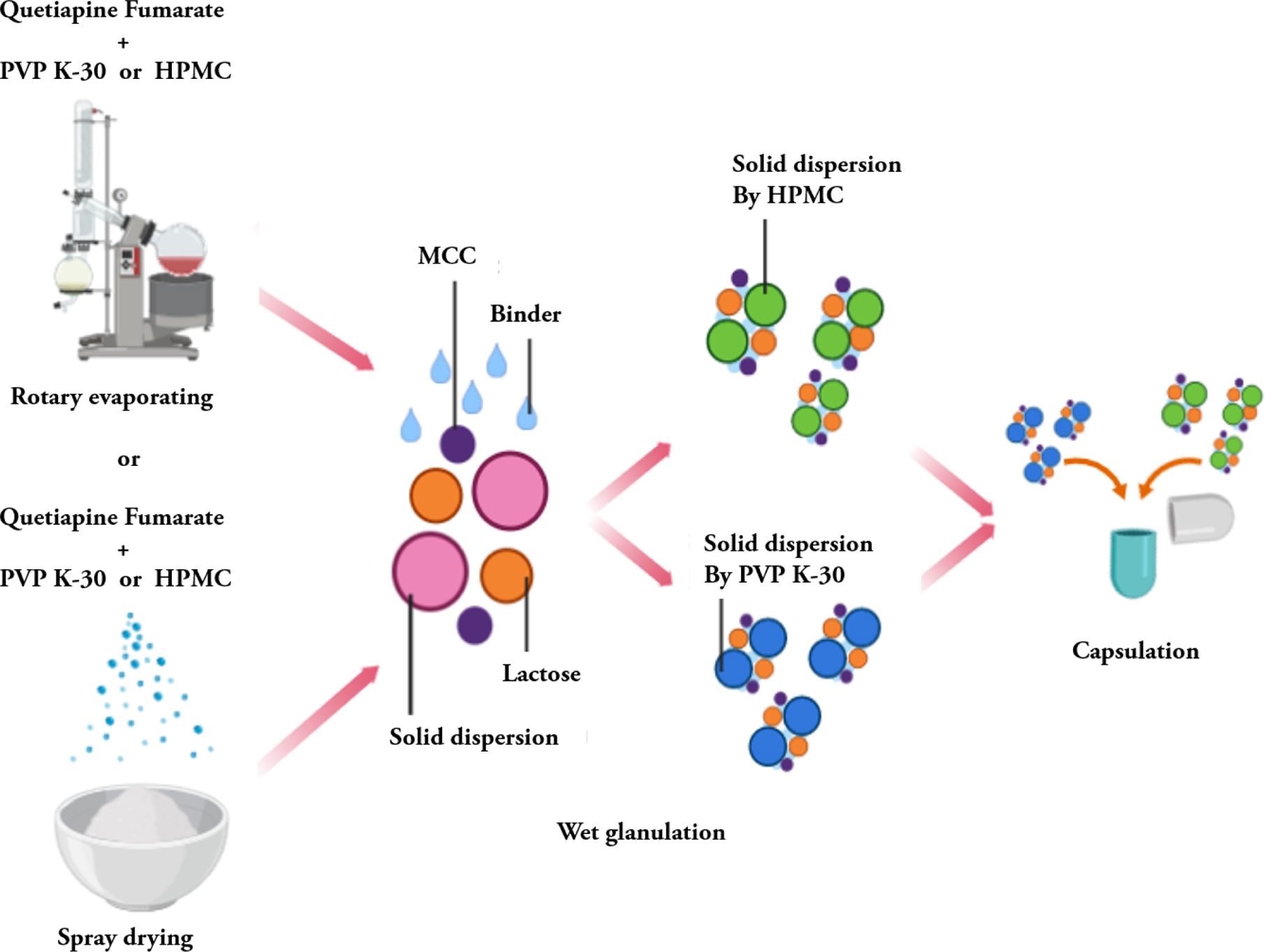
고체분산체의 제조. QF를 고체분산체로 제조하기 위해, 메탄올(methanol,
MeOH), 염화메틸렌(dichloromethane, DCM)을 각 6:4로 혼합하여 용매를 제조하고 Table 1에 명시된 각 배치(batch)
별 배합표(fomulation)대로 용해시킨 후 Scheme 1과 같이 회전증발법과 분무건조법을 사용하여 고분자에
포접시켜 주었다.
회전증발(rotary
evaporation, RE)의 경우 회전증발농축기(rotary evaporator N-1000. Eyela, 일본)을 사용하여 55 oC의 온도로 설정한 항온조에 40 rpm의 회전속도로 용매를 모두 충분히 건조시킨 후 초저온 냉장고(deep freezer, Ilshin, Korea)를 이용하여 동결시킨 후 동결분쇄기(freezer/mill
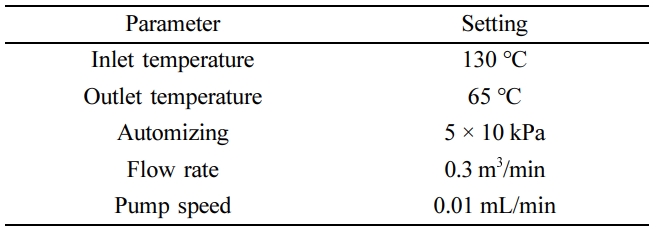
6770, Spex, USA)를 사용하여 분쇄시키고, 사용 전까지 데시케이터에 보관하였다. 분무건조(spray drying, SD)의 경우 회전증발에서
좋은 포접률 및 이상적인 용출패턴을 갖는 배치를 Table 2에 명시된 조건으로 분무건조(spray dryer SD-1000, Eyela, 일본)하여 제조하였으며, 사용 전까지 데시케이터에 보관하였다.
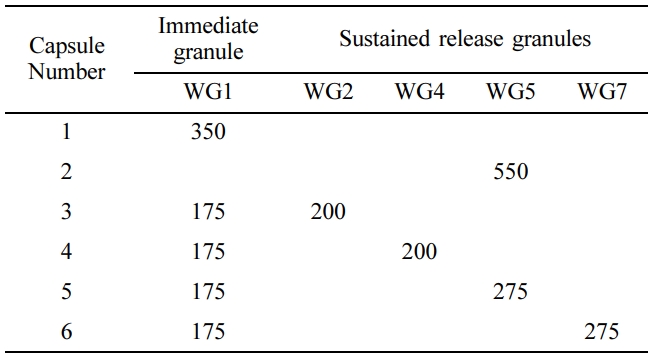
습식과립제의 제조. QF를 함유하는 과립제의 제조는 Scheme 1과 같이 고체분산체와,
부형제 및 붕해제 혼합하여 제조하였다. SD 방법으로 각 제조된 속방성, 서방성 고체분산체마다 Table 3과 같이 부형제 및 붕해제를 혼합하고 각각의 혼합물을
1% PVP K-30용액을 미세 분무기로 분무하며 조립하여 속방성, 서방성 과립물을 제조하였다. 제조된 과립제를 열풍건조기에 넣고 약 20분간
건조한 후, 다시 동결건조기를 통해 6시간 건조하였다. 건조시킨 과립제를 250 μm 크기를 갖는 체에 걸러 입도를 균일하게 정립하였으며, 수득된 과립물은 사용하기 전까지 데시케이터에 보관하였다.
캡슐 충전. Scheme 1과 같이 서방화된 과립제와 가용화된 과립제를 각각
원약물 기준 1:1 비율로 Table 4와 같이 캡슐에 충전하였다.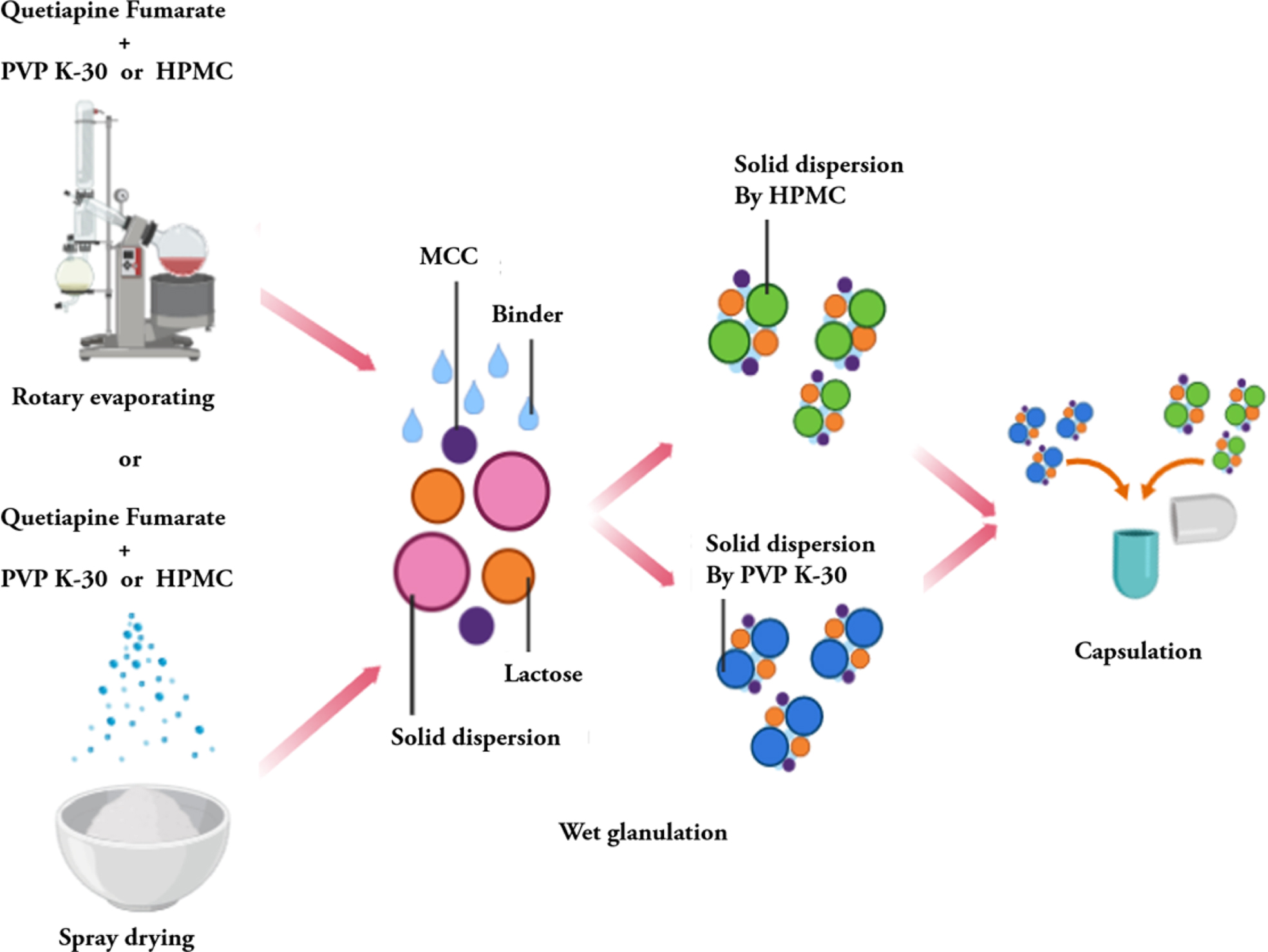
Scheme 1. Capsule manufacturing process
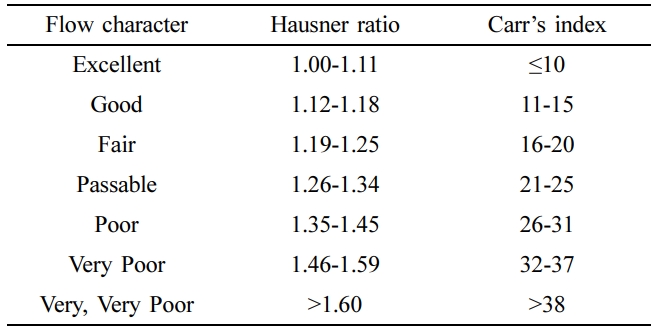
원약물과 과립물의 유동 특성 측정. 고체분산체 중 SD7 과 과립물들의 유동 특성을 측정하기
위해서 대한약전 겉보기밀도 및 탭밀도 측정법 제 1 법 정질량법으로 실시하여 식 (2), (3)으로 계산하여 Table 5에 나타낸
Hausner Ratio, Carr’s Index 지표로 유동성특성을 판단했다.23,24
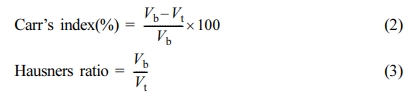
(Vb:
겉보기 부피, Vt: 탭 부피)
고체분산체의 포접률 측정. 고체분산체의 포접률을 측정하기 위해서 MeOH,
DCM을 2:1비율로 혼합하여 QF 150 mg을 기준하여 각 배치 별로 고체분산체의 QF 함량을 식 (4)로 계산하였다.25

고체분산체의 형태학적 특성분석. QF과 PVP K-30, HPMC K4M, HPMC
K15M, HPMC K100M 그리고 고체분산체들의 입자크기 및 표면을 관찰하기 위해 주사전자현미경(Bio LV-SEM, S-3000N, Hitachi Co, 일본)을
사용하여 분석을 실시하였다. SEM 분석을 위해 샘플들을 전도성 탄소 테이프 위에 고정시키고 백금-팔라듐코팅을 아르곤가스 하에서 실시했다. 코팅된
샘플은 20.0 Kv로 관찰하였다.
고체분산체의 구조학적 특성분석. QF와 각 고분자들 그리고 고체분산체들의 분자구조를 분석하고
분자간 화학 결합이 발생했는지 확인하기 위하여 FTIR(GX, Perkin Elmer, Waltham, Massachusetts, USA)을 사용해
분석하였다. 분석법으로는 ATR법을 사용하였으며 측정 범위는 4000~400 cm-1 에서 측정되었다.
고체분산체의 열적 특성분석. QF와 PVP K-30, HPMC K4M, HPMC K15M, HPMC K100M 및 고체분산체들의 열적분석을 통하여 고분자들에 원약물이
포접이 잘 이루어졌는지 확인하기 위해 DSC(TA5000/DSC2950, TA Instrument, USA)를 사용하였다. 각 물질의 5~10 mg을 이용해 DSC용 알루미늄팬에 밀봉하였고 밀봉된 팬을 30 oC/min의 승온속도로
-10~300 oC까지 온도를 상승시키며
측정하였다.
고체분산체의 결정학적 특성분석. 고분자들에 원약물인 QF가 포접이 잘 이루어졌는지 확인하기
위해 PXRD(MAX 2500 X-RAY diffractometer, 일본)로 결정성을 분석하였다. 선 회절은 0.3 mm의 투명한 유리 기관에 일정량의 샘플을 충분히 적층시켜
배향이 발생하지 않도록 하였고 이를 30 mA, 40 KV의 조건으로 측정하였다. 분석 시작각과 종료각은 각각 5°에서 50°로 하였으며, step size는
0.02°로 설정하여 진행하였다.
고체분산체 및 경질캡슐의 생체 외 방출거동. 제조된 고체분산체와 quetapine jung(환인제약, 한국) 및 경질캡슐의 용출시험은 USP dissolution
apparatus II(paddle method)으로 실시하였다. 용출액은 증류수, 인공위액(pH 1.2), 인공장액(pH 6.8)으로 USP(USP Method A acid
stage, buffer stage)에 따라 제조하였으며 용출기는 DTS-8(Lab House, 한국)을 사용하였고, 속도는 100 rpm, 용출액의 온도는 37±5 oC의 조건으로 실험하였다. 용출액의 양은 900 mL로 설정하였으며 검액추출시간은 인공위액 용출시험은
5, 10, 15, 30, 45, 60, 90, 120, 240, 360, 720분으로 하였으며, 증류수와 인공장액 용출시험은 5, 10,
15, 30, 45, 60, 90, 120, 240, 360, 480, 600, 720분으로 진행하였다. 각 시간 별로 시료를 batch당 2 mL씩 취한 후 2 mL씩 충전하였다. 취한 검액은 0.45 μm PTFE 필터로 여과한 후 HPLC를 이용하여 측정하였다. HPLC는 NS-4000(휴텍스, 한국)과 컬럼오븐은 AT-4000(휴텍스,
한국) 오토샘플러 NS-6000(휴텍스, 한국)을 사용하여 분석하였다. 사용된 칼럼의 종류는 Intersil® OSD-3 C18(4.6×150 mm, 5 μm, GL Science Inc)을 사용하였다. 유속은
1.0 mL/min, 시료 주입량은 100 μL로 분석하였으며 컬럼의 온도는 37±5 oC, 검출파장은 UV 254 nm을 사용하였고 이동상은 아세토 나이트릴, 0.02 M 인산완충액 pH 5.5(65:35)을 제조하여 사용하기
전 초음파분쇄기로 탈기하여 사용하였다.
|
Table 1 Formulation of Quetiapine Fumarate (QF) with Polymer Using Spray Dryer (SD) and Rotary Evaporator (RE)
(unit: mg) |
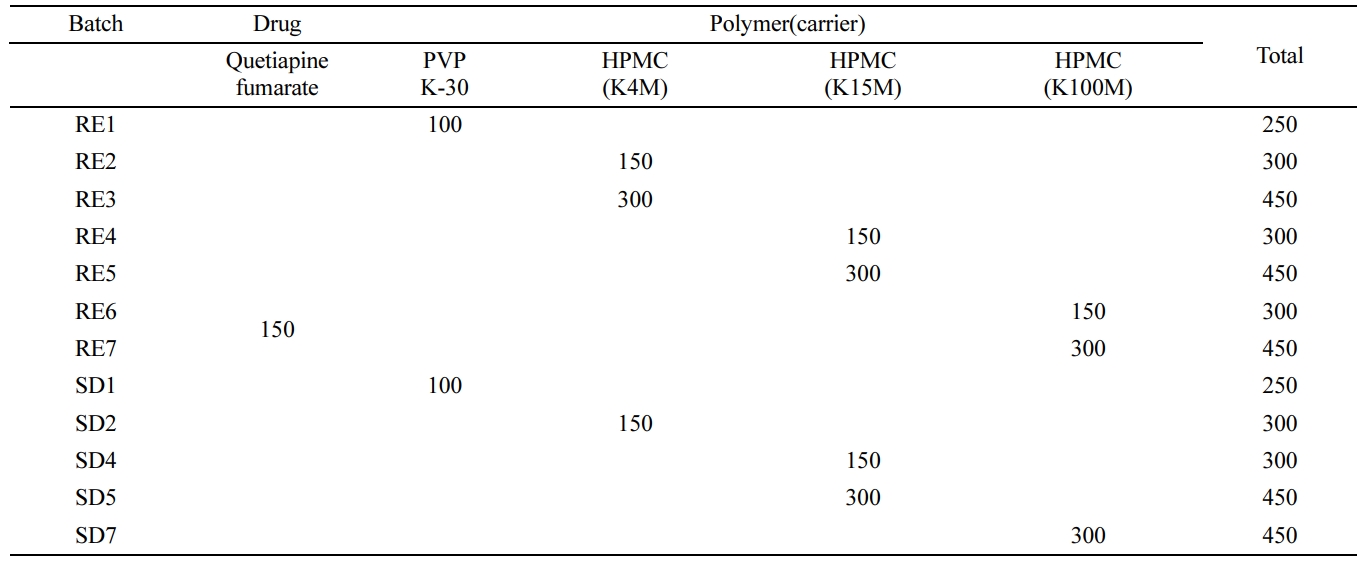
|
Table 3 Formulation of Wet Granulation (WG) on Quetiapine Fumarate (unit: mg) |
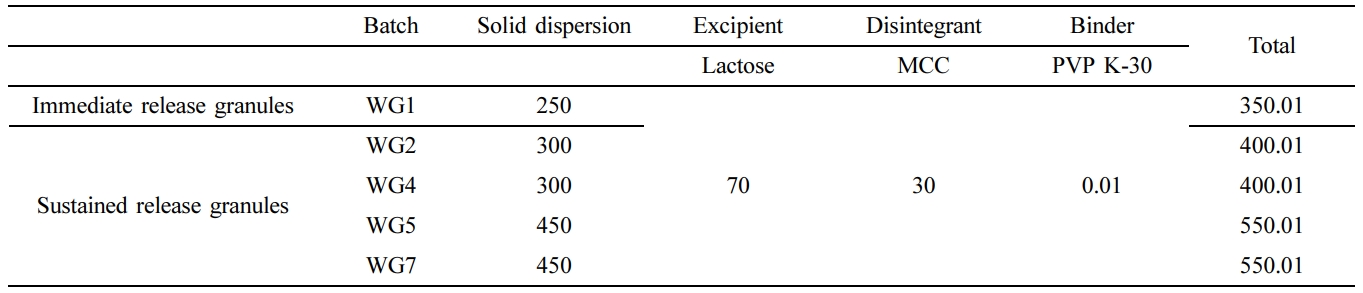
*Solid dispersion was prepared by batch (SD 1,2,4,5,7). |
원약물과 과립물의 흐름성 측정. 고체분산체와 과립물들의 유동성 특성을 아래와 같이 측정하였고
Table 6에 나타내었다. 고체분산체 SD7의 경우, Hausner ratio 지수는 약1.25±0.02로 측정되었고, 흐름성 특성은 fair
등급이 나왔으며, 20.475±1.4%로
측정된 Carr’s
index 지수 역시 fair 등급이 나왔다. 이에 반해 습식과립 공정을 거친 과립물들의 흐름성 특성은 Hausner ratio, Carr’s index 두 가지의
파라미터 모두 excellent 등급이 나와 흐름성이 개선되었다는 것을 확인하였다.
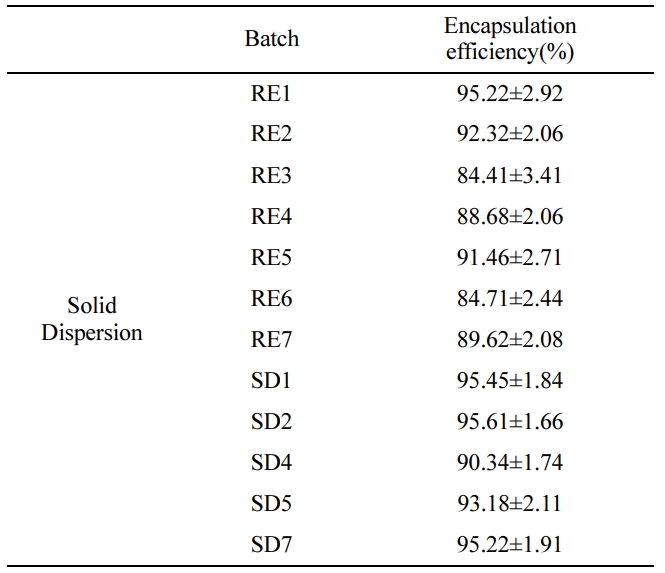
고체분산체의 포접률 분석. 분무건조기와 회전증발기를 통해 제조한 고체분산체들의 포접률은 Table 7에 나타내었다. 고체분산체를 제조하는데에 있어서의 변수인 용매제거의
방법과 서방화기제의 종류의 차이가 주는 포접률의 차이를 볼 수 있다. 이러한 차이는 담체로서의 폴리머와 약물과 밀접하게 상호작용하는데 이는 두 가지 메커니즘에 기인한다.
첫째, 긴 중합체 사슬은 원약물
분자들 사이의 결합을 입체적으로 방해하여 재결정을 방해할 수 있고 또 하나로는 중합체와 원약물 사이의 화학적 상호작용은 핵 형성을 위한 에너지 장벽,
재결정의 초기 형성을 증가시키고
결과적으로 물리적 안정성을 향상시키는 경향이 있다.26
로터리 증발기를 사용한
용매증발법을 사용해서 고체분산체를 만들어 포접률을 측정한 후 용출패턴 및 포접률이 85%이상을 갖는 이상적인 포뮬레이션을 선택하여 분무건조기를
이용해 고체분산체를 제조하여 이후 실험을 진행하였다.
고체분산체의 형태학적 특성분석. QF와 고분자 그리고 고체분산체들의 결정 크기와 형태를
관찰한 결과를 Figure 2에 나타내었다. Figure 2(a)에서 QF 결정크기는 5~50 μm를 나타내었고, PVP K-30은 10~100 μm 크기로 구의 형태를 하고 있고, 입자끼리 뭉쳐있는 형태가 관찰되었다. HPMC는 10~100 μm 크기로 불규칙적인 형태의 모습을 볼 수 있다. Figure 2(b)에서 RE1은 1~10 μm, RE2, 4, 5, 7은 5~100 μm 크기의 불규칙적인 형태를 갖고있는 반면, Figure
2(c) SD1 의 경우 5~10 μm 크기의 구의 형태, SD2, 4, 5, 7의 경우에는 1~5 μm 크기의 찌그러진 구형태가 관찰되었다. 이는 스프레이드라이어에서 분사 후 건조 단계에서 용매가 코어부터 증발함에 따라 입자 막이 생성되는데
이는 막이 충분한 유동성특성을 가져 찌그러지는 형상을 띠게 되기 때문이다.22,23
고체분산체의 구조학적 특성분석. QF와 서방화 및 가용화제로 사용된 HPMC와 PVP
K-30, 부형제와 붕해제인 락토즈와 MCC의 물리·화학적 또는 구조적 변화는 FTIR 통해 나타내었다(Figure 3).
Figure 3(a)의 QF 스펙트럼은 3313 cm-1 (O-H stretch), 3072 cm-1(Ar-H stretch),
2946 cm-1(C-H stretch), 2862 cm-1(C-H stretch),
2360 cm-1(CO2),
1942, 1598 cm-1(C-N stretch),
1568 cm-1(N-H bend),
1335 cm-1(C-H bend) 및
1305 cm-1에서 특성 피크를 나타냈다.
이 피크들은 문헌에 보고된 I, II, III 형태 중 I 형태의 다형체의
피크를 갖는다.27 또한 PVP K-30의 스펙트럼은 3300 cm-1(-OH stretching band), 2925 cm-1(C-H
stretch), 1652 cm-1(C=O stretch)에서
특성 피크를 나타내었다.
HPMC의 경우는
2350 cm-1(CO2),
1457 cm-1(-CH2
stretch), 1109 cm-1(C-O-C
stretch), 1052 cm-1(C-O stretch)에서
특성 피크를 나타내었다. 또한 고체분산체들의 피크들을 확인한 결과, 원약물 고유 특성 피크의 위치 및 성질 변화에서 뚜렷한 변화는 없고 크기에서
차이가 나는 것을 관찰할 수 있다. 이는 다른 부형제들과 QF 간에 상호작용이 없음을 알 수 있다.
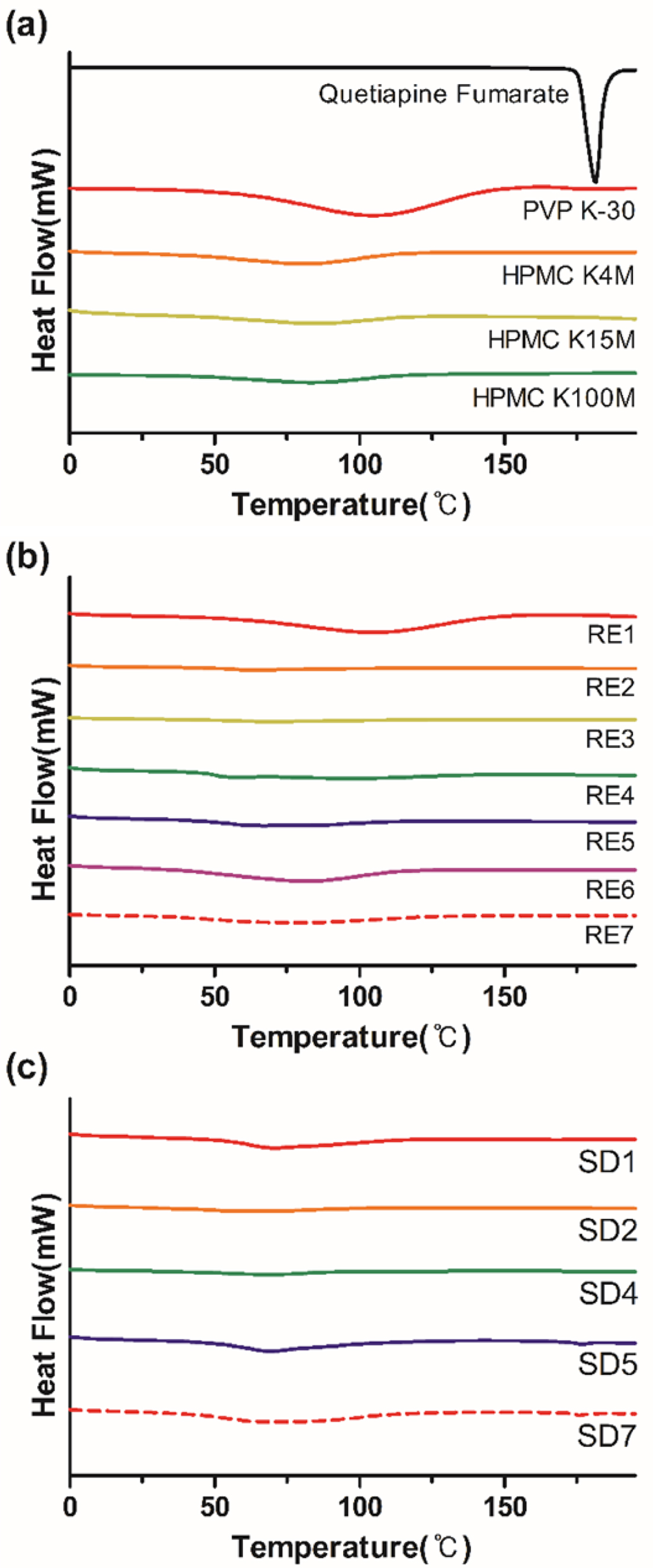
고체분산체의 열적 특성분석. QF, PVP K-30, HPMC 및 고체분산체를 DSC로 분석한 결과를 Figure 4에 제시하였다. Figure 4(a)에서 QF는
약 180 oC에서 결정격자가 융해되는 결정성 흡열 피크가 나타났고, PVP K-30는 110 oC 부근에서 약하고 넓은 흡열 피크가 나타났다. 이는 분석 중에 온도에 의한 고분자 내의 수분 증발로 인해 나타난 것으로 사료된다. 또한
HPMC는 60 oC 부근에서 넓고 약한 흡열 피크를 볼 수 있는데 이는 마이크로브라우닝 운동이 일어나는 유리전이 온도라고 예상할
수 있다. 고분자들의 특징적인 피크가 없는 걸로 보아서 PVP K-30, HPMC들은 무정형 고분자임을 알 수 있다. Figure 4(b), 4(c)의 각 고체분산체의
결과를 보면 원약물의 결정성 피크가 사라지는 것을 확인할 수 있다. 이는 회전증발과 분무건조 과정을 통해서 원약물의 결정성을 잃고 무정형 형태로 되었기 때문이다.
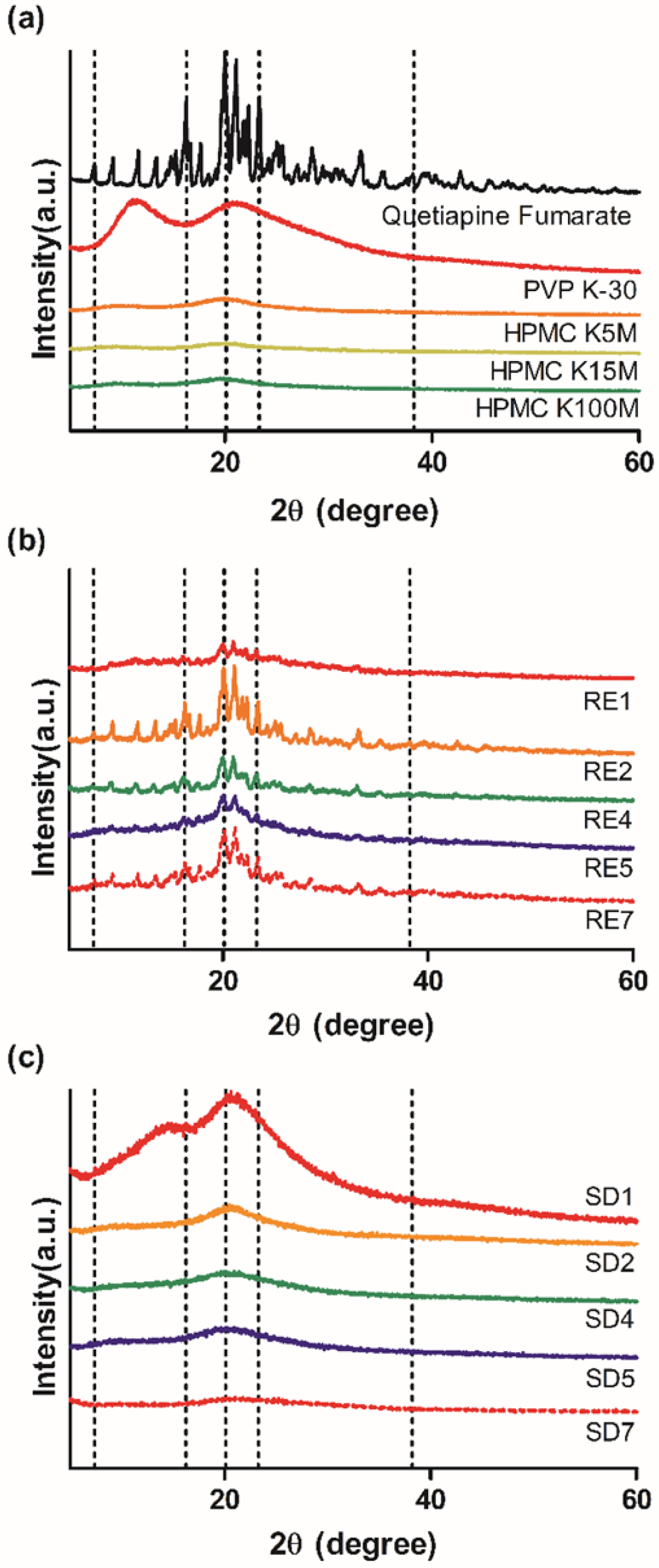
고체분산체의 결정학적 특성분석. Figure 5는 QF,
PVP K-30, HPMC 및 고체분산체를 XRD 분석한 그래프이다. Figure 5(a)에서 원약물은 7.4°, 16.26°, 20.1°,
23.29°, 38.23°에서 특정적인 회절 피크를 갖는 결정성 물질임을 확인하였다. Figure 5(a)의 PVP K-30, HPMC들은 특정적인 회절
피크를 갖지않아 이들은 무정형 물질임을 알아볼 수 있다.
또한 제조된 RE는
원약물의 결정성 회절 피크들이 SD방법으로 제조된 배치보다는 덜 하지만 어느정도 무정형 물질과 유사하게 변화한 것을 볼 수 있고, SD는 특정적인 결정성 회절 피크들이
사라져 무정형 고분자와 같은 형태로 변화한 모습을 볼 수 있다. 이는 원약물이 고체분산화할 때 약물들이 고분자 내부에 미세단위로 쪼개져 분산되어
약물의 결정성을 잃고 고분자의 무정형성을 닮아 변화하는 정도가 SD에 의한 방법이 RE보다 더 효과적인 것을 알 수 있다.
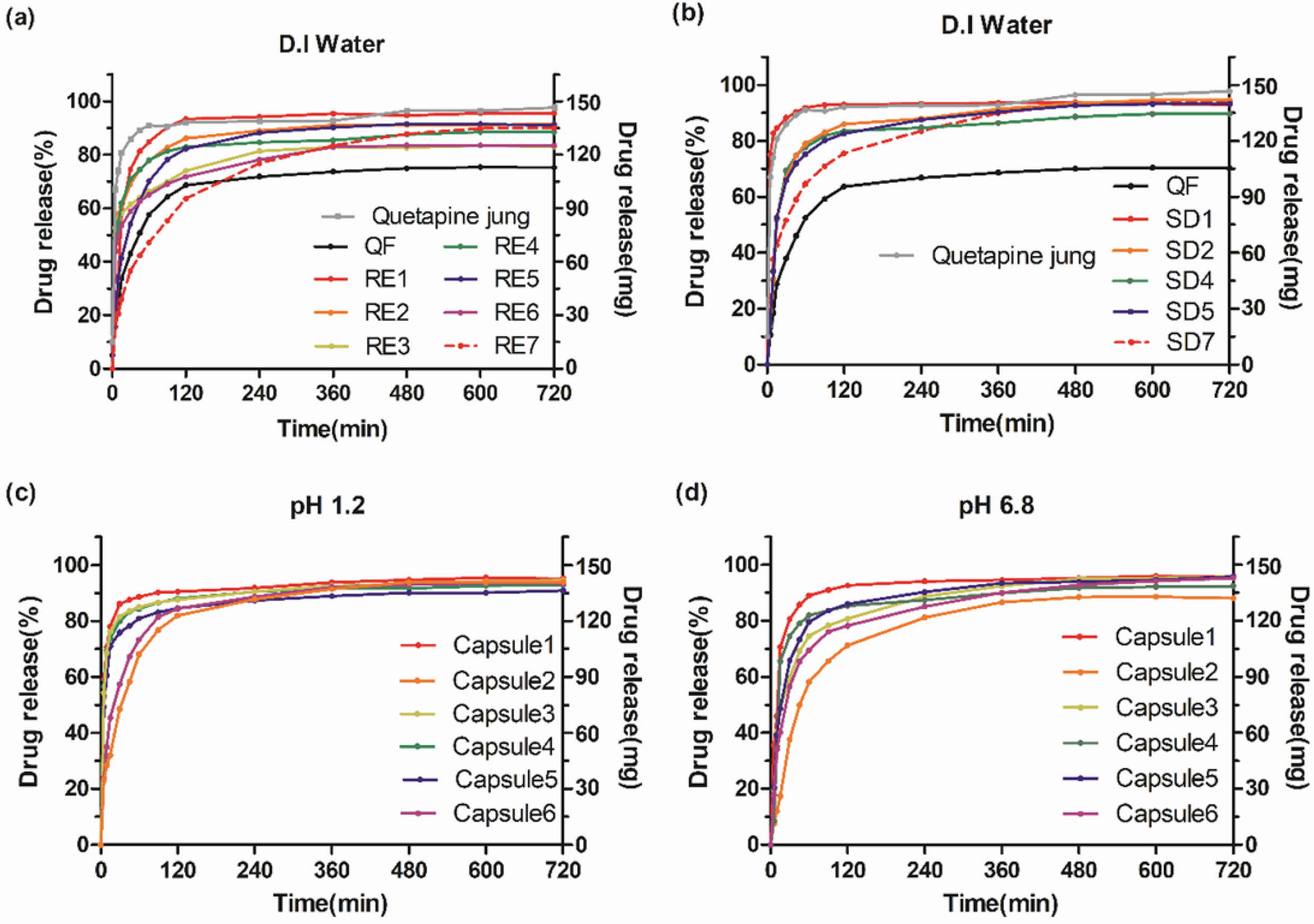
생체 외 방출 거동. 모든 제형의 생체 외 방출 거동이 Figure 6에 나타나 있다. 원약물인 QF와 시판제인 쿠에타핀정® 및 고분자의 종류와 함량을 변수로 두 가지 제조방법에 의해 제조한 고체분산체를 증류수에서 용출시험한 결과는
Figure 6(a), 6(b)에 나타냈다. 또한 속방, 서방화된 과립물을 충전하여 캡슐제로 제조하여 USP시험법에 따라 제조된 용출액 pH
1.2, pH 6.8으로 용출시험한 결과는 Figure 6(c), 6(d)에 나타냈다. Figure 6(a), 6(b)의 QF는 증류수에서
75%, 시판제인 쿠에타핀정®은 97%의 최종용출률을 나타냈다. RE군들은 최종용출률이
80~95%를 나타내었다. 이 중 최종용출률이 85% 이상을 보여주는 RE1, 2, 4, 5, 7군을 선정하여 고체분산화한 SD군들은 최종용출률이 89~95%를 나타내었다. 그리고 Figure 6(c)와 6(d)에 나타난 것처럼
캡슐제의 경우에도 pH와 상관없이 모두 90% 이상의 용출률이 나타난 것을 확인할 수 있다. Figure 6(a)와 6(b)에서 가용화기제 PVP K-30을 담체로
갖도록 제조한 RE1, SD1의 경우 원약물보다 빠른 패턴의 용출률을 나타내었다. 이는 무정형인 RE1과 SD1가 결정성을 갖는 QF보다 수분침투가
쉬워 용해도가 향상되었기 때문이다. 또한 서방화기제 HPMC를 담체를 갖도록 제조한 나머지 포뮬레이션들 중 RE7, SD7가 서방화가 뛰어난 것을
확인할 수 있다. 그리고 pH 1.2, 6.8에서 캡슐정의 용출시험은 Figure 6(c), 6(d)에 나타냈다. 속방성 과립물들과 서방성
과립물들만 충전된 캡슐 1과 캡슐 2 사이에 두 가지 과립이 혼합된 캡슐 3, 4, 5, 6이 위치해 있으며 그 중 가장 점도가 높은 고분자의 높은 농도의
서방성 과립물이 충전되어
있는 캡슐 6의 경우 30분에
55% 정도의 용출률을
갖고 이후 꾸준하게 720분까지 약 95% 용출된 것을 볼 수 있다.

|
Figure 2 SEM images of (a) quetiapine fumarate, PVP K-30, HPMC K4M, HPMC K15M, HPMC K100M; (b) REs; (c) SDs. |

|
Figure 3 FTIR spectra of (a) quetiapine fumarate and polymers; (b)
REs; (c) SDs. |
|
Figure 4 DSC thermograms of (a) quetiapine fumarate and polymers; (b) REs; (c) SDs. |
|
Figure 5 X-ray diffraction patterns of (a) quetiapine fumarate;
polymers; (b) REs; (c) SDs. |
|
Figure 6 In vitro dissolution behavior of quetiapine fumarate solid dispersions made from rotary evaporators [D.I water] (a); spray dryers
[D.I water] (b); capsules [pH 1.2] (c); [pH 6.8] (d). |
|
Table 6 Flow Characteristics of Solid Dispersion (SD7) and Granules Calculated by Hausner Ratio and Carr’s Index |

본 연구는 QF의
방출을 제어하기 위해 수용성 고분자를 사용하여 고체분산화를 진행하였고 고체분산화는 회전증발법과 분무건조법으로 실험설계를 하여 진행하였다.
제조된 고체분산체들의
입자크기를 SEM으로 관찰한 결과, QF는 1~100 μm, RE와 SD군은 1~10 μm의 크기를 가져, 고체분산체로 제조 시 입자크기가 크게 줄어드는 것을 확인했다.
포접률은 RE군들이
SD군보다 더 높은 약물함유량 즉, 포접률을 갖는 것을 확인하였다. 그리고 FTIR을 통하여 원약물과 부형제들과의 물리∙화학적 변화가 없다는 것을 확인하였고 XRD와 DSC를 통해서
원약물의 결정성을 잃고 무정형을 띠는 것을 확인하였는데, 특히 SD군들이 더 무정형을 갖는 것이 관찰되었다. 또한 습식과립을 통해 고체분산체의
유동성을 증가시켜 공정성 및 분말의 균질성을 개선하였다. 마지막으로 생체 외 방출 실험을 통하여 원약물의 용해도 증가와 초기에 약물 유효농도까지
빠른 방출을 하고 이후에 서방형 방출을 하여 지속적이고 긴 용출 패턴을 볼 수 있었다. 따라서 속방형 과립물과 서방형 과립물을 혼합하여 사용하는
방출제어 캡슐제형은 경구약제학적 가능성을 보여 주었다.
- 1. B. Green, Curr. Med. Res. Opin., 15, 145 (1999).
-

- 2. O. Gefvert, M. Bergström, B. Långström, T. Lundberg, L. Lindström, and R. Yates, Psychopharmacology(Berl), 135, 119 (1998).
-

- 3. E. Mundo, E. Cattaneo, S. Zanoni, and A. C. Altamura, Neuropsychiatr. Dis. Treat., 2, 139 (2006).
-

- 4. C. L. DeVane and C. B. Nemeroff, Clin. Pharmacokinet., 40, 509 (2001).
-

- 5. S. G. Talele and D. V. Derle, Int. J. Appl. Pharm., 10, 127 (2018).
-

- 6. J. Dressman and C. Reppas, Adv. Drug Deliv. Rev., 59, 531 (2007).
-

- 7. H. Chen, C. Khemtong, X. Yang, X. Chang, and J. Gao, Drug Discov. Today, 16, 354 (2011).
-

- 8. A. Nokhodchi, S. Raja, P. Patel, and K. Asare-Addo, J. Pharm., 2, 175 (2016).
- 9. S. Mehta, N. M. Joseph, F. Feleke, and S. Palani, J. Drug Deliv. Ther., 4, 7 (2014).
-

- 10. M. I. Ré, Dry. Technol., 24, 433 (2006).
-

- 11. L. P. Gubbala, S. Arutla, and V. Venkateshwariu, Int. J. Drug Deliv. Technol., 8, 37 (2016).
- 12. A. Narala and K. Veerabrahma, J. Pharm., 2013, 265741 (2013).
-

- 13. M. E. Aulton, Editor, Pharmaceutics: The Science of Dosage Form Design, Churchill Livingstone, Edinburgh, 2001.
- 14. Z. T. Chowhan, A. A. Amaro, and Y. P. Chow, Drug Dev. Ind. Pharm., 8, 145 (1982).
-

- 15. T. M. Chitu, D. Oulahna, and M. Hemati, Powder Technol., 208, 441 (2011).
-

- 16. J. H. Park and H. K. Choi, Arch. Pharm. Res., 38, 1336 (2015).
-

- 17. P. Timmins, A. M. Delargy, and J. R. Howard, Pharm. Dev. Technol., 2, 25 (1997).
-

- 18. K. C. Sung, P. R. Nixon, J. W. Skoug, T. R. Ju, P. Gao, E. M. Topp, and M. V. Patel, Int. J. Pharm., 142, 53 (1996).
-

- 19. A. T. Pham and P. I. Lee, Pharm. Res., 11, 1379 (1994).
-

- 20. J. W. Skoug, M. V. Mikelsons, C. N. Vigneron, and N. L Stemm, J. Control. Release, 27, 227 (1993).
-

- 21. H. Sekikawa, M. Nakano, and T. Arita, Chem. Pharm. Bull., 26, 118 (1978).
-

- 22. N. Yagi, Y. Terashima, H. Kenmotsu, H. Sekikawa, and M. Takada, Chem. Pharm. Bull., 44, 241 (1996).
-

- 23. H. H. Hausner, Int. J. Powder Metall., 3, 7 (1967).
- 24. R. L. Carr, Chem. Eng., 18, 163 (1965).
- 25. H. Park, J. S. Baek, D. Kim, G. W. Lee, H. Y. Jeon, J. E. Song, S. Y. Lee, and G. Kang, Polym. Korea, 42, 275 (2018).
-

- 26. J. Yang, K. Grey, and J. Doney, Int. J. Pharm., 384, 24 (2010).
-

- 27. R. Lifshitz-Liron, E. Kovalevski-Ishai, B. Z. Dolitzky, S. Wizel, and R. Lidor-Hadas, U.S. Patent Application No. 10/393,929 (2003).
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(5): 715-724
Published online Sep 25, 2020
- 10.7317/pk.2020.44.5.715
- Received on May 27, 2020
- Revised on Jun 23, 2020
- Accepted on Jun 29, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
Department of BIN Convergence Technology, Department of Polymer Nano Science & Technology and Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Jeonju 54896, Korea
- E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.