This study provides detailed
information on the curing system using a catalytic reagent
(3-(2-phenyl-1-imidazolyl)propionitrile, 2PZ-CN), which is capable of anionic
ring opening polymerization of epoxide as a way to improve thermal conductivity
of diglycidyl ether of bisphenol A (DGEBA) epoxy resin. First, reaction
behavior of the curing system of DGEBA/2PZ-CN was investigated through dynamic
and isothermal DSC measurements, and thermal conductivity of their cured
material and composite materials was investigated. The thermal conductivities
of DGEBA/2PZ-CN and DGEBA/2PZ-CN/Al2O3(50 wt%) were
0.31 W/m·K and 1.66 W/m·K, respectively, which were about 30% higher
values than the general epoxy specimens manufactured under the same conditions.
연구는
diglycidyl ether of bisphenol A(DGEBA)계 에폭시 수지의 열전도도 향상을 위한 방안으로 에폭사이드의 음이온성
개환 중합이 가능한 촉매 물질(3-(2-phenyl-1-imidazolyl)propionitrile,
2PZ-CN)을 활용한 경화 시스템에 대한 상세한 정보를 제공한다. 먼저 2PZ-CN의 경화 시스템에 대해 동적 DSC 및 등온 DSC 측정과 분석을 통해 경화 반응의 상세에 대해 조사하였고, 경화물과
복합재료를 제조하여 열전도도를 분석하였다. DGEBA/2PZ-CN의 열전도도는 0.31 W/m·K, DGEBA/2PZ-CN/Al2O3(50 wt%)의
열전도도는 1.66 W/m·K를 보여, 동일한 조건에서 제조된 범용 에폭시 시료 대비 약 30% 높은 열전도도를
나타냈다.
This study reports a curing system using a catalytic
reagent (2PZ-CN), which induces anionic ring opening polymerization of epoxide
as a way to improve thermal conductivity of DGEBA epoxy. First, reaction
details of the curing system of DGEBA/2PZ-CN are investigated by DSC
measurements, and thermal conductivity of their cured material and composite
materials is investigated.
Keywords: epoxy, curing, hardener, composites, thermal conductivity
본 연구 성과는
2020년도 과학기술정보통신부의 재원으로 한국연구재단의 지원(No. 2017R1C1B507634, 2020R1F1A1048251)과 2020년도 산업통상자원부의
재원으로 한국에너지기술평가원(KETEP)의 지원(No. 20183010025470) 및 한국산업기술평가원(KEIT)의 지원(No. 20011123)을 받아 수행된 연구로 이에 감사를
표합니다.
최근 전자 소자는
나날이 발전하여 더욱 고집적화되어 동일 단위 체적 당 발열량이 크게 증가하였고, 이는 전자 소자의 신뢰성 감소로 이어지는 방열 문제를 야기하였다.1
특히, 고분자 소재는 뛰어난 성형성, 경량성, 경제성을 바탕으로 내/외장재 모두에 흔히 사용되고 있으나 본질적인 절연 특성으로 인해 방열 문제의
개선을 어렵게 하고 있다.2
고분자 소재의 방열
성능 향상은 각종 열전도성 충전제를 도입하여 복합재료화 하는 것과 가공을 통해 소재 자체의 열전도도를 향상시키는 크게 두 가지 방법으로 연구가
진행되고 있다.3 전자의 경우 이미 많은 연구가 진행되었으며, 고열전도성 충전제를 사용하는 것으로 손쉽게 방열 성능을 확보
할 수 있는 장점이 있다. 하지만, 높은 수준의 방열 성능을 얻기 위해서는 매우 높은 충전제 충전율이 필수적으로 요구되며, 일정 수준 이상의 필러를
도입할 경우 고분자 소재의 최대 장점인 성형성이 크게 상실된다는 단점을 가진다. 따라서 방열 복합재료 개발의 핵심은 낮은 충전제 충전율을 유지하는
것에 있다고 할 수 있으며, 상세 방법으로 열전도성 고분자 기지재의 개발, 가공을 통한 고분자 기지재의 고열전도화, 순수 보강재의 고열전도화,
복합재료 내부의 보강재 배향 제어 등의 연구가 보고되고 있다.4
이런 방열 복합재료의
기지 수지로는 충진재와의 함침성이 뛰어난 특성으로 인해 에폭시 수지가 흔히 사용되고 있으나, 일반적인 에폭시 수지는 0.2 W/m·K 수준의 열전도도를 가져, 오히려 타 결정성 고분자류보다 낮은 방열성을 보이는 문제점을 나타낸다.5 따라서 에폭시
수지의 장점을 살리면서 열전도성을 부여하기 위한 방안으로 자기조립 현상을 통해 포논 산란을 억제하여 효율적인 열전달이 가능한 액정의 특성을 활용하는
것이 제안되었으며, 여러가지 구조의 액정 에폭시 수지가 개발된 바 있다.6-8 액정 에폭시 수지는 0.3~0.5 W/m·K 수준의 열전도도를 가지며, 이의 복합재료는 ~30 W m·K에 이르는 매우 높은 열전도도를 나타내는 것이 보고되었다.9,10 하지만, 액정 에폭시 수지는 합성과 성형 과정이 액상의
범용 에폭시 수지에 비해 매우 복잡하여 실제 활용은 다소 곤란한 것으로 알려져 있다.
에폭시 수지의 열전도도가
낮은 것은 경화 과정에서 형성되는 3차원 네트워크 구조가 비정질이라는 것에 유래한다.8,9 이는
범용의 에폭시 수지와 경화제는 모두 다작용기성 단량체로서 화학양론비적인 부가중합 반응을 통해 고분자를 형성하기 때문으로, 경화 후의 화학 구조가
불규칙하여 열전달에 불리하게 작용하는 것이 일반적이다. 경화제로는 주로 아민류, 산무수물류가 사용되며 기타 촉매류의 보조 물질들이 활용되는 경우가
있다. 촉매성 경화제의 경우, 에폭시 수지의 중합성 작용기인 에폭사이드가 양이온 또는 음이온성 물질에 의해 개환 중합 반응이 가능하다는 것을 이용한
것으로, 흔히 루이스산류나 이미다졸류가 사용되고 있다.
본 연구자 그룹에서는
촉매형 물질을 주 경화제로 활용하여 액정 에폭시 수지의 미세 구조 제어에 대한 연구를 수행하였고, 아민 계열의 경화제를 사용했을 경우와 비교하여 경화물의 결정성이
크게 향상된다는 결과를 얻었다.9 또한 증가된 결정성은 높은 열전도도로 이어질 수 있음을 보고하였다. 이 결과를 토대로, 본 연구에서는 일반적인 활용이 가능한
상용 에폭시 수지에 촉매형 물질을 주 경화제로 활용한 경화 시스템에 대해 조사하고, 범용 방열 보강재인 알루미나를 이용한 복합재료를 제조하여,
개발한 에폭시 수지의 고열전도화 방법의 확대된 활용 가능성에 대해 시험하고자 하였다.
재료. 본 실험에서 사용된 에폭시 수지와 경화제의 화학 구조는
Figure 1에 나타낸다. 먼저, DGEBA계 에폭시 수지는 국도화학에서 상품명 YD-128로 판매되는 제품으로, 에폭시 당량(epoxy
equivalent weight, EEW)이 184~190 g/eq인 것을 사용하였다. 이미다졸류의 음이온계 촉매형 경화제인
3-(2-phenyl-1-imidazolyl)propionitrile(2PZ-CN)과 에폭시 수지의 범용 경화제인 방향족 다이아민 경화제
4,4'-diaminodiphenyl-methane(DDM)은 Tokyo Chemical Industry Co., LTD.에서 구매하였다.
방열 복합재료 제조에 사용된 충전제인 알루미나는 Denka 사의 여러가지 크기의 구상 알루미나의 혼합물인 DAB-70SA 제품을 사용하였다. 모든
물질은 특별한 추가 정제 없이 받은 그대로 실험에 사용하였다.
동적 DSC 측정을 통한 경화 반응 분석. DGEBA 에폭시 수지와 2PZ-CN 경화제로 구성된
경화 시스템의 경화 반응의 반응 시작 온도, 반응 최대점, 반응 엔탈피 등 경화 반응의 상세 사항을 조사하기 위해 TA사의 Q2000 모델을 이용하여
40 oC부터 260 oC까지의 질소 분위기
하에서 동적 DSC 측정을 수행하였다. 시료는 DGEBA 에폭시 수지에 2PZ-CN 경화제를 3 wt% 조성이 되도록 계량한 후, 자석 교반기를 이용하여
실온에서 교반하여 제조하였으며, 약 10 mg의 혼합된 시료를 사용하여 DSC를 측정하였다. 또한 DGEBA/2PZ-CN 경화 시스템의 반응 속도론
분석을 위하여 동적 DSC 측정의 승온 속도를 5, 10, 20 oC/분으로 다변화하였으며,
반응 속도론의 해석에는 각각 식 (1)로 대표되는 Ozawa Method11와
식 (2)의 Kissinger Method가 사용되었다.12
ln φ = Constant - 1.052·Ea/RTp (1)
d [ln(φ/Tp2)]/d(1/Tp) = - (Ea/R) (2)
여기에서, φ는 승온 속도, Ea는 활성화에너지, R은 기체상수, Tp는 동적 DSC
곡선 최대점에서의 온도를 의미한다.
등온 DSC 측정을 통한 경화 반응 분석. 동적 DSC를 이용한 경화 거동 분석의 보다 상세한 이해와
추가적인 반응 속도론의 분석을 위해, 등온 DSC 측정을 수행하였다. 사용한 시료는 동적 DSC 측정의 시료와 동일하게 제조되었고, 약 10 mg의 DGEBA/2PZ-CN 시료를 이용하여 질소 분위기 하 100, 120, 140 oC에서 등온 곡선을 기록하였다. 시간(t)의 dH/dt 함수인 등온
DSC 곡선은 전체 반응 엔탈피(ΔHT)로 나누는 것으로 t의 반응 속도(da/dt)에 대한 함수로 변환되었다. 여기서, a는 특정 시간에서의 반응률을 의미하며, 얻어진 t의 da/dt에 대한 함수는 적분하여 등온 반응 속도론 해석을 위한 최종 형태인 a의 da/dt 함수로 변환되어 식 (3)의 자가촉매반응
모델에 입각한 반응 파라미터 계산에 사용되었다.13
da/dt = k(T) · (1 - a)n × am (3)
여기에서, k(T)는
속도 상수, m은 자가촉매반응의 반응 차수, n은 친핵성 공격 메커니즘에 기반한 경화 반응의 반응 차수를 의미한다. 얻어진 k(T)는
Arrhenius plot을 통해 활성화 에너지와 빈도 상수를 구하는데 사용되었다.
에폭시 경화물 및 복합재료 제조. 등온 DSC 측정 결과를 바탕으로,
DGEBA/2PZ-CN의 순수 경화물은 120 oC에서 2시간의 반응을
통해 제조되었다. 가열 과정에는 일반적인 컨벡션 오븐이 사용되었으며, 액상 수지 혼합물은 지름 2 cm, 높이 0.5 cm의 원형 알루미늄 틀 혹은 가로 6 cm, 세로 2 cm, 높이 0.5 cm의 스테인리스스틸 틀에 넣어 경화되었다. 복합재료
제조를 위한 수지 혼합물은 50 wt%까지의 10 wt% 간격으로 알루미나와 DGEBA/2PZ-CN 무게비를
조절한 혼합물을 각각 계량하여 일차적으로 혼합하였고, Thinky사의 공자전 믹서인 AR-100 모델을 이용하여 혼합 및 탈포 과정을 진행한 후,
순수 경화물과 동일한 과정을 거쳐 충전제 함량이 다른 복합재료 5종을 제조했다. 이 때, 촉매형 경화제인 2PZ-CN의 함량은 수지 대비 3 wt%로 동일하게 조절되었다. 또한 대조군으로 DDM
경화 시스템을 사용한 순수 경화물과 복합재료 5종을 상술한 것과 동일한 방법으로 제조했으며, 에폭시 수지와 DDM의 당량은 반응성 작용기의 화학양론비를
고려하여 동일 당량으로 조절되었다.
물성 평가. 수지 경화물의 유리 전이 온도는 상술한 동일 DSC 기기에서
질소 분위기 하 분당 10 oC의 승온 속도로 측정하였다. 그리고 경화물과 복합재료의 동역학적 특성은 TA사의 DMA Q800을 사용하여 공기 분위기 하 분당 3 oC의 승온 속도, 1 Hz의 주파수에서 분석되었으며, 열전도도는 Hot Disk 사의 TPS 2500S 모델을 이용하여
ISO-22007-2 규격에 따라 분석되었다. X선 회절 분석은 Malvern Panalytical사의 Empyrean을 이용하였다.

|
Figure 1 Chemical structures for used materials. |
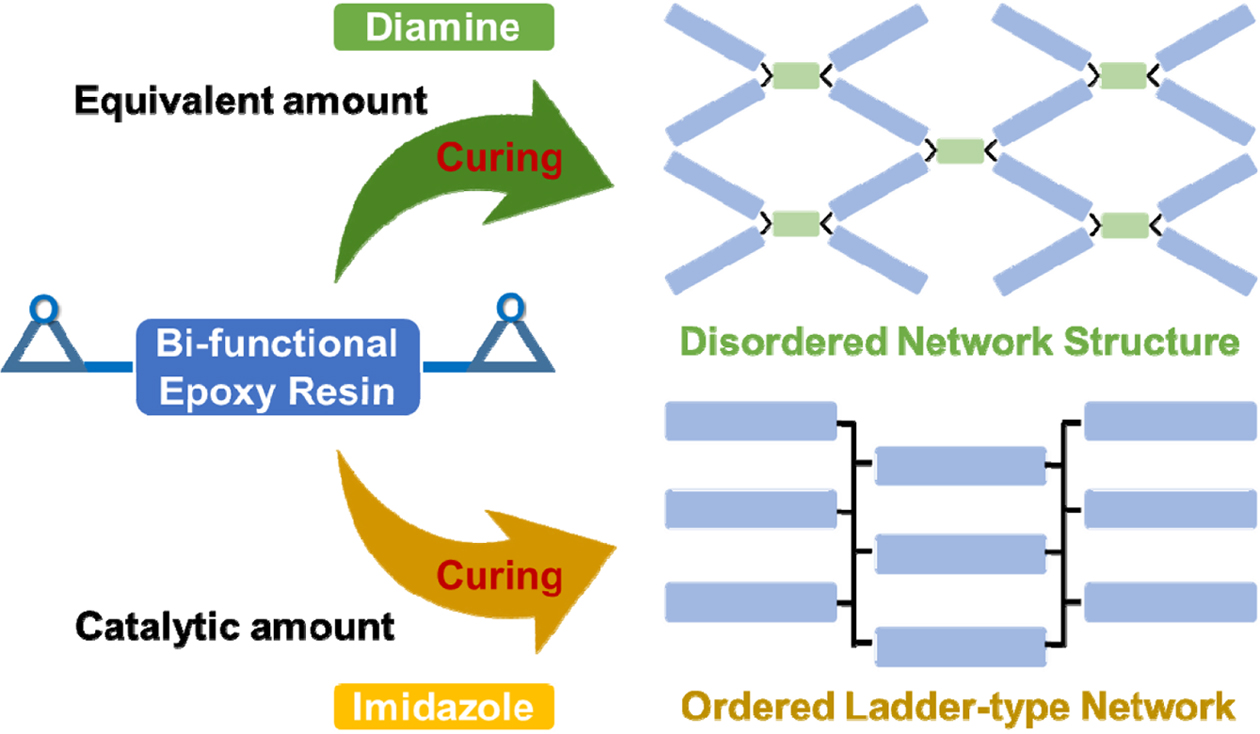
일반적인 에폭시 수지는
대부분이 2작용기성 단량체로, 분자의 말단에 에폭사이드를 가진 구조를 가진다. 경화제로 가장 흔히 사용되는 물질은 DDM과 같은 방향족 다이아민,
또는 hexamethylenediamine(HMDA)과 같은 지방족 다이아민이 있으며, 이 경우 1차 아민이 2개 있는 구조를 가지므로 각각이
3차 아민으로 전환될 때까지 반응하여 4작용기성 단량체로 작용하게 된다. 이 경우 Figure 2의 상단에 나타낸 것처럼, 먼저 1차 아민이 에폭사이드와
반응하여 2차 아민으로 전환되는 직선형 중합 반응을 일으키고, 이후 2차 아민이 올리고머 또는 고분자 형태의 미반응 에폭사이드를 공격하여 가교
반응이 발생, 최종적으로는 입체적으로 완전히 불규칙한 네트워크 구조를 형성하게 된다.14,15 본 연구에서 의도한 바는, 에폭사이드의
음이온성 개환 중합 반응이 가능한 이미다졸계의 2PZ-CN을 이용하여 DGEBA계 수지를 직선형 고분자로 변환시켜 경화물에 다소간의 규칙성을 부여하는 것으로, Figure 2의 하단에 나타낸 구조를 형성시키는
것에 있다.9 DGEBA는 2작용기성으로, 반응 초기에는 하나의 에폭사이드만이 반응하여 선형인 폴리에테르로 변환될 것이고, 이후에는 잔존한 미반응
에폭사이드 간의 중합 반응이 발생하여 고분자 사슬 간의 가교가 발생할 것으로 사료된다. 최종적으로 형성되는 구조는 불규칙할 것이나, 1차적으로
형성된 사다리 형태를 유지한 채 중합 반응이 진행할 것이므로 다이아민 경화물에 비해 규칙성을 가지는 정렬된 구조로 얻어질 것으로 생각된다. 이
배열된 특성을 열전달에 이용하고자 하는 것에 본 연구의 목적이 있다.
먼저,
DGEBA/2PZ-CN 경화 시스템의 적정 경화제 양을 조사하기 위하여, 1~5 wt%의 2PZ-CN 함량을 가지는 경화 혼합물을 제조하였고
동적 DSC 측정을 시행하였다. 결과로, 3 wt% 이상의 2PZ-CN 함량에서 발열량이 거의 동일한 것을 확인하였고, 충분한 경화 반응을 유도하기 위한
최저 필요량은 3 wt%인 것으로 판단했다. 따라서 이후 모든 실험에서는
수지/경화제 혼합물 대비 2PZ-CN 함량은 3 wt%로 균일하게 제조하였다. 다음으로, 동일 경화 시스템의 경화 반응 거동을 조사하기 위하여 승온 속도를
5, 10, 20 oC/분으로 달리하여 동적 DSC 측정을 시행하였고, 그 결과를 Figure 3과 Table 1에 나타냈다.
승온 속도에 따라 다소간의 차이는 있었으나 모든 DSC 곡선은 유사한 형태를 나타냈고, 약 100 oC 전후에서 발열 반응이 시작되어 3개의 피크로 구성되며, 250 oC 전후에서 반응이 종료되는 것을 확인하였다. 상세히, 5 oC/분 속도에서는 87.7 oC에서 경화 반응
시작점(Tonset)이, 112 oC, 149.5 oC, 208.6 oC에서 발열 피크의
최대점(Tpeak)이 확인되었고, 전체 발열량(DH)은 391.6 J/g이었으며, 10 oC/분 속도에서는
99.2 oC에서 Tonset, 119.9 oC, 154.6 oC, 218.6 oC에서 Tpeak, 388.7 J/g의 DH가, 분당
20 oC의 속도에서는 106.9 oC에서 Tonset,
132.6 oC, 159.6 oC, 229.7 oC에서 Tpeak, 373.0 J/g의 DH가 확인되었다. 승온 속도가 증가할수록, Tonset과
Tpeak 모두 온도가 높아지는 경향이 있었으며, DH 값은 유사하였으나 측정 시간이 오래 소요된 승온 속도가
낮은 시스템에서 약간 높은 값이 얻어졌다. 또한 모든 측정 곡선에서 여러 개의 곡선이 중복된 형태로 확인된 것으로부터 경화 반응이 다단계로 발생함을
유추할 수 있었다.14,15
얻어진 3곳의 Tpeak의
값을 바탕으로 식 (1)과 (2)를 이용하여 Figure 4와 Figure 5에 나타낸
것과 같이 Ozawa plot과 Kissinger plot를 각각 작성하였고, 기울기를 바탕으로 활성화에너지에 대해 분석하였다. 2가지 방법으로
작성된 plot의 형태는 거의 유사하였으며, 계산된 활성화에너지 값 역시 거의 유사하여 다음과 같은 결과를 확인했다. 먼저, Ozawa
Method에서 계산된 100 oC 근방의 첫번째 피크의 활성화에너지는 81.8 kJ/mol, 150 oC 근방의 두번째 피크의 값은 199.4 kJ/mol, 200 oC 근방의 세번째 피크는 125.4 kJ/mol로 확인되었다. Kissinger Method에서 계산된 활성화에너지 값은 동일한 피크 순서로
75.6, 192.6, 117.6 kJ/mol이 얻어졌다. 계산 값으로 유추할 때, 첫번째
피크에서는 단량체 간의 중합 반응, 두번째 피크에서는 생성된 올리고머/고분자의 가교 중합 반응, 세번째 피크에서는 탈수 반응 등을 통한 가교 반응이
발생하는 것으로 예상된다.
다음으로, 경화 반응의
속도론에 대해 상세한 분석을 위하여 추가로 등온 DSC 조사를 실시하였다. DSC에서 얻어진 곡선은 식 (3)의 해석을 위하여
실험항에 기재된 방법에 따라 반응률(a)과 반응 속도(da/dt)의 관계로 변환되어 Figure 6에 나타냈다. 측정 온도에 따라 약간의 차이는 있으나, 모든 온도에서 반응 초기에 반응 속도 최대점이 확인되었으며,
상세한 곡선의 형상으로부터 여러 개의 반응 속도 곡선이 확인되었다. 측정 온도와 무관하게 2개 이상의 곡선이 복합된 형태를 나타냈으며, 이는 동적
DSC 분석에서 얻어진 것과 마찬가지 결과가 얻어졌다. 낮은 반응률 쪽에서 확인되는 최대 반응 속도를 나타낸 곡선은 선형 올리고머/고분자를 형성하는
단계로 보이며, 반응률이 높아진 후 가교 중합이 발생하는 것으로 보인다. 특히, 100 oC, 120 oC에서 등온
DSC의 전체 발열량은 140 oC에서의 발열량 대비 각각 86%, 90% 수준을 보였으며, 140 oC에서의 값은 동적
DSC의 발열량 값과 거의 동일한 수준이 얻어졌다. 이로부터 미뤄볼 때, 140 oC에서는 완전한 경화 반응이 진행되는 것으로 판단된다.
Figure 6의
곡선으로부터 반응 속도 최대점과 관련한 상수들(tp, (da/dt)p, ap)을 Table 2에 정리하였다. 반응 속도가 최대를
나타내는 시간(tp)은 100 oC에서 5.80초, 120 oC에서 1.23초, 140 oC에서 0.24초로 현격하게 짧아지는 경향을 확인할 수 있었으며, 그 시간에서의 반응 속도의 값((da/dt)p)은 동일한 온도 순서로, 0.040, 0.104, 0.326 min-1로 매우 크게 증가하는 것을
확인할 수 있었다. 또한 반응 속도가 최대가 되는 점에서의 반응률(ap)은 0.153, 0.085, 0.050으로 나타나, 경화 온도가 높을수록 낮은 반응률에서 반응 속도 최대점이
나타남을 확인하였다.
다음으로 식 (3)을 이용하여
Figure 6의 곡선을 해석하였고, 반응 차수(m, n)와 속도 상수(k)를 산출 및 Table 2에 정리하였다. 2가지 반응 차수에
대한 분석에서는 반응 메커니즘에 대해 분석할 수 있는데, m은 경화 과정에서 발생한 하이드록실기의 수소가 에폭사이드 링의 산소에 수소
결합을 하게 되고, 이에 따라 개환 반응이 촉진하는 자가촉매반응의 차수이며, n은 시스템에 존재하는 음이온이 에폭사이드 링을 친핵성
공격하여 발생하는 개환 반응의 차수이다.13 n은 개시된 음이온과 에폭사이드 2분자 사이에서 발생하므로, 2차
반응에 근접한 값을 나타냈으며 온도 의존성은 거의 없는 것을 확인할 수 있었다. m은 온도 상승에 따라 큰 감소를 나타냈으며, 이를
통해 경화 반응에서 자가촉매반응이 차지하는 기여가 작아진다는 것을 확인할 수 있었다. 특히 m의 값이 매우 작은 것으로부터 음이온
개환 중합을 통한 경화 반응 과정에서는 자가촉매반응의 효과가 다이아민 경화 시스템에 비해 매우 작음이 시사되었다. 각 온도에서의 k에
대한 분석 결과로, 반응 온도가 20 oC 상승함에 따라 값이 약 2배 가량 증가하는 경향을 확인할 수 있었으며, 각 온도에서의 속도 상수를 바탕으로
Figure 7에 나타낸 것과 같이 Arrhenius plot을 작성하여 활성화에너지(Ea)와 빈도 상수(A)를 산출하였고, 이를 Table 2에 기재하였다.
얻어진 경화 반응에
대한 속도론 해석을 바탕으로, DGEBA/DDM 시료는 작용기의 화학당론비가 에폭시와 아민이 동일하게 경화제인 DDM을 혼합,
DGEBA/2PZ-CN 시료는 2PZ-CN의 함량을 3 wt%로 실온에서 혼합하여 순수한 에폭시/경화제 혼합물을 제조 후, 스테인리스스틸 몰드를 이용하여 경화물을
제조하였다. 전경화 및 후경화 공정없이 비교적 저온인 120 oC에서 2시간의 반응을 통해 에폭시 경화물 2종의 경화 공정을 통일하였다. 또한 충전율을 고려하여 최적 비율로
여러가지 크기의 구상 알루미나가 혼합된 충전제를 활용하여 2종의 경화제에 대해 10 wt% 간격으로 50 wt%까지 5종의 에폭시/알루미나 복합재료를 동일 경화
온도 조건에서 각각 제조하였다.
이후, 제조한 순수
에폭시 경화물과 복합재료에 대해 열전도도측정기를 이용하여 열전도도, DSC를 이용하여 유리전이온도, DMA를 이용하여 동적기계적 특성 분석을 실시하였으며,
이를 각각 Figure 8과 Table 3, Figure 9, Figure 10에 나타내었다.
Figure 8 및
Table 3의 열전도도 분석에서, 순수한 DGEBA/2PZ-CN 경화물은 0.31 W/m·K, DGEBA/DDM 경화물은 0.24 W/m·K의 열전도도를 나타내어 촉매형 경화제의 사용이 열전도도
향상에 명확한 향상 효과를 나타낼 수 있음을 확인할 수 있었다. 또한 이때 DDM 시료 대비 2PZ-CN의 열전도도 상승률은 대략 30%였으며,
이 비율은 동일 함량의 보강재를 가지는 모든 복합재료에서 유사한 값이 유지되는 것을 확인할 수 있어 기지재의 열전도도 향상이 복합재료의 열전도도
향상에 직결됨이 시사되었다. 특히, 2PZ-CN의 복합재료는 40 wt% 이상의 알루미나 함량에서 1 W/m·K를 상회하는 열전도도 값을 보였으며, 50 wt%의
알루미나 함량에서는 1.66 W/m·K의 매우 높은 열전도도를 나타내었다.
다음으로, DSC
분석을 통해 경화물의 유리전이온도(Tg)에 대해 조사하였으며, DSC 곡선을 Figure 9에 나타냈다. 복합재료의
데이터는 생략하였으나, 순수 경화물과 거의 유사한 곡선 형태를 나타냈으며 비열의 차이로 인한 heat flow 값의 차이만이 확인되었고, Tg는
유사한 범위에서 나타났다. 순수 경화물의 Tg는 DGEBA/2PZ-CN은 130.9 °C, DGEBA/DDM은 144.3 °C에서 확인되었으며, 2PZ-CN이 약간 낮지만 경화제
함량이 낮은 점을 고려하면 충분히 실용적인 범위의 값을 나타냄을 알 수 있었다.
Figure 10의
DMA 측정 결과로부터도 Tg를 확인할 수 있었는데, tan d의 최대값을 기준으로 순수 경화물
DGEBA/2PZ-CN은 114.5 °C, DGEBA/DDM은 137.2 °C에서 Tg가 확인되어
DSC 결과와 동일하게 2PZ-CN 시스템이 낮은 경향을 확인할 수 있었다. 일부 복합재료에서 확인된 값은 다소 증감이 있었으나, 비슷한 범위에서
Tg가 나타남을 확인하였다. 특히, 저장 탄성률에서 DGEBA/2PZ-CN 및 DGEBA/DDM 모두 실온에서
2 GPa 이상의 값을 나타냈으며, 저장 탄성률 및 손실
탄성률 모두 2PZ-CN 경화물에서 약간 더 높은 값이 확인되어 경화 과정에서 발생하는 가교 구조 발달이 다이아민 경화제인 DDM과 유사한 수준
또는 그 이상임을 확인하였다. 또한 2PZ-CN 경화물은 특이하게 Tg 이상의 온도에서 저장 탄성률 및 손실 탄성률의
큰 감소가 확인되지 않아 일반적인 에폭시 경화물과는 다른 양상을 보였다. 2PZ-CN의 경화 반응에서 우선적으로 선형 개환 중합 반응이 발생하므로
직선형 고분자가 생성될 것이라는 예상과는 다르게 이 결과로부터 선형 중합 후 생성되는 가교 결합이 상당 수준 발생하는 것으로 추측할 수 있다.
복합재료에서는 2종류에서 모두 충전제로 사용한 알루미나의 함량 증가에 따라 저장 탄성률 및 손실 탄성률이 크게 증가하는 것을 확인할 수 있었으며,
이는 탄성률이 높은 세라믹 성분인 알루미나에 유래한 것으로 설명될 수 있다.
또한 상세한 미세
결정 구조 분석을 위하여 순수 경화물 2종의 X선 회절 분석을 실시하였고 결과를 Figure 11에 나타냈다. 두 경화물은 모두 명확하게 날카로운
피크가 나타나지 않는 전형적인
에폭시 경화물의 비정질 고체의 곡선을 나타내었다. 2q의 흡수 최대값은 DGEBA/2PZ-CN은 17.5°,
DGEBA/DDM 경화물은
17.8°에서 확인되었으며, 전체 영역에서 DGEBA/2PZ-CN의 흡수가 미세하게 저각 영역에서 나타났다. 이는 두 경화물이 면간 배열 약
5 Å의 비정질의 네트워크 구조를 나타내는 것으로, DGEBA/2PZ-CN의 면간 거리가 약간 더 크다는 것이 확인되었고,
DGEBA/DDM이 조금 더 밀집된 네트워크를 가지는 것이라 할 수 있다.
이상의 결과를 종합하면,
2PZ-CN을 에폭시 수지의 경화제로 단독 활용할 경우, 대표적인 다이아민 경화제인 DDM에 비해 열전도성과 기계적 특성같은 타 기능성이 강화된
경화물의 제조가 쉽게 가능한 것으로 판단되어, 동일 형태의 경화 반응이 발생하는 것으로 알려진 유사 촉매형 물질에 대해서도 특성의 조사가 필요한
것으로 생각된다.

|
Figure 2 Expected molecular structures and network schemes after curing reaction |

|
Figure 3 Dynamic DSC curves of DGEBA/2PZ-CN curing mixtures under N2 gas measured at various heating rates. |

|
Figure 4 Ozawa plots of DGEBA/2PZ-CN system derived from
dynamic DSC results. |

|
Figure 5 Kissinger plots of DGEBA/2PZ-CN system derived from
dynamic DSC results. |

|
Figure 6 Plots of curing reaction rates (dα/dt, min-1) and the degree
of conversion (α) converted from isothermal DSC curves of 2PZCN curing mixtures. |

|
Figure 7 Arrhenius plot derived from the rate constants (k). |

|
Figure 8 Thermal conductivities of cured pure epoxy resins and
composites |

|
Figure 9 Glass transition of cured epoxy resins. |

|
Figure 10 DMA curves of cured pure epoxy resins and composites:
(a) storage modulus; (b) loss modulus; (c) tan δ. |

|
Figure 11 XRD patterns of cured epoxy resins. |
본 연구는
DGEBA계 에폭시 수지의 2PZ-CN 촉매에 의한 음이온성 개환 중합으로 시작되는 경화 반응에 대해 동적 DSC 및 등온 DSC를 활용하여 상세한
반응 속도론에 조사하였다. 흔히 사용되는 다이아민 경화제인 DDM과의 비교를 통해, 2PZ-CN 함량 3 wt%에서도 비슷한 수준의 반응열이 발생하는 경화 반응이
가능함을 확인하였고, 상세 반응은 선형적으로 에폭사이드 개환 반응이 발생한 후, 이어서 생성된 사슬 간의 가교 반응이 발생하는 것으로 분석되었다.
2PZ-CN 경화물은 DDM 경화물에 비해 다소 낮은 유리전이온도를 나타냈으나, 선형적으로 배열된 네트워크 구조를 형성하면서 30% 가량의 열전도도
향상이 관찰되었고, 동적기계적 특성 분석으로부터도 개선된 탄성률을 확인할 수 있었다. 또한 2종의 경화제에 대해 제조된 구상 알루미나 복합재료의
열전도도에 대해서도 조사되었으며, 순수 경화물과 유사하게 2PZ-CN 복합재료에서 높은 열전도도가 얻어짐을 확인할 수 있었다. 이렇게 단순히 경화제의
종류를 변경하여 경화물의 네트워크 구조를 제어하는 것만으로 기능성이 강화된 수지와 그 복합재료의 개발이 가능함을 확인할 수 있었다.
- 1. A. L. Moore and L. Shi, Mater. Today, 17, 163 (2014).
-

- 2. X. Huang, P. Jiang, and T. Tanaka, IEEE Electr. Insul. Mag., 27, 8 (2011).
-

- 3. M. A. Vadivelu, C. R. Kumar, and G. M. Joshi, Compos. Interfaces, 23, 847 (2016).
-

- 4. H. Chen, V. V. Ginzburg, J. Yang, Y. Yang, W. Liu, Y. Huang, L. Du, and B. Chen, Prog. Polym. Sci., 59, 41 (2016).
-

- 5. Y. H. Bae, G. D. Park, H. O. Jung, M. C. Vu, and S. R. Kim, Polym. Korea, 40, 148 (2016).
-

- 6. Y. Kim, H. Yeo, N. H. You, S. G. Jang, S. Ahn, K. U. Jeong, S. H. Lee, and M. Goh, Polym. Chem., 8, 2806 (2017).
-

- 7. H. Yeo, A. M. Islam, N. H. You, S. Ahn, M. Goh, J. R. Hahn, and S. G. Jang, Comp. Sci. Tech., 141, 99 (2017).
-

- 8. S. Tanaka, F. Hojo, Y. Takezawa, K. Kanie, and A. Muramatsu, ACS Omega, 3, 3562 (2018).
-

- 9. A. M. Islam, H. Lim, N. H. You, S. Ahn, M. Goh, J. R. Hahn, H. Yeo, and S. G. Jang, ACS Macro Lett., 7, 1180 (2018).
-

- 10. J. Lee, S. Hwang, S. K. Lee, S. Ahn, S. G. Jang, N. H. You, C. B. Kim, and M. Goh, Polymer, 179, 121639 (2019).
-

- 11. T. Ozawa, Bull. Chem. Soc. Jpn., 38, 1881 (1965).
-

- 12. H. E. Kissinger, Anal. Chem., 29, 1702 (1957).
-

- 13. S. Sourour and M. R. Kamal, Thermochim. Acta, 14, 41 (1976).
-

- 14. H. Yeo, Polymer, 159, 6 (2018).
-

- 15. H. Yeo, Polymer, 168, 209 (2019).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(5): 701-708
Published online Sep 25, 2020
- 10.7317/pk.2020.44.5.701
- Received on May 15, 2020
- Revised on Jun 19, 2020
- Accepted on Jun 23, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hyeonuk Yeo
-
Department of Chemistry Education, Kyungpook National University, Daegu 41566, Korea
- E-mail: yeo@knu.ac.kr
- ORCID:
0000-0003-2629-4353













 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.