- PLGA/Hydroxyapatite/β-TCP Composite Scaffold Possessing Negative Poisson’s Ratio for Bone Regeneration
Hong Jin Choi*, Hyeon Seong Jang, Junseok Lee, Jongman Cho, and Jeong Koo Kim†

Department of Biomedical Engineering, Inje University, Gimhae, Gyeongnam 50834, Korea
*Department of Mechanical Systems Engineering, Hansung University, Seoul 02876, Korea- 골 재생을 위한 음의 포아송을 가지는 PLGA/Hydroxyapatite/β-TCP 복합 지지체에 관한 연구
인제대학교 의용공학부, *한성대학교 기계시스템공학과
This study attempted to
maximize the cell proliferation by delivering effective physical stimulation to
cells by creating a negative Poisson’s ratio by modifying the shape of the
pores of the scaffold to cause effective bone cell proliferation in bone tissue
regeneration. Polymer and ceramic materials used as scaffolds are poly(lactic-co-glycolic
acid) (PLGA), hydroxyapatite (HA), and beta-tricalcium phosphate (β-TCP). The
support was prepared by salt leaching to provide an environment for cell
survival, seeding MG-63 cells, and stimulating the support with a negative
Poisson’s ratio so that the cells were sufficiently stimulated. In the case of
the control (PLGA/HA) support specimen, the cell proliferation rate when
compressed stimulation was applied was about 21.4, 25.8, and 39.9% higher than
the proliferation rate without stimulation over 1, 3, and 5 days, respectively.
The results showed that the experimental group (PLGA/HA/β-TCP) scaffold
specimens showed high results of 37.6, 57.7 and 71.6% when compression
stimulation was applied. This means that the PLGA/HA/β-TCP scaffolds, which
replaced the amount of HA with β-TCP about 40%, helped the growth of bone cells
by about 30%, compared with the previous study PLGA/HA composite scaffolds in
compression stimulation.
본 연구는 골조직 재생에서 효과적인 골세포 증식을 일으키기
위하여 지지체의 공극 형태를 변형시켜 음의 포아송 비를 만들어 효과적인 물리적 자극을 세포에 전달하여 세포증식의
극대화를 일으키기 위하여 시도하였다. 지지체로 사용된 고분자와 세라믹 재료는 poly(lactic-co-glycolic acid)(PLGA)와
hydroxyapatite(HA), beta-tricalcium phosphate(β-TCP)이다. 염침출법으로
지지체를 제작하여 세포 생존을 위한 환경을 제공하고 MG-63 세포를
seeding한 후, 음의 포아송 비를 가지는 지지체에 자극을 주어 세포가 충분한 자극을
받도록 하였다. 대조군(PLGA/HA) 지지체 시편의 경우, 압축자극을 가하였을 때의 세포증식률이 자극이 없을 때의 증식률보다 1, 3,
5일 차에 걸쳐 각각 약 21.4, 25.8, 39.9% 높은 결과를 보였고, 실험군(PLGA/HA/β-TCP)
지지체 시편은 압축자극을 가하였을 때 37.6, 57.7, 71.6% 높은 결과를 보였다. 이는 기존의 연구였던 PLGA/HA 복합 지지체보다 HA의 양을 40% 정도 β-TCP로
대체한 PLGA/HA/β-TCP 지지체가 약 30%가량 골세포의 성장을 도왔으며 압축 자극과의 시너지 또한 있음을 알 수 있었다.
This study attempted to maximize the cell proliferation by
delivering effective physical stimulation to cells by creating a negative
Poisson's ratio by modifying the shape of the pores of the scaffold to cause
effective bone cell proliferation in bone tissue regeneration. PLGA/HA/¥â-TCP scaffolds, which
replaced the amount of HA with ¥â-TCP about 40%, helped the growth of bone
cells by about 30%, compared with the previous study PLGA/HA composite
scaffolds in compression stimulation.
Keywords: tissue engineering, scaffold, poly(lactic-co-glycolic acid), hydroxyapatite, β-TCP
본 연구는 한국연구재단 이공분야기초연구사업(201902980002)에
의해 지원되었습니다.
세계적으로 골 결손에
있어서 골 이식재 사용은 보편화되어 있는 방법 중 하나이다. 대표적인 골 이식 방법은 자가골, 동종골, 이종골, 합성골 이식이 있는데, 자가골 이식은
면역 반응이 일어나지 않고 골 형성능력이 뛰어나 이상적인 골 이식재로 쓰인다. 하지만, 골 채취를 위하여 추가적인 수술이 필요하고 그 양이 적다는
문제점이 존재한다.1 동종골, 이종골 이식은 면역 반응에 취약한 문제점이 있어 최근에는 뛰어난 생체적합성을 가지고 높은 골
전도성을 가진 합성골 이식재의 연구가 활발히 진행되고 있다.2
골 결손 치료를 위한
방법으로 쓰이는 지지체의 고분자로는 poly(lactic-co-glycolic acid)(PLGA)가 많이 연구되고 있으며,
PLGA는 lactic acid와 glycolic acid의 공중합체로 미국의 식품의약품안전청(FDA)의 승인을 받아 그 안정성이 입증된 생분해성
고분자이다. PLGA는 약물 전달 체제 또는 물리적 자극에 좋은 조직공학용 지지체에 이용되며, 이를 이용한 지지체는 세포성장을 위한 환경 조성에
도움을 준다.
Hydroxyapatite(HA)는
인간의 뼈 구성성분 중 하나로, 생체친화성과 생체활성이 매우 우수한 인산칼슘계 세라믹이다.3,4 HA는 독성이 없을 뿐만 아니라 골 유도성을 가지고
있어 주위 생체조직과 잘 결합하여 생체재료로 장점이 많은 물질로 오래 전부터 사람의 뼈, 치아 등 경조직 대체 임플란트로 사용된 소재이다.5,6
이전 실험에서 PLGA의 물성 보완과 세포증식률 향상을 위하여 HA를 추가 혼합하여 그에 대한 기계적 물성과 세포증식률 향상을 이끌어내었다.7
Beta-tricalcium
phosphate(β-TCP)는 HA와 같이 뼈를 이루는 성분인 인산칼슘계 생체재료로 골 결손 시멘트나 임플란트에 이미 사용되고 있는 재료이다.
사람의 뼈와 화학 성분이 비슷하기 때문에 독성이 없고 생체활성이 뛰어난 특징을 가진다. β-TCP는 생분해가 매우 뛰어난 물질로 알려져 있으며,
신생 골 형성에 도움을 주는 등의 우수한 골전도성, 생체적합성을 가진 재료이다.8
물질을 횡 방향으로
당겼을 때 종 방향으로의 길이 변화가 일어나게 되는데 이 때의 변형의 크기의 비를 포아송 비(Poisson’s ratio)라 한다. 포아송 비는
횡 방향의 변형률을 축 방향의 변형률로 나누어 음의 값을 가지도록 하여 계산이 가능하다. 세상에 존재하는 일반적인 물질들은 대부분 양의 포아송 비를 가진다.9 하지만, 특정 물질이
음의 포아송 비를 가지게 된다면 일반 물질과 다른 특성을 가질 수 있다. 음의 포아송 비를 가진 물질은 구조적 특징으로 인하여 축 방향으로 당겨지면
횡 방향으로도 길이가 늘어나게 되고 반대로 축 방향으로 압축이 되면 횡 방향으로도 길이가 줄어들게 되는 특성이 있다.10 이
특성을 이용하여 세포에 등방성 자극을 줄 수 있으며, Roderic Lakes에 의해 알려진 열처리 및 3축 영구체적 압축법으로 음의 포아송 비를 지지체에 적용할 수 있다.11
골세포의 성장에 영향을
주는 방법으로는 골세포를 자극하는 방법이 있다.12,13 골세포의 성장은 세포에 주어지는 하중의 크기와 빈도에 영향을 받는데
세포를 자극할 수 있는 힘을 지지체에 효과적으로 줄 수 있도록 내부의 기공을 바꾸는 방법으로 음의 포아송 비를 구현한다면 효과적인 골 재생을 유도할
수 있을 것이다. 음의 포아송 비를 가지는 지지체를 압축하게 된다면 내부 구조에 의하여 세포가 등방성 자극을 받을 수 있게 된다. 따라서 골세포를
함유한 지지체의 압축자극에서 음의 포아송 비를 적용시켜 자극을 준다면 효과적인 세포 성장이 가능하여 조골세포의 증식이 늘어난다면 골 결손 문제를
해결할 수 있다.
본 연구에서는 기존의
인산칼슘계 세라믹 재료 HA에 골 형성을 촉진시키며 뛰어난 생체활성, 골 전도성을 가지는 물질인 β-TCP를 첨가한 지지체 시편을 제작하여 조직공학용
다공성 지지체를 제작, 3축 영구 체적 압축을 통하여 내부 공극 구조를 변형시켜 음의 포아송 비를 가지도록 함으로써 내부에 파종한 골세포에 효과적인
등방성 압축 자극을 가할 수 있도록 하여 골세포 증식을 극대화시키는 연구를 진행하고자 한다.
시약 및 재료. 본 실험에서 사용한 poly(lactic-co-glycolic
acid)(PLGA)는 Lakeshore Biomaterials(Essen, Germany)에서 구입하였으며 lactic acid와
glycolic acid의 비는 50:50이다. Molecular weight(Mw , Mn)은 124,
77 kDa이었으며 고분자의 열적 특성인 glass
transition temperature(Tg)는 47.7 oC이다. Hydroxyapatite(HA)는 Sigma-Aldrich(USA)에서 구입하였으며 β-tricalcium
phosphate(β-TCP) 또한 Sigma-Aldrich(USA)에서 구입하였다. 그 외 유기용매로 사용한 클로로포름은 Duksan
Pure Chemicals(Korea)에서 구입하였다.
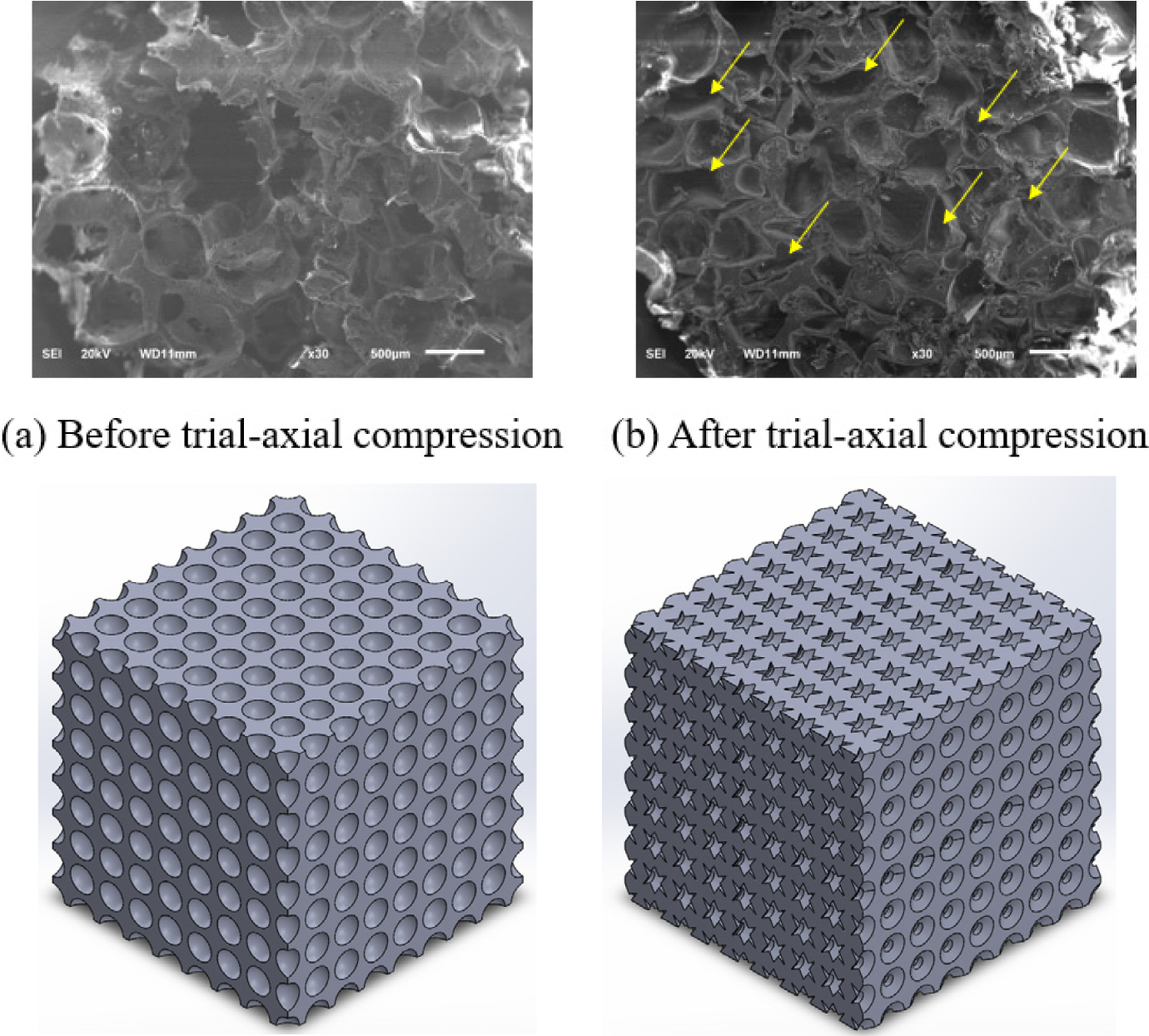
음의 포아송 비를 가지는 PLGA/HA 다공성 지지체 제작. 음의 포아송 비를 가지는 다공성 지지체를 제작하기 위해
solvent
casting/particulates leaching과 Roderic Lakes가 제안한 3축 압축 영구 체적 압축과 연화온도 이상의 열처리 방법을
사용하였다. 기공의 크기는 골세포 성장과 분화에 적합하다고 보고되어 있는 350~400 μm 범위 크기의 제작을 위해 500~600 μm 범위의 소금 입자를 사용하여 제작하였다.7
PLGA를 클로로포름에 1:5의 비율로 용해시킨 후, HA를 PLGA의 10 wt% 비율로 넣어 균일하게 분포되도록 1시간 동안 교반시켰다.
미리 제조한 소금 입자들과 균일하게 PLGA:소금 = 1:10으로 혼합한 후, 혼합물을 20×20×20 mm 몰드에 부어 36시간 동안 클로로포름이 증발하도록
건조하였다. 3축 압축 전 열처리 온도 및 시간은 60 oC/10분이며, 이전의
연구에서 기공의 크기가 무너지지 않고 포아송 비가 가장 낮았던 2.37:1로 압축하여 제작하였다.14 그 후 몰드에서 빼낸
각각의 시편들을 증류수에 48시간
동안 담가 소금 입자를 빼내고, (-)60 oC에서 48시간 동안 동결 건조하였다.7,15-17
음의 포아송 비를 가지는 PLGA/HA/β-TCP 다공성 지지체 제작. 음의 포아송 비를 가지는 PLGA/HA/β-TCP 다공성
지지체를 제작하기 위해 PLGA에 HA와 β-TCP를 교반시켜 같은 방법을 이용하여 PLGA/HA/β-TCP 지지체를 제작하였다. 이때 HA/β-TCP
파우더는 PLGA의 10 wt% 비율로 넣어 교반하였으며 HA와 β-TCP 비율은
골세포 성장에 뛰어나다고 알려진 연구 결과를 바탕으로 6:4 비율을 사용하였다.7,18
제작된 지지체들의 포아송 비의 측정. β-TCP의 첨가로 인한 포아송 비의 변화를 확인하기
위해 material testing system (MTS, LRX-PLUS, Lloyd instruments, West sussex, UK)을 이용한 실험을
진행하였다. MTS로 압축실험을 함과 동시에 디지털 비디오 레코더로 동영상 촬영을 하여 얻은 영상을 Image J program v2.0 프로그램으로
분석하였다.7 시편에 0~15% 사이의 strain 범위에서 분석하였고 5% 단위로 지지체 시편의 변화량을 이용하여 포아송
비를 측정하였다.7
골세포 배양. 세포 증식률 측정을 위해 human
osteoblastic like
cell(MG-63, KCLB, Seoul, Korea)을 배양하였다. 배양조건은 dulbecco’s minumum essential medium(DMEM, Welgene,
USA)에 10%의 우태아혈청(fetal
bovine serum;FBS, Gibco, USA)과 1%의 페니실린(penicillin/streptomycin, Sigma-Aldrich, USA)을 혼합 첨가한 배지를 제조하여 37 oC, 5% CO2 조건의 인큐베이터에 배양하였다. 안정화된 세포를 얻기
위하여 Passage 4 세포를 배양하여 실험에 사용하였다.19
압축 자극이 없는 지지체에서의 골세포 증식. PLGA/HA 지지체의 β-TCP가 첨가로 인한 골세포에
미치는 영향을 알아보기 위해 각각의 지지체 내부에 MG-63 cell을 파종하여 cell counting kit-8(CCK-8,
DOJINDO, Japan)를 이용하여 증식률을 분석하였다. 이는 압축자극에 상관없이 b-TCP만으로 세포의 성장을 돕는 것이 아님을 밝히기 위해 실험하였다. 각각의 지지체는
사용 전 70% 에탄올을 이용하여 30분간 멸균한 후 phosphate buffer saline(PBS, LONZA, USA) 용액으로 3회 세척하였다.
세포 배양 플라스크에
MG-63 cell을 배양하여 트리판블루(Gibco, USA)를 이용하여 염색한 후 hemacytometer로 세포 수를 카운팅하여 지지체 내부에
2× 105 cells/80 μL의 밀도로 세포를 파종하였다. 각 지지체는 제조한 배지 2 mL를 첨가한 후 24시간 동안 인큐베이터에 배양시킨 후 세포 점착을 유도하였다. 이후 1, 3, 5일 동안
세포증식률을 측정하였다. 1, 3, 5일 차의 각 시편들은 새로운 12-well plate에 옮겨 PBS 용액으로 세척하여 배지를 첨가하고 CCK-8 kit 시약을 배지의 10%만큼 첨가하여
반응시켰다. MTT 분석의 경우, 여러 단계를 거쳐 단일 측정으로
끝나야 하므로 오류가 증가할 가능성이 높으며 테트라 졸륨염으로 생성된 포르마잔 안료의 물에 대한 용해도가 낮다. 따라서 CCK-8 분석을 수행하였다.20
반응시킨 지지체 내의 용액은 세포증식을 평가하기 위하여 microreader(iMARK BIORAD, California, USA)로
450 nm에서의 흡광도를 측정하였다.19,21
압축 자극 적용한 음의 포아송 비를 가지는 지지체에서의 골세포 증식. β-TCP의 추가혼합과 음의 포아송 비를 가지는 지지체에
가해지는 압축 자극의 효과를 알아보기 위해 음의 포아송 비를 가지는 PLGA/HA 지지체와 PLGA/HA/β-TCP 지지체에 세포를 배양한 후
압축 자극을 가하여 세포증식률을 측정하였다. 시편 당 2×105 cells/80 μL 만큼의 세포를 파종하였으며 1일간의 안정적인 세포 점착을 유도하였다. 압축기구로 하루 4시간씩, 압축 하중 50 N, 15분 압축/15분 휴지의 주기로 압축 자극을 적용하였다.7
이러한 조건은 이전의 연구에서 골세포의 증식률이 가장 높았던 조건을
적용하였다.7 1, 3, 5일 차의 각 시편들은 새로운 12-well
plate에 옮겨 PBS 용액으로 세척하여 배지를 첨가하고 CCK-8 kit 시약을 배지의 10%만큼 첨가하여 반응시켰다. 반응시킨 지지체 내의
용액은 세포증식을 평가하기 위하여
microreader(iMARK BIORAD, California, USA)로 450 nm에서의 흡광도를 측정하였다.21,22
통계학적 분석. 실험의 통계학적 분석은 student’s t-test를
시행하여 p value가 0.05 미만인 경우 통계학적으로 유의한 것으로 분석하였다.
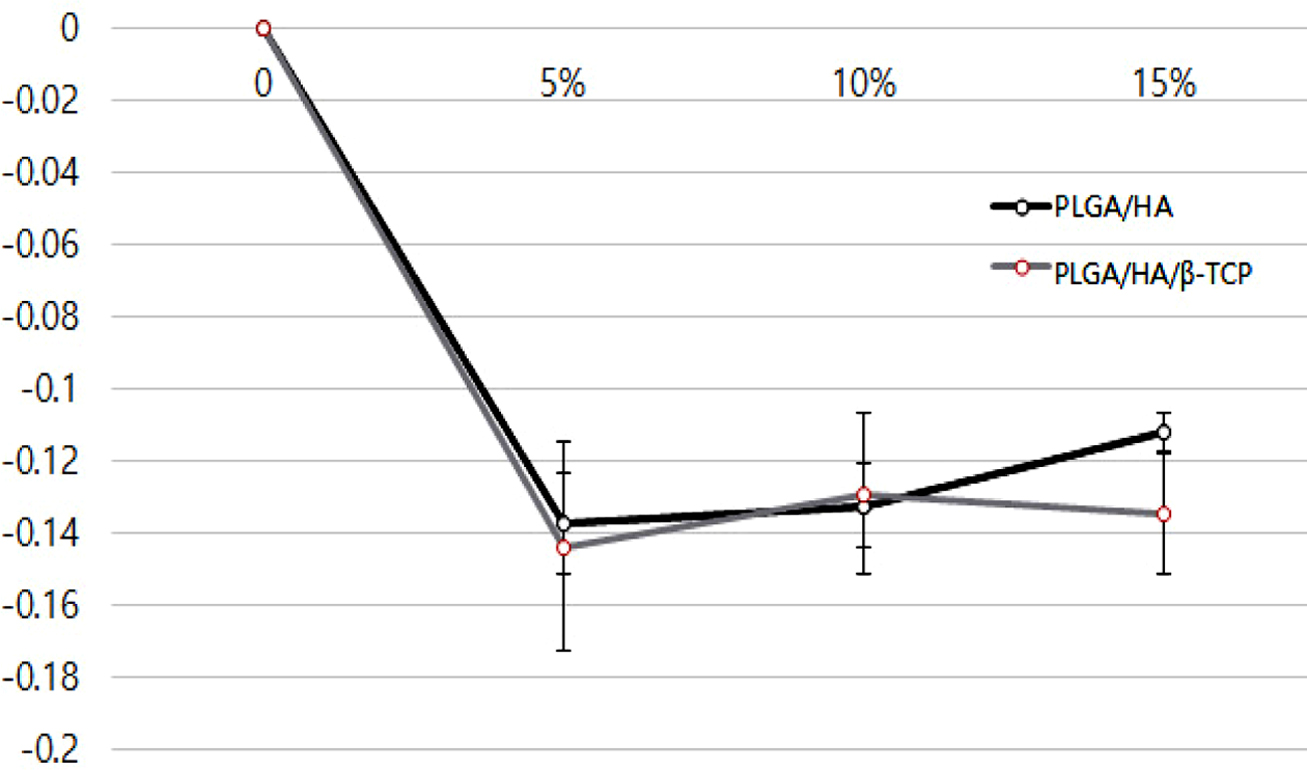
제작된 지지체들의 포아송 비 측정. 기존의 연구에서의 음의 포아송 비를 가지는
PLGA/HA 지지체의 5~15% strain에서의 포아송 비를 측정한 결과 -0.13725~-0.11225의
값이 측정되었다. β-TCP가 첨가된 PLGA/HA/β-TCP 지지체 시편은 -0.14375~-0.1345의 값이 측정되어 3축 영구 체적 압축으로
인한 음의 포아송 비 구현은 성공적으로 나타났다. 또한 유의성 평가를 위해 student’s t-test를 β-TCP의 첨가로 인한
음의 포아송 비에 있어서의 유의한 영향은 없다는 것을 확인하였다(Figure 1). 이는 β-TCP의 첨가가 3축 압축에 의한 포아송 비
변화에 평균값에는 영향을 끼쳤으나 두 그룹이 차이를 나타냈다고 볼 수 없으므로 영향을 끼치지 않음을 알 수 있었다.
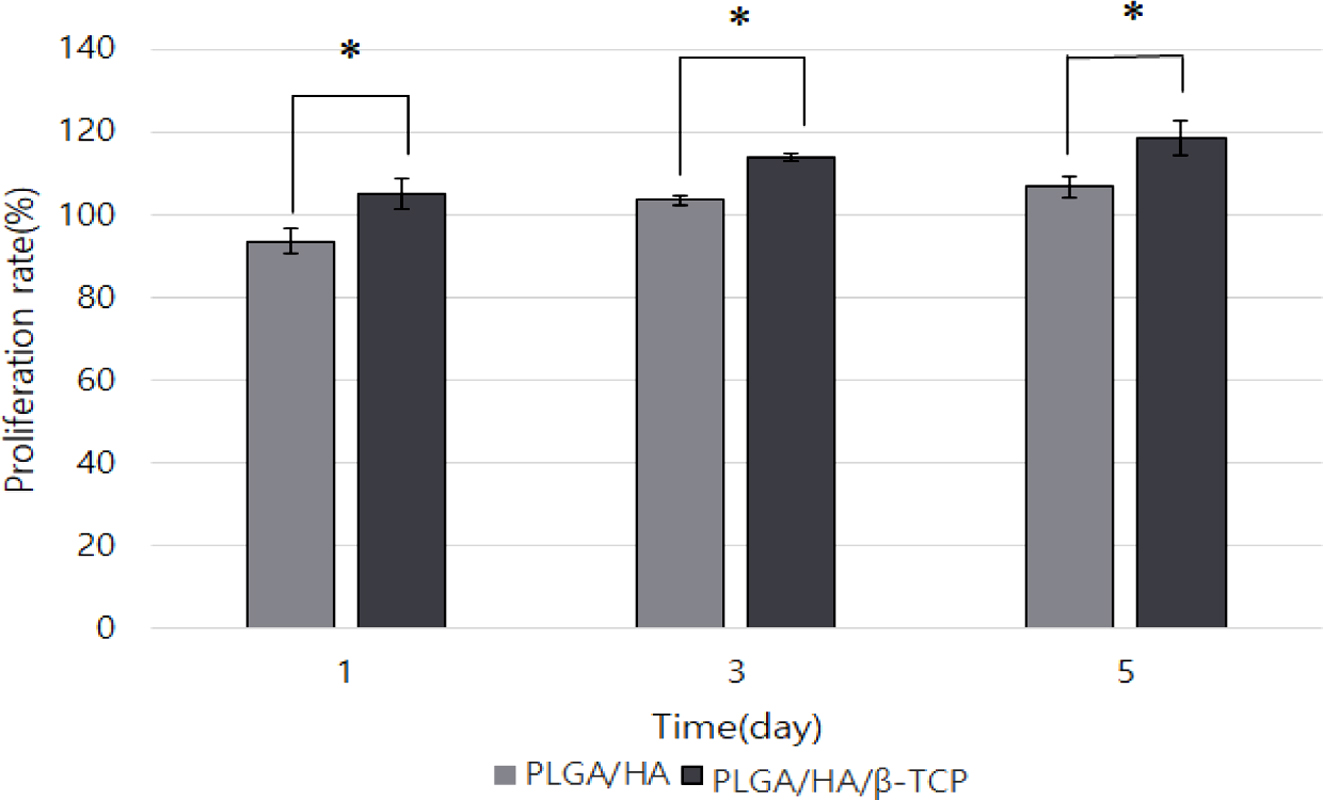
압축 자극이 없는 지지체에서의 골세포 증식. 1일차 PLGA/HA 지지체의 골세포 증식률은
93.58±3.011%, PLGA/HA/β-TCP 지지체 골세포 증식률은 105.117±3.621%으로 측정되었으며, 3일차 PLGA/HA 지지체의
골세포 증식률은 103.535± 1.185%, PLGA/HA/β-TCP 지지체의 골세포 증식률은 113.948 ±0.841%였다. 마지막 5일차의 세포증식률은
PLGA/HA 지지체에서는 106.799±2.494%, PLGA/HA/β-TCP 지지체에서는 118.541±3.951%로 β-TCP가 첨가된 지지체
시편에서 더 높은 세포증식률을 보였다(Figure 2). 이는 β-TCP의 첨가로 인해 골세포의 증식률이 약 10% 가량 증가하였으며, 압축 자극이
없어도 골세포의 증식이 향상됨을 알 수 있다.
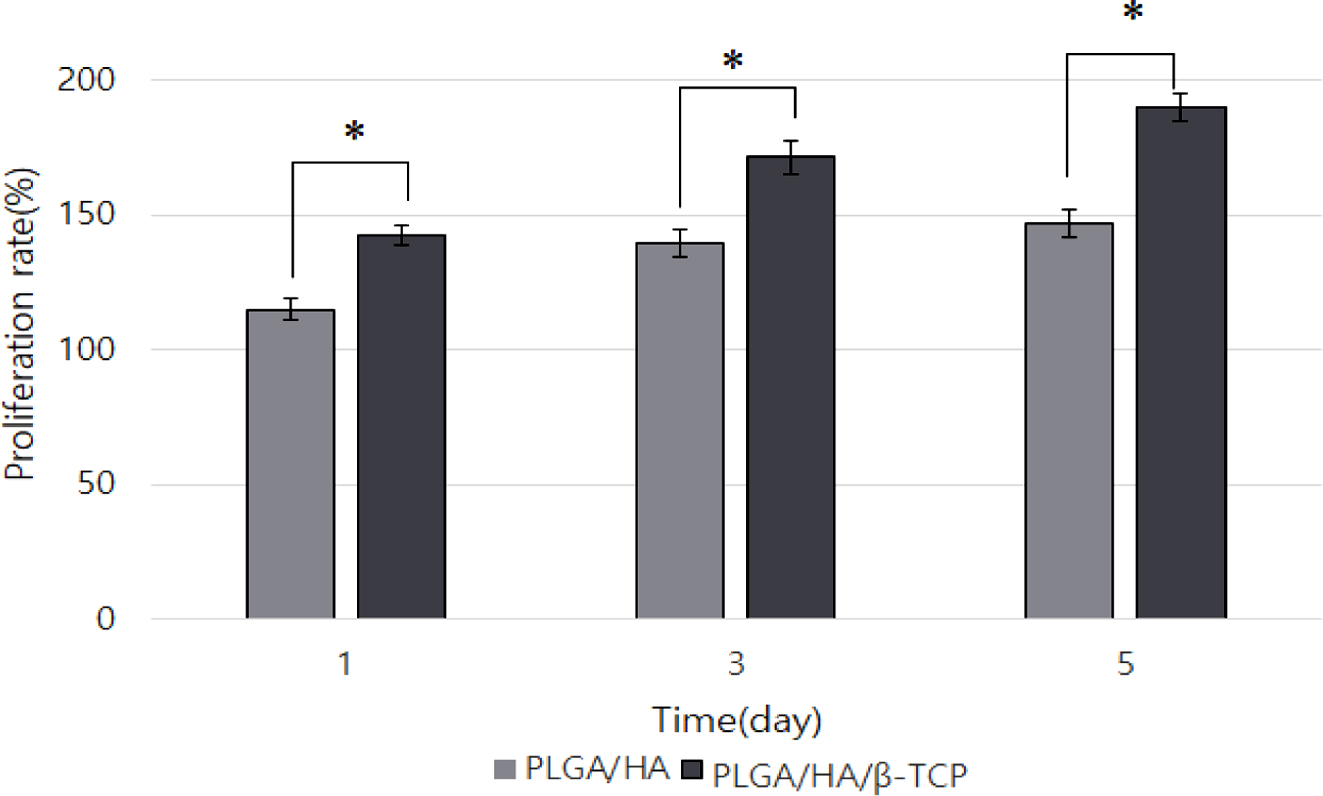
압축 자극 적용한 음의 포아송 비를 가지는 지지체에서의 골세포 증식. 1일차에서 음의 포아송 비를 가지는 PLGA/HA지지체의
세포증식률은 114.987±3.240%이며, 음의 포아송 비를 가지는 PLGA/HA/β-TCP 지지체의 세포증식률은 142.7± 3.784%였다. 3일차에서 음의 포아송 비를 가지는
PLGA/HA 지지체의 세포증식률은 139.387±3.111%, PLGA/HA/β-TCP 지지체의 세포증식률은 171.654±1.800%였다. 마지막으로
5일차에서 음의 포아송 비를 가지는 PLGA/HA 지지체의 세포증식률은 146.626±4.512%의 증식률을 보였고, PLGA/HA/β-TCP
지지체의 세포증식률은 190.142±5.213%로서 β-TCP가 첨가된 PLGA/HA/β-TCP의 지지체가 PLGA/HA 지지체보다 높은 증식률을
보였다(Figure 3).
이는 기존의 연구였던
PLGA/HA 복합 지지체보다 HA의 양의 40%를 β-TCP로 대체한 PLGA/HA/β-TCP 지지체가 약 30% 이상의 골세포의 성장을 도왔으며,
β-TCP의 첨가는 Figure 2와 Figure 3의 결과를 비교하여 압축 자극과의 시너지 또한 있음을 알 수 있었다. 이는 기존에 알려져 있는
β-TCP가 골세포의 성장을 도와주는 것 뿐만 아니라 압축 자극 후 휴지기에서 세라믹 재료들을 첨가함으로써 PLGA의 부족한 회복력을 도와 높은
증식률을 나타낸 것으로 사료된다.7,14
|
Figure 1 Measurement of Poisson’s ratio (control group: PLGA/
HA scaffold, experimental group: PLGA/HA/β-TCP, n=4). |
|
Figure 2 MG-63 cell proliferation test on non auxetic composite
scaffolds (n=5, *p<0.05). |
|
Figure 3 MG-63 cell proliferation in auxetic composite scaffolds
with compressive stimulation (n=5, *p<0.05). |
골 재생용 지지체를
제작하는데 있어 세포 증식률은 아주 중요한 요소 중 하나이다. 이에 따라 세포의 부착과 증식을 증가시켜주는 연구들이 활발하게 진행되고 있다. 그
예로 들 수 있는 것은 특정 고분자에 생체활성을 가지는 첨가물을 넣어 골 재생용 지지체를 만드는 방법이다. 진행되었던 선행 연구에서 PLGA에
HA를 교반한 지지체를 제작한 후 3축 압축하여 음의 포아송 비를 가지도록 하여 실험을 하였다. PLGA에 HA를 교반한 지지체를 제작하여 세포
증식 실험을 하였으며 HA의 첨가로 세포부착 및 증식에서 이점이 있는 것을 관찰하였다. 이번 연구의 목적은 기존에 연구하였던 PLGA에 HA를
교반한 지지체에 β-TCP를 추가혼합하여 증식률을 알아보는데 있다. 지지체의 세포 증식률을 평가하기 위해 CCK-8을 사용한 실험을 하였다. 압축시간과
휴지시간의 설정은 선행연구에서 효과적인 세포 증식에 도움을 줄 수 있다고 제안하였던 15분 압축/15분 휴지로 설정하였다. 세포 증식률 실험 결과,
지지체에 압축 자극을 가하지 않은 경우와 가한 경우 공통적으로 실험군인 PLGA에 HA와 β-TCP를 교반한 지지체의 증식률이 대조군으로 제작된
PLGA에 HA를 교반한 지지체의 증식률보다 높은 것으로 측정이 되었으며 골 전도성이 뛰어난 bioceramics 재료인 β-TCP가 세포 증식에
이점을 주는 것으로 사료된다. 압축 자극을 적용시킨 경우, β-TCP를 첨가만 하였을 때보다 세포 증식률의 향상이 뛰어났는데 이는 음의 포아송
비를 적용시킨 지지체의 구조가 골세포에 효과적인 등방성 자극을 전달하여 나온 결과로 사료된다. 이번 실험에서 음의 포아송 비를 적용시킨
PLGA에 HA와 β-TCP를 교반한 지지체를 제작하여 압축 자극을 가하는 방법으로 세포 증식률의 극대화를 이끌어낼 수 있었다. 하지만, 압축하중과
압축시간, 휴지시간 등의 변수를 조절하여 지지체 내에 파종된 세포가 어떠한 양상으로 증식할지 확인해보는 추가 연구가 필요하다. 또한 이번 연구의
기공의 크기는 골세포 성장과 분화에 적합하다고 보고되어 있는 350~ 400 μm 범위 크기의 연구만 진행되었으나 공극 크기에 따른 포아송 비 변화 또한 추가 연구가 필요하다고 사료된다.
- 1. J. Patricia, and G. Schmidmaier, Injury, 42, 77 (2011).
-

- 2. Y. K. Kim, S. G. Kim, J. H. Byeon, H. J. Lee, I. U. Um, S. C. Lim, and S. Y. Kim, Oral Surg., Oral Med., Oral Pathol., Oral Radiol. Endod., 109, 496 (2010).
-

- 3. I. S. Kim and P. N. Kumta, Mater. Sci. Eng. B, 111, 232 (2004).
-

- 4. D. Choi, K. G. Marra, and P. N. Kumta, Mater. Res. Bull., 39, 417 (2004).
-

- 5. K. L. Kim, K. M. Ok, D. H. Kim, H. C. Park, and S. Y. Yoon, J. Korean Ceram. Soc., 50, 263 (2013).
-

- 6. J. K. Lee, Y. H. Ko, and N. H. Lee, J. Korean Cryst. Growth Cryst. Technol., 22, 139 (2012).
-

- 7. H. J. Choi, J. J. Lee, J. B. Lee, H. J. Sung, J. W. Shin, J. W. Shin, J. W. Shin, Y. Wu, and J. K. Kim, Biomater. Res., 20, 32 (2016).
-

- 8. Y. H. Kim, A. Jyoti, I. S. Byun, I. H. Oh, Y. K. Min, H. M. Yang, B. T. Lee, and H. Y. Song, J. Korean Ceram. Soc., 45, 618 (2008).
-

- 9. R. Lakes, Science, 235, 1038 (1987).
- 10. E. A. Friis, R. S. Lakes, and J. B. Park, J. Mater. Sci., 23, 4406 (1988).
-

- 11. R. Lakes, Adv. Mater., 5, 293 (1993).
-

- 12. J. Y. Jeong, S. H. Park, J. W. Shin, Y. G. Kang, K. H. Han, and J. W. Shin, J. Mater. Sci.: Mater. Med., 23, 2773 (2012).
-

- 13. H. M. Frost, Angle Orthod., 64, 175 (1994).
-

- 14. H. J. Choi, J. J. Lee, Y. J. Park, J. W. Shin, H. J. Sung, J. W. Shin, Y. Wu, and J. K. Kim, Biomater. Res., 20, 33 (2016).
-

- 15. J. B. Choi and R. S. Lakes, J. Mater. Sci., 27, 4678 (1992).
-

- 16. J. B. Choi and R. S. Lakes, Int. J. Mech. Sci., 37, 51 (1995).
-

- 17. R. S. Lakes and R. Witt, Int. J. Mech. Eng. Ed., 30, 50 (2002).
-

- 18. D. Xidaki, P. Agrafioti, D. Diomatari, A. Kaminari, E. Tsalavoutas-Psarras, P. Alexiou, V. Psycharis, E. C. Tsilibary, S. Silvestros, and M. Sagnou, Materials, 11, 595 (2018).
-

- 19. L. Vikingsson, J. A. Gómez-Tejedor, G. Gallego Ferrer, and J. L. Gómez Ribelles, J. Biomech., 48, 1310 (2015).
-

- 20. E. Owusu-Ansah and U. Baneriee, Nature, 461, 537 (2009).
-

- 21. Z. Kong, J. Li, Q. Zhao, Z. Zhou, X. Yuan, D. Yang, and X. Chen, J. Appl. Physiol., 113, 619 (2012).
-

- 22. V. Dumas, A. Perrier, L. Malaval, N. Laroche, A. Guignandon, L. Vico, and A. Rattner, Biomaterials, 30, 3279 (2009).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(5): 684-688
Published online Sep 25, 2020
- 10.7317/pk.2020.44.5.684
- Received on May 12, 2020
- Revised on Jun 4, 2020
- Accepted on Jun 13, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jeong Koo Kim
-
Department of Biomedical Engineering, Inje University, Gimhae, Gyeongnam 50834, Korea
- E-mail: jkkim@inje.ac.kr
- ORCID:
0000-0001-9898-6581









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.