- Effects of the Thickness of Ion Exchange Polymers Coated onto the Carbon Electrodes and Desorption Potentials on the Desorption Performance in Capacitive Deionization Process
Department of Chemical Engineering, Hannam University, 1646 Yuseongdae-ro, Yuseong-gu, Daejeon 34054, Korea
- 축전식 탈염공정에서 탄소전극에 코팅된 이온교환 고분자의 두께와 탈착전위가 탈착 성능에 미치는 영향
한남대학교 화학공학과
The effects of the thickness
of the ion exchange polymers onto the carbon electrodes and the reverse
potential applied on the desorption process in the membrane capacitive
deionization process were investigated. Poly(ether ether ketone) (PEEK) was
used as the cation exchange polymer while polysulfone (PSf) was used as the
anion exchange polymer. The single and double coatings of the ion exchange
polymers were carried out and the reverse potentials of -0.3, -0.5, -1.0 V
were used. As the reverse potential was larger for the pristine carbon
electrode, it took for a longer time to reach the 0 of the effluent
concentration. The high effluent concentration of ca. 420 mg/L for the double coated
electrode was shown. In the desorption process, the larger reverse potential
was favorable since the time to the 0 effluent concentration took shorter as
the reverse potential increased.
탄소전극 위에 코팅된 이온교환막 층의 두께와 인가되는 역전위에
의해 막 결합형 축전식 탈염공정에서 탈착공정에 어떠한 영향을 끼치는지 조사하였다. 이온교환막은 양이온교환
고분자로서 폴리(이서 이서 케톤)(poly(ether ether
ketone), PEEK)을, 음이온교환 고분자로서 폴리설폰(polysulfone, PSf)을 사용하였다. 이온교환막의 코팅은 1회 및 2회를 실시하였으며 역전위는 -0.3, -0.5, -1.0 V가 사용되었다. 코팅되지 않은
전극에서 역전위가 클수록 배출수 농도가 0이 되는 시간이 길었는데 이는 전극의 기공 내에서 탈착하지 못하고 흡착되어 있던 염분자들이 높은 전위에서 탈착되는 것에 기인한다고 사료된다. 코팅의 두께가 클수록
탈착 시 배출수 농도가 높아 2회 코팅 시 약 420 mg/L의 농도값을 보여주었다. 탈착전위가 클수록 배출수 농도가 0으로 떨어지는 시간이 짧아지므로 탈착공정에서의 탈착전위는 큰 것이 유리함을 알 수 있었다.
The effluent concentrations are getting higher as the
desorption potentials increase. In the desorption process, the larger reverse
potentialis favorable since the time to the 0 effluent concentration took shorter as the reverse
potential increases.
Keywords: membrane capacitive deionization (MCDI), coating thickness, reverse potential, effluent concentration, desorption process.
본 연구는 환경부 “글로벌탑 환경기술개발사업”으로 지원받은 과제임(과제번호:
2016002200001).
축전식 탈염(capacitive
deionization, CDI) 기술은 하전(charged)된 전극의 계면에 형성되는 전기이중층(electric double layer)에서
전기적 힘에 의한 이온들의 흡착반응을 통해 이온성 물질의 포화흡착을 통해 이온성 물질을 제거하며 이때 전극을 단락시키거나 역전위를 인가하면 흡착된
이온들이 빠르게 탈착시켜 전극을 재생시키는 원리를 이용한 것이다.1,2 전극에 흡착되는 이온의 양은 사용된 전극의 정전용량(capacitance)에
의해 결정되므로 CDI에 사용되는 전극은 비표면적이 큰 다공성 탄소전극이 일반적으로 사용된다. CDI는 전극반응이 일어나지 않는 1.5 V의 낮은 전위에서 운전하기 때문에 에너지 소비량이 낮은
장점이 있으나 전극의 정전용량에 의존하므로 높은 염수 농도 적용에 한계가 있다. 그러나 흡착과 탈착의 반복 운전이라는 공정의 편리와 전극의 재생
과정에서 다른 첨가물을 사용하지 않은 친환경적인 것은 다른 장점이 될 수 있다. 그러나 전극의 회복 단계에서 전극으로부터 탈착된 이온들은 벌크
용액으로 들어가며 반면에 반대 이온들은 벌크용액에서 전극 쪽으로 동시에 움직이게 되는데 이러한 현상은 전극을 회복시키는 효율을 감소시키며 결국
낮은 분리 효율로 인하여 에너지 소비가 더 높아지게 된다.3-5
이러한 CDI 공정의
단점을 극복하기 위하여 막결합형 축전식 탈염(membrane capacitive deionization, MCDI) 공정이 소개되었다.6
MCDI 공정의 개념은 양이온 및 음이온 교환 막을 다공성 전극 표면 위에 놓으며 집전장치가 직접 전극에 접촉하게 하는 것이다.7,8
이런 구성에서 벌크 영역에서 전극으로의 이온 이동이 차단되며 그리고 이온교환 고분자에 흡착된 이온들은 자유롭게 전극으로부터 벗어나게 된다.7,8
MCDI의 첫 번째 시도는 Lee 등에6 의해 수행되었으며 두 이온교환막을 전극 표면 위에 놓는 것이었다. 저자는 MCDI의
염 제거 효율이 CDI의 효율보다 19% 향상되었다고 보고했다. 이로부터 수년 뒤 Moon 등은3 설폰화 및 아민화된
poly (phenylene
oxide)(PPO)를 각 전극 위에 붙였는데 이들은 계면 저항을 감소시켜 아주 우수한 염제거 효율을 보여주었다. 다음으로 탄소전극 위에 sulfur succinic
acid(SSA)를 이용하여 열가교된 poly(vinyl alcohol)(PVA)의 이온교환 고분자의 직접 코팅은 코팅하지 않은 전극보다 염제거
효율에서 14.8~30.9% 향상된 결과를 나타냈다.9 또한 본 저자의 실험실에서 설폰화된 PPO와 아민화된
polysulfone(PSf),10 SSA 및 poly(styrene sulfonic acid-co-maleic
acid)로 가교된 PVA와 아민화된 PSf,11 그리고 설폰화된 poly(ether ether ketone)와 아민화된
PSf의12 양이온 및 음이온 교환막 쌍을 MCDI에 적용하여 분리효율에 관하여 조사하였다. 코팅된 고분자의 두께는 보통 약
5 μm에서 많게는 약 15 μm 정도의 범위 내였다. MCDI의 분리성능은 확실히 이온교환 고분자의 이온교환능력에 의존하게 된다. 또한 현재까지 전극 위에 코팅된 고분자의
두께가 흡착성능에 미치는 영향에 대하여 조사된 바가 없어 두께, 흡착시간 그리고 흡착전위에 대하여 최대 흡착과 배출수 농도 등을 통하여 알아보았다.13
이온교환막의 두께가 증가됨에 따라 막을 통과하는 이온들의 움직임이 원활하지 않아 탄소전극에 충분히 흡착되지 못하여 배출수 농도의 최소점이 높아졌고,
최대 흡착 시까지 걸리는 시간이 1회 코팅에서 80분, 그리고 2, 3회 코팅에서 각각 174분, 242분으로 증가됨을 알 수 있었다. 그리고
코팅 두께에 따른 최대 흡착 시까지 걸리는 시간이 선형으로 나타난 결과는 매우 흥미로웠다.13
본 연구에서는 설폰화된
폴리(이서 이서 케톤)(sulfonated poly(ether ether ketone), SPEEK)을 양이온 고분자 그리고 아민화된 폴리설폰(aminated
polysulfone, APSf)을 음이온 고분자로 사용하여 탄소전극 위에 1회 및 2회 코팅을 하여 코팅층의 두께를 달리하였고, 이로부터 탈착이
공정에 미치는 영향을 조사하였는데 이때 탈착전위는 0.3, 0.5 그리고 1.0 V의 역전위를 인가하여 실험하였다. 이로부터 원액
100 ppm의 NaCl 용액에 대하여 각각의 탈착전위와과 코팅
두께에 대하여 탈착 시 배출수 농도를 측정하여 시간 대 농도 곡선으로부터 탈착 특성을 관찰하였다.
실험재료. 코팅층으로 사용되는 양이온 및 음이온 고분자를 제조하기 위해 Victrex사의 poly(ether
ether ketone)(PEEK, 450PF)과 Solvay사의 polysulfone(PSf, Udel)으로부터 각각 구입하여 사용하였다.
1,2-dichloroethane(DCE), N-methyl-2-pyrrolidone(NMP) N,N-dimethylacetamide(DMAc)
등의 용매는 Sigma-Aldrich사(Milwaukee, USA)로부터 구입하였으며, 황산, zinc chloride(ZnCl2),
sodium chloride, 그리고 trimethylamine 등은 Junsei(Japan)사로부터 구입하였다. 모든 시약들은 분석용 시약으로서 더 이상의 정제 없이
사용하였다. 탄소전극은 국내 Pureechem사로부터 구입하였다.
이온교환 고분자의 합성..13-16 양이온교환 고분자를 합성하기 위해 PEEK를 사용하였으며, 우선 수분을 제거하기 위해 하루 이상 진공오븐에서
건조시킨다. PEEK 15 g을 156 mL의 황산에 넣은 후 50 oC에서 활발하게 교반시키며 이때 질소 분위기 하에서 반응을 진행시킨다. 반응시간은 고분자의 설폰화도를 결정시키며,
요구된 반응시간이 지나면 반응 용액을 실온까지 낮춘다. 설폰화 반응된 SPEEK를 회수하기 위해 용액을 얼음물에 부은 다음 pH가 6이 될 때까지
초순수로 여러 번 세척한다. 탄소전극 위에 코팅하기 위해 130 oC의 진공오븐에서
완전히 건조된 SPEEK는 NMP에 11 wt% 농도로 제조하여 코팅용액으로 사용하였다.
음이온교환 고분자인 aminated PSf(A-PSf)을 합성하기
위해 용매 DCE에 PSf 8 wt%의 용액을 제조하고 40 oC의 온도에서 촉매제인 SnCl2를 첨가하였다. CMEE를 이용하여 클로로메틸화 반응을
4시간 동안 진행시키고 반응시킨 용액을 메탄올로 수차례 세척하여 반응을 종결시킨다. 고화된 고분자를 70 oC의 진공오븐에서 하루 정도 충분히 건조시킨 뒤 DMAc에 8 wt%로 녹여 만든 용액에 CMME와 같은 몰 비로
TMA를 첨가하여 음이온교환 고분자 용액을 제조하였다.
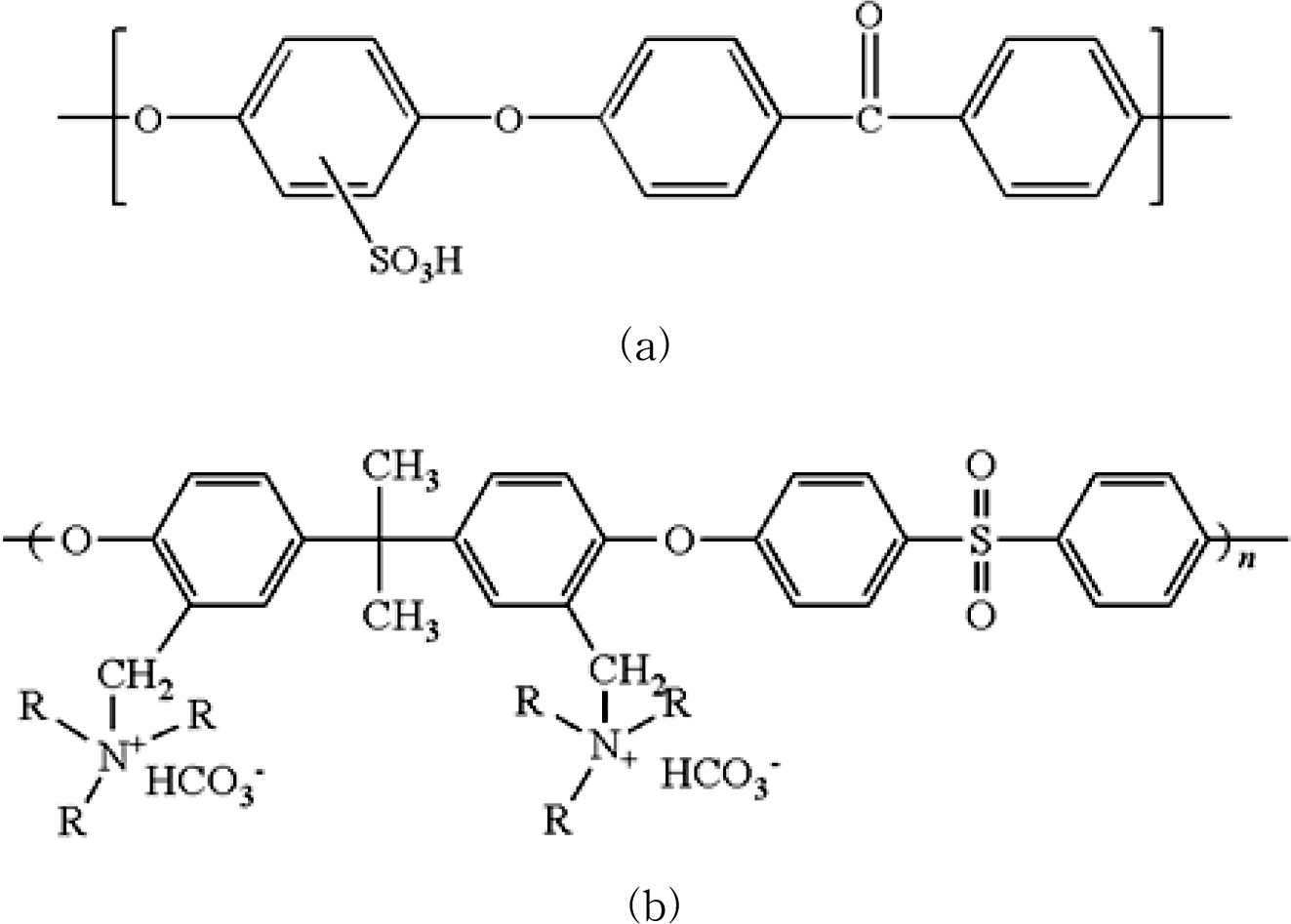
SPEEK 양이온
및 APSf 음이온 고분자의 화학 구조식을 Figure 1에 나타내었다.
이온교환용량(Ion Exchange Capacity, IEC). -RSO3- 작용기를 가진 양이온교환 고분자와 -R4N+ 작용기를 가진 음이온교환 고분자는 NaCl이나 HCl 용액을 이용한 적정법으로 측정하였다. 우선 합성된 양이온교환 고분자는 막 형태로 만들어 0.5×0.5 cm 이하의 크기로 잘게 만든 후 NaCl 용액에 하루 이상
침적하여 -SO3Na+의 형태로 존재하도록 한다. 이 용액에 페놀프탈레인을 떨어뜨려 적색을 띠도록 한 후에
다시 HCl 용액을 천천히 떨어뜨려
용액이 투명하게 변하는 종말점까지 적정을 한다. 이로부터 이온교환용량(IEC) 산출식 (1)을 이용하여 계산하였다.
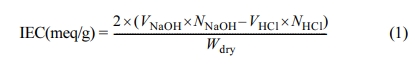
음이온교환 고분자 막의 경우 양이온교환막과 같이 0.5×0.5 cm로 만들어 NaCl 용액에 하루 이상 침적시키고 막을 초순수로 수차례 세척한다.
세척한 막을 다시 NaNO3 용액에 충분히 침적하여 염화이온과 질산이온이 서로 치환되도록
한다. 중크롬산칼륨을 지시약으로 사용하였으며 지시약을 떨어뜨려 노랗게 변한 용액에 AgNO3 용액을 이용하여 적정을 하고 종말점인 적갈색으로 변할
때까지 진행한다. 이온교환용량은 식 (2)를 이용하여 계산하였다.
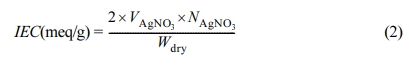
여기서, Wdry는 건조된 막의 무게, V는 적정용액의
부피, N은 적정에 사용된 용액의 농도를 나타낸다.
팽윤도(Swelling Degree). 합성된 각각의 이온교환 고분자는 필름 형태로 만든 후
상온에서 초순수에 하루 이상 침적한다. 필름 표면의 과량의 물을 제거한 후 팽윤된 필름에 대하여 측정된 무게가 ±2~3% 내에 드는 적어도 10개 이상의 측정값을 채택하여 평균값을 계산하였다. 60 oC 진공건조기에서 3일 이상 건조된 막의 무게를 측정하여 식 (3)으로부터 팽윤도값을 계산하였다.
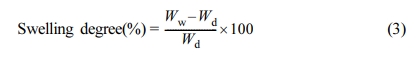
여기서, Ww는 물에 팽윤된 필름의 무게이며 Wd는 건조된 필름의 무게이다.
필름의 표면 및 단면분석. 탄소전극과 이온교환 고분자가 코팅된 탄소전극의 표면과
단면에 대해 전계방사 주사전자현미경(field emission-scanning electron microscope, FE-SEM,
Hitachi S-4800, Tokyo, Japan)을 이용하여 측정하였다.
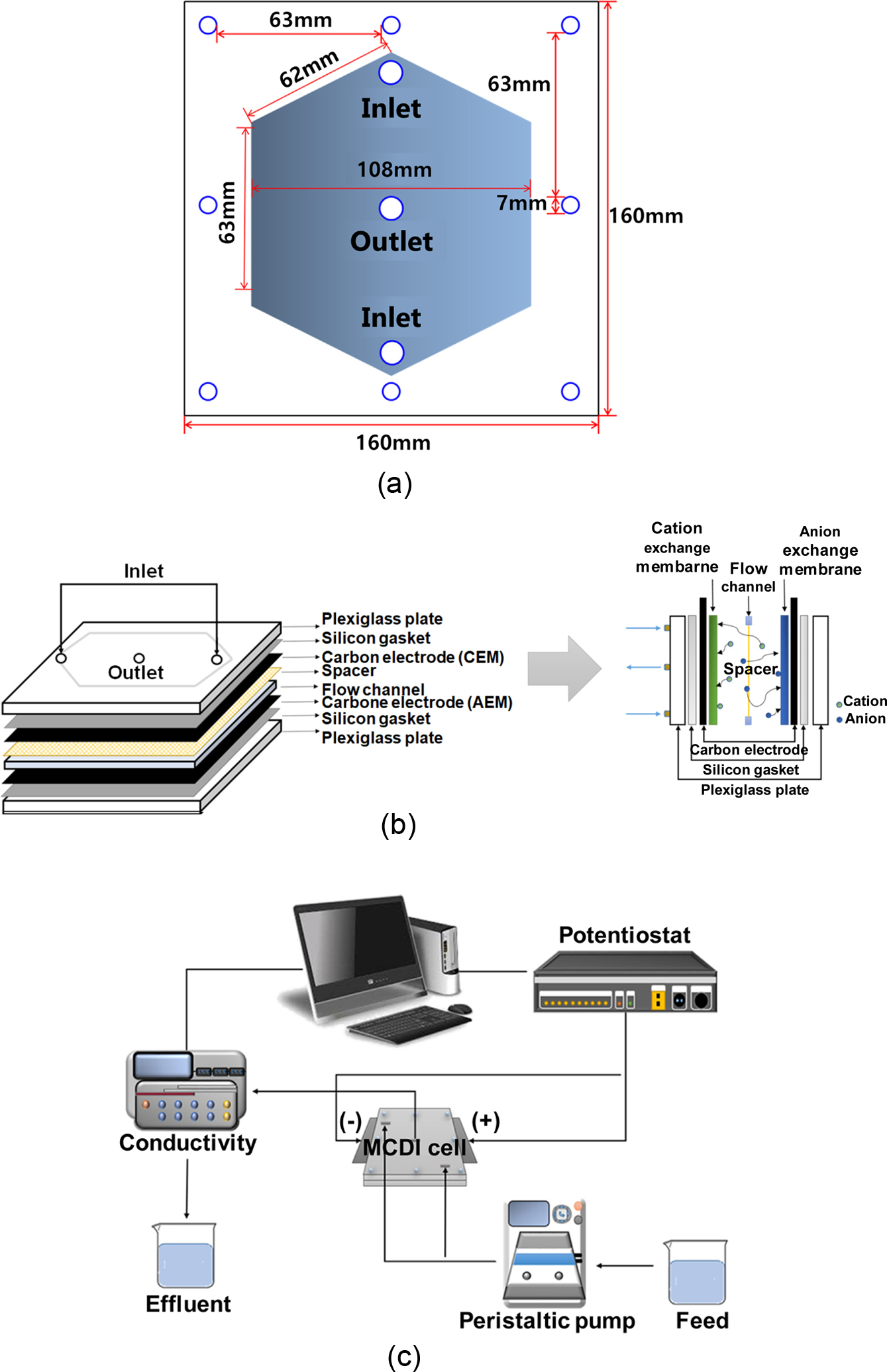
축전식 탈염공정에서의 탈착 실험. 축전식 탈염공정 실험에서 사용된 셀은 Figure
2(a)에서 보여주듯이 정육각형 셀을 이용하였다. 이 셀은 100 ppm의 염수에 대하여 적절한 흡·탈착 조건에서 염제거효율이 100%를 보여주었으며 셀의
막 유효면적은 100 cm2이었다.12 셀의 내부 구성도와 공정의 모식도를 각각 Figure 2(b)와 2(c)에 나타내었다. 실험에 사용된
원액은 100 ppm NaCl 수용액이었으며 모든
실험에 15 mL/min의 유속으로
셀로 공급하였다. 흡착조건은 흡착전위 1.2 V로 고정하였으며 흡착이 완전히 될 때까지 즉 배출수의
농도가 일정하여 30분간 농도가 변하지 않을 때까지 흡착을 진행하였다. 이때 원액은 초순수로 바꾸어주어 탈착실험을 진행하였는데 탈착전위인 -0.3,
-0.5, -1.0 V에 대하여 배출수의
농도를 시간에 대하여 TDS(total dissolved solid) 값이 0이 될 때까지 측정하였다. 이 실험을 코팅되지 않은 전극, 양이온
및 음이온 고분자가 각각 1회 코팅된 전극 그리고 2회 코팅된 전극에 대하여 실험을 수행하였다.
|
Figure 1 Chemical structure of (a) sulfonated poly(ether ether
ketone) (SPEEK); (b) aminated polysulfone (APSf). |
|
Figure 2 Schematic diagram of (a) cell configuration of hexagonal
flow channel type; (b) CDI cell configuration; (c) experimental
apparatus. |
전극의 표면 및 단면 분석. 이온교환 고분자가 탄소전극 위에 코팅된 모습과 단면의
코팅두께 등을 관찰하기 위해 SEM을 이용하여 분석한 결과를 Figure 3에 나타내었다. 코팅된 표면은 모두 매끄러워 코팅이 잘 된 것으로 확인된다.
단면의 경우도 일률적으로 비슷한 두께로 코팅된 모습을 보여주고 있다. 코팅두께는 시료표면에서 다섯 군데를 임의로 선정하여 측정된 두께로부터 평균하여
사용하였다. 1회 코팅한 경우 코팅 두께는 7.28~7.41 μm로 양이온이든 음이온 고분자이든 비교적 균일하게 코팅되어
코팅두께로부터의 실험오차는 크게 없는 것으로 간주하였다. 2회 코팅의 경우는 두께가 12.0~12.8 μm을 나타내고 있어 1회 코팅과 유사한 경향을 나타내고 있다.
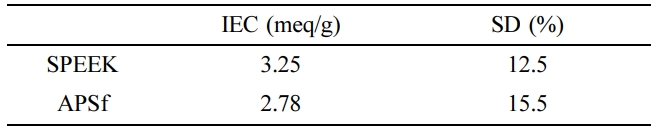
이온교환용량 및 팽윤도. 합성된 양이온 및 음이온교환 고분자의 이온교황용량과 팽윤도
측정 결과를 Table 1에 나타내었다. 이온교환용량은 막축전식 탈염공정에서 핵심 인자 중의 하나로 간주되는데 왜냐하면 이온교환용량은 원액 내에
있는 이온들이 얼마나 많이 이온교환 고분자 내에 이온결합을 통해 제거될 수 있느냐가 척도로서 간주될 수 있기 때문이다. 따라서 이온교환용량이 가능한
한 크면 좋겠지만 이 값이 클 경우 친수화도가 커져 팽윤도에 영향을 미친다. 팽윤도가 커지면 탄소전극 위에 코팅되어진 고분자의 치수가 커져 박리될
가능성이 있어 셀 내에서 원액의 흐름을 방해하여 염제거효율을 떨어뜨릴 수 있다. 따라서 이온교환용량과 팽윤도는 서로 상관관계를 가지므로 최적의
값을 지닐 수 있게 하는 것이 필요하다. 본 연구에서는 Table 1에 정리한 값을 얻을 수 있었는데 이온교환용량 측면에서는 SPEEK가 더 선호되지만
크지 않은 범위 내에서 팽윤도는 APSf가 더 유리할 수 있다.
축전식 탈염공정의 탈염 실험. 축전식 탈염공정에서 염제거효율에 영향을 미치는 공정
인자는 흡착 공정과 탈착 공정에서의 시간과 전위이다. 흡착 공정에서 염제거효율에 영향을 미치는 흡착전위 등의 조건에 대해서 이미 알아보았다.13
탈착 공정에서 염제거 효율에 영향을 미치는 인자로서는 크게 두 가지로 나눌 수 있는데 탈착전위와 막축전식 탈염공정에서는 코팅된 이온교환 고분자의
두께가 될 것이다. 따라서 이들의 영향을 알아보기 위해 우선 이온교환 고분자가 코팅이 되어 있건 또는 아니건 탄소전극에 어떤 흡착조건에서든지 염이
최대로 흡착되어 있는 상태에서 탈착실험을 변수별로 실험을 진행해야 한다.
흡착전위는 축전식
탈염공정에서 전위가 높을수록 흡착효율이 커져 탈염효율이 증가하는 것은 일반적이지만 보통 1.5 V 이상의 전위를 가하면 물의 전기분해로 탈염효율에 부정적인
영향을 끼칠 수 있다. 이 경우 물의 산화반응은 기공 구조를 변화시켜 기공 부피가 감소되며 전극의 노화를 발생시키고 원하지 않는 부산물의 생성으로
인해 탈염의 성능 저하를 가져온다.17-20 이러한 부분은 현재도 연구가 계속적으로 진행 중에 있다. 따라서 본 연구에서는
물 분해 전위가 1.5 V 이하인 1.2 V에서 실험을 수행하였다.
이 흡착전위 하에서 배출수 농도가 일정해질 때까지 흡착을 이온교환 고분자가 코팅되지 않은 전극과 1회 및 2회 코팅한 전극에 대해 진행하였다.
완전히 흡착된 후 100 ppm NaCl 공급액을 초순수로
바꿔 공정 내에 공급액을 완전히 제거하였다.
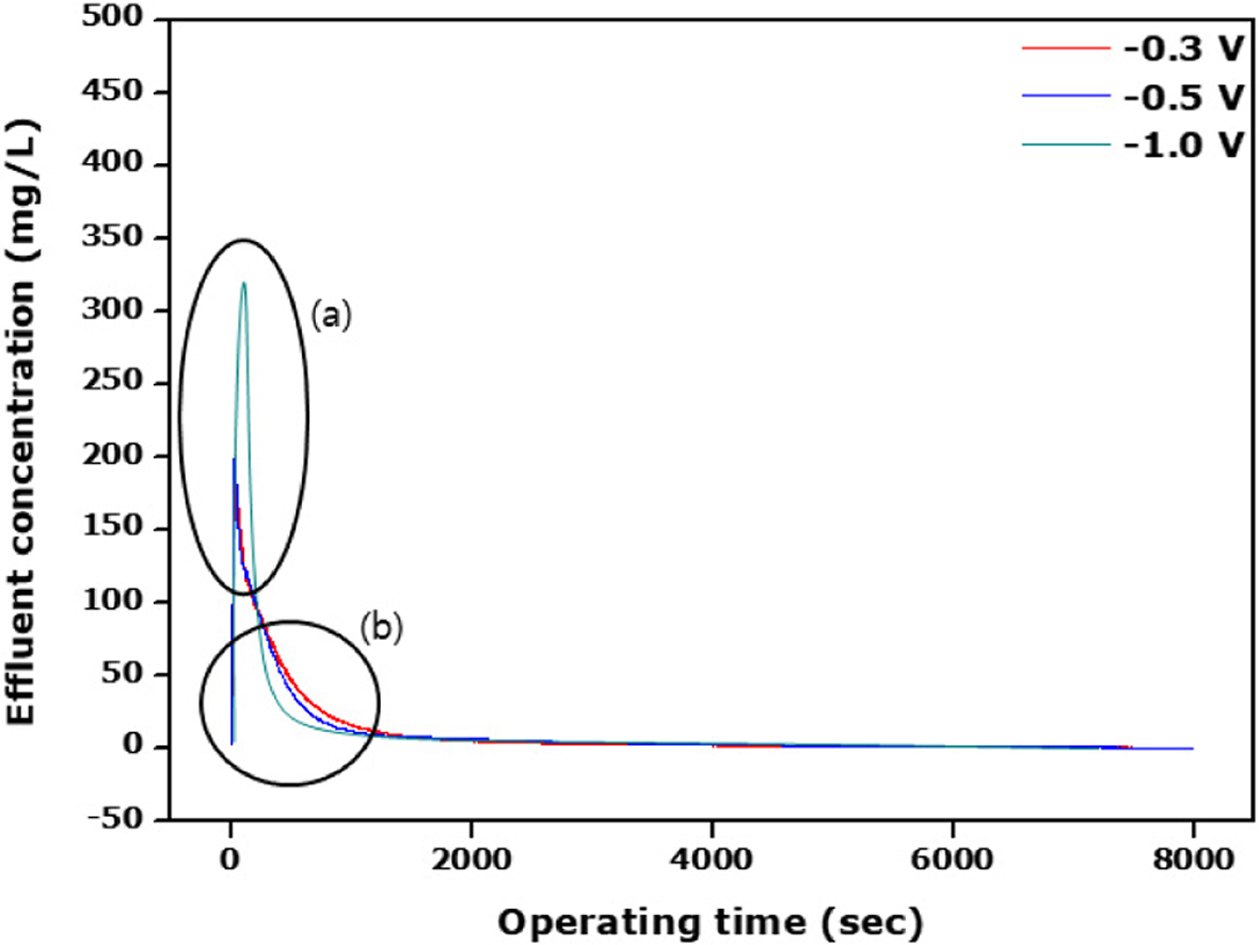
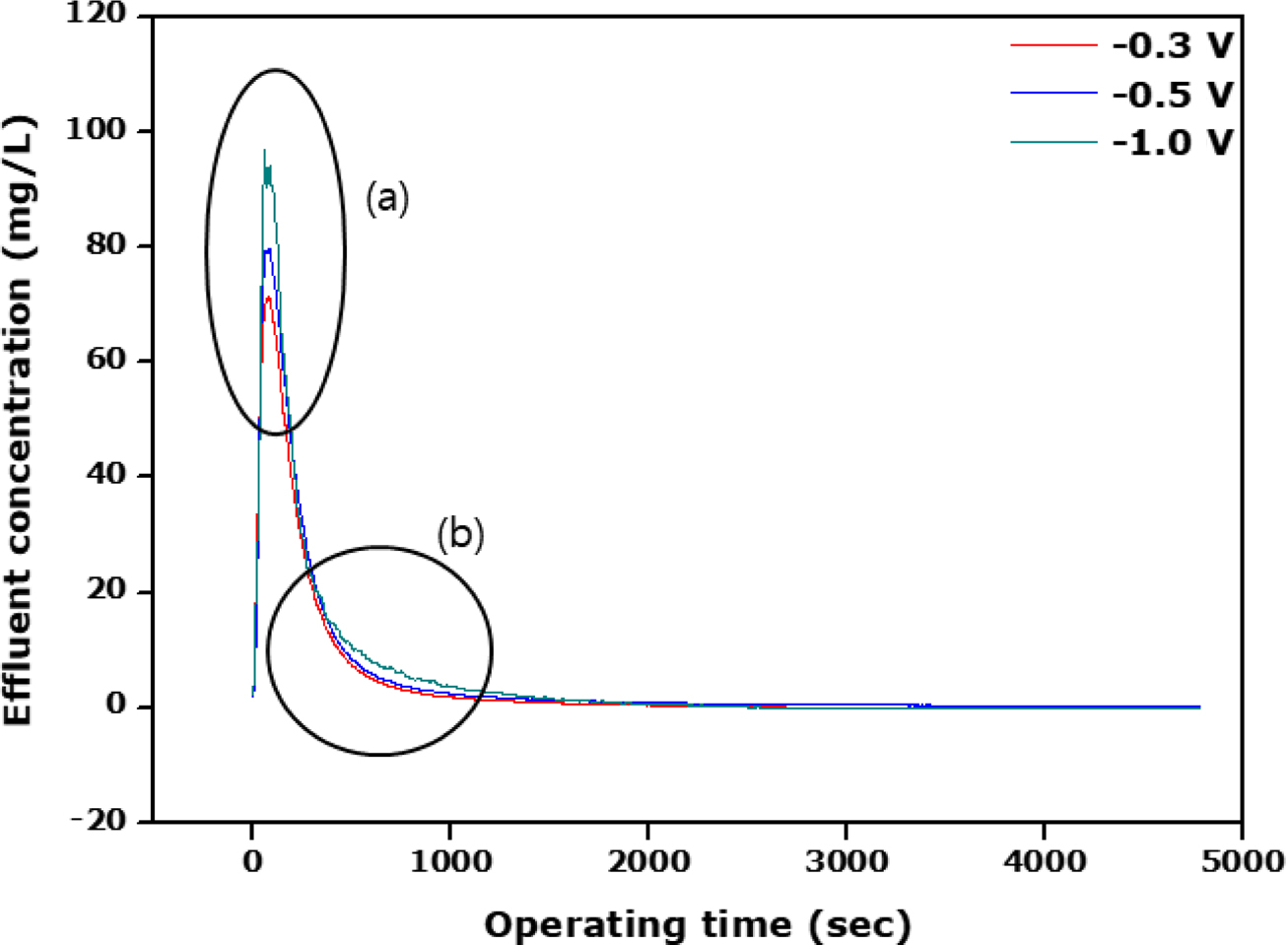
Figure 4는
이온교환 고분자가 코팅되어 있지 않은 탄소전극에 대한 탈착전위에 따른 탈착실험 결과를 시간에 대한 배출수 농도로 나타내었다. 탈착전위가 가해지면
흡착되었던 공급수의 염이 즉시 탈착되어 초기에 가장 높은 최대 염농도를 나타내게 되는데 탈착전위가 클수록 이의 농도 또한 커지게 된다. 따라서 Figure 4(a)
부분에서 보듯이 예상했던 대로 -1.0, -0.5, -0.3 V의 순서로 배출수
농도가 낮아지는 경향을 볼 수 있다. 그러나 특이한 점은 Figure 4(b) 부분으로 탈착전위가 크면 탄소전극에 흡착되었던 염이 모두 더 일찍
떨어져 배출수의 농도가 0으로 도달하는 시간이 짧아질 것으로 예상했으나 Figure 4에서 보듯이 우선 배출수 농도가 탈착전위가 큰 경우 탈착시간이
길어져도 더 큰 것을 보여주고 있다. 이는 아마 탈착전위가 크면 탄소전극의 기공 내에 흡착되어 있는 가능한 한 모든 염분자를 탈착시켜 탈착시간이
길어져도 탈착전위가 낮은 경우보다 배출수 농도가 높은 것이 아닌가 사료된다. 다시 말해 낮은 탈착전위에서는 기공 내에 흡착되어 있는 모든 염분자들의
탈착을 효율적으로 탈착시키지 못한다는 말이 된다. 따라서 탈착전위에 따라 배출수의 농도가 0이 되는 시간에 대해 관찰한다면 탈착전위가 낮은 -0.3 V에서 가장 빨리 도달하는 것을 볼 수 있다. 반면에,
탈착전위가 가장 높은 -1.0 V에서 가장 늦게 도달하는 것을 알 수 있다. 이는 앞에서도 설명한 것에 기인하며, 따라서 -0.3 V의 경우에서 염이온 분자가 전극의 기공 내에 상당한
양이 아직 흡착되어 있는 상태라고 볼 수 있다.
이와 같이 축전식
탈염공정에서 일어나는 전극에서의 불완전한 재생의 구조적 문제인, 즉 완전 탈착이 아닌 불완전 탈착 후 흡착공정으로 전환되어 결국 시간이 지남에
따라 전극의 흡착 능력을 감소시키게 되며 이는 운전 효율과 에너지 소비의 증가를 낳게 된다. 따라서 이러한 축전식 탈염공정에서의 단점을 극복하기
위해 막결합형 축전식 탈염공정이 소개되었으며 본 연구에서는 셀의 양이온 쪽에 APSf를 그리고 음이온 쪽에 SPEEK를 코팅하여 탈착전위와 시간에
따른 염의 전극으로부터의 탈착 형태를 알아보았다.
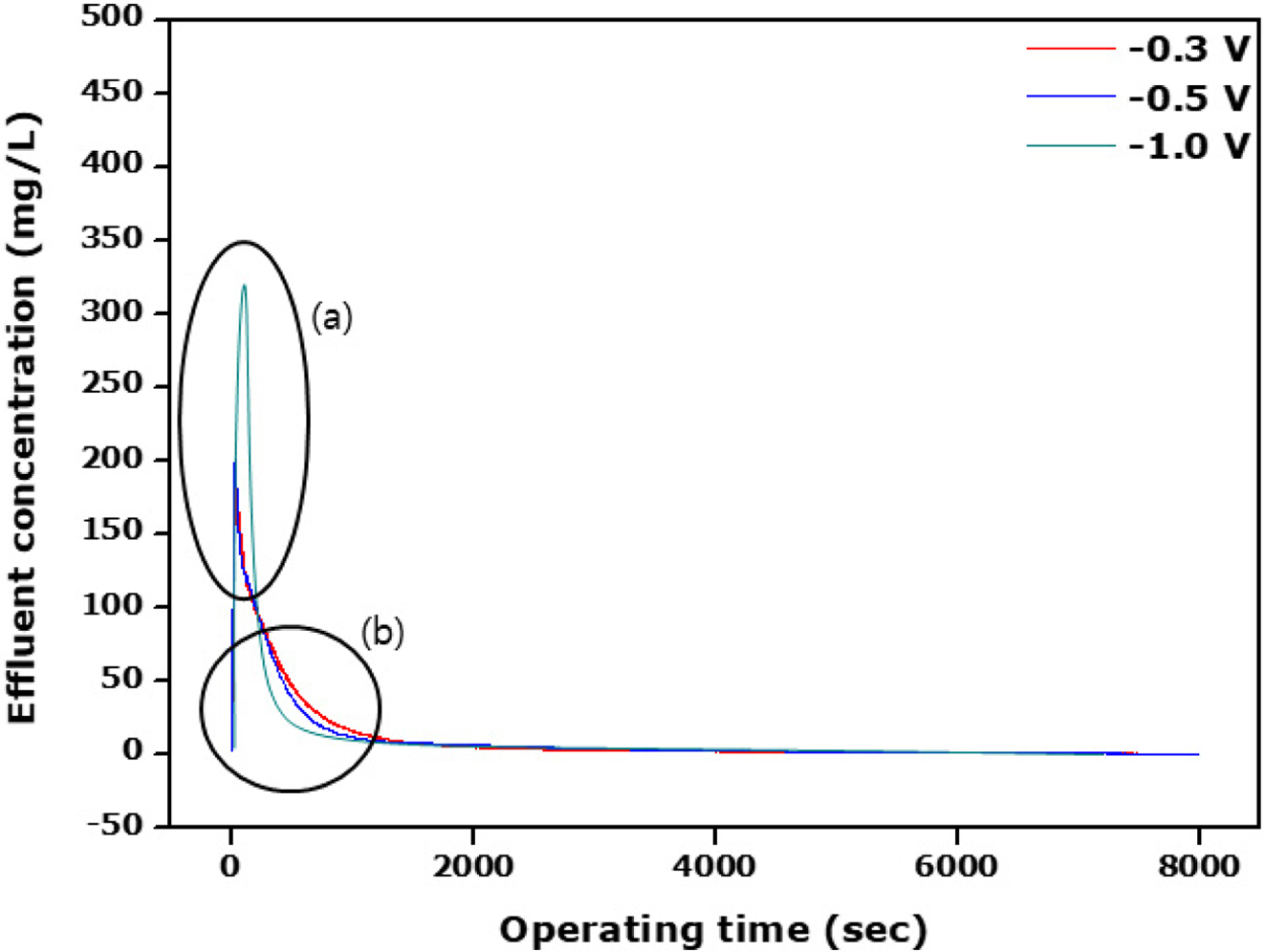
Figure 5는
방금 언급한 대로 전극 표면과 막 간의 저항을 최소화하기 위해 전극표면에 SPEEK와 APSf를 1회 코팅하여 탈착 현상을 알아보았다. 우선 전체
탈착전위 범위에서 축전식 탈염공정에 비해 배출수 농도가 현저히 높음을 알 수 있다. 본 연구에서 사용되는 탄소전극은 전극과 전해질 계면 부근의
전기이중층에서 정전기적 인력에 의하여 물리적 흡착과 탈착에 의해 에너지를 저장 및 공급하는 전기화학적 장치가 될 수 있다.21
또한 이는 전하를 인가했을 때 가해지는 전위로 인해 흡착되는 양이 극대화될 수 있으나 탄소전극의 낮은 에너지밀도로 인하여 그 양은 제한적일 수
밖에 없다. 따라서 이를 극복하기 위해 이온교환 고분자를 양이온 및 음이온 탄소전극 표면에 코팅하였다. 이에 대한 흡착 실험 결과는 선행 논문에서
조사하였다. 코팅횟수에 따라 코팅 두께가 증가함에 따라 막을 통과하는 이온들의 움직임이 원활하지 않아 탄소전극에 충분히 코팅되지 못하여 배출수의
농도의 최소점이 높아졌음을 알 수 있었다. 또한 최대 흡착까지 걸리는 시간이 1회 코팅에서 80분, 그리고 2, 3회 코팅에서 각각 174분,
242분으로 증가하는 경향을 보였으며 두께에 따른 최대 흡착 시까지 걸리는 시간은 선형으로 나타났었다. 이로부터 두께에 따른 흡착의 경우 이온고분자의
두께에 대한 특별한 선호가 없었다. 탈착전위에 대해서 전위가 커질수록 배출수 농도가 증가하는 경향을 나타내었는데 기존 탄소전극에서 배출되는 농도에
비해 월등히 큰 것을 보여주고 있다. 특이한 점은 Figure 5(b) 부분으로 이는 기존 탄소전극에서 보여주는 경향과 반대의 결과를 보여주고
있다. 탈착전위가 클수록 배출수 농도가 0으로 떨어지는 시간이 빨라지는 것을 보여주며 반대로 낮은 전위에서는 배출수 농도가 0으로 되는데 테일링이
길어지는 것을 나타내고 있다. Figure 4에서 보면 탈착전위가 -1.0 V에서 배출수 농도가 0이 되는 지점은 약 20여분이
지날 때임을 알 수 있다. 따라서 탈착공정에서 탈착전위는 일단 큰 것이 유리한 것을 알 수 있다.
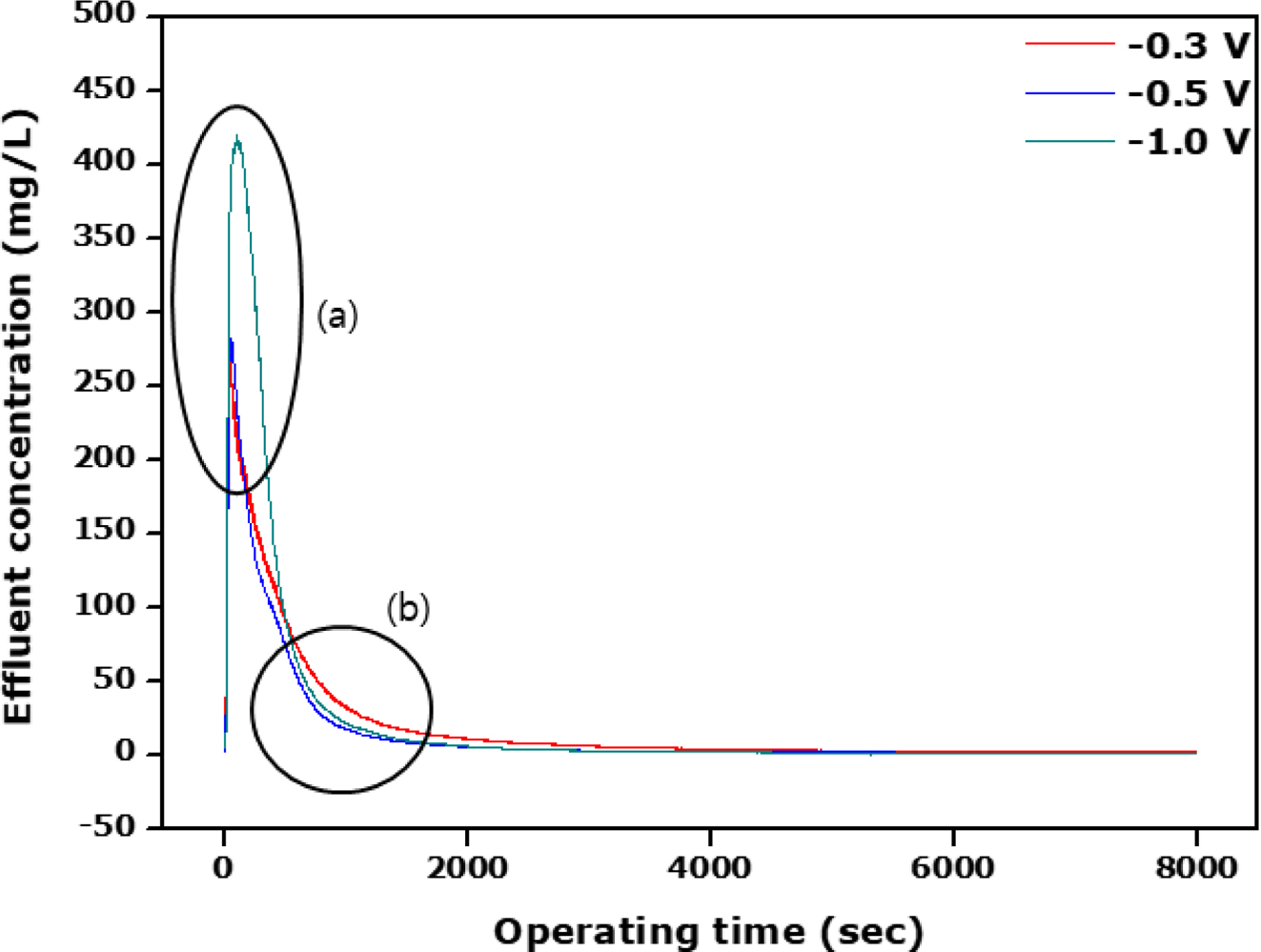
2회 코팅한 탄소전극에
대한 탈착실험 결과를 Figure 6에 나타내었다. 2회 코팅한 이온교환 고분자의 두께는 12.0~ 12.8 μm로서 1회 코팅한 7.28~7.41 μm보다 약 4.5 μm 정도 더 두꺼운 것을 Figure 3에서 보여주고 있다. 탈착실험을 하기 위해 우선 흡착실험을 해야 하는데 더 이상 흡착이 일어나지
않는 최대 흡착이 이루어질 때까지 진행해야 하는 것을 앞의 실험 방법에서 설명하였다. 이 경우 이온교환 고분자에 흡착된 이온들은 수용액 내에 있는
Na+과 Cl-인데 여기서 양이온교환 고분자의 -SO3-H+는 -SO3-Na+ 형태가 된다. 폴리아크릴산의 기능성기인 -COOH에 대한 물의 팽윤도(mol/mol)는 0.7인 반면에 -COONa에 대한 팽윤도는 4.2로 급격하게 늘어나는 것이 일찍이
보고되었다.22 이 결과는 탄소전극 위에 코팅된 이온교환 고분자가 염용액에 있을 경우 코팅된 고분자의 팽윤도가 크게 증가할
것으로 예상할 수 있다. 큰 값의 팽윤도는 Na+이 코팅된 막 내로 더욱 깊이 자유롭게 확산하여 침투할
수 있다는 것을 의미한다. 따라서 Figure 6(a)에서 볼 수 있듯이 탈착했을 때의 배출수 농도는 1회 코팅했을 경우보다 크게 증가한 것을
보여주고 있다. 결국 원액 내에 있는 염 성분을 제거하기 위해서 코팅된 이온교환 고분자의 두께가 두꺼울수록 이롭다는 것을 알 수 있다. 이는 실험에
사용된 전 전위범위 내에서 같은 경향을 보여주고 있다. 그리고 배출수 용액의 농도가 0이 되는 지점은 앞의 1회 코팅했을 경우보다 시간이 더 경과한
지점에서 일어나는 것을 Figure 6(b)로부터 알 수 있다. 이를 짧게 할수 있는 방법은 인가되는 전위의 크기를 더 세게하면 될 것으로
Figure 6의 결과는 나타내고 있다.

|
Figure 3 SEM photographs of (a) and (b) for the surface and cross-section of the pristine carbon electrode; (b) for the surface of the coated
carbon electrode; (c) for the surface of the carbon electrode coated with SPEEK; (d) for the cross-section of the carbon electrode with the
single coating of the SPEEK; (e) for the cross-section of the carbon electrode with the double single coating of the SPEEK; (f) for the surface
of the carbon electrode coated with APSf; (g) for the cross-section of the carbon electrode with the single coating of the APSf; (h) for the
cross-section of the carbon electrode with the double single coating of the APSf. |
|
Figure 4 Effluent concentration against the operating time in
accrodance with the desorption potential. |
|
Figure 5 Effluent concentration against the operating time in
accrordance with the desorption potential for the single coated carbon electrode. |
|
Figure 6 Effluent concentration against the operating time in
accrordance with the desorption potential for the double coated carbon electrode |
|
Table 1 Basic Properties of Synthesized Ion Exchange Polymers
for MCDI Application |
설폰화된 폴리(이서
이서 케톤)을 양이온 고분자로 그리고 아민화된 폴리설폰을 음이온 고분자로 사용하여 상용화된 탄소전극 위에 1회 및 2회 코팅을 하여 코팅층의 두께를
달리하였다. 두께가 다른 탄소전극의 탈착 성능을 알아보기 위해 0.3, 0.5 그리고 1.0 V의 역전위를 인가하여 실험한 결과 다음의 결론을 도출할
수 있었다.
(1) 코팅되지 않은
탄소전극에서 전위를 인가했을 때 가장 낮은 전위인 -0.3 V에서 배출수 농도가 0이 되는 시간이 가장 짧으며 반면에 높은 전위일수록 배출수 농도가 0이 되는 시간이
더 길었다. 이는 낮은 전위에서 전극의 기공 내에서 탈착하지 못하고 흡착되어 있던 염분자들이 높은 전위에서 탈착되는 것에 기인한다고 사료된다.
(2) 1회 및
2회 코팅된 전극에 대한 탈착실험에서 전위의 세기가 커짐에 따라 배출수 농도가 증가했으며, 코팅되지 않은 전극의 약 95 mg/L로부터 2회
코팅했을 때의 약 420 mg/L의 농도값을
보여주었다.
(3) 탈착전위가
클수록 배출수 농도가 0으로 떨어지는 시간이 짧아지는 것을 보여주어 탈착공정에서의 탈착전위는 큰 것이 유리함을 알 수 있었다.
(4) 코팅 두께가
두꺼워짐에 따라 배출수 농도가 0이 되는 지점은 두께가 얇은 경우보다 시간이 더 경과한 지점에서 일어나는 것을 알 수 있었다. 또한 이온작용기의
염으로의 치환은 팽윤도를 더 크게히여 염분자들이 내부로 더 확산 침투할 수 있어 배출수 농도가 커져 탈착공정만을 고려할 경우 막의 두께가 두꺼운
것이 이로운 것을 알 수 있었다.
- 1. D. D. Caudle, J. H. Tucker, J. L. Cooper, B. B. Arnold, and A. Papastamataki, Electrochemical demineralization of water with carbon electrodes, Research Report, Oklahoma University Research Institute, 1966.
- 2. H. Li and L. Zou, Desalination, 275, 62 (2011).
-

- 3. J.-Y. Lee, S.-J. Seo, S.-H. Yun, and S.-H. Moon, Water Res., 45, 5375 (2011).
-

- 4. F. A. AlMarzooqi, A. A. Al Ghaferi, I. Saadat, and N. Hilal, Desalination, 342, 3 (2014).
-

- 5. Y.-J. Kim and J.-H. Choi, Sep. Purif. Technol., 71, 70 (2010).
-

- 6. J.-B. Lee, K.-K. Park, H.-M. Eum, and C.-W. Lee, Desalination, 196, 125 (2006).
-

- 7. P. M. Biesheuvel and A. van der Wal, J. Membr. Sci., 346, 256 (2010).
- 8. R. Zhao, O. Satpradit, H. H. M. Rijnaarts, P. M. Biesheuvel, and A. van der Wal, Water Res., 47, 1941 (2013).
-

- 9. J.-S. Kim and J.-H. Choi, J. Membr. Sci., 355, 85 (2010).
-

- 10. J. S. Kim, C. S. Kim, H. S. Shin, and J. W. Rhim, Macromol. Res., 23, 360 (2015).
-

- 11. J. S. Kim, Y. S. Jeon, and J. W. Rhim, Sep. Purif. Tech., 157, 45 (2016).
-

- 12. Y. S. Jeon, S. I. Cheong, and J. W. Rhim, Macromol. Res., 25, 712 (2017).
-

- 13. W. S. Yun, S. B. Lim, and J. W. Rhim, Polym. Korea, 42, 1014 (2018).
- 14. G. Y. Moon and J. W. Rhim, Macromol. Res., 15, 379 (2007).
-

- 15. E. N. Komkova, D. F. Stamatialis, H. Strathmann, and M. Wessling, J. Membr. Sci., 244, 25 (2004).
-

- 16. M. R. Moghbeli, A. Khajeh, and M. Alikhani, Chem. Eng. J., 309, 552 (2017).
-

- 17. X. Gao, A. Omosebi, J. Landon, and K. Liu, J. Electrochem. Soc., 161, 159 (2014).
-

- 18. S. Porada, L. Borchardt, M. Oschatz, M. Bryjak, J. S. Atchison, K. J. Keesman, S. Kaskel, P. M. Biesheuvel, and V. Presser, Energy Environ. Sci., 6, 3700 (2013).
- 19. E. Bayram and E. Ayranci, Electrochim. Acta, 56, 2184 (2011).
-

- 20. I. Cohen, E. Avraham, Y. Bouhadana, A. Soffer, and D. Aurbach, Electrochim. Acta, 153, 106 (2015).
-

- 21. M.-H. Kim and K. C. Roh, Polym. Sci. Tech., 28, 3 (2017).
- 22. S. I. Semenova, H. Ohya, and K. Soontarapa, Desalination, 110, 251 (1997).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(5): 618-624
Published online Sep 25, 2020
- 10.7317/pk.2020.44.5.618
- Received on Mar 23, 2020
- Revised on Apr 14, 2020
- Accepted on Apr 14, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Ji Won Rhim
-
Department of Chemical Engineering, Hannam University, 1646 Yuseongdae-ro, Yuseong-gu, Daejeon 34054, Korea
- E-mail: jwrhim@hnu.kr
- ORCID:
0000-0001-7803-2959










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.