- Controlled Crystalline Structures of Nafion-Polyvinylidene Fluoride Blends for Proton Exchange Membranes
Department of Advanced Materials, Hannam University, 1646 Yuseong-daero, Yuseong-gu, Daejeon 34054, Korea
- 수소 이온 교환막 적용을 위한 나피온-폴리불화비닐리덴플로라이드 블렌드의 결정 구조 제어
한남대학교 신소재공학과
We present a controlled
nanostructure of a proton conducting membrane, Nafion, by introducing a blend
with a ferroelectric semi-crystalline polymer, polyvinylidene fluoride (PVDF).
Phase transition between a and γ phases of PVDF attributes the molecular structure of
the blend membranes and their hydrophilic ionic channels by a strong hydrogen
bonding between two polymers. The nanostructure of the membrane was
investigated by atomic force microscopy and small angle X-ray scattering.
Consequently, the controlled nanostructure of the blend membrane with a
blending ratio of 9:1 for Nafion: γ-PVDF allows enhanced proton
conduction and increased physical stability for water swelling.
전해질 고분자의 효과적인 수소이온 전달을 위해 대표적인
불소계 전해질 고분자 Nafion과 반결정성 강유전 고분자
polyvinylidene fluoride(PVDF)를 혼합하여 블렌드 전해질 막을 제조하였다.
Nafion과 PVDF 분자 사이의 수소결합을 통하여 블렌드 막의 친수성 수소 이온 전달
채널을 더욱 발달시킴과 동시에 PVDF가 가지는 상 변화 현상을 활용하여, a 및 γ 상 각각 경우에 대해 블렌드 막이 가지는 나노 구조와 막 물성
및 수소 이온 전도도의 상관관계를 파악하였다. 전해질 고분자의 나노 구조는 각각 atomic force microscopy과 small angle X-ray
scattering를 통해 확인하였다. 최종적으로,
Nafion-PVDF가 9:1의 혼합비율을 가지는 경우, PVDF가 γ 상을 형성하였을 때, 증가된 이온전도도와 습윤팽창에 대한
안정성을 갖는 것을 확인하였다.
Proton exchange membranes with Nafion-polyvinylidene
fluoride (PVDF) blends are developed with their controlled molecular
structures. Semi-crystalline PVDF represents a phase transition between a and γ crystals with
different dipole behaviors via thermal annealing. The blend membranes show
increased mechanical stabilities for water absorption and decreased proton
conductivities due to their reduced ion exchange capacity from containing PVDF.
However, γ-phase
PVDF arises a developed nanostructure of the membrane, consequently shows
higher proton conductivity than the blend membrane with a-phase PVDF.
Keywords: polymer electrolyte membrane, Nafion, polyvinylidene fluoride, polymer blend, fuel cell
이 성과는 정부(과학기술정보통신부)의
재원으로 한국연구재단의 이공분야기초연구사업(NRF-2019R1G1A 1003894) 및 나노·소재기술개발사업(2009-0082580)의 지원을 받아 수행된 연구이며
이에 감사를 드립니다.
고분자 전해질 연료전지(PEMFC;
proton exchange
membrane fuel cell)는 친환경 기술을 활용한 안정적인 에너지 전환과 높은 전력생산, 저온운전 등의 장점으로 수송용 및 발전용 응용분야에 걸쳐 매우 주목받는 신재생 에너지 중 하나로 여겨지고 있다.1-3
특히 연료전지를 구성하는 핵심 소재인 전해질 고분자로 구성된 수소 이온 교환막(PEM; proton exchange membrane)은 물 및
수소 이온을 전달함과 동시에 수소 및 산소와 같은 반응 가스를 막아주는 선택적 수소 이온 투과막으로서 매우 중요한 역할을 수행한다. 현재까지
미국 Dupont사의 Nafion이 가장 높은 이온 전도도와 물리/화학적 안정성을 가지는 연료전지용 전해질 막으로 사용되고 있다. Nafion은
주사슬(main chain)의 불소 원자와 곁사슬(side chain)의 술폰산 그룹(sulfonic acid group)이 서로 상 분리되어
각각 전해질 막의 물리적 안정성과 물 및 수소 이온을 전달하게 하는 채널을 형성하는 역할을 한다. 이러한 Nafion의 상 분리에 따른 구조적
안정성에 의해 현재까지 가장 유용한 연료전지용 전해질 고분자로 적극 활용되고 있다.4
그럼에도 불구하고,
수송용 연료전지 분야에 적용되기 위해서는 고분자 전해질 막의 이온 전도도와 가습조건에 따른 습윤 팽창률이 연료전지의 전력 생산 및 무게 그리고
기계적 내구성 측면에서 필수적으로 개선되어야 한다. 현재까지 Nafion 전해질 막은 이온 전도도를 향상시키기 위해 두께를 매우 얇게 조절하는
연구가 진행되어 왔다.5-7 하지만, 이와 같은 경우, 얇아진 전해질 막의 두께로 인해 가습조건의 변화에 따른
전해질 막의 습윤 및 건조에 따라 각각 야기되는 팽창 및 수축의 차이로 인해 기계적 물성이 약화되어 물리적 파단이 일어나는 경우가 보고되었다.
이를 극복하기 위하여 많은 연구진들이 polytetrafluoroethylene(PTFE) 다공성 기재에 Nafion을 함침하여 복합막을 형성하는
방법을 제안하였다.8-11 하지만, 다공성 기재를 이용한 복합막 제조에는 PTFE 기재와
Nafion과의 계면접합 문제, 복잡한 제조공정과 높은 가격 등의 문제를 여전히 해결해야 한다.7-12
한편, Nafion의
물리적 안정성, 가스 투과 방지를 향상시키기 위해 대표적인 반결정성 강유전(semi-crystalline ferroelectric) 고분자 polyvinylidene
fluoride(PVDF)를 도입한 연구 결과들이 보고되었다. Nafion과 PVDF 및 중합체를 혼합하여 직접 메탄올 연료전지(DMFC;
direct methanol fuel cell)의 메탄올 막 투과를 방지하는 연구 결과가 보고되었으며, Nafion-PVDF를 이용하여 전기방사
섬유 형태로 막을 형성한 연구도 진행되었다.13-17 하지만, 위의 연구들은 PVDF가 가지는 소수성 및 반결정성 특징을
활용하여 기존의 Nafion 기반의 전해질 막의 물리적 물성을 향상시키기 위한 목적으로 수행된 연구이며, 이온 전달 능력이 없는 PVDF가 도입됨으로써
감소되는 이온 전도도의 한계를 나타내었다.
본 연구에서는
PVDF의 결정 구조에 따른 고유한 분극 특성을 활용하여 Nafion의 이온 전도도와 물리적 안정성을 향상시키고자 한다. PVDF는 불소와 수소를 포함하고 있는 분자구조를 바탕으로 분극(polarization)을
가지게 되고, 이는 소재의 압전
및 강유전 특성으로 활용되어 에너지 하베스팅, 캐패시터, 비휘발성 메모리 등 다양한 분야에 적용되고 있다.18-23 이러한 PVDF의 분극 현상은 고분자의 결정 구조에 따라
그 정도가 매우 달라지며, a상 보다는 β 또는 γ 상에서 더욱 큰 분극을 나타낸다.18-21
Nafion과 PVDF가 혼합되어 블렌드 막을 형성하였을 때의 나노 구조와 막의 물성을 파악하고, 이에 따라 변화되는 이온전달 특성을 평가하였다.
특히, PVDF가 가지는 구조적 특징을 활용하여 각각 a 와 γ 상의 PVDF가 Nafion 및 수소 이온 전달에 미치는
효과를 확인하였다. 더불어, PDVF를 도입함에 따라 습윤 및 건조에 따른 전해질 막의 팽창 및 수축 정도를 제어하여, 향상된 물리적 안정성을
확보하였다.
Nafion-PVDF
전해질 막 제조. 21.1 wt%의 농도로 프로파놀(propanol)/물에 분산되어
있는 EW(equivalent weight) 1100 Nafion 분산액(D2021, Chemours)을 용매 증발 및 재용해를 통해
dimethylformamide(DMF) 용매로 용매 치환을 실시하였다. PVDF(MW 180000, Sigma-Aldrich)를 DMF에 녹여
10 wt%의 Nafion-PVDF 혼합 용액을 제조한다.
이 때의 혼합 비율은 Nafion:PVDF를 각각 10:0, 9:1, 7:3, 5:5, 0:10 으로 한다. 혼합 용액은
ultrasonication을 통해 30분간 처리하고, 90 oC에서 12시간 동안 stirring을 실시해준다. 유기 기판 위에 용액을
casting한 후, 각각 실험조건에 맞는 온도로 건조 및 열 처리를 하였다. 이 후, 전해질 막은 충분히 식힌 뒤, 유리 기판으로부터 떼어내
pre-standing 전해질 막을 얻어 평가를 실시하였다. 전해질 막의 두께는 마이크로미터(micrometer)로 측정하였으며, 50 mm의 두께로 제작하였다.
전해질 막 물성 및 화학적 평가. 전해질 막의 수분 흡수율(water uptake)과
습윤 팽창률(swelling ratio)을 측정하기 위하여, 막을 80 oC의 진공 오븐에서 24시간 건조한 후 막의 무게(Wdry)와 길이(Ldry)를
측정한다. 그 후, 해당 막을 초순수에 상온 조건에서 48시간 동안 담지시킨 후, 다시 꺼내어 즉시 표면의 물을 제거한 뒤, 곧바로 막의 무게(Wwet)와
길이(Lwet)를 측정한다. 최종적인 water uptake와 swelling ratio는 식 (1)과 (2)로
각각 계산한다.
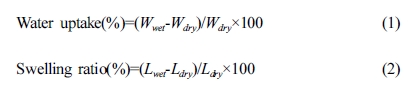
산-염기 적정을 통하여
이온교환용량(IEC; ion exchange capacity) 측정을 실시하였다. 전해질 막을 1 M NaCl 수용액에 24시간 동안 담지시켜 H+ 이온을 Na+
이온으로 치환한 후, 0.01 M NaOH 수용액을 이용해 교환된 H+
이온을 중화하며 적정하였다. 이 때, 페놀프탈레인(phenolphthalein) 지시약을 사용하여 적정점을 확인하였으며, 전해질 막의 IEC는
식 (3)으로 계산하였다.

이 때, V와
M은 각각 적정점까지 추가된 NaOH 수용액의 부피와 농도이다.
전해질 막의 구조 분석. 전해질 막의 화학적 구조 및 결합상태를
ATR-FTIR(Attenuated total reflectance-Fourier transfer infrared, Bruker)을 통하여 확인하였다.
또한 X-ray diffraction(XRD, Rigaku)과 small angle X-ray scattering (SAXS, Rigaku
D/max-2500)을 이용하여 전해질 막의 상 변화 및 상 분리 구조를 확인하였다. 이 때, SAXS는 CuKα X-ray source(λ=1.542 Å)를 이용하여 40 kV, 70 mA에서 작동하였다. 더불어, 비접촉(non-contact)
모드의 atomic force microscopy(AFM, Probes)을 이용하여 고분자의 표면 구조를 관찰하였다.
이온 전도도 측정. 전해질 막의 수소 이온 전도도를 four-probe
system으로 AC impedance spectroscopy method(Bio-Logics, SP-150)를 이용하여 측정하였다. 다양한 조건의
전해질 막을 1×4 cm2로 준비한 뒤, 4개의 백금(platinum)
전극 사이에 위치시켜 potentiostat 전기화학 분석 장치로부터 특정 전압을 인가하며 전류를 측정하였다. 온도는 70 oC를 유지하였으며, 100% 상대습도(RH; relative humidity)에서 식 (4)를 통해 이온 전도도(σ)를
계산하였다.

이 때, L은
두 개의 측정 전극 사이의 거리이며, R은 Nyquist impedance diagram에서 얻어지는 저항을 나타낸다. S는 전해질
막의 단면적으로 계산된다.
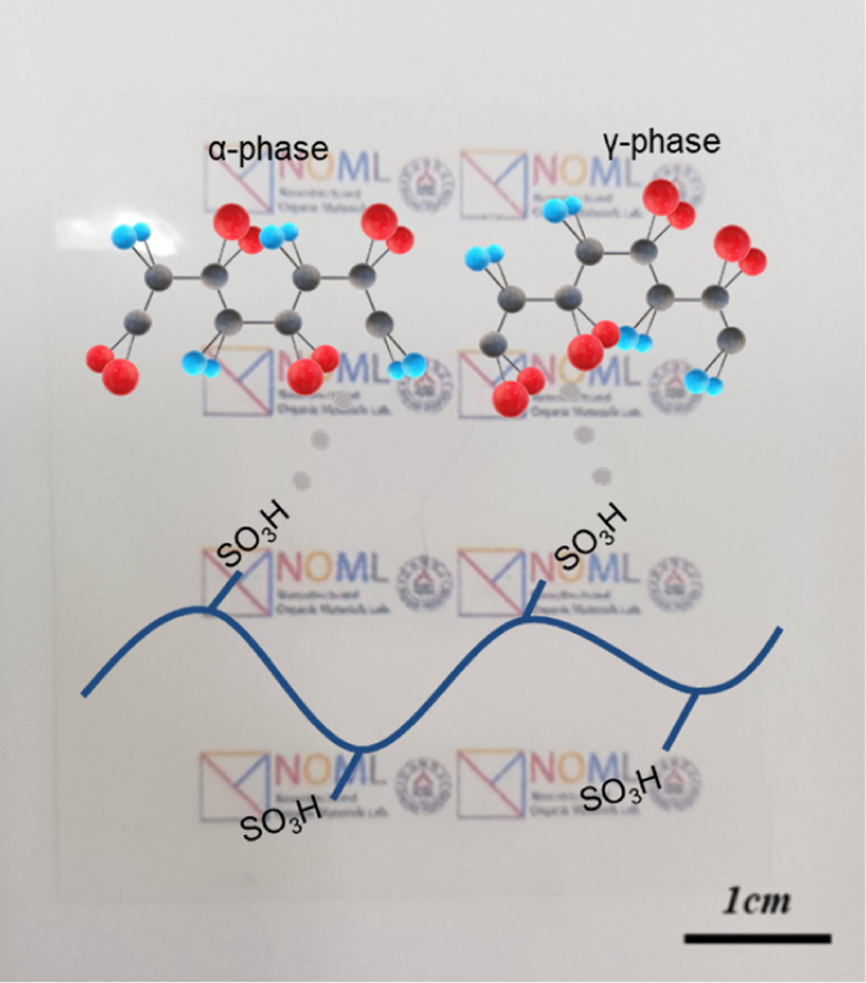
Figure
1(a)에서 나타낸 것과 같이, Nafion과 PVDF는 각각 불소를 포함하는 공통점을 지니고 있는 불소계 고분자이다. Nafion과 PVDF
사이의 수소 결합을 통해 서로 안정적으로 혼합된 블렌드 전해질 막을 형성하여 연료전지용 PEM으로 제조하였다. 특히, PVDF는 Figure
1에서 보이는 것처럼, 고분자 주사슬의 입체 배열구조(configuration)에 따라 결정 상이 달라지게 된다.
T(trans)G(gauche)TG’의 배열 구조를 가진 경우를 α 상이라 하며, 이 때에는 PVDF의 수소와 불소 사이의 분극이 서로 상쇄된다. 이와 달리,
TTTT의 배열을 갖는 β 상과 TTTG의 배열을 갖는 γ 상의 경우에는 두 원자 사이의 dipole moment 차이에 의해서 분극이 발생하게 된다.18-20
본 연구에서는 PVDF를 열처리 조건에 따라 각각 α 상과 γ 상으로 제어하여 Nafion과의 블렌드 막에서 PEM으로서의 물성과 수소 이온전도도를 평가하였다.
균일한 블렌드 전해질 막 형성을 위해 Nafion과 PVDF를 각각 DMF에 용해시켜 혼합용액을 준비하였고, 충분한
ultrasonication을 거쳐 Figure 1(b)에서와 같이 약 50 mm의 일정한 두께를 가진 막을 제조하였다.
Nafion과 PVDF의 무게 혼합 비율을 각각 9:1, 7:3, 5:5로 제조하였으며, 모든 혼합 조건에 대해 투명하고 균일한 전해질 막을 얻을
수 있었다.
PVDF의 결정상
제어 및 분석을 위해 PVDF 막을 90, 120, 140, 160 oC 조건에서 약 6시간
열처리를 실시하였다. Figure 2(a)의 ATR-FTIR 측정 결과에서 나타난 바와 같이, 90 oC 조건에서 열처리된 PVDF의 경우 812, 833, 1234, 1429 cm-1에서 γ 상을 나타내는 피크가 관찰되었다.19,24
PVDF를 120~140 oC로 온도를 높이며 열처리를 실시하였을 때에는 줄어드는 γ 상과 늘어나는 α 상을 동시에 확인할 수 있다. 160 oC 조건에서 열처리된 PVDF는 더 이상 γ 상이 관찰되지 않았고, 614, 766, 795, 855, 976,
1149, 1209, 1383 cm-1의 a 상의 결정 구조를 확인하였다.19,24 PVDF의 녹는점 이상에서의 열처리
후 서서히 식히는 과정을 통해 PVDF의 분자들이 TGTG’의 구조를 이루는 a 상을 가지게 되었다.
이와 같이 열처리 조건에 따른 PVDF의 결정 상에 대한 ATR-FTIR 결과를 바탕으로, Nafion과 혼합된 블렌드 막을 형성하였을 때의 결과를
Figure 2(b)와 같이 관찰하였다. PVDF의 결과와 같이, Nafion-PVDF(9:1) 블렌드 막에 대해서도 90 oC와 160 oC에서 각각 α 상과 γ 상의 PVDF를 나타내는 피크를 확인할 수 있다. 이는
Nafion과 PVDF가 9:1의 비율로 혼합되었을 때, PVDF의 polar한 특성을 가진 γ 상의 분극 특성이 유지될 수 있다는 점을 나타낸다.
뿐만 아니라, 이와
같은 고분자의 구조는 XRD 분석을 통해서도 관찰되었다. Figure 3(a)의 PVDF의 열처리 온도에 따른 XRD 결과를 살펴보면, 90 oC 열처리 조건의 PVDF는 γ상의 결정 피크가 관찰되며, melt-crystallization을 통한
160 oC 열처리 조건의 PVDF는 a 상의 피크가 확인된다.19
Nafion과 γ-PVDF를 블렌드하여 전해질 막을 제조할 경우, 혼합 비율에 따른 XRD 결과가 Figure 3(b)에 정리되었다.
Nafion 고분자가 가지는 17.5o의 2q에서 관찰되는 결정 피크와 비정질 피크로 구성된
15~21o 사이의 피크들을 확인할 수 있으며, PVDF가 추가됨에 따라 PVDF의 γ 상의 결정 피크가 20.76o에서
관찰되었다.25-27 9:1, 7:3, 5:5 비율로 PVDF의 함량이 증가됨에 따라 20.76o 및 36.94o,
39.94o의 γ-피크가 구별되게 나타났다. 특히 5:5의 블렌드 막의 경우, Nafion 결정 피크가 17.2o에서
17.9o로 증가되어 변화된 결정 구조를 확인할 수 있다. 더불어, Nafion 및 블렌드 막의 온도에 따른 구조
분석을 실시하였다. Figure 3(c)에서 나타나는 바와 같이, Nafion의 경우, 기존의 연구 결과와 유사하게 160 oC 열처리에 따라 결정화도가 증가됨을 확인하였다. 이는 열처리 과정 동안, 불완전한 Nafion 막의
PTFE-like 결정들의 재결정화에 의한 것으로 사료되며, 15~21o 사이의 비정질 피크가 증가됨을 확인하였다.26,27
9:1 Nafion-PVDF 블렌드 막의 경우, 90 oC 조건의 막에서는 γ-PVDF를
나타내는 20.76o의 완만한 shoulder-피크가, 160 oC 조건의 막에서는 20.12o의 a-피크가 나타났다.
연료전지 구동을 위한
PEM은 막 내부에 포함되는 수분의 양에 따라 수소 이온 전달 능력이 매우 크게 영향을 받는다. 이는 전해질 막 내부에서 수소 이온을 전달하는
두 가지 기본 메커니즘에 따라 해석할 수 있다.28 첫 번째는 Grotthuss 메커니즘으로, 수소 이온이 H3O+
의 형태로 근접하는 분자들의 분자 재배치(molecular rearrangement)를 통해 전달되는 방식이다. 두 번째 수송(Vehicular)
메커니즘에 따르면, 수소 이온이 물 분자와 결합하여 H3O+, H5O2+
및 H9O4+와 같은 형태로 술폰산 그룹의 클러스터로 이루어진 친수성 이온 채널을 따라
전달된다. 이러한 두 가지 주요한 수소 이온의 수송에 대한 원리에 따라 전해질 막에서 물 분자가 가지는 역할과 중요성은 매우 크며, 수분 및 습도에
따른 효과적인 막의 물성 평가 및 관리가 필수적으로 요구된다. Figure 4(a)와 4(b) 에서는 Nafion과 PVDF의 다양한 혼합 비율에
따른 수분에 대한 흡습성 및 팽창률을 나타내고 있다. 순수한 Nafion 전해질 막의 경우, 약 26.8%의 water
uptake를 나타내며, 이는 Nafion의 친수성 술폰산 그룹에 의한 수분 흡수로 확인된다. 대표적인 소수성 고분자인 PVDF를 전체 고분자
질량 대비 10, 30, 50 wt% 첨가함에 따라, 각각 21.1%, 12.2%,
8.9%로 감소하였다. 뿐만 아니라,
전해질 고분자는 수분을 흡수함에 따라, 부피가 팽창하게 되는데, 이를 Figure 4(b)의 면 방향 팽창률로 측정하였다. 기존의 Nafion 전해질 막이 약 9.6%의 습윤
팽창률을 보이는데 반해, PVDF가 포함될수록 9:1, 7:3, 5:5 비율에 대해 4.6%, 2.4%, 1.3%로 면적 팽창률이 급격하게 감소하는 것을 확인하였다. 이는 water uptake 결과와
유사하게, 블렌드 막이 형성됨에
따라 수분과의 결합 및 친화력이 약한 PVDF가 막 내에 포함되는 물의 양을 줄어들게 하기 때문이다. 면 방향 팽창률은 전해질 막이 연료전지 구동을
위해 전극 및 촉매, 가스확산층과 접합체로 형성되어 단위 전지(cell) 및 스택(stack)을 형성할 때에, 습도 조건의 변화에 따른 안정적인
연료전지 구동에 필수적으로 요구되는 매우 중요한 기계적 내구성의 기본 조건이 된다.29,30 과도한 면 방향 팽창률은 전극과
전해질 막의 계면 박리(delamination) 또는 전해질 막 내의 pin-hole과 같은 결함(defect)을 형성하게 되므로, 필수적으로
제어되어야 한다. Nafion-PVDF(9:1) 블렌드 막의 경우, 5% 이내의 매우 안정적인 습윤 팽창률을 나타내며, PVDF의 첨가에 의한
전해질 막의 안정성 확보를 의미한다.
전해질 고분자가 교환할
수 있는 수소 이온의 용량을 IEC로 표현하였으며, 산-염기 적정에 의해 측정 및 계산된 IEC는 Figure 4(c)에 나타나 있다. Nafion의 경우, 약
1.02 meq g-1 로 측정되었으며, 이온 교환 그룹이 없는 PVDF의 비율이
9:1, 7:3, 5:5로 늘어남에 따라, 0.85, 0.69, 0.54 meq g-1로 감소하였다.
IEC는 고분자가 포함하고 있는 술폰산 그룹과 같은 이온 교환 그룹의 비율에 따라 달라지게 되며, 이는 실제 수소 이온 전도도와 직접적인 비례
관계를 가지고 있다. IEC가 증가할수록 수소 이온전도도가 급격하게 증가할 수 있다. 하지만, 일정 이상의 IEC를 가지게 될 경우, 고분자가
물에 용해되거나 수분 흡수율이 지나치게 커져 면적 및 두께 팽창에 따른 기계적 안정성이 크게 감소되는 문제점이 있다. 따라서 적절한 IEC를 갖는 것은 수소 이온전도도의 향상과 물리적
안정성 확보에 매우 중요하다. PVDF를 9:1 비율로 첨가함으로써 IEC가 Nafion 대비 약 16.7% 감소하였으나, 수분에 의한 치수 안정성이 증가되는
trade-off 결과를 확인하였다.
전해질 고분자의 결정
구조 분석을 위해 각각 90, 160 oC에서 열처리한 블렌드
PEM에 대해 non-contact mode AFM 분석을 실시하였다. 우선, 앞의 ATR-FTIR 및 XRD 결과와 동일하게 Figure
5(a)와 5(b)의 AFM 측정 결과에서도 90, 160 oC에서도 α 상과 γ 상의 PVDF를 나타내는 모폴로지가 관찰되었다. 반결정성
PVDF 고분자가 용액 상태에서 막으로 제작되는 건조 및 열처리 조건에 따라 고분자 주사슬이 재배열되어 각각 α 상과 γ 상의 구조를 이루었다. Nafion의 경우, 불소로 인해
소수성을 가지는 주사슬과 술폰산 그룹으로 인해 친수성을 가지는 곁사슬의 상 분리가 일어난다. 이러한 상분리는 AFM 상 이미지에서 친수성 부분이
어두운 색으로, 소수성 부분이 밝은 색으로 구분되며, Figure 5(c)에서 보이는 바와 같이 9:1 블렌드 막에 대해서도 Nafion의 상
분리에 의한 나노 구조를 확인할 수 있다. 하지만, 160 oC 열처리 조건의 경우,
Nafion에 의한 상 분리가 뚜렷하게 나타나지 않았다.
나노 구조를 보다
정량적으로 파악하기 위하여 SAXS 분석을 실시하였다. Figure 6(a)에서 보이는 바와 같이 solution-casting 방법으로 제조된
γ-PVDF의 경우, interlamellar 영역의 결정질 라멜라(lamellar)와 비정질(amorphous) 층을 나타내는 약 0.0525 Å-1의 q
값과 11.96 nm의 d-spacing을 나타내었다. 그러나 160 oC 열처리 후 얻어진 α-PVDF는 q값이 0.0567 Å-1로 증가되어, d-spacing이 11.08 nm으로 감소되었다. Nafion의 경우, 고분자 내의
친수성과 소수성 그룹에 의해 상 분리가 야기되며, 이는 SAXS에서 interlamellar간 거리를 나타내는 피크(매트릭스 피크)와 친수성 술폰산 그룹의
조립으로 형성되는 클러스터 피크(이오노머 피크)로 관찰된다.31,32 Figure 6(b)에서 관찰되는 Nafion에 대한 SAXS 결과를 살펴보면,
Nafion의 매트릭스 피크가 90, 160 oC 조건에서 각각
5.68, 5.96 nm를 가지며, 결정화도가 증가되었다. 하지만,
Figure 6(c)의 9:1 비율로 혼합된 Nafion-PVDF의 경우, 90, 160 oC 조건에서 각각 5.88, 7.10 nm의 매트릭스 피크를 나타냄을 확인할 수 있다. 이는
PVDF의 열처리 및 건조 조건을 통해 a-PVDF로 PVDF가
melt-recrystallization되어 결정 상이 변화하면서, Nafion이 가지는 결정 구조에 영향을 미침을 확인할 수 있다. 특히, 블렌드 전해질 막에서는 술폰산
그룹의 클러스터로 인해 형성되는 이오노머 피크가 확인되었으며, 90, 160 oC 조건에서 각각
1.98, 1.75 nm를 나타내었다. Nafion과 γ-PVDF가 혼합된
전해질 막의 경우, g-PVDF의 분극현상으로 인해 수소 이온 전달을 돕는
술폰산 그룹의 클러스터의 사이즈가 커지고, SAXS 상에서의 피크도 더욱 뚜렷하게 확인되었다.
이러한 블렌드 전해질
막의 물성 및 나노 구조는 최종적으로 전해질 막이 가지는 수소 이온 전도도에 영향을 미치게 된다. Figure 7의 수소 이온 전도도 평가 결과를 살펴보면, 기존의
순수한 Nafion에 비해, PVDF가 혼합되면서 이온전도도가 96.02에서 12.97 mS cm-1까지 감소함을 확인할
수 있다. 이는 Figure 4(c)에서 나타난 바와 같이, PVDF가 첨가되면서 전해질 막의 IEC가 감소했기 때문이다. PVDF가 추가됨으로써
습윤 팽창률을 낮춰주어 전해질 막의 물리적 안정성을 확보하였으나, 연료전지의 성능을 결정하는 수소 이온 전도도가 낮아지는 trade-off 결과를
확인하였다. 하지만, γ-PVDF를 포함하는 블렌드 전해질 막(76.52 mS cm-1)은 같은 혼합 비율의 α-PVDF(40.68 mS cm-1)보다 약 1.88배 향상된
수소 이온 전도도를 나타내는 결과를 얻을 수 있었다. 이는 γ-PVDF가 가지는 분극 특성이 전해질 고분자 내의 친수성 수소 이온 전달 채널을
형성하는데 도움을 주었기 때문으로 사료된다. 특히, 앞의 나노 구조 분석 결과에서도 해당 조건에서 더욱 발달된 친수성 이온 채널을 확인할 수 있었고,
이러한 나노 구조의 발달은 같은 IEC를 가지는 전해질에서 보다 효과적인 수소 이온 전달을 가능하게 한다.

|
Figure 1 (a) Schematic illustration of Nafion-PVDF blend molecules; (b) images of blend membranes with blending ratios of 9:1,
7:3 and 5:5, respectively. |

|
Figure 2 ATR-FTIR spectra of (a) PVDF; (b) Nafion-PVDF blend
membranes. |

|
Figure 3 XRD results of (a) PVDF; (b, c) Nafion-PVDF blend
membranes for various blending ratios and thermal annealing conditions. |

|
Figure 4 (a) Water uptake; (b) swelling ratio; (c) IEC of NafionPVDF blend membranes with PVDF contents to polymers. |

|
Figure 5 AFM phase images of (a, b) PVDF; (c, d) 9:1 NafionPVDF blend membranes with thermal annealing temperatures of (a,
c) 90 oC and (b, d) 160 oC. Scale bar is 500 nm. |

|
Figure 6 SAXS results for (a) PVDF; (b) Nafion; (c) 9:1 NafionPVDF blend membranes. |

|
Figure 7 Proton conductivity of the blend membranes. |
Nafion 전해질
고분자의 물리적 안정성을 증가시키며 안정적인 수소 이온 전도도를 확보하기 위해, 반결정 강유전 고분자 PVDF를 도입하여 블렌드 전해질 막을 제조하였다.
PVDF의 함량이 증가될수록 water uptake와 swelling ratio, IEC가 감소하는 것을 확인하였다. 더불어, 전해질 막의 열처리
조건을 90, 160 oC로 달리하여 PVDF의 결정 상을 분자 내 dipole moment에 의한
polarization 특성 차이를 나타내는 각각의 γ 및 a 상으로 제어하였다. 제어된 PVDF 결정 상에 따라 혼합된
전해질 고분자는 수소 이온 전달 채널 및 interlamellar 구조 등의 나노 구조의 차이를 나타내었고, γ-PVDF 조건에서 더욱 균일하고
연결성이 좋은 이온 전달 나노 구조를 확인하였다. 최종적으로 Nafion: γ-PVDF의 9:1 혼합비율 조건에서 전해질 막은 76.52 mS cm-1 수소 이온 전도도와 4.7%의 안정적인 습윤 팽창률을 기록하여,
연료전지용 수소 이온 교환막으로서의 활용 가능성을 확인하였다.
- 1. L. Carrette, K. A. Freidrich, and U. Stimming, Fuel Cells, 1, 5 (2001).
-

- 2. H. Zhang and P. K. Shen, Chem. Soc. Rev., 41, 2382 (2012).
-

- 3. M. A. Hickner, H. Ghassemi, Y. S. Kim, B. R. Einsla, and J. E. McGrath, Chem. Rev., 104, 4587 (2004).
-

- 4. K. A. Maurits and R. B. Moor, Chem. Rev., 104, 4535 (2004).
-

- 5. R. Wang, W. Zhang, G. He, and P. Gao, J. Mater. Chem. A, 2, 16416 (2014).
-

- 6. M. Ozmaian and R. Haghdabadi, Phys. Chem. Chem. Phys., 16, 3173 (2014).
-

- 7. M. Klingele, M. Breitwieser, R. Zengerle, and S. Thiele, J. Mater. Chem. A, 3, 11239 (2015).
-

- 8. F. Liu, B. Yi, D. Xing, J. Yu, and H. Zhang, J. Membr. Sci., 212, 213 (2003).
-

- 9. M. Zatoń, J. Rozière, and D. J. Jones, Sustain. Energy Fuels, 1, 409 (2017).
-

- 10. X. Zhu, H. Zhang, Y. Liang, Y. Zhang, Q. Luo, C. Bi, and B. Yi, J. Mater. Chem., 17, 386 (2007).
-

- 11. X. Zhu, H. Zhang, Y. Zhang, Y. Liang, X. Wang, and B. Yi, J. Phys. Chem. B, 110, 14240 (2006).
-

- 12. A. Kusoglu and A. Z. Weber, Chem. Rev., 117, 987 (2017).
-

- 13. K.-Y. Cho, J.-Y. Eom, H.-Y. Jung, N.-S. Choi, Y. M. Lee, J.-K. Park, J.-H. Choi, K.-W. Park, and Y.-E. Sung, Electrochim. Acta, 50, 583 (2004).
-

- 14. Y. Li, J. Hui, J. Kawchuk, A. O'Brien, Z. Jiang, and M. Hoorfar, Fuel Cells, 19, 43 (2019).
-

- 15. H. J. Kim, H. J. Kim, Y. G. Shul, and H. S. Han, J. Power Sources, 135, 66 (2004).
-

- 16. G. Nawn, K. Vezzù, E. Negro, G. Pace, J. W. Park, R. Wycisk, G. Cavinato, P. N. Pintauro, and V. Di Noto, Phys. Chem. Chem. Phys., 21, 10357 (2019).
-

- 17. H.-Y. Li and Y.-L. Liu, J. Mater. Chem. A, 2, 3783 (2014).
-

- 18. A. J. Lovinger, Science, 220, 1115 (1983).
-

- 19. P. Martins, A. C. Lopes, and S. Lanceros-Mendezab, Prog. Poly. Sci., 39, 683 (2014).
- 20. Y. J. Park, I. Bae, S. J. Kang, J. Chang, and C. Park, IEEE Trans. Dielectr. Electr. Insul., 17, 1135 (2010).
- 21. S. J. Kang, Y. J. Park, I. Bae, K. J. Kim, H.-C. Kim, S. Bauer, E. L. Thomas, and C. Park, Adv. Funct. Mater., 19, 2812 (2009).
-

- 22. C. Wan and C. R. Bowen, J. Mater. Chem. A, 5, 3091 (2017).
-

- 23. S. Kim, J.-Y. Shin, Y. Yun, D. Y. Lee, D.-H. Yang, B.-Y. Kim, and Y.-S. Song, Polym. Korea, 43, 764 (2019).
-

- 24. X. Cai, T. Lei, D. Sund, and L. Lin, RSC Adv., 7, 15382 (2017).
-

- 25. H. W. Starkweather, Jr., Macromolecules, 15, 320 (1982).
-

- 26. J. Li, X. Yang, H. Tang, and M. Pan, J. Membr. Sci., 361, 38 (2010).
-

- 27. C. Yin, Z. Wang, Y. Luo, J. Li, Y. Zhou, X. Zhang, H. Zhang, P. Fang, and C. He, J. Phys. Chem. Solids, 120, 71 (2018).
-

- 28. S. J. Peighambardoust, S. Rowshanzamir, and M. Amjadi, Int. J. Hydrog. Energy, 35, 9349 (2010).
-

- 29. A. S. Alavijeh, S. Bhattacharya, O. Thomas, C. Chuy, Y. Yang, H. Zhang, and E. Kjeang, J. Power Souces, 427, 207 (2019).
-

- 30. N. S. Khattra, M. H. Santare, A. M. Karlsson, T. Schmiedel, and F. C. Busby, Fuel Cells, 15, 178 (2015).
-

- 31. P. C. van der Heijden, L. Rubatat, and O. Diat, Macromolecules, 37, 5327 (2004).
-

- 32. C. -S. Tsao, H. -L. Chang, U. -S. Jeng, J. -M. Lin, and T. -L. Lin, Polymer, 46, 8430 (2005).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(4): 572-578
Published online Jul 25, 2020
- 10.7317/pk.2020.44.4.572
- Received on May 18, 2020
- Revised on Jun 4, 2020
- Accepted on Jun 8, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Insung Bae
-
Department of Advanced Materials, Hannam University, 1646 Yuseong-daero, Yuseong-gu, Daejeon 34054, Korea
- E-mail: insungbae@hnu.kr
- ORCID:
0000-0002-7565-7360










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.