- Optimization of Synthesis Process for Aminated Polyketone Anion Exchange Membranes via Response Surface Methodology (RSM)
Department of Applied Chemical Engineering and Applied Chemistry, College of Engineering, Chungnam National University, 99 Daehak-ro, Yuseoung-gu, Daejeon 34134, Korea
- 반응표면 분석법에 의한 Aminated Polyketone 음이온 교환막의 합성공정 최적화
충남대학교 공과대학 응용화학공학과
In this study, polyketone
anion exchange membranes for water treatment and battery industries were
synthesized by the Paal-Knorr reaction mechanism. In addition, the structure of
the polyketone anion exchange membrane synthesized according to the
concentration and time of different N,N-dimethylethylenediamine
(DME) was confirmed by FTIR and XPS spectrum analysis. Response surface
methodology (RSM) analysis was performed to compare the optimum conditions of
the membrane with the experimental data. As a result of confirming the amination
rate by SEM-EDS analysis, the maximum conversion, ion exchange capacity (IEC),
and swelling ratio (S.R.) were 52.7%, 0.82 meq/g, and 10.1%, respectively. Optimum synthetic process parameters of polyketone
anion exchange membrane by RSM were confirmed. The experimental results of the
polyketone anion exchange membrane synthesized are in good agreement with the
response optimization requirement index simulated by RSM.
본 연구에서는 수처리 및 배터리 산업용 폴리케톤 음이온
교환막을 Paal-Knorr 반응 메커니즘에 따라 합성 하였다. 또한 FTIR 및 XPS 스펙트럼 분석을 통하여 다른 N,N-dimethylethylenediamine(DME)의
농도와 시간에 따라 합성된 폴리케톤 음이온 교환막의 구조를 확인하였다. RSM 분석으로 막의 최적 합성
조건을 실험값과 비교하였다. SEM-EDS 분석으로 아민화율을 확인한 결과 최대 전환율, 이온교환용량(IEC), 팽윤율(S.R.)은
각각 52.7%, 0.82 meq/g, 10.1%였다. RSM에 의한 폴리 케톤 음이온 교환막의 최적 합성 공정 변수를 도출하였다. 본 연구에서 합성된 폴리 케톤 음이온 교환막의 실험 결과는 RSM에
의해 시뮬레이션된 응답 최적화 요구 지수와 잘 일치했다.
In this study, polyketone anion exchange membranes for
water treatment and battery industries were synthesized by the Paal-Knorr
reaction mechanism. Optimum
synthetic process parameters of polyketone anion exchange membrane by RSM were
confirmed. The experimental results of the polyketone anion exchange membrane
synthesized are in good agreement with the response optimization requirement
index simulated by RSM.
Keywords: polyketone, anion exchange membrane, Paal-Knorr reaction, amination, response surface methodology
이 논문은 2019년 충남대학교 자체연구(CNU
학술연구지원사업)에 의해 수행되었음.
최근 반도체, 전자산업과
전기자동차 등의 혁신적인 스마트 시대를 구현하기 위해서는 산업적 관점에서 핵심소재인 고분자 전해질 막의 개발이 매우 중요하다.1
Nano flash memory와 같은 초정밀 반도체 부품소재 제조 시 사용되는 초순수 제조장치에 축전식탈이온(capacitive
deionization, CDI) 방식이 채택되고 있다.2,3
이러한 CDI 기술의
핵심부품은 이온교환막으로 이온교환막은 크게 불소계 막과 비불소계 막으로 분류된다. 불소계 막은 물성 및 성능이 우수한 장점이 있으나, 상대적으로
제조가격이 높고 일정시간 사용 후 효율이 급격히 저하되는 단점이 있어 불소계 막의 단점을 극복한 새로운 막 합성에 대한 연구가 필요한 실정이다.4
따라서 최근에는 이들 단점을 개선한 탄화수소계 막에 대한 연구가 활발히 진행되고 있으나 이들 막은 제조가격이 저렴하고 전기적 특성은 우수하나 내구성이
낮은 단점이 있어 이를 극복할 수 있는 기술개발이 필요한 실정이다.5,6
최근에는 내구성이
우수한 비불소계 이온선택성막을 합성하기 위하여 poly(phenylene oxide)(PPO)와 같은 엔지니어링 플라스틱을 표면화학 반응을 통하여
합성한 보고가 있다.7,8 Kim 등은 PPO를 chlorosulfonic
acid와 4차 암모늄화 반응을 통해 PPO 방향족에 술폰산기와 4차 암모늄기를 도입한 설폰화와 아민화 PPO 이온선택성 용액을 합성하였고, 이를 전해질 용액으로 roll to roll 방식으로
sulfonated poly(phenylene oxide)(SPPO)와 aminated poly(phenylene oxide)(APPO) 이온교환막을 제조하여 축전식 탈이온 분리막으로 활용함으로써
초순수 제조와 전기탈염효율을 획기적으로 개선한 연구가 보고되었다.9
그러나 기존 연구에서
보고된 이온교환막 또한 내구성이 낮은 단점이 있어 이온교환막을 광범위한 기술영역으로 활용하기 위해서는 내구성과 antifouling을 개선하는
새로운 소재 및 이를 이용한 합성기술 개발이 매우 중요하다.
따라서 본 연구에서는 내충격성,10 내화학성이11
우수하고, 강직성이 뛰어나며 전기적
침식성에 영향이 없는 폴리케톤(이하 PoK라 칭함)을 화학 표면개질법으로 관능화하여 내구성과 이온선택성이 우수한 탄화수소계 이온교환막을 합성하였다.12-14
이 분야에 대한 지금까지의
연구결과를 살펴보면 Hwang 등은 PoK 수지를 메트릭스로 사용하여 직접 술폰화 방법과, 아민화 및 4차 암모늄화 반응을 통해 술폰화 PoK 막과 4차 암모늄화
막을 합성하고, 이들의 내화학성 및 전기저항, 전도도 등 막의 전기적 성능을 평가하고 전기탈염용 수처리 막에 적용하는 연구결과를 보고한 바 있다.15-18 또한
Kim 등은19 전기저항이 낮고 이온선택 성능이 우수한 PoK 막을 방사선 그래프트 중합 방법으로 합성하고 MCDI 분리막
적용 연구를 수행한 바 있다.
그러나 연료전지,
flow battery 그리고 CDI 방식의 전기탈염용 분리막으로 사용 시 낮은 전기저항과 높은 이온전도도 및 기계적 물성을 좌우하는 치수안정성의
중요 변수인 팽윤성에 대한 합성공정을 최적화한 연구는 발표된 바 없다. 기타 다공성 폴리에틸렌 필름에 관능성 단량체를 pore filling으로
관능화하여 이온선택성 분리막을 합성한 연구가 발표되었다.20
그러나 이들 막은
충전된 단량체의 탈리로 성능이 저하되어 연료전지 적용 시 fouling 현상이 나타나기 때문에 상업화를 위한 연구와 관련하여 hybrid 복합
이온교환막 합성연구로 확산되고 있다. 따라서 이온교환막의 최근 연구경향은 좀 더 높은 선택성과 더불어 높은 화학안정성과 antifouling 특성을
부여하기 위해 다중변수를 고려한 합성공정 최적화 연구가 필요하다.
RSM(반응표면분석법)은
적은 횟수의 실험으로도 실험을 수행하지 않은 범위의 결과 값을 예측할 수 있기 때문에, 이온교환막 합성의 최적화된 조건을 찾는데 매우 유용하다.21-23
따라서 본 연구에서는
PoK을 표면개질하여 이온선택성 음이온교환막을 합성하였으며 이들의 구조를 FTIR 분광분석기, SEM-EDS 등으로 확인하였다. 적정법에 의해 이온교환용량을 확인하였으며 무게측정법으로 팽윤율을 계산하였으며, LCR meter로 막의 전기저항을 측정하였다. 또한
막의 모폴로지와 기계적 물성은 인장강도, 신율(elongation), 전자현미경(SEM), universal testing
machine(UTM)을 이용하여 측정하였고, 이를 토대로 RSM 분석을 통해 PoK 음이온 교환막의 최적 반응조건을 실험값과 유의성 평가를 통한
최적합성공정을 도출하였다.
시약 및 재료. 본 연구에서 사용한 polyketone(PoK)(MW: 200000 g/mol, Tm:약
220 oC)은 ㈜효성에서 생산된 resin (M710R: MFI 3 g/10 min)을 사용하였다. PoK 용매인 resorcinol은 삼전화학(Korea)의 순도
98%, 비중 1.285, 분자량
110.11 g/mol인 특급시약을 사용하였다. 전기저항의 기준 용액으로
1.0 M NaOH 표준용액을 사용하였다. 아민화제인 N,N-dimethyl
ethylene diamine(DME)는 TCI(Japan)사의 순도 98.0%, 비중 0.81, 분자량 88.15 g/mol인 특급시약을 사용하였다. 4차 암모늄화 반응을
위한 methyl iodide는 삼전화학의 순도 99.0%, 비중 2.28, 분자량 141.95g/mol인 특급시약을 사용하였으며 그 밖의 시약은
정제 없이 특급시약을 그대로 사용하였다.
PoK 막 제조용 Dope 용액과 막 제조. PoK 음이온 교환막을 제조하기 위하여 1 L 반응기에 PoK 수지 60 g을 넣고, resorcinol 282 g을 넣은 후 80 oC에서 5시간 동안 교반하여 PoK dope 용액을 제조하였다. PoK dope 용액을 캐스팅 방법으로
PoK 막을 제조하기 위하여 막의 두께조절이 가능한 doctor blade가 장착된 applicator로 유리판 위에 dope 용액을 75 μm 두께로 캐스팅한 후 적외선 오븐에서 24시간 동안 건조 후 유리판으로부터 분리시켜
PoK 막을 제조하였다. PoK 막을 무게와 두께를 측정하고, 탈이온수로 여러 번 세척한 후 증류수에 담가 보관하였다.
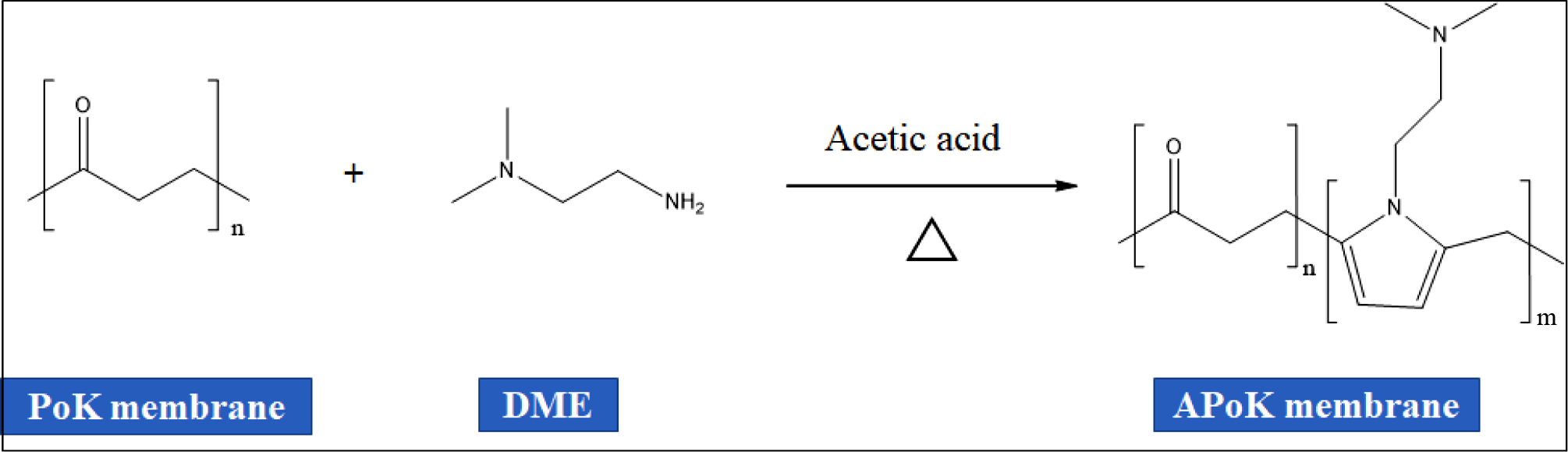
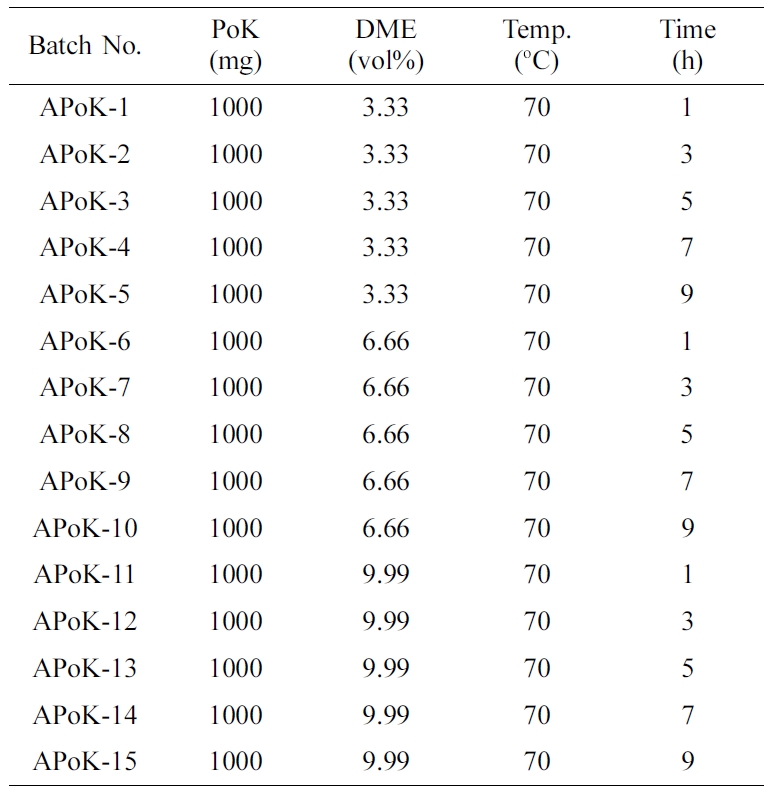
PoK 막의 아민화 반응. 4차 암모늄화 PoK 이온교환막을 합성하기 위한 중간체를 합성하기 위하여 PoK 막의 아민화 반응을 진행하였다.
아민화 반응을 위하여 냉각기, 교반기, 온도계, 질소 주입구, 시료주입구가 부착된 100 mL 4구 반응기에 3 cm×3 cm(1.0 g) 크기로 절단한 PoK 막을 넣은 후 여기에 50 mL DMSO를 주입하고, 질소 분위기에서 70 oC까지 가열한 후 온도를 유지하면서 DME를 한 방울씩 적가하였다. 또한 DME와 동일 몰수의 acetic acid를 같은
방법으로 반응기에 주입한 후 Table 1와 같이 아민화 반응시간을 변화시켜 교반하면서 Figure 1과 같은 반응 메커니즘에 따라 아민화 반응을 진행하였다.
반응 후 반응기를 냉각시킨 후 APoK 막을 증류수로 여러 번 반복 세척한 후 50 oC 진공오븐에서 24시간 동안 건조시켜 APoK 막을 제조하였다.
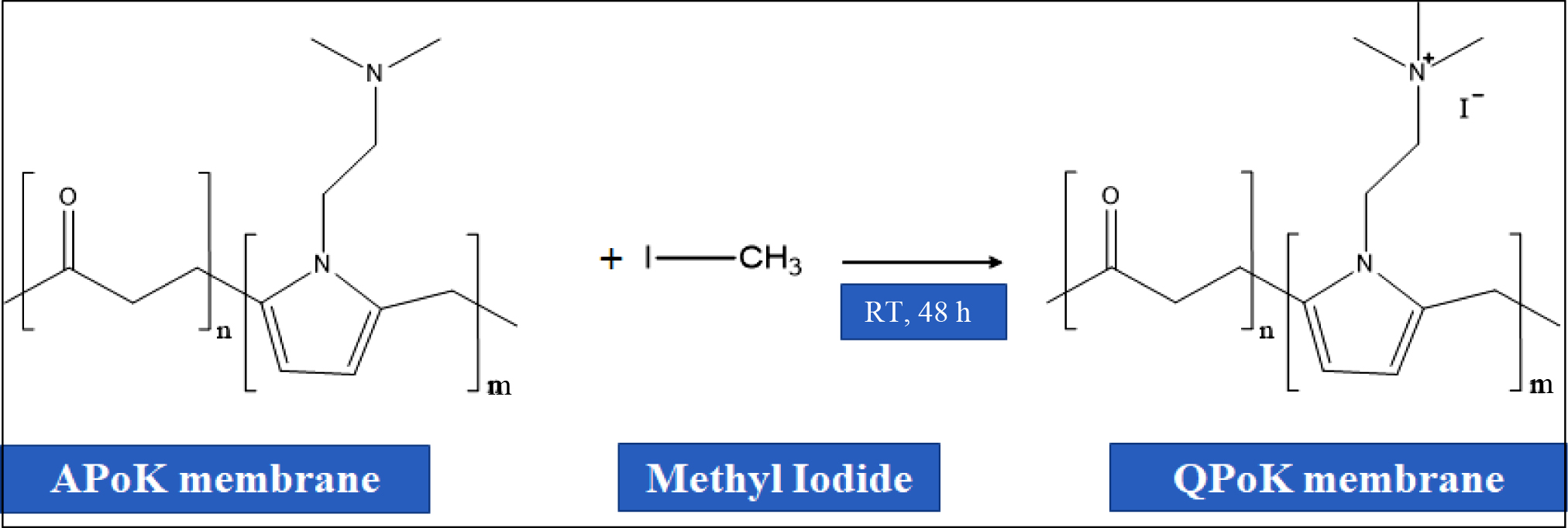
Aminated Polyketone(APoK) 막의 4차 암모늄화 반응. APoK 막의 4차 암모늄화(quaternary
ammonium) 반응을 위해
100 mL 삼각플라스크에 3 cm×3 cm 크기로 절단한 APoK 막을 넣고 여기에 30 mL methyl iodide를 넣은 후 밀봉하고, 실온에서 48시간 동안 Figure 2와 같은 반응
메커니즘에 따라 4차 암모늄화 반응[quaternary
ammonium
polyketone (QPoK)]을 진행하였다. 반응 후 막을 꺼내어 증류수로 세척한 후 50 oC 진공오븐에서 24시간 동안 건조한 후 냉각시켜 실험에 사용하였다.
FTIR 스펙트럼 분석. PoK, APoK, QPoK 막의 관능화
반응 전후 구조변화를 확인하기 위하여 Fourier transform infrared(FTIR) 스펙트럼을 분석하였다. FTIR 스펙트럼은 Shimadzu(Japan)사의 IR
Prestige-21를 이용하여 ATR 방법으로 4000~600 cm-1 범위에서 scan number 20, resolution 4 cm-1로 하여 필름상태로 PoK, APoK, QPoK 막들의
흡수스펙트럼을 얻어 분자구조를 확인하였다.
X-ray
Photoelectron Spectroscopy(XPS) 분석. PoK 막의 표면원소 화학조성변화를 확인하기 위하여
XPS(X-ray photoelectron spectroscopy)는 Thermo Fisher Scientific사(USA)의 Multi
Lab 2000로 0 eV에서 1100 eV까지의 에너지 범위에서 스펙트럼 분석을 하였다.
SEM-EDS 모폴로지 관찰. 합성한 PoK 막의 모폴로지 변화와 원소의 조성변화를 확인하기 위하여 TESCAN 사의 Model LYRA3 XMU(Czech)를 사용하여
시편을 이온 스퍼터링 방법으로 표면을 금 코팅하고 배율을 ×4000배로 하여 SEM-EDS 분석을 하였다.
함수율(Water Uptake, W.U.) 측정. PoK 막의 함수율 변화를 측정하기 위하여 각각의 막을 3 cm×3 cm 크기로 절단하여 건조시킨 후 무게를 측정하고, 증류수에
24시간 동안 충분히 침적시킨 후
막 표면의 수분을 제거하고 무게를 측정하여 식 (1)에 대입하여 PoK 막의 함수율을 계산하였다.
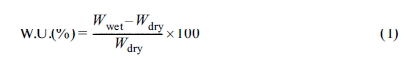
여기서, Wwet은
증류수에 팽윤된 막의 무게이고 Wdry는 건조된 막의 무게이다.
팽윤율(Swelling Ratio, S.R.) 측정. PoK 막의 관능화 반응 전후 팽윤율 변화를 측정하기 위하여 3 cm×3 cm 크기로 절단하여 24시간 동안 증류수에 침적시켜
충분히 팽윤시킨 후 증가된 막의 가로, 세로 길이를 측정한 후 식 (2)에 대입하여 PoK 막의 팽윤율을 측정하였다.

lwet는 팽윤된 상태의 PoK 막의 길이이며, ldry는
건조된 상태의 PoK 막의 길이를 나타낸다.
이온교환용량(Ion Exchange Capacity, I.E.C.) 측정. QPoK 음이온 교환막의 I.E.C.을 적정법으로 측정하였다. I.E.C.의 변화량을 측정하기 위하여 건조된 100 mL 삼각플라스크에 QPoK 이온교환막 1 g과 1.0 M KOH 표준용액 50 mL를 넣은 후 실온에서 24시간 교반하여
OH-foam으로 치환시켰다. 이후 증류수로 여러 번 반복 세척하고, 50 oC 진공오븐에 24시간 동안 건조시킨 후 100 mL 삼각 플라스크에 넣고 0.1 M HCl 표준용액
50 mL를 넣은 후 24시간 동안 교반시켜 평형에 도달시킨
다음 상등액 20 mL를 분취한 후 페놀프탈레인 2~3 방울 적가하고 교반하면서 0.1 M NaOH 표준용액으로 적정하고 식 (3)에 대입하여
QPoK 이온교환막의 이온교환량을 식 (3)에 대입하여 계산하였다.
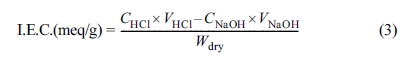
여기에서, CHCl은
HCl의 농도(mol/L), VHCl는 HCl의 부피(mL)이며, CNaOH는
NaOH의 농도(mol/L), VNaOH는 HCl의 부피(mL)이다. 또한 Wdry는
건조된 QPoK 음이온 교환막의 무게이다.
전기저항(Electrical Resistance, E.R.) 측정. 합성한 QPoK 음이온 교환막의 전기저항을 측정하기 위하여 HIOKI사의
Model 3522-50 LCR meter(Japan)로 2-compartment cell에 1 M NaCl 표준용액에 24시간 침적시킨 막을 1.5 cm× 1.5 cm 크기로 절단하여 고정하고, 각각의 셀에 1 M NaCl 표준전해질 용액을 채운 후 막의 전기저항을
측정하고, 1 M NaCl 전해액의 전기저항을 측정하여 식 (4)에 대입하여 QPoK 이온교환막의 전기저항 값을
식 (4)에 대입하여
계산하였다.
여기서, R1은
셀에서 측정한 이온교환막의 전기저항이고, R2는 순수 전해질의 전기저항을 나타낸다. 그리고 A는 측정에
사용된 막의 유효면적이다.
전기전도도(Electrical Conductivity, E.C.) 측정. QPoK 음이온 교환막의 전기저항 값을 토대로 제조한 막의 전기전도도를 식 (5)에 대입하여 계산하였다.17,24

여기서, A는
측정에 사용된 막의 유효면적을 나타내고, L은 측정 내면(in-plane) 전극과 통과면(through-plane)에 대한
prob 전극 사이의 길이(cm)를 나타낸다. 본 연구에서는 prob 전극간의 거리가 1 cm로 고정하였다.25
PoK 이온교환막의 기계적 물성 시험. QPoK 음이온 교환막의 관능화 반응 전후 기계적 물성인 인장강도와 신장률을
측정하기 위하여 JIS K6251 시험방법에 따라 Dumb bell 3호로 시편을 제작하고, INSTRON model 5967 UTM(USA)으로 PoK 이온교환막의 인장강도 및 신장률을 측정하였다.
QPoK 이온교환막의 RSM 분석. 반응조건을 달리하여 합성한 음이온교환막의 최적 합성조건을 도출하기 위하여 MINITAB Release 18(Minitab
Inc., State College, PA, USA) RSM 프로그램으로 실험결과를 분산분석, 회귀분석 등을 이용하여 독립변수와 종속변수간의 상관관계를 3차원 표면도(반응표면도, 등고선도 등)로 나타내어 함수관계를 추정하고,
예측하여 최적화하였다. 본 연구에서는 반응표면분석법을 이용하여 DME 농도와 반응시간에 따른 이온교환막의 함수율, 팽윤율, 이온교환용량, 전기저항
및 전기전도도와 내구성에 영향을 미치는 기계적 물성 즉 인장강도와 신장률에 대한 변화값을 이용하여 함수관계를 추정, 예측함으로써 QPoK 음이온교환막의
합성 최적화 조건을 도출하였다.
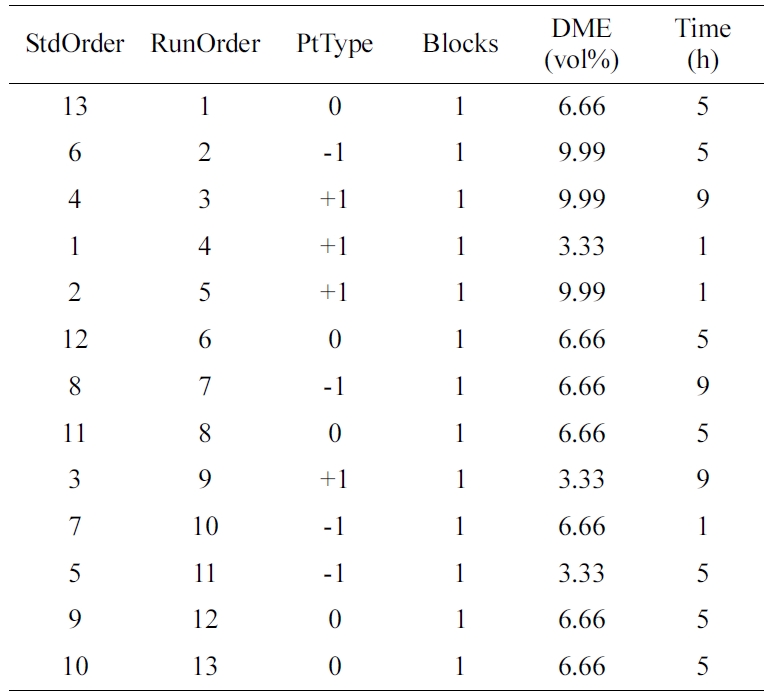
실험 설계(Experimental Design). QPoK 음이온 교환막 합성조건 최적화를 위하여 실험설계는 실험계획법의 일종인 RSM의 2차 다항 희귀모형(second
order regression model)의 중심합성계획법(central composite design, CCD)을 사용하였다. 중심합성계획법에서
독립변수로 DME [몰 분율(mol fraction), wt%(A)], 반응시간(B)을 설정하고 Table 2와 같이 3단계로 code화 하였다.
즉 two-level factorial, full factorial로 factors 2, replication 1, base runs 13,
total runs 13, base & total blocks는 1로 하였다. 또한 point type은 cubic points 4,
center points in cube는 5, axial points 4, center points in axial은 0으로 하였다. 설계표는
randomized 하였다. 이 때 각 인자의 변위는 high level(+1), center points(0), low level(-1)로
code화하였다.
|
Figure 1 Amination mechanism for polyketone (PoK) membrane in DME. |
|
Figure 2 Quaternary ammonium reaction mechanism of aminated polyketone (APoK) membrane using methyl iodide. |
|
Table 2 Design & Coded Table of the Ranges of Different Parameters Selected for the CCD of Each Reaction Condition (Randomization) |
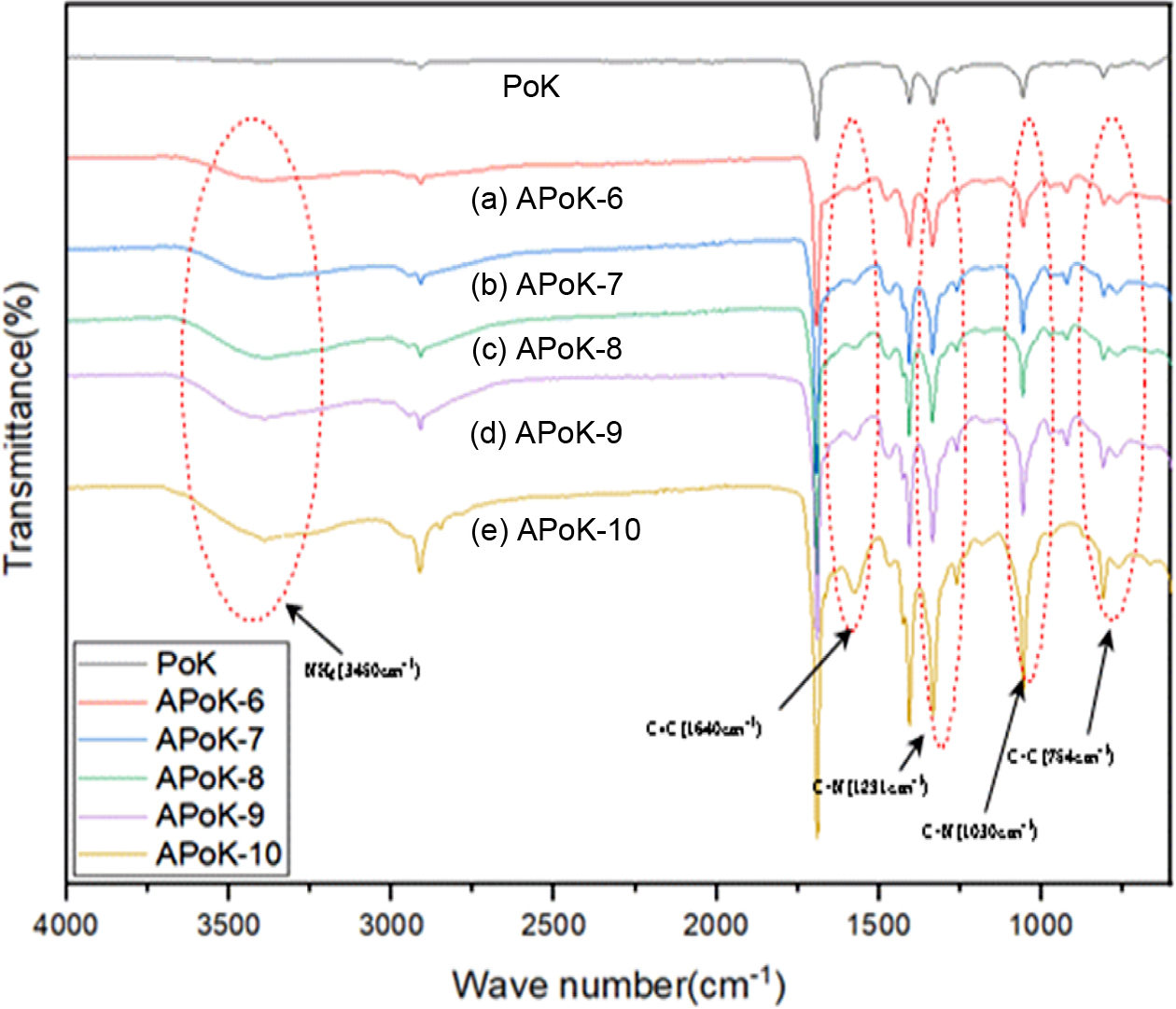
APoK 막의 FTIR Spectrum 분석. 본 연구에서는 QPoK 음이온 교환막을 합성하기
위하여 중간체인 APoK 막을 합성하고, 이들의 분자구조 확인을 위하여 FTIR 스펙트럼을 측정하여 그 결과를 Figure 3에 나타냈다.
Figure 3에서 보는 바와 같이 PoK의 경우 2800 cm-1 부근에서 전형적인 에틸렌의
CH2 신축진동 피크가 보이며,16,26 DME의 농도와 반응시간을 변화시켜 합성한 APoK
이온교환막의 경우 아민화 반응이 진행됨에 따라 3450 cm-1 부근에서 NH2 특성피크가 broad하게 나타나며,
1291와 1030 cm-1에서 C-N 특성피크와
1640 cm-1에서 C=C 피크 및
754 cm-1 부근에서 C-C 피크가 나타나는
것으로 보아 PoK 막 내부에 아민기가 도입되었음을 확인할 수 있었다. 아민화에 따른 FTIR 스펙트럼의 특성 변화는 Ataollahi 등의 PoK을 이용한 음이온
교환막의 합성연구에서 제시한 표면개질의 반응진행에 대한 특정 band assignment 방법에서 얻은 결과와 일치하는 경향을 보였다.25
또한 Parr-Knorr 반응에 의한 pyrrole ring의 구조가 PoK 분자 내의 카보닐 라디칼과 DME가 반응하여 1차 아민기가 생성되기
때문으로 사료되었다.
한편, 다른 아민화제
1,3-aminopropyl imidazole(API), ethylene diamine
(EDA)로
PoK를 아민화한 APoK 이온교환막의 FTIR 스펙트럼 분석으로 구조를 확인한 결과 아민화 반응이 진행됨에 따라 FTIR 스펙트럼에서
pyrrole 구조의 C-N, C=C 피크의 intensity가 DME보다 상대적으로 낮게 나타났는데 이러한 결과는 amino aromatic
base 분자구조를 가진 API의 경우 입체장애의 영향을 받는 것으로 판단되었다. 또한 EDA는 방향족 구조를 갖고 있어 친핵적 치환이 상대적으로 낮아 아민화 반응이 제한을 받는 것으로 판단하였다. 따라서 이들 결과로부터 본 연구에서는 아민화율이 가장
높은 DME를 아민화제로 사용하여 PoK의 아민화 반응을 진행하였다.
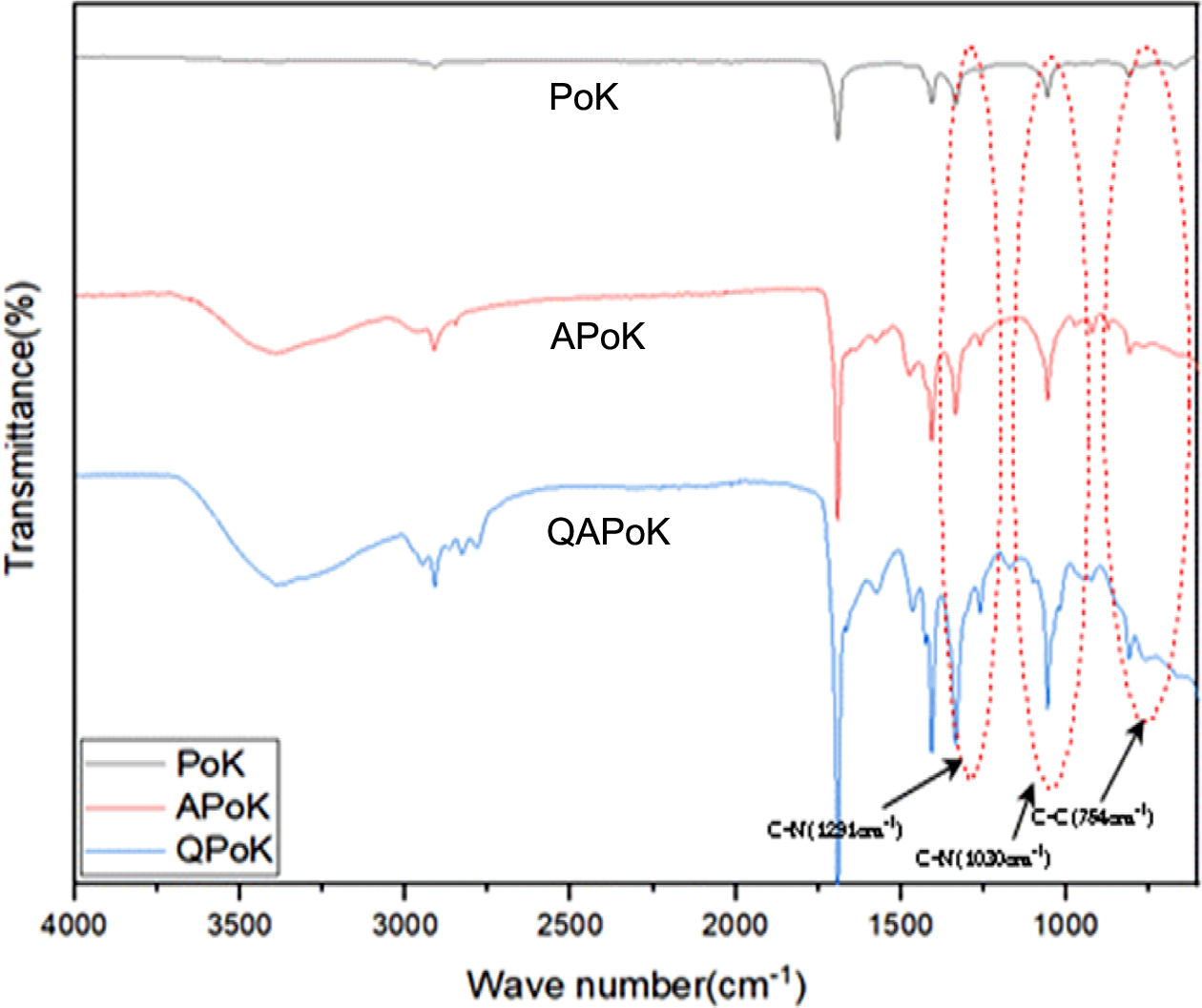
APoK 막의 4차 암모늄화 반응. APoK 막에 4차 암모늄기를 도입한 QPoK 음이온 교환막의 구조 확인을 위하여 FT-IR 스펙트럼 분석을
하였는데 그 결과가 Figure 4에 나타나 있다.
Figure 4에서 보는 바와 같이 APoK 막에 4차 암모늄기가 도입됨에 따라
1291, 1030 cm-1에서 나타나는 C-N 특성피크
세기가 증가하였고, 특히 4차 암모늄기의 메틸기에 의한 754 cm-1 부근에서 나타나는 C-C 굽힘 진동피크가 새롭게 나타나는 것으로 보아
QPoK 음이온 교환막이 합성되었음을 확인할 수 있었다.
PoK 막의 아민화 전환율 측정. PoK 막의 아민화 전환율을 구하기 위하여 EDS 분석 결과를 토대로 아민화 반응 전후 막의 원소의 조성변화를
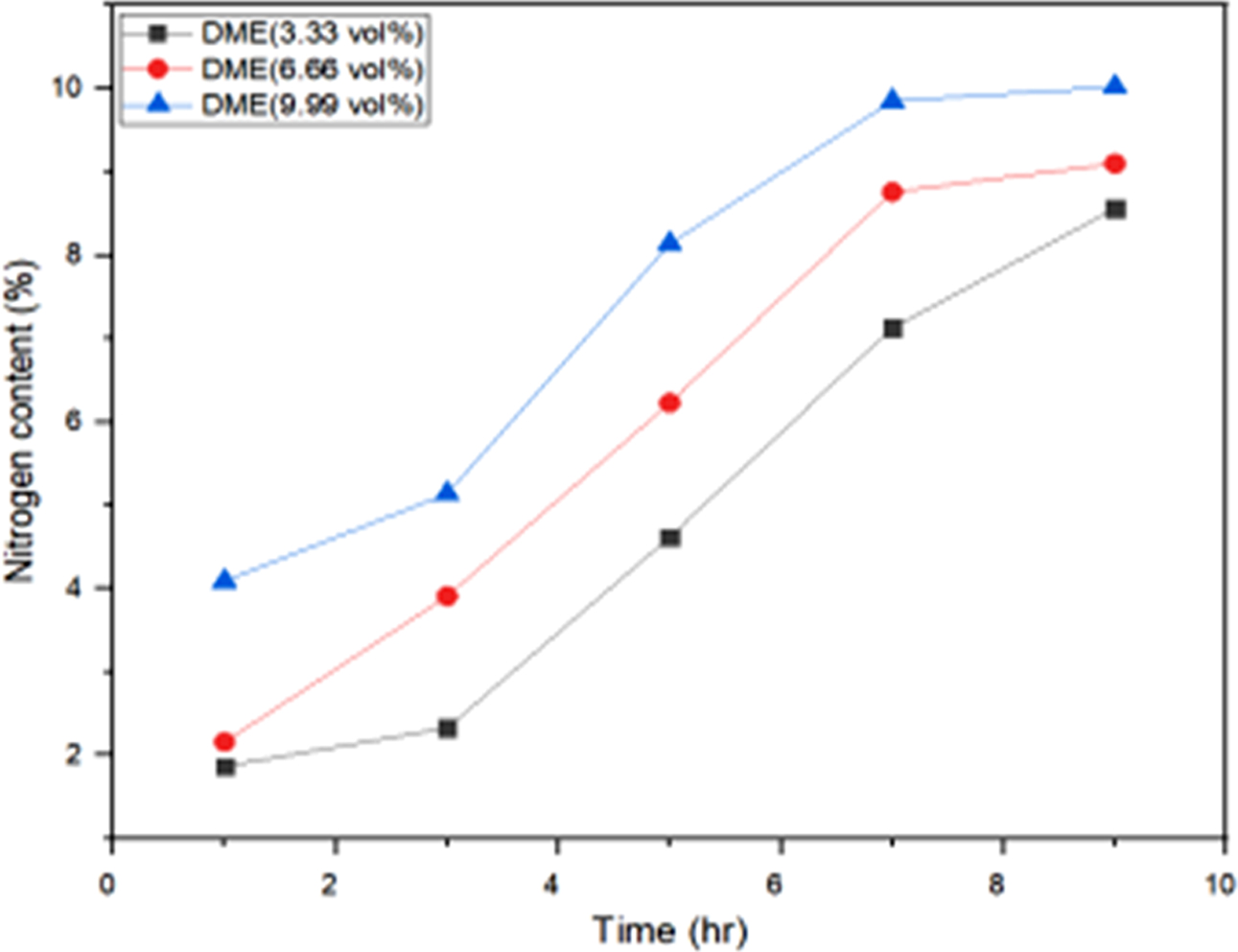
측정하고, 질소함량 변화를 기준으로 아민화율을 Figaroa 등의27 방법에 따라 계산하였는데 그 결과가 Figure 5에 나타나
있다. 본 연구에서 아민화율은 Figaroa 등이27 제안한 반응 메커니즘에서 2분자의 산소와 2분자의 질소원자가 치환되는
반응을 토대로 계산하였는데 Figure 5에서 보는 바와 같이 PoK의 아민화율은 DME의 농도와 반응시간이 증가함에 따라 질소함량은
선형적으로 증가하는 경향을 보이고 있으며, 최대 아민화율은 10%까지 증가하였다. 또한 전환율을 반응 전후의 무게법에 의하여 측정한 결과 전환율은
APoK의 질소함량이 증가함에 따라 증가하였으며 DME 농도 9.99 vol%, 반응시간 9시간에서 최대 52%의 아민화 전환율을 나타내었다.
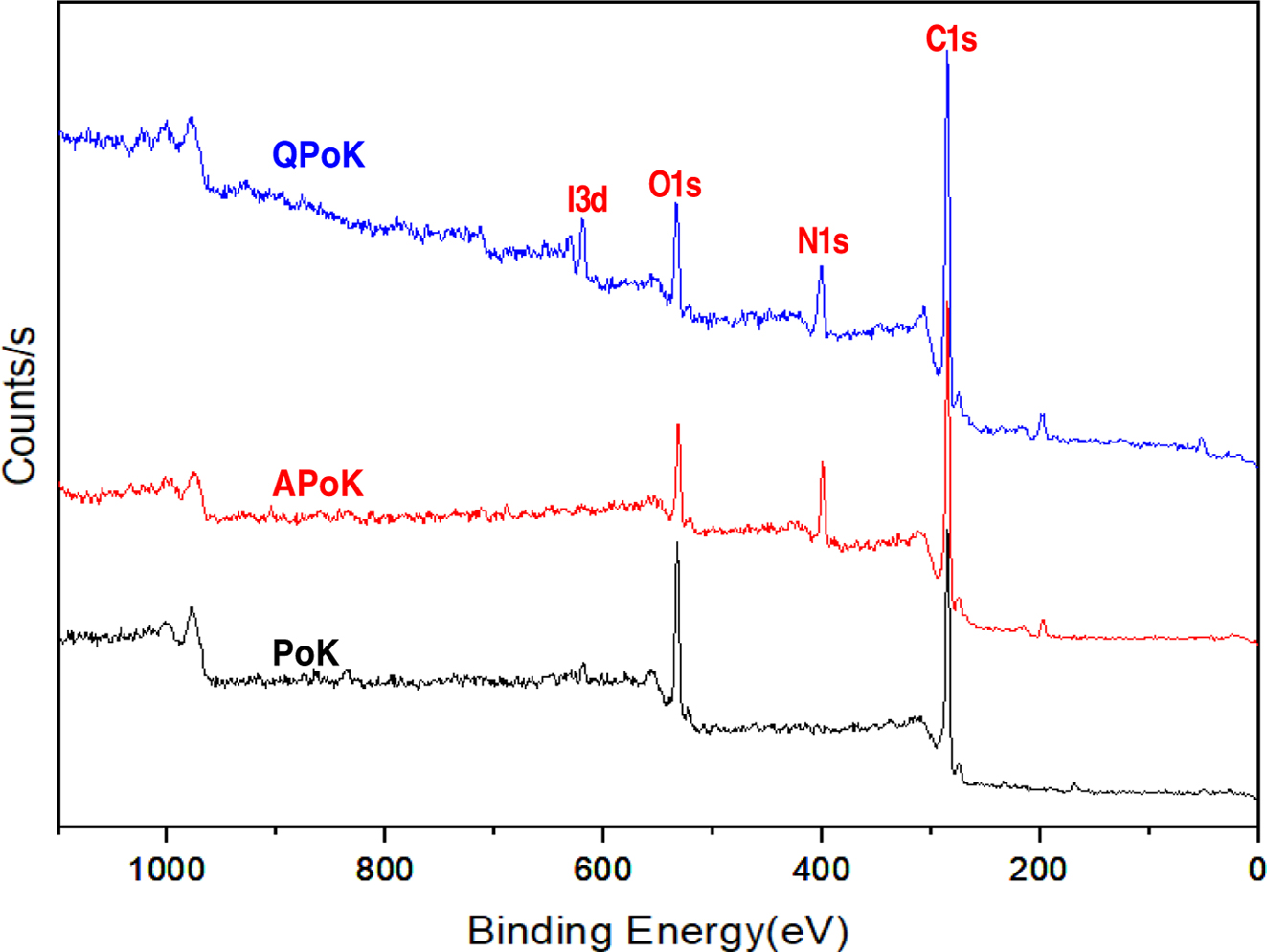
XPS 분석. APoK 막의 4차 암모늄화 반응을 통해 QPoK 음이온 교환막을 합성하고 4차 암모늄기의 도입여부를 정량적으로
확인하기 위하여 XPS 분석으로 QPoK 이온교환막의 원소의 조성을 확인한 결과를 Figure 6에 나타냈다. Figure 6 에서 보는
바와 같이 아민화 및 4차 암모늄화 반응이 진행됨에 따라 반응 전 PoK 막에서 나타나지 않던 질소 특성피크가 binding energy
400 eV에서 N1s 피크가 나타나고 이들의 피크 세기는
4차 암모늄화 반응이 진행될수록 증가하는 경향을 보였다. 또한 4차 암모늄기가 APoK 막에 도입됨에 따라 APoK 막에서 나타나지 않는
binding energy 625 eV에서 I(Iodine)의 3d 특성피크가 나타나는
것으로 보아 4차 암모늄화 반응이 진행되었으며 이를 통해 강염기성 QPoK 음이온교환막이 합성되었음을 확인할 수 있었다.
SEM 모폴로지 관찰. PoK로부터 아민화반응과 4차 암모늄화반응을 통해 합성한 APoK, QPoK 막의 표면을 SEM으로 모폴로지를
관찰하였는데 그 결과를 Figures 7과 8에 각각 보였다. 반응 전 PoK 막의 SEM
사진에서 보는 바와 같이 막 표면에 미세기공이 없이 균일한 형태를 보였으며, 아민화제의 농도와 시간을 달리하여 합성한 APoK 막의 경우 반응이
진행됨에 따라 막 표면의 거칠기(roughness)가 증가하는 경향을 보였다. DME 농도의 변화에 따라서는 모폴로지가 크게 변하지 않았으나,
아민화 반응시간이 증가함에 따라 표면 거칠기는 증가하였으며 아민화 반응시간이 5시간 이상에서 합성한 APoK 막의 표면 거칠기가 급격히 증가하면서
시간이 경과될수록 blister 및 pin hole과 같은 육안으로 관찰할 수 있는 기공이 형성되었음을 확인할 수 있었다.
이러한 원인은 아민화
반응이 진행됨에 따라 PoK 막 표면에 도입된 아민기에 의해 결합구조가 bulk 해지기 때문이며 4차 암모늄화 음이온 교환막의 경우 관능기에 의한
분기가 형성됨으로써 막 표면이 불규칙해지면서 나타난 것으로 사료되었다. 또한 이러한 현상은 Schaub 등이28 발표한 연구결과와
잘 일치하는 경향을 보였다.
또한 본 연구에서는
PoK의 물리적 특성을 유지할 수 있는 범위의 아민화율을 고려하여 DME 농도 6.66 vol%, 5시간 반응시켜 합성한 아민화 폴리케톤(APoK-8)
막을 토대로 4차 암모늄화 반응을 진행한 QPoK 음이온 교환막의 SEM 모폴로지를 관찰하였는데 그 결과가 Figure 8에 나타나
있다. Figure 8에서 보는 바와 같이 QPoK 이온교환막의 표면은 4차 암모늄화 반응시간이 증가함에 따라 약간 거칠기가 증가하는 경향을 보였으나 큰 차이가 없는 것을 확인할 수
있었다. 이들 결과로부터 본 연구에서 합성한 QPoK 음이온 교환막의 반응에 의한 물성변화로 막의 성능을 저하시키지 않을 것으로 판단되었다.
QPoK 막의 성능 시험. APoK 막을 4차 암모늄화 반응에 의하여 합성한 QPoK 음이온 교환막에 대하여 막 특성을 평가할 수 있는 성분인 함수율, 팽윤율, 이온교환용량, 전기저항, 전기전도도 및 인장강도와 신장률 등의 측정값을
Table 3에 나타냈다. Table 3에서 보는 바와 같이 동일한 DME 농도에서 반응시간이 증가함에 따라 이온교환용량은 증가하였으며 아민화제의
농도 3.33 vol% DME에서 합성한 음이온 교환막(QPoK-1)의
이온교환용량 값은 0.18~0.6 meq/g이었으며, 6.66 vol% DME 농도에서 반응시킨 이온교환막(QPoK-2)의 이온교환용량은
0.36~0.75 meq/g이었고, 9.99 vol% DME 농도에서 합성한
이온교환막(QPoK-3)의 이온교환용량은 0.38~0.82 meq/g의 값을 각각 나타내었다.
QPoK 음이온 교환막의 이온용량은 Table 3에서 보는 바와 같이 반응시간 및 DME 농도에 따라 모두 증가하는
경향을 보였으며, 반응시간 및 DME의 농도가 증가함에 따라 이온교환용량의 증가폭이 다소 줄어드는 경향을 보였다. 또한 본 연구에서 합성한
QPoK 음이온 교환막의 이온교환용량은 최대 0.82 meq/g으로 불소계 Nafion N117 이온교환막의 이온교환용량 값(ca. 0.95
meq/g)과 비슷한 수준으로 나타나는 것으로 보아 본 연구에서 합성한 PoK 이온교환막은 내구성만 보완한다면 불소계 막의 대체용으로
사용할 수 있을 것으로 판단된다.29,30
또한 관능화제의 농도와
반응시간을 달리하여 합성한 QPoK(QPoK-1, QPoK-2, QPoK-3) 음이온 교환막의 함수율은 각각 95~135%, 100~141%, 107~170%로 관능화제의
농도와 시간이 증가함에 따라 증가하였다. 이렇게 함수율이 증가하는 이유는 PoK 막에 4차 친수성 4차 암모늄기가 도입됨에 따라 막의 친수성이
증가하기 때문으로 사료되었다.
한편, 막의 팽윤율은
동일조건에서 측정한 함수율 값의 변화에 비례하는 경향을 보였다. 그러나 기계적 물성 즉 인장강도와 elongation 값은 관능화 반응이 진행됨에
따라 낮아지는 경향을 보이는 것으로 보아 PoK 막의 불소화 막 대체용으로 사용하기 위해서는 부분 가교반응
또는 화학반응을 통한 내부 분자구조의 변화를 통해 내구성을 향상시키는 연구가 진행되어야 할 것으로 판단되었다.
본 연구에서 아민화제
및 반응시간을 변화시켜 함성한 QPoK 음이온 교환막의 전기저항은 반응시간과 DME 농도가 증가함에 매우 낮게 나타난 반면 전기전도도는 증가하는
것으로 보아 본 연구에서 합성한 QPoK 음이온 교환막의 기계적 물성 즉 내구성을 보완한다면 불소계 이온교환막의 대체 소재로 사용이 가능할 것으로 판단되었다.
RSM에 의한 QPoK 막 합성공정 최적화. 물리화학적 특성값의 최적화 조건은 Table 3에서 제시한 QPoK 막의 물리화학적 특성 값으로부터
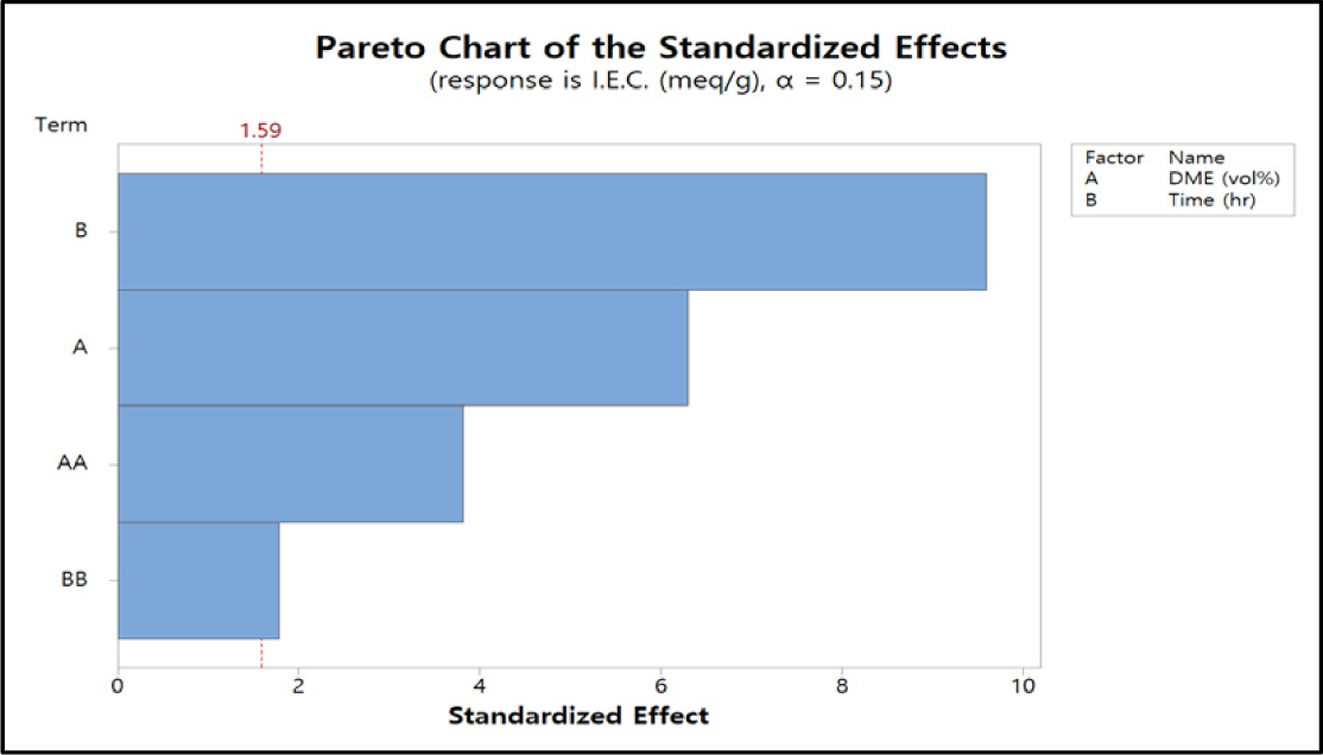
Minitab 18 Version으로 RSM을 분석하여 얻은 이온교환용량 값에 영향을 미치는 반응변수의 영향도를 Figure 9의
pareto chart로 표현하고 Figure 10은 잔차분석 결과를 도시한 것이다. 이 그림에서 알 수 있듯이 반응인자 중 DME 농도보다
반응시간이 더 큰 영향을 주는 것을 알 수 있다. 물론 DME 농도 또한 표준화된 효과의 유의수준 a 값이 1.59보다 높은 것을 알 수 있다. 따라서 QPoK 음이온 교환막의 이온교환용량에 영향을 주고 교호작용도 있음을 확인할 수 있었다.
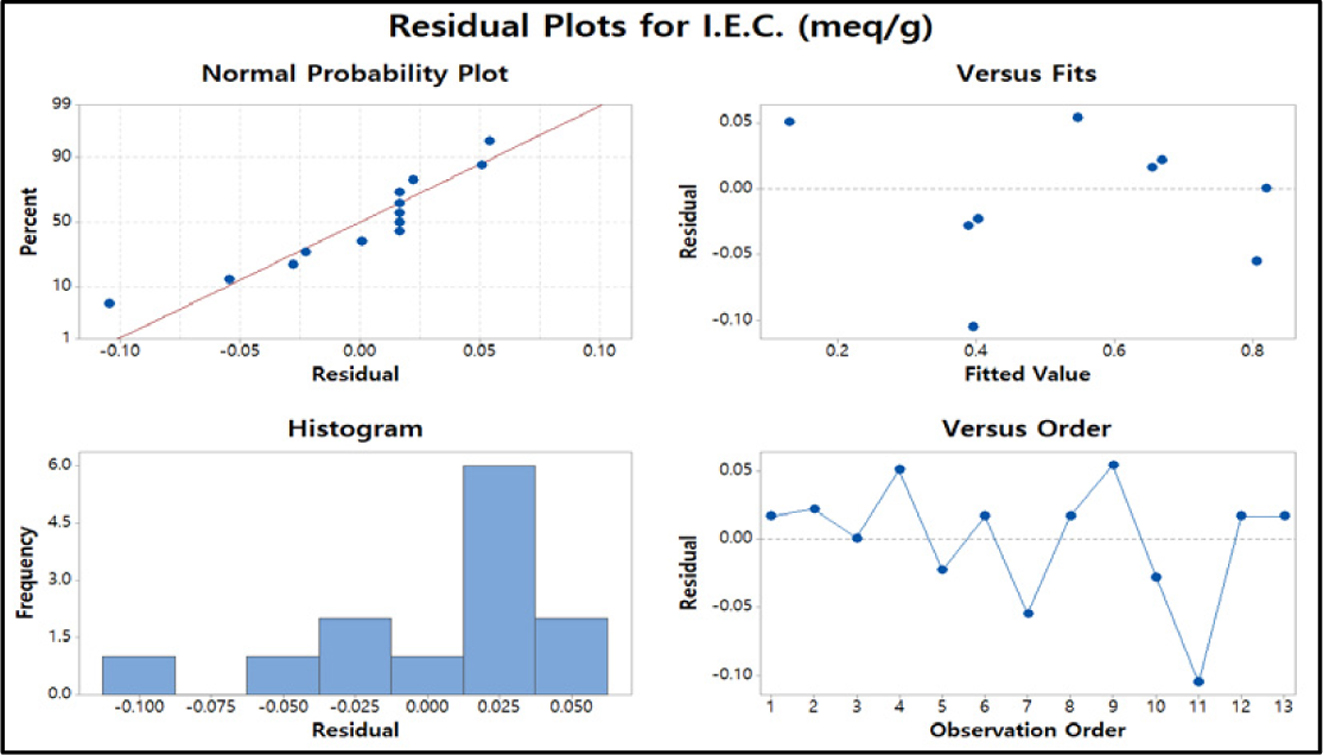
또한 잔차분석 결과의 정규확률도 분석결과 직선에 따라 정규분포를 따른다고 판단할 수 있으며 잔차 대 적합치는 0을 기준으로 분산된 그림을 보여주고
있다. 그러나 histogram에서는 범위 내에서 정규분포를 보이고 있다.
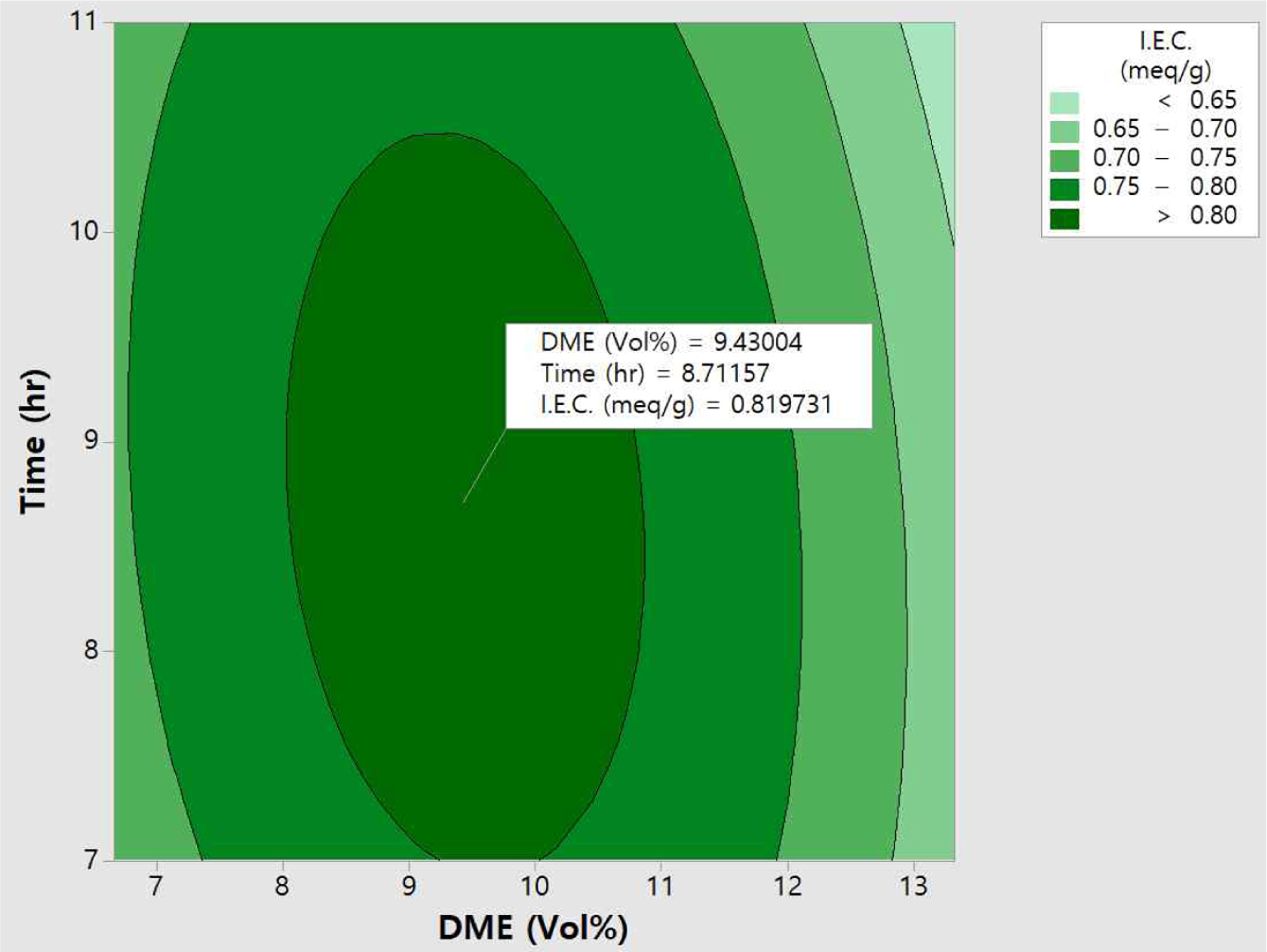
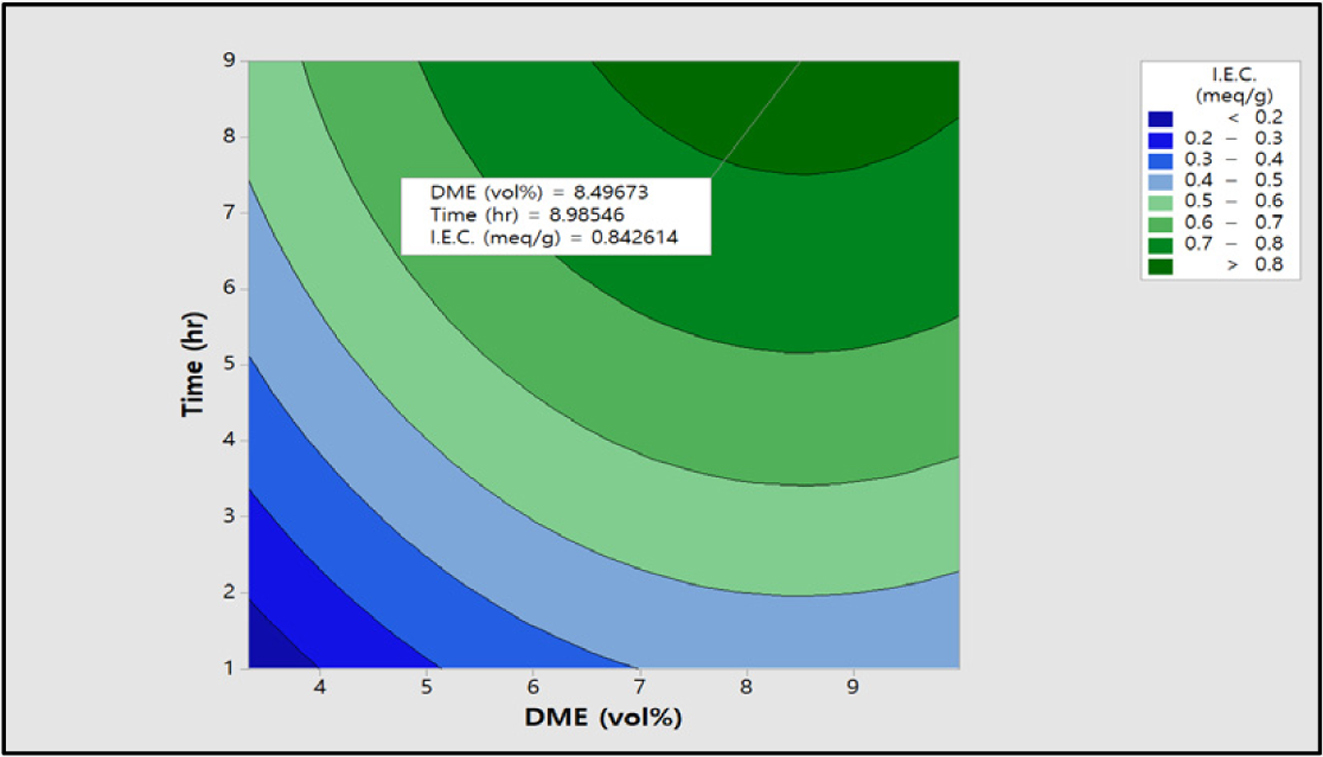
Figure 11에는 이온교환용량
값에 미치는 반응변수 DME 농도와 반응시간에 대한 contour plot 그림이다. Figure 11에서 알 수 있듯이 DME 농도가 증가하고 반응시간이
2시간에서 8시간으로 증가하면 이온교환용량 값이 선형적으로 증가하는 것을 확인할 수 있다. 이 그림에서도 앞의 표준화 효과에서 설명한 바와 같이
DME 농도보다 반응시간이 영향이 큰 것을 다시 한 번 확인하였다. 이때의 최대 이온교환용량은 0.8 meq/g 이상으로 DME 농도와 반응시간이 상호 반응인자임을
확인할 수 있으며, 이들 결과로부터 아민화제 농도와 반응시간과의 교호작용이 존재하는 것을 확인하였다.
Figure 12는 이온교환용량
값에 대한 DME 농도와 반응시간에 대한 maximum optimization plot한 것이다. Figure 12에서 보는
바와 같이 이온교환용량 y의 최대 값은 0.843으로 나타났다.
그리고 만족도 d 값은 1.0으로 이온교환용량 값을 증가시키기 위해서는 DME 농도를 9.99 vol%로 증가시키고 반응시간을 9시간으로 조절하면 이온교환용량을
최대 0.84 meq/g까지 증가시킬 수 있을 것으로 판단되었다.
QPoK 막의 분산분석. 본 연구에서 도출한 각 성분들 값에 영향을 미치는 각 성분의 통계적 관점에서 Anova 측정 결과와 변위들의 분산된 정도를 분석하였는데
그 결과가 Table 4에 나타나 있다.
Table 4는
respective response에 대한 각 성분들에 미친 반응변수에 대한 영향도와 표준편차, 그리고 R-sq 값, R-sq
adjusted 값, 그리고 R-sq predicted 값을 통하여 본 연구에서 도출한 최적화모델에 대한 상관성(reliability)에
대하여 평가한 결과이다. 이 결과는 각 성분들에 대한 최적화 모델제안에 대하여 매우 유용한 방법임을 확인할 수 있었다. 이들 결과는 Ahmad
등의31 RSM에 의한 열적, 기계적 신축 막 성능의 최적화 연구에서 사용한 기법에서 나타나고 있는 결과와 잘 일치하는 경향을
보였다.
Table 4에서
보는 바와 같이
QPoK 음이온 교환막의 이온교환용량, 전환율, 인장강도. 신장률 등이 R-sq 값이 0.9 이상으로 나타났다. 그러나 표준편차에서는 함수율과 막의 인장강도는 각각
3.38%, 1.85 kgf/mm2로 높은 편차 값을 보였으며,
위 성분들과는 다르게 이온교환용량 값은 0.053 meq/g, 전기저항 0.026 W·cm2, 팽윤율은 0.30%으로 상대적으로 낮았다.
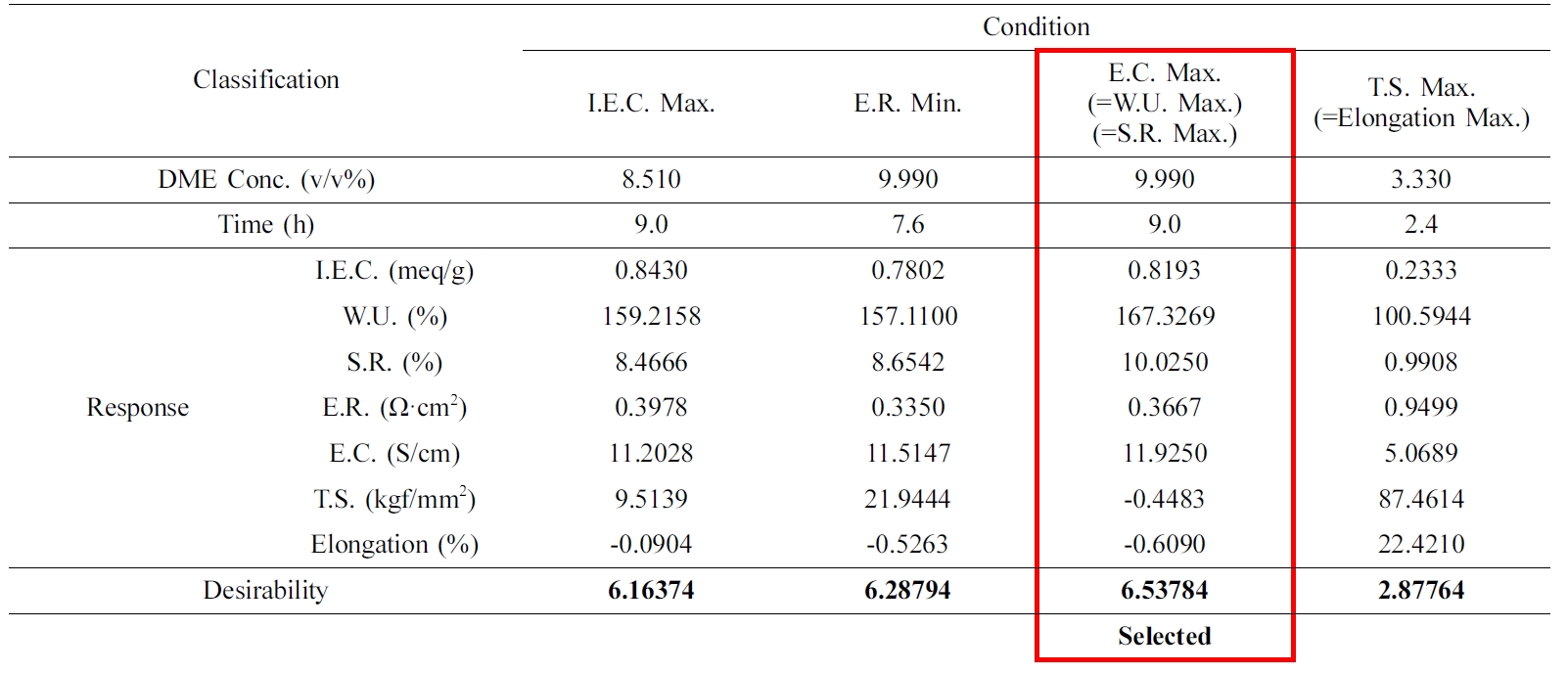
QPoK 막의 Optimal Desirability. Table 5는 Ahmad 등의 연구 방법과32 본 연구에서 채택한
RSM 프로그램인 Minitab 18의 response optimizer 방법을 통해 각 response의 optimal
desirability(D 값)을 구하여 얻은 결과를 요약한 것이다. 이때의 분석방법은 각 response의 D값은
1점이 최대로 하고, 각 성분의 중요도에 따라서 가중치를 이온교환용량, 함수율, 팽윤율의 가중치를 1.4, 전기저항, 전기전도도의 가중치를 1.2, 그리고 인장강도와 elongation의 가중치를 각각 1.0로 부여하고
각 항목에 따라 곱해주어 얻은 값이다. 이와 같이 각 response 값을 전체를 합하여 10점 기준으로 desirability를 평가하고 순위를 정하였다. 이와 같이 경우의 수를 정하여
최대 이온교환용량, 최대 함수율, 최대 전기전도도 및 전기저항,
팽윤율을 판정한 결과 desirability는 6.53에서 6.16 범위에 있었다. 그러나 인장강도와 elongation은 2.87로서 낮은 값을
보였다. 이러한 결과는 QPoK 음이온 교환막의 물리화학적 특성을 조절하고 최적의 막 성능을 구현하기 위해서는 인장강도와 신장률의
consistency 확보가 중요한 요소임을 확인할 수 있었다.
QPoK 막에 대한 Optimal Desirability의 확인. Table 6은 Table 5에서 response optimization으로 제시된 조건으로 실험계획을 재설계한
내용이다. 이 조건에서 얻은 이온교환막의 주요 특성성분인 이온교환용량, 팽윤율, 전기전도도를 선정하고 실험을 진행하여 유효성 검증을 실시한 것이다.
Response optimization에서 제시된 two factorial 범위에서 반응조건을 DME 6.66, 9.99, 13.32 vol%와
반응시간은 7, 9, 11시간으로 각각 설정하여 진행하였다. 그 결과를 Table 6에 제시하였다.
이온교환용량 값의
경우 기존 반응에서 최대 조건인 DME 9.99 vol%와 9시간을 기준으로 DME 농도와 반응시간이 증가하면서 최대 이온교환용량 값은
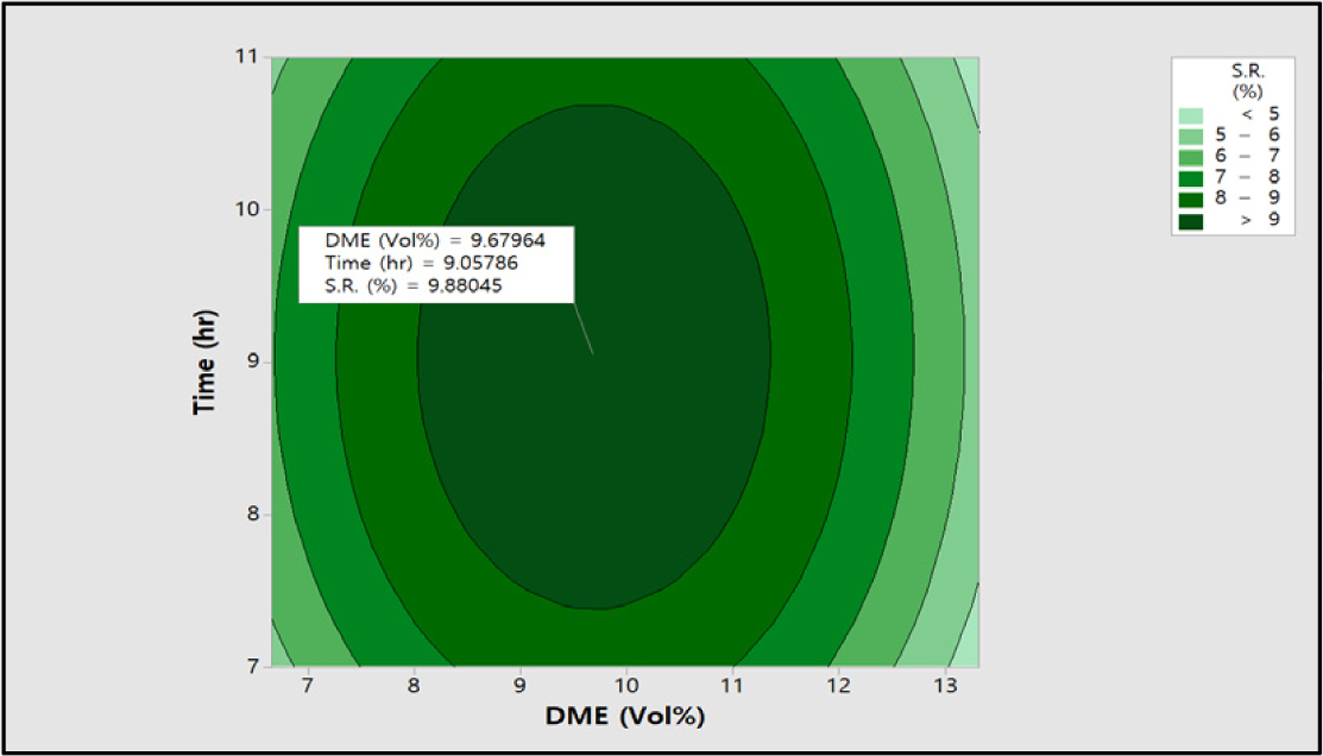
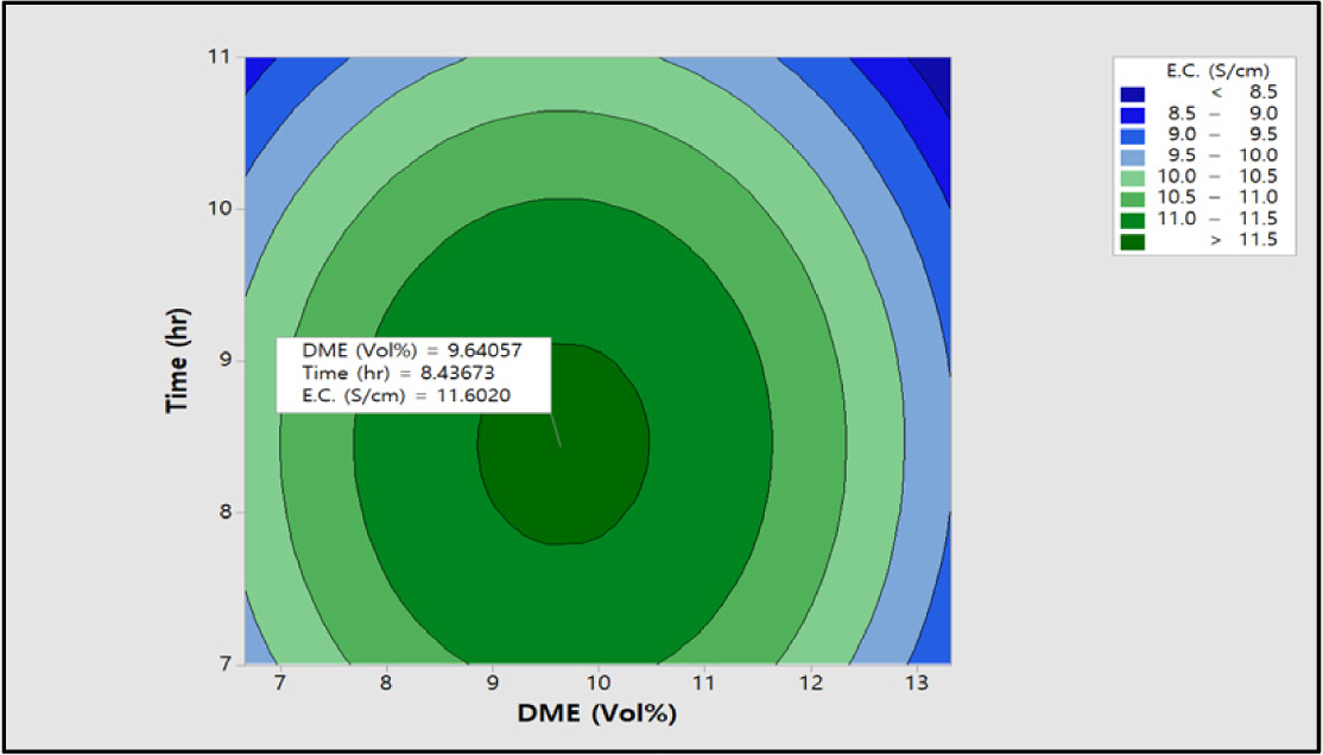
0.82에서 0.63 meq/g까지 감소하였다. 팽윤율과 전기저항 값 역시
기존 반응에서 최대 조건인 DME 9.99 vol%와 9시간을 기준으로 DME 농도와 반응시간이 증가하면서 팽윤율은 최대 10.1%에서 4.7%까지
감소하였고, 전기전도도 역시 최대 11.7에서 8.6 S/cm까지 감소하였다.
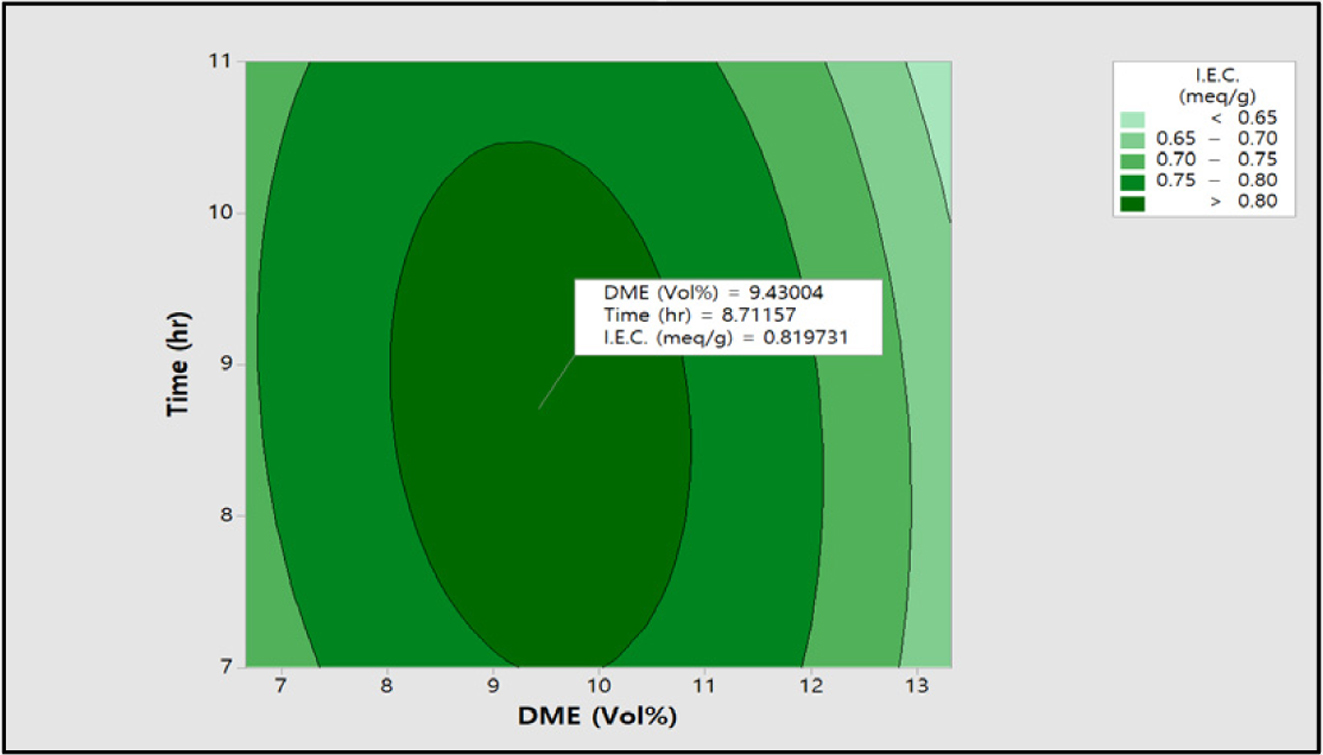
이 실험을 통해 얻은
데이터(I.E.C., S.R., E.C.)를 이용하여 RSM 분석을 실시하였으며, 이에 대한 contour plot를 Figure 13, 14, 15에 각각 도시하였다. Figure 13에서 보는 바와 같이 이온교환용량은 DME
9.43 vol%, 반응시간 8.7시간에서 0.82 meq/g 최적화된 값을 확인할 수 있었으며, 팽윤율은
Figure 14에 나타낸 바와 같이 DME 9.68 vol%, 반응시간 9.05시간에서 9.8%로 나타났다. 그리고
전기전도도 값은 Figure 15에 도시한 바와 같이 DME 9.64 vol%, 반응시간 8.44시간에서 11.6 S/cm로 최적화할 수 있었다. 이러한 측정값은
Table 5에서 제시한 desirability의 조건에 잘 일치하는 것으로 확인할 수 있었다. 이와 같은 desirability의
indices 평가는 Trautmann과33 Chabbi 등의23 연구에서 제시한 방법을 적용한 것이다.
Desirability
기능접근 방법의 목표는 반응의 최적화를 결정하는 것으로서 이와 같은 기술은 다반응 최적화를 위하여 변위에 비의존적이고 반응조건을 찾아내는 특성이
있으므로 반응공정의 최적화 또는 근사최적화 값을 구하는데 유용하다고 판단되었다. 따라서 QPoK 음이온 교환막의 최적 합성조건은 DME 농도
9.43 vol%, 반응시간 9시간으로 각각 확정할 수 있었다.
|
Figure 3 FTIR spectra of PoK and APoK membranes DME concentration (6.66 vol%) and reaction time (h): (a) 1; (b) 3; (c) 5; (d) 7; (e) 9. |
|
Figure 4 FTIR spectra comparison for PoK, APoK and QPoK membranes. |
|
Figure 5 Nitrogen contents of APoK membranes synthesized in various reaction time and DME concentration. |
|
Figure 6 Typi cal X PS s pectra o f P oK, A PoK a nd Q PoK m embranes. |

|
Figure 8 SEM photographs of PoK and QPoK membranes synthesized based on the APoK-8 at different reaction time (h): (a) 12; (b) 24; (c) 36; (d) 48; (e) 60. |
|
Figure 9 Pareto chart of I.E.C. |
|
Figure 10 Residual plots of I.E.C. |
|
Figure 11 Contour plot of I.E.C. (meq/g) vs time (h), DME (vol%). |

|
Figure 12 Maximum optimization plot of I.E.C (meq/g) vs DME (vol%) and time (h). |
|
Figure 13 Contour plot of I.E.C. (meq/g) vs time (h), DME (vol%). |
|
Figure 14 Contour plot of S.R. (%) vs time (h), DME (vol%). |
|
Figure 15 Contour plot of E.C. (S/cm) vs time (h), DME (vol%). |
|
Table 3 Physicochemical Properties of QPoK Anion Exchange Membranes |
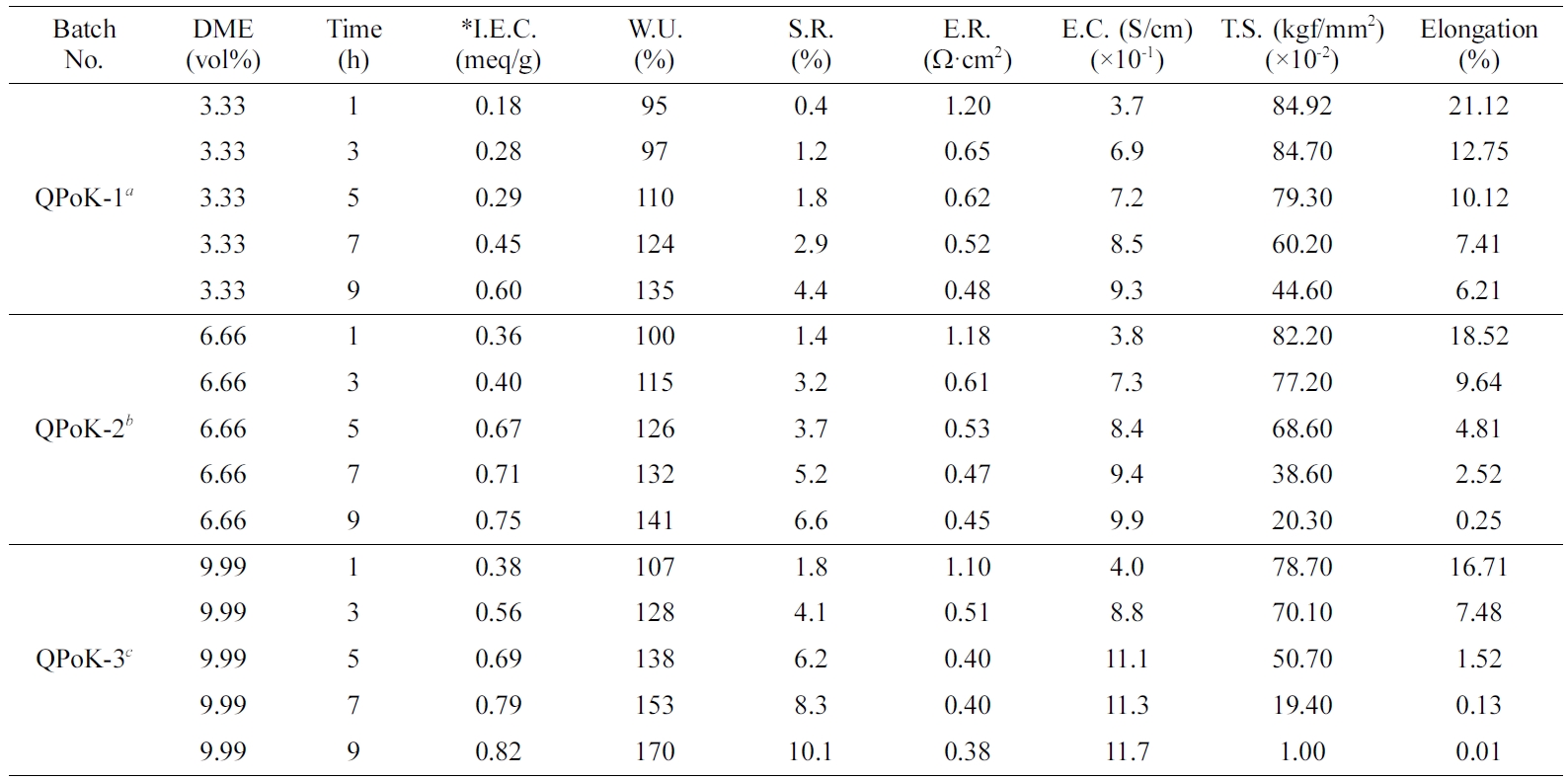
*I.E.C.: Ion exchange capacity, W.U.: Water uptake, S.R.: Swelling ratio, E.R.: Electric resistance, E.C.: Electric conductivity, T.S.: Tensile strength. aQPoK-1: DME content=3.33 vol%, Temp.=70 oC. bQPoK-2: DME content=6.66 vol%, Temp.=70 oC. cQPoK-3: DME content=9.99 vol%, Temp.=70 oC. |
|
Table 4 Summary of ANOVA and Regression Analysis for the Responses |
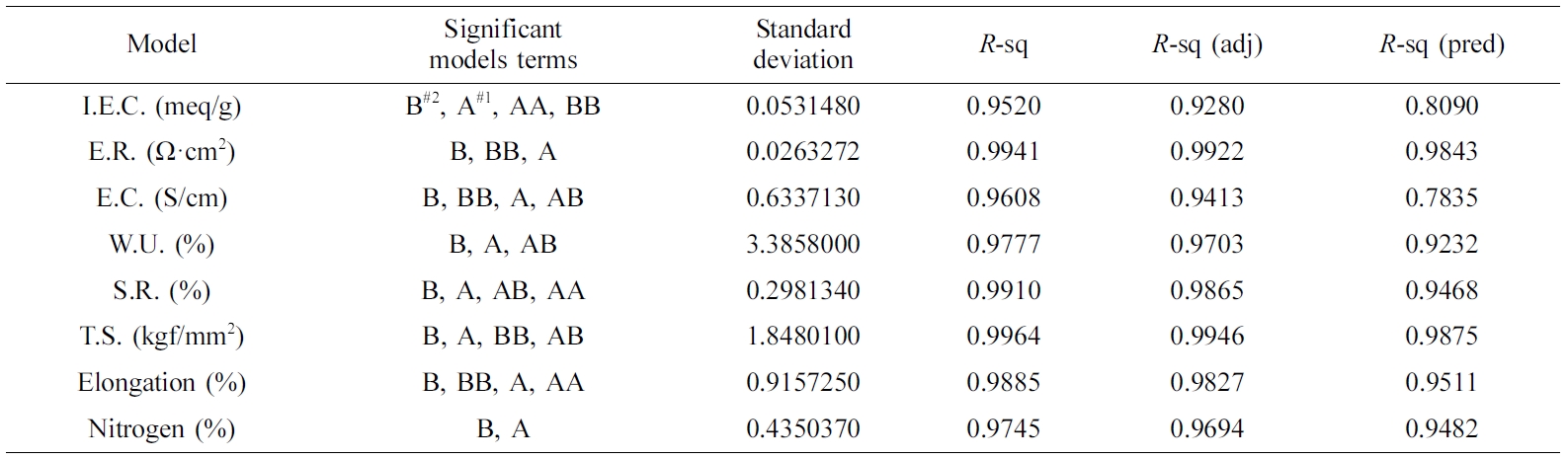
A#1: DME (vol%). B#2: Time (h). |
본 연구는 폴리케톤
고분자의 화학표면개질 방법에 의한 아민화(amination) 및 4차 암모늄화(quaternary ammonium) 반응을 통해 4차 암모늄화
폴리케톤 음이온교환막(QPoK)을 합성하고, 이들의 물리화학적 특성과 RSM 분석방법을 통한 최적 합성공정변수를 도출한 결과 다음과 같은 결론을
얻었다.
1. QPoK 음이온 교환막의 아민화율은
아민화제(DME)의 농도 및 반응시간이 증가함에 따라 증가하였으며 최대 아민화율은 52.7%이었다. 이온교환용량, 함수율 및 팽윤율은 아민화율과
질소 함량증가와 비례적 상관을 보였다.
2. PoK 음이온 교환막의 최대
이온교환용량은 0.82 meq/g, 팽윤율은 10.1%이었다. 음이온 교환막의 인장강도와 신장률은 관능화 전 PoK 막보다 낮았으며,
PoK 음이온 교환막의 수처리 및 연료전지 분리막으로 사용하기 위해서는 가교방법과 내부구조의 변화를 통한 막의 내구성 향상 연구가 필요할 것으로
판단된다.
3. RSM으로부터
얻은 response optimization desirability의 indices 평가는 다반응의 최적화를 결정하는 기술로 의미가 있었으며,
변위에 비의존적이고 반응조건을 찾아내는 요소로 활용이 가능하여 최적화 또는 근사최적화 값을 구하는데 유용하였다. 따라서 QPoK 음이온 교환막의
최적 합성공정 조건은 DME 농도 9.43 vol%, 9시간 반응이 PoK 음이온 교환막 합성의 최적 합성조건임을 도출하였다.
- 1. D. H. Lee, Y. S. Kang, and J. H. Kim, Macromol. Res., 17, 104 (2009).
-

- 2. J. Ran, L. Wu, Y. He, Z. Yang, and Y. Wang, J. Membr. Sci., 522, 267 (2017).
-

- 3. Y. Yang, and S. Holdcroft, Fuel Cells, 5, 171 (2005).
-

- 4. H. S. Park, Y. S. Kim, W. H. Hong, Y. S. Choi, and H. K. Lee, Macromolecules, 38, 2289 (2005).
- 5. K. S. Kang, Development of high-performance desalination electrode and purification module dispersed by carbon nano materials, MSIP Government Project R, Republic of Korea. 201402310 (2015).
- 6. J. H. Choi, Sep. Purif. Technol., 70, 362 (2010).
-

- 7. R. A. Becerra-Arciniegas, R. Narducci, G. Ercolani, S. Antonaroli, E. Sgreccia, L. Pasquini, P. Knauth, and M. L. Di Vona, Polymer, 185, 121931 (2019).
-

- 8. J. Y. Lee, J. H. Lee, S. B. Ryu, S. H. Yun, and S. H. Moon, J. Membr. Sci., 478, 19 (2015).
-

- 9. I. S. Kim, S. Y. Hwang, B. G. Kang, and T. S. Hwang, Korean Chem. Eng. Res., 57, 65 (2019).
-

- 10. J. Guo, Y. Ye, S. Gao, and Y. Feng, J. Mol. Catal. A-Chem., 307, 121 (2009).
-

- 11. W. P. Mul, H. Dirkzwager, A. A. Broekhuis, H. J. Heeres, A. J. van der Linden, and A. G. Orpen, Inorganica Chim. Acta, 327, 147 (2002).
-

- 12. C. Bianchini and A. Meli, Coord. Chem. Rev., 225, 35 (2002).
-

- 13. B. L. Rivas, E. D. Pereira, and I. Moreno-Villoslada, Prog. Polym. Sci., 28, 173 (2003).
- 14. T. S. Hwan, A Development of commercial application technologies on ion selective core materials and parts, MSIP Government Project R, Republic of Korea (2014).
- 15. Y. J. Kim, C. W. Hwang, S. M. Hyeon, A. Canlier, and T. S. Hwang, Macromol. Res., 25, 898 (2017).
-

- 16. Y. S. Jung, A. Canlier, and T. S. Hwang, Polymer, 141, 102 (2018).
-

- 17. S. Y. Hwang, J. B. An, B. C. Park, T. K. Kim, and T. S. Hwang, J. Ind. Eng. Chem., 81, 464 (2020).
-

- 18. S. Y. Hwang, J. J. Kim, E. J. Park, and T. S. Hwang, Macromol. Res., 28, 465 (2020).
-

- 19. I. S. Kim, C. W. Hwang, Y. J. Kim, A. Canlier, K. S. Jeong, and T. S. Hwang, Macromol. Res., 25, 1063 (2017).
-

- 20. A. Navarro, C. del Rio, and J. L. Acosta, J. Polym. Sci., Part B: Polym. Phys., 46, 1684 (2008).
-

- 21. M. A. Park, Preparation and Characterization of Anion Exchange Membranes with a Pore-Filling Structure for Vanadium Redox Flow Battery Application, RISS (2014).
- 22. M. M. Momeni, D. Kahforoushan, F. Abbasi, and S. Ghanbarian, J. Environ. Manage., 211, 347 (2018).
-

- 23. M. Chabbi, M. A. Yallese, I. Meddour, M. Nouioua, T. Mabrouki, and F. Girardin, Measurement, 95, 99 (2017).
-

- 24. N. Ataoliahi, K. Vezzu, G. Nawn, G. Pace, G. Cavinato, F. Girardi, P. Scardi, V. D. Noto, and R. D. Maggio, Electrochim. Acta, 226, 148 (2017).
-

- 25. T. Soboleva, Z. Xie, Z. Shi, E. Tsang, Navenssin, and S. Holdcroft, J. Electroanal. Chem., 622, 145 (2008).
-

- 26. D. L. Pavia, G. M. Lampman, G. S. Kriz, and J. A. Vyvyan, Introduction to spectroscopy, BROOKS/COLE Cengage Learning, Belmont, 2008.
- 27. P. A. Figaroa, H. Miedema, G. J. Euverink, and F. Picchioni, Pure Appl. Chem., 89, 41 (2017).
-

- 28. N. J. Schaub, C. Le Beux, J. Miao, R. J. Linhardt, J. G. Alauzun, D. Laurencin, and R. J. Gilbert, PloS One, 10, e0136780 (2015).
-

- 29. K. A. Mauritz and R. B. Moore, Chem. Rev., 104, 4535 (2015): D. Rana and T. Matsuura, Chem. Rev., 110, 2448 (2008).
-

- 30. M. N. Tsampas, A. Pikos, S. Brosda, A. Katsaounis, and C. G. Vayenas, Electrochim. Acta, 51, 2743 (2006).
-

- 31. A. L. Ahmad, S. C. Low, S. R. Abd Shukor, and A. Ismail, Sep. Purif. Technol., 66, 177 (2009).
-

- 32. M. M. Momeni, D. Kahforoushan, F. Abbasi, and S. Ghanbarin, J. Environ. Manage., 211, 347 (2018).
-

- 33. H. Trautmann, Multiobjective optimization with desirability function and desirability indices, Drug design workshop, TU Dortmund University Germany (2009).
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(4): 459-470
Published online Jul 25, 2020
- 10.7317/pk.2020.44.4.459
- Received on Feb 6, 2020
- Revised on Mar 18, 2020
- Accepted on Mar 30, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Taek Sung Hwang
-
Department of Applied Chemical Engineering and Applied Chemistry, College of Engineering, Chungnam National University, 99 Daehak-ro, Yuseoung-gu, Daejeon 34134, Korea
- E-mail: tshwang@cnu.ac.kr,
- ORCID:
0000-0002-5462-6039










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.