- Preparation of Injectable Hydrogels Immobilized with FGF Using UV-curable Hyaluronic Acid Derivatives
Sung-Jun Min, Shin-Woong Kim, Tae-Hoon Lee, Il-Keun Kwon*, and Tae-Il Son†

Department of Systems Biotechnology, Chung-Ang University, Seodongdae-ro 4726, Anseong-si, Gyeonggi-do 17546, Korea
*Department of Dentistry, Graduate School, Kyung-Hee University, Kyungheedae-ro 26, Dongdaemun-gu, Seoul 02447, Korea- FGF가 고정화된 UV경화형 히알루론산 유도체를 이용한 Injectable한 수화젤의 제조
중앙대학교 생명공학대학 시스템생명공학과, *경희대학교 치과대학 치의학과
The aim of this study was to
prepare injectable hydrogels that can effectively deliver drugs.
Azidophenyl-hyaluronic acid derivatives (Az-HA) were prepared using natural
polymer hyaluronic acid with biocompatibility and biodegradability. It was
confirmed that azido group was successfully introduced into hyaluronic acid by
FTIR and 1H NMR analysis. In addition, The maintenance of hydrogel
properties of the prepared derivatives was examined using rheological analysis.
Protein immobilization was confirmed using the photo-immobilization method, and
the protein release experiment was conducted to confirm whether the protein
drug immobilized with Az-HA derivative was continuously released. Through
cytotoxicity test, the biocompatibility of Az-HA was confirmed. As a result of
the intracellular administration of Az-HA immobilized with fibroblast growth
factor (FGF), cell proliferation was confirmed. According to the result of the
above experiments, the prepared UV-curable Az-HA are considered to have
applicability as a biomedical material capable of effective delivery of drugs.
본 연구는 단백질약물이 고정화된 주사제 형태의 수화젤을
제조하는데 목적을 두었다. 생체적합성, 생분해성의 특징을
가지는 천연고분자 히알루론산을 이용하여 azidophenyl 히알루론산 유도체(Az-HA)를 제조하였다. FTIR 및 1H NMR 분석을 통하여
hyaluronic acid에 azido기가 성공적으로 도입되었음을 확인하였다. 또한 유변학적 분석을 통하여 제조된 유도체의 수화젤 특성 유지여부를 검토하였다. 광고정화방법을 이용하여 단백질의 고정화 가능여부를 형광현미경으로 확인하였다.
Az-HA 유도체에 고정화된 단백질약물이 지속적으로 방출되는 여부를 확인하기 위해 단백질 방출 실험을 실시하였다. 세포 독성 실험을 통하여 Az-HA의 생체적합성과 광고정화된 섬유아세포
성장인자(FGF)의 세포증식 촉진효과를 확인하였다. 위와
같은 실험결과로부터 본 연구에서 제조한 Az-HA는 효과적으로 약물 전달이 가능한 의료용 생체소재로서
활용가능성을 가질 수 있을 것으로 사료된다.
Azidophenyl hyaluronic acid (Az-HA) derivatives were
prepared by amide bond formation between the carboxyl groups of HA and the
amine groups of 4-azidoaniline. Az-HA hydrogels prepared using UV light
irradiation for stable and safe protein immobilization have mechanical
properties and biocompatibility. The
cell proliferation test confirmed that the
fibroblast growth factor (FGF) immobilized with Az-HA maintained its
growth-promoting effect.
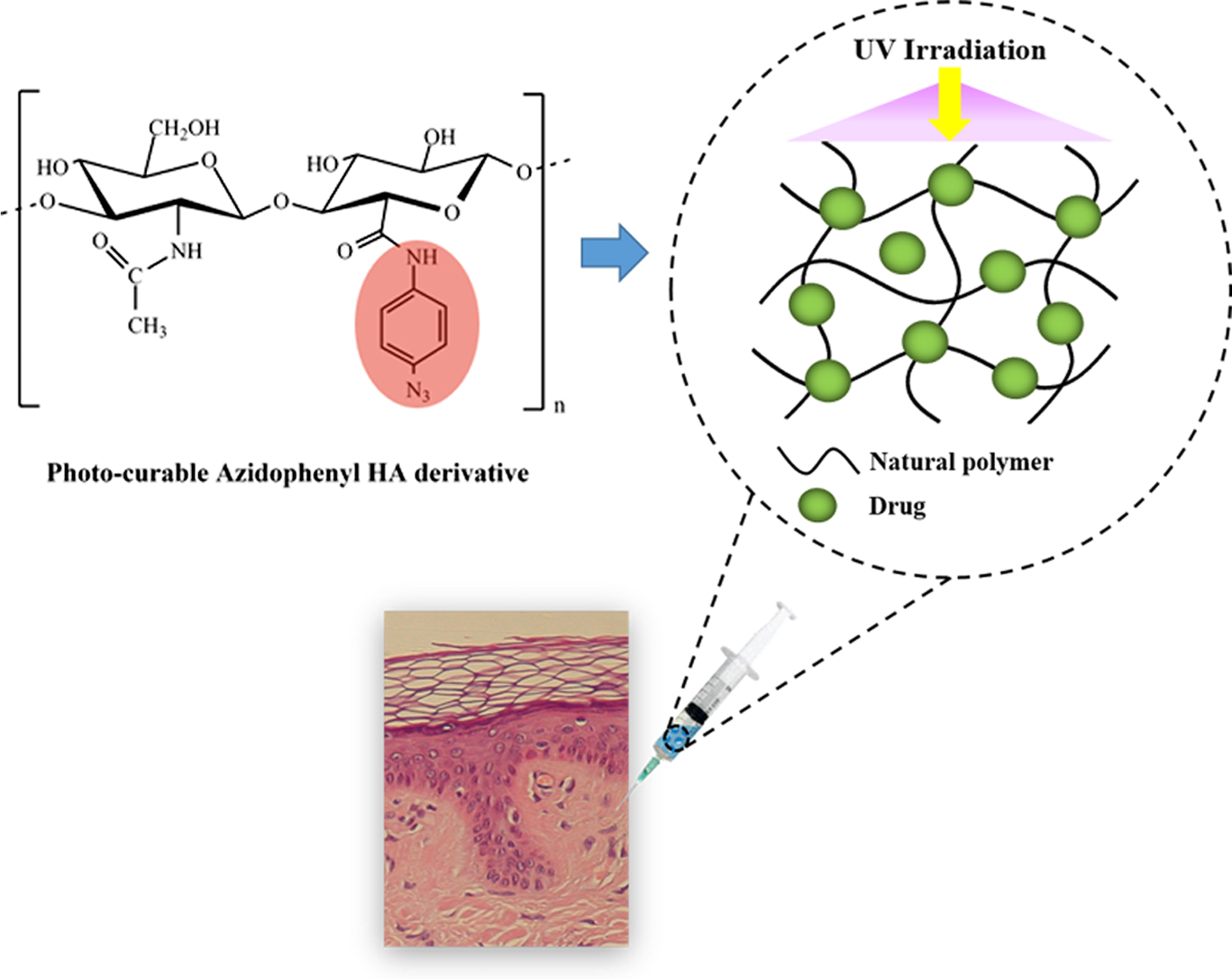
Keywords: azidophenyl hyaluronic acid derivatives, injectable hydrogel, protein-immobilization, fibroblast growth factor
단백질약물이 신체에
직접적으로 투여되면 체내에 존재하는 효소로 인해 불안정해지며 물리적 및 화학적 조건으로 인해 생리활성이 저감될 수 있다. 예를 들어, 단백질약물의
응집이나 변성에 의해 약물이 불활성화되거나 기능이 반감되는 것으로 보고되고 있다. 그 결과, 단백질약물 또는 성장인자의 기능을 보호하고 안정화시키기
위한 연구가 많이 이루어졌다.1-4
단백질 약물인 성장인자를
안정화시키는 방법으로는 다양한 방법이 있으며 생리활성분자 표면에 존재하는 아미노기, 카복시기, 티올기 등의 작용기를 지지체에 직접 공유결합시키는 화학적 가교제에 의한 고정화 방법이 널리 이용되어 왔다.
그러나 이러한 방법은 부산물의 독성으로 인하여 반응과정에서 단백질의 분자구조적인 변형의 문제가 야기될 수 있다.5,6 그렇기 때문에 약물 전달
시스템에서는 이를 방지하기 위해 단백질의 전달과 활성을 유지하는 것이 필수적이다.7,8 따라서 본 연구에서는 위와 같은 문제를
보완하기 위해서 약물의 제어 방출을 위한 광고정화 방법을 통하여 천연고분자 유도체에 단백질약물 고정화를 시도했다. 광고정화 방법은 UV광조사에 의해 발생한 nitrene의 가교반응을
이용하여 단백질약물이 특별한 가교제나 작용기가 없어도 손쉽게 안정화됨으로써 화학적 고정화 방법의 단점을 보완할 수 있을 것으로 사료된다.9
이러한 이유로 본 연구에서는 효과적으로 단백질약물을 안정화시킬 목적으로 UV경화형 히알루론산 유도체(Az-HA)를 제조하였다. Scheme 1에서
보는 바와 같이 Az-HA와 단백질약물이 혼합된 수용액에 UV를 조사하게 되면 질소가 방출되고 nitrene 화학 종이 생성되어 이들 화학 종
간의 반응에 의하여 이량화와 히알루론산 내의 다른 작용기와 반응함으로써 광경화가 일어난다.10-12
한편, 의료용 목적으로
사용하기 위한 생체소재의 특징으로는 기본적으로 인체에 독성이 없으며 안전해야 하고, 최소한의 면역반응 및 염증반응이 없어야 한다. 따라서 생체적합성과
생분해성의 특성을 가지는 천연고분자가 의료용 목적으로 체내에 이용하기에 적합하다고 생각된다.13-15
자연에는 키토산,
젤라틴, 히알루론산, 알지네이트 등의 여러 가지의 천연고분자가 존재한다. 그 중에서, 히알루론산(HA)은 친수성을 가진 천연고분자로, N-아세틸글루코사민과
D-글루쿠론산으로 이루어진 고분자 화합물이다(Scheme 2). 또한 HA는 대부분의 신체조직의 세포 외 기질에서 발견되며 신체의
피부, 폐 및 내장을 구성하는 성분으로 알려져 있다. 그리고 HA는 생체적합성과 생분해성, 점탄성 등의 특징을 가지며, 약물전달 시스템, 유착방지제,
tissue engineering scaffold 등의 의료분야에서 널리 사용되고 있다. 그러나 이러한 여러 장점에도 불구하고 hyaluronidase와 같은
효소에 의한 분해로 인해 체내 유지기간이 짧다는 한계를 가지고 있다.16-18
본 연구에서는 이를
극복하기 위해 광조사를 통한 광고정화 방법을 이용하여 단백질약물 고정화 및 천연고분자인 HA의 생체 내 지속성을 증가시키기 위해 주사제형 수화젤을 제조하였다. 수용액 상에서의
HA는 카복시기와 N-아세틸기의 수소결합으로 인하여 수화젤의 형태를 가진다.17 수화젤은 친수성 고분자의 가교로
인하여 많은 물을 함유하고 있기 때문에 체내의 세포 외 기질을 모방한 물질의 한 유형이다. 이것은 친수성 단백질의 구조 및 생리적 활성을 보존하기
위한 최적의 환경을 제공할 수 있다. 또한 수화젤은 내부에 함유된 약물, 단백질, 성장 인자 및 기타 물질의 방출을 제어할 수 있다. 더 나아가
주사제형 수화젤은 표적 영역에 약물 투여를 용이하게 할 뿐만 아니라 결손부위의 복잡성에 관계없이 주변 구조와 밀접하게 접촉이 가능하다는 장점을
가지고 있다.19-23
본 연구에서 제조한
수화젤에 광고정화시킬 단백질약물의 모델로써 섬유아세포 성장인자인 fibroblast growth factor (FGF)를 선정하였다. FGF는 세포의 증식을 촉진하며
세포 분열 및 성장을 유도하는 단일 사슬 폴리펩티드 성장인자이다. 이는 강한 증식성을 유도하는 상처 치유 과정에서 중요한 역할을 한다.24,25
그러나 신체에 주입되면 주변 효소에 의한 즉각적인 공격으로 인해 생리 활성이 저하되는 한계점을 가지고 있다.26,27 따라서
이를 극복하기 위해 많은 제어 방출시스템이 개발되어지고 있다.28,29 본 연구에서는 이러한 광경화형 천연고분자 유도체에 단백질약물을
광고정화함으로써 약물전달 효율을 높일 수 있는 방법을 사용하였다.
따라서 본 연구에서는
제조한 Az-HA에 FGF가 광고정화된 수화젤을 신체에 주입했을 때 FGF의 방출량을 제어할 수 있기 때문에 체내에서 보다 안정화된 활성을 가질
것이라고 사료된다.
본 연구의 목적은
효과적으로 약물 전달이 가능한 주사제 형태의 광경화형 유도체를 제조하는 것이다. 이를 위해 수화젤을 구성하는 유도체 제조 및 구조 분석, 수화젤의
유변학적 분석, 광경화성 Az-HA의 단백질 약물 광고정화 능력 확인, 유도체에 광고정화된 단백질약물의 방출 제어 평가, 생체적합성 확인을 위한 세포 독성 실험 등을 진행하였다.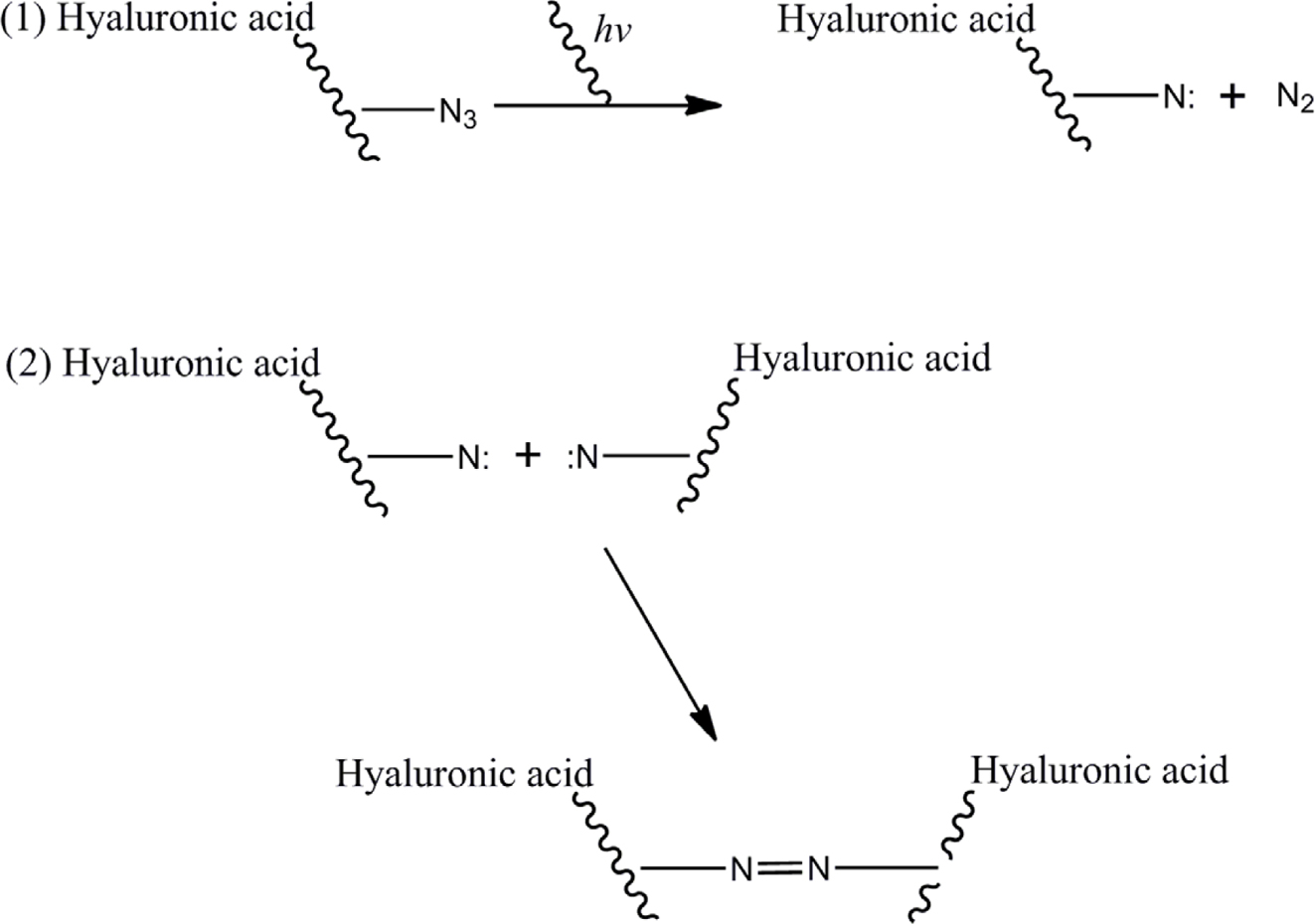
Scheme 1. Photo-curing mechanism of UV reactive hyaluronic acid derivatives.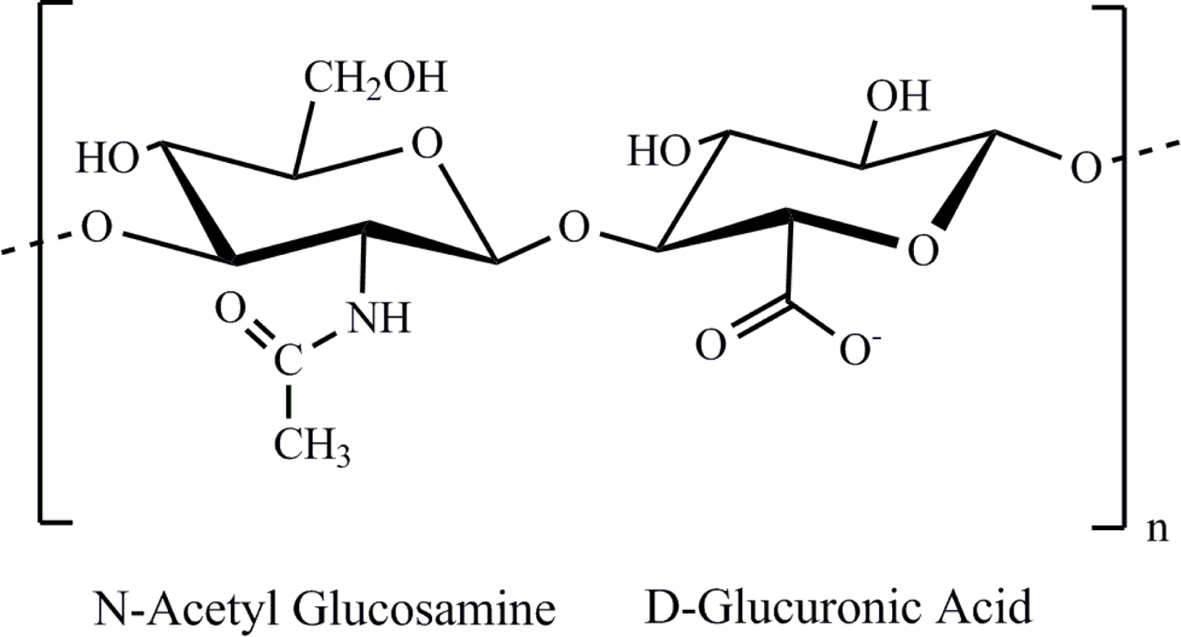
Scheme 2. Chemical structures of hyaluronic acid (HA).
재료. Hyaluronic acid sodium
salt(Mw: 1.3~1.8 MDa)는 Bioland(Cheonan, Korea)의
제품을 사용하였으며, 1-(3-dimet-hylaminopropyl)-3-ethyl carbodiimide(EDC),
4-azidoaniline hydrochloride,
deuterium oxide(D2O), fluorescein
isothiocyanate
conjugated bovine serum albumin(FITC-BSA), trypsin ethylenediaminetetraacetic
acid(trypsin-EDTA), bovine serum albumin(BSA)는 Sigma Aldrich(Flanders, NJ, USA)의
제품을 사용하였다.
Sodium hydroxide, hydrochloric acid, acetone, ether는 Duksan Pure Chemical Co., Ltd.(Seoul,
Korea)의 제품을 사용하였으며, UV 조사기기는 Hamamatsu(Shizuoka, Japan) 제품의 UV Spot Light
Source L5662를 사용하였다. 또한 세포 배양을 위해 NIH3T3 mouse embryo fibroblasts를 사용하였다. Cell
counting kit-8은 Dojindo(Kumamoto, Japan)의 제품을 사용하였고 Recombinant Mouse
Fibroblast Growth factor는 Prospect(Korea)의 제품을 사용하였다. Culture-Insert 2 well 24는
ibidi(8.4×8.4×5 mm, Germany) 제품을 사용하였다.
Dulbecco’s modified Eagle’s medium (DMEM)은 WelGene Inc. 제품을 사용하였고 fetal bovine
serum(FBS), penicillinstreptomycin은 Gibco(Eggenstein, Germany) 제품을 사용하였다.
Rheological rheometer는 Malvern Panalytical Kinexus lab+
rheometer(U.K)를 사용하였다.
Az-HA의 제조. Azidophenyl hyaluronic
acid(Az-HA) 유도체의 합성은 이전에 보고된 바 있다.30,31 간략하게 설명하자면, hyaluronic acid
sodium salt(HA, 100 mg)를 증류수(100 mL)에 용해시킨 후, 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide
hydrochloride(EDC, 92 mg)와 4-azidoaniline hydrochloride(98 mg)를 첨가하여 교반하였다. 이어서 1 N NaOH를 첨가하여 pH를 7로 적정하였다.
Oil bath를 암실에 비치하고 60 oC에서 혼합물을 하루
동안 반응시켰다. 여과를 통해 얻은 생성물에 남아있는 용매를 증발시켰다. Methanol, acetone, ether를 사용하여 생성물을 세척하고
하루 동안 진공 건조하였다. 위 실험과정을 통해 최종적으로 생성물인 Az-HA를 제조하였다(Scheme 3).
Az-HA의 구조 분석. 제조한 Az-HA의 구조적인 특성을 알아보기 위해
FTIR과 1H NMR spectroscopy를 실시하였다. 먼저 FTIR 분석을 위해 막자 사발을 이용하여 Az-HA과
KBr을 1:100의 비율로 혼합하였다. 혼합물을 압축한 후, 투명한 디스크를 만들어 적외선 분광기를 통해 측정하였다(FTIR 8400S
spectrometer, Shimadzu, Kyoto, Japan). 1H NMR 분석을 위해 Az-HA(25 mg)를 D2O에 녹여 샘플을 만들고
1H NMR spectroscopy를 통하여 측정하였다(Gemini 2000, 300 MHz, Varian Inc., Palo Alto,
CA, USA).
Rheological
Analysis. UV 조사 유무에 따라 달라지는 Az-HA 유도체의 유변학적
특성을 분석하였다. 먼저 증류수에 녹인 0.1, 0.3, 0.5% 농도의 Az-HA 용액을 만들어 유리판에 도말한 뒤에 UV 조사하여 진공건조를
하였다(48 mW/cm2, 1 min). 이 후 광경화된 Az-HA 샘플을 다시 증류수에
녹여 각 1mL의 0.1, 0.3, 0.5% 농도의 Az-HA 수화젤 샘플을 만들었다. UV 조사를 하지 않은 0.1, 0.3, 0.5% 농도의
Az-HA 샘플과 UV 조사한 0.1, 0.3, 0.5% 농도의 Az-HA 샘플을 Malvern Panalytical Kinexus lab+
rheometer를 사용하여 측정하였다(Oscillation measurement: 1.0~10.0 Hz, Shear strain: 0.2%,
Temperature equilibrium: 25 oC).
단백질 고정화 실험. Az-HA의 단백질약물 고정화 기능여부를 확인하기 위해 fluorescein
isothiocyanate-conjugated bovine serum albumin(FITC-BSA)를 사용하였다. FITC-BSA(1 mg/mL)를 함유한 0.5% 농도의 Az-HA 용액을
준비하여 유리판에 도말한 후, UV 조사하였다(48 mW/cm2, 1 min). 조사한 샘플을 실온에서 완전히 건조시킨 뒤
막자 사발을 이용하여 분쇄하였다.
고정화되지 않은 FITC-BSA를 제거하기 위해 증류수로 세척하였다. 20 rotor에 10분간 8000 rpm에서 원심분리하였다. 상등액을 제거한 후에 메탄올로 같은
과정을 진행한 후에 침전된 샘플을 회수하여 하루 동안 진공건조하였다. 회수한 샘플을 형광현미경(TS-1000 microscope
interfaced with NIS elements imaging software, Nikon, Japan)으로 관찰하였다.
단백질 방출 실험. Az-HA 유도체에 고정화된 단백질약물이 지속적으로 방출되는
여부를 확인하기 위해 단백질 방출 실험을 진행하였다. Bovine serum albumin(BSA, Sigma Aldrich, USA)를 드레싱
폼에 광고정화하여 Bradford assay를 통해 BSA의 방출 정도를 측정하였다. 먼저 0.1, 0.3, 0.5% 농도의 Az-HA 용액을
준비하였다. 각 샘플에 BSA(1 mg)를 첨가하여 드레싱 폼에 250 μL씩 투여하였다. UV 조사하여 BSA를 고정화하였다(48 mW/cm2, 1 min). BSA가 고정화된 드레싱 폼에 증류수를 첨가하여
6시간 동안 고정화되지 않은 BSA가
방출되도록 했다. 고정화되지 않은 BSA를 제거한 뒤, 최대 48시간 동안 12시간 간격으로 같은 방법으로 증류수를 첨가하여 추가로 방출되는 BSA의 양을
UV/VIS spectro-photometer(Optizen 3220UV, Mecasys Co., Ltd., Daejeon,
Korea)를 이용하여 450 nm에서 측정하였다.
세포독성 실험. 광경화형 Az-HA 유도체가 세포 내에서 작용하는지 여부를
알아보기 위해 WST assay를 이용하여 세포독성 실험을 실시하였다. 0.3, 0.5, 0.7, 1%의 농도로 Az-HA 용액을 준비하였다.
5% CO2 incubator에서 NIH3T3 세포를 FBS(1%)와 penicillin-streptomycin(1%)을 함유한
DMEM 배지에 배양하였다. 세포(5.0×103
cells/mL, 100 μL)를 96 well plate에 접종하고, 5% CO2
incubator에서 24시간 동안 37 oC에서 배양하였다.
세포가 부착된 후, 각각의 plate에 농도별로 Az-HA 용액(10 μL)을 첨가하였고 5% CO2 incubator에서 최대 48시간 동안 배양하였다.
각 배양시간마다 CCK-8 용액을
첨가하였고 세포를 2시간 동안 배양하였다(10 μL/well, Kumamoto, Japan). Microplate reader(Molecular
Device, 450 nm, USA)를 통해 12시간 간격으로 세포의 활성도를
측정하였다.
세포증식 실험. In vitro scratch assay는 시험관 내에서 할 수 있는
간단한 실험 방법으로 세포의 단층에 인위적인 간격을 생성하여 간격의 가장자리에서부터 세포의 증식경과를 가시적으로 확인할 수 있다.32-35
Az-HA 유도체에 고정화된 성장인자가 세포 증식에 작용하는지의 여부를 확인하기 위해 In vitro scratch
assay를 실시하였다. 5% CO2 incubator에서 NIH3T3 세포를 FBS(10%)와
penicillin-streptomycin(1%)을 함유한 DMEM 배지에 배양하였다. 세포(4.8×105 cells/mL)를
24 well plate 중앙에 위치한 두 개의 growth area에 70 μL씩 접종하고 5% CO2
incubator에서 12시간 동안 37 oC에서 배양하였다.
세포가 두 개의 growth area에 세포가 부착되어 자란 것을 확인한 후에 세포가 자라지 않은 culture insert를 제거하고 1X
DPBS(500 μL)로 세척을 해주었다. FBS(10%)와
penicillin-streptomycin(1%)을 함유한 DMEM 배지 1 mL을 coating area에 투여한 뒤, 각
well에 PBS(100 μL), free FGF(100 ng/100 μL), 1% 농도의 Az-HA 용액(100 μL), FGF (100 ng)가 고정화된 1% 농도의 Az-HA 용액(100μL)을
첨가하였다. 5% CO2 incubator에서 24시간 동안 37 oC에서 배양하며 6시간 간격으로 각 배양시간마다 현미경을 통해 세포의 증식 정도를 관찰하였다(Scheme
4).
통계학적 분석. 정량법의 신뢰성에 관한 분석자료의 모든 값은 평균±표준편차로
표시되며, 통계학적 분석을 위하여 GraphPad Prism software을 이용한 Tukey’ test의 이원분산분석(Two-way
ANOVA)을 실시하였다(*p<0.05, **p<0.01, and ***p<0.001).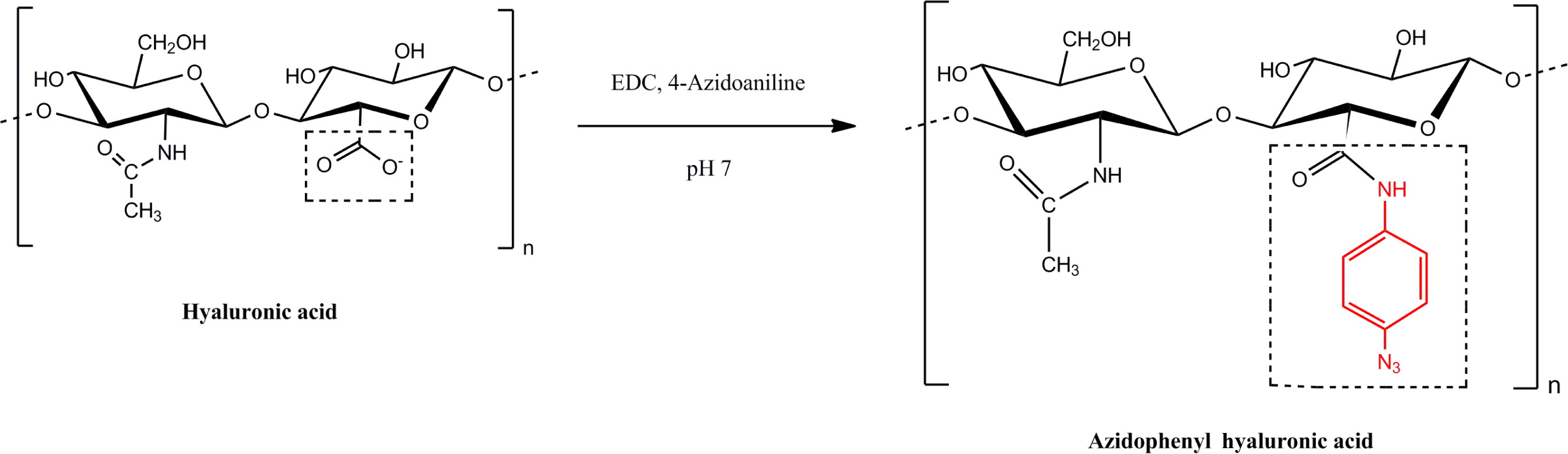
Scheme 3. Preparation scheme of azidophenyl hyaluronic acid derivatives (Az-HA).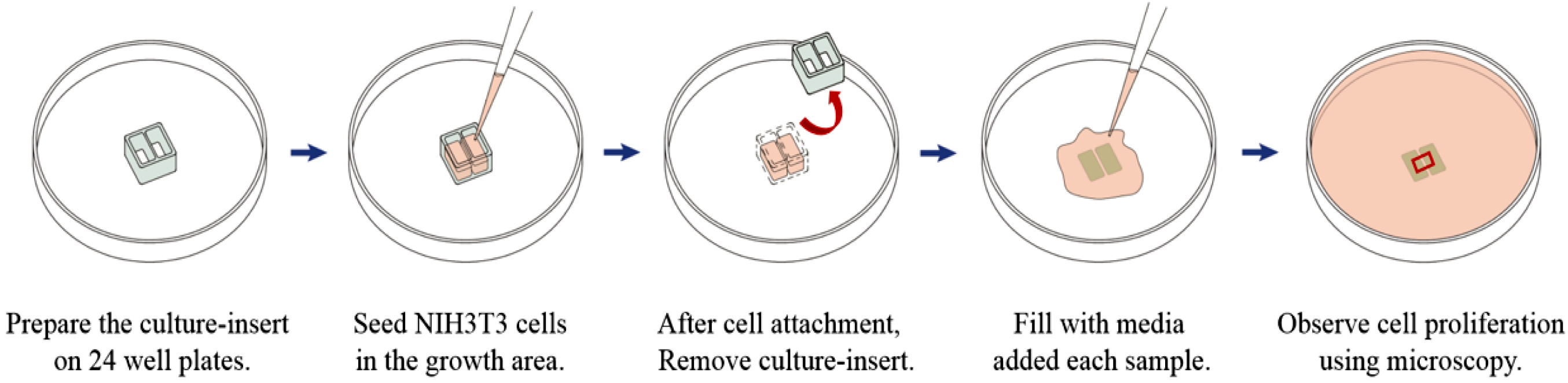
Scheme 4. Process of cell proliferation test (in vitro scratch assay).
Az-HA의 구조 분석. Az-HA의 화학적 구조 분석은 FTIR과 1H NMR spectroscopy에 의해 확인할 수 있었다(Figure
1). FTIR의 HA
spectrum에서는 -CO(1650 cm-1) 흡수대와 -OH 흡수대(3400 cm-1)를 확인할 수 있었다.
Az-HA spectrum에서는 HA가 가진 작용기들 뿐만 아니라 2124.6 cm-1에서 azido기의 흡수 피크를
확인할 수 있었는데, 이는 azidophenyl기의 C-N amide bond stretch가 생성되었음을 알 수 있었다.
또한 1H NMR spectrum에서 Az-HA은 HA과 달리
7.01와 7.44 ppm에서 phenyl ring에 해당하는 두 개의
proton 피크를 확인할 수 있었다. 이와 같은 결과로 HA의 카복시기에 azidoaniline의 아민기가 결합됨으로써 Az-HA가 제조되었음을
확인할 수 있었다(Figure 2).
Rheological
Analysis. 제조된 Az-HA 수화젤의 점성 및 탄성 거동을 확인하기 위하여 유변학적 분석을 실시하였다.
손실 탄성률(G'')은 진동하고 있는 시료 중 점성에 의해 상실하는 탄성 에너지의 크기를 나타낸다. 반면에, 저장 탄성률(G')은
진동하고 있는 시료 중에 탄성에 의해 손실 없이 축적되는 탄성 에너지의 크기를 나타내며 젤의 변형 저항성을 의미하기 때문에 주사제형 수화젤의 특성에서
가장 중점적인 요인이 된다. 실험 결과, 광경화를 하지 않은 0.5% 농도의 Az-HA 수화젤의 G'과 G''이 10 Hz에서 각각 73.56, 50.84 Pa인 것에 반해, 광경화한 0.5% 농도의
Az-HA 수화젤의 G'과 G''은 각각 110.51, 60.84 Pa이었다(Figure 3). 이를 통해 Az-HA 유도체의 농도가 높아짐에 따라 수화젤의 G'이
증가하고, 광경화를 통하여 수화젤의
강도가 높아지는 것을 확인할 수 있었다. Figure 3에 제시된 G' 값들은 150 Pa 이하로 기존에 개발된 수화젤에 비해 강도가 낮지만,
유도체의 농도를 더 높게 설정하여 수화젤을 제조하고 광경화를 통하여 젤의 강도를 높인다면 수화젤의 변형 저항성이 커질 수 있을 것으로 예상된다.
따라서 제조된 광경화형 Az-HA 수화젤 유도체가 주사제형으로서 체내에 적용되었을 때 수화젤 특성을 보유할 수 있을 것으로 사료된다.
단백질 고정화 실험. 형광현미경 관찰을 통하여 형광단백질인 FITC-BSA가
Az-HA 유도체에 고정화되었음을 확인하였다. 실험 결과를 통하여, 광반응성 작용기를 가진 Az-HA 유도체와 단백질약물이 혼합된 수용액에
UV 조사하였을 때 광경화로 인하여 단백질이 고정화되는 것을 확인할 수 있었다(Figure 4).
단백질 방출 실험. 단백질 방출 실험 결과, 고정화되지 않은 BSA를 제거한지
12시간이 지난 후 0.1% 농도의 Az-HA에 고정화된 BSA가 초기보다 56% 방출되었으며, 0.3% 농도의 Az-HA에 고정화된 BSA가
27%, 0.5% 농도의 Az-HA에 고정화된 BSA가 25% 방출되었음을 알 수 있었다. 48시간 동안 시간경과에 따른 BSA 방출량의 추이를
보았을 때, Az-HA의 농도가 낮을수록 BSA의 방출이 빨리 일어나고 농도가 높을수록 BSA의 방출이 천천히 일어나는 것으로 유추할 수 있었다(Figure
5). 이와 같은 실험결과를 통하여 제조된 Az-HA에 광고정화된 단백질약물이 생체 내에서 지속성을 가질 수 있을 것으로 사료된다. 또한
Az-HA의 농도에 따라서 단백질약물의 방출량을 조절할 수 있을 것으로 판단된다.
세포독성 실험. In
vitro 상에서의 광경화형
Az-HA 유도체에 대한 세포독성 정도를 알아보기 위해 WST assay를 실시하였다. 실험 결과, 대조군과 비교했을 때 오히려 세포가 더 높은
활성을 띠는 것으로 확인할 수 있었으며, 1% 농도의 Az-HA에 대해서는 대조군 대비 150% 이상의 활성도를 보였다(Figure 6). 이
결과를 통해 제조된 Az-HA 유도체는 주사제형으로서 체내에 적용되었을 때 무해하기 때문에 생체소재로써 활용 가능성이 있다고 판단된다.
세포증식 실험. 본 연구에서는 HA의 생체 내 지속성을 증가시키기 위해
광고정화 방법을 사용하여 Az-HA를 제조하였으며, Az-HA 유도체에 고정화된 성장인자가 세포 증식에 작용하는지 여부를 확인하기 위해
In vitro scratch assay를 실시하였다.
관측 결과, 아무런
처리가 되지 않은 대조군에 비해 Az-HA에 고정화된 FGF를 투여한 세포의 well에서 세포의 증식이 가장 활발히 이루어지는 것을 확인하였다(Figure
7). 이를 통해 광경화형 Az-HA를 이용해 고정화된 성장인자가 생체 내에서 정상적으로 방출되어 효과적으로 기능할 수 있을 것으로 유추할 수
있었다.

|
Figure 1 FTIR spectra of hyaluronic acid (HA) and azidophenyl hyaluronic acid (Az-HA). In the spectrum, the specific peak of the azido group shows at 2160-2080 cm-1. As a result, it can be assumed that an azido group was introduced into hyaluronic acid. |

|
Figure 2 1H NMR spectra of hyaluronic acid (HA) and azidophenyl hyaluronic acid (Az-HA). In the spectrum of Az-HA, there are two proton peaks between 7.01 and 7.44 ppm (benzene rings of azidophenyl group), indicating that Az-HA was successfully prepared. |

|
Figure 3 Rheological analysis of (A) non-crosslinked 0.1, 0.3, 0.5% Az-HA; (B) crosslinked 0.1, 0.3, 0.5% Az-HA. As the concentration of Az-HA increases, the storage modulus of the hydrogel increases. |

|
Figure 4 Az-HA particle form observed under a fluorescent microscope: (A) observed in visible-light filter; (b) observed in fluorescencelight filter. It was confirmed that FITC-BSA was immobilized on the Az-HA derivative. |

|
Figure 5 Protein releasing test. The amount of released protein according to the concentration of Az-HA photo-cured on dressing foam was measured by Bradford assay. The higher the concentration of Az-HA derivatives, the slower the release of BSA could be inferred. |

|
Figure 6 Cytotoxicity test. In vitro cytotoxicity of the Az-HA measured via WST assay. Cell viability of the Az-HA was more than when compared to the control group for 48 h. n = 4, *p<0.05, **p <0.01, and ***p<0.001 compared with the control group. |

|
Figure 7 Cell proliferation test of untreated control, free-FGF, 1% Az-HA, and FGF immobilized with 1% Az-HA (1% Az-HA+FGF). Scale bar = 50 μm. It was confirmed that cell proliferation was most actively performed in the FGF immobilized with 1% Az-HA compared to the control group which was not treated at all. |
단백질약물이 신체에
직접적으로 투여되면 효소로 인해 불안정해지며 생리활성이 저감될 수 있다. 본 연구는 이를 극복하기 위해 광반응에 의한 광고정화 방법을 통하여 단백질약물
고정화 및 천연고분자인 HA의 생체 내 지속성을 증가시키기 위해 주사제형 수화젤을 제조하고자 하였다. 생체적합성과 생분해성이 우수한 천연고분자
히알루론산에 UV경화형 작용기를 도입하여 광고정화를 통해 약물의 고정화가 가능한 주사제형 유도체를 제조하는데 목적을 두었다. FTIR 및 1H NMR에 의한 구조분석을 통해서 Az-HA가 성공적으로
제조되었음을 확인하였으며 유변학적 분석을 통해 유도체의 수화젤 특성이 유지되는 것을 확인하여 주사제형으로서 활용가능성을 확인하였다. 단백질 고정화
실험을 통해 약물이 성공적으로 고정화되었음을 확인하였으며 제조된 Az-HA의 농도가 높을수록 지속적으로 방출된다는 것을 확인하였다. 세포 독성 실험을 통해 생체적합성이 확인되었으며 세포증식
실험에서 유도체에 고정화된 성장인자가 효과적으로 작용하는 것을 확인하였다. 따라서 위와 같은 실험 결과, 본 연구에서 제조한 Az-HA는 효과적으로
표적부위에 단백질약물 전달이 가능한 주사제형 의료용 생체소재로서 활용가치가 높을 것으로 사료된다.
- 1. C. Dai, B. Wang, and H. Zhao, Colloid Surface B, 41, 117 (2005).
-

- 2. Y. Wang, L. Zhang, Q. Wang, and D. Zhang, J. Control. Release, 172, 1126 (2013).
-

- 3. V. Truong-Le, P. Lovalenti, and A. M. Abdul-Fattah, Adv. Drug Deliv. Rev., 93, 95 (2015).
-

- 4. X.-C. Yang, B. Samanta, S. S. Agasti, Y. Jeong, Z. J. Zhu, S. Rana, O. R. Miranda, and V. M. Rotello, Angew. Chem. Int. Ed., 50, 477 (2011).
-

- 5. A. Sadana, Biotechnol. Bioeng., 48, 481 (1995).
-

- 6. Y. Ito, T. Yamauchi, and K. Omura, Kobunshi Ronbunshu, 61, 501 (2004).
-

- 7. K. E. Uhrich, S. M. Cannizzaro, R. S. Langer, and K. M. Shakesheff, Chem. Rev., 99, 3181 (1999).
-

- 8. M. Ali and N. Manolios, Lett. Pept. Sci., 8, 289 (2001).
-

- 9. T. Matsuda and T. Sugawara, Langmuir, 11, 2272 (1995).
-

- 10. Y. Ito, Biotechnol. Prog., 22, 924 (2006).
-

- 11. H.-N. Na, Y. Heo, K.-I. Kim, K. H. Chung, and T.-I. Son, J. Chitin Chitosan, 15, 92 (2010).
- 12. Y. Heo, S. H. Park, S. Y. Seo, J. Y. Yun, Y. Ito, and T. I. Son, Macromol. Res., 22, 541 (2014).
-

- 13. Z. Shi, X. Gao, M. W. Ullah, S. Li, Q. Wang, and G. Yang, Biomaterials, 111, 40 (2016).
-

- 14. J.-W. Kim, E.-H. Kim, G.-D. Han, S.-H. Noh, H.-C. Goo, J.-Y. Yun, J.-W. Nah, and T.-I. Son, J. Chitin Chitosan, 22, 1 (2017).
-

- 15. E.-H. Kim, G.-D. Han, S.-H. Noh, J.-W. Kim, J.-G. Lee, Y. Ito, and T.-I. Son, J. Ind Eng. Chem., 54, 1 (2017).
-

- 16. J.-E. Kim and J. M. Sykes, Facial Plast. Surg., 27, 523 (2011).
-

- 17. G. D. Monheit and K. M. Coleman, Dermatol. Ther., 19, 141 (2006).
-

- 18. B. Joddar, T. Kitajima, and Y. Ito, Biomaterials, 32, 8404 (2011).
-

- 19. M. Hamidi, A. Azadi, and P. Rafiei, Adv. Drug Deliv. Rev., 60, 1638 (2008).
-

- 20. A. S. Hoffman, Adv. Drug Deliv. Rev., 54, 3 (2004).
- 21. N. A. Peppas, Curr. Opin. Colloid Interface Sci., 2, 531 (1997).
-

- 22. K. Y. Lee and D. J. Mooney, Chem. Rev., 101, 1869 (2001).
-

- 23. H. Tan and K. G. Marra, Materials, 3, 1746 (2010).
-

- 24. M. J. Hickey and W. A. Morrison, Biochem. Biophys. Res. Commun., 201, 1066 (1994).
-

- 25. N. Yang, H. Zhang, L. Shi, X. Hu, Y. He, L. Chen, Q. Zhang, and K. Zhao, React. Funct. Polym., 100, 73 (2016).
- 26. E. R. Edelman, E. Mathiowitz, R. Langer, and M. Klagsbrun, Biomaterials, 12, 619 (1991).
-

- 27. S. Vemuri, I. Beylin, V. Sluzky, P. Stratton, G. Eberlein, and Y. J. Wang, J. Pharm. Pharmacol., 46, 481 (1994).
-

- 28. W. H. Ryu, Z. Huang, F. B. Prinz, S. B. Goodman, and R. Fasching, J. Control. Release, 124, 98 (2007).
-

- 29. F. Z. Volpato, J. Almodóvar, K. Erickson, K. C. Popat, C. Migliaresi, and M. J. Kipper, Acta Biomater., 8, 1551 (2012).
-

- 30. H.-J. Lee, S.-H. Park, S.-Y. Seo, Y.-M. Cho, H. D. Woo, Y. Ito, and T.-I. Son, Macromol. Res., 21, 216 (2013).
-

- 31. H.-D. Woo, H.-J. Lee, J.-W. Lee, and T.-I. Son, Macromol. Res., 22, 494 (2014).
-

- 32. M. T. Rose, Vet. J., 193, 539 (2012).
-

- 33. C.-C. Liang, A. Y. Park, and J.-L. Guan, Nat. Protoc., 2, 329 (2007).
-

- 34. M. Fronza, B. Heinzmann, M. Hamburger, S. Laufer, and I. Merfort, J. Ethnopharmacol., 126, 463 (2009).
-

- 35. F. Felice, Y. Zambito, E. Belardinelli, A. Fabiano, T. Santoni, and R. D. Stefano, Int. J. Biol. Macromol., 76, 236 (2015).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(4): 451-458
Published online Jul 25, 2020
- 10.7317/pk.2020.44.4.451
- Received on Feb 6, 2020
- Revised on Mar 20, 2020
- Accepted on Mar 20, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Tae-Il Son
-
Department of Systems Biotechnology, Chung-Ang University, Seodongdae-ro 4726, Anseong-si, Gyeonggi-do 17546, Korea
- E-mail: tisohn@cau.ac.kr,
- ORCID:
0000-0002-7705-5662









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.