Glycol chitosan (GC) is a
hydrophilic derivative of chitosan, and has non-toxic, biocompatible, and
biodegradable properties. Also, GC shows excellent solubility under a wide
range of pH conditions. Therefore, it is widely studied in various biomedical
fields due to the excellent solubility. The self-healing hydrogel means that
the hydrogel could restore its structure and functionality after damage. This
self-healing behavior can be achieved by the dynamic chemical bonds including
imine bond as well as the physical bonds including hydrogen bond, and can be
applicable to scaffolds for tissue engineering and drug delivery systems. In
this study, the catechol-modified GC (GC-CA) conjugate was synthesized, and its
self-healing hydrogel was prepared via Schiff’s base (-CH=N-) formation of
GC-CA conjugate. The gelation behavior and self-healing properties of the GC-CA
hydrogel were dependent on the various conditions, such as polymer
concentration, degree of substitution, and pH. The results indicate that the
GC-CA hydrogel will be applicable to self-healing biomaterials and tissue
engineering scaffolds
글리콜 키토산은 키토산의 친수성 유도체로서 무독성, 생체적합성 및 생분해성을 가지며, 넓은 범위의 pH 조건의 수용액에서 우수한 용해성을 나타내는 친수성 다당류이다. 따라서
글리콜 키토산은 키토산과는 달리 중성 pH 조건의 수용액에서 용해가 가능하기 때문에 생체재료 분야에서
연구가 활발히 진행되고 있다. 한편, 자가치유 수화젤은 외력에
의해 파괴된 가교구조를 원래대로 회복할 수 있는 능력을 가진 수화젤을 의미한다. 이는 수소결합과 같은
물리적 결합 혹은 이민결합과 같은 화학적 결합을 통해 제조할 수 있으며, 조직공학용 재료 및 약물전달시스템
등에서 응용되고 있다. 본 연구에서는 이민결합 형성을 위해 글리콜 키토산에 카테콜기를 도입하여 자가치유
특성을 가지는 수화젤을 제조하였다. 또한 농도, 치환도 및 pH에 따른 젤화거동의 변화와 자가치유능을 분석하여 생체재료로서의 적용가능성을 살펴보았다
The catechol-modified glycol chitosan (GC-CA) conjugate was synthesized, and its self-healing hydrogel was prepared via Schiff’s base (-CH=N-) formation of GC-CA conjugate. The gelation behavior and self-healing properties of the GC-CA hydrogel were dependent on the various conditions, such as polymer DS, concentration, and pH. Therefore, the GC-CA hydrogel will be applicable to self-healing biomaterials and tissue engineering scaffolds.
Keywords: glycol chitosan, hydrogel, self-healing, imine bond, catechol group
본 연구는 충남대학교
연구우수장학금 지원으로 수행되었으며 이에 감사드립니다.
오늘날 고분자 소재는
일상생활뿐만 아니라 다양한 산업분야에서 널리 사용되고 있다. 최근에는 기존 고분자의 성질 외에 독특한 기능성이 부여된 스마트 고분자 소재에 대한
연구가 꾸준히 이루어지고 있다. 그 중 주목되고 있는 기능 중의 하나는 자가치유 특성이다. 이는 고분자 소재 자체가 인체조직처럼 외력에 의해 발생한
크랙 형성, 파손, 스크래치 등을 스스로 치유하여 본래의 특성을 회복하는 것을 의미한다. 제품에 손상이 발생하면 부품을 교체하거나 수리하여 사용하지만,
자가치유 소재가 적용되었을 경우, 수리 및 교체하지 않고도 오랫동안 사용할 수 있어 제품의 수명 증가, 환경보호 등 경제적 효과가 증대될 뿐 아니라,
수리과정에서의 위험성 감소와 제품안전성 향상에도 크게 기여할 수 있다. 따라서 고분자 소재에 자가치유능력을 도입하는 연구가 꾸준히 진행되고 있다.1
최초의 고분자를 사용한
자가치유에 대한 연구는 개환형 가교반응이 가능한 기능성 물질을 함유한 마이크로캡슐이 대상이었다.2 마이크로캡슐이 함유된 고분자
매트릭스가 손상될 경우, 즉 마이크로캡슐에 균일이 생기면 기능성 물질이 즉시 방출되어 고분자 매트릭스에 분산된 반응물이나 촉매와의 가교반응으로
경화되어 파단면을 회복하는 캡슐형 자가치유 방식을 채택하였다.2-6 하지만, 자가치유시간이 길고 한정적인 치유매체의 양, 물성저하,
촉매의 불안정성과 같은 문제가 발생되었고, 또한 한 번 치유된 부위는 일회성으로 반복적인 자기치유가 제한된다는 문제점이 있었다. 이 후, 반복적
치유가 가능한 자가치유 고분자를 개발하고자 하는 다양한 연구가 활발히 진행되어 왔다.7 반복적 치유가 가능한 자가치유 방식으로
많은 주목을 받고 있는 동적 결합(dynamic bond) 네트워크의 경우, 네트워크 구조가 외부 충격에 의해 손상이 발생하였을 시 분자인식 및
자가조립을 통해 분자 간 상호작용력이 다시 형성되어 손상부위에 가교가 다시 구성되는 방식으로 치유되는 방식이다. 앞서 언급한 캡슐형 자가치유 방식과는
달리 반복적인 치유가 가능하다는 점에서 많은 관심을 받고 있다.7-9 이러한 동적 결합을 통해 형성되는 수화젤은 특히 창상피복재,
약물전달시스템, 조직공학 등 의료용 고분자 분야에서 연구가 활발히 진행되고 있다.
따라서 본 연구에서는
천연 고분자인 키토산의 수용성 유도체인 글리콜 키토산을 이용하여 가교제 및 효소 없이 자가치유 특성을 갖는 수화젤을 제조하였다. 글리콜 키토산의
곁사슬에 EDC 커플링 반응을 이용하여 카테콜기를 도입시킨 후, 아민기와 카테콜기 사이의 Schiff base 반응을 유도하여 가역적 특성을 갖는
이민결합(imine bond)을 형성시키고자 하였다. 이 과정에서 수용액의 농도, 카테콜기의 치환도 및 pH에 따른 젤화거동 및 젤의 강도를 분석하였다.
또한 이민결합을 통한 수화젤의 자가치유 특성을 관찰하였다.
재료. 글리콜 키토산(GC, DP>200)은 Wako
Pure Chemical Industries(일본) 제품을 구입하여 사용하였다. 3,4-dimethoxy-cinnamic
acid(hydroxycaffeic acid, HCA)와 N-(3-dimethyl-aminopropyl)-N′-ethylcarbodiimide
hydrochloride(EDC)는 Sigma-Aldrich(미국)
제품을 사용하였다. 용매로는 증류수와 에탄올을 사용하였다. pH 조절 시 사용한 1 N 수산화나트륨(NaOH) 수용액과 1 N 염산(HCl) 수용액은 삼전화학(한국)에서 구입하여
사용하였다.
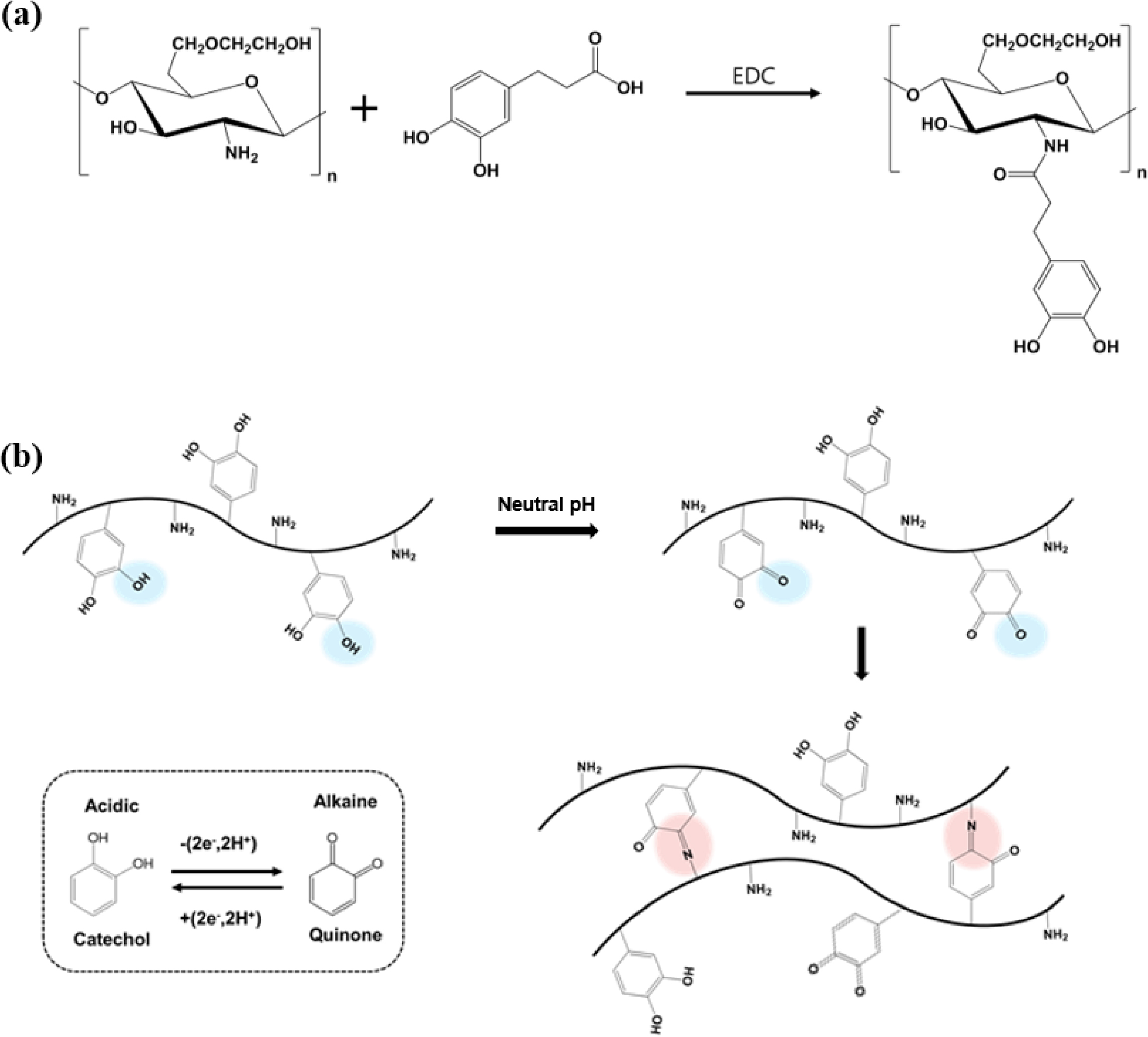
카테콜기 함유 글리콜 키토산 유도체의 제조. 카테콜기를 함유한 글리콜 키토산(catechol-modified
glycol chitosan, GC-CA)은 GC의 개질을 통해 제조하였다. Figure 1(a)과 같이 GC의 곁사슬에 존재하는 아미노기에 카테콜기를
치환하기 위하여, 45 mL 증류수와 1 N HCl 5 mL가 혼합된 용매에 GC 0.5 g을 용해시켜 균일한 용액을 제조한 후, 원심분리를 통해
용해되지 않은 침전물을 제거하였다. 그 후, 0.1 N NaOH를 이용하여 pH를 6.5로 조절한 후 아마이드결합 형성반응의 촉매인 EDC와 카테콜 전구체인
HCA를 첨가하였다. 다양한 pH 조건에서 10분간 반응시킨 후, 0.1 N HCl를 이용하여 pH를 4.5로 조절하고 12시간
동안 교반하였다. 이후, 셀룰로오스 투석막(cut-off 12000~14000 Da)을 사용하여 3일 동안 투석하여 미반응물을 제거한
다음, 동결건조를 통해 최종적으로 건조된 분말형태의 GC-CA 생성물을 얻었다. GC-CA는 1H NMR 및 UV-Vis 스펙트럼을 통해 구조를 확인하였다.
카테콜기 함유 글리콜 키토산 수화젤의 제조. GC-CA의 수화젤을 제조하기 위하여, 다양한 농도의
GC-CA 수용액을 제조한 후 1 N NaOH를 사용하여 pH 2~7 범위의 수화젤 형성을
위한 수용액을 제조하였다. 이후, Figure 1(b)에 도식화된 반응과 같이 수 분에서 수 시간 동안 교반을 통해 가교제 및 효소의 첨가 없이
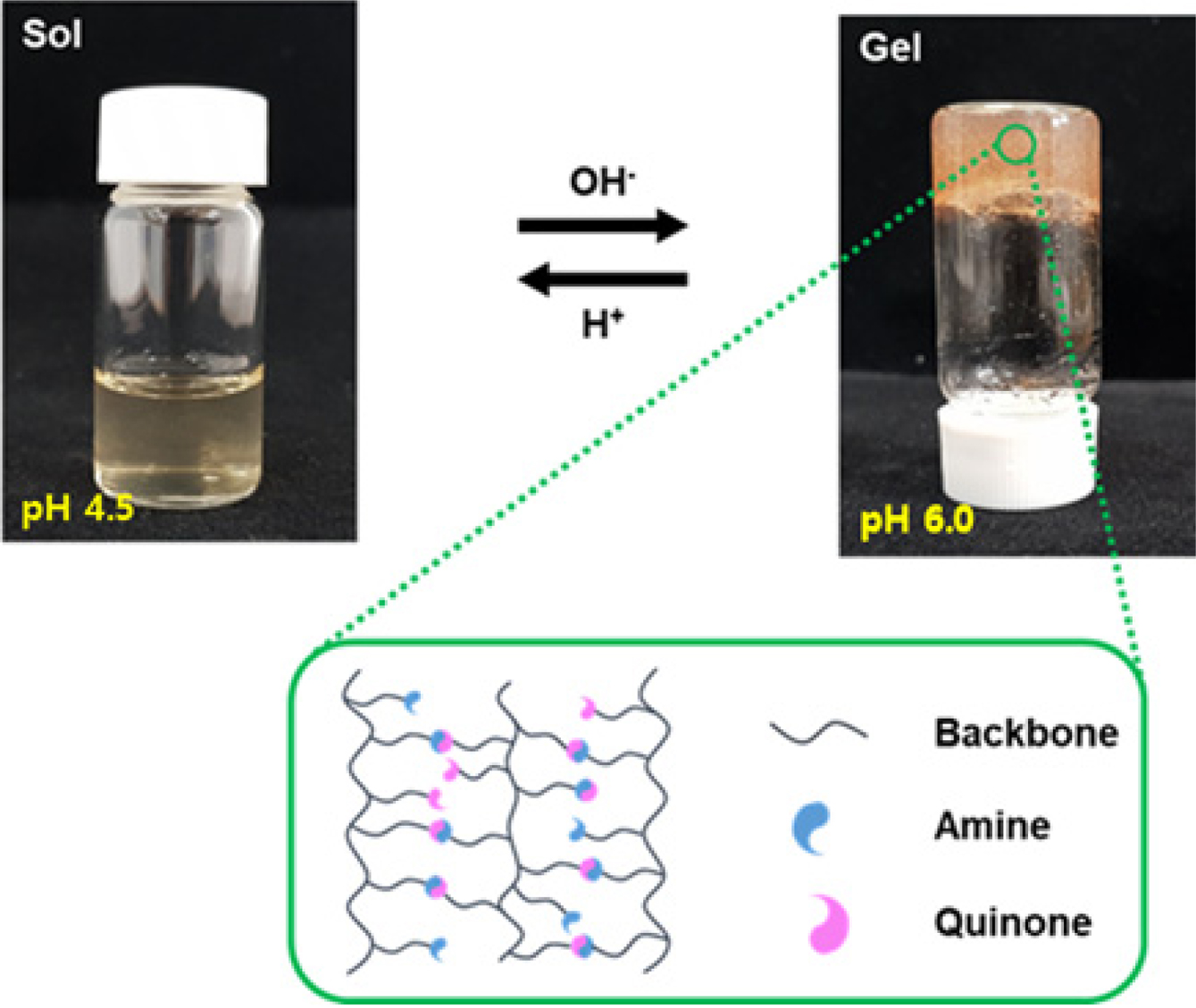
GC-CA 수화젤을 제조하였다. 수화젤의 형성은 Figure 2와 같이 vial tilting method를 이용하여 vial 병 속에서 수화젤을 형성시킨 후 뒤집었을 때, 30초
내로 흐르지 않는 상태를 확인하여 결정하였다.
1H NMR 스펙트럼 분석. EDC 반응을 사용하여 GC의 아미노기에 카테콜기가 치환되었는데, 본 실험에서는 반응 시 카테콜기 전구체인
HCA의 양과 pH의 변화에 따른 치환도를 구하였다. 측정을 위하여 각 시료는 D2O에 2 wt% 농도로 용해시켰다. GC에 대한 카테콜기의 치환도는
6.75~6.88 ppm에 나타난 방향족의 양성자 피크면적을 2.25 ppm 아세틸기의 양성자 피크면적으로 나누어 식 (1)과 같이 계산하였다.
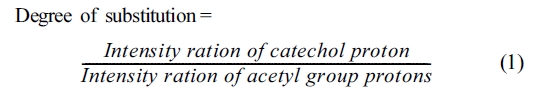
UV-Vis
스펙트럼 분석. 1H NMR과 함께 UV-Vis 분광광도 분석을 사용하여
GC-CA 유도체의 구조를 확인하였다. 카테콜기의 최대흡수파장은 280 nm에서 나타났다. 따라서 도파민과 같은 표준물질을 사용하여
얻어진 검량선을 사용하여 카테콜기의 치환도를 계산하였다.
ATR-IR
스팩트럼 분석. ATR-IR 스펙트럼을 사용하여 GC-CA 유도체의 카테콜기와
이민결합의 생성을 확인하였다. 이 실험에서는 GC, GC-CA, GC-CA 수화젤의 스펙트럼을 비교하여 구조를 분석하였다. 이때, 동결건조시킨
분말형태의 고분자 시료를 사용하여 3000~800 nm 파장범위에서 스펙트럼을 얻었다.
XPS 분석. XPS는 X-ray 시료에 조사되는 X-선 광이온 빔의
조사면적을 400×400 μm로 조절한 다음, 2×10-9 기압의 진공상태에서 단일파장의 빛을 쪼여 시료표면 근처에서 광전효과에 의해서 튀어나오는
전자의 세기를 운동에너지에 따라 분석하였다. 동일한 시료에 대하여 탄소, 산소 및 질소 고배율 스펙트럼을 얻어 비교 평가하였다.
젤화거동 분석. 본 연구에서 제조된 카테콜기로 개질된 GC의 유변학적
특성을 파악하고자 레오미터를 사용하였다. 이 때, 고분자 용액의 농도와 pH에 따른 유변학적 거동의 차이를 살펴보았다. 또한 저장탄성률을 분석함으로써
시료의 젤화가 일어나는 시점과 그 순간의 측정값을 구하였다.
자가치유 특성분석. 수화젤의 자가치유 특성을 분석하기 위하여 레오미터를 사용하였다.
변형률을 점차 증가시켜 수화젤의 졸-젤 전이점을 확인하였고 amplitude sweep 테스트로 1-120%를 1분씩 교대로 변경하여 수화젤의
자가치유 특성을 분석하였다. 거시적 평가를 위하여 두 개의 다른 염료를 함유한 원형 수화젤을 이등분으로 절단한 후 재부착하여 자가치유 특성을 평가하였다.
|
Figure 1 (a) Synthesis of GC-CA conjugate; (b) formation reaction of GC-CA hydrogel. |
|
Figure 2 Photographs of sol-gel transition of GC-CA hydrogel. |
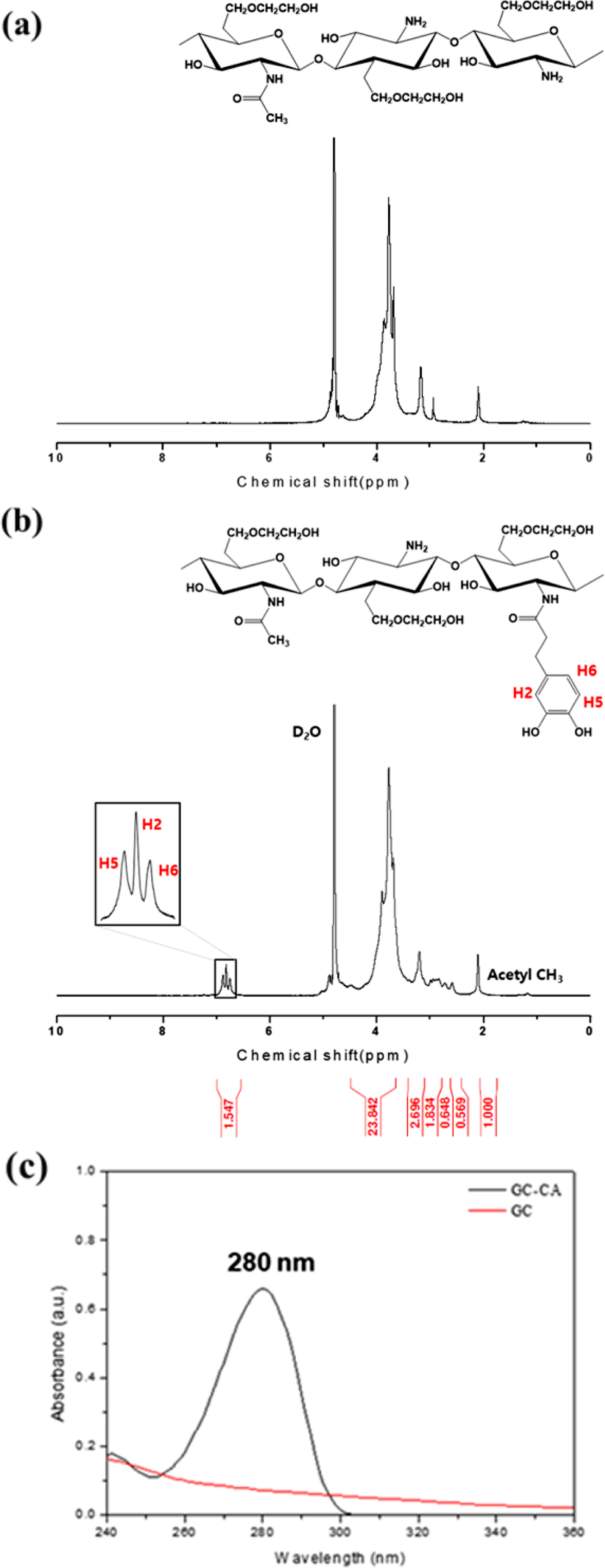
1H NMR을 이용한 구조분석. GC-CA 유도체의 구조는 1H NMR 스펙트럼을 사용하여 확인하였는데, 카테콜기의 치환도는
카테콜기의 양성자(3H, 6.75-6.88 ppm)와 아세틸기의 양성자(3H, 2.1-2.25 ppm)의 피크면적을 비교하여 계산하였다.
Figure 3(a)는 GC의 NMR 스펙트럼으로 전형적인 특성피크를 확인할 수 있었다. 한편, Figure 3(b)의 GC-CA 유도체의 1H NMR 스펙트럼을 이용하여 GC에 카테콜기가 도입되었음을
알 수 있었다. 합성한 GC-CA 유도체는 7 ppm 근처에서 카테콜기의 피크가 관찰되었으며, 이와 같은 새로운 카테콜기의 피크를 관찰함으로써
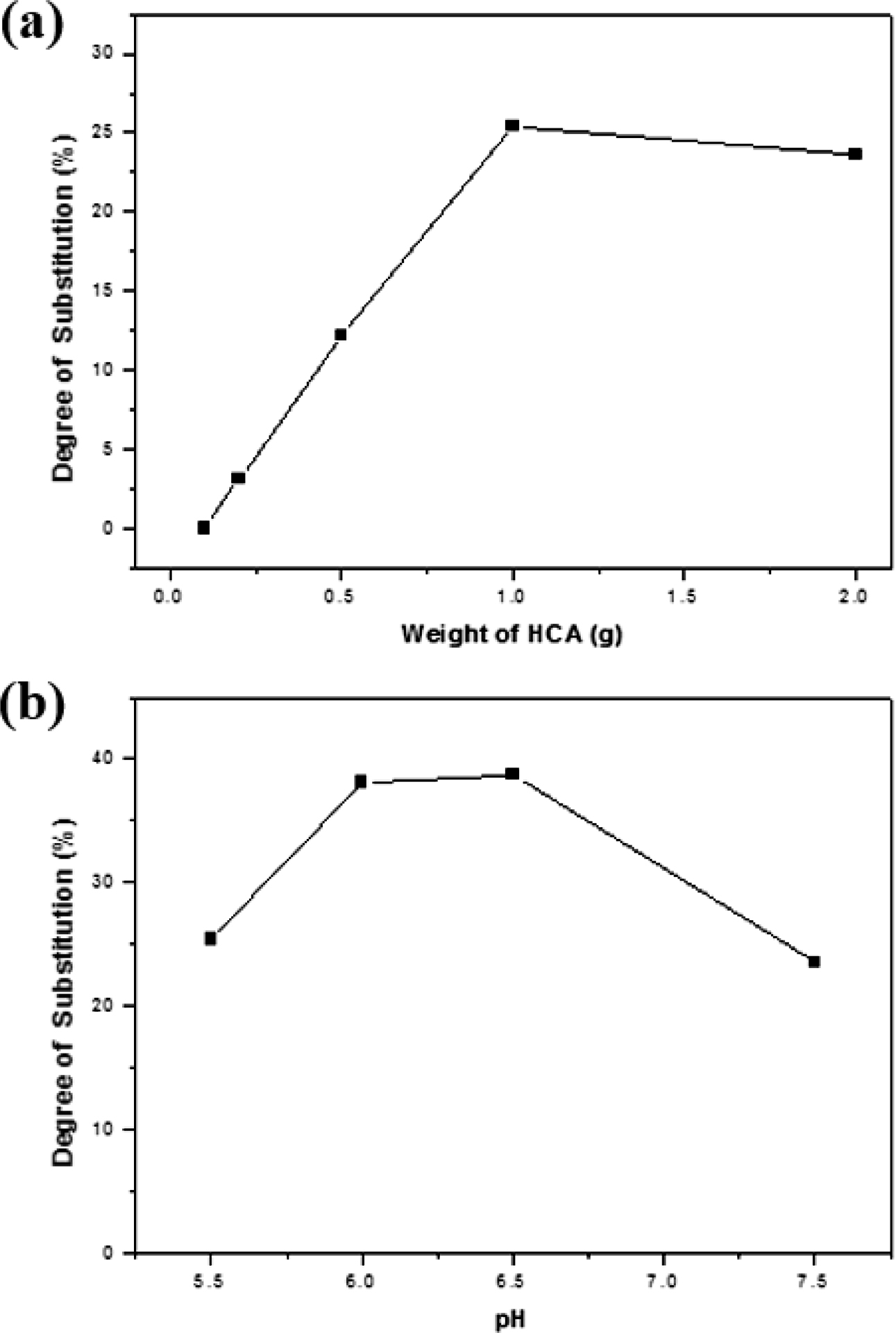
GC-CA 유도체가 잘 합성되었음을 알 수 있었다. pH 5.5의 수용액에서 HCA의 양에 따른 GC-CA 유도체의 카테콜기 치환도의 변화를
Figure 4(a)에 나타내었다. 반응 시 HCA의 양이 증가함에 따라 치환도가 상승하지만 1 g 이상의 투입량에서는 큰 변화가 없는 것으로 나타났다.
또한 Figure 4(b)는 HCA의 투입량을 1 g으로 고정하여 카테콜기 치환도의 변화를 pH 5.5~7.5 범위에서 관찰한 결과이다. GC는 중성의
pH에서도 물에 대한 용해성이 우수하므로 pH 5.5에서 보다 pH 6.5에서 치환도가 높아짐을 확인할 수 있었다. 그러나 pH 7.5에서는 일부
산화된 HCA에 기인하여 GC의 아민기와의 반응이 덜 일어나므로 치환도가 조금 감소된 것을 알 수 있었다. 따라서 최대 38.6%의 치환도를 가지는
GC-CA 유도체의 반응조건으로 HCA의 양(1 g)과 pH(6.5)를 고정하였다.
UV-Vis
스펙트럼을 이용한 구조분석. 1H NMR 스펙트럼과 함께 UV-Vis 스펙트럼은 카테콜기의
치환도를 정량하는데 자주 사용되는 방법이다. 카테콜기의 최대흡수피크는 280 nm의 파장에서 나타난다고 알려져 있다. Figure
3(c)에는 GC와 GC-CA 유도체의 UV-Vis 스펙트럼을 비교하여 나타내었다. GC-CA 유도체에서는 280 nm에서 최대흡수피크를 관찰되었고 이는 카테콜기가 잘
도입되었음을 의미한다. 또한 300 nm에서의 흡광도 값이 0.015이며 그 이상의 파장에서는 흡광도 값이 0에 수렴하였다. 이러한 300 nm 이상의 파장에서 낮은 흡광도 값을 갖는다는 사실로부터
GC에 도입된 카테콜기가 거의 산화되지 않았음을 알 수 있었다.10
ATR-IR을 이용한 구조분석. 순수 GC, 합성된 GC-CA 유도체 및 그 수화젤의
구조를 분석하기 위해 ATR-IR 스펙트럼을 사용하였으며 Figure 5에 그 결과를 나타내었다. 먼저 GC의 스펙트럼을 살펴본 결과,
1646 cm-1에서 GC의 특성피크인
amide I/II 밴드의 -C=O기가 관찰되었고, 1580 cm-1에서는 –NH2기의
피크가 나타났다.11,12 GC-CA 유도체에서는 EDC반응을 통해 –NH2가 HCA와 반응하면서 –NH2기
피크가 작아지는 것을 알 수 있었고, 1523 cm-1에서 방향족 고리에 의한 피크가 생성되었다. 따라서 카테콜기가 잘
도입된 것을 확인할 수 있었다. 또한 제조된 수화젤의 ATR-IR 스펙트럼의 관찰결과, 위와 동일하게 GC의 특성피크인 1580 cm-1의 –NH2기의
피크가 감소한 것을 관찰할 수 있었다. GC-CA 수화젤은 GC-CA 유도체에 비해 1642 cm-1 피크가 증가하였는데,
이는 GC의 NH2기와 카테콜의 퀴논구조의 -C=O 사이에 이민결합이 형성되었음을 의미한다. 따라서 본 실험에서 사용한 조건에서
이민결합의 형성에 의해 수화젤이 형성되었다고 추정할 수 있었다.
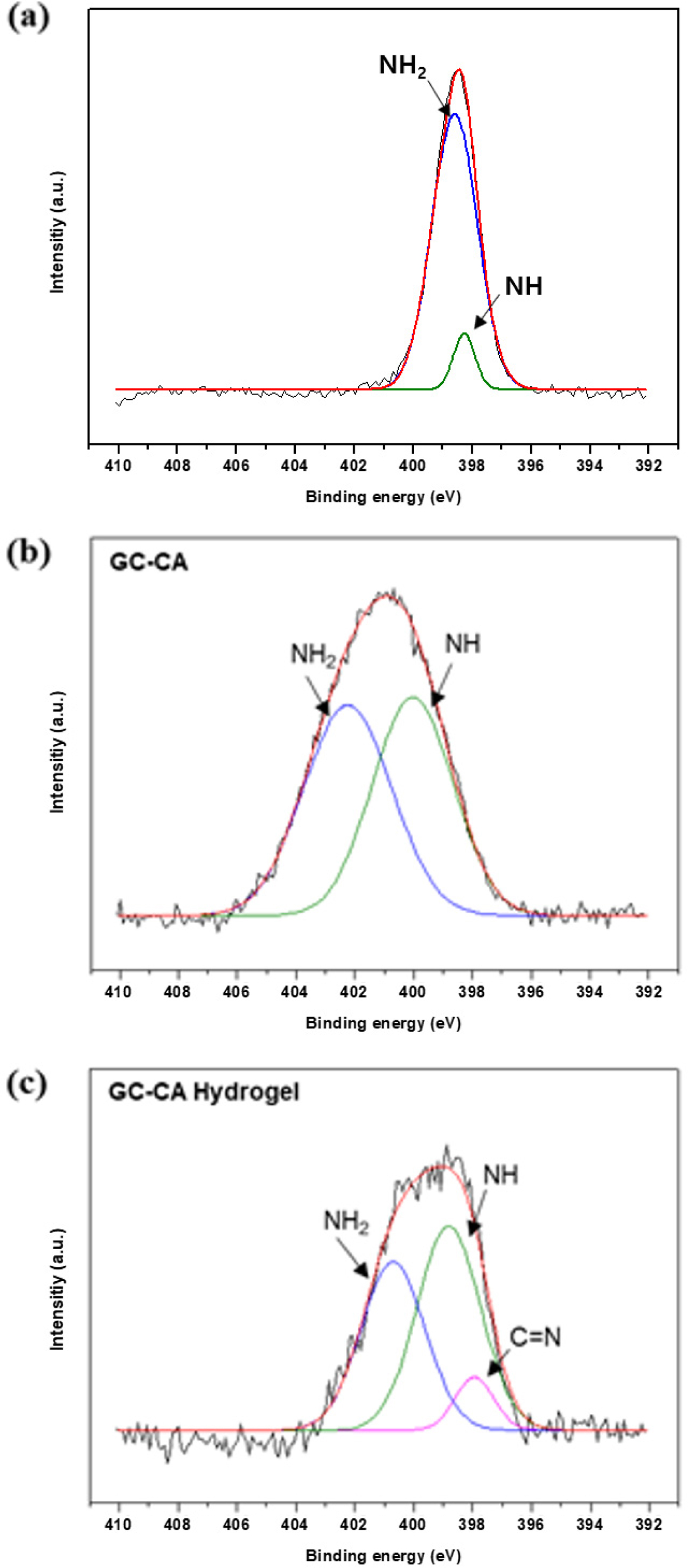
XPS를 이용한 구조분석. GC-CA 유도체로부터 이민결합에 의한 수화젤의 형성을
좀 더 명확하게 해석하기 위해 XPS 분석을 사용하였다. GC, GC-CA 유도체 및 수화젤의 XPS 스펙트럼을 Figure 6에 나타내었다.
결합에너지 390~410 eV 범위에서 N1s 스펙트럼을 살펴본 결과, GC의 –NH2기가 HCA와 반응하여
GC-CA 유도체를 형성하면서 GC의 –NH2기에 기인한 피크가 줄어든 것을 관찰할 수 있었다. 따라서 카테콜기가 잘 도입되었음을
알 수 있었다. 제조된 수화젤의 경우, GC의 –NH2기와 카테콜기의 퀴논기 사이에서 이민결합(-C=N-)의 형성을 통한 분자간
가교가 이루어지면서 수화젤을 형성하기 때문에 Figure 6(c)에서 이민결합에 의한 피크가 일부 생성된 것을 알 수 있다. 따라서 본 실험에서
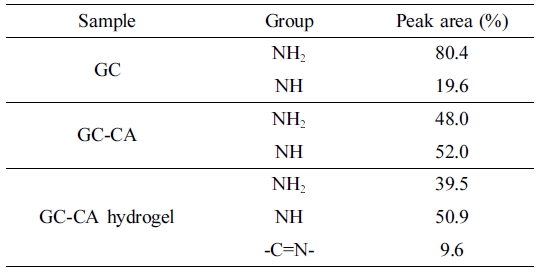
제조된 GC-CA 수화젤은 분자간 이민결합 형성에 의한 것으로 추정할 수 있었다. 또한 Table 1에 GC, GC-CA 및 GC-CA 수화젤에
대한 –NH2, -NH- 및 –C=N- 결합의 상대적인 양을 정리하여 제시하였다.
젤화거동 분석. 예비실험을 통해 수용액의 농도에 따른 수화젤의 형성거동을
유변학적으로 해석한 결과, 수화젤의 형성을 위한 GC-CA의 농도를 10 wt%로 고정하였다. 이후, pH 변화에 따른 수화젤
형성거동을 살펴보았는데, 고분자의 엉킴이 발생하는 10 wt% 농도에서의 pH 변화에 따른 GC-CA의 젤화거동을 Figure 7에 나타내었다. pH는 3.0,
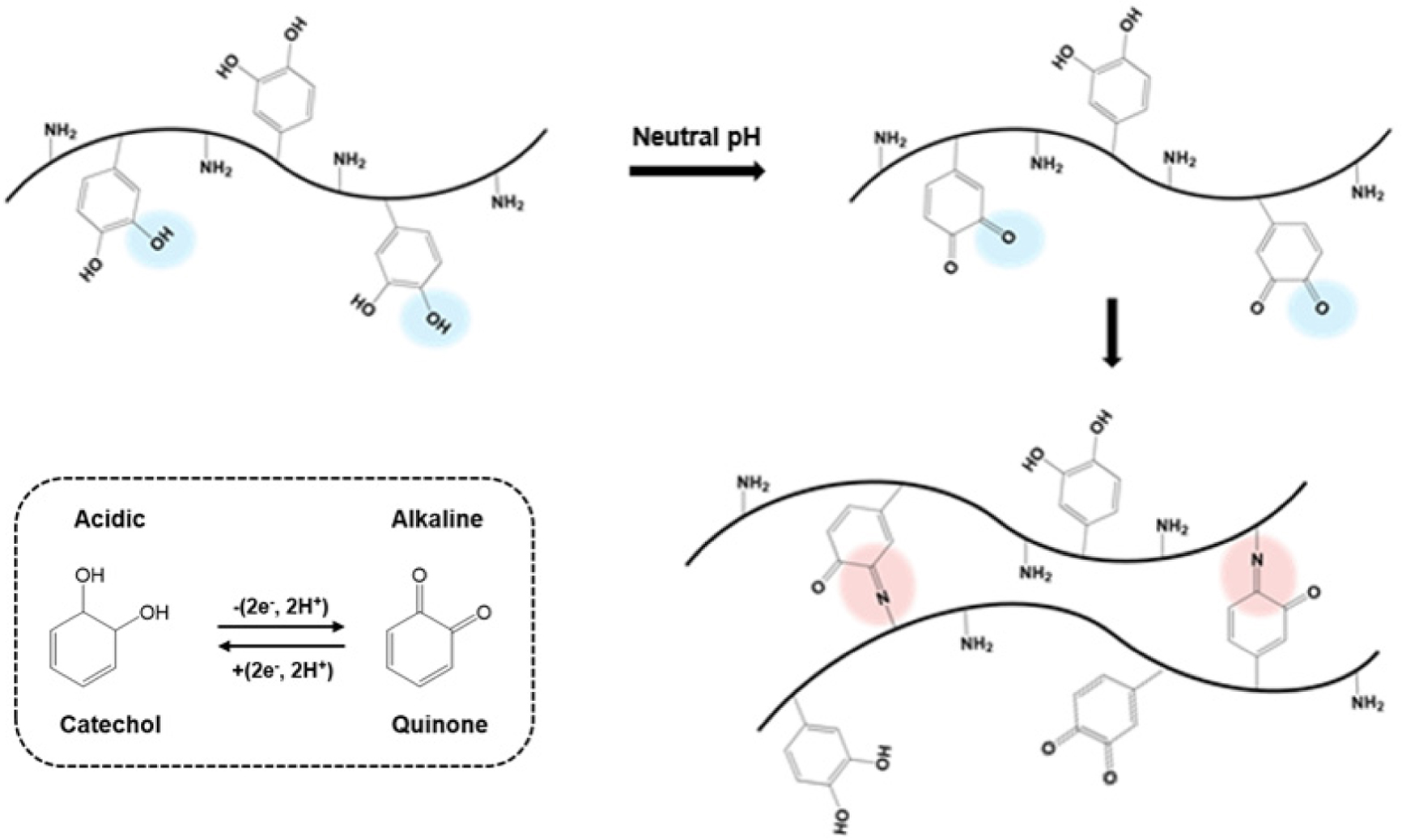
5.0, 6.0, 7.0 및 9.0으로 변화시켜 실험하였다. 그 결과, pH 3~5 범위의 산성영역에서는 아민기가 대부분 암모늄으로 이온화되어
이민결합을 형성하기 힘들기 때문에 GC-CA 수화젤이 형성되지 않았으며, 또한 pH 7 이상의 중성 및 약염기성 영역에서는 빠른 젤화로 인해 불균일한
수화젤이 형성되었다. 또한 약염기성 조건에서는 카테콜기가 급격하게 산화되어 이민결합보다는 퀴논구조에 의한 카테콜-카테콜기 간의 비가역적인 공유결합이
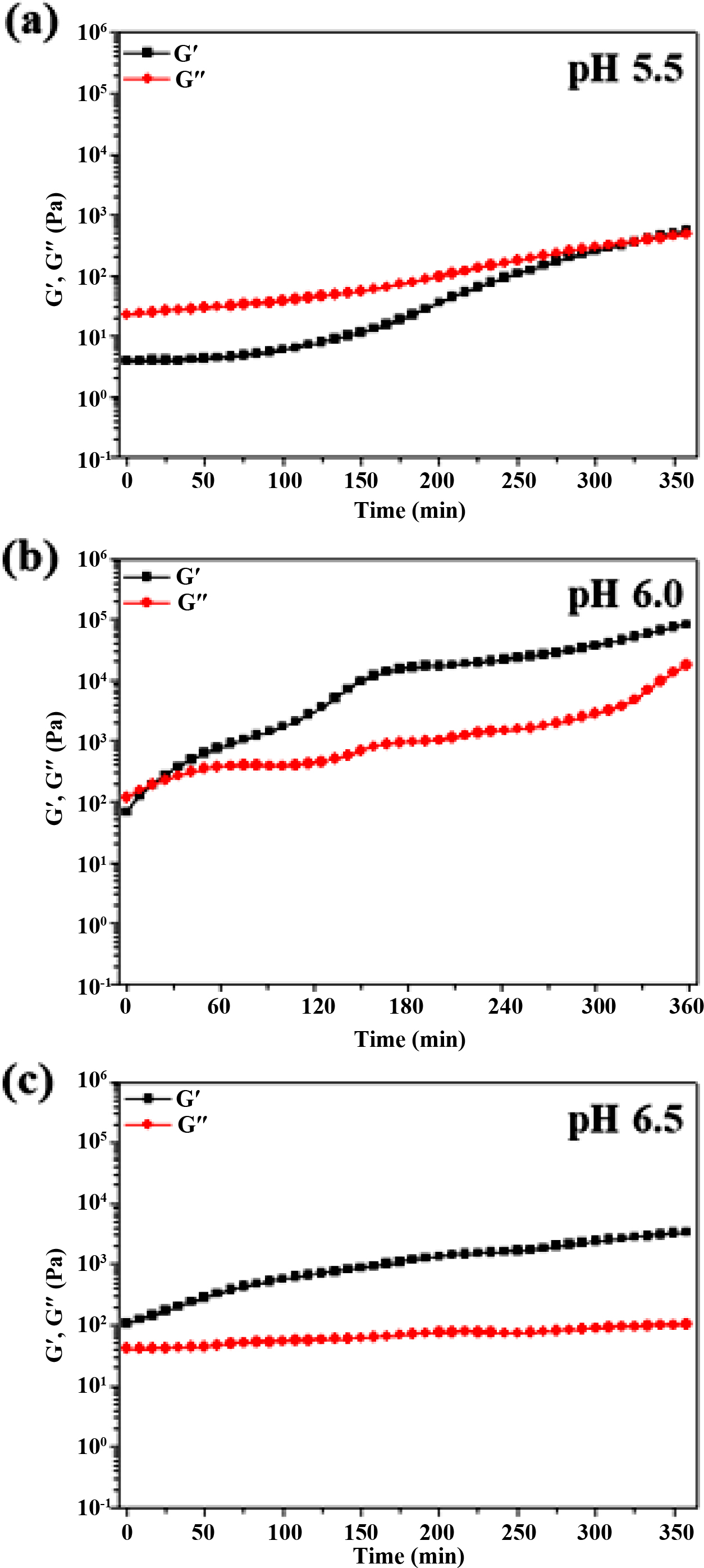
증가하여 자가치유 특성이 발현되지 않는 수화젤이 제조되었다. 따라서 약산성 영역의 pH를 세분화하여 5.5, 6.0, 6.5에서 유변학적 거동을
관찰하였으며, 그 결과는 Figure 8에 나타내었다. pH 5.5에서는 젤화시간이 6시간으로 상당히 길었고, 반대로 pH 6.5 조건에서는 젤화시간이
너무 빨라 측정시료를 제조하는 과정에서 수화젤이 형성되었다. 따라서 pH 5.5~6.5 범위의 약산성 영역에서는 균일한 수화젤이 형성되었고,
pH가 5.5에서 6.5로 증가할수록 젤화시간이 6시간에서 수초까지 단축되었다. 자가치유능을 가지는 GC-CA 수화젤의 제조를 위해서 젤화시간이
3분까지 단축되었고 비교적 균일한 수화젤을 형성하는 pH 6.0의 조건을 최적 pH로 하여 이 이후의 실험에 적용하였다.
자가치유 특성분석. GC-CA 수화젤의 가역적인 가교결합의 형성여부를 살펴보기
위해 농도를 10 wt%로 고정하고 pH 6의 조건에서 레오미터로 측정하였다.
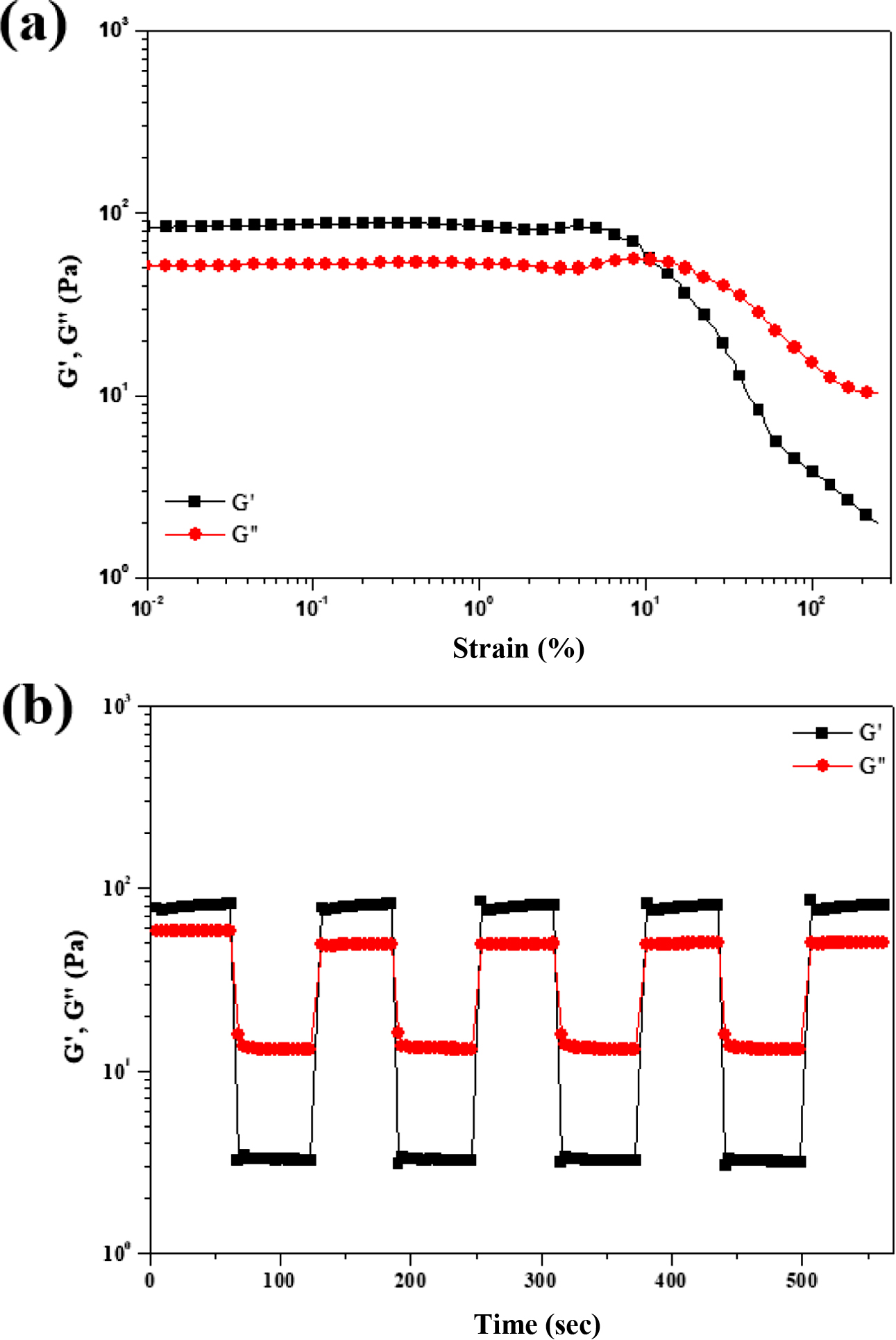
Strain amplitude sweep 테스트로 변형률을 0.01~250%로 조절하였고 angular frequency(f )는 1 Hz로 고정하여 실험하였다. Figure 9(a)에 나타낸
변형률에 따른 G' 및 G''의 변화에서
약 70%에서 G'과 G'' 값의 역전이 일어나는
것으로 보아 수화젤의 파단이 일어나는 것을 알 수 있었다.
수화젤의 파단이 일어나는
변형률(~70%)을 참고로 하여 변형률을 1%와 120%로 교대로 1분씩 진행하여 수화젤의 자가치유능을 살펴본 결과를 Figure 9(b)에 나타내었다.
수화젤은 1%의 변형률에서는 기존의 수화젤의 물성을 나타내었지만, 변형률 120%에서는 졸-젤 전이가 일어나며 수화젤이 파괴됨을 확인하였다. 그러나
다시 1% 변형률로 변경하였을 때 수 초 내로 기존 수화젤의 거동으로 즉시 회복하는 것을 확인하였다. 이는 외력에 의해 가교가 절단되어 파단되었던
수화젤이 외력이 줄어듬에 따라 재가교가 형성되어 물성이 빠르게 회복되는 것을 의미한다. 따라서 GC-CA 수화젤이 가지는 자가치유능은 아미노기와
카테콜기 간에 형성되는 가역적인 분자 간 가교결합(이민결합)에 기인한다는 것을 알 수 있었다.
Figure 10은
GC-CA 수화젤의 자가치유능을 거시적으로 평가한 결과이다. 각각 다른 염료로 염색된 수화젤을 2등분으로 절단한 후 재부착하는 실험을 진행하였다.
재접착 후 10분 후부터 서서히 계면이 사라지는 것을 보였고 1시간 후 수화젤을 양 쪽에서 잡아 당겼을 때 파단이 일어나지 않고 신장되는 것으로
보아 가역적 가교결합에 의한 자가치유 특성이 잘 발현되었음을 관찰할 수 있었다.
|
Figure 3 1H NMR spectra of (a) GC; (b) GC-CA conjugate; (c) UV-Vis spectra of GC and GC-CA conjugate. |
|
Figure 4 Change in degree of substitution of GC-CA with (a) different HCA contents; (b) different pH conditions. |

|
Figure 5 ATR-IR spectra of GC, GC-CA, and GC-CA hydrogel. |
|
Figure 6 XPS spectra in N1s region of GC, GC-CA, and GC-CA hydrogel. |

|
Figure 7 Photographs of GC-CA solution with different pHs. |
|
Figure 8 Rheological behavior for GC-CA hydrogels with different pHs. |
|
Figure 9 (a) G′ and G″ of GC-CA hydrogel with 10 wt% concentration from strain amplitude sweep (γ = 0.01%~250%) at a fixed angular frequency (1 rad/s); (b) damage-healing property of GC-CA hydrogel with 10 wt% obtained by continuous step strain (1%~120% strain) measurements. |

|
Figure 10 Macroscopic self-healing behavior of GC-CA hydrogel. the hydrogel was cut into two pieces and stretched after 1 h. |
|
Table 1 Relative Percentage of Peak Area of XPS C1s Spectra of GC, GC-CA and GC-CA Hydrogel |
본 연구에서는 추가적인
화학적 가교제의 첨가 없이 글리콜 키토산 유도체 기반의 수화젤을 제조였으며, 또한 수화젤에 자가치유 특성을 부여하기 위해 글리콜 키토산의 아민기와
카테콜기의 산화에 의해 형성되는 카테콜 퀴논과의 Schiff’s base 형성반응을 통한 가역적 이민결합을 형성시켰다. 1H NMR과 UV-Vis 스펙트럼을 통해 글리콜 키토산에
카테콜기가 성공적으로 도입되었음을 관찰하였다. 또한 ATR-IR, XPS 스펙트럼 결과에서는 카테콜기가 잘 도입된 것 뿐만 아니라 제조된 수화젤에
가역적 이민결합이 형성되었음을 확인하였다. 수화젤의 형성거동을 유변학적으로 해석하기 위해 레오미터를 이용하였고, pH 변화에 따른 수화젤 형성은
산성 pH에서는 아민기가 대부분 암모늄으로 이온화되어 수화젤이 형성되지 않았으며, 약염기성 조건에서는 카테콜기의 빠른 산화로 인하여 이민결합이
아닌 카테콜기 간 비가역적 공유결합이 형성됨에 따라 불균일한 수화젤이 형성된 반면에, 약산성 조건에서는 카테콜기의 느린 산화를 기반으로 이민결합
형성이 우세하여 자기치유 특성을 갖는 수화젤이 제조되는 것을 관찰하였다. 카테콜-글리콜 키토산 수화젤은 가역적이고 반복적인 자가치유 기능을 발현하였고
이것을 거시적 및 미시적 관찰로 확인할 수 있었다. 이러한 결과를 통해 자가치유 특성이 부여된 글리콜 키토산 수화젤은 조직공학, 특히 연골재생
분야에 유용하게 적용될 수 있을 것으로 기대된다.
- 1. H. Y. Lee and S. H. Cha, KIC News, 20, 33 (2017).
- 2. S. R. White, N. R. Sottos, P. H. Geubelle, and J. S. Moore, Nature, 409, 794 (2001).
-

- 3. C. Dry, Compos. Struct., 35, 263 (1996).
-

- 4. Yang, M. W. Keller, J. S. Moore, and S. R. White, Macromolecules, 41, 9650 (2008).
-

- 5. S. Then, G. S. Neon, A. Kasim, and N. Hayaty, Sains Malays., 40, 795 (2011).
-

- 6. H. Lee, S, Y. Choi, K. Y. Shin, J. H. Yang, and J. W. Jeong, KIC News, 20, 18 (2017).
- 7. P. Cordier, F. Tournilhac, C. Soulié-Ziakovic, and L. Leibler, Nature, 451, 977 (2008).
-

- 8. F. Herbst, D. Döhler, P. Michael, and W. H. Binder, Macromol. Rapid Commun., 34, 203 (2013).
-

- 9. D. Montarnal, P. Cordier, C. Soulié‐Ziakovic, F. Tournilhac, and L. Leibler, J. Polym. Sci., Part A: Polym. Chem., 46, 7925 (2008).
-

- 10. Y. Liu and S. Hsu, Front. Chem., 6, 449 (2018).
-

- 11. H. Yuan, S. Zhang, C. Lu, S. He, and F. An, Appl. Surf. Sci., 279, 279 (2013).
-

- 12. Y. Zheng, Y. Zhai, G. Li, B. Guo, X. Zeng, L. Wang, H. Yu, and J. Guo, J. Appl. Polym. Sci., 121, 702 (2011).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(2): 225-232
Published online Mar 25, 2020
- 10.7317/pk.2020.44.2.225
- Received on Jan 13, 2020
- Revised on Feb 13, 2020
- Accepted on Feb 14, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Won Ho Park
-
Department of Organic Materials Engineering, Chungnam National University, Daejeon 34134, Korea
- E-mail: parkwh@cnu.ac.kr
- ORCID:
0000-0003-1768-830X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.