- Preparation of Antioxidant Hydrogel Contact Lenses Based on Interpenetrating Hyaluronic Acid Network
Department of Chemistry, Dankook University, Chungnam 31116, Korea
*Department of Chemistry, Chosun University, Gwangju 61452, Korea- 상호침투 히알루론산 네트워크 구조를 기반으로 한 항산화 기능성 수화젤 콘택트렌즈 제조
단국대학교 화학과, *조선대학교 화학과
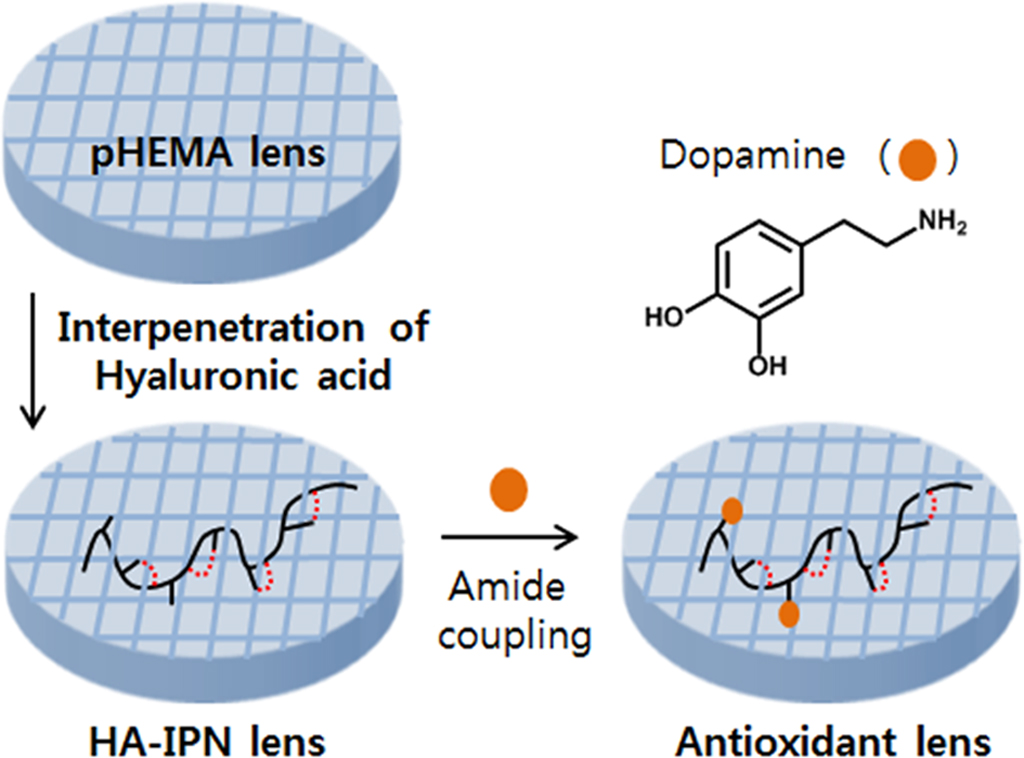
In this work, we prepared
antioxidant contact lenses functionalized with polyphenolic dopamine on the
lens surface. Before introducing the antioxidant dopamine, poly(2-hydroxyethyl
methacrylate) (pHEMA) lens was synthesized by copolymerizing 2-hydroxyethyl
methacrylate (HEMA) and ethylene glycol dimethacrylate (EGDMA). The pHEMA lens
surface formed an interpenetrating hyaluronic acid network structure, and the
carboxylic acid of hyaluronic acid polymer was coupled with dopamine, finally
yielding antioxidant contact lens. The prepared antioxidant lens showed a high
optical transparency, and better water content and surface hydrophilicity than
those of pHEMA lens. The antioxidant activity of the antioxidant contact lens
was about 80% higher than that of the pHEMA lens (12.6%), as characterized by
2,2-diphenyl-1-picrylhydrazyl and
2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) radical scavenging
assays. These antioxidant results are equivalent to more than 98% of the
ascorbic acid antioxidant activity.
본 연구에서는 도파민을 표면에 부착한 항산화 콘택트렌즈를
제조하였다. 2-Hydroxyethyl methacrylate(HEMA), ethylene glycol
dimethacrylate(EGDMA)를 공중합하여 기본
pHEMA 렌즈를 제조하였다. 제조된 렌즈 표면에 히알루론산 고분자를 상호침투시킨 후, 히알루론산의 카복실산 부분에 도파민으로 공유 결합시켜 항산화 콘택트렌즈를 제조하였다. 본 항산화 렌즈는 높은 광학 투명도를 보였으며, pHEMA 렌즈
대비 높은 습윤성 및 표면 친수성을 나타내었다. 라디칼 소거능 시험을 이용하여 항산화 기능성을 확인한
결과, 항산화 렌즈는 도파민을 부착하지 않은 pHEMA 렌즈에
비해 높은 소거율을 나타냈다. 본 결과는 대표적 항산화 물질인 아스코빅산의 항산화 기능대비 98% 이상에 해당하는 수치이다
Antioxidant hydrogel contact lens could be obtained by the
formation of interpenetrating hyaluronic acid network on the lens surface and
subsequent amide-coupling with polyphenolic dopamine group. The prepared
contact lenses exhibited an excellent antioxidant capability, which is nearly
equivalent to that of ascorbic acid.
Keywords: hydrogel, contact lens, antioxidant, interpenetrating polymer network, dopamine
콘택트렌즈는 비교적
짧은 역사에도 불구하고 대표적 굴절이상 교정 기구로서 사용이 증가하는 추세이다. 또한 단순한 미용 렌즈의 기능을 넘어 약물 전달용,1
신체 신호 감지용2 등 다양한 기능성이 부여되어 개발되고 있다. 야외 활동으로 인한 고에너지 자외선의 노출은 안구 내 라디칼
형태의 활성 산소(reactive oxygen species, ROS) 생성을 증가시켜 세포 손상을 야기한다고 보고되었다.3
그 결과, 활성 산소는 수정체 상피 세포의 사멸을 유도하고 녹내장과 백내장 등 각종 안질환을 유발한다.4 이러한 활성 산소는
항산화 물질로부터 제거될 수 있는데, 항산화 물질은 산화 연쇄 반응의 개시나 증식을 억제함으로써 다른 분자의 산화를 지연시키는 화합물이다. 이 물질의 주요 역할은 활성 산소로 인한 신체 손상으로부터
몸을 보호하는 것이다.5 폴리페놀계열 화합물은 방향족 부분에 위치한 하이드록시 그룹이 라디칼과 반응하여 Figure 1과
같이 퀴논 형태로 전환되어 항산화 기능을 수행할 수 있는 것으로 알려져 있다.6,7 도파민은 폴리페놀계열의 대표적 항산화 물질로
잘 알려져 있으며, 활성 산소가 발병 원인 중 하나로 뽑히는 파킨슨병의 치료제로 이용되고있다.8,9
히알루론산은 습윤성과
생체 적합성, 단백질 흡착 억제 등의 특성 때문에 생체 재료로 적용될 뿐만 아니라 콘택트렌즈와 같은 수화젤 분야에서도 기능성 물질로 연구되고 있다.10-12
한편, 수화젤에 기능성 작용기를
도입하는 다양한 방법들이 시도되고 있다. 일례로, 정전기 상호 작용(electrostatic interaction)을 이용하는 방법 및 티올-엔
클릭 반응(thiol-ene click reaction) 등의 직접적인 화학결합 형성을 통한 방법들이 시도되고 있다.13,14
또한 수화젤을 개조하기 위한 또 다른 방법으로, 수화젤 표면에서 고분자와의 물리적 침투를 통해 젤 표면 기능을 수정할 수 있는 상호침투 중합체
네트워크(interpenetrating polymer networks, IPNs) 형성법도 시도되고 있다. 상호침투 중합체 네트워크는 두 개 이상의
중합체가 적어도 하나의 가교 결합을 이루어 사슬이 물리적으로 얽혀있는 구조이다.15 이 구조를 사용할 때 이점 중 하나는 상이한
성질을 갖는 고분자들이 양립성을 최소화하면서 조합할 수 있어, 추가의 공정 단계를 거치지 않는 것이다.16
본 연구에서는 항산화
물질을 콘택트렌즈에 부착하여 안구 내 활성 산소를 감소시키는 것을 목적으로 한다. 히알루론산을 사용하여 poly(2-hydroxyethyl
methacrylate)(pHEMA)와 상호침투 중합체 네트워크 구조를 형성한 후 도파민을 부착하여 항산화 기능성 콘택트렌즈를 제조하였다. 제조된
항산화 콘택트렌즈는 도파민 그룹을 공유결합을 통해 도입하였기 때문에, 안구로 침투를 방지하기 때문에, 생체 부작용을 방지할 수 있을 것으로 예상이
된다. 도파민 그룹을 히알루론산 상호 침투 중합체 형성 후에 도입한 이유는, 2-hydroxyethyl methacrylate(HEMA)로만 이루어진
렌즈의 경우, 하이드록시 그룹으로만 구성되어 있기 때문에, 도파민과의 화학 결합이 용이하지 않을 뿐만 아니라, 위에서 언급한 히알루론산의 특성들이
렌즈에 장점으로 작용할 수 있기 때문이다. 최종적으로, 본 연구에서는 DPPH 라디칼 소거능 시험을 통해 도파민이 없는 렌즈들과의 항산화 능력을 비교 분석하였다.

|
Figure 1 Antioxidant mechanism of dopamine unit through oxidation of catechol into ortho-quinone. |
재료. 본 연구에 사용된 시약들인 HEMA,
ethylene glycol dimethacrylate(EGDMA), 2,2-azobis(2-methylpropionitrile) (AIBN),
2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulphonic
acid)(ABTS), potassium persulfate, dopamine hydrochloride, 히알루론산(hyaluronic
acid, 10 kDa)을 Sigma-Aldrich사로부터 구입하였고,
1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride(EDC-HCl), n-hydroxysuccinimide(NHS),
adipic dihydrazide를 Tokyo Chemical Industry사로부터 구입하여 정제 없이 사용하였다.
pHEMA
렌즈 제조. 바이알에 친수성 단량체인 HEMA 9.92 g과 개시제인 AIBN 0.04 g, 가교제인 EGDMA 0.04 g을 넣고 30분 동안 초음파 처리를 수행하여 균일하게
용해시켰다. 준비된 혼합시료를 암형인 polypropylene(PP) 몰드에 주입한 후, 수형인 polybutylene terephthalate(PBT) 몰드로 덮는다. 이후, 온도를 90 ℃로 유지한 오븐에서 4시간 동안 열중합을 수행하였다. 몰드로부터 탈착한 pHEMA 렌즈들은 반응하지 않은
단량체와 개시제를 제거하기 위해 2일 동안 탈염수에서 세척과정을 거쳤다. 탈염수는 1일에 세 번씩 교체하였다.
히알루론산 수정. Adipic dihydrazide 0.032 g(7.89×10-4 mol)를 탈염수 10 mL에 용해시킨 후, pH가 4.5~4.8이 될 때까지
0.1 M HCl을 첨가하였다. 다른 비이커에 히알루론산 0.1 g(2.63×10-4mol),
EDC-HCl 0.015 g(7.89×10-5 mol),
NHS 0.009 g(7.89×10-5 mol)을 정량하여 차례로 넣고 탈염수 20 mL로 용해시킨다. 만들어진 히알루론산 수용액을 앞서
만든 adipic dihydrazide 수용액에 첨가한다. 이후, pH 페이퍼를 사용하여 pH가 4.5~4.8인지 다시 확인한다. 혼합액은
24시간 동안 실온에서 교반하였다.
히알루론산이 수정된 정도는 핵자기 공명분광법을 통해 확인하였다.
상호침투 중합체 네트워트 렌즈(HA-IPN Lens) 제조. 수정된 히알루론산 용액에 pHEMA 렌즈 10개를 담근
후, 과량의 EDC-HCl 0.5 g과 NHS 0.5 g을 차례로 첨가하였다. 가교 결합 반응은 실온에서
24시간 동안 진행되었다. 가교 결합된 HA-IPN 렌즈들은 반응하지 않은 가교 결합제를 제거하기 위해 2일 동안 탈염수에서 세척하였다. 탈염수는
1일에 세 번씩 교체하였다.
Dopamine
부착 렌즈(Dopa-HA-IPN Lens) 제조. 20 mL 탈염수에 HA-IPN 렌즈 10개를 담근 후,
EDC-HCl 0.3 g (1.6×10-3 mol), NHS 0.18 g(1.6×10-3 mol), dopamine hydro-chloride
0.3 g(1.6×10-3 mol)을 차례로
첨가했다. 반응은 실온에서 24시간 동안 진행되었다. 도파민이 부착된 렌즈들은 반응하지 않은 생성물을 제거하기 위해 2일 동안 탈염수에 담갔다.
탈염수는 1일에 세 번씩 교체하였다. 렌즈에 부착된 도파민 그룹의 몰 수 정량은 자외선-가시광선 흡광도 측정을 통해 얻을 수 있었다. 이를 위해,
표준 물질로 도파민을 사용하여 표준 검정선을 우선적으로 작성하였다. 280 nm에서 나타나는 도파민 그룹의 특성 흡수 피이크의 흡광도
세기를 도파민 농도에 따라 표시한 후, 최소 자승법을 이용하여 직선 방정식을 얻을 수 있었다. 얻어진 방정식의 R2은
0.9999 값을 나타내었다. 이 후, 항산화 콘택트렌즈의 흡수 스펙트럼을 얻은 후, 검정선에 대입하여, 항산화 콘택트렌즈 표면 당 도파민 몰
수를 계산하였다. 항산화 콘택트렌즈의 흡광도는 1.037을 나타냈고, beer의 법칙에 따라 도파민은 렌즈의 표면 (1 cm2) 당 0.327 μmol이 함유된 것을 확인하였다. 따라서 렌즈 한 개(0.985 cm2) 당 함유하는 도파민의 몰
수가 0.32 μmol인 것을 확인하였다.
가시광선 투과율 측정. UV-vis spectrophotometer(SHI-MADZU UV-2600)을 이용하여 가시광선 투과율을 측정하였다.
시편은 수화된 렌즈를 부분 절단하여 렌즈의 굴곡을 없앤 후, 슬라이드 글라스 사이에 넣은 후, 고정하여 투과율을 측정하였다.
함수율
측정. 제조된 수화젤 콘택트렌즈를 48시간 동안 탈염수에 담근
후, 표면 수분을 제거하였다. 수화된 렌즈의 무게를 측정하여, 식 (1)을 통해 함수율(percentage
of water content, PWC)을 계산하였다. 각 시료 별로 3차례 실험을 하여, 평균값을 표시하였다.
접촉각 측정. HI-SCOPE HS-300U를 이용하여 수화젤 콘택트렌즈의
접촉각을 측정하였다. 5 μL 물방울을 수화된 렌즈 표면에 떨어뜨리고 3분 후에
물방울 사진을 찍으면서, 각도를 결정하였다.
DPPH를 이용한 항산화 기능 측정. 시간에 따른 DPPH 용액(0.2 mM)의 라디칼 소거 정도를 UV-vis
spectrophotometer (SHIMADZU UV-2600)를 통해 517 nm에서의 용액 흡광도 변화를 측정함으로써 렌즈들의 항산화 기능성을 결정하였다.17-19 DPPH 용액은 DPPH 0.079 g을 100 mL의 에탄올에 넣어 제조한 후, 10배 희석하여 사용했다.
렌즈 샘플(각 샘플당 2개의 렌즈)들을 20 mL 갈색 바이알에 각각 넣은 뒤, 0.2 mM DPPH를 각 바이알에 2.7 mL씩 첨가했다. 따라서 DPPH 용액에 존재하는
DPPH 몰 수는 0.54 μmol에 해당한다. 37 ℃에서 30분 동안 상기 시료들을 교반한 후, 517 nm에서 흡광도를 측정하여 식 (2)를 통해 라디칼 소거율을
계산하였다. 아스코빅산의 경우, 0.002 M 농도의 수용액을 제조하여, 0.3 mL를 2.7 mL의 DPPH 용액(0.2 mM)에 첨가하여, 항산화 기능을 측정하였다.20
이렇게 첨가한 아스코빅산 용액 내 아스코빅산 888몰 수는 0.54 μmol에 해당한다. 이는 Dopa-HA-IPN 렌즈 2개에 부착된 도파민의 몰 수와 유사한 값이다.

ABTS를 이용한 항산화 기능 측정. 시간에 따른 ABTS 용액의 라디칼 소거 정도를
UV-vis spectrophotometer(SHIMADZU UVs-2600)를 통해 734 nm에서의
용액 흡광도 변화를 측정함으로써 렌즈들의 항산화 기능성을 결정하였다.21 7 mM
ABTS 용액과 2.4 mM K-persulfate를 같은 비율로 섞어 24시간 암실에서 반응하였다. 그 후, 734 mM에서 혼합액의 흡광도가 0.35~0.5되도록
메탄올로 희석한다. 렌즈 샘플(각 샘플당 2개의 렌즈) 들을 20 mL
갈색 바이알에 각각 넣은 뒤, ABTS 용액을 바이알에
2.7 mL씩 첨가했다. 37 ℃에서 30분 동안 상기 시료들을 교반한 후, 734 nm에서 흡광도를
측정하여 식 (3)을 통해 라디칼 소거율을 계산하였다. 아스코빅산의
경우, 위에서 기술한 바와 동일하게, 0.002 M 농도의
수용액을 제조하여, 0.3 mL를 2.7 mL의 ABTS 용액에 첨가하여, 항산화 기능을 측정하였다.
히알루론산 및 도파민을
기반으로 하는 항산화 수화젤 콘택트렌즈(Dopa-HA-IPN 렌즈)의 합성 과정은 Scheme 1에 나타내었다. 우선적으로, HEMA와 가교제인
EGDMA, 개시제인 AIBN을 사용하여 라디칼 중합을 통해 pHEMA 렌즈를 제조하였다.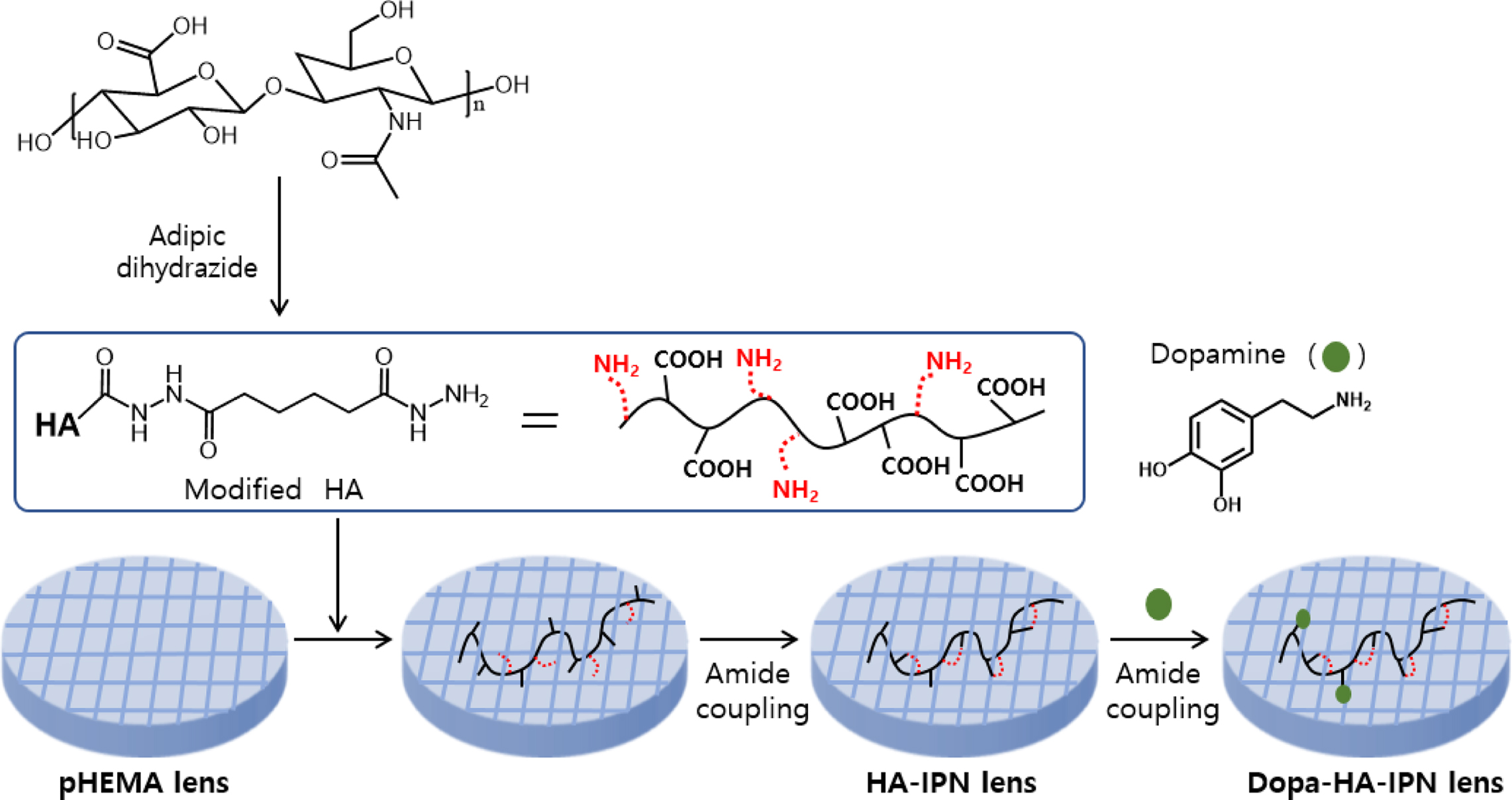
Scheme 1. Synthesis of antioxidant contact lenses via an interpenetrating polymer network formation and dopamine-coupling.
추후, 히알루론산과
pHEMA와의 상호침투 중합체 네트워크 구조를 형성시키기 위해, 우선 히알루론산에 위치하고 있는 카복실산 일부를 adipic
dihydrazide와 amide coupling을 통해, amine 그룹으로 전환하였다. 본 과정에서 히알루론산의 가교 반응을 억제하기 위해서,
히알루론산의 NHS로 처리된 카복실산 당량 대비, adipic dihydrazide의 당량을 상당히 과량인 10당량으로 맞추어 반응을 진행하였다.
수정된 히알루론산의 핵자기공명분광법을 통해, 히알루론산에 adipic dihydrazide 치환된 정도를 확인하였다. 1.94 ppm에서 나타나는 히알루론산 acetyl 수소 피이크와
2.27 ppm에서 나타나는 adipic dihydrazide의
methylene 피이크의 상대적인 적분값을 비교하여 결정한 결과, 히알루론산 카복실산 약 40%가 치환됨을 확인하였다(Figure
2).
다음 단계로, 수정된
히알루론산 고농도 수용액에 pHEMA 렌즈를 넣은 후, 상호침투를 용이하게 하기 위하여, 2시간 동안 방치과정을 거친 후, pHEMA 사슬과 히알루론산
사슬들 이 물리적으로 얽혀있는 상태에서 amide coupling 고정화 반응을 수행, HA-IPN 렌즈를 제조하였다. 이렇게 상호침투 중합체
네트워크 구조가 형성된 후에도, 반응에 참여하지 않은 약 20%의 히알루론산 카복실산 그룹과 도파민과의 amide coupling 반응을 통해,
최종적으로 항산화 기능성이 도입된 수화젤 콘택트렌즈(Dopa-HA-IPN 렌즈)를 제조할 수 있었다.
항산화 콘택트렌즈에
부착된 도파민을 정량하기 위해서 자외선-가시광선 흡광도를 측정하였다. 표준 물질로 도파민을 사용하여 표준 검정선을 작성하여, 항산화 콘택트렌즈
표면 당 도파민 몰 수를 계산하였다. 280 nm에서 Dopa-HA-IPN 렌즈의 흡광도는 1.037을 나타냈고, 따라서 도파민은 렌즈의 표면(1 cm2) 당 0.327 μmol이 함유된 것을 확인하였다(Figure
3). 이를 토대로, 렌즈 한 개(0.985 cm2) 당 함유하는 도파민의 몰 수가 0.32 μmol인 것을 알 수 있었다.
다음으로, 항산화
시험에 참여할 렌즈의 도파민 몰 수를 결정하기 위해 도파민의 몰 수에 따른 517 nm 파장의 흡광도를 측정하였다. 농도가 다른 5개(0.05,
0.1, 0.3, 0.5, 1 mM)의 도파민 용액을 제조한 후, 2.7 mL DPPH 용액에 1.5 mL씩 첨가하여 DPPH 항산화 시험을 진행하였다. 도파민
몰 수가 증가함에 따라, 517 nm 피이크가 감소하다가, 몰 수가 0.5 μmol (용액농도: 0.3 mM) 이상의 도파민 용액에서는 흡광도의 변화가 거의
없는 것을 알 수 있었다(Figure 4). 따라서 앞선 검정곡선과 위의 실험결과를 토대로, 항산화 기능성 시험에 사용할 렌즈 개수를 2개로(도파민
몰 수: 0.64 μmol) 고정하여 실험을 수행하였다. 왜냐하면,
DPPH 분자 몰 수보다 렌즈에 함유된 도파민 몰 수가 많은 조건을 제공하여야, 렌즈의 항산화 특성을 조사할 수 있기 때문이다.
수화젤 콘택트렌즈에
있어서 중요한 물리적 특성인 광학 투명도를 측정하기 위하여, 제조된 항산화 콘택트렌즈의 가시광선(파장 영역: 400~780 nm) %투과율을 자외선-가시광선 흡수 분광법을 통해 조사하였다.22 제조된 렌즈는
400 nm 이후 전체 가시광선 영역에서 95% 평균 투과율을 나타냈다. 이를 통해 항산화 콘택트렌즈는
렌즈 표면에 히알루론산의 가교결합이 균일하게 일어나 가시광선 산란을 초래하지 않는 것을 알 수 있었다. 한편, 본 콘택트렌즈는 자외선 영역에서
흡수가 일어나, 자외선 일부를 차단하는 것을 알 수 있었다. UVB 영역인 280-315 nm 범위와 UVA 영역인 315-400 nm 범위에서 각각 57.2%와 16.8%의 차단율을 나타내었다(Table 1).
다음으로 렌즈 착용감과
관련있는 함수율 및 접촉각 측정 실험을 수행하였다. 함수율은 pHEMA 렌즈, 히알루론산만을 포함한 렌즈(HA-IPN 렌즈), 항산화 렌즈(Dopa-HA-IPN
렌즈)를 각 3번씩 측정한 후,
평균하여 Table 2에 나타내었다. pHEMA 렌즈의 평균함수율은 38%였고 통상적으로 보고된 함수율(38%) 값과 일치하였다.
HA-IPN 렌즈는 55% 평균 함수율을 나타냈는데, 이는 히알루론산의 높은 습윤성으로 인한 함수율 증가로 pHEMA 렌즈에 비해 17% 높은
수치를 보였다. Dopa-HA-IPN 렌즈의 경우, 평균 함수율은 41%로 나타났다. 도파민이 첨가되어 Dopa-HA-IPN 렌즈보다는 낮은 함수율을
보였지만, 여전히 pHEMA 렌즈보다는 높은 함수율을 보였다. 렌즈 표면 친수성을 확인하기 위해 렌즈 위로 떨어뜨린
물방울의 접촉각을 측정하였다.23 pHEMA 렌즈의 경우, 85.7ᵒ의 접촉각을 나타낸
반면, HA-IPN 렌즈 및 Dopa-HA-IPN 렌즈의 접촉각은 60o 정도로 현저하게 낮아지는 것을 알 수 있었다(Table 2).
이는, 함수율에서 보였던 양상과 비슷하게, 히알루론산으로 수정된 렌즈의 표면이 수정 전 pHEMA 렌즈의 표면보다 높은 습윤성을 갖는 것을 알 수 있다.
주사 전자 현미경(scanning
electron microscope, SEM)을 통해 제조된 렌즈들의 표면을 확인하였다(Figure
5). 3개의 렌즈(pHEMA
렌즈, HA-IPN 렌즈, Dopa-HA-IPN 렌즈) 모두 매끄러운 표면 특성을 보였다. 따라서 히알루론산과 도파민이 표면에 추가되었지만, 렌즈
표면 형태는 크게 변하지 않는다는 것을 알 수 있었다.
제조된 항산화 콘택트렌즈의
항산화 기능은 DPPH 라디칼 소거능 분석법을 통해 우선적으로 확인하였다. DPPH 라디칼 소거 정도는 라디칼 피이크가 나타나는 517 nm 파장에서의 흡수 피이크 감소 정도를 통해 정량적 분석이
가능하다. DPPH 라디칼이 DPPH-H로 전환됨에 따라 가시광선 영역인 517 nm 파장의 흡수 피이크가 줄어들고, 용액의 색이 보라색에서
노란색으로 색변화가 일어난다. 항산화 기능은 준비된 3개의 콘택트렌즈(pHEMA 렌즈, HA-IPN 렌즈, Dopa-HA-IPN 렌즈)를 측정하여
비교 분석하였다. Table 3과 Figure 6에서 볼 수 있듯이, pHEMA 렌즈와
HA-IPN 렌즈의 517 nm 흡수 피이크는 완전히 사라지지 않았고 각각
12.6%와 45.5%의 라디칼 소거율을 보였다. 또한 시험 후 pHEMA 렌즈의 DPPH 용액은 거의 색변화가 일어나지 않아 초기 보라색을 띠었다.
HA-IPN 렌즈는 pHEMA 렌즈보다 약 33% 높은 소거율을 보인만큼 보라색이 옅어지는 현상이 관찰되었다. HA-IPN 렌즈는 pHEMA 렌즈보다
상대적으로 높은 항산화 기능을 나타난 이유는 pHEMA 렌즈는 일차 알코올로 구성되어 있는 반면, HA-IPN 렌즈는 2차 알코올로 구성되어 있기 때문으로 해석 가능하다. 알코올에 위치한 알파 수소와 라디칼 종과 반응이 선호되는데,
반응 후 형성되는 탄소 라디칼의 안정도를 고려하며, 2차 탄소에 위치한 라디칼이 hyperconjugation 효과로 인해 보다 안정하기 때문이다.
실제로, Hawkins와 Davies에 의해 수행된 히알루론산과 라디칼 반응 연구 논문에서, 라디칼 반응 후, 2차 탄소에 라디칼을 형성함으로써, 라디칼 반응이 진행되어 항산화 효과를 나타냄을 증명한 바
있다.24
한편, 항산화 물질이
부착된 Dopa-HA-IPN 렌즈는 라디칼 피이크가 완전히 사라져 형태를 알 수 없었고, 92%의 높은 라디칼 소거율을 보였다. 이는
phenol-OH와 라디칼과의 반응성이 매우 높다는 것을 나타낸다. pHEMA 렌즈, HA-IPN 렌즈를 포함하는 DPPH 용액들의 색과는 다르게
노란색을 띠어 렌즈에 부착된 도파민의 산화과정을 통해 DPPH 라디칼이 대부분 소거된 것을 알 수 있었다.
그러나 위의
DPPH 라디칼 소거능 시험으로 소거율을 결정할 경우, 517 nm에서의 흡수 피이크는 330 nm 근처에서 흡수하는 피이크의 영향으로 0의 흡수 세기를 갖을 수 없다. 따라서 라디칼 피이크가 완전히
사라져 형태를 보이지 않아도 소거율 100%를 나타낼 수 없기 때문에, 본 연구에서는 대표적 항산화 물질인 아스코빅산을 동일한 조건 하에서
DPPH 라디칼 소거능 시험을 진행하여 비교하였다. 아스코빅산의 소거율은 93.87%였고, 이를 100%라고 가정하여 본 연구에서 제조된 콘택트렌즈들과 비교하였다(Figure 7). pHEMA 렌즈와 HA-IPN 렌즈는 각각 13.4, 48.5%를 나타냈고,
Dopa-HA-IPN 렌즈는
98.9%로 아스코빅산과 비슷한 항산화 기능을 나타내었다.
DPPH 라디칼 소거능
분석법과 더불어, ABTS 라디칼 소거능 분석법을 통해서도 렌즈들의 항산화 기능을 확인하였다. ABTS 소거 정도는 734 nm 파장에서 피이크 감소 정도로 알 수 있다. ABTS 라디칼을 소거함에 따라 734 nm에서 나타나는 흡수 피이크의 세기가 줄어들고, 용액의
색은 초록색에서 노란색으로 변화된다.
ABTS 라디칼 소거능 분석 결과, DPPH 항산화 시험 결과와 유사한 양상을 보였다(Table 4, Figure 8). pHEMA 렌즈와 HA-IPN 렌즈는 734 nm 파장에서의 흡수 피이크가 남아있었지만,
Dopa-HA-IPN 렌즈는 피이크가 완전히 사라지며, 99.4% 높은 소거율을 보였다. Dopa-HA-IPN 렌즈의 높은 라디칼 소거능은
ABTS 용액의 색변화를 통해서도 확인했다. pHEMA 렌즈와 HA-IPN 렌즈의 용액은 초기의 색인 청록색을 띠고 있는 반면,
Dopa-HA-IPN 렌즈는 노란색으로 변화되어(Figure 8). 렌즈에 위치하고 있는 도파민 그룹이 ABTS 라디칼 모두를
소거한 것으로 해석할 수 있다.
렌즈시료와 함께, 아스코빅산도
동일한 조건 하에서 ABTS 라디칼 소거능 시험을 진행하였고, 아스코빅산
대비 콘택트렌즈들의 상대적인 라디칼 소거능을 Figure 9에 나타냈다. 아스코빅산의 소거율을 100%라고 가정하였을 때, pHEMA 렌즈와 HA-IPN 렌즈는 각각 24.2, 84.0%를 나타내었다. 한편, Dopa-HA-IPN 렌즈는 99.8%를 나타내어, 아스코빅산과 거의 동일한 항산화 기능을 보였다.

|
Figure 2 1H NMR spectra of hyaluronic acid modified with adipic dihydrazide. |

|
Figure 3 Absorbance spectrum of Dopa-HA-IPN lens. |

|
Figure 4 Variation of the absorbance at 517 nm as a function of mole of dopamine in the DPPH solution. |

|
Figure 5 SEM photographs of (a) pHEMA lens; (b) HA-IPN lens; (c) Dopa-HA-IPN lens. |

|
Figure 6 Absorption spectra and radical scavenging reaction in the DPPH solutions of (a) pHEMA lens; (b) HA-IPN lens; (c) Dopa-HAIPN lens. |

|
Figure 7 Relative radical scavenging capacities of lens samples in comparison to ascorbic acid. |

|
Figure 8 Absorption spectra and radical scavenging reaction in the ABTS solutions of (a) pHEMA lens; (b) HA-IPN lens; (c) Dopa-HAIPN lens. |

|
Figure 9 Relative radical scavenging capacities of lens samples in comparison to ascorbic acid. |
|
Table 3 Absorbance (Radical Scavenging Efficiency) at 517 nm with Time in the Absorption Spectra of Contact Lenses |

|
Table 4 Absorbance (Radical Scavenging Efficiency) at 734 nm with Time in the Absorption Spectra of Contact Lenses |

본 연구에서는 폴리페놀계 도파민을 부착한 콘택트렌즈를 제조하여 항산화 기능을 시험하였다. 우선, HEMA와 EGDMA, AIBN을 사용하여 pHEMA 렌즈를
제조하고, 히알루론산과 상호침투 네트워크(IPNs) 구조로
가교 결합시켰다. 이후, 히알루론산의 카복실산 그룹에 도파민을
아마이드 결합시켜 최종 항산화 기능성 콘택트렌즈를 제조하였다. pHEMA 렌즈에 히알루론산과 도파민이
결합되었음에도, 가시광선 영역에서 약 95% 평균 투과율을 보여 높은 광학 투명도를 확인하였다. 또한 Dopa-HA-IPN 렌즈의 함수율과 접촉각 측정
결과, 항산화 물질을 부착하지 않은 HA-IPN 렌즈보다는
물에 대한 친화도가 낮았으나 pHEMA 렌즈보다는 높은 습윤성을 갖는 것을 알 수 있었다. 콘택트렌즈들의 항산화 기능성은 DPPH 및 ABTS 라디칼 소거능 시험으로 확인하였다. DPPH 라디칼 소거능
시험 결과, 도파민이 부착된 Dopa-HA-IPN 렌즈는 90% 이상의 소거율을 보였고, 이는 pHEMA 렌즈에 비해 70% 높은 수치이다. 또한 아스코빅산 대비 약 99%를 나타내 높은 항산화 능력을 갖는
것을 알 수 있다. 따라서 본 논문에서 제시한 연구방법을 통해, 항산화
기능 콘택트렌즈 개발에 적용할 수 있을 것으로 기대된다.
- 1. X.Hu, L. Hao, H. Wang, X. Yang, G. Zhang, G. Wang, and X. Zhang, Int. J.Polym. Sci., 2011, 9 (2011).
- 2. J.-H. Kim, M.-J. Kim, M.-S. Lee, K.-J. Kim, S.-Y. Ji,Y.-T. Kim, J.-H. Park, K.-M. Na, K.-H. Bae, H.-K. Kim, F. Bien, C.-Y. Lee, andJ.-U. Park, Nat. Commun., 8, 14997 (2017).
-

- 3. H. J. Majima, K. Watanabe, T. Ueda, H. P. Indo, S.Suenaga, T. Hisamitsu, T. Ozawa, H. Yasuhara, R. Koide, and T. Nakanishi-Ueda, FreeRadical Res., 47, 774 (2013).
-

- 4. M. Nita and A. Grzybowski, Oxid. Med. Cell. Longev.,2016, 23 (2016).
-

- 5. W. Brand-Williams, M. E. Cuvelier, and C. Berset, LWT-FoodSci. Technol., 28, 25 (1995).
-

- 6. J. Kawabata, Y. Okamoto, A. Kodama, T. Makimoto, andT. Kasai, J. Agric. Food Chem., 50, 5468 (2002).
-

- 7. S. Schindler and T. Bechtold, J. Electroanal. Chem.,836, 94 (2019).
-

- 8. G. C. Yen and C. L. Hsieh, Biosci. Biotech.Biochem., 61, 1646 (1997).
-

- 9. M. Iida, I. Miyazaki, K. I. Tanaka, H. Kabuto, E.Iwata-Ichikawa, and N. Ogawa, Brain Res., 838, 51 (1999).
-

- 10. J. B. Leach, K. A. Bivens, C. W. Patrick, and C. E.Schmidt, Biotechnol. Bioeng., 82, 578 (2003).
-

- 11. Y. H. Yun, D. J. Goetz, P. Yellen, and W. Chen, Biomaterials,25, 147 (2004).
-

- 12. X.Deng, M. Korogiannaki, B. Rastegari, J. Zhang, M. Chen, Q. Fu, H. Sheardown, C.D. M. Filipe, and T. Hoare, ACS Appl. Mater. Interfaces,8, 22064 (2016).
-

- 13. J. Wang and J. Wei, Appl. Surf. Sci., 382,202 (2016).
-

- 14. C. Zhou, V. X. Truong, Y. Qu, T. Lithgow, G. Fu, andJ. S. Forsythe, J. Polym. Sci., Part A: Polym. Chem., 54, 656(2015).
-

- 15. J. K. Yeo, L. H. Sperling, and D. A. Thomas, Polym.Eng. Sci., 21, 696 (1981).
-

- 16. A. Hillerstrom and B. Kronberg, J. Appl. Polym.Sci., 110, 3059 (2008).
-

- 17. L. Poláková, V. Raus, L. Kostka, A. Braunová, J.Pilar, V. Lobaz, J. Pánek, and Z. Sedláková, Biomacromolecules, 16,2726 (2015).
-

- 18. G. J. Papariello and M. A. M. Janish, Anal. Chem.,37, 899 (1965).
-

- 19. A. A. Soares, C. G. M. de Souza, F. M. Daniel, G. P.Ferrari, S. M. G. da Costa, and R. M. Peralta, Food Chem., 112,775 (2009).
-

- 20. B. Kim, B. Kang, T. P. Vales, S. K. Yang, J. Lee, andH.-J. Kim, Macromol. Res., 26, 35 (2018).
-

- 21. M. B. Arnao, A. Cano, and M. Acosta, Food Chem.,73, 239 (2001).
-

- 22. H.-J. Kim, G.-C. Ryu, K.-S. Jeong, and J. Jun, Macromol.Res., 23, 74 (2015).
-

- 23. L. Introzzi, P. Biagioni, T. Holz, A. Schiraldi, L.Piergiovanni, and S. Farris, Langmuir, 27, 7563 (2011).
-

- 24. C. L. Hawkins and M. J. Davies, Free Radic. Biol.Med., 21, 275 (1996).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(1): 21-29
Published online Jan 25, 2020
- 10.7317/pk.2020.44.1.21
- Received on Aug 12, 2019
- Revised on Sep 30, 2019
- Accepted on Oct 12, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Byoung-Ki Cho
-
Department of Chemistry, Dankook University, Chungnam 31116, Korea
- E-mail: chobk@dankook.ac.kr
- ORCID:
0000-0002-2297-7707












 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.