- Attachment and Detection of His-tag Protein on the Surface of Chelating Polydiacetylene Liposomes
Young Hwa Lee#, Hye Won Lee*,#, and Joon Sig Choi†
Department of Biochemistry, Chungnam National University, Gung-dong 220, Yuseong-gu, Daejeon 34134, Korea
*Division of Viral Disease Research, Center for Infectious Diseases Research, Korea National Institute of Health, Korea Centers for Disease Control and Prevention, Osongsaengmyeong2-ro 187, Cheongju 28159, Korea- 킬레이트화 폴리디아세틸렌 리포좀 표면에 히스택 단백질의 부착 및 검출
이영화# · 이혜원*,# · 최준식†
충남대학교 자연과학대학 생화학과, *질병관리본부 국립보건원 감염병연구센터 바이러스질환연구과
Polydiacetylene (PDA) is a unique conjugated liposome that shows a significant colorimetric change in response to a variety of external environments such as temperature, pH and molecular recognition. In this study, we demonstrated that PDA liposome can be functionalized with Ni-NTA DOGS (1,2-dioleoyl-sn-glycero-3-{[N(5-amino-1-carboxypentyl) iminodiacetic acid] succinyl} (nickel salt) lipid to interact with His-tag protein, which could be analyzed qualitatively by colorimetric detection. The His-tag green fluorescent protein (GFP) extracted from the jellyfish, Aequorea Victoria, was expressed in bacteria and purified as a model protein. It was observed that Ni-NTA functionalized PDA liposome could specifically interact with the protein through chelation. Although further studies for sensitivity, specificity, and stability improvements should be necessary for clinical applications, it is believed that the results of Ni-nitrilotriacetic acid (NTA)/methoxy polyethylene glycol (MPEG)-10,12-pentacosadiynoic acid (PCDA)/PCDA liposome with His-tag GFP present a potential platform system for simple detection and effective delivery of proteins in various biotechnology fields.
폴리디아세틸렌(PDA)은 온도, pH 및 분자 인식과 같은 다양한 외부 환경에 대한 반응으로 색변화를 나타내는 공액성 고분자 리포좀이다. 본 연구에서, 폴리디아세틸렌 리포좀에 Ni-NTA DOGS(1,2-dioleoyl-sn-glycero-3-{[N(5-amino-1-carboxypentyl) iminodiacetic acid] succinyl} (nickel salt) 지질을 추가하여 기능성을 가지는 표면이 될 수 있게 제작하였고, 이를 이용하여 일반적인 히스택 단백질의 표면 고정화와 그 확인을 위한 나노구조체로써 적용 가능성을 제시하였다. 해파리 Aequorea Victoria에서 유래한 녹색형광단백질(GFP)을 박테리아에서 발현 후 정제한 히스택 GFP를 모델 단백질로 사용하여 Ni-NTA로 표면 개질된 PDA 리포좀과 킬레이션한 경우 특이적인 결합능력을 보이는 것으로 확인하였다. 본 연구에서 개발한 Ni-nitrilotriacetic acid(NTA)/methoxy polyethylene glycol (MPEG)-10,12-pentacosadiynoic acid(PCDA)/PCDA 리포좀과 히스택 단백질을 사용한다면 의약학적 및 생물학적 분야에서 용이하게 단백질을 리포좀 표면에 부착하고 이를 검출할 수 있을 것이며, 의약용 단백질의 효과적 전달 및 효율적인 포뮬레이션을 위한 새로운 플랫폼으로써 사용할 수 있을 것으로 사료된다.
We demonstrated that PDA liposome can be functionalized with Ni-NTA DOGS lipid to interact with His-tag protein. Ni-NTA/MPEG-PCDA/PCDA liposome was constructed to immobilize His-tag green fluorescent protein (GFP) through chelation. After treatment of the liposome with His-tag GFP, color transition and fluorescence change was measured at various concentration ranges.
Keywords: polydiacetylene, liposome, chelation, green fluorescent protein, His-tag protein
이 연구는 충남대학교 학술연구비에 의해 지원되었음.
나노테크놀로지, 치료(therapy) 및 바이오이미징을 접목한 융합 나노바이오 기술은 암의 조기발견과 치료효과를 높이기 위한 매우 중요한 연구분야이다. 특히, 나노물질과 치료제를 결합하여 환자에게 투여한 후 이미징을 통해 선택적인 암 치료와 진단이 가능하게 할 수 있기 때문에 많은 연구가 이루어지고 있다.1,2 융합 나노바이오 기술의 경우 바이오 센서 시스템에 적용 시 세포 수준이나 in vivo 상에서 형광을 띠는 물질의 특성을 이용하여 신호를 검출함으로써 보다 쉽고 유용하게 정보를 얻을 수 있다. 화학 및 바이오센서는 측정 대상물로부터 정보를 감지, 측정하여 인식 가능한 신호로 변화하는 물질이다. 센서는 타겟으로부터 정보를 획득할 때 색, 형광, 전기적 신호 등과 같이 인식 가능한 신호로 변환시켜 검출을 돕는다. 센서가 표적 물질을 인식하면 사람이 인식할 수 있도록 변환기를 통해 신호를 보내게 된다.3
바이오 센서에 이용되는 물질은 표적 물질에 대한 높은 선택성과 감도가 요구된다. 대표적으로 이용되는 효소와 항체의 경우 뛰어난 기질 특이성과 높은 결합력을 가지고 있으나 센서 장치에 고정화되었을 때 안정성이 떨어지고 가격이 비싼 단점을 지닌다.4
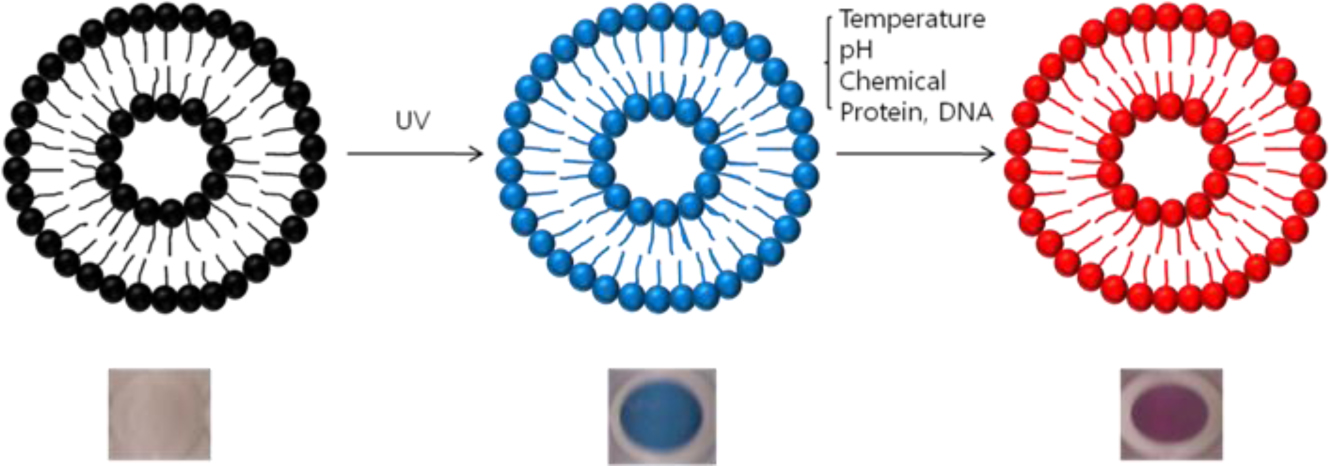
바이오 센서 물질 중 폴리디아세틸렌(polydiacetylene, PDA)은 자가 조립된 디아세틸렌(diacetylene) 단량체의 광중합에 의해 만들어진다. 254 nm의 자외선에 의해 1,4-첨가 중합이 일어나면서 이중 결합과 삼중 결합이 교대로 존재하는 PDA가 형성된다(Scheme 1).5 PDA는 부가적인 촉매나 개시제없이 수용액 상에서 합성이 가능하다는 장점이 있다. 또한 PDA는 일반적으로 약 640 nm에서 최대 흡수 파장을 지니는 청색이지만, 자극을 받으면 약 550 nm의 최대 흡수 파장을 지니는 적색으로 색 전이가 일어난다(Figure 1).6 이 때, 색 전이를 일으키는 자극은 온도, pH, 화학물질, 단백질 그리고 DNA와 같은 물질로 알려져 있다. 또한 색 전이가 일어났을 때 육안으로 구별이 용이할 뿐 아니라 형광현미경 측정 시 청색에서는 형광이 나타나지 않으며 적색에서는 형광이 나타나는 특징이 있다.7,8
대부분 센서로 사용되는 물질의 경우 비가역적인 색 전이가 나타난다. 예를 들어 청색에서 적색으로 색 전이가 일어난 후 자극 인자를 제거해도 다시 청색으로 돌아가지 않는다. 그러나 PDA 센서의 머리 부분 상호작용을 조절하면 가역적 색 전이를 유도할 수 있다.9
녹색형광단백질(green fluorescent protein, GFP)은 28 kDa의 분자량을 가지는 단량체로 살아있는 세포나 조직에서 유전자 발현, 단백질 기능 및 이동 경로 등을 연구하는데 사용되어지는 모델 단백질이다.10,11 특히 따로 염색할 필요 없이 형광을 낼 수 있는 장점이 있다. GFP은 238개의 아미노산으로 구성되어 있으며 단백질 내부에 아미노산 잔기인 세린(serine), 티로신(tyrosine), 글리신(glycine)이 반응하여 발색단(chromophore)인 색소 복합체를 형성하고 있다.12
기존의 센서칩은 대부분 반응시키고자 하는 물질 끝에 고가의 형광 염료를 부착하는 방법을 사용하고 있다. 이와 같은 방법은 비용이 많이 소비될 뿐만 아니라 부착시키는 방법도 번거롭기 때문에 질병을 진단하거나 치료를 위해서 사용되기에 어려움을 겪고 있다.2,3
이러한 단점을 극복하기 위하여 본 연구에서는 외부 자극에 의한 색 전이와 형광 관찰이 가능한 PDA를 기본으로 Ni-NTA DOGS 지질(1,2-dioleoyl-sn-glycero-3-{[N(5-amino-1-carboxypentyl) iminodiacetic acid] succinyl} (nickel salt)을 도입함으로써 무표지(label-free) 방식의 PDA 리포좀을 제조하였다. 또한 methoxypolyethylene glycol(MPEG)가 연결된 PDA는 세포 독성을 감소시키고, 면역 반응을 일으키지 않으며 수용성을 향상시키기 위하여 도입하였다.13,14 형광 단백질인 히스택 녹색형광단백질(His-tag GFP)을 박테리아에서 발현하여 금속 결합 크로마토그래피를 이용하여 정제한 후 Ni-NTA DOGS 지질이 포함된 PDA 리포좀에 첨가하였다. 이미다졸(imidazole)도 마찬가지로 Ni-NTA DOGS 지질에 결합할 수 있기 때문에 이미다졸과 녹색형광단백질을 이용하여 리포좀의 색, 형광의 변화를 확인하였다.
|
Figure 1 Color changes of PDA liposomes. |
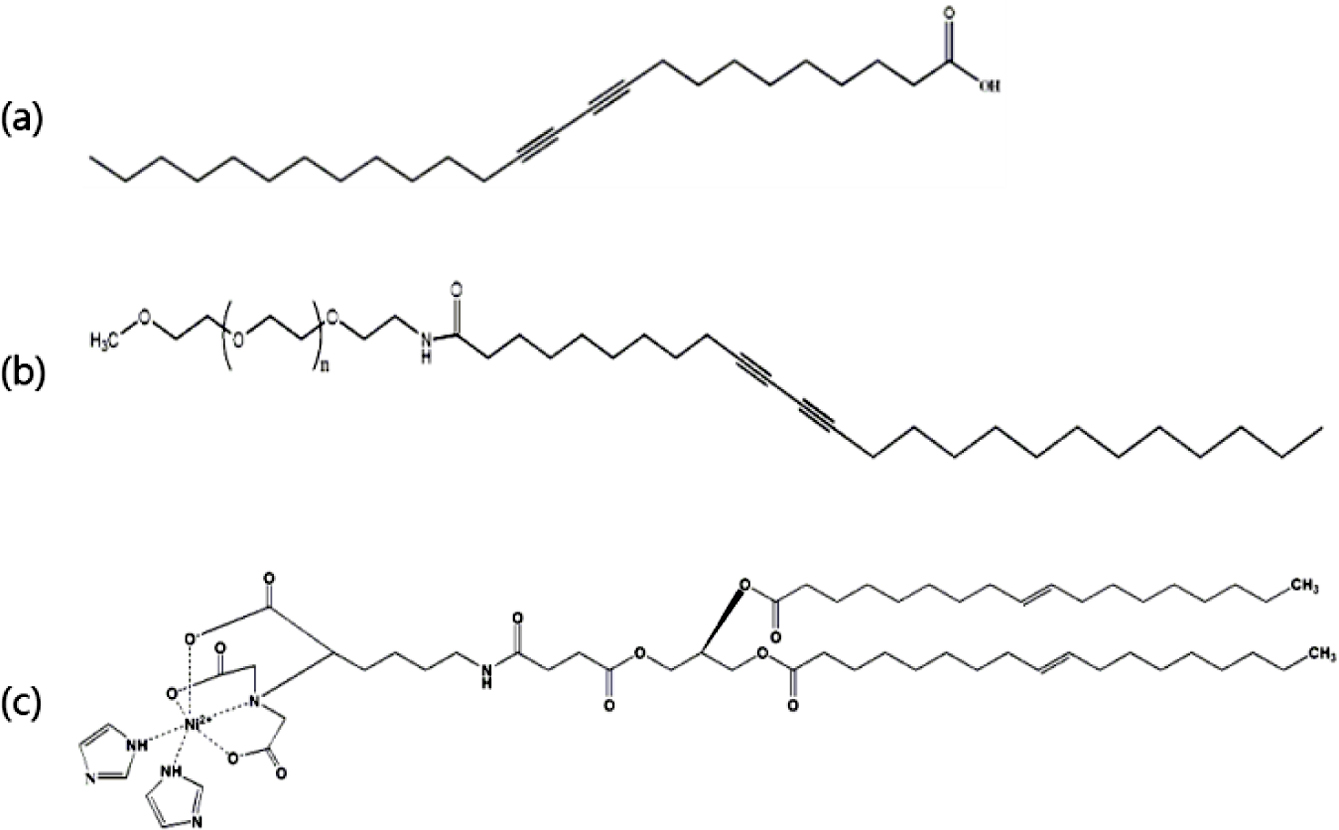
시약 및 재료. 본 실험에서 사용된 10,12-pentacosadiynoic acid(PCDA, HPLC grade,≥97%)는 Fluka사에서 구매하여 사용하였다. Chloroform(anhydrous, ≥99%), N,N-dimethylfor-mamide(DMF), N,N-diisopropylethylamine, ether(≥99%), isopropyl b-D-1thiogalacropyranoside(IPTG, ≥99%)은 Sigma-aldrich사에서 구입했다. N-hydroxybenzotriazole(HOBt), 2-(1H-benzotriazole-1-yl)-1,1,3,3-tetramethyluronium(HBTU)는 Anaspec사에서 구매하였다. Ni-NTA DOGS lipid는 Avanti Polar Lipids사에서 구매하였다. Methoxypolyethylene glycol-amine(MPEG-NH2, MW2000)은 Sunbright사에서 구매하였다. 정제를 위해 사용된 IDA Excellose는 Bioprogen, VIVASPIN (MWCO=10000), 0.22 µm, 0.8 µm syringe filter는 Sartorius Stedim Biotech에서 구매하였다.
Ni-NTA/MPEG-PCDA/PCDA 리포좀 제조. 본 연구에서 사용된 리포좀은 다음과 같은 방법으로 제조하였다. 우선, 1 당량의 MPEG-amine을 anhydrous DMF에 녹인 후, 각각 4 당량의 HOBt, HBTU, PCDA를 넣고 8 당량의 NN-diisopropylethyl(DIPEA)를 넣어 실온에서 16시간 동안 반응을 보냈다. 생성된 MPEGPCDA를 정제하기 위하여 과량의 에테르를 넣어 불순물을 제거해 주었다.15
다음으로, Ni-NTA DOGS 지질, MPEG-PCDA 그리고 PCDA(Figure 2)를 유기용매인 클로로포름에 녹이고 질소 가스로 유기용매를 증발시켜 필름 상태로 만들었다. 그 다음, 최종 농도 2 mM에 맞추어 0.22 μm syringe filter로 필터링한 3차 증류수를 더하고 80℃로 water bath(Lab Companion, CW-05GL)에서 15분 동안 가열시킨다. 15분 후, sonication을 진행하고, 이어서 0.8 μm syringe filter를 통해 필터링하여 불순물을 제거해 주었다. 마지막으로 리포좀 안정화를 위해 4℃에서 12시간 이상 보관하였다.
크기 및 표면 전하 측정. 제조된 리포좀의 크기와 표면 전하(zeta potential)를 확인하기 위하여 Zetasizer ELS-Z2(Photal, Otsuka)을 이용하여 측정하였다. 모든 샘플은 순수 증류수에 녹여 측정하였다.
PCDA 리포좀의 고분자화 및 외부 물질에 따른 색, 형광 변화 관찰. 제조된 Ni-NTA/MPEG-PCDA/PCDA 리포좀을 20-30초 동안 254 nm의 UV를 조사하여(UV 반응기, RMR-600) 고분자화 시켰다. 그리고 고분자화된 리포좀에 His-tag GFP를 넣었을 때의 영향을 알아보고자 농도 별로 His-tag GFP를 넣어 색 변화와 형광을 관찰하고 UV-Vis spectrophoto-meter(Optizen POP)를 이용하여 400~700 nm 사이의 파장을 스캔하여 그래프로 나타내었다.
색 전이 값 정량. 중합된 폴리디아세틸렌이 청색에서 적색으로 색 전이된 정도를 비율로 알아보기 위해 CR(color response)값으로 계산하였다.

여기에서, PB1은 UV-Vis 스펙트럼에서 PDA가 청색(650 nm)일 때와 적색(550 nm)일 때의 상대적인 최대 흡광도 값을 대입하였다. PB0는 Ni-NTA/MPEG-PCDA/PCDA 리포좀에 녹색형광단백질이나 이미다졸을 넣은 뒤에 얻어진 흡광도 값을 대입하여 CR 값을 계산하였다.
녹색형광단백질 발현 및 정제. pET-21b 벡터에 6개의 히스티딘이 태깅된 녹색형광단백질(His-tag GFP)을 클로닝한 뒤, BL21 대장균에 형질전환하였다. 콜로니를 12시간 동안 LB배지(엠피실린 첨가)에 배양시킨 후 UV-vis spectrophoto-meter를 사용하여 600 nm에서 흡광도를 측정한다. 이 때, 대장균의 농도가 0.6~0.8 사이가 되면 isopropyl β-D-1-thiogalacto-pyranoside(IPTG)를 처리하여 단백질의 발현을 유도하였다.
His-tag GFP를 affinity chromatography(IDA excellose)를 통해 정제하였다. 정제 버퍼 조성은 다음과 같다: Washing buffer(50 mM Tri base, 500 mM NaCl, 50 mM imidazole, pH8.0), elution biffer(50 mM Tri base, 500 mM NaCl, 100 mM imidazole, pH8.0). 정제 후 버퍼에 포함된 이미다졸을 제거하기 위해 4 ℃에서 overnight 투석(ThermoFisher, MWCO 10K)하였다. 정제된 His-tag GFP는 Vivaspin (Sartorius, MWCO 10K)으로 농축하여 4℃에 보관하였다 SDS-PAGE를 통해 정제와 농축된 His-tag GFP를 최종 확인하였다.
형광현미경 관찰. PCDA 리포좀의 형광 변화를 확인하기 위하여 녹색형광단백질이나 이미다졸과 반응시킨 PCDA 리포좀을 형광현미경(Nikon, Eclipse, TS100)을 통해 관찰하였다. 형광이미지는 TRICT(tetramethylrhodamine, excitation filter = 540/25 nm, dichroic mirror = 565 nm, barrier filter = 605/55 nm) 필터를 장착하여 관찰하였다.
|
Figure 2 Chemical structure of (a) 10,12-PCDA; (b) MPEG-PCDA; (c) Ni-NTA-DOGS lipid. |
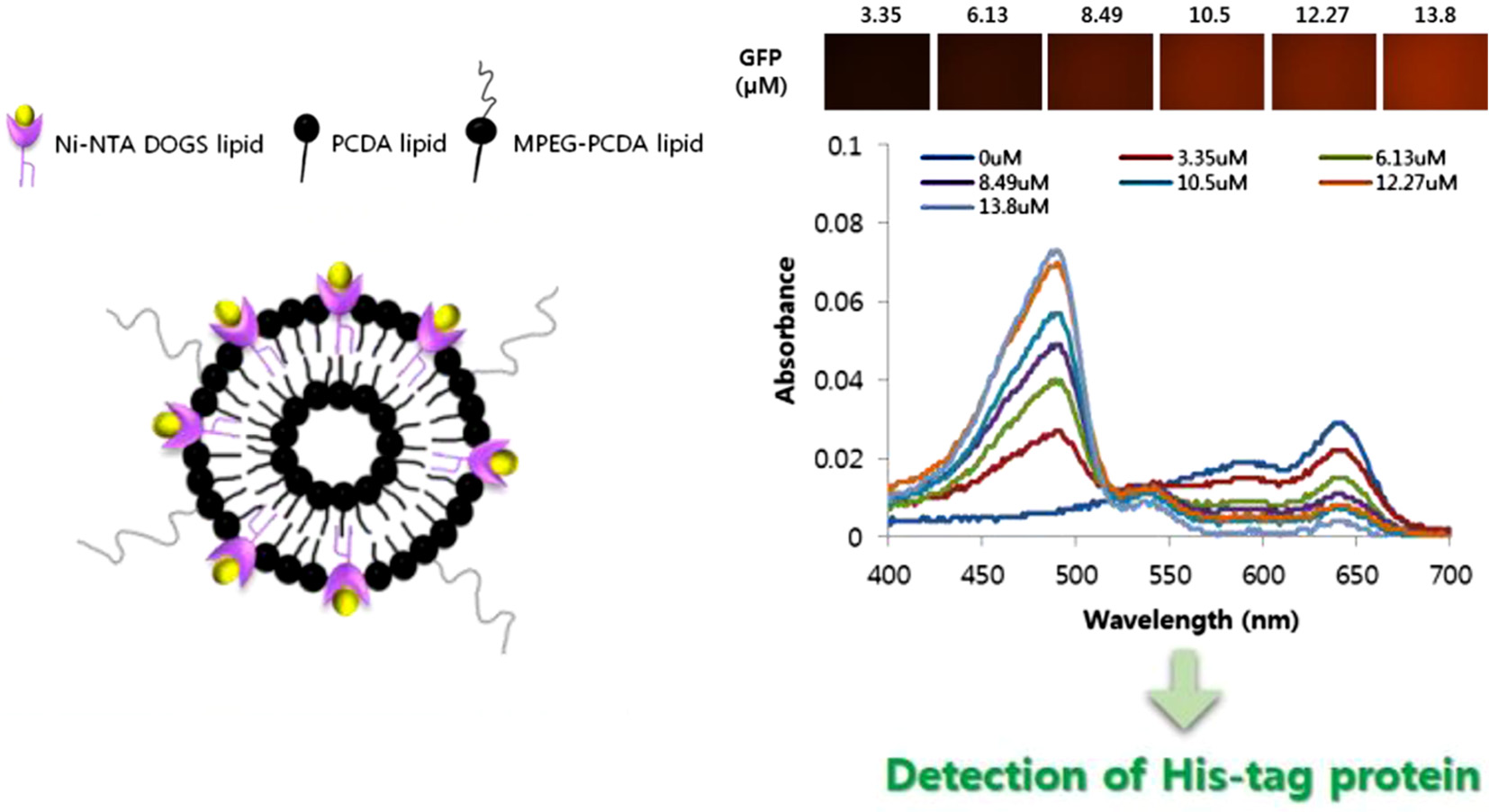
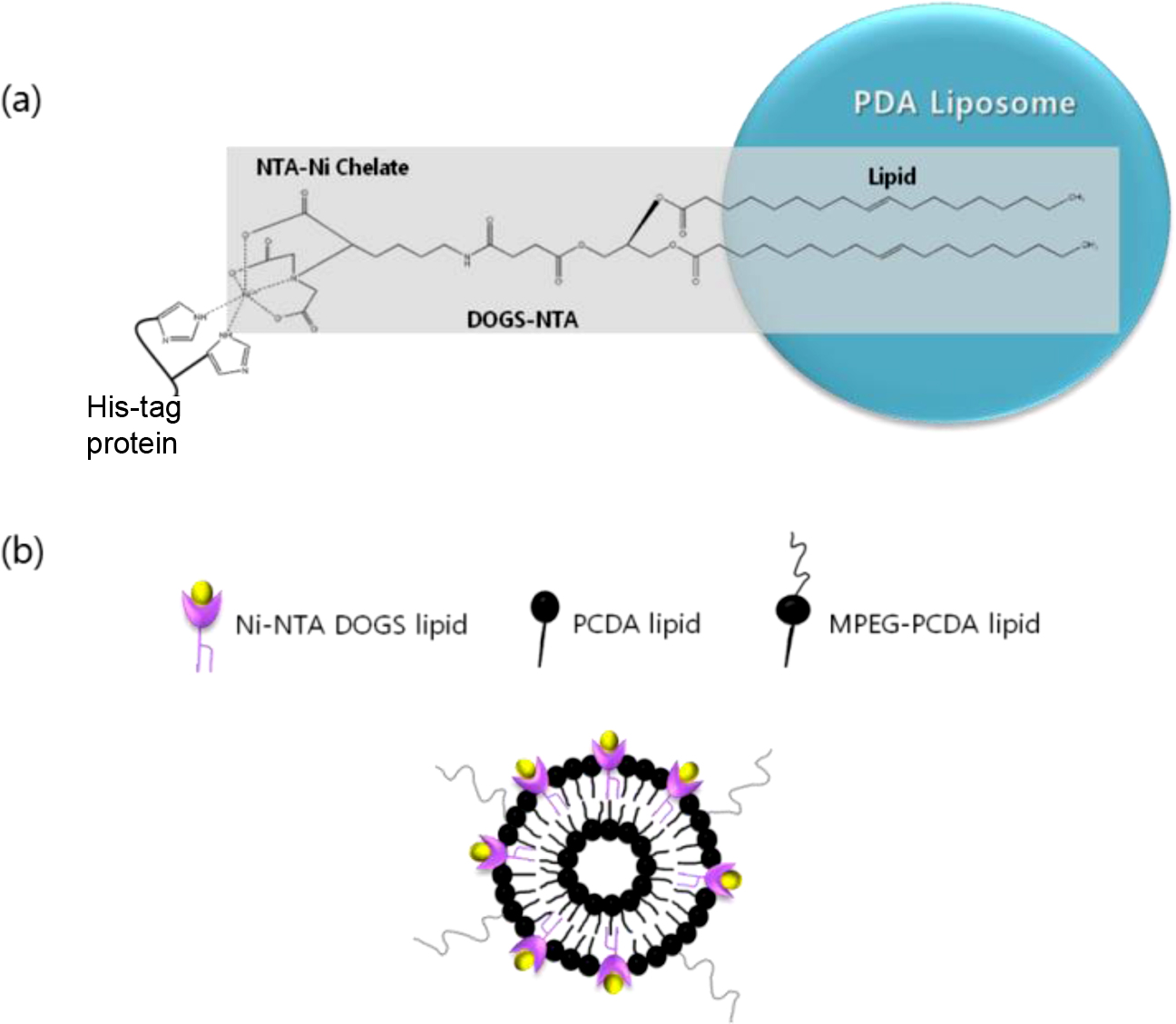
Ni-NTA/MPEG-PCDA/PCDA 리포좀 형성 확인. His-tag GFP를 리포좀 표면에 킬레이트화 반응에 의해 고정하기 위해 PCDA 리포좀에 Ni-NTA DOGS 지질을 도입하였으며 수용액상에서 용해도와 안정도를 높이기 위해 MPEG-PCDA를 추가로 도입하여 나노입자 크기의 리포좀을 제작하였다. Ni-NTA DOGS 지질은 각각 1, 5, 10 mol%의 몰 비로 넣어 리포좀을 제조하였다. 최종적으로 합성된 Ni-NTA/MPEG-PCDA/PCDA 리포좀의 예상구조는 Figure 3에 나타내었다.
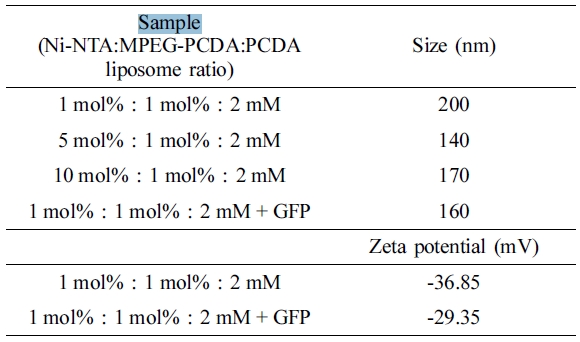
Ni-NTA/MPEG-PCDA/PCDA 리포좀 크기 및 전하 측정. 제조된 리포좀의 물리적인 성질을 알아보기 위해 크기와 표면전하를 측정해 보았다(Table 1). Ni-NTA는 1, 5, 10 mol%로 변화를 주었고 MPEG-PCDA와 PCDA는 각각 1 mol%, 2 mM로 고정하여 리포좀을 제조하였다. 그 결과, Ni-NTA의 비율이 증가하여도 리포좀의 크기는 200 nm 이하의 크기를 가지는 것을 확인할 수 있었다. 1, 5 mol%와 10 mol%의 Ni-NTA/MPEG-PCDA/PCDA 리포좀의 경우 각각 200, 140, 170 nm의 크기를 나타냈다. 1 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀에 GFP를 넣어 준 후 크기를 측정하였을 땐 160 nm의 크기를 나타내는 것을 확인할 수 있었다. 또한 1 mol%의 Ni-NTA를 포함하는 리포좀의 표면 전하를 측정하였다. GFP가 없는 경우 -36.85 mV의 음전하를 나타냈으며 GFP를 넣어준 경우 -29.35 mV로 두 종류의 리포좀 모두 음전하를 띠는 것을 확인할 수 있었다. 이는 리포좀 표면에 카복실산을 포함하는 작용기가 있기 때문에 수용액 상에서 음전하를 띤다고 설명할 수 있다.
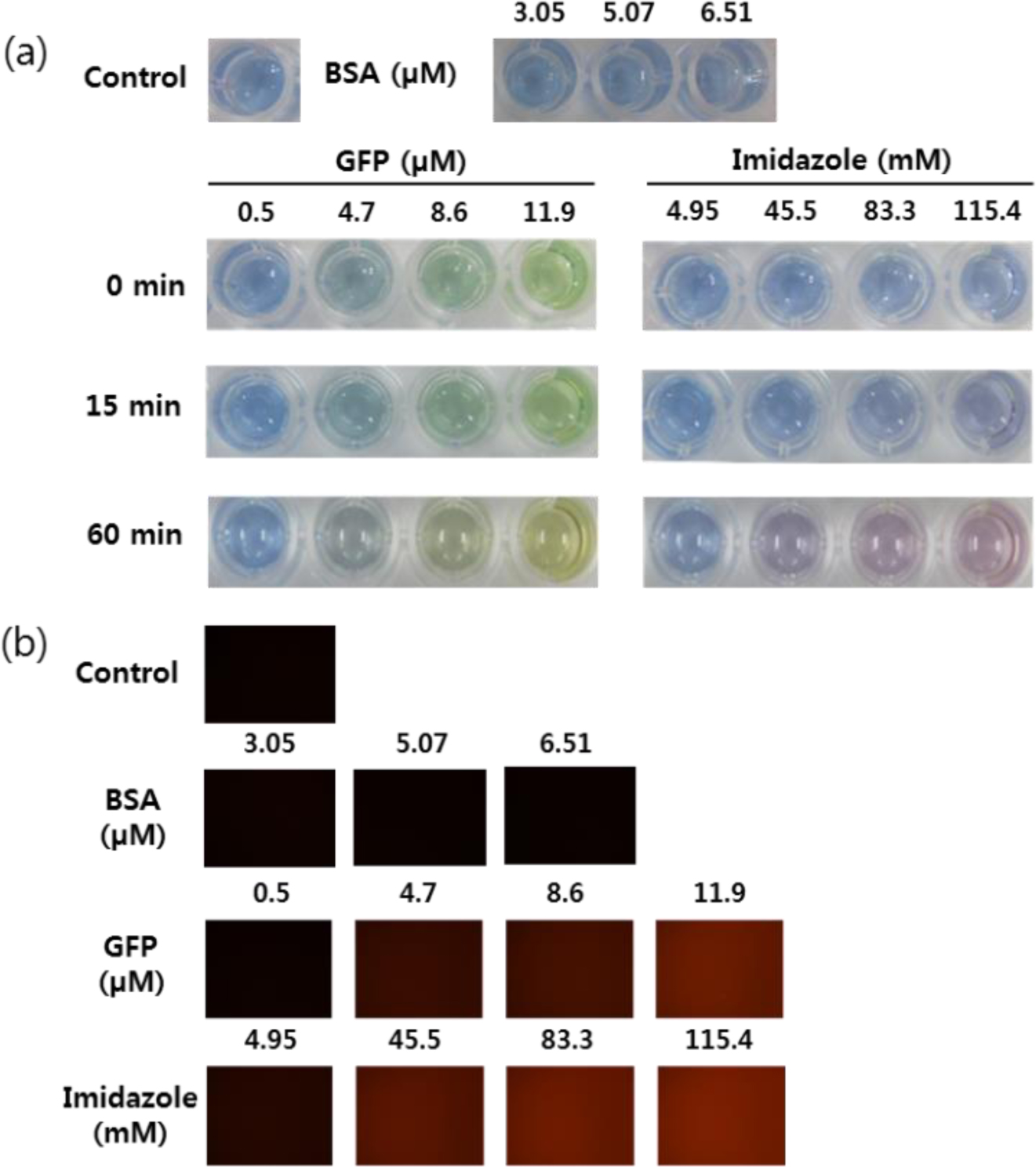
10 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 색 전이 및 형광 변화 확인. 10 mol%의 Ni-NTA DOGS 지질과 1 mol%의 MPEG-PCDA가 도입된 PCDA 리포좀에 His-tag GFP 또는 이미다졸을 넣어 주었을 때의 색 변화를 확인해보았다. 외부 인자 없이 리포좀만 들어있는 경우 PCDA 리포좀의 색인 파란색을 나타내는 것을 알 수 있었다. 이 때, 대조군으로 His-tag이 없는 BSA 단백질로 비교해 보았다. 그 결과, BSA만 첨가한 경우에는 색 변화를 볼 수 없었다. His-tag GFP를 넣어준 경우 초기에는 녹색형광단백질 때문에 색이 변하였지만, 1시간 후 녹색형광단백질의 농도가 높을수록 PCDA 리포좀의 색이 파란색에서 노란색으로 전이가 일어난 것을 알 수 있었다. 또한 이미다졸을 넣어 준 경우 15분 후 이미다졸의 농도가 높아질수록 리포좀의 색이 전이되는 것을 알 수 있었고, 1시간 후 농도가 증가함에 따라 색이 적색으로 전이된 것을 알 수 있었다(Figure 4(a)).
PCDA 리포좀은 육안으로 구별하는 색 변화뿐만 아니라 청색에서는 형광이 나타나지 않고 적색에서는 형광이 나타나는 특성을 가지고 있다. 이를 확인하기 위하여 형광 현미경을 통해 붉은색 형광이 나타나는지 확인하였다. 대조군인 PCDA 리포좀과 BSA 단백질의 경우 적색 형광이 나타나지 않는 것을 확인하였다. 녹색형광단백질이나 이미다졸을 넣기 전, 즉, 육안으로 관찰하였을 때 청색의 리포좀일 때는 형광이 나타나지 않는 것을 확인할 수 있었다. 그러나 녹색형광단백질이나 이미다졸을 넣은 후 리포좀의 색 전이가 일어났을 경우에는 농도가 증가함에 따라 적색 형광이 증가하는 것을 관찰할 수 있었다(Figure 4(b)). 흡광도와 형광 이미지를 통하여 본 연구에서 제조된 Ni-NTA/MPEG-PCDA/PCDA 리포좀은 His-tag GFP나 이미다졸에 특이적으로 탐지하여 색 전이와 형광을 내는 것을 알 수 있었다.
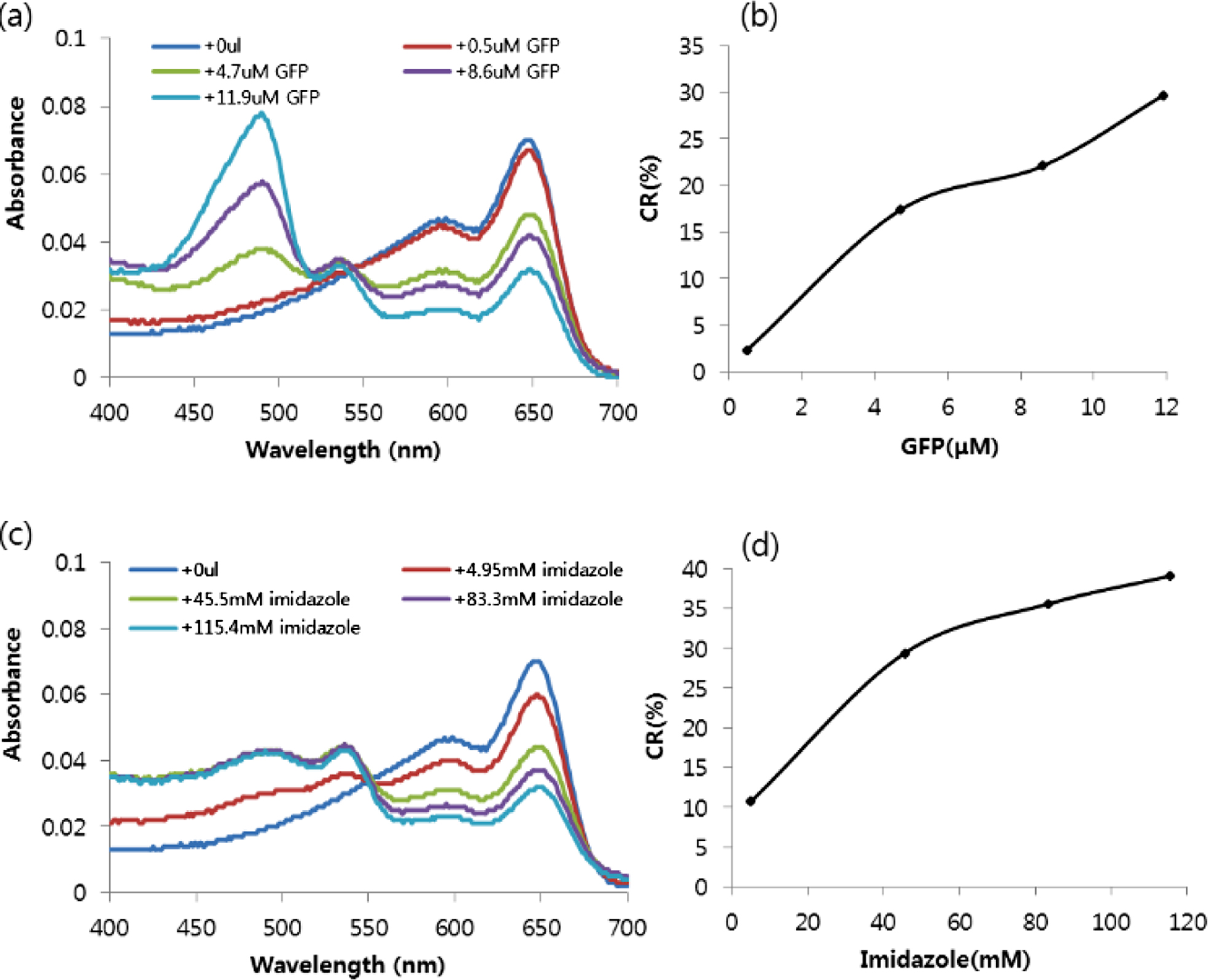
10 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 흡광도 및 CR 값 확인. 녹색형광단백질과 이미다졸을 농도 별로 넣어주었을 때 10 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 색 변화를 UV/Vis 스펙트럼을 통해 측정하였다. 650 nm 근처에서 증가되는 흡광도 값은 고분자화된 PCDA 리포좀이 청색을 띠는 것을 의미한다. 녹색형광단백질의 농도가 증가할수록 650 nm 흡광도 값이 감소하는 것을 확인할 수 있었다. 또한 488 nm 흡광도 값이 증가하였는데, 이는 녹색형광단백질 농도가 증가함에 따라 증가하는 것을 알 수 있으며, 즉, 녹색형광단백질로 인한 값임을 알 수 있었다. 또한 500~550 nm 사이의 흡광도 값이 증가하는데, 이는 농도에 따라 색 전이가 일어나 청색 흡광도가 낮아지며 적색 흡광도 값이 증가하는 것을 확인할 수 있었다. 이미다졸의 경우도 동일하게 이미다졸의 농도가 증가할수록 청색 흡광도 값이 낮아지며 적색 흡광도 값이 증가하는 것을 통해 PCDA 리포좀의 색이 전이되었음을 확인할 수 있었다(Figure 5(a), (C)).
다음으로 중합된 PDA 구조의 청색에서 적색으로 색 전이된 정도를 비율을 통해 알아보기 위하여 CR 값을 계산해 그래프로 나타내었다. CR 값이 높아질수록 청색에서 적색으로 색 전이가 더 많이 되었음을 의미한다. Figure 5(b,d)에서 확인할 수 있듯이 녹색형광단백질과 이미다졸의 농도가 증가할수록 CR 값이 증가하여 PCDA 리포좀의 색 전이가 일어 났음을 확인할 수 있었다.
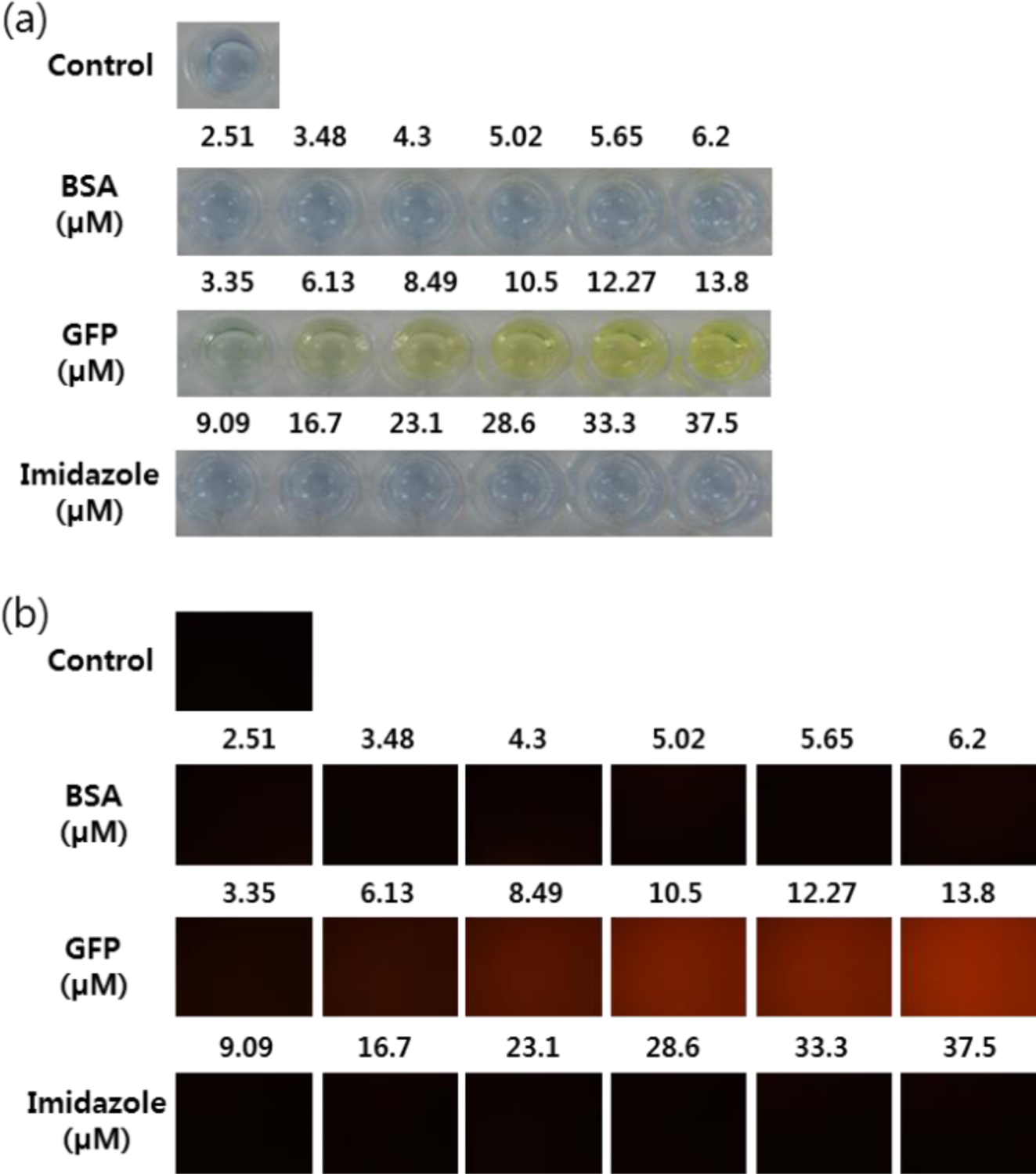
1 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 색 전이 및 형광 변화 확인. 다음으로 Ni-NTA DOGS 지질의 몰 비를 바꾸어 리포좀을 제조하였다. 5 mol% Ni-NTA DOGS 지질이 포함된 리포좀의 경우 10 mol% Ni-NTA DOGS 포함 리포좀에 비해 큰 차이가 없었다. 반면에, 1 mol% Ni-NTA DOGS 지질이 포함된 리포좀은 10 mol% Ni-NTA DOGS 지질 리포좀에 비해 상대적으로 짧은 시간인 10분 안에 색이 변화한 것을 알 수 있었다. 하지만, His-tag GFP와 비교하기 위해 이미다졸의 양을 mM에서 ?M 수준으로 낮추어 넣어준 경우에는 리포좀의 색이 변하지 않았다(Figure 6(a)).
형광 이미지의 경우 대조군인 BSA를 넣어 준 경우 형광을 확인했을 때 붉은색 형광이 나타나지 않는 것을 볼 수 있었다. His-tag GFP의 경우 농도에 따라 붉은색 형광이 동일하게 증가하는 것을 볼 수 있었다. 이미다졸의 경우 μM 단위로 농도가 증가하여도 형광이 나타나지 않음을 알 수 있었다(Figure 6(b)). 따라서 His-tag GFP나 이미다졸의 경우 둘 다 Ni-NTA/MPEG-PCDA/PCDA 리포좀에 결합할 수 있지만 μM 단위 수준의 적은 양을 첨가하였을 경우에는 상대적으로 이미다졸보다 His-tag GFP가 PCDA 골격 자체에 더 큰 영향을 줌으로 인해 색 전이와 형광 이미지를 유도한 것으로 생각된다.
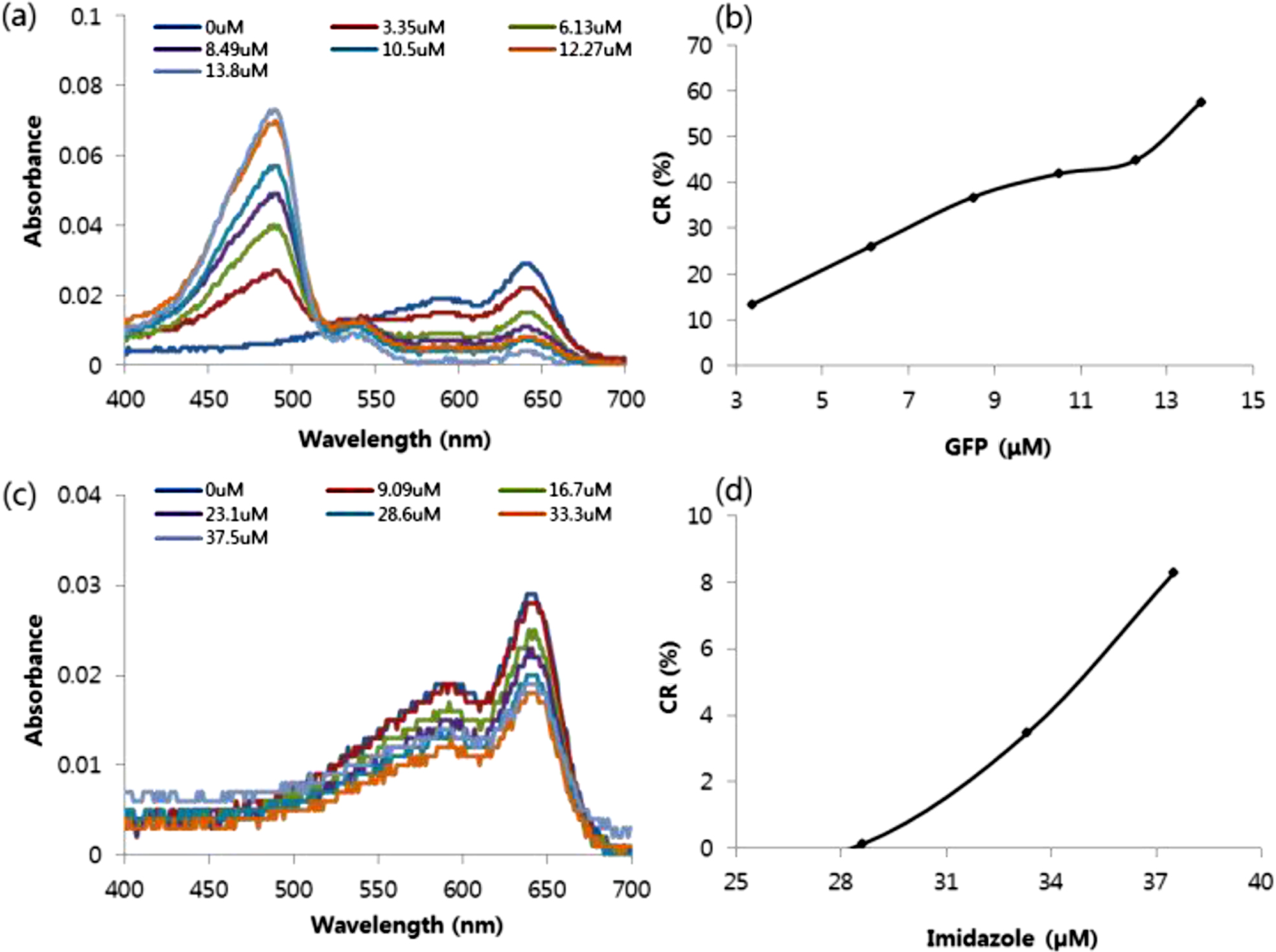
1 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 흡광도 및 CR 값 확인. His-tag GFP와 이미다졸을 농도 별로 넣어주었을 때 1 mol% Ni-NTA/MPEG-PCDA/PCDA 리포좀의 색 변화를 UV/Vis 스펙트럼을 통해 측정하였다. His-tag GFP를 넣어 준 경우에만 500에서 550 nm 사이에서 흡광도 값이 증가하는 것을 확인하였다. 이미다졸의 경우 mM의 수준에서는 흡광도가 변화되는 것을 확인할 수 있었지만, μM 수준에서는 흡광도 변화가 나타나지 않았다(Figure 7(a), (C)).
다음으로 His-tag GFP과 이미다졸을 넣었을 때 색 전이 값을 계산해 보았다. 그 결과, 리포좀에 녹색형광단백질과 이미다졸을 넣어준 경우 모두 농도에 따라 CR(%) 값이 증가하는 것을 볼 수 있었다(Figure 7(b), (d)). 두 개의 그래프 값을 비교해 보면 녹색형광단백질을 넣어 준 경우 이미다졸을 넣어 준 경우보다 상대적으로 적응 양으로도 높은 CR값을 보였다. 넣어준 Ni-NTA DOGS 지질의 몰 비가 다른 두 리포좀을 비교해 보면 10 mol% Ni-NTA DOGS 지질이 포함된 리포좀은 녹색형광단백질이 12 μM 첨가되었을 때 30%의 CR 값을 가지지만, 1 mol% Ni-NTA DOGS 지질이 포함된 리포좀은 50% 근처의 CR 값을 가졌다.
Ni-NTA/MPEG-PCDA/PCDA 리포좀은 PCDA 리포좀 사이에 Ni-NTA DOGS 지질이 끼어들어가 있는 구조로 예상된다. 따라서 상대적으로 많은 10 mol% Ni-NTA DOGS 지질이 포함된 리포좀보다 1 mol% Ni-NTA DOGS 지질이 포함된 리포좀이 His-tag GFP나 이미다졸을 검출하였을 때 PCDA 골격 전체에 더 쉽게 영향을 줄 수 있기 때문에 보다 짧은 시간에 색 변화와 형광을 낼 수 있다고 생각된다.
|
Figure 3 (a) Surface of polydiacetylene can be modified with NTA to bind His-tag proteins; (b) Schematic representation of Ni-NTA/MPEG-PCDA/PCDA liposomes. |
|
Figure 4 (a) Color transitions; (b) fluorescence microscopy images of the PCDA liposomes after incubation with GFP or imidazole in various concentrations at room temperature. The developed red fluorescence intensity has a close relationship with the concentration of the GFP and imidazole. (Control : 10 mol% Ni-NTA/1 mol% MPEG-PCDA/2 mM PCDA liposomes, incubation time = 30 min). |
|
Figure 5 (a,c) The absorption wavelength scanning experiment was performed to analyze the visible spectra change according to the addition of GFP(a) or imidazole(c) to the liposomes. (b,d) Colorimetric response as a function of GFP(b, μM) or imidazole(d, mM) concentration. |
|
Figure 6 (a) Color transitions; (b) fluorescence microscopy images of 1 mol% Ni-NTA/MPEG-PCDA/2 mM PCDA liposomes after interaction with His-tag GFP or imidazole (incubation time=10 min). |
|
Figure 7 (a,c) The absorption wavelength scanning experiment was performed to analyze the visible spectra change according to the addition of GFP(a) or imidazole(c) to the to the 1 mol% Ni-NTA/1 mol% MPEG-PCDA/2 mM PCDA liposomes. (b,d) Colorimetric response as a function of GFP(b, μM) or imidazole(d, μM) concentration. |
|
Table 1 Dynamic Light Scattering (DLS) and Zeta Potential Data of Ni-NTA/MPEG-PCDA/PCDA Liposomes |
폴리디아세틸렌 리피드의 대표적인 시료인 PCDA는 리포좀 형성 후 자외선 조사 시에 고분자화 리포좀으로 형성되며 색 전이를 동반하기에 이를 이용하여 센서로써 응용성이 높아서 그동안 많은 연구가 이뤄져 왔고, 또한 본 연구팀은 PEG와 결합된 PCDA 리피드와 함께 나노입자의 리포좀이 형성될 수 있음을 발표하였다.16,17 이러한 PCDA 리포좀의 특성을 이용하여 최근에는 일반적으로 약산성을 띠는 암세포에 자가조립된 리포좀을 전달하게 되면 폴리디아세틸렌의 색이 빨간색으로 변하면서 리포좀 내부에 있던 항암약물을 방출시켰고, 이러한 연구 결과는 폴리디아세틸렌 리포좀을 통하여 암 치료 및 이미징에 효과적인 모니터링이 가능하다는 결과도 발표하였다.18
본 연구에서는 폴리디아세틸렌을 기본 골격으로 하는 단백질 나노전달체 개발을 위해서, His-tag과 선택적으로 킬레이션할 수 있는 Ni-NTA DOGS 지질과 수용액상에서의 용해도를 높이기 위해 MPEG-PCDA를 도입하여 리포좀을 제조하였다. 제조된 리포좀의 크기는 100-200 nm 사이로 균일하게 측정되었으며 음전하를 띠는 것을 확인하였다.
여기에 His-tag GFP 또는 이미다졸을 첨가하였을 때 리포좀에서 유도되는 색 변화와 형광을 확인하였다. 실험 결과 Ni-NTA DOGS 리피드가 도입된 리포좀에서만 특이적으로 His-tag GFP 또는 이미다졸을 검출하여 색 변화와 형광을 나타내는 것을 확인하였다.
또한 리포좀에서 Ni-NTA DOGS 리피드의 몰 비율을 1과 10 mol% 두 가지 조건에서 비교하였을 때, 1 mol%가 더 효과적이며 짧은 시간에 색 변화와 형광을 나타내는 것을 확인하였다. 이는 아직 더 연구가 필요하지만, 상대적으로 적은 1 mol%의 Ni-NTA DOGS가 도입된 리포좀에서 His-tag 단백질과의 상호작용이 고분자화된 PCDA 골격 전체에 더 쉽게 영향을 주는 것에 기인하는 것으로 생각된다.
본 연구를 통해 제조된 Ni-NTA/MPEG-PCDA/PCDA 리포좀은 간단한 제조 방법과 특별한 형광 물질을 부착하지 않아도 되는 장점을 가지고 있어 생물학적 분야에 센서로써 응용이 가능할 수 있을 것이라 기대된다. 또한 단백질 전달체로써 목적 세포에서 단백질/리포좀 결합 나노입자의 위치를 이미징으로 보다 쉽게 확인이 가능하다. His-tag GFP 뿐만 아니라 다른 His-tag 단백질을 리포좀에 도입할 수 있는 가능성을 제시하였으며, 이는 단백질의 나노구조체 표면에의 부착 및 효율적인 전달체 제제화 연구에 대한 응용성을 기대할 수 있을 것으로 사료된다.
- 1. M. Caraglia, M. Marra, and A. Budillon, Expert Opin. Biol. Th., 8, 1031 (2008).
-

- 2. S. Okada, S. Peng, W. Spevak, and D. Charych, Acc. Chem. Res., 31, 229 (1998).
-

- 3. J. Lee, H. J. Kim, and J. Kim, J. Am. Chem. Soc., 130, 5010 (2008).
-

- 4. J. M. Kim, Y. B. Lee, D. H. Yang, J. S. Lee, G. S. Lee, and D. J. Ahn, J. Am. Chem. Soc., 127, 17580 (2005).
-

- 5. M. A. Reppy and B. A. Pindzola, Chem. Commun., 42, 4317 (2007).
-

- 6. N. Mino, H. Tamura, and K. Ogawa, Langmuir, 8, 594 (1992).
-

- 7. Y. L. Su, J. R. Li, and L. Jiang, Colloid Surface B, 38, 29 (2004).
-

- 8. D. J. Ahn, E. H. Chae, G. S. Lee, H. Y. Shim, T. E. Chang, K. D. Ahn, and J. M. Kim, J. Am. Chem. Soc., 125, 8976 (2003).
-

- 9. Y. H. Lee, K. H. Yim, J. Heo, and J. S. Choi, Polym. Korea, 38, 43 (2014).
-

- 10. R. Heim, D. C. Prasher, and R. Y. Tsien, Proc. Natl. Acad. Sci. USA, 91, 12501 (1994).
-

- 11. B. G. Reid and G. C. Flynn, Biochemistry, 36, 6786 (1997).
-

- 12. M. Chalfie, Y. Tu, G. Euskirchen, W. W. Ward, and D. C. Prasher, Science, 263, 802 (1994).
-

- 13. J. M. Harris and R. B. Chess, Nat. Rev. Drug Discov., 2, 214 (2003).
-

- 14. J. N. Slaughter, K. M. Schmidt, J. L. Byram, and S. Mecozzi, Tetrahedron Lett., 48, 3879 (2007).
-

- 15. H. Choi, Y. M. Bae, G. S. Yu, K. M. Huh, and J. S. Choi, J. Nanosci. Nanotechnol., 8, 5104 (2008).
-

- 16. E. K. Ji, D. J. Ahn, and J. M. Kim, Bull. Korean Chem. Soc., 24, 667 (2003).
-

- 17. H. Choi and J. S. Choi, Bull. Korean Chem. Soc., 34, 3083 (2013).
-

- 18. S. H. Won, J. U. Lee, and S. J. Sim, J. Nanosci. Nanotechnol., 13, 3792 (2013).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(5): 687-693
Published online Sep 25, 2019
- 10.7317/pk.2019.43.5.687
- Received on Apr 8, 2019
- Revised on Jun 4, 2019
- Accepted on Jun 4, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Joon Sig Choi
-
Department of Biochemistry, Chungnam National University, Gung-dong 220, Yuseong-gu, Daejeon 34134, Korea
- E-mail: joonsig@cnu.ac.kr
- ORCID:
0000-0002-8463-841X









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.