- Fabrication of Bioabsorbable Poly(vinyl pyrrolidone) Nanofibrous Sheets Containing Blood Coagulants for Hemostatic Application
Eun Jung Sim, Young-Gwang Ko, Eun Jin Kim*, Oh Kyoung Kwon**, and Oh Hyeong Kwon†

Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
*Theracion Biomedical Co., Ltd., Seongnam, Gyeonggi 13201, Korea
**Gastric Cancer Center, Kyungpook National University Chilgok Hospital, Daegu 41404, Korea- 혈액응고인자를 함유하는 생체흡수성 폴리비닐피롤리돈 나노섬유시트 지혈제의 개발
금오공과대학교 고분자공학과, *(주)테라시온바이오메디칼, **칠곡경북대학교병원 위암센터
This study develops nanofiber sheet type hemostatic agents using poly(vinyl pyrrolidone) (PVP) containing calcium chloride and thrombin. It is supposed to have benefits, such as advanced hemostasis, biocompatibility, easy storage and handling. The microstructure of nanofibers, the content of elemental compositions, and the distribution of blood coagulation factors were confirmed by scanning electron microscopy and energy dispersive spectroscopy. The PVP nanofibers containing 5.5 mg/mL calcium chloride and 500 units/mL thrombin showed the highest hemostatic ability from in vitro whole blood coagulation experiments. The nanofiber hemostatic agents showed low cytotoxicity with the cell viability over 90%. In addition, nanofiber hemostatic agents reduced bleeding time and bleeding amounts compared to the control groups as assessed via in vivo Sprague-Dawley rat liver hemorrhage model. Our PVP nanofiber sheet containing calcium chloride and thrombin is expected to be useful in medical field as an advanced hemostatic agent.
본 연구에서는 생체친화적이고 보관 및 사용이 편리한 동시에 우수한 지혈능을 가지는 지혈제를 개발하고자 염화칼슘과 트롬빈이 함유된 폴리비닐피롤리돈(PVP) 나노섬유형 지혈제를 제조하였다. 나노섬유의 미세구조, 원소함량비, 혈액응고인자의 분산도는 전자현미경과 에너지분산형 분광분석법을 통해 확인하였다. PVP 나노섬유에 포함된 트롬빈 및 염화칼슘의 비율에 따른 in vitro 전혈응고실험에서 5.5 mg/mL 염화칼슘 및 500 units/mL 트롬빈을 함유한 샘플의 지혈능이 가장 높게 나타났으며, 세포생존율 90% 이상의 낮은 세포독성을 나타내었다. In vivo Sprague-Dawley(SD) rat 간출혈 모델 실험에서도 나노섬유 지혈제는 대조군보다 감소된 출혈시간과 출혈량을 보여주었다. 염화칼슘과 트롬빈이 함유된 PVP 나노섬유시트는 고성능 지혈제로 의료현장에서의 활용이 기대된다.
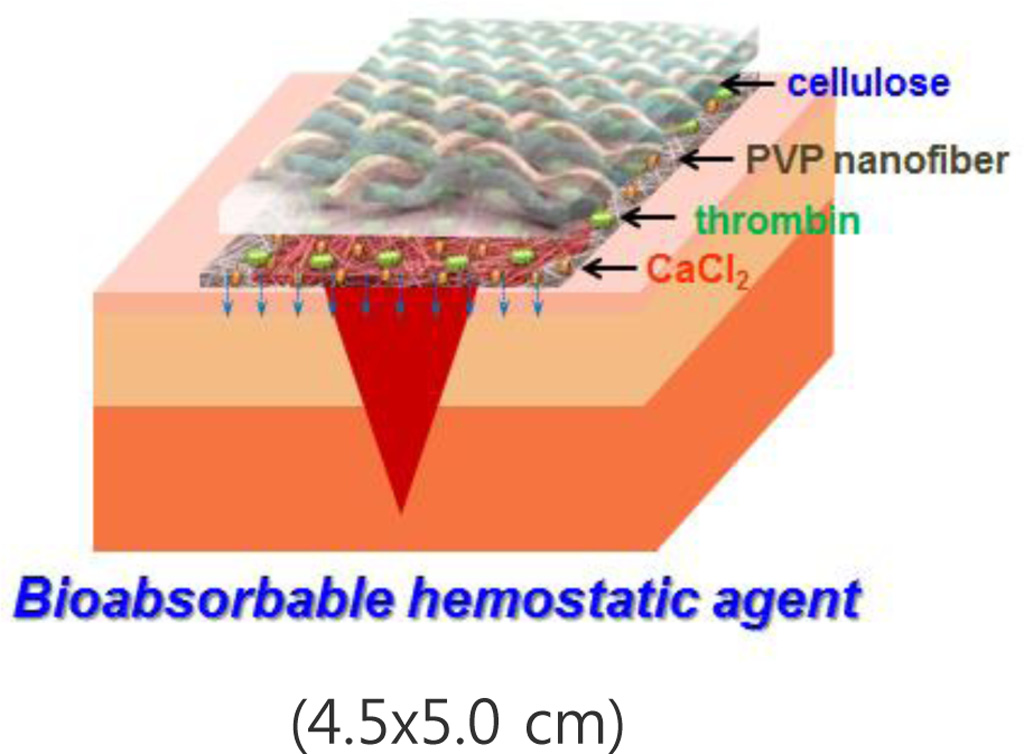
The nanofiber sheet type hemostatic agent was developed using poly(vinyl pyrrolidone) (PVP) containing calcium chloride and thrombin with a cellulose nonwoven fabric. The hemostatic ability of the sample was significantly improved by combination of blood coagulants and bioabsorbable nanofibers.
Keywords: poly(vinyl pyrrolidone), nanofiber, calcium chloride, thrombin, hemostatic agent
이 연구는 금오공과대학교 학술연구비에 의하여 지원된 논문임.
현대사회의 눈부신 발전으로 인하여 인간의 평균수명은 늘어났지만 사고도 급증하였을 뿐만 아니라 고령인구비율이 증가함에 따라 조직 및 장기의 손상을 현대의학 기술을 통해 치료하기 위한 외과적 수술이 급증하고 있다.1 가벼운 상처 및 간단한 수술과정에서의 출혈은 체내 지혈작용에 의해 충분히 제어가 되지만 대형사고나 외과수술 시 응급상황에서 자주 발생하는 과다출혈의 경우, 지혈제 처치가 필수적으로 요구된다.2-5 정상 성인의 혈액은 체중의 6-7% 정도이며 전체 혈액량의 10% 이상의 출혈이 발생하면 생존위험을 초래하며 특히, 유아의 경우는 25-30 mL 정도의 소실로도 쇼크사를 초래할 수 있다.6 생체에 상처가 발생하면 초기 1일 이내에 지혈 및 염증기를 거쳐 상피화가 진행되고 이어서 상피세포의 증식이 약 3주에 걸쳐 진행된다. 지혈제는 생체의 혈액 유출을 막고 상피화가 진행되어 외부 침입을 막는 가장 초기단계에 적용된다. 지혈방법에는 크게 기계적 방법과 냉온에 의한 방법, 화학적 방법이 있다. 기계적 방법에는 손으로 거즈를 대고 직접 눌러주는 방법, 봉합사나 클램프, 클립 등과 같은 기구를 이용하는 방법이 있으며, 냉온에 의한 방법에는 온도를 낮춰 출혈을 억제하는 냉찜질과 같은 방법과 전기를 이용해 열을 발생시켜 혈관을 소작하는 혈관 소작술이 있다.3,4 화학적 방법에는 수렴제, 혈액응고제, 국소지혈제를 이용하는 방법 등이 있는데, 최근에는 혈액성분이 음전하를 띠기 때문에 양전하를 띠는 고분자 재료를 이용한 지혈제 개발도 행해지고 있다. 지혈제에 이용되는 약물로서는 응혈계의 혈액 및 조직성분인 섬유소, 섬유소원, 트롬빈, 트롬보플라스틴이나 혈액을 흡수하고, 섬유소의 석출을 촉진해 응고를 촉진하는 젤라틴 스펀지나 헤모글로빈과 반응해 혈액응고를 촉진시키는 산화재생셀룰로오스(Surgicel®, Ethicon, USA) 등이 있다. 패킹을 통해 지혈을 하게 되는 경우 거즈나 압축스펀지를 사용할 수 있으나, 패킹하는 동안 압박감을 유발하며 통증을 일으킬 수 있어 이러한 단점을 보완하기 위해 흡수성 패킹이 개발되고 있다.7 대표적인 예로 젤라틴 스펀지(Gelfoam®, Pfizer, USA), 생체흡수성 폴리우레탄 폼(Nasopore®, Polyganics, Netherlands), 젤라틴/트롬빈 혼합물(Floseal®, Baxter, USA), 히알루론산 스펀지(MeroGel®/Meropack®, Medtronic, USA), 카복시메틸셀룰로오스 메쉬(Sinu-Knit, ArthroCare®, UK), 흡수성 콜라겐 스펀지(Avitene®, Davol, USA) 등이 있다.3-7 그러나 현재 상용되고 있는 흡수성 패킹은 지혈효과가 떨어지며, 매우 고가로 판매되고 있고, 생체적합성이 낮으며 점막의 재생효과는 미미하다. 따라서 지혈효과는 뛰어나면서 저렴한 가격으로 공급이 가능하며 생체적합성이 뛰어나고 점막의 재생을 촉진하여 재출혈을 방지할 수 있는 고기능성 지혈제의 개발이 필요하다.
위와 같은 문제점을 보완하면서 효과적인 지혈제를 만들기 위해 생체적합성 및 생체흡수성을 가지는 폴리비닐피롤리돈[poly(vinyl pyrrolidone), PVP]을 주재료로 하여 염화칼슘, 트롬빈과 같은 혈액응고인자를 함유하는 기존의 스펀지 혹은 젤 형태가 아닌 나노섬유 형태의 지혈제(PVP-CaCl2-thrombin)를 설계하였다.8-11 나노섬유는 특성상 넓은 표면적을 가지며, 나노사이즈의 직경을 가지는 섬유가 부직포 형태로 촘촘하게 적층되어 있어 빠르게 혈액을 흡수하고 혈액응고인자를 신속하게 방출시켜 줌으로써 우수한 지혈기능을 기대할 수 있다.11 섬유는 높은 비표면적과 유연성을 가지므로 다양하게 응용이 되고 있으며 멜트블로운(melt blown), 복합방사, 분할방사, 전기방사 등의 방법으로 섬유산업 분야에서 널리 실용화되어 있지만, 그 중에서도 직경 1 μm 이하의 섬유를 제조할 수 있는 전기방사 기술은 섬유직경, 섬유직경 분포, 섬유표면 물성, 기공구조, 기공분포, 기공도, 제품의 두께 균일성, 제품의 단면구조, 기계적 물성 등의 성능을 쉽게 설계할 수 있어 다양한 산업에 적용되고 있다. 특히 전기방사된 나노섬유 부직포는 매우 작은 직경 및 공극을 가지며 또한 큰 비표면적을 가져 혈액응고인자의 효과를 극대화시킬 수 있다. 전기방사법으로 제조한 나노섬유는 고효율 필터용 막재료, 기능성 섬유 등 다양한 분야에 응용가능하며, 특히 창상치료재, 약물전달시스템(DDS), 조직공학용 지지체 등 고부가가치를 가지는 의료용 소재의 가공법으로 최근 주목받고 있다.8-23
본 연구에서는 외과수술 시 과다출혈이 일어나는 경우 빠른 혈액흡수와 혈액응고인자의 방출로 신속한 혈액응고능을 가지는 지혈제를 제조하였다. 기존에 사용하는 스펀지형 지혈제의 경우 지혈 효과가 떨어지며, 매우 고가로 판매되고 있고, 생체적합성이 낮으며, 젤형의 경우에는 바이러스 감염문제와 취급 및 보관이 어렵다는 단점이 있다. PVP-CaCl2-thrombin 나노섬유시트 형태의 지혈제는 생체적합성을 유지하면서 기존 제품대비 지혈능을 개선시킬 수 있을 것으로 기대하고, in vitro 혈액응고실험과 in vivo 동물실험을 통해 지혈특성 평가 및 의료용 지혈제로서의 적용 가능성을 제시하고자 하였다.
PVP-CaCl2-thrombin 방사용액 및 나노섬유의 제조. 나노섬유의 주재료인 poly(vinyl pyrrolidone)(PVP, Mw 1300000 g/mol)은 Sigma-Aldrich(USA)에서 구입하였다. PVP는 물, 에탄올, 메탄올, THF, chloroform, dichloromethane 등의 용매를 이용하여 전기방사용 용액을 제조할 수 있으나, 독성이 낮고 트롬빈 활성에 영향을 가장 적게 미치며 휘발이 빠르게 진행되어 나노섬유 제조에 용이한 에탄올(anhydrous, 99.5%, Daejung, Korea)을 용매로 이용하였다. 혈액응고인자로 사용한 염화칼슘(CaCl2, anhydrous, 93%)은 Daejung(Korea)에서 구입한 시약을 막자사발로 분쇄하여 사용하였고, 트롬빈(bovine thrombin)은 RMBIO(USA)의 제품을 사용하였다. 트롬빈 정량에 이용된 Bradford reagent는 Sigma-Aldrich(USA)에서 구입하여 사용하였다. 트롬빈 활성도 측정을 위해 사용된 Chromogenix(USA)의 chromogenic substrates S-2238은 정제수에 녹여 4 mM의 stock solution을 만들어 사용하였다. 트롬빈 활성도 측정 시 이용되는 tris-buffer를 제조하기 위해 염화나트륨을 Daejung(Korea)에서 trizma base를 Sigma-Aldrich(USA)에서 0.5 M EDTA · 2Na solution을 Welgene (Korea)에서 구입하여 사용하였다. 아세트산은 Daejung (Korea)사의 제품을 구입하여 사용하였다. 전기방사용액에 CaCl2와 트롬빈을 직접 첨가하면 CaCl2가 용해되면서 방출하는 열로 인해 단백질인 트롬빈이 변성될 수 있고, 트롬빈이 방사용매인 에탄올에 용해되지 않으므로 CaCl2와 트롬빈을 고농도로 정제수에 각각 용해하여 수용액 상태로 제조한 뒤, 이를 희석하여 사용하였다. CaCl2 용액은 66과 264 mg/mL로 각각 정제수에 녹여 제조하였고, 트롬빈 용액은 6000과 24000 units/mL가 되도록 각각 정제수에 완전히 녹여 제조하였다. CaCl2와 트롬빈의 농도는 기존에 시판되고 있는 젤 형태 지혈제에 함유된 CaCl2와 트롬빈의 농도를 각각 참고한 것이며 1배수와 4배수를 각각 적용하였다. 방사용액은 용매인 에탄올 수용액에 PVP를 완전히 녹인 후, CaCl2 용액을 첨가하여 교반시키면서 CaCl2 용액이 완전히 혼합되었으면 트롬빈 용액을 첨가하여 24시간 이상 교반시켜 트롬빈을 균일하게 현탁시킨 후 전기방사에 적용하였다. 본 실험에서는 70-80 wt% 에탄올 수용액 용매를 이용하여 10 wt% PVP 전기방사용 용액(A)과 5.5 mg/mL CaCl2을 함유하는 PVP 전기방사용 용액(B), 500 units/mL 트롬빈을 함유하는 PVP 전기방사용 용액(C), 그리고 5.5 mg/mL CaCl2, 500 units/mL 트롬빈을 모두 함유하는 PVP 전기방사용 용액(D), CaCl2가 4배인 22 mg/mL, 트롬빈 500 units/mL를 함유하는 PVP 전기방사용 용액(E), 트롬빈이 4배인 2000 units/mL, CaCl2 5.5 mg/mL를 함유하는 PVP 전기방사용 용액(F) 각각 6가지의 시료를 제조하여 사용하였다(Figure 1).
전기방사의 다양한 공정인자 중 섬유형태에 중요한 영향을 주는 용액의 농도, 인가전압, 방사거리, 토출속도, 집전판의 형태, 온도 및 습도에 따라 얻어지는 나노섬유의 미세구조 및 직경을 분석하여 섬유형태가 균일하고 지혈제로 적용하기에 적절한 방사조건을 검토하였다. 전기방사용액은 일회용 폴리프로필렌 주사기(NORM-JECT, luer lock type, 12 mL, Air-Tite Products Co., Inc., USA)에 21 gauge metal needle을 결속하여 주사기펌프(syringe pump, KDS220, KD Scientific Inc., USA)에 장착한 후, 주사기 끝과 집전판 사이의 인가전압은 20 kV, 주사기 끝과 집전판 사이의 거리는 15 cm, 토출속도는 주사기 펌프에 의해 2 mL/h로 고정시키고, 200 rpm으로 회전하는 드럼형태 집전판에 12시간 동안 24 mL를 대량방사하여 나노섬유시트를 제조하였다. 25 oC에서 전기방사하는 동안 제습기를 가동하여 30% 이하의 습도를 유지하였다. 전기방사된 나노섬유시트는 섬유상에 포함된 잔존용매와 습기를 제거하기 위하여 진공오븐에서 24시간 건조한 후 보관하였다.
나노섬유의 미세구조 및 직경분석. 전기방사법으로 제조된 나노섬유의 미세구조는 전계방사형 주사전자현미경(field emission scanning electron microscope, FE-SEM, JSM-6500F, JEOL, Japan)을 이용하여 관찰하였다. 모든 시료는 공기 중의 수분에 의한 분해 및 변형을 방지하기 위해 밀봉하여 운반하였으며, 시료표면을 관찰하기 전에 150초간 sputter coater(108auto, Cressington Scientific Instruments Inc., UK)를 이용하여 백금으로 코팅 처리하였다. FE-SEM의 가속전압은 10 kV로 고정하여 디지털이미지를 촬영하였다. 섬유의 직경 및 직경분포를 조사하기 위하여 영상분석기(IMT I-solution, Image & Microscope Technology Inc., Korea)를 이용하였다. 먼저 FE-SEM을 통해 얻어진 나노섬유의 이미지는 영상분석 프로그램으로 scale bar를 보정하여 각각 100개의 서로 다른 섬유의 직경을 측정하여 평균직경을 계산하였고, 전체적으로 섬유직경이 가늘고 균일한 나노섬유를 최적조건으로 선정하여 차후 실험에 적용하였다.
PVP 나노섬유에 포함된 혈액응고인자인 CaCl2 및 트롬빈의 함유량 및 분산도를 확인하기 위하여 energy dispersive X-ray spectroscopy(EDS) 및 EDS mapping을 통해 각 원소의 성분비를 측정하였고 검출된 원소들을 시료 표면상에 점으로 나타내었다.
In Vitro 전혈 응고실험(Lee-White Method, Imai-Nose Method). 혈액응고시간 및 혈전형성의 정량분석은 혈액과 접촉되는 고분자재료의 혈액응고능을 평가하는 효과적인 방법이다. 나노섬유시트형 지혈제로 처리한 혈액의 응고특성을 분석하기 위해 한국동물혈액은행(Korea Animal Blood Bank, Korea)에서 구입한 개의 전혈을 이용하여 실험 전반에 사용하였다. 개의 전혈에는 약 13%의 항응고제가 포함되어 있으며, 채혈 이후 냉장상태에서 1주 이내인 전혈을 실험에 사용하였다. Lee-White 법은 혈액응고시간을 측정하는 것으로 유리 vial을 37 oC 항온수조에 10분간 방치하여 vial의 표면온도를 고정 후, 혈액(1 mL)을 vial에 넣고, 매 20초 마다 vial을 기울여 혈액이 응고하는 시간을 측정하는 혈액응고능 확인법이다.24 본 연구에서는 혈액의 혈액응고를 촉진시키기 위해 전혈에 10 mM CaCl2를 도입하였고, 나노섬유 지혈제가 있는 경우와 없는 경우의 Lee-White 법을 각각 진행하였다. 혈액이 더 이상 흐르지 않을 때까지의 시간을 기록하여 나노섬유 지혈제를 적용한 경우와 적용하지 않은 경우를 분석하였다.
Imai-Nose 법은 응고된 혈전의 무게측정을 통한 혈전형성능 확인법으로 실험과정은 다음과 같다.25 37 oC의 항온조에 스테인레스 스틸로 된 원심관 튜브 랙을 준비한다. 랙 위에 유리로 된 시계접시를 올려놓고 그 위에 나노섬유 시료 20 mg을 도입한다. 시계접시의 밑부분이 물에 잠기도록 한 후 10분간 방치하였다. 혈액 200 μL를 나노섬유 지혈제 위에 도입하고 조심스럽게 섞어 반응을 개시하였다. 대조군으로는 나노섬유 지혈제를 도입하지 않고 시계접시의 유리표면에 혈액 200 μL를 도입하여 실험하였다. 이 때 각각의 나노섬유마다 반응시간을 2, 4, 6, 8, 10, 20분으로 달리하였다. 일정 시간이 경과되면 시료 위에 5 mL 정제수를 첨가하여 혈액응고반응을 정지시켰다. 응고된 혈전을 분리한 후, 35% 포르말린 Daejung(Korea)으로 10분간 고정시키고 혈전을 다시 정제수에 침지시켜 5분간 세척한 뒤, 물기를 제거하여 24시간 동안 건조시켰다. 그 후 각 혈전의 무게를 측정하였다.
적혈구 용혈 실험. 나노섬유 표면에서 혈전형성 후 정제수에 의해 용혈된 적혈구의 정량을 통해 혈전형성속도 및 지혈능을 부가적으로 확인할 수 있다. Imai-Nose법에서 5 mL 정제수를 첨가하여 혈액응고반응을 정지시킨 시료에 5분 후, 혈전을 제외하고 정제수에 의해 용혈된 적혈구가 있는 상층액을 채취하고, 다시 정제수 5 mL를 첨가하여 잔존하는 적혈구 용혈용액를 채취하였다. 이를 1회 더 반복한 후, 96 well plate에 용혈용액을 분주하였다. 적혈구가 용혈되면 적혈구 내부에 있던 헤모글로빈이 방출되는데, 이 헤모글로빈을 microplate reader를 이용하여 540 nm에서의 흡광도를 측정하여 적혈구를 정량분석하였다.
혈소판 점착능 평가. 혈액의 응고는 혈장 중의 혈액응고인자(외인계 및 내인계 응고인자) 외에 혈소판의 활성화에 의해서도 일어난다. 본 실험에서는 일반 셀룰로오스와 혈액응고인자를 함유하는 나노섬유가 방사된 셀룰로오스 상에서의 혈소판의 점착정도와 점착혈소판의 세부형태를 관찰하였다. 항응고제가 첨가된 혈액을 1200 rpm으로 20분간 원심분리하여 platelet-rich plasma(PRP)를 얻고, 이를 냉장보관하면서 수시간 이내에 실험에 사용하였다. 37 ℃ 건조오븐에 12 well plate를 놓고, 각각의 셀룰로오스와 나노섬유-셀룰로오스 시료를 지름 2 cm로 제단하여 12 well plate에 배치 후, PRP 200 μL를 각 시료 위에 도입하고 37 ℃ shaking bath에 방치하였다. 10분 경과한 후에 PBS 2 mL를 도입하여 1분 동안 시료 위의 혈장을 가볍게 2회 세척하였다. 그 후 2.5% 글루타알데히드에 30분간 침지시켜 표면에 부착된 혈소판을 고정화시키고, 50, 70, 100% 에탄올 수용액에 1분씩 연속적으로 침적시켜 탈수시킨 후 상온에서 24시간 건조시켰다. 건조된 시료들의 표면을 백금코팅하고 전자현미경을 이용하여 각 시료표면에 응집된 혈소판의 수와 형태를 관찰하였다.
PVP-CaCl2-thrombin 나노섬유의 세포독성 평가. 혈액 및 창상조직과 직접적으로 접촉하는 의료용 소재의 세포독성평가는 필수적이다. 세포독성시험은 국제시험규격 ISO 10993-5에 의거하여 마우스의 섬유아세포(NIH-3T3)를 이용하여 시험물질인 나노섬유 지혈제가 세포의 배양환경 상에서 나타내는 세포독성 정도를 평가하였다. 실험절차를 간단히 설명하면, 마우스의 섬유아세포를 6-well plate에 2×105 cells/well 농도로 분주하고, 37 ℃, 5% CO2 환경에서 24시간 배양하였다. 24시간 후에 용출액을 처리하여 48시간 동안 배양한 후, 광학현미경을 이용하여 세포의 성장형태 및 성장억제를 관찰한 후, WST-1(water soluble tetrazolium salt, Daeil Lab Co., Korea) 용액을 처리하여 2시간 동안 반응시켜준 후, microplate reader를 이용하여 450 nm 파장에서 흡광도를 측정하여 결과 분석값(%)을 산출하였다.
SD Rat을 이용한 In Vivo 실험. 본 연구에서 제조된 나노섬유 지혈제의 지혈능 평가를 위해 실험대상으로 outbred male Sprague Dawley rat(8주령, 250-300 g, 효창사이언스)을 이용하여 간출혈 모델 in vivo 실험을 수행하였다.26 동물실험은 경북대학교병원 동물실험윤리위원회의 시행규정 및 승인에 의해 진행하였다. 수술을 시행하기 전 일주일 동안 동물을 항온항습(temperature range: 22±2℃, humidity 50±5%)이 유지되는 실험실에서 적응시켰다. 자세한 방법은 아래와 같다.
(1) SD rat을 동물용 마취제 Zoletil® 50(Virback, France)과 Rompun®(Bayer, Germany)을 4:1 비율로 섞어 투입하면서 상태를 관찰한다.
(2) 마취가 완료되면 70% 알코올로 소독 후 복부를 제모한다.
(3) 마취된 SD rat을 수술대에 고정시킨 뒤에 포비돈 요오드 용액으로 복부 전체를 소독한 후 복벽 및 복막을 10번 블레이드를 이용하여 약 20-30 mm 절개하고, 양측으로 거상시켜 간을 노출시킨다.
(4) 수술대를 45º 각도로 기울이고, 미리 무게를 측정한 파라필름과 여과지를 간 하부에 배치한다.
(5) 15번 블레이드로 깊이 4 mm의 상처를 간 좌엽에 내고, 출혈이 시작되면 시료(2×2 cm2)를 도입하여 지혈이 완료된 시간을 측정한다.
(6) 지혈이 되면 혈액을 흡수한 여과지와 시료의 무게를 측정하여 출혈량을 계산한다. SD rat을 안락사시킨 후 간조직을 채취하고, 절개된 복벽을 봉합하여 마무리한다.
조직관찰(Histology). 절개 후 지혈된 조직 내외부의 다양한 세포 및 지혈과정에서 형성된 피브린, 적혈구 및 혈소판의 분포를 관찰하기 위하여 hematoxylin-eosin 및 Carstair’s 염색을 실시하였다. 채취한 조직은 10% 포르말린 용액으로 고정시켰다. 화학적으로 고정시킨 조직은 탈수, 파라핀 포매과정 후 마이크로톰을 이용하여 5 μm 두께로 절편한다. 절편조직은 hematoxylin-eosin 및 Carstair’s 염색법으로 염색 후 CCD 카메라(DS-Fi-2, Nikon, Japan)를 장착한 광학현미경(Eclipse TS100, Nikon, Japan)을 통해 관찰하였다.
통계분석. 정량적인 측정수치의 유의성 평가는 통계분석 소프트웨어(KyPlot version 2.0, KyensLab, Inc.)를 사용하여 분석하였다. 각 수치는 평균±표준편차로 표기하였으며 significance level은 parametric Student’s t-test와 one-way ANOVA (analysis of variance)의 Tukey’s 사후검증법으로 판별하였다. 통계적 유의성은 p<0.05의 값으로 설정하였다.

|
Figure 1 Photomicrographs, fiber diameter distribution and energy dispersive spectroscopy (EDS) of the PVP nanofiber (A), PVP nanofibers containing 5.5 mg/mL CaCl2 (B), 500 units/mL thrombin (C), 5.5 mg/mL CaCl2 with 500 units/ml thrombin (D), 22 mg/mL CaCl2 with 500 units/mL thrombin (E), and 5.5 mg/mL CaCl2 with 2000 units/mL thrombin (F), respectively. All of nanofibers were electrospun using a 10 wt% PVP-80% ethanol solution at 20 kV voltage, 15 cm tip-to-collector distance, and 2 mL/h feed rate. The insets show EDS mapping (cyan dots: Ca; pink dots: S). The ○ marks in bar charts indicate 500 μm in diameter distributions. |
PVP-CaCl2-thrombin 나노섬유의 형태 관찰. 지혈제는 혈액과 직접적으로 접촉하므로 생체적합성이 우수하고 독성이 없으며 안전성이 검증된 소재를 적용해야 한다. 폴리비닐피롤리돈(PVP)은 생체친화성이 높고, 낮은 독성, 흡습성, 착화합물 형성능력 등을 갖고 있고, 물에 용해되는 수용성 고분자이며, 다른 수용성 고분자들과는 달리 알코올류, 특정종류의 염소화합물, 니트로파라핀, 아민류 등 많은 유기용매에도 쉽게 용해되어 의학, 화장품, 피막제, 합성세제 및 생체재료 등 그 응용범위가 매우 다양하다.8,9 또한 PVP는 FDA로부터 체내사용이 승인된 고분자로서 생의학적 응용에 있어 광범위하게 사용되는 합성고분자 중 하나이며, 높은 방사성을 가지고 있는 장점이 있어 지혈제용 나노섬유의 주재료로 활용하기에 적합한 소재이다. 제조공정에서는 PVP를 주성분으로 하는 나노섬유를 셀룰로오스 부직포 상에 전기방사함으로써 이중층 지혈제를 제조하였다. CaCl2와 트롬빈을 함유하는 PVP 나노섬유를 제조하여 혈액응고능을 갖게 함으로써 지혈제로의 기능을 부여하였고, PVP-CaCl2-thrombin의 나노섬유 제조 시 어려움을 80% 에탄올을 방사용매로 사용함으로써 해결하였다. 또한 셀룰로오스 부직포를 이중층 구조로 도입하여 혈액흡수능을 보완하고자 하였다. 나노섬유를 제조하는 과정에서 전기방사성이 좋으면서 나노섬유에 함유되는 트롬빈의 활성도가 유지될 만한 방사용매를 선정하는 데는 제한이 있다. 이를 보완하기 위해 휘발이 잘 되는 유기용매 중에서도 독성을 거의 나타내지 않는 에탄올을 사용하여 전기방사함으로써 PVP-CaCl2-thrombin 나노섬유를 얻을 수 있었다. 이러한 PVP를 70% 에탄올 수용액에 각각 10 wt%로 녹여 단독 방사하여 전자현미경으로 관찰한 결과, 용매가 튀어 군데군데 섬유가 녹은 것을 확인할 수 있었다. 반면, 80% 에탄올을 용매로 이용할 경우, 고분자용액이 튀지 않는 상태에서 상대적으로 균일한 나노섬유를 얻을 수 있었다. PVP 용액의 농도, 인가전압, 방사거리 및 토출속도에 따라 시험방사하여 미세구조 및 직경을 분석 후 섬유형태가 균일하고 지혈제로 적용하기에 적절한 전기방사 조건을 검토하였으며, 최적조건은 전압 20 kV, 방사거리 15 cm, 토출속도 2 mL/h로 설정하였다. 위 방사조건으로 10 wt% PVP 방사용액, 5.5 mg/mL CaCl2를 함유하는 10 wt% PVP 방사용액, 500 units/mL 트롬빈을 함유하는 10 wt% PVP 방사용액, 5.5 mg/mL CaCl2, 500 units/mL 트롬빈을 함유하는 10 wt% PVP 방사용액, 22 mg/mL CaCl2, 500 units/ml 트롬빈을 함유하는 10 wt% PVP 방사용액, 5.5 mg/mL CaCl2, 2000 units/mL 트롬빈을 함유하는 10 wt% PVP 방사용액을 각각 이용하여 나노섬유를 제조하였고, 전자현미경으로 미세구조를 촬영하였다(Figure 1). 6가지 나노섬유는 모두 원기둥모양의 방사형 섬유배열로 방사되었고, PVP 단독방사로 얻은 나노섬유와 비교하여 PVP-CaCl2, PVP-thrombin, PVP-CaCl2-thrombin 나노섬유 모두 평균직경 및 섬유형태의 차이점이 나타나지 않았다. PVP-CaCl2-thrombin 나노섬유 제조를 위한 방사조건을 확립한 후, 셀룰로오스 부직포 상에 섬유를 방사하였고 부직포 표면에 나노섬유가 균일하게 방사되는지 확인하기 위해 소량의 청색염료를 첨가한 용액을 전기방사하여, 셀룰로오스 부직포 표면에서의 전기방사도 균일함을 확인하였다.
섬유직경과 분포는 영상분석기를 통해 전자현미경 이미지를 분석하여 계산하였다. 시료는 영상분석기로 100개의 섬유직경을 측정하여 평균직경을 계산하였고, 전체적으로 섬유직경의 분포도를 막대그래프로 표현하였다. CaCl2와 트롬빈 농도에 따른 각 나노섬유의 평균직경 및 직경분포도를 Figure 1에 나타내었고, 분석 결과 혈액응고인자의 함유량에 따른 직경변화는 큰 차이가 나타나지 않았다. 이는 CaCl2와 트롬빈의 분자량이 작고, 미량 첨가되어 직경에 큰 영향을 주지 않는 것으로 사료된다. 이러한 나노사이즈의 섬유형태는 큰 비표면적 특징을 나타낸다. 큰 비표면적을 가짐으로써 혈액과 접촉하였을 때, 더욱 빠르게 혈액응고인자를 방출하여 신속한 지혈이 가능할 것으로 사료된다.
나노섬유의 제조공정 특성상 효소 혈액응고제 트롬빈은 유기용매 및 고전압의 영향을 받으므로 활성도의 검증이 요구된다. 전기방사 전후의 트롬빈 활성도는 chromogenic substrate (S-2238, H-D-phenylalanyl-L-pipecolyl-L-arginine-p-nitroaniline dihydrochloride)와 트롬빈의 반응에 의해 생성되는 p-nitroaniline의 흡광도를 측정하여 검증하였으며, 전기방사 및 에탄올에 의한 트롬빈 활성도의 영향이 미미함을 확인하였다.
Energy Dispersive X-ray Spectroscopy(EDS) 분석. 전기방사를 통해 얻은 PVP, PVP-CaCl2, PVP-thrombin, PVP-CaCl2-thrombin 나노섬유의 성분을 정량분석하기 위해 EDS 분석을 하였다(Table 1). CaCl2는 칼슘을 통해, 트롬빈의 경우엔 단백질 구조에 있는 아미노산 중 시스테인과 메티오닌에 존재하는 황(S)을 통해 CaCl2와 트롬빈이 방사가 잘 되었는지와 각각의 존재유무를 확인하였다. 그 결과 CaCl2나 트롬빈을 첨가하지 않은 경우엔 칼슘이나 황이 나타나지 않았으나 CaCl2나 트롬빈을 첨가한 경우에는 나타난 것을 확인할 수 있었다. CaCl2가 첨가된 나노섬유는 전체 표면에 칼슘이 약 1.5-2.0% 정도, 트롬빈이 첨가된 나노섬유의 경우 표면에 황이 약 0.2% 정도 함유되어 있는 것으로 나타났고, 황의 함유량이 칼슘에 비해 적은 이유는 트롬빈의 단백질 구조 상에 황을 포함하는 시스테인과 메티오닌의 비율이 낮기 때문인 것으로 사료된다.
전기방사를 통해 얻은 PVP-CaCl2, PVP-thrombin, PVP-CaCl2-thrombin 나노섬유 상에 칼슘과 트롬빈이 얼마나 잘 분산되어 있는지 분석하기 위해 EDS mapping 분석을 하였다. CaCl2에 있는 칼슘은 하늘색 점으로 표현하였고, 트롬빈의 단백질 구조에 있는 아미노산 중 시스테인과 메티오닌에 존재하는 황은 자주색 점으로 표현하여 각각의 분산 및 응집성을 확인하였다. 그 결과 CaCl2나 트롬빈이 한 군데 뭉쳐있지 않고 잘 분산되어 있다는 것을 확인할 수 있었다. 이는 전기방사를 통해 입자들이 섬유상에 골고루 잘 분산될 수 있다는 것을 나타내고, CaCl2와 트롬빈이 잘 분산되어 있음으로써 지혈제로 사용될 때 출혈부위에 골고루 지혈작용을 촉진할 수 있음을 의미한다.
PVP-CaCl2-thrombin 나노섬유의 In Vitro 혈액응고 실험. In vitro 평가법은 채혈된 혈액을 체외에서 시료와 접촉시키고 그 혈액이 응고할 때까지의 시간을 측정하여 혈전성의 기준으로 삼는 방법이다. 가장 일반적인 방법으로는 평가할 재료로 시험관을 만들거나, 시험관에 코팅하여 그 안에 채혈된 혈액을 넣고 응고시간을 측정하는 것이다. 응고시간이 짧을 수록 혈액응고인자의 활성화, 혈소판의 점착능이 크고 혈액응고능이 우수하게 된다. 이 방법은 비교적 간단하고 시간도 적게 걸린다는 이점이 있으나, 혈액을 체외로 채혈했을 때 이미 다른 이물질에 접촉하거나 조직의 손상액이 혼합되어 있는 경우 혹은 측정 중에 공기와의 계면이 존재하기 때문에 단백질의 변성이 일어나기 쉬운 점 등 평가해야 할 재료 이외에 환경적 영향을 받기 쉽다는 결점이 있다.
전혈응고실험으로 Lee-White 법과 Imai-Nose 법을 실시하였다. Lee-White 법은 혈액응고시간을 측정하는 것으로 혈액 0.5, 1.0 mL에서 나노섬유 지혈제 시료 20 mg에 대한 혈액응고시간을 측정하였고, 유리표면을 대조군으로 설정하여 실험한 결과를 Figure 2에 나타내었다. 대조군과 나노섬유 지혈제 시료를 비교하였을 때 5.5 mg/mL CaCl2 단독으로 함유된 PVP 나노섬유 시료를 제외하고 모든 시료의 혈액응고시간이 대조군보다 약 4배정도 빠른 것으로 나타났다. 5.5 mg/mL CaCl2를 함유한 나노섬유가 대조군보다도 혈액응고시간이 길게 나타난 이유는 항응고제에 의해 탈칼슘이온화된 혈액의 혈액응고를 촉진시키기 위해 혈액에 CaCl2 10 mM을 도입한 상태에서 추가로 시료를 도입하여 칼슘이온농도가 너무 높아져 칼슘이온이 트롬빈과 피브리노겐의 반응을 방해하여 피브린 형성을 지연시켰기 때문인 것으로 보여진다. 나머지 4가지 시료와 비교하였을 때는 서로 큰 차이가 나타나지 않았으며, 이는 이미 혈액응고반응이 일어나기에 충분한 양의 칼슘과 트롬빈을 포함하고 있기 때문에 칼슘과 트롬빈의 양을 추가하더라도 응혈시간에 현저한 차이가 없는 것으로 보여진다.
Imai-Nose 법은 일정량의 혈액에 나노섬유 지혈제 시료를 도입하여 일정 시간이 지난 뒤, 혈액응고반응을 정지시켜 시간에 따라 혈전이 얼마나 형성되는지 평가하는 시험법으로 대조군은 Lee-White 법과 동일하게 유리표면으로 두어 실험을 진행하였다(Figure 3(A)). 나노섬유 지혈제 시료가 대조군보다 짧은 시간에 현저히 많은 혈전이 형성되었고 이를 통해 혈액이 완전히 응고되는 속도가 훨씬 더 빠르다는 것을 알 수 있었다. 트롬빈이 함유되지 않고 5.5 mg/mL의 염화칼슘만 함유된 시료와 22 mg/mL 염화칼슘 및 500 unit/mL 트롬빈을 함유한 시료의 초기 혈전형성은 다른 시료의 절반 수준이었으나 10분 이후의 혈전형성은 대조군을 제외하고 유사한 경향을 나타내었다. 이는 염화칼슘보다 트롬빈이 초기의 혈액응고작용에 결정적이며, 과량의 염화칼슘은 초기의 혈액응고를 방해한다는 것을 의미한다. 혈전형성 후 용혈액에 포함된 헤모글로빈의 정량분석에서도 트롬빈이 함유되지 않은 시료와 과량의 염화칼슘이 함유된 시료의 초기 헤모글로빈 용출 경향이 위의 결과와 유사하게 나타났다(Figure 3(B)). 특히, 염화칼슘을 함유하지 않고, 500 unit/mL 트롬빈만 함유한 나노섬유 지혈제의 경우 초기의 혈전형성은 5.5 mg/mL 염화칼슘 및 500 unit/mL 트롬빈을 함께 함유한 지혈제와 비교하여 유사하거나 약간 낮지만 20분 이후에는 약 11.1%의 낮은 수치를 나타내었으며, 염화칼슘이 혈액 속의 혈장의 응고를 촉진하고 적혈구와 흡착하면서 후기의 혈전형성률을 높여주는 것으로 예상된다.
적혈구 용혈실험. Imai-Nose 법을 진행하는 중에 응고되지 않고 잔존하는 적혈구의 양을 확인하기 위해 적혈구 용혈 실험을 실시하였다(Figure 3(B)). 대조군과 각 나노섬유 시료마다 일정시간 동안 혈액응고를 진행시킨 뒤, 정제수를 넣어 혈액응고반응을 정지시키고 잔존하는 적혈구를 용혈시켰다. 적혈구가 용혈되면 헤모글로빈이 나오는데 헤모글로빈의 흡광도가 540 nm에서 최대치를 나타내게 되므로, 적혈구 용혈 용액의 흡광도를 540 nm에서 측정하였다. 대조군에 비해 나노섬유 시료의 흡광도 값이 현저히 낮게 나온 것으로 보아 잔존하는 적혈구의 양이 더 적다는 것을 알 수 있고, 이는 혈전형성이 더 많이 되었다는 것을 의미한다. 각 나노섬유 시료마다 잔존하는 적혈구의 양을 비교하면 큰 차이가 없는 것으로 나타났는데, 이미 충분한 양의 트롬빈과 칼슘이온이 도입되었기 때문인 것으로 사료된다.
칼슘 재첨가 실험. 혈장단백질과의 상호작용을 확인하기 위해 platelet-poor plasma(PPP)를 채취하여 칼슘 재첨가 실험을 진행하였고, 이를 통해 혈장단백질의 fibrin network 형성시간(plasma recalcification time, PRT)을 측정하였다. 대조군은 전혈응고실험과 마찬가지로 유리표면으로 하였고, 대조군과 각 나노섬유 지혈제 시료들의 실험결과값을 Figure 4에 나타내었다. 대조군과 나노섬유 시료를 비교하면 5.5 mg/mL CaCl2가 함유되어 있는 PVP 나노섬유 시료는 오히려 PRT 값이 지연되었고, 이를 제외한 나노섬유 시료의 fibrin network 형성속도는 대조군보다 약 7배 정도 빠른 것으로 확인되었다. 5.5 mg/mL CaCl2가 함유된 PVP 나노섬유 외에 나머지 시료 종류에 따라서는 큰 차이가 나타나지 않았다. 5.5 mg/mL CaCl2가 함유되어 있는 시료의 경우에는 PPP에 일정량의 CaCl2를 도입한 후, 추가로 시료를 도입하여 칼슘이온농도가 너무 높아지면서 Lee-White 법의 결과에서와 같이 칼슘이온이 트롬빈과 피브리노겐의 반응을 방해하여 피브린 형성이 지연된 것으로 보여진다. 나머지 시료들은 이미 충분한 양의 트롬빈과 칼슘이온이 도입되었기 때문에 차이가 나지 않는 것으로 사료된다. 혈액응고인자 염화칼슘과 트롬빈의 함량에 따른 PVP 나노섬유 지혈제의 in vitro 전혈응고실험의 결과들을 종합하면, 500 unit/mL 이상의 트롬빈이 함유된 지혈제의 혈액응고능은 대조군에 비하여 모두 현저히 높은 지혈능을 나타내었다. 반면, 500 unit/mL 트롬빈과 22 mg/mL의 염화칼슘을 모두 함유한 PVP 나노섬유 지혈제의 지혈능은 과량의 염화칼슘으로 인하여 초기지혈능이 다소 감소하였다. 위와 같은 결과들을 바탕으로 이후의 혈소판점착능 및 in vivo 동물실험에서는 500 unit/mL 트롬빈과 5.5 mg/mL 염화칼슘을 함유한 PVP 나노섬유 지혈제를 실험군에 적용하였다.
혈소판 점착능 평가. 혈소판 점착 및 활성능을 확인하기 위해 혈소판이 많이 함유되어 있는 PRP를 일반 셀룰로오스 부직포와 혈액응고인자를 함유하는 나노섬유가 방사된 셀룰로오스 부직포에 각각 도입한 뒤, 이를 글루타알데하이드로 고정하여 전자현미경을 통해 관찰하였다(Figure 5). 일반 셀룰로오스 부직포에서는 혈소판이 보이지 않는데, 이는 혈소판 활성화에 의한 피브린 응집을 형성하기 전에 섬유직경이 큰 부직포 기공 사이로 대부분의 혈소판이 유출된 것으로 판단된다. Figure 5(C)의 확대사진에서와 같이 혈소판이 구형이고 피브린 섬유소가 적은 것을 관찰할 수 있었다. 반면, 셀룰로오스-PVP 나노섬유 지혈제의 경우 혈소판이 혈구와 엉켜서 셀룰로오스 섬유표면 및 내부에 점착되어 있는 것이 관찰되었다. Figure 5(F)의 확대사진에서와 같이 혈소판의 형태가 변형되고 주변부에 피브린 섬유소가 방사형으로 퍼져있었다. 이는 나노섬유 표면에 분산된 트롬빈과 혈소판이 접촉하면서 활성화되어 기공 사이를 혈소판이 부분적으로 메워나가면서 응집이 형성된 것으로 보여진다.
PVP-CaCl2-thrombin 나노섬유의 세포독성평가. 지혈제는 체액과 직접적으로 접촉하는 의료용 소재로 세포독성시험을 통해 생체안전성의 검증이 필수적이다. 세포독성시험은 국제시험규격 ISO 10993-5에 의거하여 마우스의 섬유아세포(NIH-3T3)의 배양환경 하에서 시험물질의 세포독성을 정성적 및 정량적으로 평가하였다(Table 2). 양성대조군 용출액에서의 세포는 5%의 세포만 생존하였고, 정성적 반응도는 grade 4인 거의 완전하게 세포층이 파괴되는 것으로 판정되었다. 반면, 5.5 mg/mL CaCl2와 500 units/mL 트롬빈을 함유한 PVP 나노섬유 지혈제로부터 용출된 용액에서 48시간 동안 세포를 배양하여도 92% 이상의 세포가 생존하였으며 정성적 반응도는 광학현미경 관찰 시 grade 1인 20% 이하의 약한 세포형태변화 및 성장저해를 확인할 수 있었다. 이는 세포독성 1등급(>80%)에 해당하는 결과로 생물학적 안전에 관한 기준에서 세포독성이 매우 낮음으로 판정할 수 있다.
SD Rat을 이용한 In Vivo 동물시험. In vivo 평가법은 재료를 직접 체내 출혈부위에 적용하여 혈전형성 및 지혈 정도를 관찰하는 방법으로 실험동물의 종류 및 혈류량의 영향을 받기 쉽고, 실험자의 능숙한 기술이 필요하다. SD rat의 복부를 개복하여 미리 무게를 측정한 여과지와 파라필름 위에 간을 노출하고 간의 좌엽에 상처를 형성하여 지혈시간과 혈액흡수량을 확인하였다(Figure 6). 실험군 시료는 가장 방사성이 좋고 혈액응고실험에서도 효과가 좋았던 5.5 mg/mL CaCl2 및 500 units/mL 트롬빈을 함유한 PVP nanofiber-cellulose nonwoven을 이용하였고, 대조군으로는 상처형성 이후로 아무 처리하지 않은 경우와 시판중인 Surgicel®을 사용한 경우, 두 가지를 사용하였다. 각 군당 SD rat 20마리씩을 적용하여 각 군의 지혈시간과 출혈량, 시간당 출혈량에 대한 평균값을 도출하였다. 지혈시간은 대조군의 경우 평균 2분 30초, Surgicel®의 경우 평균 2분, 실험군 시료의 경우 평균 2분 이내로 지혈이 이루어짐을 확인할 수 있었고, 출혈량은 대조군이 평균 479 mg으로 가장 높았고, Surgicel®이 평균 316 mg, 시료의 경우 평균 194 mg으로 실험군의 출혈량이 가장 적음을 확인할 수 있었다. 이를 바탕으로 시간당 출혈량을 계산해본 결과, 대조군은 169.07 mg/min, Surgicel®은 154.32 mg/min, 실험군 시료는 114.08 mg/min으로 실험군의 지혈능이 가장 우수하였으며, 현재 시판되고 있는 지혈제인 Surgicel®보다 더 효과적인 것으로 확인되었다. Surgicel®은 의료현장에서의 광범위하게 사용되고 있는 산화재생셀룰로오스 기반의 지혈제이지만 부착성이 약하고 혈전형성능이 낮은 단점이 있다. 반면, 나노섬유상에 혈액응고인자가 균일하게 분포된 PVP와 셀룰로오스 이중층 지혈제는 혈전형성을 촉진해주는 칼슘이온과 트롬빈의 작용에 의해 지혈시간 뿐만 아니라 출혈량도 감소한 것으로 사료된다.
조직학적 관찰. 혈액응고인자가 함유된 PVP 나노섬유시트-셀룰로오스 이중층 지혈제에 의해 지혈된 간조직의 지혈부위 상처구역의 조직학적 사진을 Figure 7에 나타내었다. Hematoxylin-eosin 조직염색은 세포의 핵을 진청색, 세포질은 연홍색, 피브린은 진홍색으로 염색시켜, 절개조직 주변의 세포분포 및 수복형태를 확인할 수 있다. Figure 7(A)에서와 같이 상처구역에는 대량으로 응집된 피브린이 쐐기모양으로 채워져 있고, 주변부에서는 간조직의 핵 및 세포질이 관찰되었다.27,28 Carstair’s 조직염색으로는 피브린을 진홍색, 혈소판은 청색, 콜라겐은 연청색, 적혈구는 진황색으로 염색하여 지혈된 조직의 상태를 자세히 확인할 수 있다.28 지혈이 시작되면 1차적으로 상처부위에서 다량의 혈소판 유착이 발생하여 혈괴 마개를 형성하고, 2차적으로 피브린이 적혈구와 혈소판을 응집하도록 섬유소를 생성하여 혈전을 형성하게 되는데, Figure 7(B)의 조직학적 현미경사진과 같이 상처내부에는 피브린 및 적혈구가 대량으로 존재하고 절개조직의 상부에는 혈소판이 많이 응집되어 있음을 확인할 수 있었다. 이는 출혈이 발생한 상처표면의 혈액에 비표면적이 큰 PVP-CaCl2-thrombin 나노섬유 지혈제에 분산된 칼슘이온과 트롬빈이 급속히 접촉하면서 혈소판 분비의 활성화 및 혈괴형성 후, 순차적으로 수용성 당단백질인 피브리노겐을 느슨한 그물망 형태의 피브린으로 변화시킨 후 단단한 섬유소로 혈전형성을 촉진한 것으로 사료된다.

|
Figure 2 Effect of CaCl2 and thrombin amounts in PVP nanofibers on blood coagulation time tested by Lee-White method. |

|
Figure 3 Thrombus formation rate (A) of PVP-CaCl2-thrombin nanofibers as a function of incubation time by Imai-Nose method. Absorbance of hemoglobin (B) of PVP-CaCl2-thrombin nanofibers as a function of incubation time by red blood cells hemolysis. |

|
Figure 4 Fibrin formation time by plasma recalcification using PRT method. |

|
Figure 5 Photomicrographs of adhered platelets on the cellulose nonwoven fabrics (A-C); cellulose-PVP nanofiber sheets containing CaCl2 and thrombin (D-F). Magnification of each image is ×300 (A, D), ×1000 (B, E), and the single spot of platelets on the surfaces of cellulose (C) and cellulose-PVP (F). |

|
Figure 6 Bleeding time (A) of control, Surgicel®, and PVP nanofiber containing CaCl2 and thrombin-cellulose nonwoven fabric bilayer samples. Hemorrhage quantity (B) of control, Surgicel®, and PVP nanofiber containing CaCl2 and thrombin-cellulose nonwoven fabric bilayer samples. (NS means not significant, **p<0.005, ***p <0.001) |

|
Figure 7 Histological photomicrographs of incision sites (liver in rats) with hematoxylin-eosin (A, dark red; fibrin, pink; cytoplasm, dark blue; nuclei) and Carstair's (B, dark red; fibrin, blue; blood platelet, bright blue; collagen, clear yellow; red blood cell) staining by treating the PVP nanofiber containing CaCl2 and thrombin-cellulose nonwoven fabric bilayer sample. |
|
Table 1 Element Composition in the PVP Nanofiber Sheets Containing CaCl2 and Thrombin |

aPVP nanofiber. bPVP nanofibers containing 5.5 mg/mL CaCl2. c500 units/mL thrombin. d5.5 mg/mL CaCl2 with 500 units/mL thrombin. e22 mg/mL CaCl2 with 500 units/mL thrombin. f5.5 mg/mL CaCl2 with 2000 units/mL thrombin. |
|
Table 2 Cytotoxicity Test of the PVP Nanofiber Sheets Containing 5.5 mg/mL CaCl2 and 500 units/mL Thrombin |

a0; None, 1; Slight, 2; Mild, 3; Moderate, 4; Severe. |
지혈제는 응급상황이나 외과수술 중에 빈번하게 발생하는 과다출혈을 신속히 정지시키기 위해 사용하는 최초의 제재이므로 효과적이며 안전성이 개선된 지혈용 소재의 지속적인 연구개발은 필수적이다. 본 연구에서는 전기방사 공정인자를 최적화하여 CaCl2와 트롬빈이 균일하게 분산된 PVP 나노섬유를 셀룰로오스 부직포 상부에 방사함으로써 혈액응고인자가 함유된 이중층 나노섬유 지혈제를 제작할 수 있었다. 다양한 비율의 CaCl2와 트롬빈이 함유된 PVP 나노섬유 실험군들의 평균직경은 약 570-610 nm였으며, 망상구조의 섬유상에 혈액응고인자들이 균일하게 분포하고 있었다. In vitro 혈액응고실험을 통해 5.5 mg/mL CaCl2와 500 unit/mL 트롬빈을 함유한 PVP 나노섬유 지혈제의 혈액응고시간이 대조군에 비해 4배 정도 단축되고, 혈전의 형성속도 및 형성량은 현저하게 높게 나타났으며 피브린 형성시간도 약 7배 단축되는 것을 확인할 수 있었다. 셀룰로오스 단층표면에 비해 혈액응고인자를 함유한 나노섬유-셀룰로오스 이중층 표면상에서 과량의 혈소판 응집 및 접착이 관찰되었다. 섬유아세포를 이용한 PVP-CaCl2-thrombin 나노섬유의 용출물 세포독성평가는 92%의 세포생존율을 나타내었으며, 이는 세포독성 1등급의 안전성을 의미한다. SD rat을 이용한 간출혈 동물실험에서 PVP-CaCl2-thrombin 나노섬유 실험군은 대조군 및 Surgicel®군에 비하여 우수한 지혈능을 보여주었다. Hematoxylin-eosin 및 Carstair's 조직염색을 통하여 간출혈 부위의 조직에서 다량의 피브린 적혈구 및 혈소판을 확인하였다. 본 연구에서 제조한 PVP-CaCl2-thrombin 나노섬유형 지혈제는 상용 지혈제보다 우수한 지혈능을 나타내었으며 외과용 지혈제로 적용 및 응용가능성이 기대된다.
- 1. F. E. Turrentine, H. Wang, V. B. Simpson, and R. S. Jones, J. Am. Coll. Surg., 203, 865 (2006).
-

- 2. J. L. Jameson, A. S. Fauci, D. L. Kasper, S. L. Hauser, D. L. Longo, and J. Loscalzo, Chapter 61: Bleeding and thrombosis, Harrison's principles of internal medicine, 20th ed., McGraw-Hill Education, 2018.
- 3. A. K. Vine, Retina, 29, 1 (2009).
-

- 4. E. Peralta, Overview of topical hemostatic agents and tissues adhesives used in the operating room, Uptodate®, 2018.
- 5. C. P. Sundaram and A. C. Keenan, Indian J. Urol., 3, 374 (2010).
-

- 6. J. B. Gross, Anesthesiology, 58, 80 (1983).
-

- 7. M. Pogorielov, O. Kalinkevich, V. Deineka, V. Garbuzova, A. Solodovnik, A. Kalinkevich, T. Kalinichenko, A. Gapchenko, A. Sklyar, and S. Danilchenko, Biomater. Res., 19, 1 (2015)
-

- 8. Q. Yang, Z. Li, Y. Hong, Y. Zhao, S. Qiu, C. E. Wang, and Y. Wei, J. Polym. Sci. B, 42, 3721 (2004).
-

- 9. X.-Y. Dai, W. Nie, Y.-C. Wang, Y. Shen, Y. Li, and S.-J. Gan, J. Mater. Sci. Mater. Med., 23, 2709 (2012).
-

- 10. G. Oshima, Thromb. Res., 15, 93 (1990).
- 11. L. Ruan, H. Zhang, H. Luo, J. Liu, F. Tang, Y.-K. Shi, and X. Zhao, PNAS, 106, 5105 (2009).
-

- 12. A. Haider, S. Haider, and I.-K. Kang, Arab. J. Chem., 11, 1165 (2018).
-

- 13. M. Liu, X.-P. Duana, Y.-M. Li, D.-P. Yang, and Y.-Z. Long, Mater. Sci. Eng.: C, 76, 1413 (2017).
-

- 14. R. Vasita and D. S. Katti, Int. J. Nanomed., 1, 15 (2006).
-

- 15. S. M. Jo, W. S. Lee, and S. W. Chun, Fiber Technology and Industry, 6, 112 (2002).
- 16. E. D. Boland, J. Biomed. Mater. Res., 71B, 144 (2004).
-

- 17. G. E. Wnek, M. E. Carr, D. G. Simpson, and G. L. Bowlin, Nano Lett., 3, 213 (2003).
-

- 18. D. Li and Y. Xia, Adv. Mater., 16, 1151 (2004).
-

- 19. S. Ramakrishna, K. Fujihara, W. E. Teo, T. C. Lim, and Z. Ma, An Introduction to Electrospinning and Nanofibers, World Scientific Publishing Co. Pte. Ltd., New Jersey, Lodon, Singapore, Beijing, Shanghai, Hong Kong, Chennai, 2005.
-

- 20. Z. M. Huang, Y. Z. Zhang, M. Kotaki, and S. Ramakrishna, Compos. Sci. Technol., 63, 2223 (2003).
-

- 21. H. N. Park, J. B. Lee, and I. K. Kwon, Biomater. Res., 14, 95 (2010).
- 22. K. C. Gupta, A. Haider, Y.-R. Choi, and I.-K. Kang, Biomater. Res., 18, 27 (2014).
-

- 23. J. B. Lee, Y.-G. Ko, D. Cho, W. H. Park, and O. H. Kwon, Biomater. Res., 21, 128 (2017).
-

- 24. R. I. Lee and P. D. White, Am. J. Med. Sci., 145, 1827 (1953).
- 25. Y. Imai and Y. Nose, J. Biomed. Mater. Res., 6, 165 (1972).
-

- 26. U. A. Sezer, Z. Kocer, B. Aru, G. Y. Demirel, M. Gulmez, A. Aktekin, S. Ozkaraf, and S. Sezer, RSC Adv., 6, 95189 (2016).
-

- 27. K. C. Carstairs, N. Woolf, and T. Crawford, J. Pathol., 88, 537 (1964).
-

- 28. M. Ghasemzadeh, Z. S. Kaplan, I. Alwis, S. M. Schoenwaelder, K. J. Ashworth, E. Westein, E. Hosseini, H. H. Salem, R. Slattery, S. R. McColl, M. J. Hickey, Z. M. Ruggeri, Y. Yuan, and S. P. Jackson, Blood, 121, 4555 (2013).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(4): 629-639
Published online Jul 25, 2019
- 10.7317/pk.2019.43.4.629
- Received on Apr 2, 2019
- Revised on Apr 21, 2019
- Accepted on Apr 22, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Oh Hyeong Kwon
-
Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
- E-mail: ohkwon@kumoh.ac.kr
- ORCID:
0000-0002-7160-0105









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.