- Syntheses and Characterizations of Functionalized Graphene Oxide with Cationic Surfactant/Polystyrene Nanocomposites
Bo-Jeong Kim and Younggon Son†
Advanced Materials Science and Engineering, College of Engineering, Kongju National University, Cheonan, Chungnam 331717, Korea
- 양이온 계면활성제로 개질된 그래핀 옥사이드와 폴리스티렌 나노복합재료의 합성 및 특성분석
김보정 · 손영곤†
공주대학교 신소재공학부
This study reports a new method of purifying graphene oxide (GO) through the addition of cationic surfactants. In this process, the cationic surfactant, (benzyl dimethyl hexadecyl ammonium chloride), was added to GO/H2SO4 mixture. Then the GO* (GO coupled with the cationic surfactant) becomes lipophilic. When CH2Cl2, a lipophilic solvent, was added to the mixture, the GO* migrated to CH2Cl2 phase, and resulted in a two-phase system consisting of H2SO4 + water + KMnO4 -phase, and GO* + CH2Cl2 -phase. The GO* was separated from GO* + CH2Cl2 mixture by drying and then subsequently converted to reduced-GO by thermal reduction. After purification, GO* and polystyrene (PS) nanocomposites were fabricated by polymerization, solvent mixing and melt mixing. It was found that nanocomposites with surfactant treated GO* exhibited better dispersion in PS than conventional-GO and reduced-GO and demonstrated improved barrier properties in non-polar solvents.
화학적 박리법에 의하여 흑연으로부터 rGO(reduced graphene oxide)를 제조하는 공정은 산화 흑연(GO, graphene oxide)/황산 혼합용액에서 GO를 분리해내는 과정이 핵심이다. 이 연구에서는 GO/황산 혼합물에 양이온 계면 활성제를 투여하여 산을 쉽게 제거하는 방법을 제안하였다. GO/산 혼합물에 양이온 계면 활성제를 투여하면 양이온 계면활성제와 결합한 GO*는 기름 상과 친화력이 높아졌다. 여기에 친유성 용매인 CH2Cl2를 투여하면 GO*는 CH2Cl2 상으로 이동하여, 황산 + 물 + KMnO4 상과 GO* + CH2Cl2 두 상으로 층 분리되었다. 건조를 통해서 GO* + CH2Cl2 상에서 분리한 GO*를 열 환원법으로 rGO로 전환하였다. 또한 GO*와 폴리스티렌(PS) 나노 복합재료를 제조하였다. 중합법, 용액 혼련법 및 용융 혼련법의 세가지 방법을 사용하여 제조한 복합재료에서 GO*의 분산 특성 및 용매 차단 특성에 대하여 평가하였다. 계면활성제로 개질된 GO*가 GO나 rGO보다 PS과의 나노복합재료 제조 시에 분산성이 월등함을 알 수 있었다. 또한 비극성 용매에 대해 차단특성실험을 한 결과 PS/GO* 나노복합재료의 경우가 차단 특성이 개선되는 것을 알 수 있었다.
The cationic surfactant treated GO and polystyrene (PS) nanocomposites were prepared.
Nanocomposites with surfactant treated GO showed enhanced dispersion in PS and demonstrated improved barrier properties.
Keywords: graphene, functionalized graphene oxide, polystyrene, nanocomposite
이 논문은 2017년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(grant Number: NRF-2017R1D1A3B03031861).
그래핀은 흑연을 한 층으로 박리한 탄소재료로 탁월한 열적 특성,1-3 전기적 특성4-7 및 기계적8 특성을 나타낸다. 이러한 특성 때문에 그래핀은 투명 전극, 전자소자, 에너지 저장 소자 및 고성능 복합재료 등 다양한 분야에서 응용될 것으로 기대된다. 그래핀의 다양한 응용 연구 분야 중 고분자/그래핀 나노 복합재료는 전기 전도성, 기계적 물성 및 차단 특성 증가를 위한 다양한 연구가 진행되어 왔다.9,10 최근에는 그래핀의 넓은 표면적과 높은 종횡비 등 나노 클레이와의 구조적인 유사성으로 인해 차단 특성(barrier property)에 관한 관심이 높아지고 있다.
그래핀을 제조하는 방법으로는 화학 기상 증착법(chemical vapor deposition),11,12 에피 성장법(epitaxial growth),13,14 필 오프 방법,15 화학적 박리법16,17 등 다양한 방법이 존재한다. 이 방법들은 대량 생산이 어려워 생산비가 매우 높다. 이들 중에서 고분자 복합재료에 사용될 만큼 많은 양을 생산할 수 있는 방법은 화학적 박리법이 유일한 방법이라고 알려져 있다.16,17 흑연을 질산이나 황산 또는 그 혼합물에 넣고 과망간산 칼륨(KMnO4) 등의 산화제와 함께 일정시간 침지시키면 흑연의 층 사이로 산과 산화제가 침투해 산화 반응으로 산화 흑연(graphite oxide)이 만들어진다. 이와 동시에 흑연의 층간 거리가 증가하고 층간의 π-π 상호 작용 및 힘은 줄어들어 박리가 쉽게 일어날 수 있게 된다. GO를 환원시키면 층들의 박리가 일어나면서 환원된 그래핀(reduced GO. rGO)이 만들어 진다.16 현재 대부분의 화학적 박리법에 의한 GO 및 rGO 제조는 Hummers가 초기에 고안한 기술을 기반으로 한 방법들이다. 흑연을 산화제와 함께 산에 투입하여 형성된 GO는 표면의 산소 작용기에 의하며 높은 극성을 띠게 되고 물이나 산에 분산이 쉽게 되는데 박막 플레이트 형상으로 존재한다고 알려져 있다.18 이렇게 얻어진 GO + 산 혼합물에서 산을 제거하기 위해서는 매우 오랜 시간의 원심 분리 및 극 미세 필터를 통한 세정법을 사용하여야 하기 때문에 산 세척에 아주 많은 비용이 소요된다. 화학적 박리법이 다른 방법들에 비해 경제적이기는 하지만 산 처리에 소요되는 폐수량이 많아 비효율적이며 생산단가가 비교적 높다.
이 연구에서는 rGO를 제조하는 과정에서 GO/산 혼합물에 양이온 계면 활성제를 투여하여 산을 쉽게 제거하는 방법을 제안하였다. GO/산 혼합물에 양이온 계면 활성제를 투여하면 양이온 계면활성제와 결합한 GO*는 기름 상(oil phase)과 친화력이 높아졌다. 여기에 친유성 용매인 CH2Cl2를 투여하면 GO*는 CH2Cl2 상으로 이동하여, 황산 + 물 + KMnO4 상과 GO* + CH2Cl2 두 상으로 층 분리되었다. GO* + CH2Cl2 (비점=39.6 ℃) 상에서 GO*를 쉽게 분리하여 열분해를 통하여 rGO를 얻었다. 또한 GO*는 친유성이기 때문에 고분자와 혼화성이 높을 것으로 생각되어 폴리스티렌(PS)과 나노복합재료를 제조하였다. 나노 복합재료는 중합법, 용액 혼련법 및 용융 혼련법 등 세가지 방법을 사용하였고 각각의 방법으로 제조한 복합재료에서 GO*의 분산 특성, 열적 특성, 유변학적 특성 및 용매 차단 특성에 대하여 평가하였다.
재료. 흑연은 Graphit Kropfmühl사의 그레이드 명 Cond 5를 사용하였다 평균 입경이 5 µm였다. 흑연으로부터 산화그래핀(GO)을 제조하기 위하여 Junsei사의 H2SO4, Aldrich사의 과망간산 칼륨(KMnO4, 순도>99.0%), 그리고 삼전화학의 함량 35% 과산화수소수(H2O2)를 사용하였다. GO를 기능화시키기 위한 양이온 계면활제, benzyl dimethyl hexadecyl ammonium chloride(BDHd-N+Cl-)는 Aldrich사에서, dichloro-methane(CH2Cl2, 순도 99.5%)은 삼전화학에서 구입하여 별도의 정제없이 사용하였다. 폴리스티렌(PS) 중합을 위한 스티렌 단량체는 Junsei Chemicals에서 구입하였다. 내경 30 mm의 유리 컬럼에 알루미늄 옥사이드(aluminum oxide)를 30 cm 채워 넣고 스티렌을 흘려 중합금지제를 제거하였다. 정제과정에서 스티렌의 중합을 방지하기 위하여 정제 공정은 -20 ℃에서 수행하였다. 중합 개시제인 2,2-azobisisobutyronitrile (AIBN)은 삼전화학에서 구입하여 메탄올에 의한 재결정 방법으로 정제하여 사용하였다. 폴리(비닐 알코올)(poly(vinyl alcohol), PVA, 중합도=1500)은 TCI Chemicals에서 구입하였다. Hydroxyl ethyl cellulose(HEC, 200~300 mPa.s)는 Junsei Chemicals에서 구입하였다.
GO의 합성. 1리터 3구 플라스크에 기계식 교반기를 장착하고 ice bath를 이용하여 반응기 내부 온도를 0 ℃까지 낮추고 같은 온도로 계속 유지하였다. 흑연(1 g)을 황산(110 mL)에 투입하여 20분 동안 90 rpm으로 교반한 후 150 rpm으로 속도를 높여 15분 동안 더 교반하였다. 그 후 KMnO4(4.2 g)를 30분간 여러 번에 걸쳐 서서히 투입하고 이후 상온에서 12시간 동안 더 교반하였다. 이 후 증류수(50 mL)를 투입하고 15분 동안 교반한 후 반응의 종결을 위해 2 L 비이커에 옮겨 담은 뒤 증류수/H2O2(145/44 mL) 혼합물을 투입하여 미 반응된 물질을 제거하여 GO 용액을 제조하였다.
GO의 세척 및 건조. 이 단계에서 반응물은 황산 수용액에 GO 박막 플레이트들이 분산되어 있는 상태이다. 여기에서 황산을 제거하고 GO 입자를 분리하는 것은 매우 시간이 걸리는 작업이었다. 반응물에 과량의 증류수(1 L)를 혼합하고 48시간 정도 방치하면 GO는 서서히 가라앉아 아래층은 진한 갈색 위 층은 맑은 용액이 된다. 침강 시간을 가속시키기 위해서 혼합물을 원심 분리기용 플라스틱 튜브(50 mL)에 나눠 담고 최고 속도에서 6시간 원심 분리하였다. 이후 맑은 위층을 따라내고 다시 과량의 물을 투입하고 초음파로 분산시킨 후 원심 분리를 다시 시도하였다. pH가 6~7이 될 때까지 이 과정을 수회 반복하였는데 보통 7-8차례 반복하여 GO 세척에만 10일 이상 소요되었다. 이 후 12시간 동결 감압 건조시켜 GO 파우더를 얻었다.
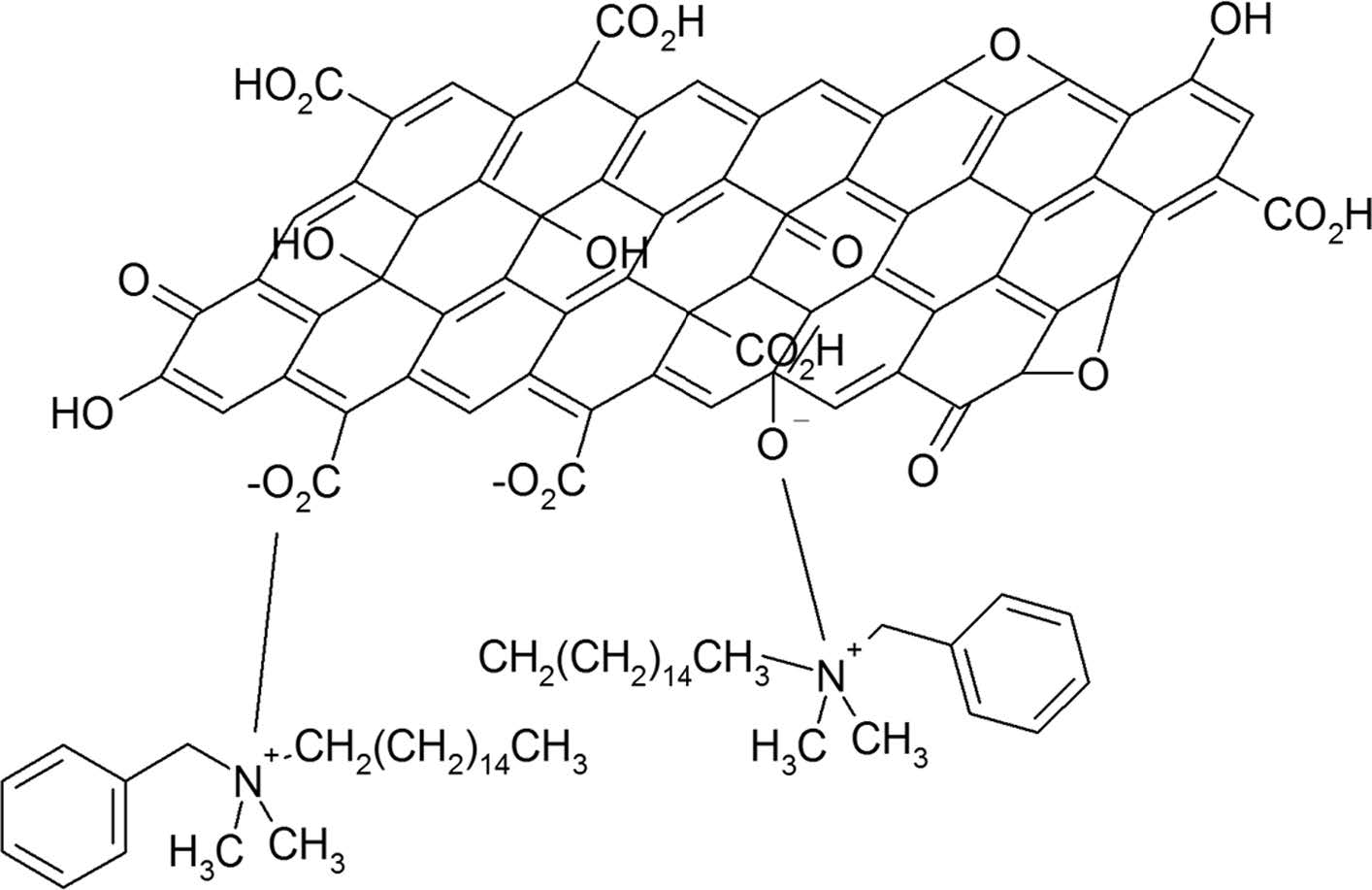
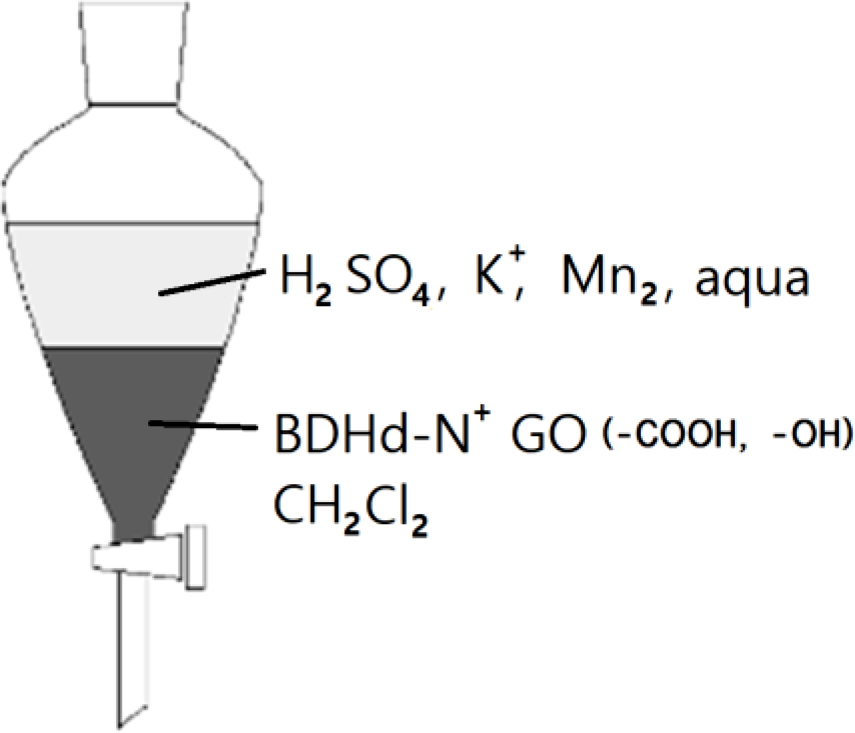
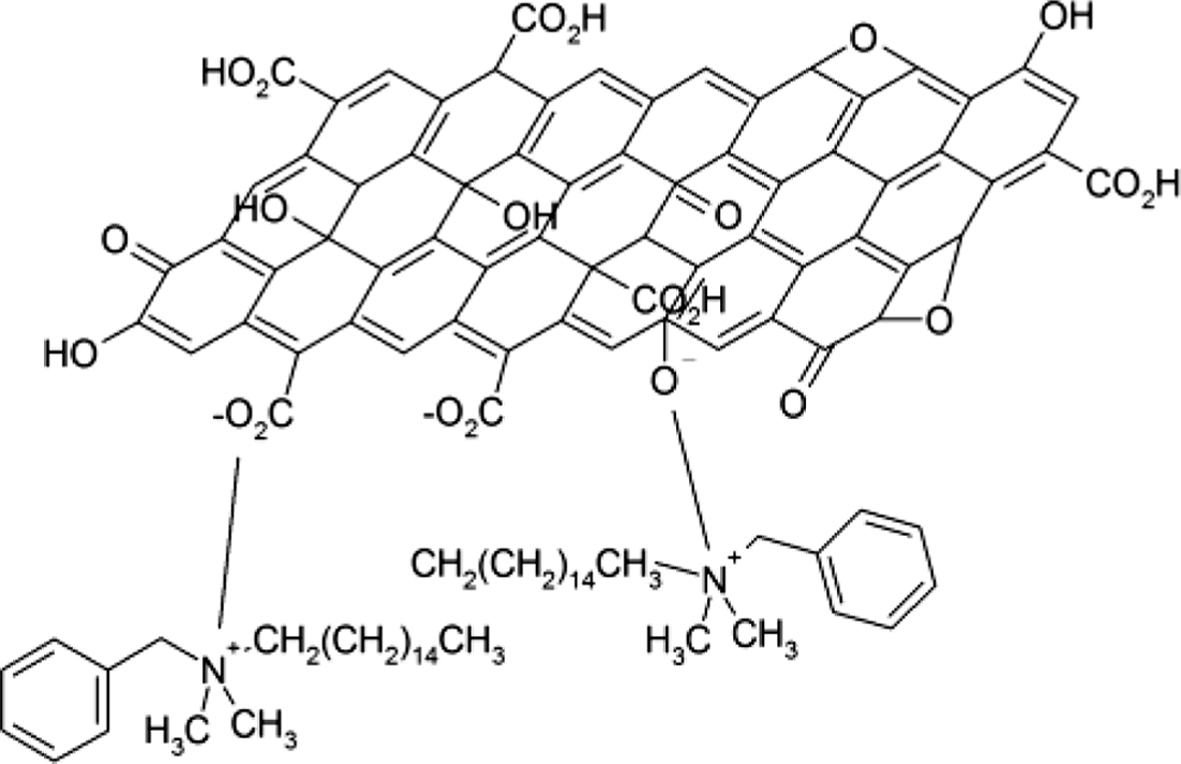
BDHd-N+GO의 제조. 앞서 얻어진 GO 용액(세척 전 단계)에 BDHd-N+Cl-(0.5 g)와 CH2Cl2(methylene chloride)(100 mL)를 혼합한 후 교반하였다. 혼합물을 분액 깔때기에 옮겨 층 분리를 시켰다. 이 상태를 Figure 1에 나타냈다. CH2Cl2의 밀도가 물보다 크기 때문에 기름 층이 하층으로 수상(water phase)이 상층으로 분리되었다. 층 분리는 교반을 멈춘 후 수 분 이내에 이루어졌다. 상층은 투명하고 맑은 색, 하층은 갈색을 나타냈다. GO는 친수성이지만 양이온계면활성제와 결합한 BDHd-N+GO는 모두 기름 층인 하층으로 이동하였다. 하층을 분리한 후 하층이 pH 7이 될 때까지 과량의 증류수와 혼합, 층 분리를 반복하였다. 최종적으로 얻어진 하층을 에탄올로 수회 세척하고 건조하여 BDHd-N+GO을 제조하였다. BDHd-N+GO의 구조는 Figure 2에 나타내었다.
rGO의 제조. BDHd-N+GO 또는 기존의 세척 방법으로 제조된 GO를 석영관에 투입하고 질소를 충분히 흘려주었다. 1000 ℃의 고온 전기로에 석영관을 넣고 1분간 유지하였다. 이때 GO 표면에 산소관능기가 제거되면서 부피가 급격히 팽창하므로 석영관의 가스 배출구를 더 많이 열어 주어야 한다. 고온에서 열에 의하여 관능기들이 제거되면서 환원되어 rGO를 제조하였다.
PS/BDHd-N+GO 복합재료의 제조. 복합재료는 중합법 (polymerization), 용액 혼합법(solvent blending) 및 용융 혼련(melt blending)의 세가지 방법으로 제조하였다. 스티렌에 BDHd-N+GO을 혼합하여 분산시킨 후 90 ℃에서 현탁 중합을 진행하였다. 개시제는 AIBN(스티렌 대비 0.5 phr)을 사용하였고 현탁 안정제는 PVA와 HEC 혼합물(현탁수 대비 PVA 0.005 wt% + HEC 0.6 wt%)을 사용하였다(중합법). PS와 BDHd-N+GO을 각각 THF(tetrahydrofuran)와 메탄올에 분산시킨 후, 두 용액을 교반기에서 혼합하였다. 그 후 혼합물에 과량의 메탄올을 투입하고 침전물을 여과시켜 건조하였다. BDHd-N+GO는 메탄올에 용해되지만 PS와 혼합한 후에는 과량의 메탄올 투입후 메탄올에 용해된 남은 BDHd-N+GO는 거의 없었다(용액 혼합). 이축압출기(BA-11, Bautek사)를 이용하여 220 ℃에서 PS와 BDHd-N+GO 및 rGO를 용융 혼합하였다(용융 혼합).
특성분석. 제조된 GO와 rGO의 구조 분석을 위해 퓨리에 변환 적외선 분광기(Fourier transform infrared spectrometer, FTIR spectrum 1000, Perkin Elmer)와 1H NMR(Bruker Biospin, AVANCE III 400)을 이용하였다. NMR용 분석 용매는 D2O를 사용하였다. PS/GO 복합재료의 분산을 확인하기 위해 X-선 회절분석기(X-ray diffractometer, MiniFlex600, Rigaku)와 레오미터(Rheometer, MCR301, Anton Paar)를 사용하였다. 레오메터는 평판형 레오메터로 oscillatory mode로 strain=10%로 고정하고 온도 180, 200, 220 ℃ 세 온도에서 각 주파수(ω, angular frequency) 0.01~100 rad/s 범위에서 복소 점도(η*, complex viscosity)를 측정하였다. 복합재료의 열분해 특성을 분석하기 위해 열 중량 분석기(thermogravimetry analysis, Q50, TAinstrument)를 사용하였다. 복합재료의 차단 특성을 파악하기 위해서 유기용매의 흡수율을 측정하였다. 직경 25 mm, 두께 1 mm의 시험편을 압축성형으로 제조하여 유기용매에 담근 후 일정 시간 간격으로 꺼내어 흡수된 유기 용매의 양을 측정하였다.
|
Figure 1 Schematic diagram for two separated layers in a separating funnel during the purification procedure. |
|
Figure 2 Chemical structure of graphene oxide (GO) functionalized by benzyl dimethyl hexadecyl ammonium chloride (BDHd-N+Cl−). |
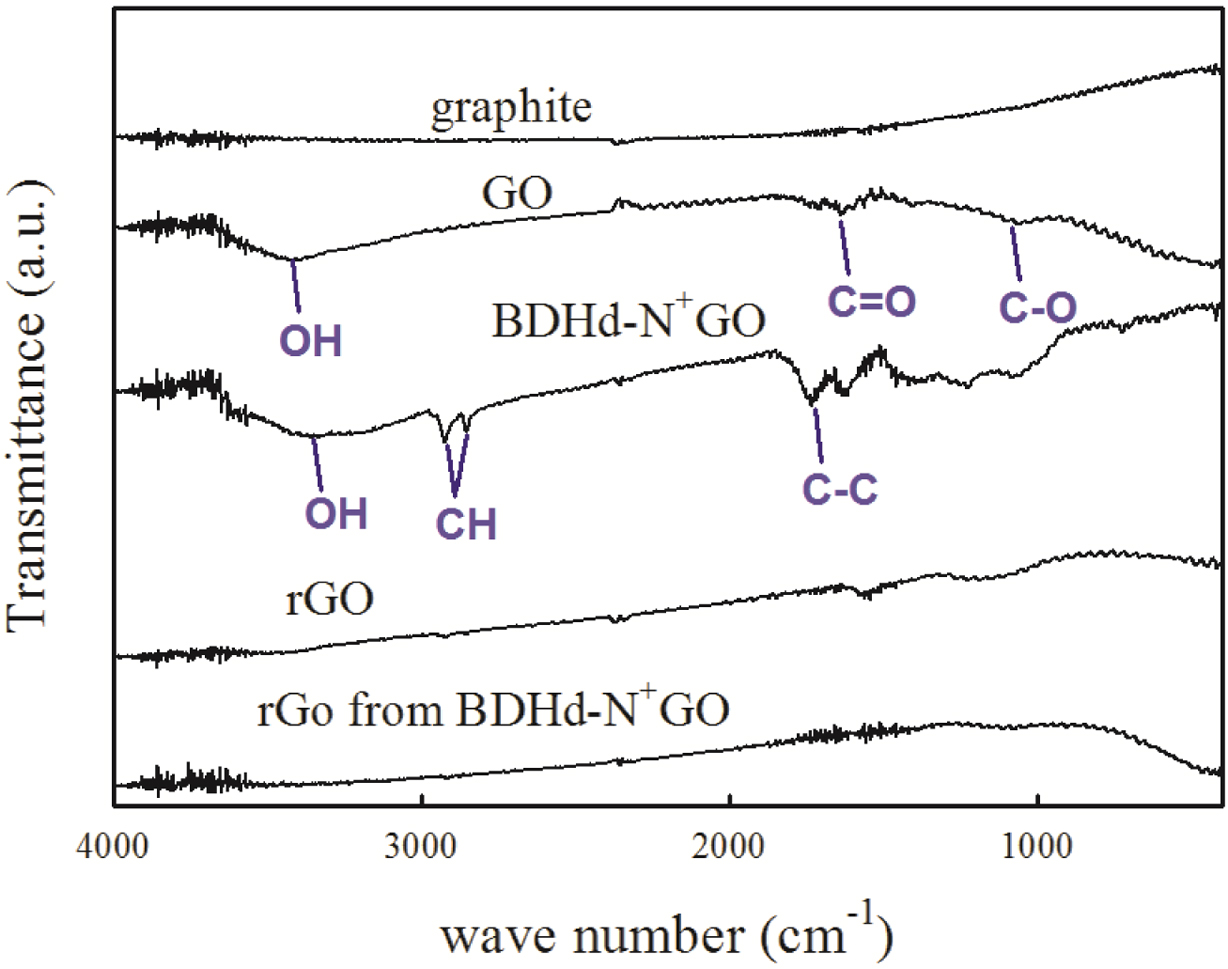
제조된 GO 및 rGO 등의 구조를 파악하기 위하여 FTIR 스펙트럼을 얻었고 Figure 3에 나타냈다. 흑연은 특성 피크가 존재하지 않지만, GO에는 약 3600, 1700, 1300-1000 cm-1에서 각각 -OH, C=O, C-O 피크가 나타나는 것으로 보아 산소 관능기들이 형성되었고 GO가 성공적으로 합성되었다는 것을 알 수 있다. 양이온 계면활성제로 개질한 BDHd-N+GO는 약 3000 cm-1에서 두 개의 피크가 나타나는데 이것은 C-H 피크로서, C-H 결합을 포함한 계면활성제가 관능기로 부여되면서 나타나는 관찰된 결과이다. 이로부터 GO 표면에 양이온 계면활성제가 이온결합으로 존재함을 예측할 수 있다. 환원된 rGO의 경우에는 약간의 산소관능기가 포함되어 있으나 특성피크가 거의 사라지는 것을 볼 수 있다. 하지만, Figure 4에서 볼 수 있듯이 BDHd-N+GO로부터 환원한 rGO의 겉보기 비용적(bulk specific volume)이 GO로부터 환원한 rGO에 비해 적은 것으로 보아 BDHd-N+GO로부터 환원한 rGO는 환원 과정에서 다시 그래핀 층들이 응집하는 것으로 생각된다. 두 시료 모두 같은 열 이력(thermal history)으로 열 환원 (thermal reduction)을 시도하였으나 GO 표면에 붙어있는 관능기의 크기나 종류에 따라 환원 과정에서 매우 다른 거동을 보일 것으로 생각된다. 세밀한 열 이력 조정(tuning)을 통하여 BDHd-N+GO로부터 환원한 rGO의 품질은 개선될 수 있을 것으로 기대한다.
BDHd-N+GO에서 GO와 BDHd-N+의 화학 결합 여부 및 -COOH 관능기의 농도에 관한 정보를 알기 위하여 1H NMR 분석을 수행하였고 Figure 5에 나타냈다. GO는 물이나 중수에 분산이 잘 되는데 이는 GO 표면에 존재하는 친수성 관능기(-COOH, -C=O and etc.) 때문이다. 서론 부분에서도 설명한 바와 같이 GO를 물에 용해시키면 개개의 GO 층이 완벽히 박리되면서 용해되지는 못하고 박막 플레이트(수십~ 수백 층의 GO 시트 집합체) 상으로 존재한다.18 즉 GO가 물에 완벽히 용해되는 것이 아니라 분산이 잘되는 것이다. Solution NMR에서는 시료가 용매에 완벽히 용해되어야 특성 피크들이 관찰된다. 분산된 형태에서는 NMR 상 어떠한 피크들도 관찰되지 않는다. 이런 이유로 D2O solution NMR에서 GO는 어떠한 공명 피크(resonance peak)도 보이지 않는 것으로 생각된다. 고체 NMR에서는 GO 표면의 극성기에 의한 피크를 보일 수도 있겠지만 완벽히 용해되지 않은 상태에서는 아무런 피크도 나타내지 못한다. GO의 4.8 ppm에서의 강한 피크는 D2O로부터 기인한 것이다. 4.18, 3.7, 1.35과 1.2 ppm에서 보이는 작은 피크들은 흑연으로부터 GO를 합성할 때 생긴 소량의 불순물로부터 기인한 것이라 생각된다. BDHd-N+Cl-은 몇몇 피크들을 보였는데 각각의 피크들은 Figure 5의 화학식에 표기된 위치의 수소에 기인한 것들이다. BDHd-N+GO에는 BDHd-N+Cl- 에 나타나는 피크들이 전혀 나타내지 않았는데, 이는 BDHd-N+GO를 합성하는 과정에서 미반응되거나 GO에 결합하지 않은 BDHd-N+Cl- 들이 전부 세척되어 완벽하게 제거되었다는 것을 의미한다. BDHd-N+GO과 BDHd-N+Cl-을 반씩 단순 혼합하여 D2O에 녹였을 때도 BDHd-N+Cl-에 나타나는 피크들이 전혀 나타내지 않았다. 이는 BDHd-N+GO과 BDHd-N+Cl-를 중수에 녹이는 과정에서 모든 BDHd-N+Cl-가 GO에 결합되었다는 것을 의미한다. BDHd-N+GO의 제조과정에서 1 g의 GO와 0.5 g의 BDHd-N+Cl-를 혼합하였다. BDHd-N+GO과 BDHd-N+Cl-를 반반씩 단순 혼합한 NMR 시료에서는 GO: BDHd-N+Cl- 비가 1:3이므로 GO에 아주 많은 카복실(-COOH) 기가 있음을 알 수 있다. 그리고 BDHd-N+GO의 제조과정에 투입한 모든 BDHd-N+Cl-가 GO와 결합했다는 것을 짐작할 수 있다. FTIR과 1H NMR 분석을 통하여 투입한 모든 BDHd-N+Cl-가 GO와 결합하여 BDHd-N+GO를 형성하였음을 알 수 있었고 이로 인하여 친수성인 GO가 친유성인 BDHd-N+GO로 바뀌어 황산 제거 과정을 단순화할 수 있었다. 산화 그래핀 제조과정에서 생긴 GO/H2SO4 혼합물에서 H2SO4을 제거하기 위해서는 수 차례의 반복적인 미세 필터링이나 원심 분리가 필요하고 많은 양의 폐수가 발생한다. 실험실에서 1 g의 GO를 얻는데 황산 제거에만 10일 이상이 소요되었다. 반면, GO/H2O/H2SO4 에 BDHd-N+Cl-과 친유성 용매를 혼합하면 GO가 친유성인 BDHd-N+GO로 바뀌어 H2O/H2SO4과 BDHd-N+GO/친유성 용매 두 층으로 분리되어 쉽게 H2SO4를 제거할 수 있었다.
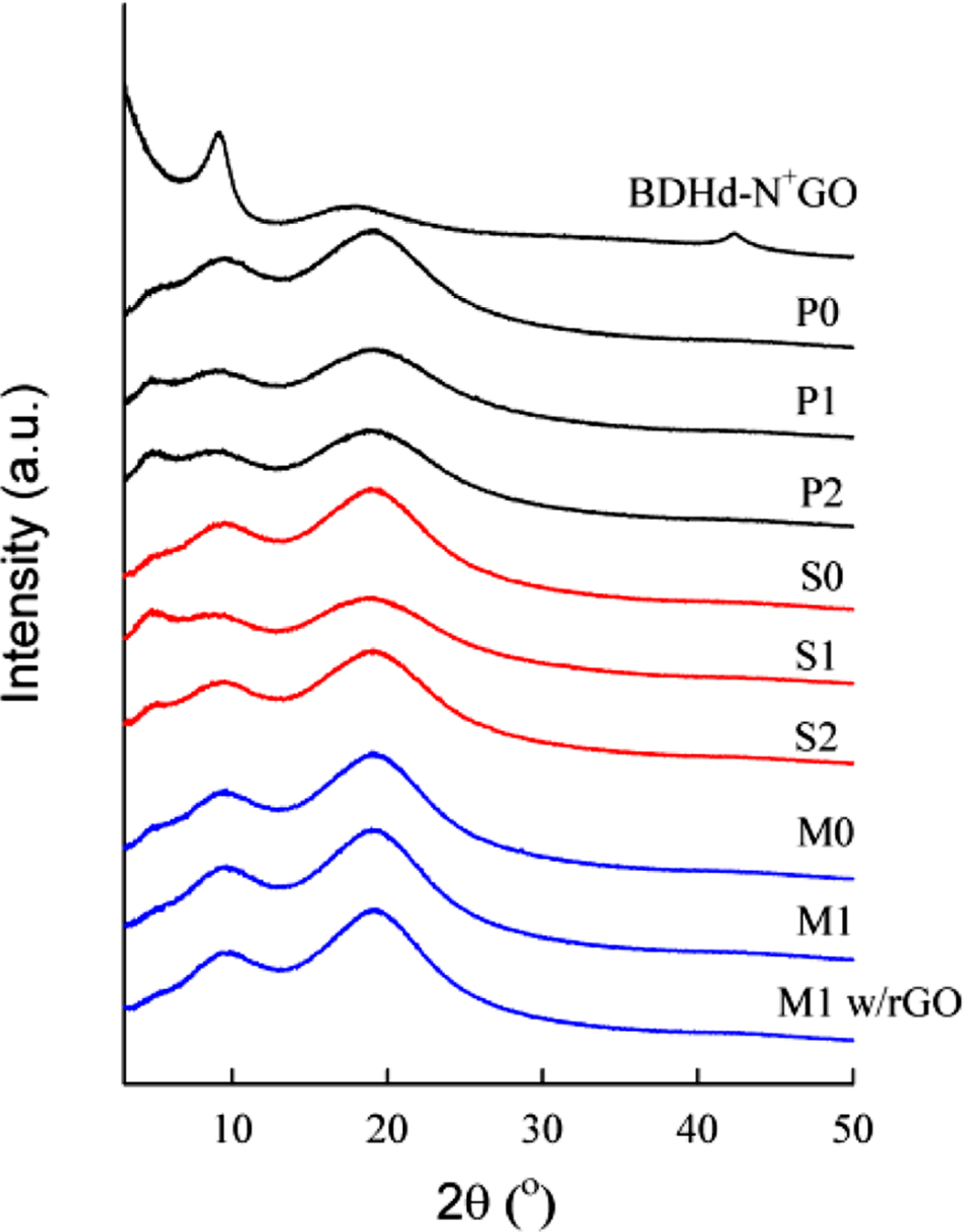
세가지 방법으로 제조한 PS/BDHd-N+GO 복합재료의 XRD 결과를 Figure 6에 나타냈다. BDHd-N+GO는 약 9o(0.982 nm), 18o(0.492 nm) 및 42o(0.215 nm)에서 피크를 나타냈다. 순수한 PS(Figure 6에서 P0, S0, M0)는 약 9o와 20o(0.444 nm)에서 비결정의 넓게 분포된 피크가 나타나며, 중합(P1, P2)과 용액 혼합 방법(S1, S2)으로 제조한 시료에서는 5o(1.766 nm)에서 새로운 피크를 볼 수 있다. 이는 PS 고분자 사슬이 BDHd-N+GO 층간에 삽입하면서 층간 거리가 증가하게 되어 새로 나타나는 피크로 생각된다.19,20 하지만, 용융 혼련 (M1, M1 w/rGO)으로 제조한 시료에는 새로운 피크가 나타나지 않는 것으로 보아 중합법과 용액 혼합법에 비해 BDHd-N+GO 입자의 분산이 덜 이루어진 것으로 생각된다.
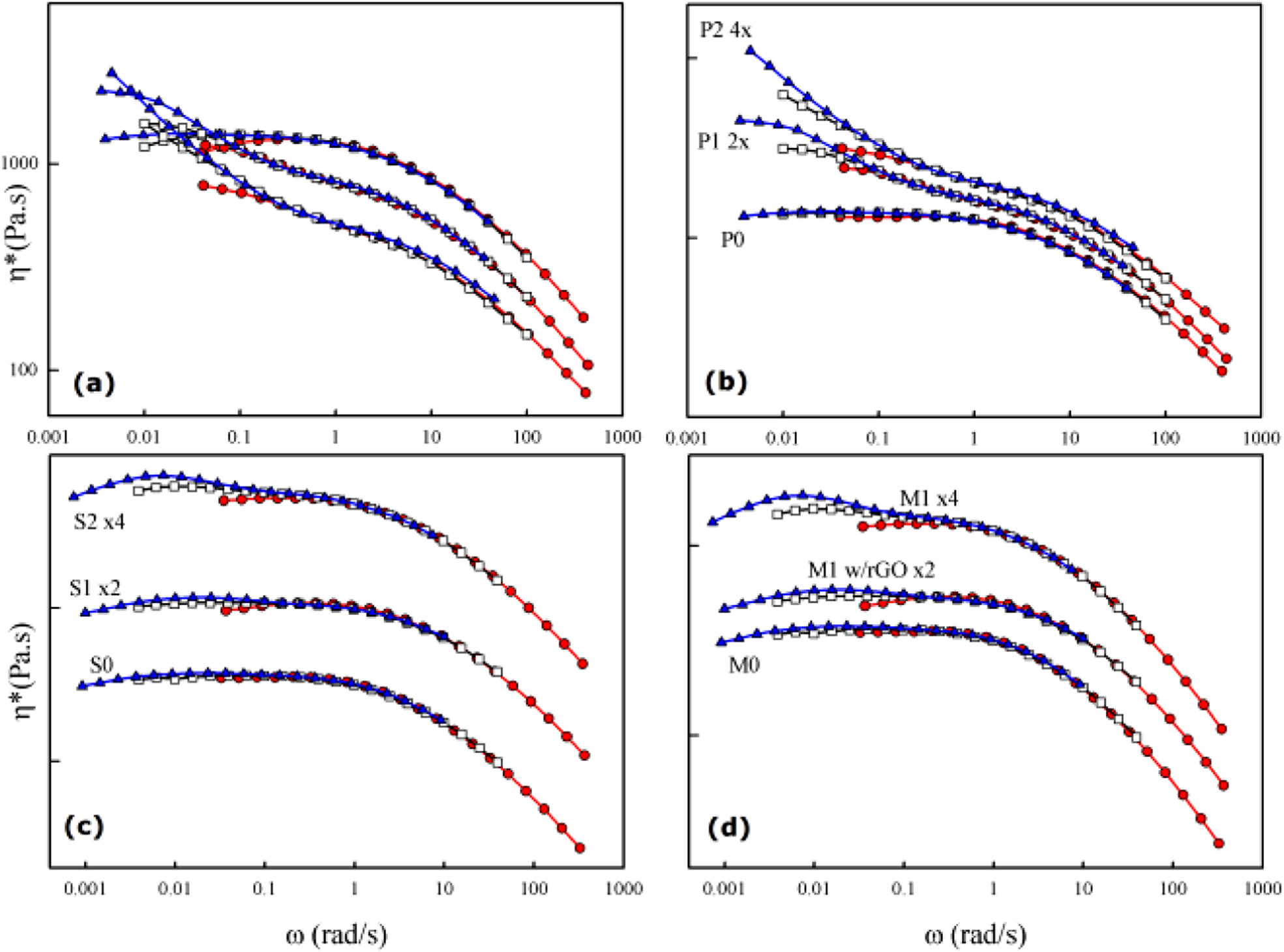
복합재료의 유변학적 특성을 관찰하면 충진제의 분산에 관한 자세한 정보를 얻을 수 있다. Figure 7에 PS/BDHd-N+GO 나노복합재료의 복소 점도(η*, complex viscosity)를 각 주파수(ω, angular frequency)의 함수로 나타냈다. 낮은 주파수 영역에서의 유변 거동이 재료의 구조에 민감하게 반응한다. BDHd-N+GO가 첨가되지 않은 순수한 PS(P0, S0, M0)는 낮은 ω에서 점도가 일정한 값을 보이는 뉴톤성 거동을 보인다. Figure 7에 나타낸 데이터는 서로 다른 세 온도에서 측정한 데이터를 시간-온도 중첩 원리(time-temperature superpo-sition principle)에 의하여 한 온도로 이동하여 그린 그림으로 순수한 PS는 세 온도에서 측정한 데이터가 한 그래프에 잘 겹쳐지는 것을 볼 수 있다. BDHd-N+GO를 첨가한 복합재료에서는 낮은 ω에서 약한 yield 현상(ω가 낮아질수록 η*가 증가함.)을 볼 수 있다. 중합으로 제조한 시료에서는 BDHd-N+GO 함량이 증가할수록 높은 ω에서 η*가 감소했는데 이는 분자량의 감소 때문이다. 동일한 조건에서 중합을 해도 GO-BDHd-N+가 있는 경우 분자량이 낮아졌는데 이는 BDHd-N+GO가 스티렌과 작용하여 중합 시 라디칼 형성을 방해하기 때문으로 추정된다. 하지만, 낮은 ω에서는 BDHd-N+GO의 첨가에 따라 η*가 급격히 증가하는 yield 현상이 보이고 함량이 2 wt%에서는 뚜렷하게 yield 현상을 볼 수 있다. 이는 고체 입자가 잘 분산된 복합재료에서는 전형적으로 볼 수 있는 현상으로 고체 입자와 매트릭스 고분자의 상호 작용이 강할수록 yield 현상은 더 뚜렷하게 관찰된다.21,22 용액 혼합으로 제조한 시료(S0, S1 및 S2)에서도 BDHd-N+GO의 투입에 따라 yield 현상이 관찰되었으나, 중합으로 제조한 시료에 비해서는 그 정도가 미미했다. 이축 압출기에서 용융 혼합한 시료(M0, M1, M1w/rGO)에서는 M1에서 미세한 yield가 관찰되나 M1w/rGO은 M0와 동일한 결과를 보여준다. 이상의 결과로부터 중합법, 용액 혼합, 용융 혼련법 순으로 나노 입자의 분산이 용이하다는 것과 BDHd-N+GO가 rGO보다 PS와의 친화도가 높다는 것을 알 수 있었다.
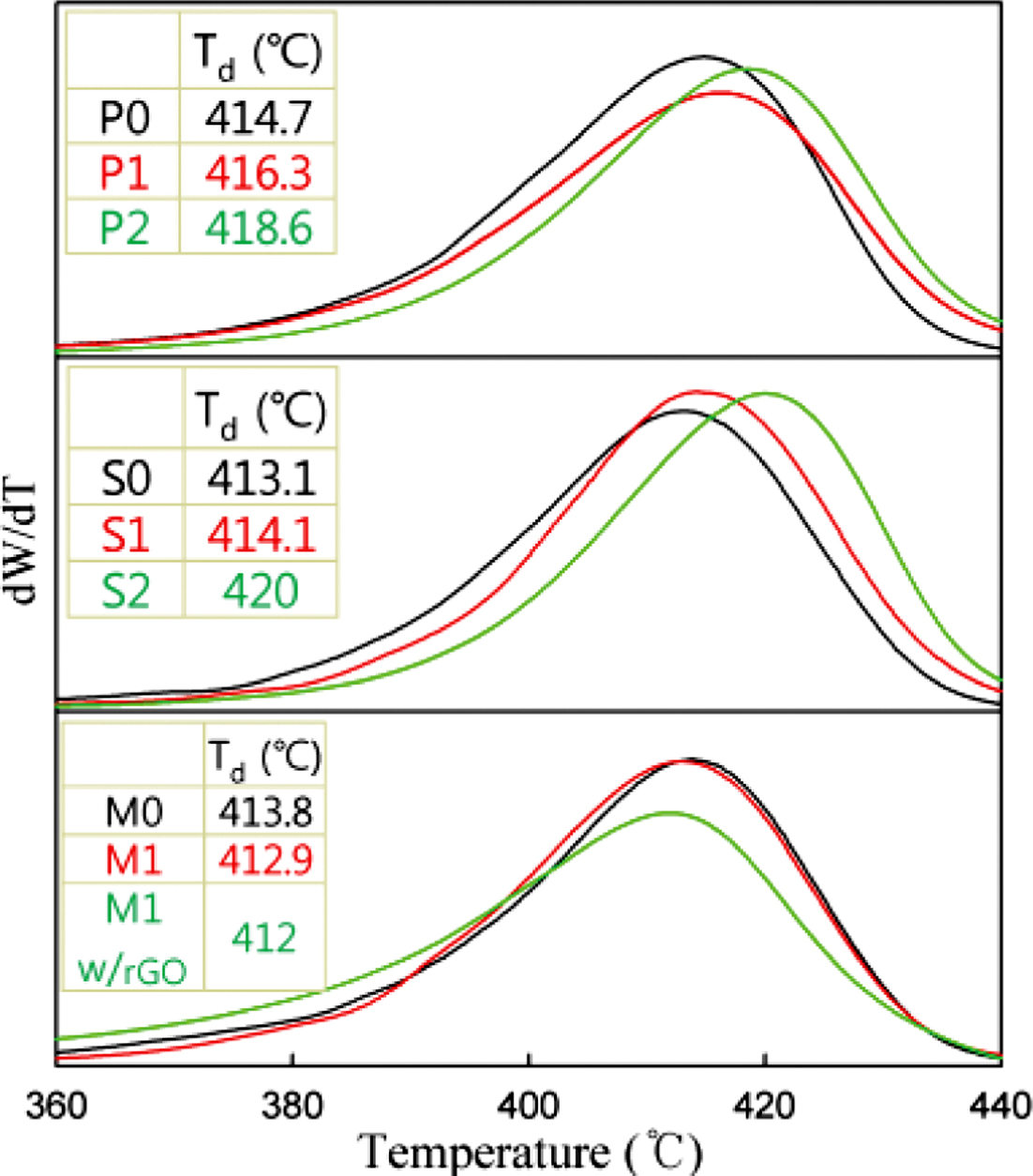
PS/BDHd-N+GO 복합재료의 분해 거동을 관찰하기 위해 열중량 분석을 실시하였고 미분 열분석(differential thermal analysis) 결과를 Figure 8에 나타냈다. 중합법과 용액 혼합법으로 제조된 복합재료의 피크 분해 온도(peak decomposition temperature, Td, 분해 속도가 최고인 온도)는 BDHd-N+GO의 함량이 증가할수록 높아지는 것으로 관찰되었다. BDHd-N+GO와 PS의 결합력이 우수하여 분해를 늦춰주는 것으로 생각된다. 하지만, 용융 혼련으로 제조된 복합재료의 경우엔 Td의 변화가 거의 없거나(M1) 약간 감소하였다(M1 w/GO). MB1w/rGO는 XRD와 유변 특성 관찰에서 볼 수 있었듯이 BDHd-N+GO의 분산이 거의 이루어지지 않았음을 알 수 있었다.
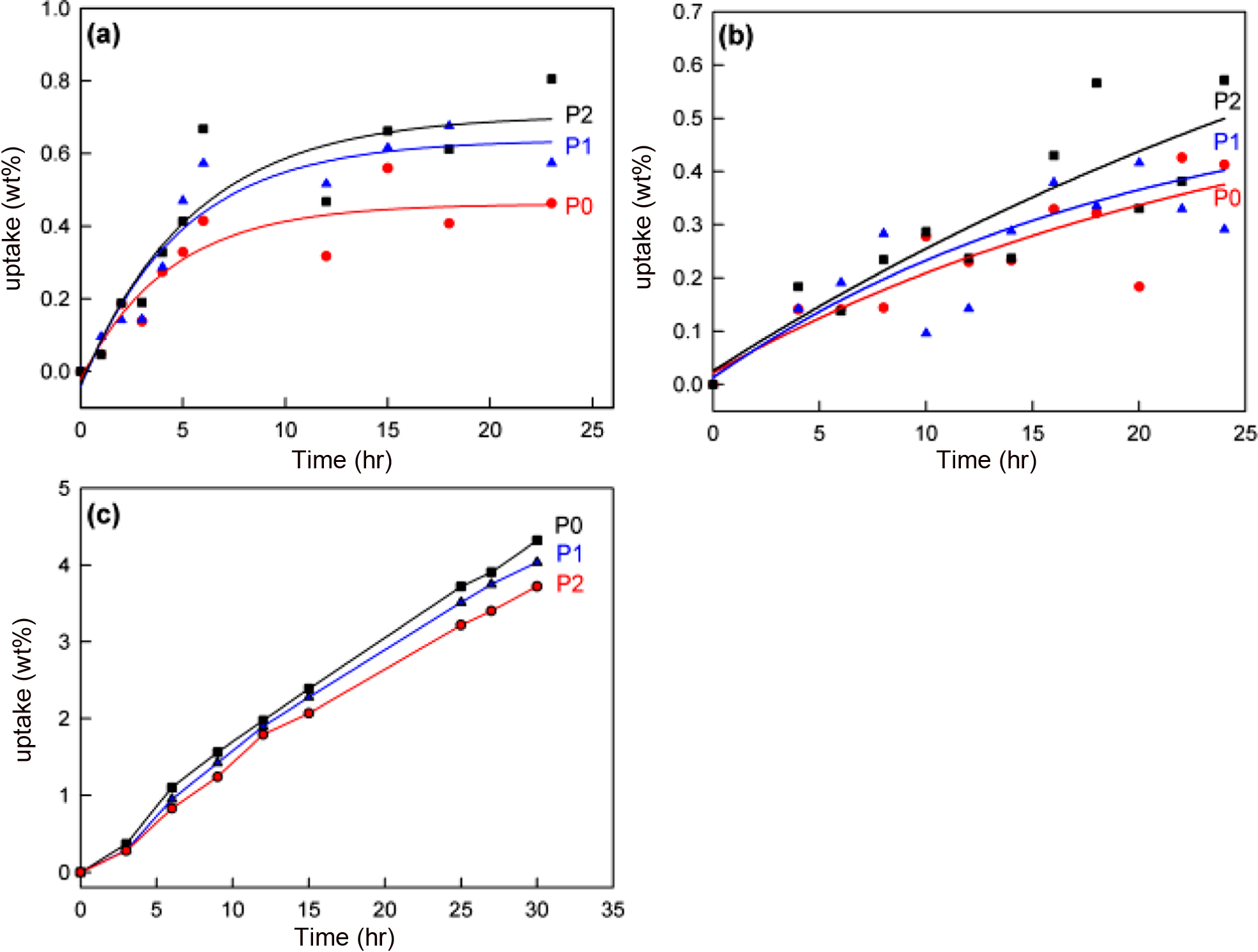
제조된 복합재료의 차단 특성을 평가하기 위하여 몇몇 유기 용매에 대한 흡수율을 Figure 9에 나타냈다. 시간에 따라 흡수율을 측정한 결과 극성인 용매에서는 BDHd-N+GO의 함량이 증가할수록 흡수율이 증가하는 것으로 나타났다. 이는 BDHd-N+GO의 표면에 BDHd-N+Cl-과 결합하지 않고 남은 -COOH, -OH, -C=O 때문인 것으로 추정된다. 그러나 헥산과 같은 비극성 용매에 대해서는 BDHd-N+GO의 존재가 차단 (barrier) 특성을 개선시켜 준다는 것을 Figure 9(c)에서 확인할 수 있다. BDHd-N+GO 제조 시 충분한 양의 BDHd-N+Cl-를 투입하여 GO 표면의 -COOH를 BDHd-N+로 결합시킨다면 극성 용매에서도 차단 특성을 개선시킬 수 있을 것으로 예상된다.
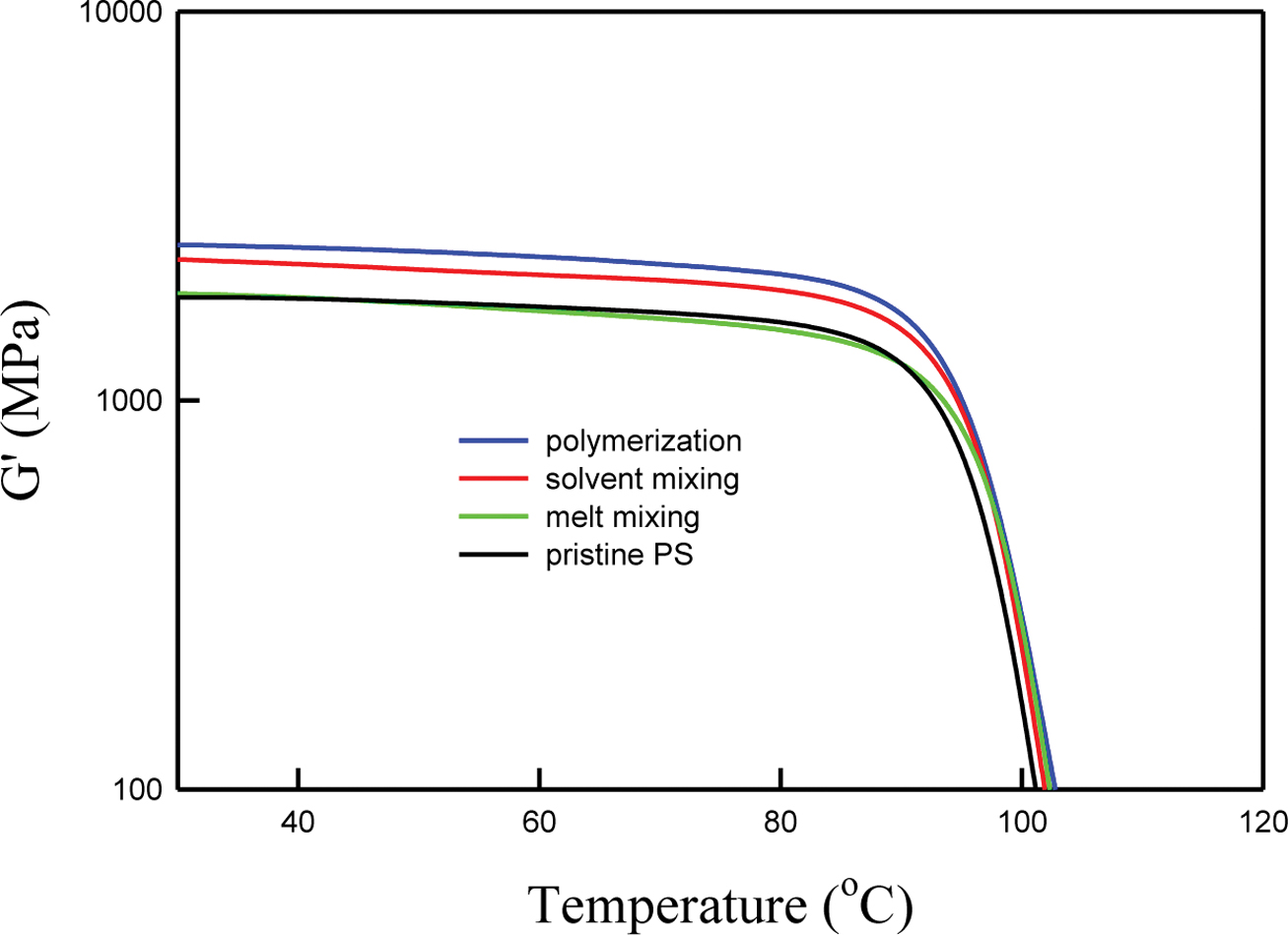
PS/BDHd-N+GO 복합재료에서 나노입자의 분산 정도를 공학적인 관점에서 고찰하기 위하여 동적 기계 분석(DMA, dynamic mechanical analysis)을 수행하였고 온도에 따른 저장 탄성률(storage modulus, G')을 Figure 10에 나타냈다. Tg 이하에서 G'가 거의 변하지 않다가 Tg 부근에서 온도 증가에 따라 G'가 급격히 감소하는 전형적인 거동을 관찰할 수 있다. 고분자 복합재료의 G'는 고체 입자의 첨가에 따라 상승하는 경우가 일반적이다. 이 연구에서도 BDHd-N+GO의 첨가에 따라 복합재료의 G'는 상승하였다. 그 상승 정도는 혼련 방법에 따라 달랐다. 용융 혼합으로 제조한 복합재료는 순수한 PS와 유사한 G'를 나타낸 반면 용액 혼합법으로 제조한 복합재료는 그보다 약간 높은 G'를 나타냈고 중합법으로 제조한 복합재료는 가장 높은 G'을 나타냈다. 이는 용융 혼합법, 용액 혼합법, 중합법 순으로 분산도가 높아서 나타난 결과로 유변물성 측정에서 평가한 것과 동일한 순서로 분산도가 증가하는 것으로 나타났다.
|
Figure 3 FTIR spectra of graphite powder, GO, BDHd-N+GO, rGO and rGO from BDHd-N+GO. |

|
Figure 4 Thermally reduced GO: from GO (left, bulk density = 0.012 g/cm3) and from BDHd-N+GO (right, bulk density = 0.034 g/cm3). |

|
Figure 5 1H NMR spectra of GO, cationic surfactant (BDHd-ammonium chloride whose chemical structure is shown in the inserted figure), BDHd-N+GO and simple mixture of the surfactant/BDHd-N+GO. |
|
Figure 6 XPS spectra of BDHd-N+GO and PS/BDHd-N+GO nano composites. Notations P, S, M in the figure represent polymerization, solvent mixing and melt mixing, respectively. Number followed |
|
Figure 7 η* of PS/BDHd-N+GO nanocomposites as a function of ω. Notations are same with those of Figrue 6. (a) polymerization; (b) polymerization, P1 and P2 are shifted vertically (multiplied by 2 and 4 respectively) to increase the visibility; (c) solvent mixing, C1 and C2 are shifted vertically; (d) melt mixing, M1 and M1 w/rGO are shifted vertically. |
|
Figure 8 Differential thermal analysis (DTA) of PS/BDHd-N+GO nanocomposites. |
|
Figure 9 Solvent uptake experiment for PS/BDHd-N+GO composite: (a) methanol; (b) ethanol; (c) n-hexane. |
|
Figure 10 DMA results for pristine PS and PS/BDHd-N+GO(99/1) nanocomposites. |
GO를 세척할 때 소요되는 시간 및 폐수의 양을 줄이고자 양이온 계면활성제인 BDHd-N+Cl-와 유기 용매 CH2Cl2를 황산/물/GO 혼합물에 투여하였다. BDHd-N+Cl-와 GO가 즉각적으로 반응하여 BDHd-N+GO를 형성함을 FTIR과 NMR을 통하여 확인하였다. 형성된 BDHd-N+GO는 친유성을 띠게 되어 황산 + 물 + KMnO4 상과 BDHd-N+GO + CH2Cl2 두 상으로 층 분리되었다. BDHd-N+GO + CH2Cl2 상에서 건조를 통하여 분리한 BDHd-N+GO는 열 환원을 통하여 rGO로 제조되었다.
양이온 계면활성제 BDHd-N+Cl-를 이용하여 GO를 처리하면 기존의 원심분리 방법에 비해 소요시간과 폐수의 양을 현저히 줄여 높은 효율성을 나타내었고 산업적으로 이용한다면 rGO의 생산단가를 크게 줄일 수 있을 것으로 기대된다.
또한 표면에 부여된 관능기에 의해 유기 용매와 고분자에 높은 분산성을 가져 고분자 나노복합재료로 사용하기에 적합하였다. 제조된 BDHd-N+GO을 고분자와 중합으로 블렌딩하여 제조했을 때 비극성 용매에 낮은 흡수율을 보여주어 차단 특성이 향상되었다.
- 1. A. B. Kuzmenko, E. V. Heumen, F. Carbone, and D. V. D Marel, Phys. Rev. Lett., 100, 117401 (2008).
-

- 2. Y. Zhang, J. W. Tan, K. L. Stormer, and P. Kim, Nature, 438, 201 (2005).
-

- 3.
M. D. Stoller, S. Park, Y. Zhu, J. An, and R. S. Ruoff, Nano Lett., 8, 3498 (2008). -

- 4. T. T. Baby and S. Ramaprabhu, J. Appl. Phys., 108, 124308 (2010).
-

- 5. K. S. Novoselov, D. Jiang, F. Schedin, T. J. Booth, V. V. Khotkevich, S. V. Morozov, and A. K. Geim, Proc. Natl Acad. Sci., 102, 10451 (2005).
-

- 6. K. S. Novoselov, A. K Geim, S. V. Morozov, D. Jiang, M. I. Katsnelson, I. V. Grigorieva, S. V. Dubonos, and A. A. Firsov, Nature, 438, 197 (2005).
-

- 7. A. K. Geim and K. S. Novoselov, Nature Mater., 6, 183 (2007).
-

- 8. C. Lee, X. Wei, J. W. Kysar, and J. Hone, Science, 321, 385 (2008).
-

- 9. G. Mittal, V. Dhand, K. Y. Rhee, S.-J. Park, and W. R. Lee, J. Ind. Eng. Chem., 21, 11 (2015).
-

- 10. H. Kim, A. A. Abdala, and C. W. Macosko, Macromolecules, 43, 6515 (2010).
-

- 11. J. Cho, L. Gao, J. Tian, H. Cao, W. Wu, Q. Yu, E. N. Yitamben, B. Fisher, J. R. Guest, Y. P. Chen, and N. P. Guisinger, ACS Nano, 5, 3607 (2011).
-

- 12. X. Li, W. Cai, J. An, S. Kim, J. Nah, D. Yang, R. Piner, A. Valemakanni, I. Jung, E. Tutuc, S. K. Banerjee, L. Colombo, and R. S. Ruoff, Science, 324, 1312 (2009).
-

- 13. Y. Pan, H. G. Zhang, D. X. Shi, J. T. Sun, S. X. Du, F. Liu, and H. J. Gao, Adv. Mater., 21, 2777 (2009).
-

- 14. P. W. Sutter, J.-I. Flege, and E. A. Sutter, Nature Mater., 7, 406 (2008).
-

- 15. K. S. Novoselov, A. K. Geim, S. V. Morozov, D. Jiang, Y. Zhang, S. V. Dubonos, I. V. Grigorieva, and A. A. Firsov, Science, 306, 666 (2004).
-

- 16. W. Hummers and R. Offeman, J. Am. Chem. Soc., 80, 1339 (1958).
-

- 17. T. Kuila, S. Bose, A. K. Mishra, P. Khanra, N. H. Kim, and J. H. Lee, Prog Mater. Sci., 57, 1061 (2012).
-

- 18. A. M. Dimiev, L. B. Alemany, and J. M. Tour, ACS Nano, 7, 576 (2013).
-

- 19. T. N. Blanton and D. Majumdar, Powder Diffract., 27, 104 (2012).
-

- 20. T. Szabó, A. Szeri, and I. Dékány, Carbon, 43, 87 (2005).
-

- 21. A. B. Metzner, J. Rheol., 29, 739 (1985).
-

- 22. S. H. Jin, Y.-B. Park, and K. H. Yoon, Compos. Sci. Tech., 67, 3434 (2007).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(4): 519-526
Published online Jul 25, 2019
- 10.7317/pk.2019.43.4.519
- Received on Dec 19, 2018
- Revised on Apr 4, 2019
- Accepted on May 9, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Younggon Son
-
Advanced Materials Science and Engineering, College of Engineering, Kongju National University, Cheonan, Chungnam 331717, Korea
- E-mail: sonyg@kongju.ac.kr
- ORCID:
0000-0003-1601-7280









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.