- Evaluation of Lansoprazole Enteric Hard Capsule Encapsulated by Sodium Alginic Acid
Jong Seon Baek, Jin Su Kim, Won Kyung Kim, David Kim, Jeong Eun Song, and Gilson Khang†

ept. of BIN Convergence Tech & Dept. of PolymerNanoSci Tech, Chonbuk National University,
567 Baekje-daero, Jeonju 54896, Korea- 알긴산 나트륨에 포접된 란소프라졸 장용성 경질캡슐의 특성분석
전북대학교 BIN융합공학과, 고분자나노공학과, 고분자융합소재연구소
An effective drug treatment for peptic ulcer and reflux esophagitis is the proton pump inhibitor (PPI) such as lansoprazole. However when the lansoprazole is exposed to low pH, its dissolution rate becomes low and thus re-precipitation occurs. Therefore an enteric solute capsule was prepared using sodium alginate and wet granulation process. This formulation aimed to inhibit release in acidic conditions of stomach fluid and to cause rapid drug release under conditions of intense, neutral or weakly alkaline conditions. DSC, XRD, FTIR, and SEM were performed to characterize the manufactured hard capsules. In order to confirm that the formulation was properly designed, the dissolution rate was confirmed through in vitro dissolution behavior. Based on these results, it can be confirmed that lansoprazole enteric capsules containing sodium alginate can be used as a treatment for peptic ulcer and reflux esophagitis.
소화성 궤양 및 역류성 식도염을 치료하는 효과적인 약물 치료제로는 양성자펌프 억제제(proton pump inhibitor, PPI)가 있다. 란소프라졸은 PPI계열 약물로 복용 후 낮은 pH에 노출되면 용출률이 저해되어 재석출이 일어난다. 따라서 본 연구에서는 란소프라졸의 약물방출을 제어하기 위하여, 알긴산 나트륨과 습식과립 공정을 이용한 장용성 용질캡슐을 제조하였다. 이 제형은 위액의 산성조건에서 방출이 억제되고, 장액의 중성이나 약 알칼리 조건에서 급속한 약물방출이 일어나는 것을 목표로 하였다. 제조된 경질캡슐의 특성분석을 위해 DSC, XRD, FTIR, SEM을 실행하였다. 이 후 제형이 제대로 설계되었는지 확인하기 위하여 생체 외 용출거동을 통해 변화된 용출률을 확인하였다. 이러한 결과를 토대로 알긴산나트륨이 포접된 란소프라졸 장용성 캡슐은 소화성 궤양 및 역류성 식도염 치료제로 사용 가능함을 확인할 수 있다.
Keywords: lansoprazole, sodium alginic acid, enteric hard capsule, wet granules
이 논문은 과학기술정통부의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(2017R1A2B 3010270)과 과학기술국제화사업(2017K1A3A7A03089427)의 지원을 받아 수행된 연구입니다.
소화성 궤양이란 소화관 점막의 일부에 손상으로 인하여 궤양이 발생하는 질환으로 위궤양, 십이지장궤양을 말한다. 이는 소화관의 공격인자 위산 외 방어인자 점막 사이의 균형이 깨질 때 발생하는 것으로, 주요 원인은 감염과 비스테로이드 이성 소염제인 것으로 널리 알려져 있다.1,2 역류성 식도염이란 위 내용물의 역류로 인한 속쓰림과 복부 통증 등의 증상이 나타나는 점막의 변화를 가져오는 질환이다. 산에 노출되는 시간이 길수록 심한 병변을 보이며 만성적인 질환이 되기도 한다.3,4
소화성궤양 및 역류성 식도염을 치료하기 위한 의약품으로 제산제(antacids), 항콜린제(anticholinergics) 및 히스타민수용체 길항제(histamin-2 receptor antagonists)가 있다. 또한 위산분비 자극이 벽세포로 전달 시 양성자 펌프의 활성화를 방해하여 위산분비를 억제하는 치료제인 양성자 펌프 억제제 (proton pump inhibitor, PPI)와5 칼륨 경쟁적 위산분비 억제제(potassium ion-competitive acid blocker)들이6 개발되고 있다.
양성자 펌프 억제제 계열의 전구 약물인 란소프라졸은 위벽세포 소관의 산성환경 하에서 활성형 설펜아미드 대사물인 AG-1812와 AG-2000으로 대사되어 약리작용을 나타낸다.7 이 대사물은 H+/K+ exchanging ATPase 분자의 설프히드릴기(sulfhydryl group)와 결합하여 양성자 펌프를 불활성화시킴으로 세포내 칼륨과 수소의 교환을 막는다.8 이때 설펜아미드 대사물이 H+/K+ exchanging ATPase와 비가역적으로 공유결합을 형성하기 때문에 위산분비는 다시 효소가 합성되어질 때까지 억제되므로 작용시간이 24시간 이상으로 길다. 이러한 특성을 가지는 란소프라졸은 그 치료효과가 우수함에도 불구하고 약물이 산성에 매우 민감해서 분해되기도 하고 낮은 용해도로 인해 재석출되는 문제 때문에 단일 약물의 제품화에는 많은 어려움이 있다.9 이러한 문제점을 개선하기 위해 methacrylic acid copolymer dispersion을 이용해 장용성 코팅을 하는 방법,10 methylcellulose와 키토산을 전달체로 이용해 floating micropellet으로 만드는 방법11 등이 사용되고 있다. 본 연구에서는 pH가 낮은 환경에서 물에 녹지않고 약 알칼리성에 잘 녹는 알긴산 나트륨을 란소프라졸과 습식과립으로 제조하여 경질캡슐로 충전하고 효율성을 개선하고자 한다.
시약 및 재료. 란소프라졸(Tokyo Chemical Industry, 일본), 알긴산 나트륨(Sigma-Aldrich, 영국)을 사용하였으며, 붕해제인 미결정셀룰로오스(microcrystalline cellulose, MCC), 전분글리콜산나트륨(sodium starch glycolate, SSG), 저치환도 히드록시메틸셀룰로오스(low substituted hydroxymethyl-cellulose, L-HPC)는 JRS pharma(일본)에서 구매하였으며, 결합제로 사용된 PVP K30은 Showa(일본)에서 구매하였다. 그 외 사용한 모든 시약은 HPLC 등급을 사용하였다.
란소프라졸 경질캡슐의 제조. 원료 의약품인 란소프라졸과 약물 포접에 사용할 알긴산 나트륨을 Table 1과 같은 비율에 따라 첨가하고, 붕해제로 MCC, SSG, L-HPC을 넣고, 결합제로 PVP K30을 첨가하여 균일하게 섞었다. 한 batch당 5배수를 제조하였고, 섞은 혼합물을 10% 에탄올수용액 50 μL를 10번 첨가하여 습식과립하였다. 이 후 600 μm 매쉬를 이용해 과립물을 걸러 오븐에 건조시켰다. 각 배치 총량에 맞게 경질캡슐에 과립물을 충전하여 용출시험에 사용하였다(Table 1). 제조된 모든 과립물들은 사용하기 전까지 데시게이터 안에 보관하였다.
과립물의 구조학적 특성분석. 란소프라졸 및 알긴산 나트륨 그리고 각 제조된 과립물들의 분자구조를 분석하고 새로운 화학 결합이 생성되었는지 확인하기 위해 FTIR(GX, Perkin Elmer, Waltham, Massachusetts, USA)을 이용해 분석하였다. ATR법으로 측정하였으며 측정 범위는 4000~400 cm-1에서 이루어졌다.
과립물의 열적 특성분석. 란소프라졸과 포접에 사용된 알긴산 나트륨의 열전이를 측정하고 과립물들의 포접이 정상적으로 이루어졌는지 확인하기 위하여 DSC(TA5000/DSC2950, TA Instrument, USA)를 이용하였다. 각 물질의 5~10 mg을 이용해 샘플을 제조하였고, 30 oC/min의 승온속도로 -10~300 oC까지 온도를 상승시키며 측정하였다.
과립물의 결정학적 특성분석. 과립물들의 포접이 정상적으로 이루어졌는지 확인하기 위하여 PXRD(MAX 2500 X-ray diffractometer, 일본)로 결정성을 분석하였다. X선 회절은 0.3 mm의 투명한 유리 기판에 일정량의 시료를 충분히 적층시켜 배향이 발생하지 않도록 하였으며, 30 mA, 40 kV 조건으로 측정하였다.
과립물의 형태학적 특성분석. 원약물과 알긴산 나트륨 그리고 과립물들의 입자상태 및 표면을 관찰하기 위해서 주사전자현미경(Bio LV-SEM, S-3000N, Hitachi Co, 일본)을 사용하여 분석하였다. SEM 관찰을 위해 시료를 탄소테이프 위에 샘플을 고정시키고 아르곤가스 하에서 백금-팔라듐 코팅을 180초 동안 실시하였다. 코팅된 시료는 15.0 kV에서 관찰하였다.
HPLC 조건. 란소프라졸 경질캡슐제제의 약물방출거동을 측정하기 위한 HPLC분석기는 NS-4000 HPLC 시스템 (Futecs, 한국)과 NS-6000 오토샘플러(Futecs, 한국)를 사용하여 분석하였다. 컬럼은 Intersil® OSD-3 C18(4.6×150 mm, 5 μm, GL Science Inc)을 사용하였으며, 유속은 1.0 mL/min, 시료주입량은 100 μL로 설정하여 분석하였다. UV 파장은 260 nm에서 분석하였으며, 사용한 이동상은 아세토니트릴과 0.02 mM NaH2PO4 수용액을 수산화나트륨으로 pH 7.0까지 조절한 완충액을 60:40(v/v%)의 비율로 혼합하여 사용하였다.10,11 제조된 이동상은 교반 후 사용하기 전에 초음파분쇄기로 탈기하여 사용하였다.
란소프라졸 경질캡슐의 생체 외 용출거동. 제조된 경질캡슐의 용출시험은 대한약전 제 11개정 용출시험 제 2법인 패들법으로 실시하였다. 용출액은 인공위액(pH 1.2), 인공장액 (pH 7.2)으로 대한약전(제 11개정 용출실험법 제 1액-인공위액, 제 2액-인공장액)에 따라 제조하였으며 용출기는 DTS-8 (Lab House, 한국)을 사용하였고, 속도는 100 rpm, 용출액의 온도는 37±0.5 oC로 설정하였다.
용출액의 양은 900 mL로 설정하였으며 실험시간은 인공위액 용출시험은 5, 10, 15, 30, 45, 60, 90, 120분에 걸쳐 진행하였고, 인공장액 용출시험은 5, 10, 15, 30, 45, 60, 90, 120, 180분에 걸쳐 진행하였다. 각 시간별로 시료를 1 mL씩 취한 후 1 mL씩 충전하였다. 취한 시료는 0.45 μm의 PTFE필터로 여과한 후 HPLC를 이용하여 측정하였다.
통계학적 분석. 각 실험의 통계학적 분석은 student’s t-test를 시행하여 p 값이 0.05 미만일 때 통계적으로 유의 한 것으로 하였다(*p<0.05, **p<0.01, ***p<0.001) (n=3)).
|
Table 1 Compositions of Different Formulation Batches of Lansoprazole Hard Capsule |
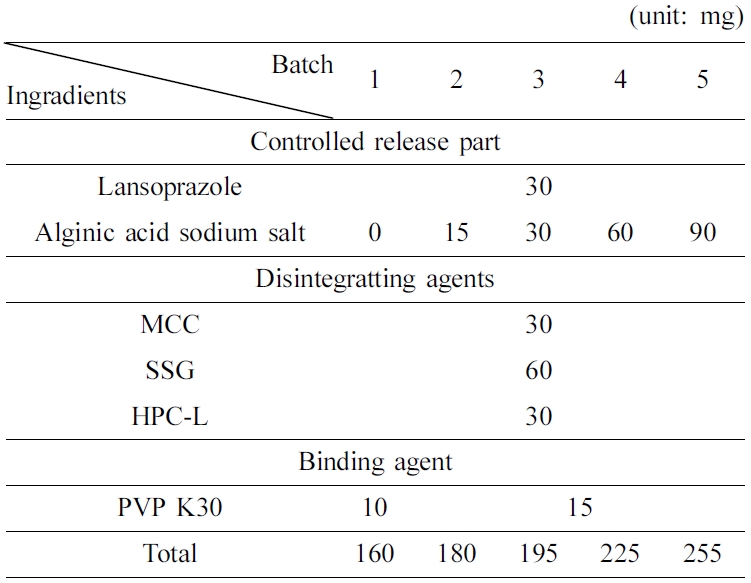
과립물의 구조학적 특성분석. 란소프라졸과 알긴산 나트륨이 포접하는 과정에서 어떠한 화학 결합에 의해 포접되었는지 알아보았다(Figure 1). 먼저 란소프라졸은 3222, 2983, 1580, 1282, 1117 cm-1에서 피크가 나타났으며, 각각은 N-H 결합, -CH2- 결합 신축진동, 방향족 고리, C-N 결합, 피리딜 고리, 에테르 결합에 의한 흡수 파장이 나타났다.12 알긴산 나트륨은 3000~3600, 2850~2920, 1649, 1460, 1107, 935 cm-1에서 흡수 파장이 나타났고, 각 파장에 대한 결합으로는 O-H 결합, C-H 결합 신축진동, 대칭과 비대칭 카복실이온 진동, C-O 결합 신축진동, 파라노실고리, C-C-H 결합, C-O-H 결합이 나타났다.13 알긴산 나트륨의 분자식 구조상 카복실기를 포함하고 히드록시 결합이 많아 기본적으로 친수성이다. 각 군들은 란소프라졸과 알긴산 나트륨의 비율에 따라 알긴산 나트륨이 많을수록 알긴산 나트륨의 피크가 더 잘 관찰되는 것을 확인할 수 있었다. 또 batch 1~5에서 공통적으로 3000~ 3600 cm-1 피크의 강도가 감소하였고 낮은 파수쪽으로 이동한 것을 보아 수소결합이 작용함을 알 수 있다. 이는 습식과립으로 인해 란소프라졸, 알긴산 나트륨과의 분자간 O-H, N-H, F-H 수소결합 때문에 강한 인력이 작용하여 포접이 잘 이루어짐을 확인할 수 있다.14
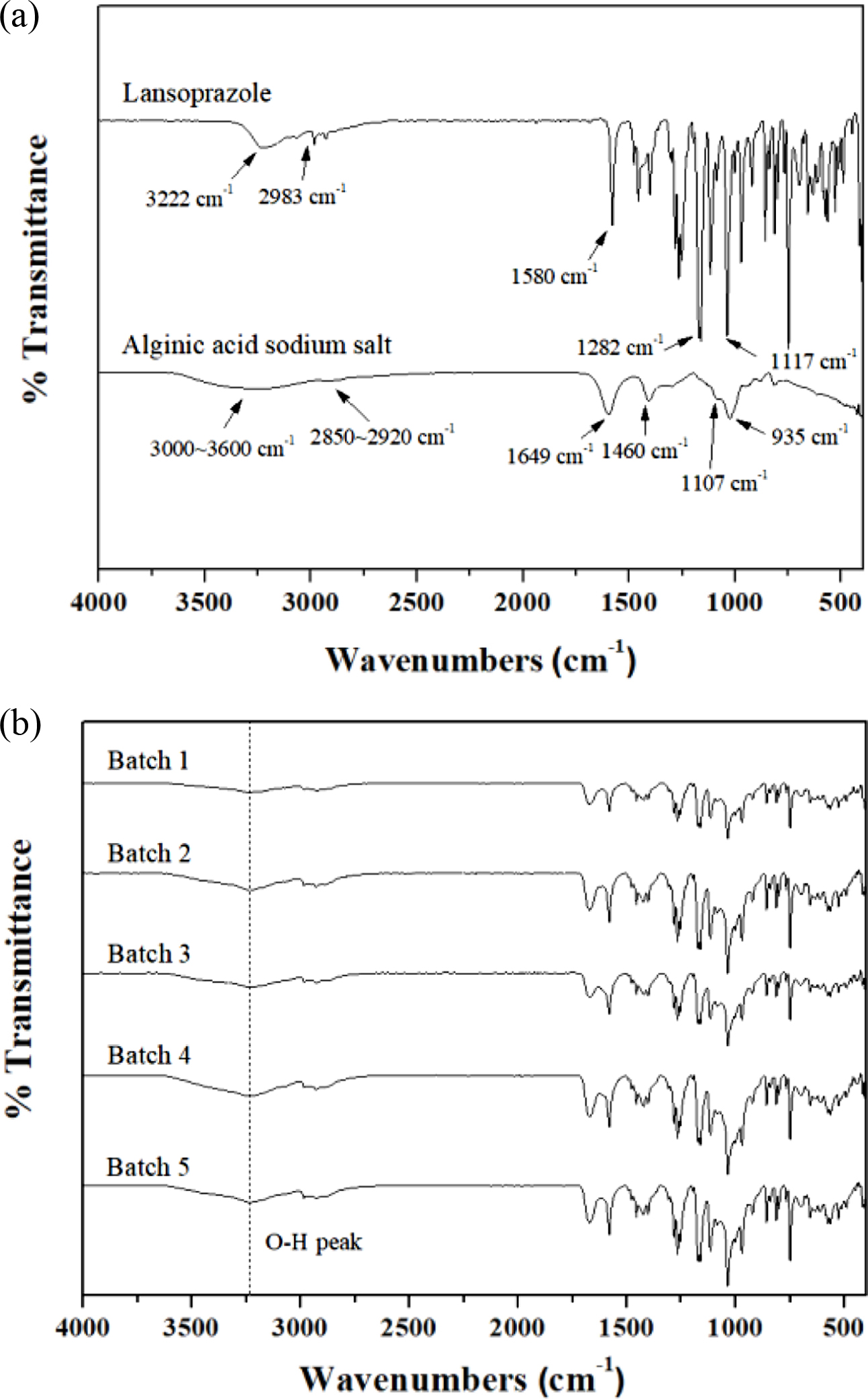
과립물의 열적 특성분석. 알긴산 나트륨에 의해 포접이 잘 일어났는지 확인하기 위하여 DSC를 실시하였다(Figure 2). 란소프라졸의 경우 176 oC에서 녹는점이 관찰되고 이 후 재결정이 일어남을 확인할 수 있다.15,16 알긴산 나트륨의 경우 63~165 oC까지 넓은 흡열 피크가 나타나는데, 이는 알긴산 나트륨의 수분증발에 의한 피크로 많은 O-H 결합과 카복실기로 인한 수분 함유량이 많아서 나타난다. 알긴산 나트륨의 Tg는 약 270 oC에서 나타나고, 따라서 녹는점은 더 높은 위치에 나타날 거라는 것을 예측할 수 있다.17 즉 알긴산 나트륨에 의해 포접된 란소프라졸은 알긴산 나트륨이 녹지 않기 때문에 batch 1~5에서 나타나듯이 란소프라졸의 고유피크가 나타나지 않음을 알 수 있다. 따라서 란소프라졸과 알긴산 나트륨의 수소결합으로 인해 포접이 정상적으로 이루어짐을 확인할 수 있다. 또 알긴산 나트륨의 비율이 많아질수록 알긴산 나트륨의 고유 피크가 뚜렷하게 관찰됨을 알 수 있다. 이를 통해 습식과립 과정으로 알긴산 나트륨 안에 란소프라졸이 정상적으로 포접되어 있음을 확인할 수 있다.
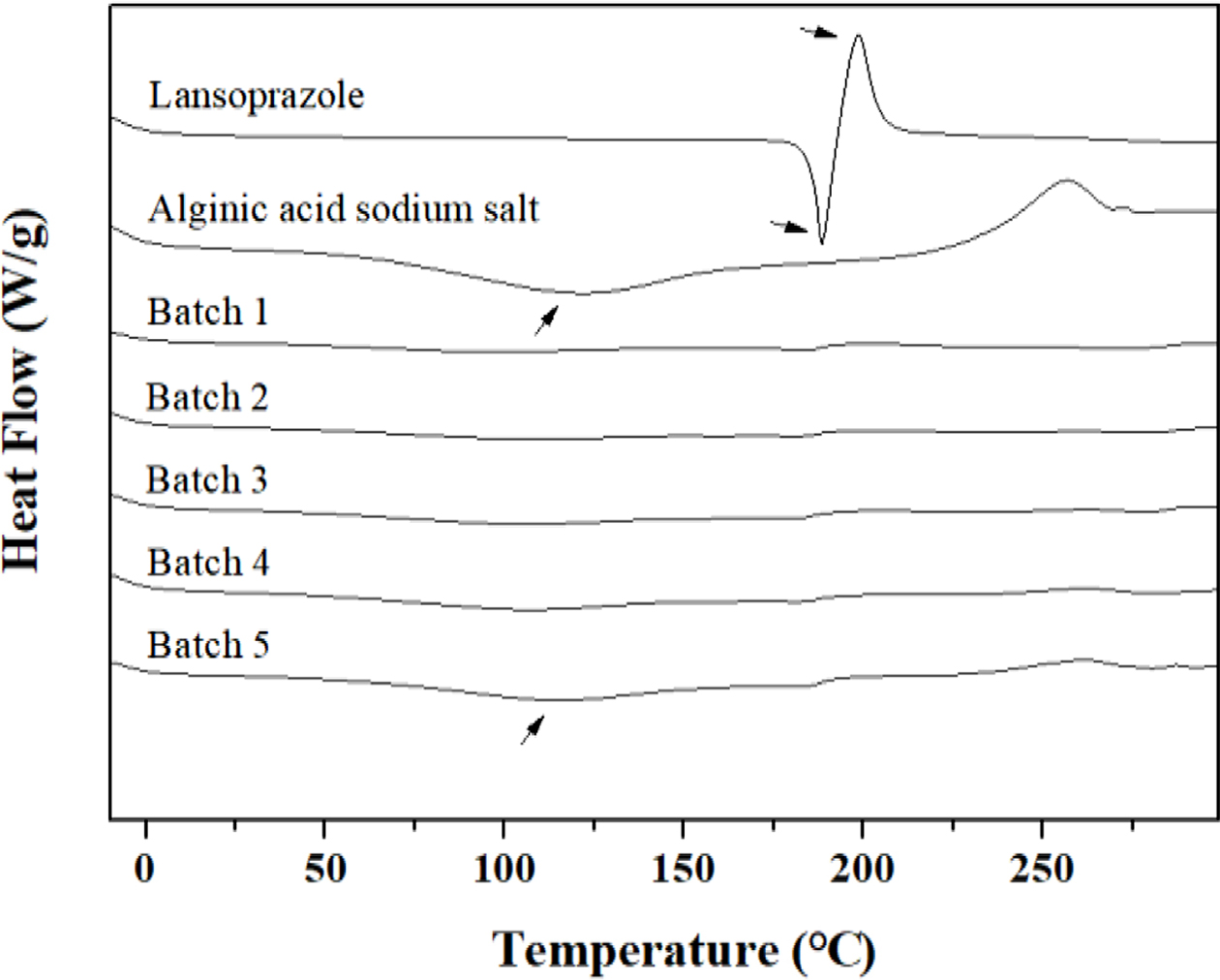
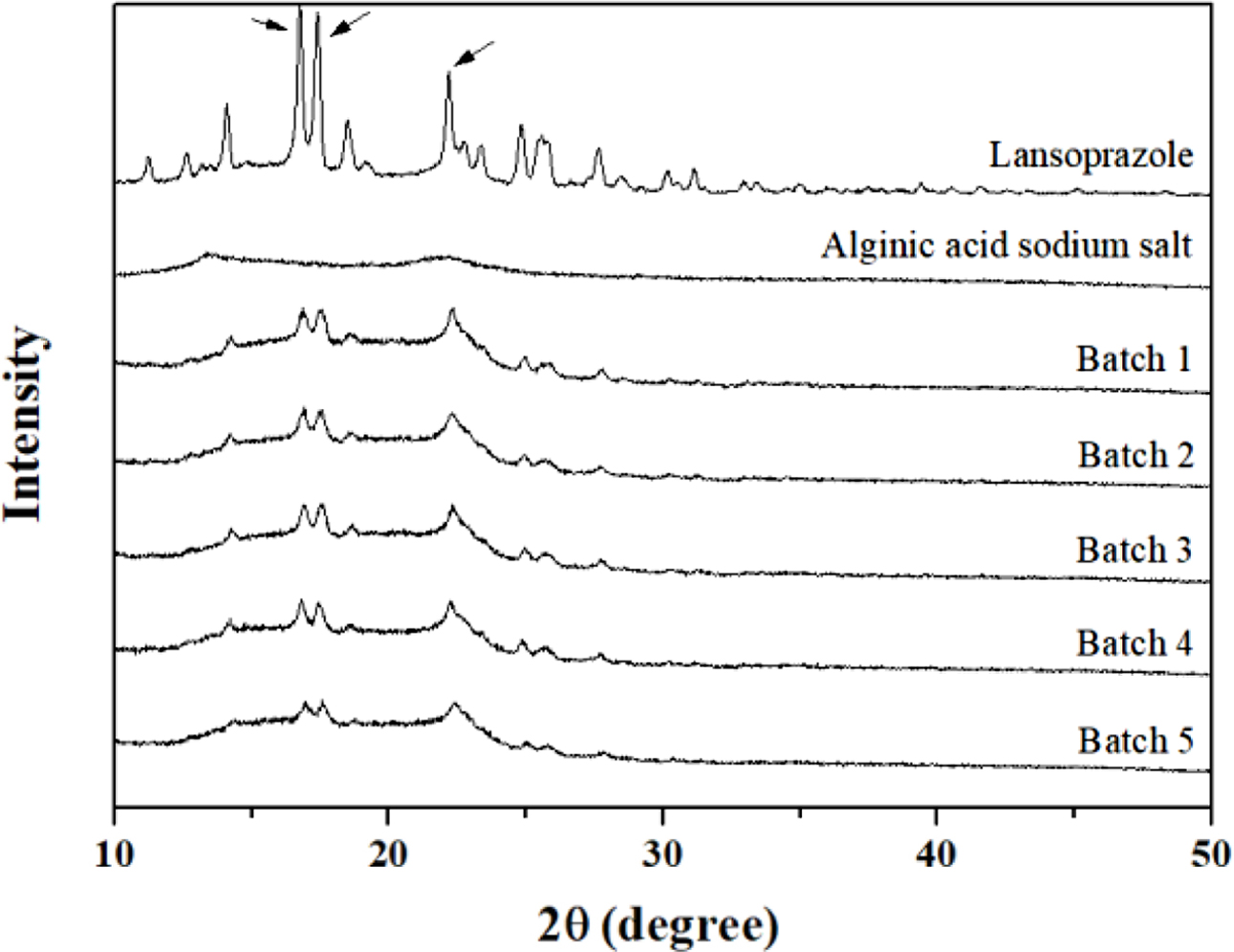
과립물의 결정학적 특성분석. 란소프라졸은 결정화도가 높은 약물로 비교적 물에 녹기 힘든 약물로 알려져있다. XRD 결과에서도 여러 각도에서 피크가 관찰되었고, 특히 16.7, 17.3, 22.1o에서 높은 피크가 측정되었다(Figure 3).18 알긴산 나트륨의 경우에는 전체적으로 무정형 형태로 넓은 피크가 관찰되었다.19 습식과립으로 제조한 각 배치에서는 원약물의 피크가 상대적으로 감소하였지만, 완벽하게 포접된 형태의 과립물이 아님을 알 수 있다. 알긴산 나트륨의 양이 batch 1에서 batch 5로 점차적으로 증가하였기 때문에 약물의 피크도 약간씩 감소함을 볼 수 있다. 따라서 알긴산 나트륨의 양이 증가하면 약물의 포접률도 약간 증가함을 알 수 있다.
과립물의 형태학적 특성분석. 란소프라졸이 알지네이트에 의해 정상적으로 포접되고, 입자크기의 균일성을 확인하기 위해 SEM 촬영을 실시하였다(Figure 4). 란소프라졸은 결정성 약물로 20~100 μm 크기의 입자들을 가진다. 알긴산 나트륨은 10 μm의 작은 입자부터 200 μm 크기의 큰 입자까지 다양하게 분포하고 있다. Batch 1은 알긴산 나트륨을 제외한 첨가제들과 란소프라졸의 습식과립물로 과립물의 크기가 다른 배치들에 비해 상대적으로 작고 결정성의 란소프라졸 입자들이 많이 관찰되었다. Batch 2는 알긴산 나트륨에 의해 과립을 형성하고 있는 과립물들이 관찰되었고, 크기 또한 batch 1에 비해 컸다. 하지만, 알긴산 나트륨과 란소프라졸의 비율이 적어 정상적인 과립물들의 개수가 적게 나타났고, batch 5로 갈수록 비율이 높아져 과립물의 입자크기가 크게 나타났고 포접되지 않은 란소프라졸의 결정이 적게 관찰되었다. 따라서 알지네이트의 비율이 증가할수록 과립형성이 잘 일어났고 균일한 크기의 과립물 입자들이 관찰됨을 알 수 있었다.
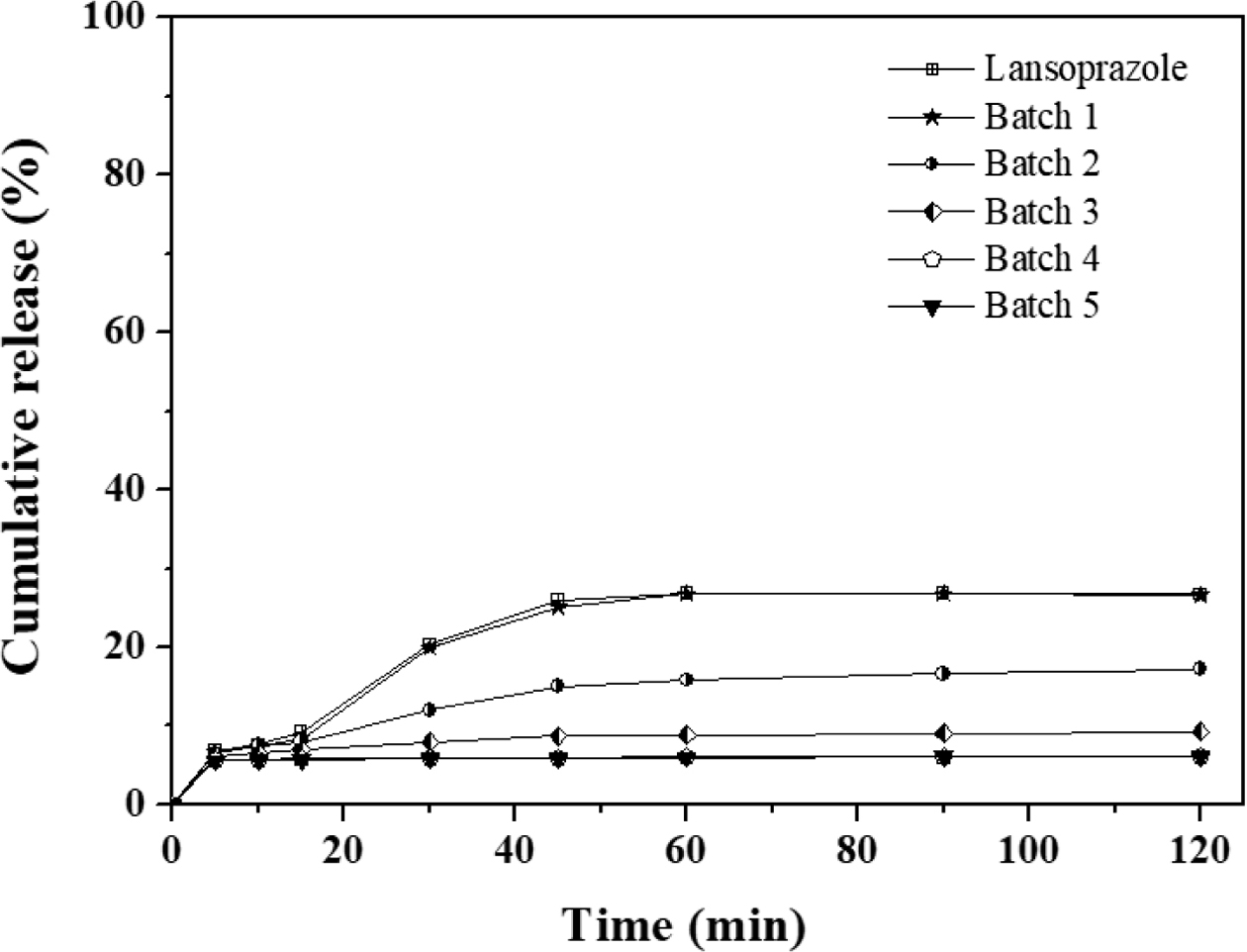
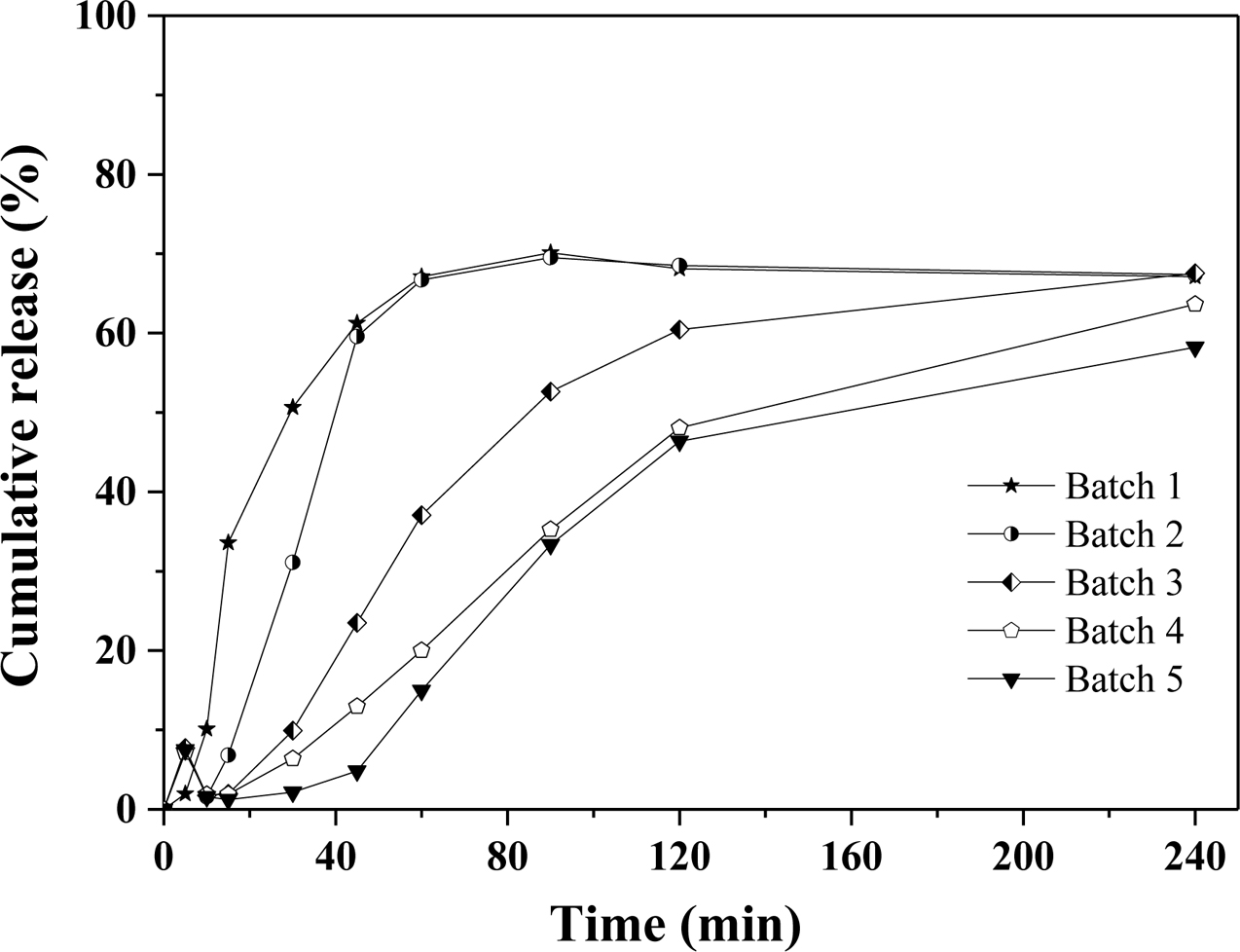
란소프라졸 경질캡슐의 생체 외 용출거동. 란소프라졸은 산성 조건에서 안정성이 떨어지며 분해 가능성이 높아 경구복용 시 위액 산성 조건(pH 1.2)에서 생체 이용률이 낮다. 따라서 장용성 제제로 설계하여 장액 조건(pH 6.8)에서 세시간 이내의 빠른 시간 내에 붕해 및 용출이 되는 성질을 갖는 제형을 선정하였다. 란소프라졸만 경질캡슐에 충전하여 위액 조건에서 용출시험을 진행한 경우에서는 최대 26%까지 용출이 되었다. 알긴산 나트륨이 없는 batch 1에서는 장용성 코팅이 되지 않았기 때문에 란소프라졸만 있는 군과 비슷한 용출그래프를 나타내었다. Batch 2부터는 알긴산 나트륨의 비율이 높아질수록 약물포접이 잘 되기 때문에, 약물방출이 감소하는 경향을 보이고 batch 5에서 가장 억제된 그래프를 볼 수 있다. Batch 2에서는 알긴산의 비율이 너무 적기 때문에 적절한 약물포접이 이루어지지 않았고, 비율이 높아질수록 수월하게 포접됨을 확인할 수 있다. 하지만, batch 4와 batch 5의 차이가 크지 않기 때문에 일정 비율의 알긴산 나트륨을 이용하면 결과가 같은 것이라는 것을 예측할 수 있다(Figure 5). 장액 조건에서는 batch 1에서는 붕해제에 의해 빠르게 분산되며 40분 이내에 급속한 방출이 이루어졌다. 하지만, 란소프라졸 특성상 용해도가 좋지 않기 때문에 70%의 용출률을 보이고 시간이 지날수록 약간 감소하는 경향을 보였다. Batch 2는 알긴산 나트륨에 의해 란소프라졸이 포접되어 batch 1에서보다 늦은 약물방출을 보인다. 하지만, 나머지 배치들에 비해 급격하게 기울기가 증가하며 급속한 약물방출은 인체 내에서 급격한 혈중약물농도의 증가를 야기하고 부작용으로 이어질 수 있기 때문에 batch 1, 2는 제형으로 적합하지 않다는 것을 알 수 있다. 알긴산 나트륨의 비율이 미치는 영향은 batch 2~5를 통해 확인할 수 있다. 과립물의 알긴산 나트륨의 비율이 높아질수록 약물은 천천히 방출되고 최종 용출률은 증가하는 것을 볼 수 있다(Figure 6).
|
Figure 1 FTIR spectra of (a) lansoprazole and alginic acid sodium salt; (b) batch 1~5. |
|
Figure 2 DSC thermograms of lansoprazole, alginic acid sodium salt, and batch 1~5. |
|
Figure 3 X-ray diffraction spectra of lansoprazole, alginic acid sodium salt, and batch 1~5. |

|
Figure 4 SEM images of (a) lansoprazole; (b) alginic acid sodium salt; (c)~(g) batch 1~5 (scale bar is 100 µm). |
|
Figure 5 Release behavior of lansoprazole hard capsules batch 1~5 (in gastric juice, pH 1.2). |
|
Figure 6 Release behavior of lasoprazole hard capsules batch 1~5 (in intestinal fluid, pH 6.8). |
란소프라졸의 습식과립물을 제조하고 경질캡슐로 충전하여 산성 조건에서 약물방출을 억제하고 중성 및 약알칼리성 조건에서 약물방출이 이루어지는 장용성 제형을 설계하였다. 습식과립물은 란소프라졸과 알긴산 나트륨의 수소결합으로 인해 과립물을 형성할 수 있고, DSC와 XRD를 통해 정상적으로 과립물이 형성되었는지 알 수 있다. 과립물에 남아있는 란소프라졸의 결정들은 알긴산 나트륨이 증가할수록 포접이 잘 되어 감소하는 경향을 SEM 촬영으로 관찰할 수 있었다. 또 생체 외 용출거동에서도 알긴산 나트륨의 첨가로 인해 10%이상 용출률의 증가를 보였으며 산성 조건에서 약물방출이 억제되는 것을 확인할 수 있었다.
- 1. B. J. Marshall and J. R. Warren, The Lancet, 323, 1311 (1984).
-

- 2. P. Malfertheiner, F. K. L. Chan, and K. E. L. McColl, The Lancet, 374, 1449 (2009).
-

- 3. S. Vigneri, R. Termini, G. Leandro, S. Badalamenti, M. Pantalena, V. Savarino, F. D. Mario, G. Battaglia, G. S. Mela, A. Pilotto, M. Plebani, and G. Davi, N. Engl. J. Med., 333, 1106 (1995).
-

- 4. W. J. Dodds, J. Dent, W. J. Hogan, J. F. Helm, R. Hauser, G. K. Patel, and M. S. Egide, N. Engl. J. Med., 307, 1547 (1982).
-

- 5. P. Richardson, C. J. Hawkey, and W. A. Stack, Drugs, 56, 307 (1998).
-

- 6. S. Yamada, T. Kawakami, Y. Nakatsugawa, T. Suzuki, H. Fujii, N. Tomatsuri, H. Nakamura, H. Sato, Y. Okuyama, H. Kimura, and N. Yoshida, World J. Gastrointest. Pharmacol. Ther., 7, 550 (2016).
-

- 7. T. Iwahi, H. Satoh, M. Nakao, T. Iwasaki, T. Yamazaki, K. Kubo, T. Tamura, and A. Imada, Antimicrob. Agents Chemother., 35, 490 (1991).
-

- 8. H. Nagaya, N. Inatomi, A. Nohara, and H. Satoh, Biochem. Pharmacol., 42, 1875 (1991).
-

- 9. W. D. Chey, M. Woods, J. M. Scheiman, T. T. Nostrant, and J. DelValle, Am. J. Gastroenterol., 92, 446 (1997).
- 10. T. Shimizu, M. Sugaya, Y. Nakano, D. Izutsu, Y. Mizukami, K. Okochi, T. Tabata, N. Hamaguchi, and Y. Igari, Chem. Pharm. Bull., 51, 1121 (2003).
-

- 11. K. Muthusamy, G. Govindarazan, and T. K Ravi, Indian J. Pharm. Sci., 67, 75 (2005).
- 12. P. Reddy, B. M. Jayaprakash, K. Sivaji, G. T. Jyothesh, E. C. Kuamr, S. Reddy, and B. R. Reddy, IJABPT, 1, 683 (2010).
- 13. B. Prasanna, K. Reddy, Y. R. Reddy, and D. Ramachandran, E-J. Chem., 6, 489 (2009).
-

- 14. X. Zhang, N. Sun, B. Wu, Y. Lua, T. Guan, and W. Wu, Powder Technol., 182, 480 (2008).
-

- 15. H. Daemi and M. Barikani, Sci. Iran., 19, 2023 (2012).
-

- 16. M. Jivraj, L. G. Martini, and C. M. Thomson, Pharm. Sci. Technol., Today, 3, 58 (2000).
-

- 17. X. Zhang, N. Sun, B. Wu, Y. Lu, T. Guan, and W. Wu, Powder Technol., 182, 480 (2008).
-

- 18. A. Shabir, F. Alhusban, Y. Perrie, and A. R. Mohammed, J. Basic Clin. Pharm., 2, 71 (2011).
- 19. B. Sarmento, D. Ferreira, F. Veiga, and A. Ribeiro, Carbohyd. Polym., 66, 1 (2006).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(3): 415-419
Published online May 25, 2019
- 10.7317/pk.2019.43.3.415
- Received on Jan 28, 2019
- Revised on Feb 27, 2019
- Accepted on Feb 27, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
ept. of BIN Convergence Tech & Dept. of PolymerNanoSci Tech, Chonbuk National University,
567 Baekje-daero, Jeonju 54896, Korea - E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.