- Preparation and Characterization of Solid Reducing Agent Using a PVA Binder
Ho Young Jung, Jun Youn Sohn*, Sun Gyun Roh**, Min Hwa Lim, and Jeong Sun Sohn***,†

Department of Environment and Energy Engineering, Chonnam National University, Gwangju 61186, Korea
*Department of Bioenvironmental & Chemical Engineering, Chosun College of Science & Technology, Gwangju 61453, Korea
**Department of Fire Service Administration, Honam University, Gwangju 62399, Korea
***Division of Undeclared Majors, College of General Education, Chosun University, Gwangju 61452, Korea- PVA 바인더를 이용한 고형환원제 제조 및 특성연구
전남대학교 환경에너지공학과, *조선이공대학교 생명환경화공과, **호남대학교 소방행정학과, ***조선대학교 기초교육대학 자유전공학부
In this study, a solid reducing agent, a spherical porous composite structure for hydrogen fluoride (HF) removal, was prepared. First, SiO2 as a support and Ca(OH)2 were introduced to prepare a CaO/SiO2 mixture, and poly(vinyl alcohol) (PVA) having various molecular weights was used as a binder to prepare solid reducing agents having various compositions. Thermal properties, morphology, compressive strength, specific surface area, and pore characteristics were investigated according to their compositions. The optimized compressive strength, the specific surface area and porosity were observed for the solid reducing agent (60-2PVA50K) using 2 wt% of PVA having a weight average molecular weight of 31000 to 50000 as a binder in a mixture having a CaO concentration of 60 wt%. The introduction of the binder is expected to increase the specific surface area and improve the adsorption characteristics while suppressing the formation of powder of the solid reducing agent.
본 연구에서는 불화수소(HF) 제거를 위한 구형 다공성 복합구조체인 고형환원제를 제조하였다. 먼저 지지체로 SiO2와 Ca(OH)2를 도입하여 CaO/SiO2 혼합물을 제조한 후, 바인더로 다양한 분자량을 갖는 폴리(비닐 알코올) (PVA)을 이용하여 여러 가지 조성으로 고형환원제를 제조하고 이들의 조성에 따른 열적특성, 모폴로지, 압축강도, 비표면적특성 및 기공특성을 조사하였다. CaO의 농도가 60 wt%인 혼합물에 바인더로 중량평균분자량이 31000~50000인 PVA를 2 wt% 사용한 고형환원제(60-2PVA50K)의 경우 압축강도, 비표면적 및 기공도가 최적화되는 것을 확인하였다. 바인더의 도입은 고형환원제가 분말화되는 것을 억제하면서 비표면적을 크게 하여 흡착특성을 향상시킬 수 있을 것으로 기대된다
Keywords: calcium hydroxide, calcium oxide, hydrophobic silica, binder, composite
이 논문은 2014학년도 조선대학교 학술연구비의 지원을 받아 연구되었음.
과불화화합물(PFCs, perfluorinated compounds)은 반도체 산업에서 증착(chemical vapor deposition, CVD), 식각(etching) 등 공정에 광범위하게 사용되고, 공급되는 PFCs의 약 10~50%가 미반응의 상태로 대기 중으로 방출되며 이는 주로 CF4, C2F6, C3F6, NF3 그리고 SF6 등을 포함한다.1 PFCs는 CFC(chlorofluorocompound)보다도 매우 수명이 길고 안정하여 대기에 그대로 방출될 경우 장기간 체류하게 되고 제거가 용이하지 않아 지구 온난화를 일으키는 물질로서, 이산화탄소에 비하여 연평균 증가율이 높고 지구온난화지수(global warming potential, GWP)가 5700~23900배 높아 세계적으로 사용규제가 강화되고 있어 이들의 분해제거 기술이 절실히 요구되어 왔다. 하지만, PFCs는 불소원자를 다수 포함하고 있기 때문에 어떠한 처리과정에서도 부산물로 부식성이 강하고 맹독성인 불화수소(HF)가 생성된다(eq. (1)).2-5 따라서 이를 제거하기 위한 공정이 필요한 상태이며, HF를 제거하기 위해 많은 연구들이 진행되어 왔고, 크게 건식제거법과 습식제거법으로 구분된다. 먼저, 습식제거법은 HF를 액체 상태인 알칼리용액으로 중화시켜 처리하는 방법으로 열에 의한 부식성이 더 강해져 시스템이 부식되어 내구성이 떨어지고 폐수 등의 2차 환경오염 문제가 발생한다. 따라서 건식제거법이 요구되고 있다.6 건식제거법은 고형흡착제를 이용하여 HF를 제거하는 방법이며, 고형흡착제로는 Ca계 물질 중에서 생석회로 잘 알려진 CaO가 일반적으로 적용되고 있으며, HF와 반응하여 불산제조 원천물질인 고순도의 CaF2를 생성함으로써 자원회수 및 재활용이 가능하기도 하다(eq. (2)).7-11 하지만, 반응을 위한 고온의 필요에 의해 공정이 복잡해지는 문제점을 갖는다. 따라서 본 연구팀에서는 이와는 다르게, 발생하는 HF를 고형환원제를 사용하여 지속적으로 제거함으로써 르샤틀리에의 원리에 의하여 평형을 파괴함으로써 반응온도를 낮춤과 동시에 HF를 효과적으로 제거할 수 있는 기술을 개발하기 위한 연구를 하였다. 이러한 일환으로 반응성과 효율성이 좋은 고형흡착제를 제조하고자 하였다.
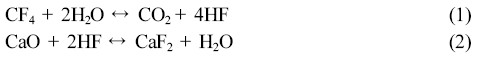
고형흡착제 제조 시 CaO는 상온에서 공기 중에 노출되면 H2O와 CO2를 흡수하여 수산화칼슘이나 탄산칼슘으로 되돌아 가려는 성질을 갖는다(eq. (3), eq. (4)).12,13

뿐만 아니라 CaO는 물이나 수증기를 접하면 심한 발열반응을 일으켜 분화하여 미립자 분말의 Ca(OH)2가 만들어지는데 이를 수화공정이라 한다. 순수 CaO보다 수화시켜 제조된 Ca(OH)2에서의 열분해로 생성된 CaO의 경우 넓은 비표면적으로 활성도가 높아져 반응성이 더 좋은 것으로 보고되었다. 이러한 특성을 이용하여 본 연구팀의 이전의 연구에서는 HF 제거용 고효율 고형환원제를 제조하기 위하여 지지체로서 소수성 실리카를 도입하고 열분해를 통하여 CaO/SiO2 혼합물을 제조하고 비표면적 특성 및 소수성의 최적화 조건 등을 고찰하였다.14 본 연구에서는 HF 제거를 위한 입자상 고형환원제를 제조하기 위해 다양한 분자량을 갖는 바인더를 도입하여 성형함으로써 기술의 차별화를 유도하였고 제조된 구형 복합구조체의 비표면적 특성 및 표면형상 등 그들의 특성을 고찰하고자 하였다.
재료 및 기기. 불화수소(HF) 제거용 고효율 고형환원제를 제조하기 위해 출발물질로는 isopropyl alcohol에 분산되어 있는 졸 상태의 소수성 silica(Ranco(Korea), 50 nm, Optisol-LSA430U5)를 사용하였고, calcium hydroxide(Junsei(Japan), assay 95.0%)와 isopropyl alcohol(Junsei(Japan), assay 99.7%)은 특별한 정제 없이 사용하였다. 고형환원제를 성형하기 위해 바인더로서 중량평균분자량(MW)이 9000~10000(Aldrich, 80% hydrolyzed), 31000~50000(Aldrich, 98~99% hydrolyzed) 그리고 146000~186000(Aldrich, 99% hydrolyzed)인 poly (vinyl alcohol)(PVA)를 사용하였다. 시료들의 표면 형상과 입자크기의 미세구조 분석은 FE-SEM(field emission scanning electron microscope, Hitachi-S4700)으로 실시하였고, 시료들의 비표면적, pore volume 및 pore diameter는 질소흡착법인 BET(Brunauer-Emmett-Teller, ASAP 2020)법을 이용하여 측정하였다. 열분해 공정을 통해 고형환원제 제조를 위한 바인더 및 용매 제거를 위한 소성온도 결정을 위하여 TGA(thermo-gravimetric analyzer, TGA 2050)를 이용하여 질소기류 하에서 10 ℃/min의 가열속도로 30에서 800 ℃까지 열적 특성을 조사하였다.
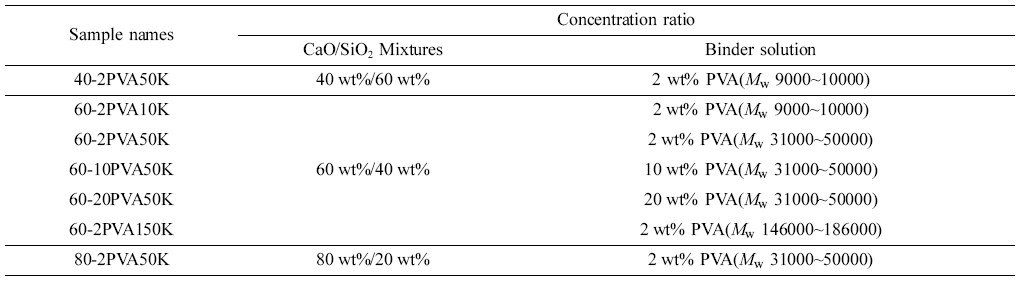
Ca(OH)2/SiO2 및 CaO/SiO2 혼합물의 제조. HF 제거용 고효율 고형환원제의 출발물질인 Ca(OH)2/SiO2의 혼합물은 이전의 연구결과인 Sohn 등의 방법에14 의해 제조하였다. 제조된 Ca(OH)2/SiO2 혼합물들의 농도 비율은 20~80 wt%/80~20 wt%의 범위 안에서 변화시켜 준비하였고, 제조방법은 Figure 1과 같다. 회전증발기로 용매를 제거한 Ca(OH)2/SiO2 혼합물은 Ca(OH)2에서 CaO로 전환시키기 위해 소결로(FB1310M-26, Barnsted Thermolyne co.)를 통해 열분해 처리하였고, 승온 조건은 3.5시간에 걸쳐서 100 ℃씩 단계별로 650 ℃까지 올린 후 650 ℃에서 4시간 동안 소성(calcination)하여 CaO/SiO2 혼합물을 제조하였다(Figure 2).
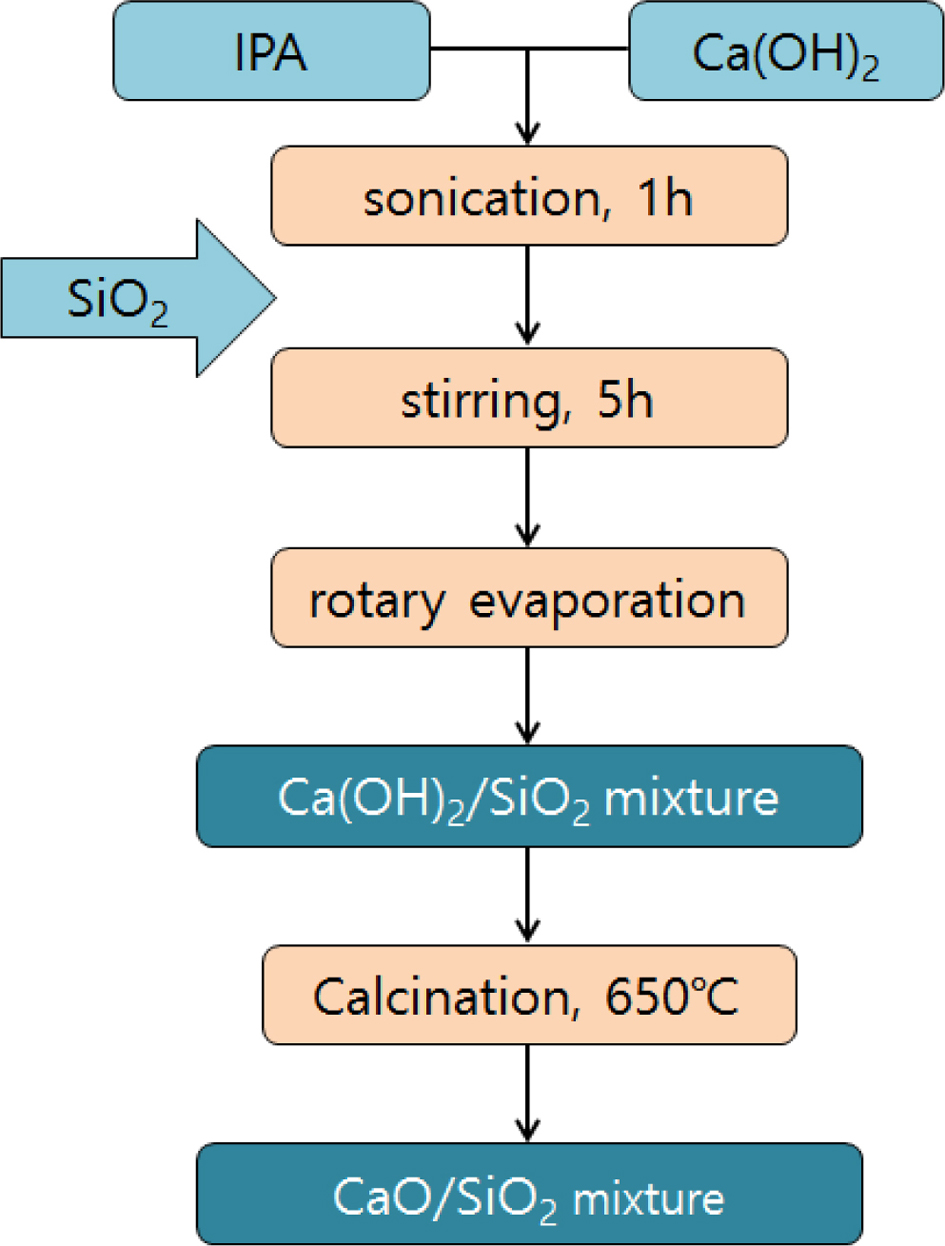
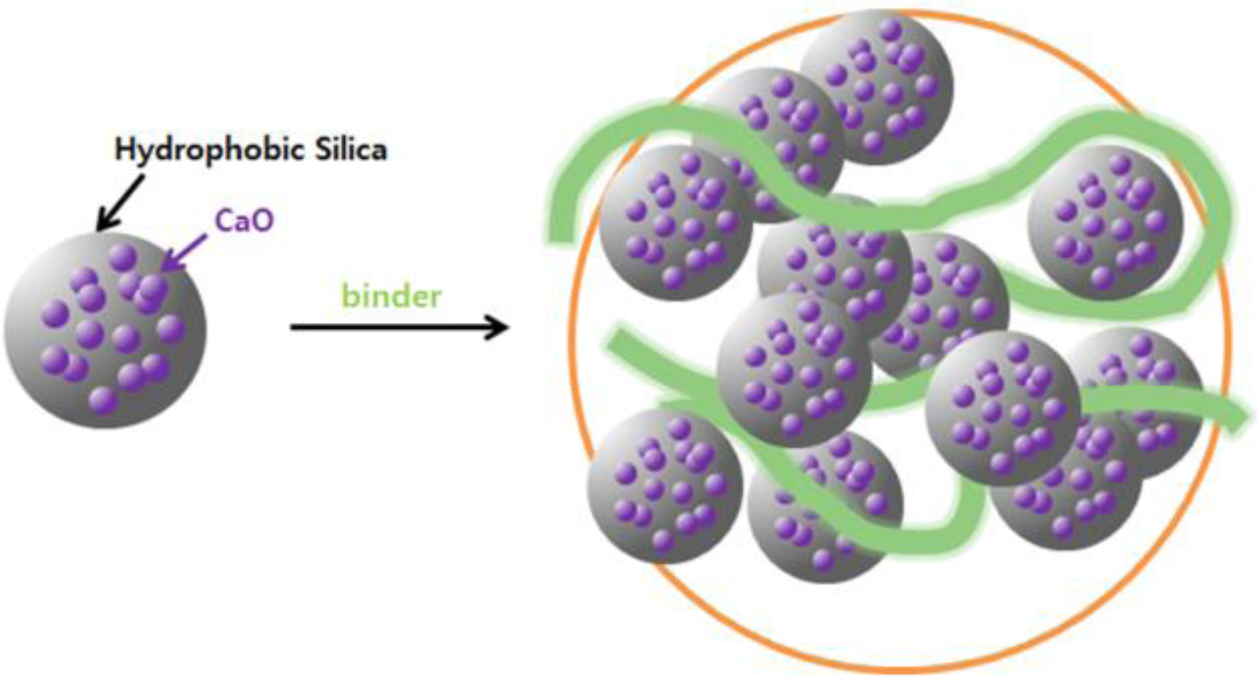
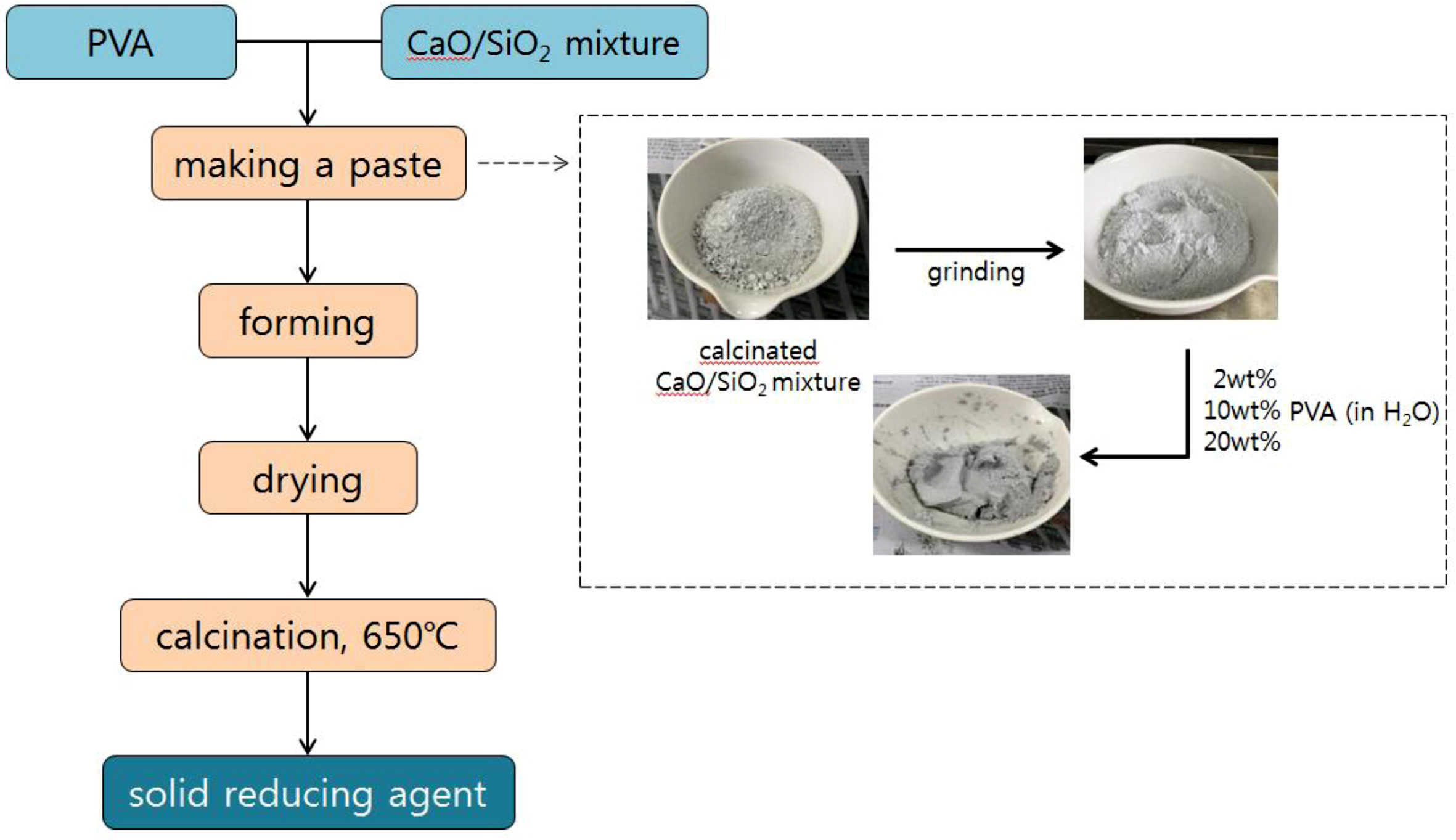
고형환원제의 제조. 고형환원제를 성형하기 위해 소성이 완료된 CaO/SiO2 혼합물에 고분자 바인더를 사용하였다(Figure 3). 고분자 바인더로는 중량평균분자량이 9000~10000, 31000~50000 그리고 146000~186000인 PVA를 사용하였고, 바인더 용액 제조를 하기 위해 각각 2, 10 그리고 20 wt%의 농도로 증류수에 바인더를 용해시켰다. 이 용액에 소성된 CaO/SiO2 혼합물을 넣고 혼합하여 반죽상태로 만든 다음 구형의 입자상태로 제조한 후 상온에서 12시간 동안 건조시켰다. 건조가 완료된 입자상의 성형물은 소결로에서 용매와 바인더를 제거하기 위하여 650 ℃에서 4시간 동안 각각 소성하였다(Figure 4). 위와 같은 방법으로 제조된 각각의 고형환원제의 명칭은 CaO/SiO2 혼합물과 바인더의 혼합 조성비 및 바인더 종류와 분자량에 따라 정리하여 Table 1에 나타내었다.
|
Figure 1 Scheme of the preparation of CaO/SiO2 mixture by cal-cination.14 |

|
Figure 2 CaO/SiO2 mixture using hydrophobic nanosilica as a sup-port. |
|
Figure 3 A spherical composite structure of CaO/SiO2 incorporat-ing a binder. |
|
Figure 4 Scheme of the preparation of CaO/SiO2 composite incorporating a binder. |
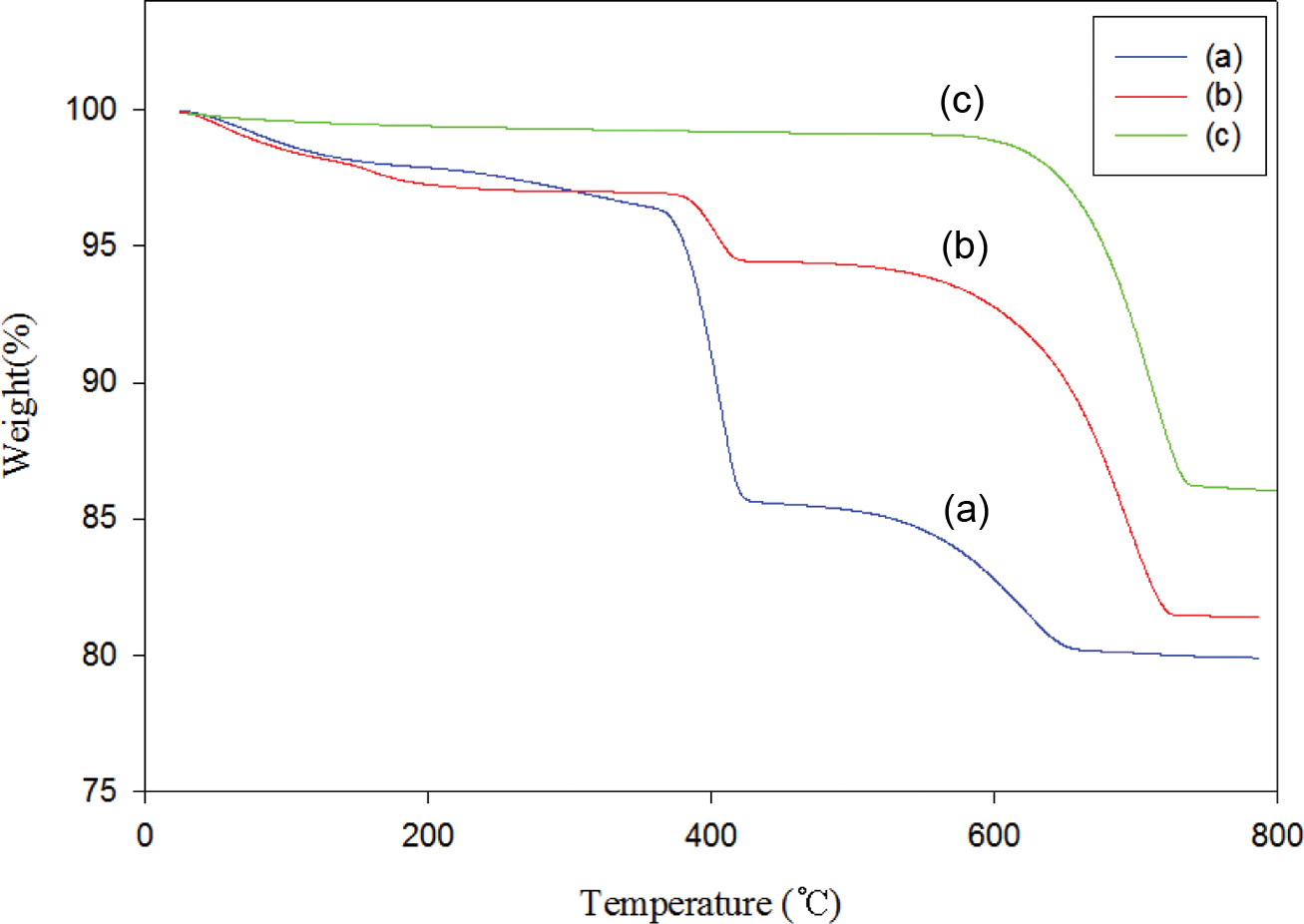
고형환원제의 출발물질인 Ca(OH)2/SiO2 혼합물과 바인더를 사용하여 제조된 고형환원제의 소성전후의 열적특성을 알아보기 위해 Figure 5에 TGA 곡선들을 나타내었다. Figure 5(a) 곡선은 Ca(OH)2의 함량이 60 wt%이고 SiO2의 함량이 40 wt%인 Ca(OH)2/SiO2 혼합물의 1차 소성 후 얻어진 CaO/SiO2 혼합물에 대한 열곡선이고, Figure 5(b)와 (c) 곡선은 각각 Ca(OH)2/SiO2 (60 wt%/40 wt%) 혼합물을 1차 소성한 후 얻어진 CaO/SiO2 혼합물에 분자량이 31000~50000인 PVA 바인더 2 wt%를 사용하여 제조한 고형환원제(60-2PVA50K)의 소성 전과 소성 후의 열곡선이다. 각각 100~200 ℃ 사이에서 일어나는 중량감소는 Figure 5(a) 곡선의 경우, 용매로 사용한 IPA와 대기 중에 흡착된 수분이 제거되어 중량이 감소한 것으로 판단되고, Figure 5(b) 곡선은 PVA에 흡착된 물 손실로 인한 중량감소,15 그리고 Figure 5(c) 곡선의 경우도 마찬가지로 고형환원제에 흡착된 대기 중의 수분이 제거된 것으로 판단된다.16-18 고형환원제의 출발물질로 사용된 Ca(OH)2는 410 ℃ 부근에서 CaO와 H2O로 분해되며, 이는 Figure 5(a) 열곡선에서 보는 것처럼 350 ℃부터 큰 중량손실을 보여주며 424 ℃에서는 85.7 wt%의 잔여량을 확인할 수 있었다. 또한 450~650 ℃ 사이에서의 중량감소 곡선은 화학 흡착된 물의 제거에 의한 것으로 판단된다.19 Figure 5(b) 열곡선에서 바인더로 사용된 PVA는 180 ℃부터 서서히 분해가 시작되어 360 ℃부터 420 ℃의 온도에서 중량손실을 보여주는데, 이는 곁사슬에 붙어있는 작용기가 서서히 분해되기 시작하면서 300 ℃ 이후엔 주사슬의 열분해가 일어난 것으로 해석된다.20 바인더 함량을 2 wt%로 사용했을 때 초기 PVA에 흡착된 물에 의한 중량 감소를 제외하고 main weight loss를 계산해 보면, 2.3%로 중량 손실과 거의 일치하는 것을 확인할 수 있었다. 그리고 열처리에 의한 PVA의 완벽한 제거는 Figure 5(c)에서 보는 바와 같이 550 ℃ 이하에서는 어떠한 변곡점을 보이지 않아 PVA가 열처리 됐음을 확인할 수 있었다. 그리고 Figure 5(b)와 (c) 곡선 둘 다 550~750 ℃ 사이에 큰 중량 손실을 보여주는데, 이는 탄산칼슘의 분해 온도로 앞에서 언급했듯이 고형환원제를 제조하는 과정에서 CaO가 공기 중에 노출되어 나타난 현상이라 보여진다.19 TGA 열분석 결과를 종합하여 본 실험에서는 혼합물의 소성온도와 바인더로 사용된 PVA를 제거함으로써 고형환원제의 기공률을 높이기 위한 소성온도를 650 ℃로 진행하였다.
Figure 6은 Ca(OH)2/SiO2(60 wt%/40 wt%) 혼합물을 1차 소성한 후 얻어진 CaO/SiO2 혼합물(Figure 6(a))과 이에 바인더를 사용하여 제조된 고형환원제의 소성 전과 소성 후의 표면 모폴로지를 보여주는 SEM 이미지이다. Ca(OH)2/SiO2(60 wt%/40 wt%) 혼합물을 1차 소성한 후 얻어진 CaO/SiO2 혼합물에 분자량이 31000~50000인 PVA 바인더 2 wt%를 사용하여 제조한 고형환원제(60-2PVA50K)의 소성 전(Figure 6(b))의 경우 치밀한 표면을 관찰할 수 있고 반면, 소성 후(Figure 6(c))의 경우 2차 소성에서 PVA의 분해로 얻어진 표면의 다공성을 확인할 수 있었다. 제조된 구형 복합 구조체는 micro-pore 뿐만이 아니라 macro-pore를 형성하여 반응물의 유입이 용이한 다공성 구조체로서의 역할을 할 수 있음을 확인하였다. 또한 이러한 바인더의 도입은 고형환원제가 분말화되는 것을 억제하면서 비표면적을 크게 하여 궁극적인 흡착특성을 향상시킬 수 있으리라 사료된다.
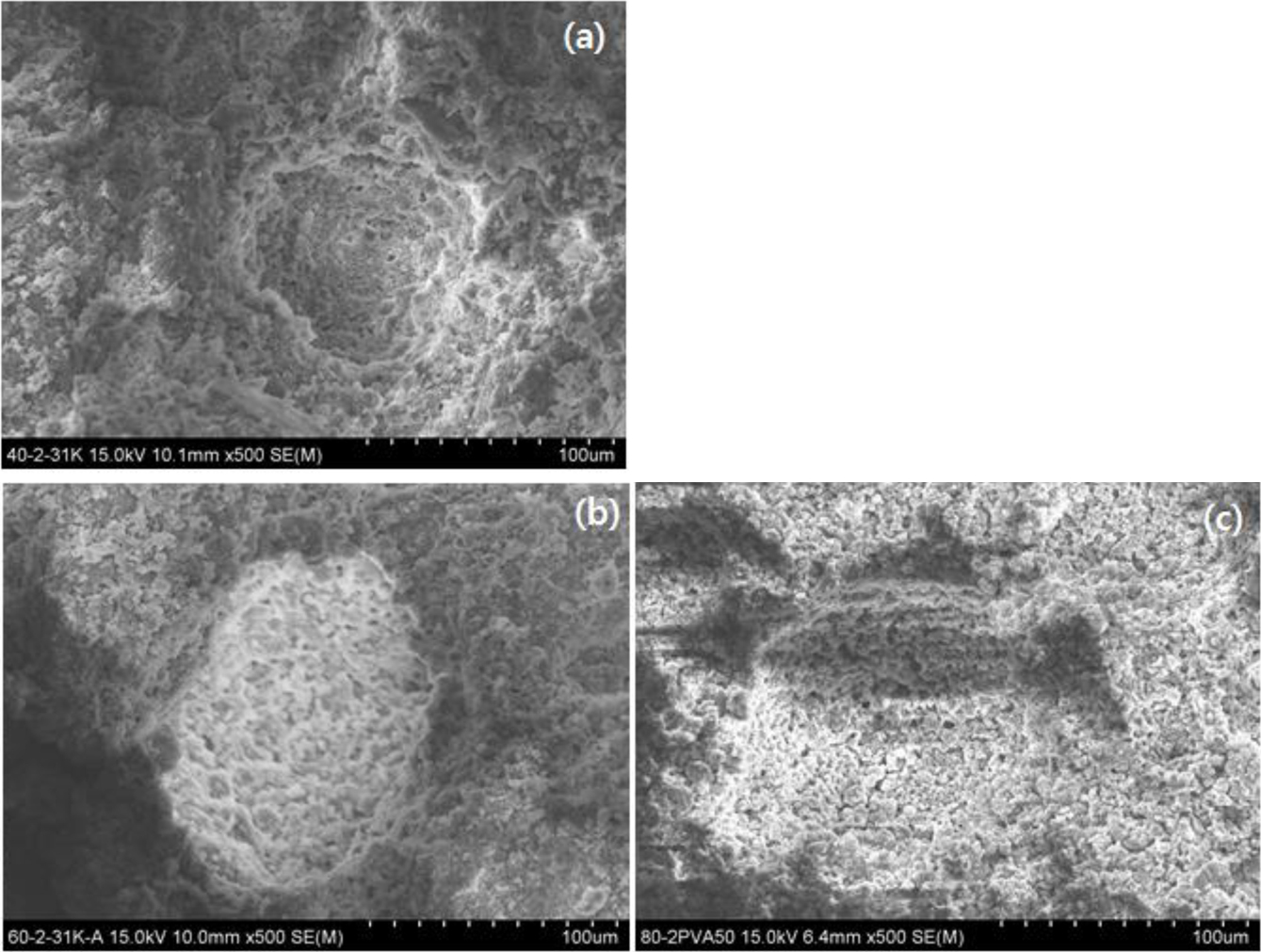
바인더 함량과 바인더 분자량에 따른 고형환원제의 표면 특성을 확인하기 위하여 SEM을 이용하여 측정한 결과를 Figure 7에 나타내었다. Figure 7(a)는 상용 CaO의 표면 이미지를 나타내었고, Figure 7(b)~(g)는 바인더 PVA를 이용하여 제조된 고형환원제의 표면 이미지를 나타내었다. Figure 7(a)는 CaO의 표면 형상을 나타낸 이미지이고 Figure 7(b)는 Ca(OH)2/SiO2 (60 wt%/40 wt%) 혼합물을 1차 소성한 후 얻어진 CaO/SiO2 혼합물에 바인더로서 중량평균분자량이 31000~50000인 PVA 2 wt% 사용하여 제조된 고형환원제, 60-2PVA50K의 소성 전 이미지이다. 비교해 보면, 분말 형태인 Figure 7(a)와 다르게 바인더를 사용한 고형환원제에서 치밀한 표면을 볼 수 있는데, 이는 고형환원제를 성형하는 과정에서 CaO/SiO2와 PVA에 의하여 응집되었음을 알 수 있다. 반면에, 고형환원제 60-2PVA50K의 소성 후 이미지(Figure 7(d))를 살펴보면, 소성 후 고형환원제의 경우 PVA가 제거됨에 따라 표면에 새로운 기공이 형성됨을 확인할 수 있었다. Figure 7(c), Figure 7(d-1) 그리고 Figure 7(g)는 바인더 분자량에 따른 고형환원제의 제조 후 그들의 표면특성을 확인한 결과이다. Ca(OH)2/SiO2 (60 wt%/40 wt%) 혼합물을 1차 소성한 후 얻어진 CaO/SiO2 혼합물에 바인더로서 각각 중량평균분자량이 9000~10000, 31000~50000 그리고 146000~ 186000인 PVA를 2 wt% 사용하여 제조된 고형환원제, 60-2PVA10K, 60-2PVA50K, 그리고 60-2PVA150K의 소성 후 이미지들이다. 비교해 보면, 전체적으로 분포된 기공의 수는 비슷한 정도를 보였으며, 소성 후 PVA 제거로 인한 기공의 크기는 평균 91±5, 143±8 그리고 191±11 µm로 분자량에 따라 커짐을 확인하였다. Figure 7(g)의 경우 Figure 7(c)와 Figure 7(d-1)와 같이 500배의 이미지 사진에서는 하나의 기공크기를 한 눈에 보여줄 수 없어 350배의 사진을 비교하였다. 향후 기공의 크기와 반응성과의 관계 및 기공크기 분포도가 좁아 반응성이 좀 더 균일할 수 있도록 용매처리 방법 및 에어브로잉 방법 등에 의한 기공성 조절에 대해서도 연구가 필요하다고 사료된다. Figure 7(d-2), Figure 7(e) 그리고 Figure 7(f)는 바인더 함량에 따른 고형환원제의 제조 후 그들의 표면특성을 확인한 결과이다. 바인더로서 중량평균분자량이 31000~50000인 PVA를 각각 2, 10 그리고 20 wt% 사용하여 제조된 고형환원제, 60-2PVA50K, 60-10PVA50K, 그리고 60-20PVA50K의 소성 후 이미지들이다. 열분해 처리 시 PVA의 제거량이 달라지므로 고형환원제에 PVA의 양이 많아질수록 표면에 기공 형성이 증가함을 확인할 수 있었다. Figure 8은 바인더의 분자량과 함량을 각각 Mw=31000~50000, 2 wt%로 일정하게 하고 Ca(OH)2/SiO2의 함량을 달리하여 제조된 고형환원제의 표면 특성 결과이다. Ca(OH)2의 함량이 많아질수록 소성 후 기공크기가 커짐을 확인하였고 이는 후에 언급되는 BET 측정결과와도 일치한다.
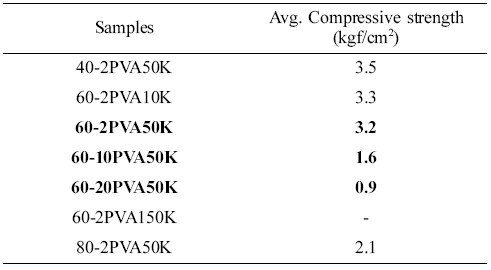
제조된 고형환원제의 강도측정을 위하여 압축강도를 측정한 결과를 Table 2에 나타내었다. 바인더로서 중량평균분자량이 31000~50000인 PVA 2 wt% 사용하고 Ca(OH)2/SiO2의 함량을 달리하여 제조된 고형환원제(40-2PVA50K, 60-2PVA50K, 그리고 80-2PVA50K)의 경우 비표면적이 큰 SiO2 (비표면적: 58.68 m2/g)의 함량이 60, 40, 그리고 20 wt%로 적어질수록 압축강도 값이 3.5에서 2.1 kgf/cm2으로 낮아짐을 확인하였다. 즉, Ca(OH)2의 함량이 많아질수록 소성 후 생기는 기공특성으로 인해 강도가 낮아지는 것으로 설명된다. 이는 SEM의 표면특성 및 BET에 의한 평균세공크기의 실험결과와도 일치한다. Ca(OH)2/SiO2를 60 wt%/40 wt%으로 하고, 바인더로서 중량평균분자량이 31000~50000인 PVA를 사용하여 제조된 고형환원제(60-2PVA50K, 60-10PVA50K, 그리고 60-20PVA50K)의 경우, PVA 함량이 2, 10 그리고 20 wt%로 증가할수록 소성 후 기공의 크기가 많아져 압축강도가 낮아짐을 확인하였다. PVA 함량은 2 wt%로 고정하고 PVA의 분자량의 크기에 따라 고형환원제의 압축강도를 비교한 결과, 분자량 ~10 K와 ~50 K는 3.3과 3.2 kgf/cm2로 비슷한 결과를 보였으나 ~150 K의 경우 육안으로 보았을 때는 형태를 충분히 유지하였으나 큰 분자량의 영향으로 압축강도를 특정할 수 없어 고형환원제로의 의미를 갖지 않는다고 할 수 있다.
따라서 다음의 BET 측정에서는 CaO 함량과 바인더의 함량에 따른 결과만을 측정하였다.
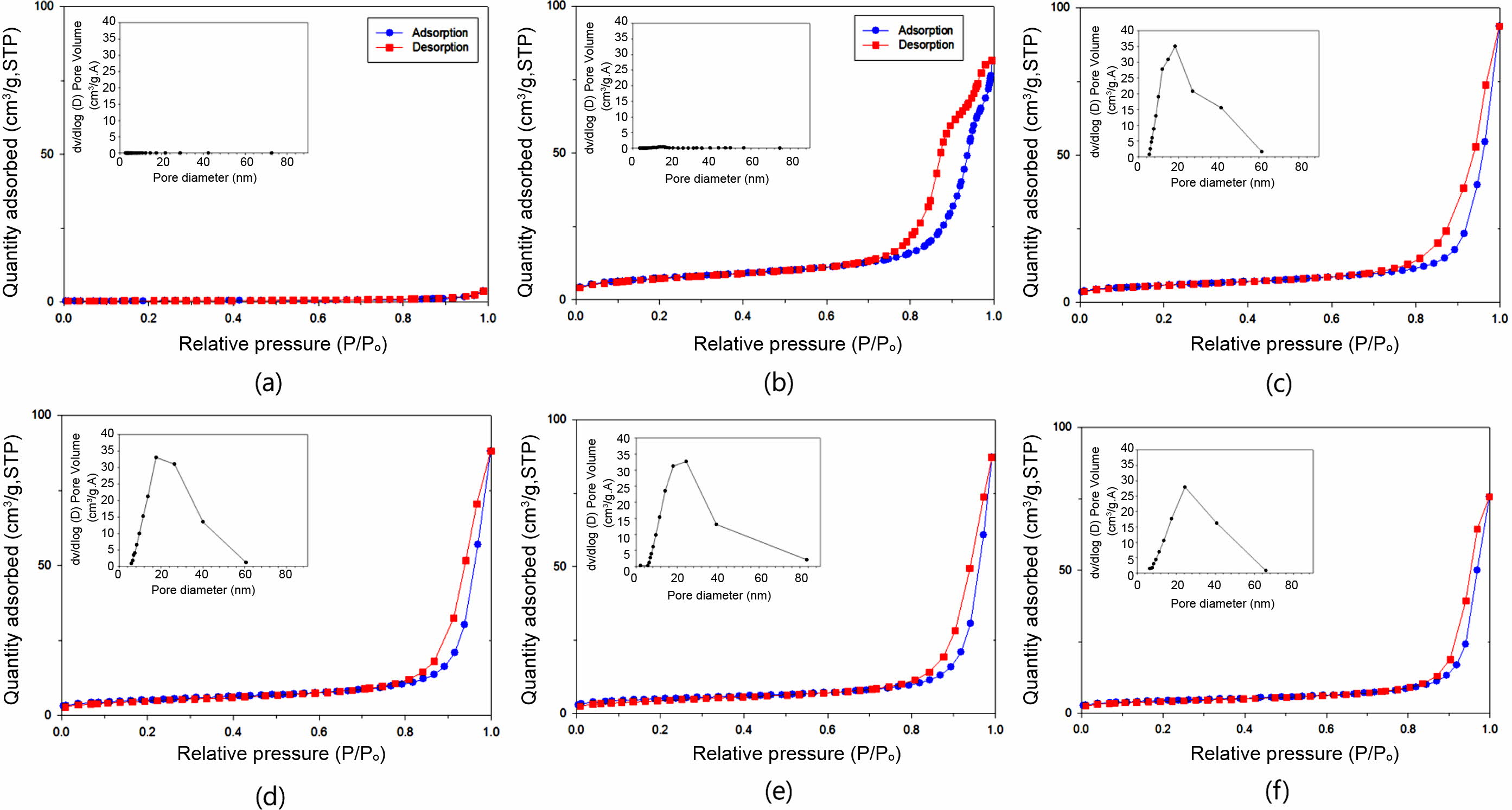
일반적으로 상업용 산화칼슘(CaO)은 비표면적이 2~4 m2/g으로 매우 작은 값을 갖는다. 흡착용 활성물질의 비표면적이 클수록 수분을 흡착하는 능력이 우수하나, 사용 가능한 기계적 물성과 흡착성을 위해서는 적절한 고비표면적을 만족하는 것이 바람직하다. Figure 9는 흡착제로서 바인더를 도입한 고형환원제의 비표면적을 살펴보기 위해 고형환원제들의 질소 흡착-탈착 등온선을 나타내었다. CaO/SiO2 혼합물의 조성비율과 바인더의 함량에 따른 고형환원제들의 비표면적(specific surface area, SSA), 총 세공부피(total pore volume, VT) 그리고 평균 세공직경(average pore diameter, DP)을 나타내었다(Table 3).
질소 흡착-탈착 등온선은 여러 가지 형태가 있으며, 이는 IUPAC에서 정의한 6개 유형의 흡착등온선으로 흡착제의 표면 성질을 해석할 수 있다.21 바인더를 도입한 고형환원제들의 경우 P/P0=0.90~0.95 사이에서 급격한 흡착을 보이며, IUPAC에서 정의한 Type IV 형태로 meso-pore(2~50 nm)임을 확인할 수 있었다. 그리고 CaO/SiO2 혼합물의 조성비율로 비교하였을 때, SiO2의 함량이 많을수록 meso-pore가 발달함을 보여준다(Figure 9(a), 9(b)와 9(e)). 순수 CaO와 열분해된 CaO의 비표면적을 비교한 결과, 상용 CaO는 1.37 m2/g이며, Ca(OH)2의 탈수반응으로 생성된 CaO/SiO2 혼합물의 고형환원제들은 15.63~25.98 m2/g의 특정값을 가짐으로써 비표면적이 증가함을 알 수 있었다. 또한 기공부피도 소성 후 10배 이상 증가함을 확인할 수 있다(Table 3). Figure 9(b)~9(f)의 등온선에서 상용 CaO를 제외한 모든 고형환원제들은 흡착-탈착 등온선들은 히스테리시스(hysteresis) 곡선을 보여주는데, 이는 질소 흡착-탈착 등온선들이 서로 일치되지 않고 어떤 상대압력에서 탈착선이 흡착선 보다 위에 있다. 이러한 히스테리시스의 모양으로 세공 모양과 균일성을 알 수 있으며, 여러 가지 형태의 등온선 중 40-2PVA50K 고형환원제는 H2 형태로 실린더 형태의 기공으로 다른 크기의 기공들이 서로 연결되어 있는 물질 주로 무기산화물에서 많이 발견되며, 60-2PVA50K, 60-10PVA50K, 60-20PVA50K 그리고 80-2PVA50K 고형환원제들은 H3 형태로 판상 입자가 뭉쳐 있거나 slit 모양의 세공을 가지는 것으로 설명할 수 있다.22-25 또한 사용된 SiO2(비표면적: 58.68 m2/g)는 비교적 큰 비표면적을 가지고 있어 혼합물을 제조하는 과정에서 CaO와 응집에 의해(Figure 9) CaO의 함량이 증가할수록 전체적으로 비표면적이 감소됨을 확인할 수 있었다. 따라서 SiO2의 함량이 많을수록, 바인더 함량이 적을수록 비표면적이 증가함을 알 수 있으며, CaO의 농도가 40, 60, 그리고 80 wt%로 증가할수록, 중량평균분자량(Mw) 31000~50000인 PVA(2 wt%)를 바인더로 사용한 고형환원제의 경우 각각 15.88, 26.01, 그리고 29.20 nm로 평균세공크기가 증가함을 확인할 수 있었다. 이는 소성 과정에서 Ca(OH)2에서 CaO로의 탈수반응에 의한 물이 제거됨에 따라 새로운 기공이 형성된 결과라고 사료된다(Table 3).
|
Figure 5 TGA thermograms of (a) Ca(OH)2(60wt%)/SiO2(40wt%)mixture; (b) 60-2PVA50K solid reducing agent before calcination; (c) 60-2PVA50K solid reducing agent after calcination at 650 ℃. Conditions: heat from 30 ℃ to 800 ℃ at a rate of 10 ℃/min in N2. |

|
Figure 6 Surface morphology of (a) CaO/SiO2 composite obtainedby calcination of Ca(OH)2(60 wt%)/SiO2(40 wt%) mixture; (b) 60-2PVA50K solid reducing agent before calcination; (c) 60-2PVA50Ksolid reducing agent after calcination at 650 ℃. |

|
Figure 7 SEM images of the CaO and solid reducing agent sam-ples: (a) commercial CaO; (b) 60-2PVA50K before calcination; (c) 60-2PVA10K; (d) 60-2PVA50K ((d)-1: x500, (d)-2: x200); (e) 60-10PVA50K; (f) 60-20PVA50K; (g) 60-2PVA150K. (c)~(g) solidreducing agent samples were obtained by calcination. |
|
Figure 8 SEM images of the CaO/SiO2 samples: (a) 40-2PVA50K;(b) 60-2PVA50K; (c) 80-2PVA50K. (a)~(c) solid reducing agentsamples were obtained by calcination. |
|
Figure 9 Nitrogen adsorption/desorption isotherm of solid reducing agent samples: (a) CaO; (b) 40-2PVA50K; (c) 60-2PVA50K; (d) 60-10PVA50K; (e) 60-20PVA50K; (f) 80-2PVA50K. |
|
Table 2 Average Compressive Strength for Solid ReducingAgents |
Test speed : 10mm/sec, temp.: 25 ℃. |
|
Table 3 BET Surface Areas (SSA), Total Pore Volumes (VT), and Average Pore Diameters (DP) of Various Solid ReducingAgent Samples |
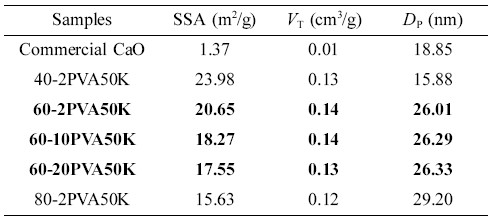
본 연구에서는 불화수소(HF) 제거용 고형환원제 제조를 위하여 지지체로서 소수성 실리카와 Ca(OH)2를 도입하여 CaO/SiO2 혼합물을 제조한 후, PVA 바인더를 사용하여 meso-pore 및 macro-pore가 발달된 구형 다공성 복합구조체인 고형환원제를 제조하고 그들의 특성을 조사하였다. 열적 특성을 확인하여 기공률을 높이기 위한 소성조건을 650 ℃로 결정하였다. 바인더의 함량이 증가할수록 기공형성이 증가하였고 비표면적이 감소하며 압축강도가 낮아짐을 확인할 수 있었다. 바인더의 분자량이 커질수록 기공의 크기는 평균 91±5, 143±8 그리고 191±11 µm로 따라 커지고 압축강도는 현저히 낮아지는 경향을 보였다. 흡착용 활성물질의 비표면적이 클수록 수분을 흡착하는 능력이 우수하나, 사용 가능한 기계적 물성과 흡착성을 위해서는 적절한 고비표면적을 만족하는 것이 바람직하다. 따라서 종합하여 보면, CaO의 농도가 60 wt%인 혼합물에 중량평균분자량이 31000~50000인 PVA 바인더 2 wt%가 사용된 고형환원제(60-2PVA50K)의 경우 압축강도(CS= 3.2 kgf/cm2), 비표면적(SSA=20.65 m2/g) 및 기공도(평균세공직경, Dp=26.01 nm)가 최적화되는 것으로 판단된다.
향후 이러한 결과들을 바탕으로 RE-RSC(reaction-enhanced regenerative catalytic system) 반응기에서14 HF 흡착능력에 대한 성능평가 및 특성연구를 하고자 한다.
- 1. C. F. Yang, S. H. Kam, C. H. Liu, J. Tzou, and J. L. Wang, Chemosphere, 76, 1273 (2009).
-

- 2. C. Y. Choi, J. B. Kim, and S. J. Lee, J. KSEE, 34, 391 (2012).
-

- 3. L. Qin, J. Han, G. Wang, H. J. Kim, and I. Kawaguchi, EPPH Conference(China), June 21-23, Chengdo, China (2010).
- 4. S. Kanno, S. Tamata, and H. Kurokawa, 227th ACS Meeting (USA), March 28 ~ April 1, Anaheim, CA (2004).
-

- 5. S. S. Choi, D. W. Park, and T. Watanabe, Nucl. Eng. Technol., 44, 21 (2014).
-

- 6. C. M. Lee, S. C. Oh, H. P. Lee, H. T. Kim, and K. O. Yoo, Korean J. Chem. Eng., 37, 430 (1999).
- 7. C. Ngamcharussrivichai, W. Meechan, A. Ketcong, K. Kangwansaichon, and S. Butnark, J. Ind. Eng. Chem., 17, 587 (2011).
-

- 8. Z. Tang, D. Claveau, R. Corcuff, and K. Belkacemi, Mater. Lett., 62, 2096 (2008).
-

- 9. M. A. Alavi and A. Morsali, J. Exp. Nano, 5, 93 (2010).
-

- 10. Y. Zhu, S. Wu, and X. Wang, Chem. Eng. J., 175, 512 (2011).
-

- 11. S. Assabumrungrat, P. Sonthisanga, W. Kiatkittipong, N, Laosiripojana, A. Arpornwichanop, A. Soottitantawat, W. Wiyaratn, and P. Praserthdam, J. Ind. Eng. Chem., 16, 785 (2010).
-

- 12. S. S. Choi, D. W. Park, and T. Watanabe, Nucl. Eng. Technol., 44, 21 (2014).
-

- 13. Y. Yanagisawa, H. Shimodama, and A. Ito, J. Chem. Soc., Chem. Commun., 610 (1993).
-

- 14. J. S. Sohn, S. G. Roh, J. Y. Sohn, M. H. Lim, T. Sadhasivam, H. K. Lim, S. K. Ryi, and H. Y. Jung, Adv. Compos. Mater., 28, 65 (2019).
-

- 15. X. F. Lei and J. X. Ma, J. Braz. Chem. Soc., 21, 209 (2010).
-

- 16. D. Y. Kim, Y. S. Kim, S. H. Cho, J. Y. Jung, M. I. Kim, and Y. S. Lee, Appl. Chem. Eng., 24, 587 (2013).
- 17. H. H. An, KIGAS, 14, 35 (2010).
- 18. W. C. Oh, Anal. Sci. Technol., 13, 332 (2000).
- 19. Z. X. Tang, Z. Yu, Z. L. Zhang, X. Y. Zhang, Q. Q. Pan, and L. E. Shi, Nova, 36, 993 (2013).
-

- 20. B. J. Holland and J. N. Hay, Polymer, 42, 6775 (2001).
-

- 21. S. Brunauer, L. S. Deming, W. E. Deming, and E. Teller, J. Am. Chem. Soc., 62, 1723 (1994).
-

- 22. C. Rodriguez-Navarro, E. RuizAgudo, M. Ortega-Huertas, and E. Hansen, Langmuir, 21, 10948 (2005).
-

- 23. U. D. Joshi, P. N. Joshi, S. S. Tamhankar, V. P. Joshi, B. B. Idage, V. V. Joshi, and V. P. Shiralkar, Acta, 387, 121 (2002).
-

- 24. S. Brunauer, P. H. Emmett, and E. Teller, J. Am. Chem. Soc., 60, 309 (1938).
-

- 25. F. Rouquerol, J. Rouquerol, and K. Sing, Adsorption by Powders and Porous Solids, Academic Press Inc., NewYork, p. 191 (1999).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(3): 379-386
Published online May 25, 2019
- 10.7317/pk.2019.43.3.379
- Received on Jan 9, 2019
- Revised on Feb 8, 2019
- Accepted on Feb 20, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jeong Sun Sohn
-
Division of Undeclared Majors, College of General Education, Chosun University, Gwangju 61452, Korea
- E-mail: jss4347@chosun.ac.kr
- ORCID:
0000-0002-4473-233X









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.