- Development of Shark Cartilage Extracts Loaded Hydrogel for the Stomatitis Treatment
Eun-Jee Park#, Min-Suk Kook*,#, Jin Kim**,†
 , and Ki-Young Lee***,†
, and Ki-Young Lee***,† 
Department of Advanced Chemicals and Engineering, Chonnam National University, Gwangju 61186, Korea
*Department of Oral and Maxillofacial Surgery, Chonnam National University School of Dentistry, Gwangju 61186, Korea
**Department of Oral and Maxillofacial Surgery, College of Dentistry, Chosun University & Institute of Dental Science,
Chosun University, Gwangju 61452, Korea
***School of Chemical Engineering, Chonnam National University, Gwangju 61186, Korea- 상어 연골 추출물이 함유된 구내염 치료용 하이드로젤의 개발
전남대학교 신화학소재공학과, *전남대학교 치의학 전문대학원 구강악안면외과학교실, **조선대학교 치과대학 구강악안면외과학교실 & 조선대학교 치의학연구원, ***전남대학교 화학공학부
oly(vinyl alcohol) (PVA) hydrogel containing shark cartilage extract was prepared by freezing-thawing method for the treatment of stomatitis. The properties of hydrogel were evaluated by FTIR (Fourier transform infrared spectroscopy), EDS (energy-dispersive X-ray spectroscopy), surface pH, contact angle, and bio-adhesive strength. PVA/SCE hydrogel was found to have adhesion in the oral mucous membrane. PVA/SCE (shark cartilage extracts) hydrogel was attached to a hamster with oral ulcers. We have identified a higher ulcer healing effect with the treatment of the PVA/SCE hydrogel than the control group.
구내염 치료를 위해 상어 연골 추출물(SCE)을 포함하는 poly(vinyl alcohol)(PVA) 하이드로젤을 동결-융해 방법으로 제조하였다. 하이드로젤의 특성은 FTIR(Fourier transform infrared spectroscopy), EDS(energy-dispersive X-ray spectroscopy), 표면 pH, 접촉각, 생체점착강도를 통해 평가하였다. PVA/SCE 하이드로젤은 PVA 하이드로젤보다 구강점막에 대해 점막점착력이 있는 것을 확인하였다. 시리안 햄스터에 구강궤양을 유발한 후 PVA/SCE(shark cartilage extracts) 하이드로젤을 처치했을 때 대조군 그룹보다 높은 궤양 치유 효과를 확인하였다.
Keywords: poly(vinyl alcohol), hydrogel, shark cartilage, stomatitis, oral delivery system
이 논문은 2015년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No.2015H1 C1A1035894), 2016년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No. 2016R1A6A 3A11935439). 전남대병원 의생명연구원 연구비 지원에 의하여 이루어졌음(CRI 17010-1).
상어 연골 성분 중 하나인 chondroitin sulfate(CS)는 포유류의 연골에서 발견되는 천연 고분자로, sulfated glycosaminogl-ycans(GAGs) 유도체이다. N-acetylgalactosamine과 glucuronic acid로 구성되어 있으며 카복실기와 설페이트 그룹으로 인해 강한 음전하를 띤다. Chondroitin sulfate는 생체점착성이 있어 약물 흡수를 위한 시간을 증가시키고 환자에게 약물투여 횟수를 감소시켜 치료에 대한 순응도를 향상시킨다고 알려져 있다.24 또한 혈액응고작용, 항염증, 세균감염 억제작용 등의 효과가 있다고 보고되었다.25 Glycyrrhizin과 그 유도체인 dipotassium glycyrrhizinate는 친수성 약물로 화학유인물질인 HMGB1 단백질과 유사분열촉진 활성을 억제하는 천연 항염 및 항바이러스성 트리테르펜이다.26 본 연구에서는 구내염의 치료약물 dipotassium glycyrrhizinate가 담지된 상어 연골 추출물과 PVA를 혼합하여 동결-융해(freeze-thaw)에 의해 3차원 네트워크를 가진 하이드로젤을 제조하고 물성을 분석하였다. 동물실험을 통해 상어 연골 추출물을 함유한 PVA 하이드로젤의 구강궤양치료효과를 관찰하여 생채재료로서 활용 가능성을 제시하고자 한다.
상어 연골 추출물 제조. 3 kg의 상어 연골을 물로 헹궈 핏물을 제거한 후 0.2 N acetic acid 수용액에 6시간 동안 침지시켰다. 침지시킨 상어 연골을 꺼내어 12시간 동안 흐르는 물에 중화시켰다. 가열 용기에 상어 연골 무게 10배의 물을 채워 가열한 후 가열과정에서 생성되는 불순물을 채로 걸렀다. 일정량으로 농축되면 가열을 멈추고 식힌 뒤 12000 rpm에서 15분간 원심 분리하여 상층액을 채로 걸러 정제하였다. 이 후 -70 ℃에서 냉동시킨 뒤 동결건조하였다. 동결건조된 추출물을 분쇄기에 갈아 분말 형태로 만들어 실험에 사용하였으며 이 추출물을 SCE(shark cartilage extract)라고 명명하였다.
PVA/SCE 하이드로젤 제조. 예비실험으로 PVA를 5, 10, 15%로 하여 하이드로젤을 제조한 후 UTM을 이용하여 기계적 물성을 측정하였다. 하이드로젤을 구내에 처치하였을 때 오랜기간 동안 형태를 유지하면서 염증 부위에 약물을 방출할 수 있도록 가장 물성이 높은 15%의 PVA를 선택하였다. 15%의 PVA를 90 ℃에서 천천히 교반시키면서 1시간 동안 용해시킨 후 121 ℃의 고압멸균기(AC-13, Lab. Companion, Korea)를 이용하여 용해시켰다. PVA 용액에 SCE의 농도가 0, 1, 2, 4 wt%가 되도록 고정한 후, 0.1 wt% dipotassium glycyrrhizinate을 첨가 후 용해시켰다. 조성별로 제조된 PVA/SCE 용액에 petri dish에 붓고 기포를 제거한 뒤 -70 ℃에서 3시간 동결 후, 상온에서 6시간 해동하여 하이드로젤을 제조하였다.
FTIR, EDS 분석. 작용기 분석을 위해 SCE, PVA/SCE 하이드로젤을 푸리에 변환 적외선 분광기(FTIR)을 이용하여 4000~600 cm-1의 파장영역에서 측정하였다. 또한 정밀한 성분분석을 위해 하이드로젤을 에너지분산 X-선 분광계(EDS)를 이용하여 원소분석을 실시하였다.
표면 pH. PVA/SCE 하이드로젤의 표면 pH를 측정하기 위해 각 조성당 5개의 시료를 준비하여 pH 6.8 인산염 완충액이 담긴 petri dish에 120분 동안 침지시켰다. 팽창된 하이드로젤의 표면 pH는 pH Meter(8100, ETI Ltd., UK)를 사용하여 측정하였다. pH Meter의 전극을 하이드로젤의 표면에 접촉시킨 후 1분 동안 평형을 이루게 한 후에 측정하였다.27
접촉각 측정. PVA/SCE 하이드로젤의 습윤 특성을 알아보기 위해 contact angle analyzer(Phoneix-Smart, Surface Electro Optics, Korea)를 사용하여 접촉각을 측정하였다. 접촉각 측정기에 장착된 주사기에 증류수를 채워 사용하였고 접촉각 측정은 각도가 일정하게 유지될 때까지 기다린 후 측정하였다. 5회 반복하여 평균값을 사용하였다.
생체점착강도 측정. UTM(universal testing machine, TO-102D, Test one, Korea)을 사용하여 하이드로젤의 구강 점막에 대한 점착 강도를 측정하였다. 햄스터로부터 구강점막을 채취한 후 멸균생리식염수로 세척하여 사용하였다. 채취한 구강점막을 cyanoacrylate adhesives(Sigma Aldrich, USA)를 사용하여 인장시험기의 상단과 하단에 부착시켰다. 시험물질의 크기는 1 cm×1 cm로 준비하였고 부착된 두 개의 점막과 5분 동안 접촉시켰다. Loadcell은 10 kgf, cross head의 속도는 10 mm/min으로 설정하였고 시험물질과 점막이 완전히 분리될 때까지 측정하였다. 본 실험은 전남대학교 용봉캠퍼스 동물실험윤리위원회에서 승인을 받아 시행되었다(CNU IACUC-YB-R-2017-66).
약물방출 실험. KG를 포함하는 하이드로젤을 pH 6.8 phosphate buffer에 넣고 방출되는 약물을 측정하였다. Shaking incubator(HB-201SF, Hanbaek Co., Korea)에서 속도는 100 rpm, 온도는 37 ℃로 유지하면서 일정 시간마다 1 mL의 방출 용액을 채취한 후 동량의 fresh buffer를 보충해주었다. 방출 용액에 함유된 약물의 농도는 HPLC로 측정하였으며, KG를 pH 6.8 phosphate buffer에 용해시켜 HPLC로 분석하여 농도와 피크면적으로부터 검량선을 작성하였다.
세포독성 평가. 세포 생존율을 측정하기 위해 MTT assay을 실시하였다. NIH-3T3 섬유아세포는 37 ℃, 5% CO2 incubator에서 배양하였으며 10% FBS와 1% Pen Strep이 첨가된 DMEM 배지를 사용하였다. 96 well plate에 배양된 NIH-3T3 세포를 5×104 cells/mL 만큼 분주하고 24시간 동안 배양하였다. ISO 10993-12에 의거하여 제조한 PVA/SCE 하이드로젤을 DMEM 배지에 담가 37 ℃에서 24시간 용출액을 사용하였다. 용출액을 농도별로 희석하여 배양된 세포에 처리하였다. 24시간 후 0.5% MTT(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide)용액을 각 well에 20 μL씩 처리하여 37 ℃에서 4시간 동안 배양하였다. 이 후 MTT 용액과 배지를 제거하고 DMSO 100 μL을 첨가한 후 ELISA reader(Bio-Tek, USA)을 이용하여 570 nm 파장에서 흡광도를 측정하였다.
Nitric Oxide 소거능 측정. 항염 효과를 확인하기 위해 Nitric Oxide asaay를 실시하였다. 96 well plate에 배양된 RAW 264.7 세포를 5×104 cells/mL 만큼 분주하고 10% FBS와 1% Pen Strep이 함유된 DMEM 배지에서 37 ℃, 5% CO2 조건의 incubator에서 24시간 동안 배양하였다. 약물담지 PVA/SCE 하이드로젤을 DMEM 배지에 담가 37 ℃에서 24시간 용출시켜 사용하였다. 용출액을 농도별로 희석하여 배양된 세포에 처리하여 3시간 동안 배양한 후, LPS를 10 ng/mL로 처리한 후 24시간 동안 배양하였다. 이 후 상등액을 100 μL씩 취하여 새로운 96 well plate에 넣고 동량의 griess reagent(1% sulfanilamid, 0.1% n-(1-naphthyl)-ethylenediamine dihydro-chloride in 2.5% phosphoric acid)와 반응시켜 10분간 상온에서 방치한 후 ELISA reader을 이용하여 570 nm 파장에서 흡광도를 측정하였다.
구강 점막 궤양 치유 실험. 실험동물은 시리안 햄스터(male, 80~110g)를 나라바이오텍(경기도 평택)에서 구입하였다. 사육조건은 온도 20~23 ℃, 상대습도 55±5%, 명암 교대시간은 12시간을 유지하였다. 동물사육장에서 1주간의 적응 기간을 두었으며 실험 전 24시간 동안은 절식시켜 실험에 사용하였다. 본 실험은 전남대학교 용봉캠퍼스 동물실험윤리위원회에서 승인을 받아 시행되었다(CNU IACUC-YB-R-2017-66). 각 그룹당 3마리의 햄스터의 무게를 잰 뒤 알팍산(Alfaxan, Jurox Pty Limited, Australia)과 럼푼(바이엘코리아㈜, Korea)을 1:1 비율로 혼합하여 준비하였다. 투여부위는 복부 정중선을 중심으로 대퇴부분에 있는 복부 좌우로 복부에 평행하게 피하에 주사침을 5 mm 정도 찌른 뒤, 주사침을 45o 정도 세워서 복강 내로 찌른다. 햄스터의 양측 볼 주머니를 핀셋으로 잡아당겨 꺼낸 다음 점막에 0.5 cm×0.5 cm 크기로 창상을 유발한 후 좌측에는 시험물질을, 우측에는 대조물질을 적용시켰다. 햄스터가 시험물질을 뱉어내지 못하도록 목밴드를 착용시켰다. 창상을 유발한 후로부터 1, 3, 5, 9, 14일째에 digital camera를 이용하여 촬영하였다. 촬영한 이미지에서 창상부위를 잘라내어 이미지 분석 프로그램인 ImageJ를 사용하여 궤양 면적을 수치로 산출하였다. 창상치유율(ulcer healing rate)은 창상을 유발했을 때의 궤양 크기를 기준으로 하여 각 군의 치유기간 동안의 치유율을 백분율로 계산하여 도출하였다.
통계 처리. 모든 실험은 3회 이상 반복하였고 결과 데이터는 평균값(mean)과 표준편차(standard deviation, SD)로 표시하였다. 대조군과 실험군의 통계적 검정에는 t-test를 이용하였고 *p<0.05, **p<0.01에서 유의성을 판단하였다.
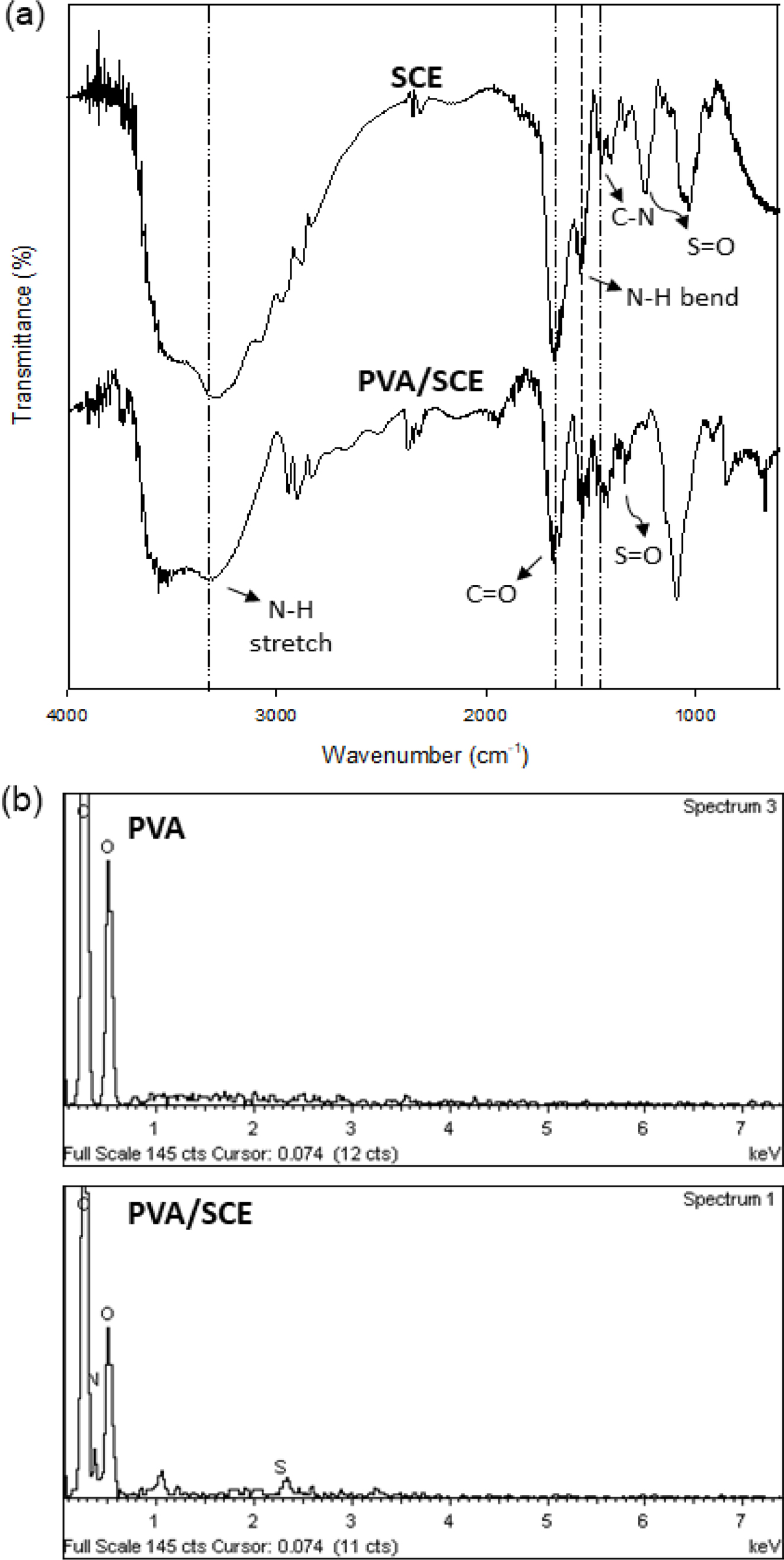
FTIR, EDS 분석. 제조한 PVA/SCE 하이드로젤의 구조적 특성 확인을 위해 FRIR을 사용하여 분석한 결과는 다음과 같다(Figure 2). SCE에서 chondroitin sulfate가 나타내는 특징적인 피크와 단백질에서 관찰되는 피크가 관찰되었다. Chondroitin sulfate의 3280 cm-1(–OH group), 3100 cm-1(–N–H stretching), 1660 cm-1(–C=O stretching), 1560 cm-1(N–H bending vibration), 그리고 1240 cm-1(R–OSO2–O−)가 확인되었다.28 PVA/SCE 하이드로젤에서 –N–H stretching, N–H bending vibration, C-N stretching, R–OSO2–O stretching이 각각 3308, 1560, 1456, 1248 cm-1에서 나타났다. 또한 EDS 분석을 통해 PVA 하이드로젤에 존재하지 않는 PVA/SCE 하이드로젤에서 S(황), N(질소)의 피크를 추가적으로 확인하였다. FTIR 및 EDS 결과는 PVA/SCE 하이드로젤 내 chondroitin sulfate의 존재를 통해 PVA 하이드로젤에 chondroitin sulfate의 성분을 확인할 수 있었다.
표면 pH. 산성 또는 알칼리성의 pH는 구강 점막에 자극을 유발할 수 있으며 약물방출 및 고분자의 수화도에 영향을 줄 수 있다. 조성별로 제조한 PVA/SCE 하이드로젤 표면의 pH를 측정한 결과 모두 타액의 pH에 가까워 구강점막에 대한 자극성은 낮은 것으로 판단하였다(Table 1).
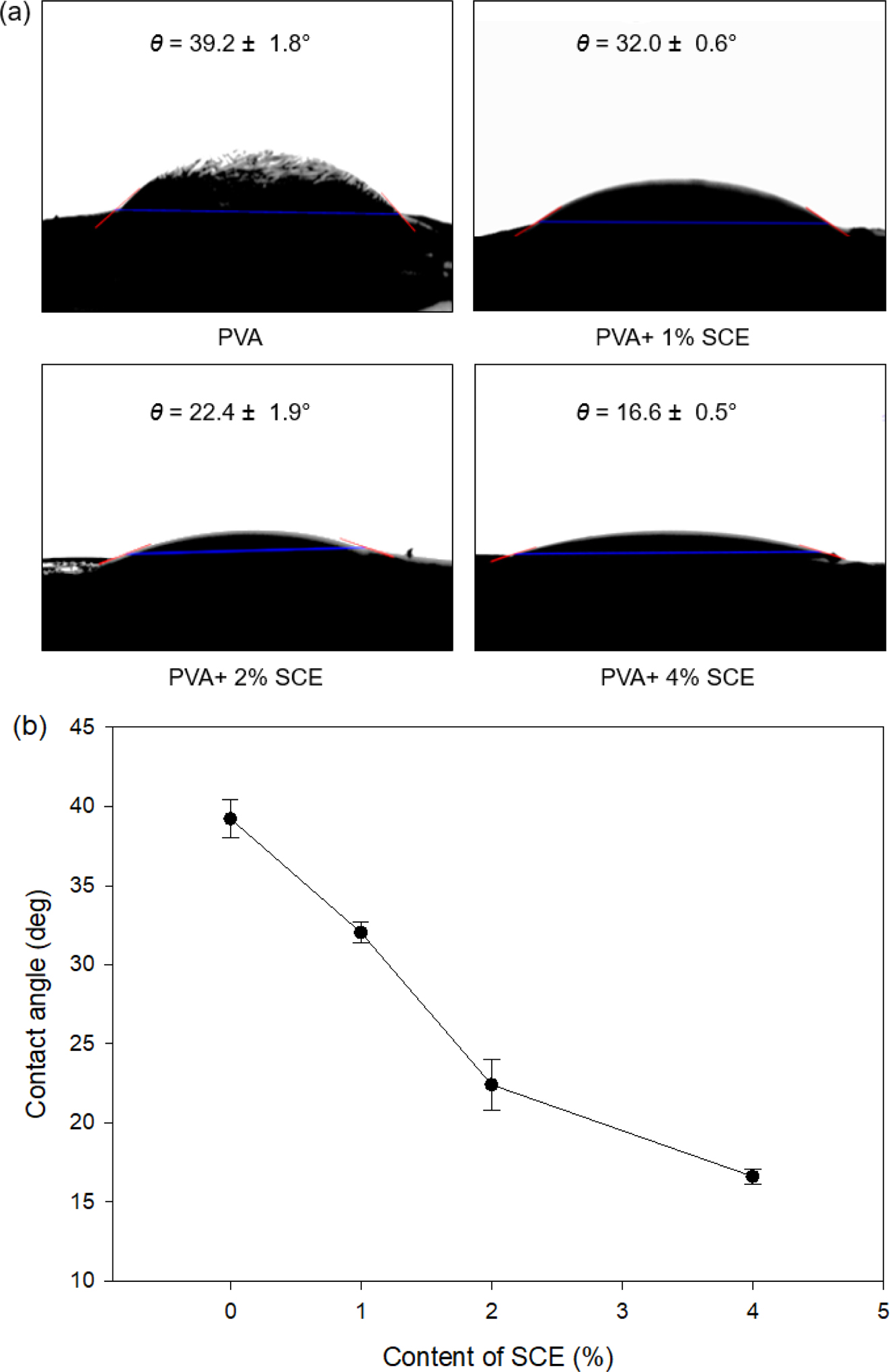
접촉각 측정. PVA/SCE 하이드로젤의 습윤성을 알아보기 위해 접촉각 측정 결과를 Figure 3과 같이 나타내었다. 친수성인 중합체일수록 높은 계면 자유 에너지로 인해 계면과 친밀한 접촉이 이루어지고, 이는 접촉각을 낮추게 한다.10 PVA/SCE 하이드로젤의 SCE의 함량이 높을수록 하이드로젤에 접촉된 물방울의 퍼짐현상과 함께 접촉각이 감소하는 경향을 보였다. 이는 카복실기와 설페이트 그룹으로 인해 강한 음전하를 띠고 있는 chondroitin sulfate가 PVA 수용액에서 물분자와의 수소결합 수를 증가시키기 때문이라고 사료된다. 이를 통해 PVA 수용액에 SCE의 함량이 증가할수록 하이드로젤의 수분 함유량을 증가시켜 친수성을 향상시켰음을 알 수 있었다. 하지만, 과도한 수분은 점착 없이 미끄러운 점액만을 형성한다.29
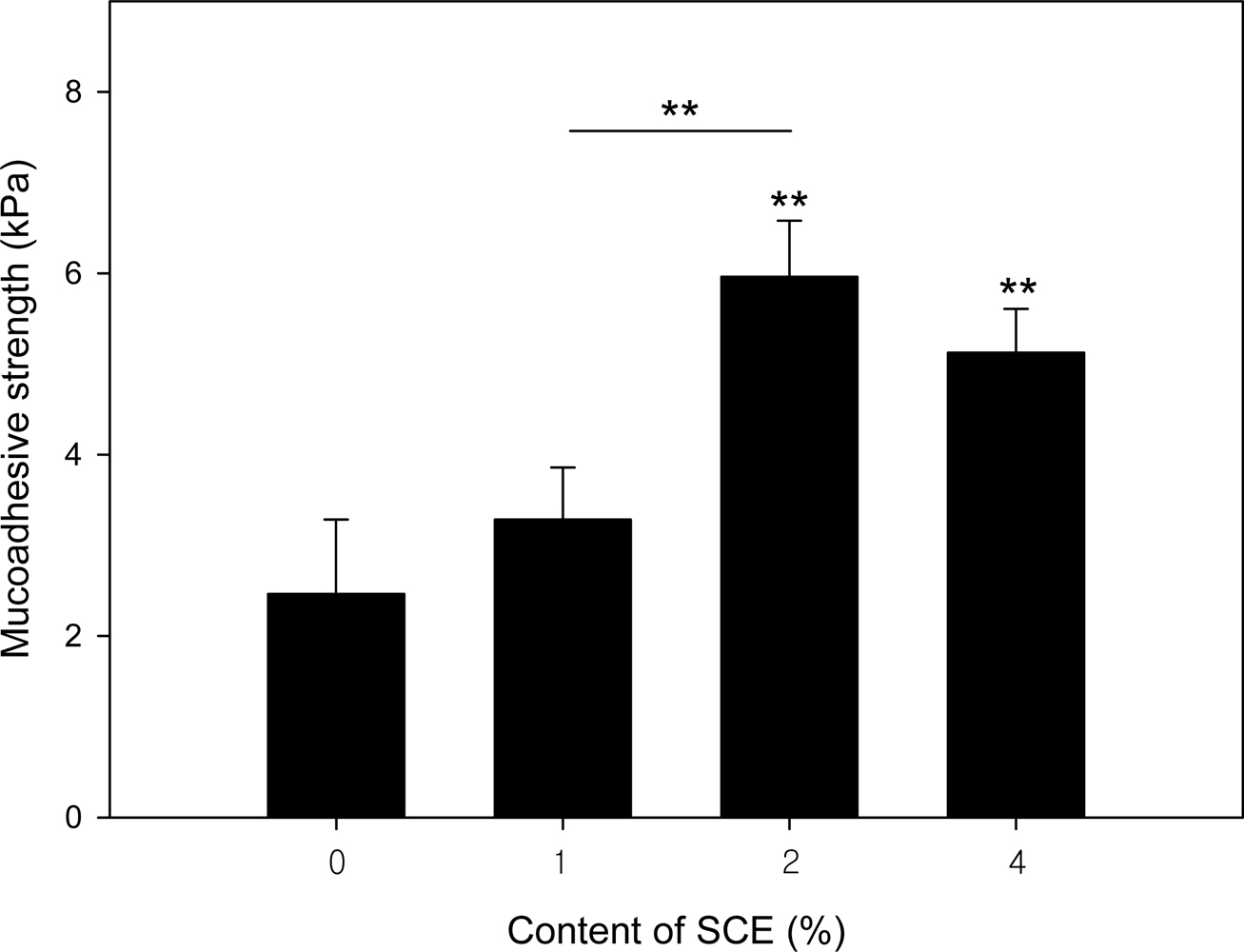
생체점착강도 측정. 생체 내 최대 점막점착력을 확인하기 위해 UTM을 사용하여 제조한 하이드로젤의 구강 점막에 대한 점착강도를 측정하였다(Figure 4). PVA 하이드로젤의 점막점착력은 2.46±0.82 kPa로 가장 낮았으며 SCE의 함량이 1%에서 2%로 증가함에 따라 3.29±0.57에서 5.96±0.62 kPa로 증가하였다. 그리고 SCE의 함량이 4%일 때는 5.12±0.48 kPa로써 점막점착력은 2%에서 최대를 보였다. Ahuja는30 최대의 점막접착력에 대한 최적의 중합체 농도가 있다고 밝혔다. 고도로 농축된 시스템에서는 최적의 농도를 넘으면 접착력이 현저하게 떨어진다.31 즉, 고농축 용액에서 나선형 분자는 용매가 부족해지고 상호 침투를 위해 이용 가능한 사슬 수가 제한되어 점착강도가 크게 감소한다.32 또한 PVA 수용액에 대한 SCE의 함량이 증가함에 따라 하이드로젤의 친수성은 증가하지만 2% 이상에서는 chondroitin sulfate의 가교수 증가에 따라 개별 고분자 사슬의 이동성이 떨어지고 점액층으로 침투할 수 있는 사슬의 유효 길이가 감소하여 생체점착강도 또한 감소시켰을 것이라 사료된다.31 따라서 최대 점막점착력을 갖는 PVA/2% SCE 하이드로젤은 높은 점막접착력으로 인해 약물 전달 시 약물의 체류 시간을 연장시킬 수 있을 것이라 판단된다.
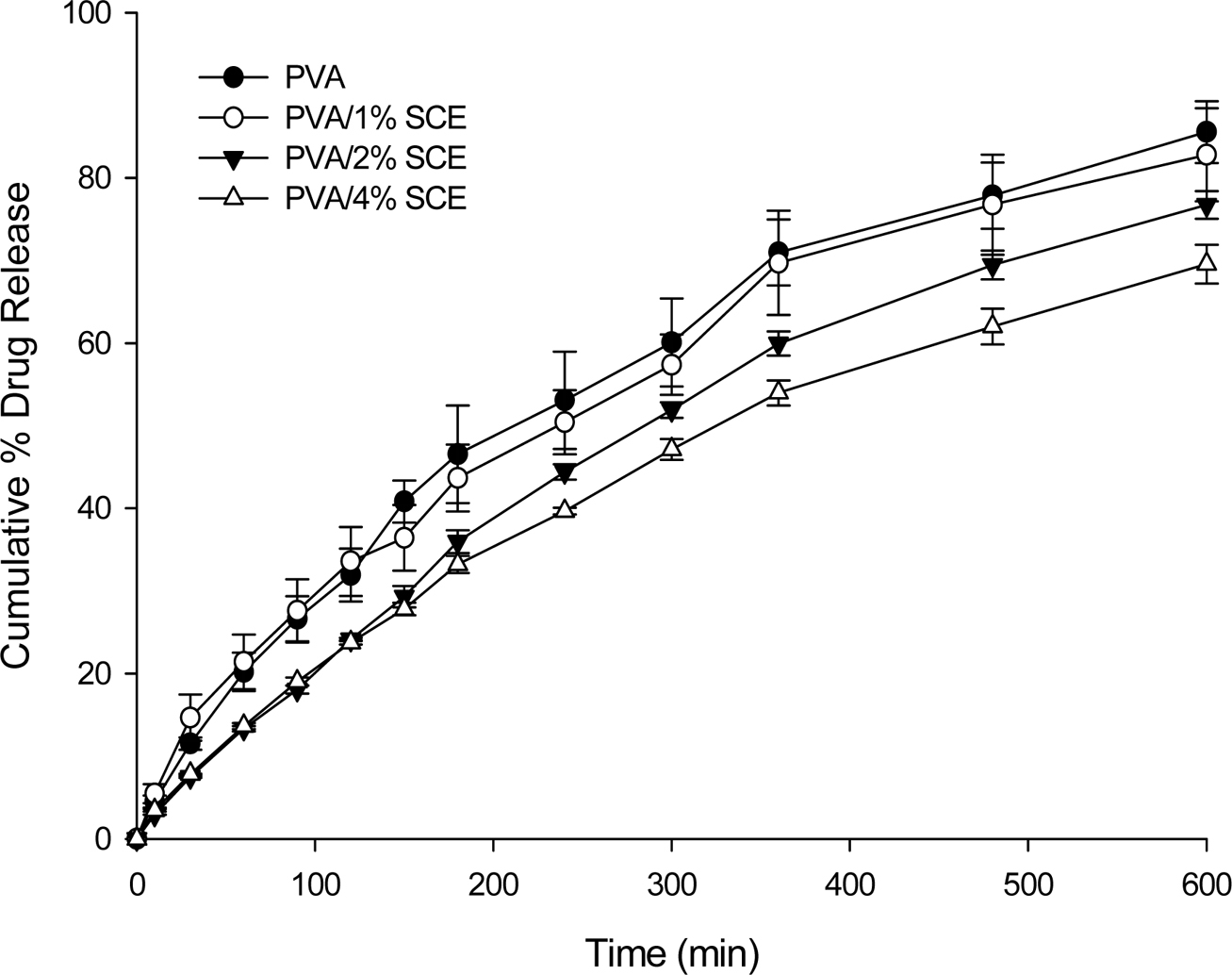
약물방출 실험. HPLC를 사용하여 제조한 하이드로젤로부터 구내염 치료약물인 KG의 약물방출 실험을 진행하였다. 실험결과 PVA/SCE 하이드로젤의 SCE 함량이 증가함에 따라 방출속도가 감소하였다(Figure 5). 이는 SCE가 약물과 하이드로젤 매트릭스 사이의 상호작용을 향상시켜 방출량 및 방출속도를 감소시켰을 것이라 사료된다.
세포독성 평가. 구내염 약물이 담지된 PVA/SCE 하이드로젤을 농도별로 세포독성을 분석하기 위하여 각 조성을 일정시간 용출시키고 실험에 사용하였다. 각 조성에 따른 하이드로젤의 농도별 용출액은 모든 농도에서 80% 이상으로 독성이 거의 없었다(Figure 7). 본 실험에 이용된 PVA/SCE 하이드로젤은 세포 독성이 없는 생체 소재로 체내 삽입이 가능하며, 다양한 종류의 약물을 담지시킨 약물담지시스템으로 응용 가능할 것으로 사료된다.
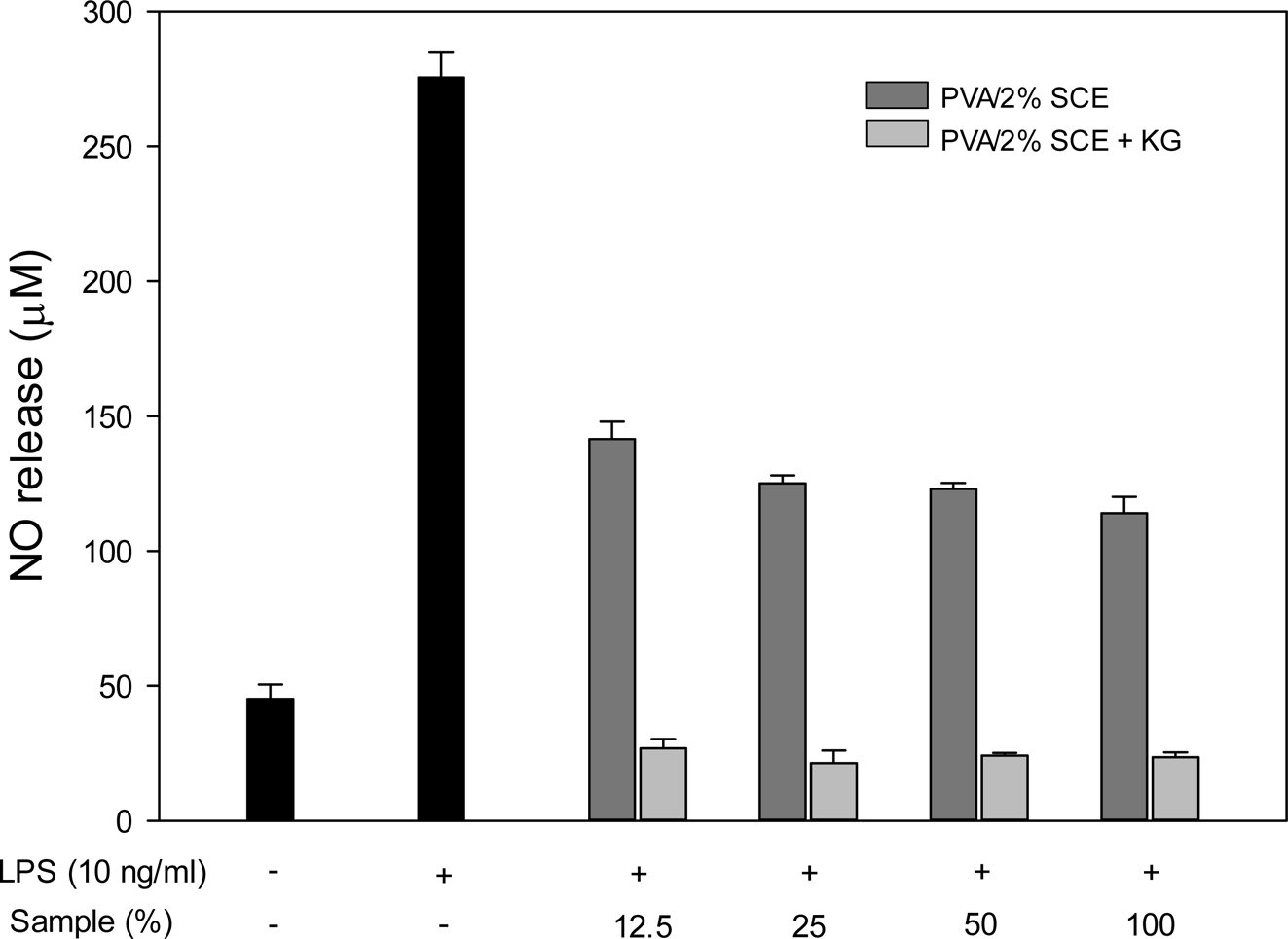
Nitric oxide 소거능 측정. Nitric oxide(NO)는 생체 내에서 중요한 세포신호전달물질로서 작용하나 과잉 생산 시 산화적 스트레스의 유발을 통해 염증 및 세포 손상의 원인이 된다.33 대식세포가 lipopolysaccharide(LPS)로 자극되면 inducible nitric oxide synthase(iNOs)의 발현에 영향을 주어 많은 양의 NO를 발생시킨다. PVA/SCE 하이드로젤이 유발된 RAW 264.7 세포의 NO 생성에 미치는 영향을 분석하였다(Figure 7). 실험군으로 PVA/2% SCE 하이드로젤의 용출물을 사용하였다. LPS를 처리한 후 NO의 생성량은 45.17±5.37에서 275.60±9.48 μM로 약 6배 이상 증가되었다. 하이드로젤 용출물의 농도를 12.5, 25, 50, 100%로 세포에 처리하여 NO 소거능을 측정하였다. KG가 첨가되지 않은 PVA/2% SCE 하이드로젤은 각각 141.5, 125.0, 123.0, 114.0 μM로 측정되었다. KG가 첨가된 PVA/2% SCE 하이드로젤은 26.8, 21.3, 24.1, 23.6 μM로 KG의 항염 효과로 인해 더 높은 NO 소거능을 보였다. PVA/2% SCE 하이드로젤은 모든 농도에서 NO 형성이 억제되었으며, 농도가 증가함에 따라 NO 소거능도 증가한 것을 볼 수 있었다. 따라서 제조한 하이드로젤이 염증매개물질인 NO를 억제하는 것으로 보아 염증 및 인체 질환의 치료에 도움이 될 수 있을 것이라 사료된다.
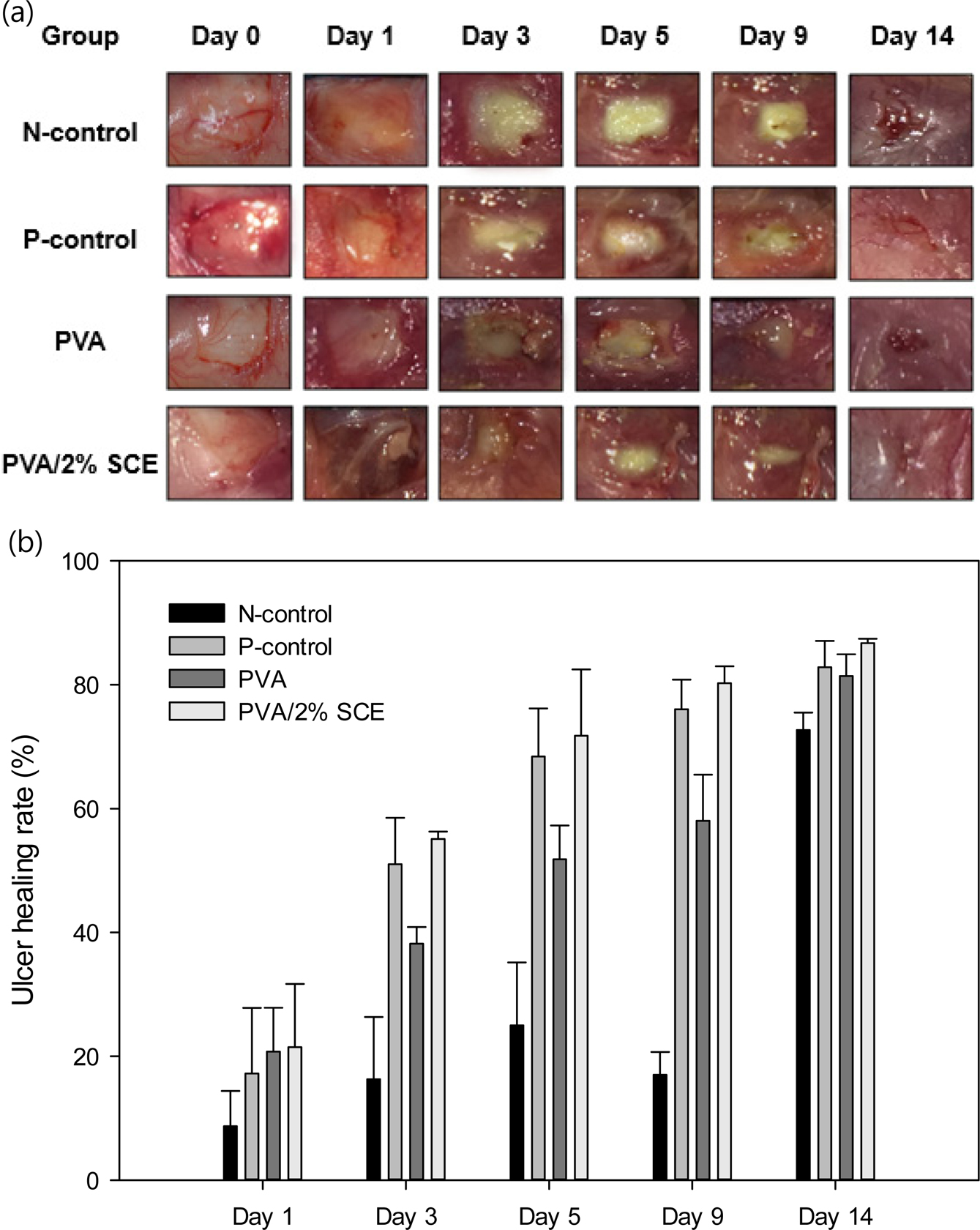
구강점막 궤양 치유 실험. In vitro 실험결과에 따라 PVA/2% SCE을 실험군으로 선택하였다. 시리안 햄스터의 구강점막에 창상을 유발한 후, 좌측 볼에는 대조군으로 양성대조군(Taisho®-A, PVA)과 음성대조군(무처치)을 처리하였고 우측 볼에는 실험군을 처리하였다. 창상을 유발한 후로부터 1, 3, 5, 9, 14일이 경과하였을 때 이미지 분석 프로그램인 ImageJ를 사용하여 궤양 크기를 측정하였다. 1, 3, 5, 9, 14일 후의 햄스터 구강점막 궤양의 모습과 면적을 Figure 8에 나타내었다. 창상유발 후 1일째 모든 그룹에서 궤양이 형성된 것을 관찰할 수 있었으며, 3일째부터 치유속도의 차이를 육안으로 관찰할 수 있었다(Figure 9(a)). Figure 9(b)는 창상을 유발했을 때의 궤양 크기를 기준으로 하여 각 군의 치유기간 동안의 치유율을 백분율로 계산한 결과이다. PVA/2% SCE를 처리한 군은 치유기간 동안 양성대조군(Taisho®-A, PVA)과 음성대조군(무처치)보다 치유속도 및 치유율이 높았다. 모든 군에서 14일째 가장 높은 치유율을 보였고, PVA/2% SCE를 처리한 군이 86.71±0.71%로 음성대조군(무처치)보다 1.19배 높았고 양성대조군인 Taisho®-A보다 1.04배, PVA보다 1.06배 높은 치유 효과를 나타냈다.

|
Figure 1 Figure 1. Photographs of PVA/SCE hydrogels. |
|
Figure 2 Figure 2. (a) FTIR spectra of PVA/SCE hydrogel in comparison with the spectra of pure SCE; (b) EDS spectra of PVA/SCE hydrogel in comparison with PVA hydrogel, which confirm the presence |
|
Figure 3 Figure 3. (a) Photographs of a water droplet on the surface of the PVA/SCE hydrogels; (b) contact angles of the surface of the PVA/SCE hydrogel versus SCE weight proportion. |
|
Figure 4 Figure 4. Mucoadhesive strength of the PVA/SCE hydrogels. *p<0.05; **p<0.01. |
|
Figure 5 Figure 5. In vitro release profiles of drug from PVA/SCE hydrogels in pH 6.8 phosphate buffer at 37 ℃. |
|
Figure 7 Figure 7. Effect of the extracts of PVA/2% SCE hydrogel and PVA/2% SCE hydrogel containing KG on nitric oxide production from RAW 264.7 cell treated with LPS. |
|
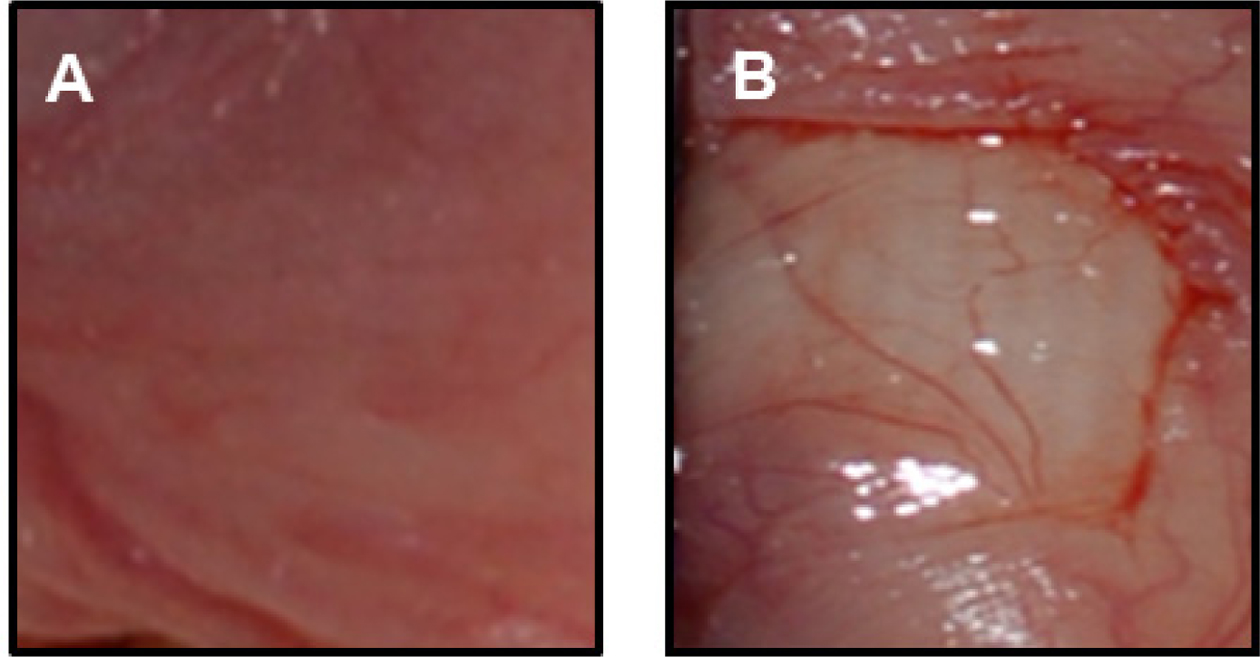
Figure 8 Figure 8. Appearance of hamster mucosa: (a) before modeling; (b) after modeling. |
|
Figure 9 Figure 9. (a) Representative photographs of wound spot; (b) ulcer healing rate at 0, 1, 3, 5, 9 and 14 days (mean±SD, n=5). |
본 연구는 구내염 질환을 타겟으로 낮은 약물 체류 시간을 갖는 기존의 치료제가 가진 문제점을 개선한 점막점착성이 향상된 상어 연골 추출물 함유 PVA 하이드로젤을 개발하였다. 동결-융해 가교결합을 이용하여 PVA/SCE 하이드로젤을 제조하고 물리적 및 화학적 특성을 확인한 후 in vivo 실험을 통해 구내염 치료를 위한 응용 가능성을 평가하였다. FTIR과 EDS 분석을 통해 추출물로부터 chondroitin sulfate를 확인할 수 있었고 타액에 가까운 표면 pH로 구강점막에 대한 낮은 자극성을 확인하였다. PVA/SCE 하이드로젤은 SCE의 함량이 증가함에 따라 친수성이 증가하였고 15:2 비율에서 가장 높은 점막 점착력을 보였다. 세포독성 실험을 통해 높은 생존율을 보여 생체에 적합함을 확인할 수 있었다. 또한 PVA/2% SCE 하이드로젤은 염증매개물질인 NO를 억제하여 구강궤양 치유실험에서 시제품 및 PVA 하이드로젤보다 높은 치유효과를 보였다. 이러한 결과를 통해 해양유래소재인 상어 연골 추출물을 포함하는 PVA 하이드로젤은 생체 재료로써 구내염 치료를 위한 경구전달용 시스템의 응용 가능성을 보여주었다.
- 1. M. Chavan, H. Jain, N. Diwan, S. Khedkar, A. Shete, and S. Durkar, J. Oral. Pathol. Med., 41, 577 (2012).
-

- 2. L. Preeti, K. Magesh, K. Rajkumar, and R. Karthik, J. Oral. Maxillofac. Pathol., 15, 252 (2011).
-

- 3. Y. Zhou, Q. Chen, W. Meng, L. Jiang, Z. Wang, J. Liu, M. Lin, H. Zhou, X. Chen, M. Zhao, and X. Zeng, Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 109, 561 (2010).
-

- 4. A. Altenburg, N. El-Haj, C. Micheli, M. Puttkammer, M. B. Abdel-Naser, and C. C. Zouboulis, Dtsch. Arztebl. Int., 111, 665 (2014).
-

- 5. F. Femiano, C. Buonaiuto, F. Gombos, A. Lanza, and N. Cirillo, Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 109, 402 (2010).
-

- 6. I. Volkov, I. Rudoy, T. Freud, G. Sardal, S. Naimer, R. Peleg, and Y. Press, J. Am. Board. Fam. Med., 22, 9 (2009).
-

- 7. M. W. Liang and C. Y. Neoh, Ann. Acad. Med.. Singap., 41, 463 (2012).
- 8. S. Nguyen and M. Hiorth, Ther. Deliv., 6, 595 (2015).
-

- 9. G. P. Andrews, T. P. Laverty, and D. S. Jones, Eur. J. Pharm. Biopharm., 71, 505 (2009).
-

- 10. A. P. Nikalje, S. Tiwari, and S. Kamble, Int. J. Res. Pharm. Sci., 2, 32 (2012).
- 11. P. Tangri and N. Madhav, JBI, 2229, 7499 (2011).
- 12. N. A. Peppas and N. K. Mongia, Eur. J. Pharm. Biopharm., 43, 51 (1997).
-

- 13. T. K. Mandal, Eur. J. Pharm. Biopharm., 50, 337 (2000).
-

- 14. N. A. Peppas and J. E. Scott, J. Control. Release, 18, 95 (1992).
-

- 15. K. Morimoto, S. Fukanoki, K. Morisaka, S. H. Hyon, and Y. Ikada, Chem. Pharm. Bull. (Tokyo), 37, 2491 (1989).
-

- 16. K. Morimoto, A. Nagayasu, S. Fukanoki, K. Morisaka, S. H. Hyon, and Y. Ikada, Pharm. Res., 6, 338 (1989).
-

- 17. R. W. Korsmeyer and N. A. Peppas, J. Memb. Sci., 9, 211 (1981).
-

- 18. N. A. Peppas and N. K. Mongia, Eur. J. Pharm. Biopharm., 43, 51 (1997).
-

- 19. N. A. Peppas and R. E. Berner, Jr., Biomater Res., 1, 158 (1980).
-

- 20. R. W. Korsmeyer and N. A. Peppas, J. Memb. Sci., 9, 211 (1981).
-

- 21. V. Gimenez, A. Mantecon, and V. Cadiz, J. Appl. Polym. Sci., 59, 425 (1996).
-

- 22. V. Gimenez, A. Mantecon, and V. Cadiz, J. Polym., Sci., Part A: Polym. Chem., 34, 925 (1996).
-

- 23. J. Bo, J. Appl. Polym. Sci. Symp., 46, 783 (1992).
-

- 24. S. C. da Costa Sanches, F. de Vasconcelos, C. E. F. da Costa, P. S. B. Marinho, M. R. Guilherme, E. J. M. Tavares, J. A. P. D. Júnior, J. O. C. S. Júnior, and R. M. Ribeiro-Costa, J. Therm. Anal. Calorim., 120, 991 (2015).
-

- 25. Y. Ohtsuka, H. Nakae, H. Abe, and T. Obinata, Zoolog. Sci., 11, 407 (1994).
- 26. L. Mollica, F. De Marchis, A. Spitaleri, C. Dallacosta, D. Pennacchini, M. Zamai, A. Agresti, L. Trisciuoglio, G. Musco, and M. E. Bianchi, Chem. Biol., 14, 431 (2007).
-

- 27. R. I. Prasanna and K. U. Sankari, Int. J. Pharm. Investig., 2, 26 (2012).
-

- 28. D. L. Pavia, G. M. Lampman, G. S. Kriz, and J. A. Vyvyan, Introduction to Spectroscopy, 4th Edition, California, Brookescole Pubishers, 2008.
- 29. J. Chen and G. Cyr, Composition producing adhesion through hydration in mainly Adhesion in biological system, New York, Academic Press, 1970.
-

- 30. D. Duchěne, F. Touchard, and N. Peppas, Drug Dev. Ind. Pharm., 14, 283 (1988).
-

- 31. R. Barrer, J. Barrie, and P.-L. Wong, Polymers, 9, 609 (1968).
-

- 32. T. R. R. S. Rahamatullah Shaikh, M. J. Garland, A. D. Woolfson, and R. F. Donnelly, J. Pharm. Bioallied. Sci., 3, 89 (2011).
-

- 33. B. Kalyanaraman, Redox Biol., 1, 244 (2013).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(3): 365-371
Published online May 25, 2019
- 10.7317/pk.2019.43.3.365
- Received on Jan 7, 2019
- Revised on Feb 11, 2019
- Accepted on Feb 12, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jin Kim**, and Ki-Young Lee***
-
Department of Advanced Chemicals and Engineering, Chonnam National University, Gwangju 61186, Korea
**Department of Oral and Maxillofacial Surgery, College of Dentistry, Chosun University & Institute of Dental Science,
Chosun University, Gwangju 61452, Korea
***School of Chemical Engineering, Chonnam National University, Gwangju 61186, Korea - E-mail: cream4251@chosun.ac.kr, kilee@jnu.ac.kr
- ORCID:
0000-0002-2558-8643, 0000-0002-0891-4195










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.