- Polycaprolactone Composite Membranes Containing Polyphenol -Loaded Hydroxyapatite Nanoparticles for Bone Regeneration
Department of Biomedical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea
- 폴리페놀이 도입된 하이드록시아파타이트 나노입자를 함유하는 골재생용 폴리카프로락톤 복합 멤브레인
대구가톨릭대학교 의공학과
To provide adequate conditions for the regeneration of damaged bone, it is necessary to develop porous membranes with anti-oxidant and anti-inflammatory activities. In this study, we fabricated composite membranes comprising polycaprolactone (PCL) and epigallocatechin gallate (EGCG)-introduced hydroxyapatite (HA) (HAE) nanoparticles using an electrospinning process. The resulting composite membranes exhibited completely interconnected pore structures. The average diameter of the composite membranes was slightly decreased by the addition of the HAE nanoparticles. Cytocompatibility test results revealed that the proliferation and differentiation of osteoblasts (MC3T3-E1) on the membranes increased with the high content of HAE nanoparticles because of the improved anti-oxidant and anti-inflammatory properties of the membranes. These results suggest that the PCL composite membranes are an ideal biomaterial for bone tissue regeneration.
손상된 뼈가 재생될 수 있는 적절한 환경을 제공하기 위해서는 항산화성과 항염증성을 가지는 다공성 멤브레인의 개발이 필요하다. 본 연구에서 폴리카프로락톤(polycaprolactone, PCL)과 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)가 함유되어 있는 하이드록시아파타이트(hydroxyapatite, HA) (HAE) 나노입자를 이용하여 전기방사법으로 복합 멤브레인을 제조하였다. 제조된 복합 멤브레인은 상호연결된 기공구조를 가지고 있었다. 복합 멤브레인에 도입된 HAE 나노입자의 양이 증가할수록 섬유의 직경은 약간 감소한다는 것을 확인하였다. 세포적합성 시험 결과 복합 멤브레인에 HAE 나노입자를 많이 도입할수록 항산화성과 항염증성의 개선에 의해서 조골세포 성장 및 분화가 촉진되었다. 이들 결과로부터 PCL 복합 멤브레인은 골조직 재생을 위한 생체재료로서의 사용가능성이 확인되었다.
Keywords: polycaprolactone, hydroxyapatite, epigallocatechin gallate, composite membrane, bone regeneration
이 결과물은 2017년도 대구가톨릭대학교 학술연구비 지원에 의한 것임.
질병, 사고 및 노화와 같은 원인으로 생긴 골 결손부위의 재생을 위해서 골이식술, 사지연장술(distraction osteogenesis) 및 골유도재생술(guided bone regeneration, GBR) 등과 같은 다양한 방법들이 시도되고 있다.1-3 그 중에서도 GBR은 골 결손부위와 손상된 조직의 기능과 구조의 재건을 위해서 효과적인 방법으로 알려져 있다. GBR 방법의 가장 기본적인 원리는 골 결손부위와 인접한 결합 조직 사이에 GBR 멤브레인을 삽입하여 일반적으로 재생 속도가 빠른 연조직 부위가 재생 속도가 느린 골조직 결손부위로 침투하는 것을 차단시켜 새로운 골조직의 재생을 촉진시키는 것을 목적으로 한다.4 따라서 GBR 멤브레인은 골 결손부위의 기계적인 지지체 역할을 할 수 있을 정도의 기계적인 강도와 세포의 성장 및 조직의 재생을 위한 생체적합성이 요구되어 진다. 또한 멤브레인을 통한 영양분, 산소 및 대사산물의 이동이 가능하도록 3차원 연결된 다공성 구조를 가져야 한다.1
GBR 멤브레인은 일반적으로 비분해성과 생분해성으로 구분되어 지며, 비분해성 멤브레인은 막이 조기에 노출되었을 경우 조직 감염과 골손실을 초래하며, 멤브레인을 제거하기 위한 2차 수술이 필요하기 때문에 최근에는 폴리락틱산(polylactic acid, PLA), 폴리글리콜릭산(polyglycolic acid, PGA), 폴리카프로락톤(polycaprolactone, PCL) 등과 같은 생분해성 합성고분자를 이용한 GBR 멤브레인의 개발이 많이 연구되고 있다.1,5,6 특히, PCL은 반결정성 선형구조와 높은 분자량을 가진 생분해성 폴리에스테르로서 우수한 기계적 강도와 생체적합성을 보이므로 약물전달체나 조직공학용 지지체로서 많이 연구되고 있다.7 그러나 이들 생분해성 합성고분자는 세포친화성이 부족하고 표면의 소수성으로 인해 초기 세포부착 및 성장률이 낮다는 단점이 있다.7 이러한 단점을 보완하기 위해서 플라즈마 또는 감마선을 이용한 멤브레인 표면 개질, 생리적 기능을 가지는 생체분자를 표면에 결합하는 방식 및 생체적합성을 가지는 무기물과의 복합체를 형성하는 방법 등이 시도되고 있다.7-10
생체적합성을 가지는 다양한 무기물 생체재료 중에서 칼슘포스페이트(CaP)의 한 종류인 하이드록시아파타이트(HA)는 우수한 생체활성으로 인해서 많은 관심을 받고 있다.11 특히 HA는 골조직을 구성하고 있는 무기물과 화학 성분 및 특성이 유사하고, 살아있는 조직과의 화학적 결합도 가능하므로 정형외과 및 치과 분야에서 손상된 골조직의 재생을 위한 골대체물로서 많이 이용되고 있다.10 특히 HA와 생분해성 고분자로 이루어진 복합 지지체의 경우 우수한 기계적 특성을 보일 뿐만 아니라 골세포의 성장 및 분화를 촉진시키는 것으로 보고되고 있고, 이들 복합 지지체는 HA 나노입자와 고분자를 블렌딩하는 방법으로 쉽게 제조될 수 있다.11,12
식물성 폴리페놀은 식물계에 널리 분포되어 있는 2차 대사산물로서 광합성에 의해 생성된 식물의 색소와 쓴맛을 내는 성분이며 식물세포의 생성 및 활성화에 영향을 준다. 그 중에서 플라보노이드류로 분류되며 녹차의 주요 활성 성분으로 알려진 에피갈로카테킨 갈레이트(EGCG)는 항산화성, 항암활성 및 항염증성 등과 같은 다양한 약리적 기능을 가지는 것으로 보고되고 있다.13-15 특히 골대사에서 EGCG는 리포다당류(LPS)에 의한 파골세포(osteoclast)의 골흡수 및 염증 반응에 의한 골 손실을 억제시킨다.16,17 또한 조골세포(osteoblast)의 성장과 alkaline phosphatase(ALP) 활성화도를 증가시켜 골형성을 촉진시키는 것으로 알려져 있다.18
따라서, 본 연구에서는 생분해성 고분자의 단점인 초기의 낮은 세포 부착률과 성장률을 개선하고, 항산화성 및 항염증성을 부여하여 조골세포의 성장 및 분화를 촉진시키기 위해서 항산화성과 항염증성이 우수한 식물성 폴리페놀인 EGCG가 도입된 HA 나노입자를 합성하였다. 계속해서 이들 나노입자와 생분해성 고분자인 PCL을 이용하여 전기방사법으로 복합 멤브레인을 제조하였다. 제조된 복합 멤브레인의 표면형태 및 특성 변화에 대해서 조사하였고, 또한 도입된 나노입자의 양이 조골세포의 성장 및 분화에 미치는 영향을 평가하였다.
시약 및 재료. 폴리카프로락톤(PCL, Mn=80000 Da), 알긴산 나트륨, epigallocatechin gallate(EGCG), calcium nitrate tetrahydrate(Ca(NO3)2·4H2O), ammonium phosphate dibasic ((NH4)2HPO4), ammonium hydroxide solution(NH4OH), alizarin red S(ARS), cetylpyridinium chloride, dimethyl sulfoxide(DMSO), methylene chloride(MC), isopropyl alcohol (IPA)과 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium-bromide(MTT)는 Sigma-Aldrich Co.(USA) 제품을 구입하여 사용하였다. Alpha minimum essential medium(α-MEM), Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), penicillin-streptomycin과 Dulbecco’s phosphate buffered saline(DPBS, pH 7.4)은 Gibco BRL(USA)에서 구입하였다. Mouse calvaria preosteoblast cell line(MC3T3-E1)은 American Type Culture Collection(ATCC, USA)에서 구입하였고, QuantiChromTM alkaline phosphatase(ALP) assay kit(DALP-250)는 BioAssay Systems(USA)에서 구입하여 사용하였다. 그 외의 사용된 시약과 용매는 일반 회사에서 구입하였으며, 추가적인 정제과정 없이 사용하였다.
폴리페놀이 도입된 HA 나노입자 합성. 폴리페놀인 EGCG가 도입된 HA(HAE) 나노입자를 합성하기 위해서 먼저 2 w/v%의 EGCG 수용액을 0.05 w/v% 알긴산 나트륨 수용액에 첨가하여 수소결합과 정전기적 인력을 이용하여 고분자-EGCG 복합체를 형성시켰다. 계속해서, 35 mL의 0.1 M Ca(NO3)2· 4H2O 용액을 적하한 후 25 w/v% NH4OH 수용액으로 반응 용액의 pH를 10에 맞추었다. 이 반응 용액에 Ca/P 최종 비율이 1.67이 되도록 0.1 M(NH4)2HPO4 수용액을 2시간 동안 적하하였다. 최종적으로 EGCG의 농도는 알긴산 나트륨과 HA의 전구체(Ca(NO3)2·4H2O와 (NH4)2HPO4)를 합친 무게 대비 1 wt%와 2 wt%를 투입하였다. 적하 완료 후에 40℃에서 24시간 동안 반응시켰고, 생성물을 24시간 멤브레인 투석 후에 세척과 동결건조를 통해서 얻었다.
HAE 나노입자 특성 분석. HAE 나노입자의 표면은 field-emission scanning electron microscope(FE-SEM, JSM-6335F, JEOL, Japan)를 이용하여 분석하였고, 나노입자의 입자 크기 분포는 Zetasizer Nano ZS(Malvern Instruments, UK)를 이용하여 동적 광산란(DLS) 방법을 이용하여 측정하였다. 나노입자의 화학구조는 attenuated total reflectance Fourier transform infrared(ATR-FTIR, ALPHA, Bruker Optics, USA)를 이용하여 분광 해상도(spectral resolution)를 4 cm-1로 고정하고 파수(wavenumber)를 400-4000 cm-1 범위에서 조사하였다. 또한 나노입자의 결정구조는 X-ray diffractometer(XRD, X’Pert Pro, Panalytical B.V., The Netherlands)를 이용하여 조사하였다. XRD 분석에서 X-ray tube는 Cu Kα를 사용하여 40 kV, 30 mA의 조건으로 조사하였다. Diffractogram은 20-60o의 범위의 2θ를 2o/min의 속도로 측정하였다. 나노입자에 도입된 EGCG의 양은 샘플을 0.1 N HCl 용액에 녹인 후에 UV-visible spectrometer(U-2900, Hitachi, Japan)를 이용하여 278 nm에서의 흡광도를 측정하여 HAE 나노입자의 무게대비 도입량으로 계산하였다. 나노입자의 Ca/P molar ratio는 X-ray fluorescence srectroscopy(XRF, ZSX Primus II, Rigaku. Japan)를 이용하여 분석하였다.
PCL 복합 멤브레인 제조. PCL 복합 멤브레인을 제조하기 위해 사용한 전기방사장치는 0-40 kV의 전압공급이 가능한 고전압 공급장치(high voltage DC power supply unit, 청파 EMT, 한국), 평판형태(200×200 mm, stainless steel)의 집전판(collector), 고분자용액을 일정하게 토출해 줄 수 있는 주사기펌프(syringe pump, KDS100, USA), 주사기(gastight and needle lock type 10 mL, Hamilton, USA), 금속주사기 바늘(ID=0.41 mm) 등으로 구성하였다. 복합 멤브레인의 전기방사를 위해서 먼저 PCL을 MC와 IPA 4:1의 혼합용매에 완전히 녹이고, 여기에 HAE 나노입자를 추가하여 상온에서 12시간 동안 교반하여 PCL의 최종농도가 15 w/v%이고, HAE 나노입자는 PCL 무게 대비 5, 10, 및 15 wt%가 첨가된 방사용액을 제조하였다. 복합 멤브레인의 제조조건은 방사거리 15 cm, 인가전압 17 kV, 유체속도 2 mL/h로 고정시키고, 실온에서 상대습도 60% 이하의 조건에서 복합 멤브레인을 제조하였다. 방사 완료 후에 집전판에 모여 있는 복합 멤브레인을 수거하여 40℃에서 24시간 진공건조하여 잔존하는 용매를 모두 제거하였다.
PCL 복합 멤브레인의 특성 분석. PCL과 HAE 나노입자를 함유하는 복합 멤브레인의 표면 특성은 FE-SEM과 이미지 분석 프로그램(Image-Pro Plus, Media Cybernetics Inc., USA)을 이용하였다. 먼저 FE-SEM을 통해 얻어진 복합 멤브레인의 사진 이미지를 이미지 분석 프로그램을 이용하여 평균직경, 표준편차 등을 얻어내었다. FE-SEM을 이용하여 복합 멤브레인의 표면을 관찰하기 전에 백금(Pt)을 이용하여 멤브레인의 표면을 80초 동안 코팅하였고, 관찰 시에 가속전압을 5.0 kV로 고정하여 관찰하였다. FE-SEM 분석에 사용한 동일한 샘플을 이용하여 나노입자의 사용에 의한 복합 멤브레인 표면의 칼슘원소 분포도를 energy disperse X-ray spectroscopy(EDX)를 이용하여 분석하였다. 또한 PCL 복합 멤브레인의 표면 화학구조는 ATR-FTIR과 X-ray photoelectron spectroscopy(XPS, Quantera SXM, ULVAC-PHI Inc., Japan)를 이용하여 분석하였다. XPS에 사용된 X-ray 에너지는 monochromated Al Kα radiation(1486 eV)이다. 복합 멤브레인의 열적 특성은 thermogravimetric analysis(TGA, Q500, TA Instruments, USA)를 이용하여 질소기류 하에서 5℃/min의 승온속도로 상온에서 800℃까지의 범위 내에서 측정하였다.
세포 생존율 평가. PCL 복합 멤브레인의 in vitro 세포 독성을 알아보기 위해서 조골세포인 MC3T3-E1 세포를 사용하였다. 모든 세포배양에는 10% FBS와 0.5% penicillin-streptomycin을 함유하고 있는 α-MEM을 사용하였고, 복합 멤브레인에서의 세포 생존율은 MTT assay를 이용하여 분석하였다. 세포배양 전에 복합 멤브레인을 자외선을 이용하여 3시간 동안 멸균시키고, 계속해서 DPBS와 α-MEM을 이용하여 각 3회씩 세척하였다. 그 후 세포배양용 24-well plate에 복합 멤브레인을 넣어 주고, 여기에 MC3T3-E1 세포를 5×104 cells/well로 파종하여 37℃에서 7일 동안 배양시켰다. 세포 생존율을 평가하기 위해서 MTT 용액을 각각의 복합 멤브레인 상에서 배양된 세포에 넣어 주고 4시간 추가 배양하였다. 상층액을 제거하고 침전물을 DMSO로 용해시켜서 마이크로플레이트 리더기(OPSYS-MR, Dynex Technology Inc., USA)를 이용하여 570 nm에서의 흡광도를 측정하여 평가하였다.
ALP 활성화도 및 광물화 반응 평가. 복합 멤브레인 상에서의 MC3T3-E1 세포의 분화능을 알아보기 위해서 초기 조골세포 분화 표지로서 ALP 활성화도를 ALP assay kit를 이용하여 측정하였다. MC3T3-E1 세포(5×104 cells/well)를 14일간 배양한 후에 세포층만 회수하여 0.2% Triton X-100을 이용하여 녹이고, 이 용액을 4℃ 및 5000 rpm의 조건으로 10분간 원심분리하여 상층액만을 분리하였다. 분리된 샘플의 상층액에 존재하는 ALP와 기질인 p-nitrophenyl phosphate를 반응시킬 경우 ALP에 의해서 p-nitrophenyl phosphate가 p-nitrophenol로 변환된다. 이 때 생성되는 p-nitrophenol의 농도를 405 nm에서 측정하여 ALP activity를 평가하였다. 또한 복합 멤브레인 상에서의 MC3T3-E1 세포의 분화능을 재확인하기 위해서 세포 성장 후의 광물화 반응 정도를 ARS 염색법을 이용하여 평가하였다. MC3T3-E1 세포(5×104 cells/well)를 14일간 배양한 후에 배지를 제거하고 DPBS를 이용하여 3회 세척하였다. 그 후 4% paraformaldehyde 용액으로 15분간 고정화 작업을 행하고 ARS 용액(40 mM, pH 4.2) 1 mL를 각 well에 넣고 항온진탕배양기에서 20분간 반응시켰다. 반응 종료 후에 미반응 ARS 용액을 세척하였고 10 w/v% cetylpyridinium chloride 용액으로 1시간 동안 반응시킨 후에 이들 용액의 흡광도 변화를 540 nm에서 측정하여 광물화 반응 정도를 평가하였다.
염증성 사이토카인 정량. PCL 복합 멤브레인이 염증성 사이토카인인 interleukin-6(IL-6)의 발현에 주는 영향은 murine macrophage cell line RAW 264.7(Korean cell line bank, Korea)를 이용하여 분석하였으며, 실험을 위해서 먼저 RAW 264.7 세포를 10%의 열처리된 FBS와 0.5% penicillin-streptomycin을 함유하고 있는 DMEM 배지에서 배양하였다. 계속해서 이들 RAW 264.7 세포를 PCL 복합 멤브레인이 들어가 있는 24-well plate에 2×104 cells/well로 파종하고 37℃에서 24시간 배양한 후에 1 μg/mL의 LPS를 세포가 배양되고 있는 배지 용액에 넣어주고 24시간 추가 배양을 하였다. 복합 멤브레인에서 RAW 264.7 세포가 방출하는 IL-6의 정량은 enzyme-linked immusorbent assay(ELISA) kits(R&D Systems, USA)를 이용하였다.
통계처리. 모든 실험 결과의 통계처리는 one-way ANOVA (Turkey test) 방법을 이용하여 각각의 샘플에 대한 평균±표준오차로 나타내었다. 대조군에 대한 샘플의 유의한 차이는 SigmaPlot 13.0(Systat Software, USA)을 이용하여 p*<0.05의 수준에서 분석하였다.
HAE 나노입자 합성 및 특성 분석. 생분해성 고분자 PCL의 세포친화성을 높이기 위해서 생체적합성이 우수하고 뼈의 주요 구성성분인 HA에 항산화성과 항염증성이 우수한 것으로 알려져 있는 식물성 폴리페놀인 EGCG가 도입된 나노입자를 고분자가 용해되어 있는 수용액 상에서 침전법으로 합성하였다. 합성된 나노입자를 EGCG의 사용량에 따라서 HAE0, HAE1 및 HAE2로 표기하였다(Table 1).
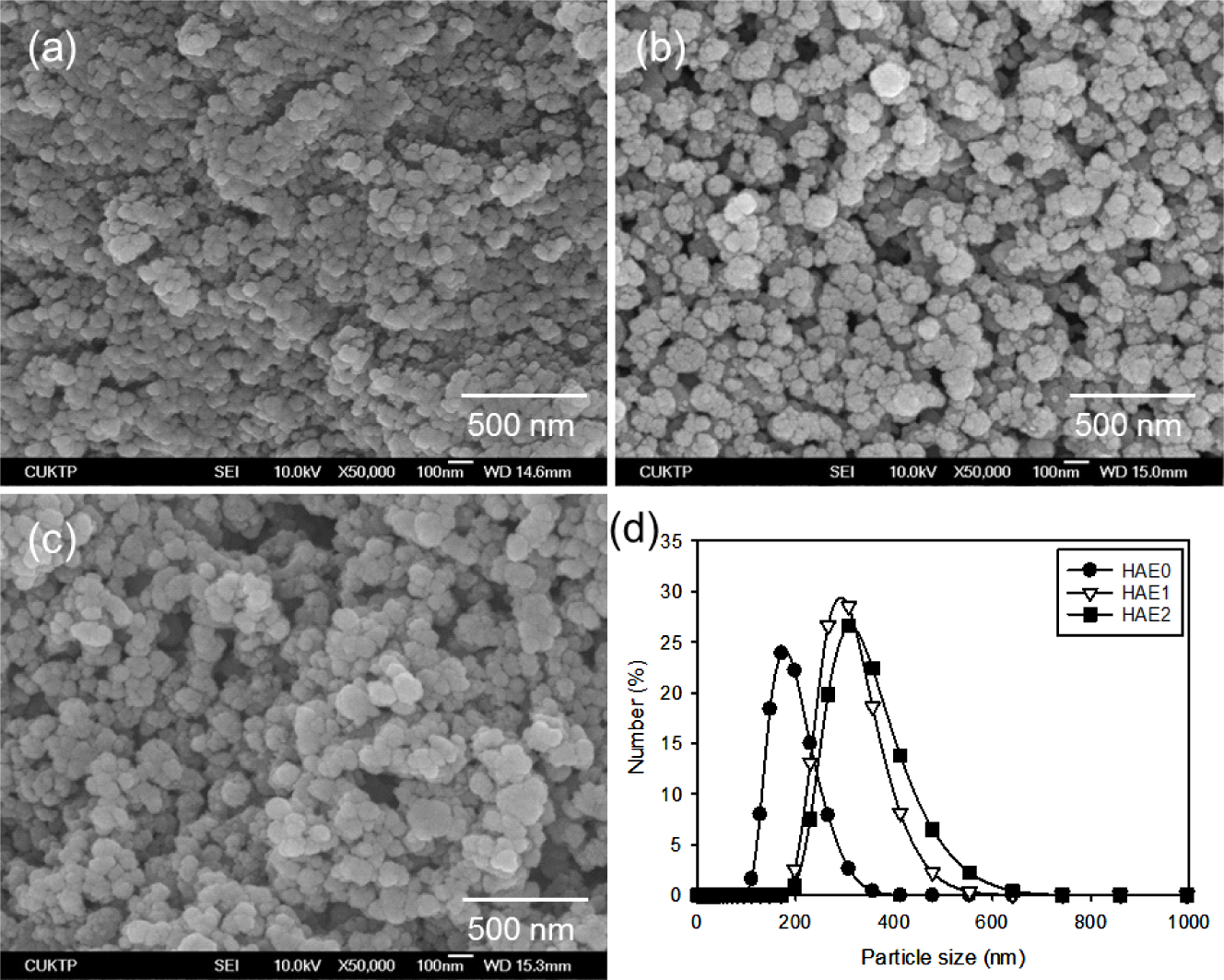
HAE 나노입자의 표면 형상을 FE-SEM을 이용하여 관찰한 결과, Figure 1에서 볼 수 있는 것처럼 평균 크기가 100 nm 이하이고 구형의 형상을 가지는 것을 확인할 수 있었다. 또한 나노입자의 크기는 EGCG의 함량 증가에 따라 다소 증가하는 경향을 보였다. HAE 나노입자의 생성 메커니즘은 먼저 알긴산 나트륨과 EGCG가 수소결합에 의한 복합체를 형성하고, 계속해서 알긴산 나트륨의 카복실기와 Ca2+ 이온이 강한 이온결합을 통해서 입체화학적인 배열을 형성하게 되어 Ca2+ 이온이 풍부한 복합체를 최종적으로 형성하게 된다. 이들 복합체에 PO43- 이온을 반응시키면 HAE 나노입자가 생성된다. 따라서 이들 HAE 나노입자의 형상 및 크기는 합성 시에 사용된 EGCG 분자 및 Ca2+ 이온이 수소결합 또는 이온결합을 통해서 알긴산 나트륨과 복합체를 형성하여 알긴산 나트륨의 카복실기 주위에 EGCG 분자 및 Ca2+ 이온의 농도를 높임과 동시에 입체화학적인 배열을 형성함에 기인한다.19
계속해서 이들 복합체들은 PO43- 이온과 강하게 결합하여 HAE 나노입자를 만들기 위한 핵형성(nucleation)을 시작한다. 즉 나노입자의 크기는 핵형성과 성장속도에 기인하고, EGCG의 함량이 증가할수록 핵형성과 성장이 빠르게 일어나므로 최종생성물인 HAE 나노입자의 크기가 증가하는 것으로 판단된다.20 그러나 입자 1개(1차 입자)의 크기는 100 nm 이하이지만 알긴산 나트륨의 존재 하에서 합성된 HAE의 경우 수백 나노미터 크기의 집합체(aggregate, 2차 입자)를 형성하는 것을 관찰할 수 있었다. 따라서, 집합체의 형성이 많아지고 크기가 증가할수록 실제 복합 멤브레인의 제조에 분산성 저하 등의 이유로 사용이 제한될 수 있으므로, HAE 현탁액을 이용하여 DLS 방법로 집합체의 크기를 측정한 결과 EGCG 함량의 증가에 의해서 189±45 nm에서 336±76 nm로 증가하였다(Figure 1).
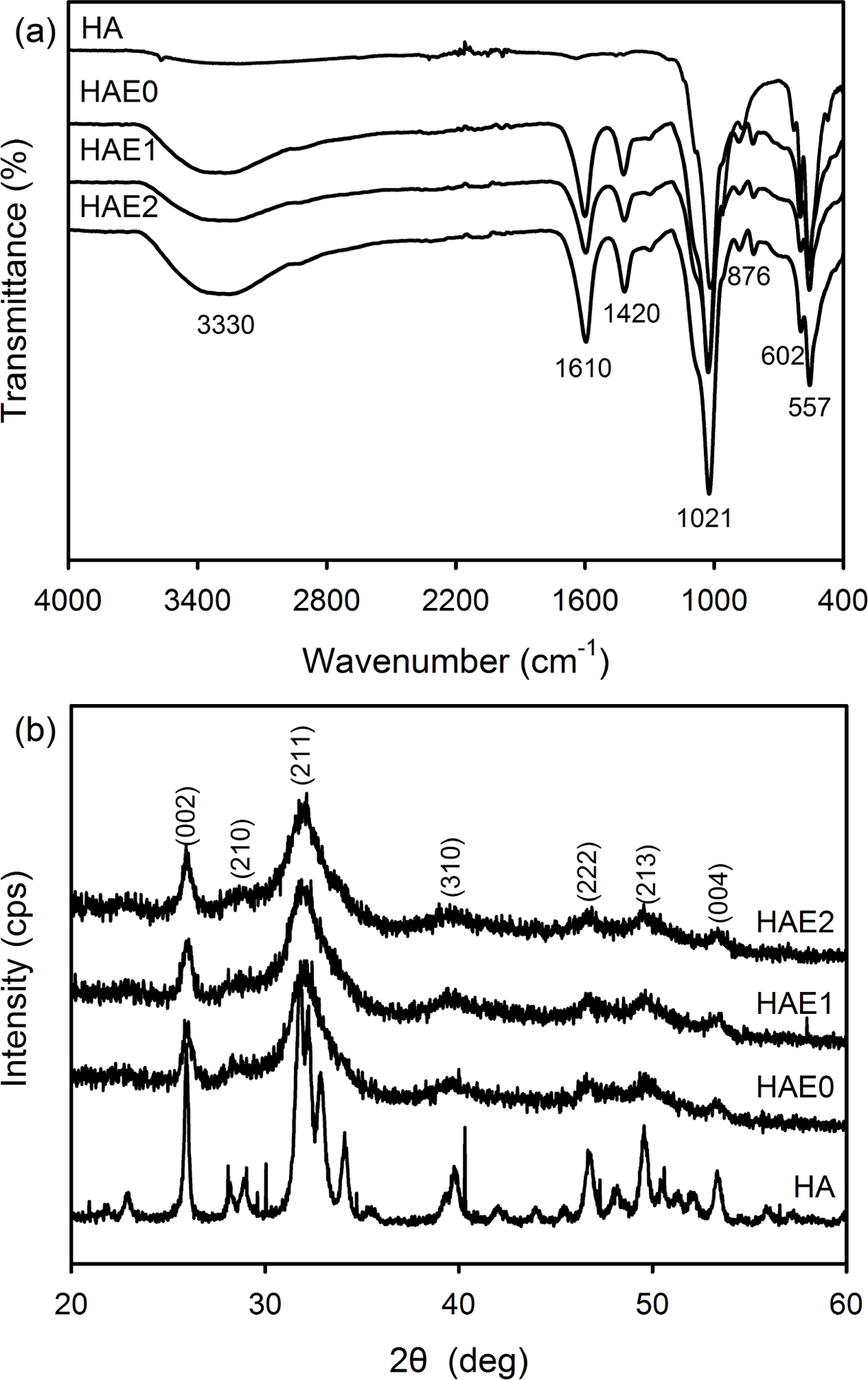
HAE 나노입자의 화학적 구조를 알아보기 위해서 ATR-FTIR을 이용하여 400-4000 cm-1 범위에서 분석하였다. Figure 2(a)에서 볼 수 있는 것처럼 모든 샘플에서 PO43-의 stretching vibration에 기인하는 특성피크가 1021, 602 및 557 cm-1에서 확인되었고, 알긴산 나트륨과 흡수된 물의 -OH에 기인하는 피크가 3330 cm-1에서 관찰되었다.20 또한 1610 cm-1에서 COO-의 asymmetric stretching에 기인하는 특성피크가 관찰되었고, 1420과 876 cm-1에서 PO43-의 자리에 치환된 CO32-에 기인하는 피크가 확인되었다.21 이들 CO32- 이온은 반응 용액 중의 OH- 이온과 대기 중의 CO2의 반응에 의해서 생성된 것으로 판단된다. 그러나 EGCG에 기인하는 피크는 다른 특성피크와 중복이 되어 확인이 불가능하였다.
또한 HAE 나노입자의 결정구조를 XRD를 이용하여 조사하였다(Figure 2(b)). HAE 나노입자의 XRD spectra에서 HA의 결정구조 기인하는 피크가 25.9o, 28.6o, 31.9o, 39.6o, 46.6o, 49.6o 및 53.3o에서 확인이 되었고, 이들 피크는 (002), (210), (211), (310), (222), (213) 및 (004)의 결정면의 특성을 나타내는 것이다.22 그러나 모든 회절(diffraction) 패턴이 넓은 피크들로 구성되어 있으며, 이는 낮은 결정성의 HA 결정이 형성되었다는 것을 의미한다. 즉 HA와 비결정성의 고분자의 복합체 형성 및 PO43-의 자리에 CO32-로의 치환에 의해서 최종 생성물인 HAE의 결정화도가 감소된 것으로 판단되어 진다. 선행 연구에 의하면 낮은 결정성을 가지는 CaP가 높은 결정성을 가진 CaP에 비해서 더 뛰어난 세포 부착력을 보이는 것으로 알려져 있다.22
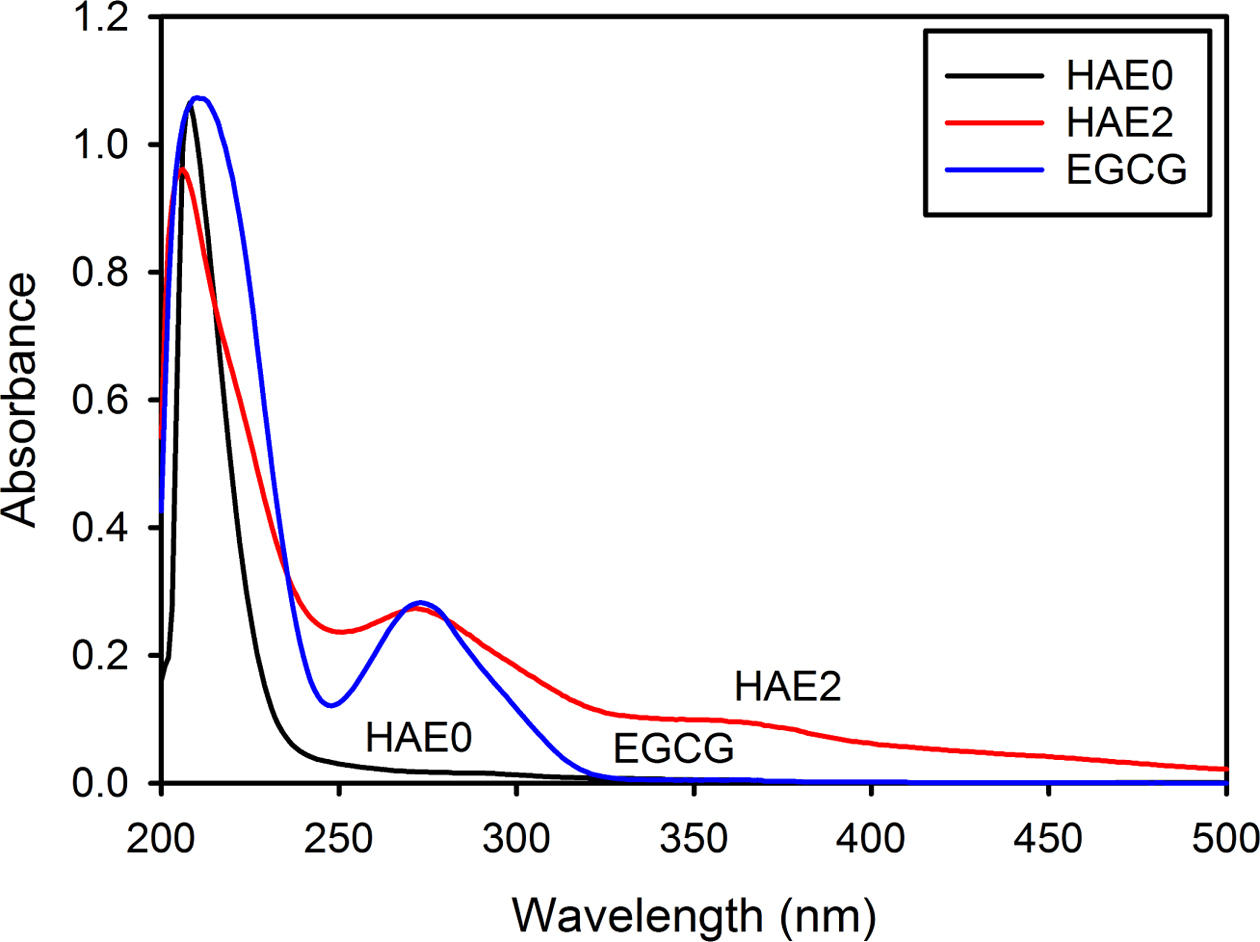
최종 생성물인 HAE 나노입자에 함유되어 있는 EGCG의 함량을 UV-visible spectrophotometer로 정량하였다. 먼저 EGCG의 HAE 나노입자로의 도입 여부를 확인하기 위해서 0.1 N HCl 용액에 HAE 나노입자 및 EGCG를 용해하여 흡광도를 조사한 결과 HAE0의 경우는 278 nm에서 흡수 피크를 보이지 않지만, HAE2와 EGCG는 278 nm에서 최대 흡수 피크를 보이는 것으로부터 HAE 나노입자에 EGCG가 도입된 것을 확인하였다(Figure 3). Table 1에 나타낸 것처럼 EGCG의 도입량을 정량한 결과 HAE1에는 0.9±0.05 wt%가 함유되어 있고, HAE2에는 1.7±0.08 wt%가 함유되어 있었다. 또한 이들 HAE 나노입자의 Ca/P molar ratio를 XRF로 분석한 결과 1.68±0.01에서 1.72±0.03으로 EGCG의 도입에 따른 Ca/P molar ratio의 차이는 거의 없는 것으로 확인되었다(Table 1).
PCL 복합 멤브레인의 형상 관찰. 전기방사된 복합 멤브레인은 생체 내에서 3차원 네트워크를 형성하고 있는 결합조직의 세포외기질(ECM)과 유사하기 때문에 골조직 재생 과정에서 기계적인 지지체 역할을 할 뿐만 아니라 우수한 생체적합성과 골전도성을 보이는 것으로 보고되고 있다.5,9 따라서, 본 연구에서는 1.7±0.08 wt%의 EGCG가 도입된 HAE2 나노입자를 다양한 농도로 PCL과 혼합하여 전기방사법으로 PCL 복합 멤브레인을 제조하였고, 사용된 HAE2 나노입자의 함량은 PCL 무게 대비 0(PCL), 5(PHAE05), 10(PHAE10) 및 15 wt%(PHAE15)이다. 또한 대조군으로 HAE0 나노입자가 15 wt%(PHA15) 함유된 복합 멤브레인도 제조하였다. 전기방사된 PCL 복합 멤브레인의 형상을 SEM을 이용하여 관찰한 결과, Figure 4에서 볼 수 있는 것처럼 3차원적으로 연결된 기공구조를 가지고 있었고, 멤브레인의 표면에서 HAE 나노입자가 확인됨으로써 복합 멤브레인이 성공적으로 제조되었다는 것을 확인하였다. 이들 멤브레인을 구성하고 있는 섬유의 평균 직경은 PCL이 3.16±0.22 μm, PHAE05가 2.36±0.34 μm, PHAE10이 2.22±0.31 μm, PHAE15가 1.92±0.43 μm 및 PHA15가 1.96±0.48 μm로 나노입자의 첨가에 의해서 섬유의 직경이 약간 감소하는 것이 확인되었다. 이는 나노입자의 사용에 의해서 비드(bead)가 일부 생성되었고, 이로 인해서 섬유의 균일성이 떨어졌기 때문이다.
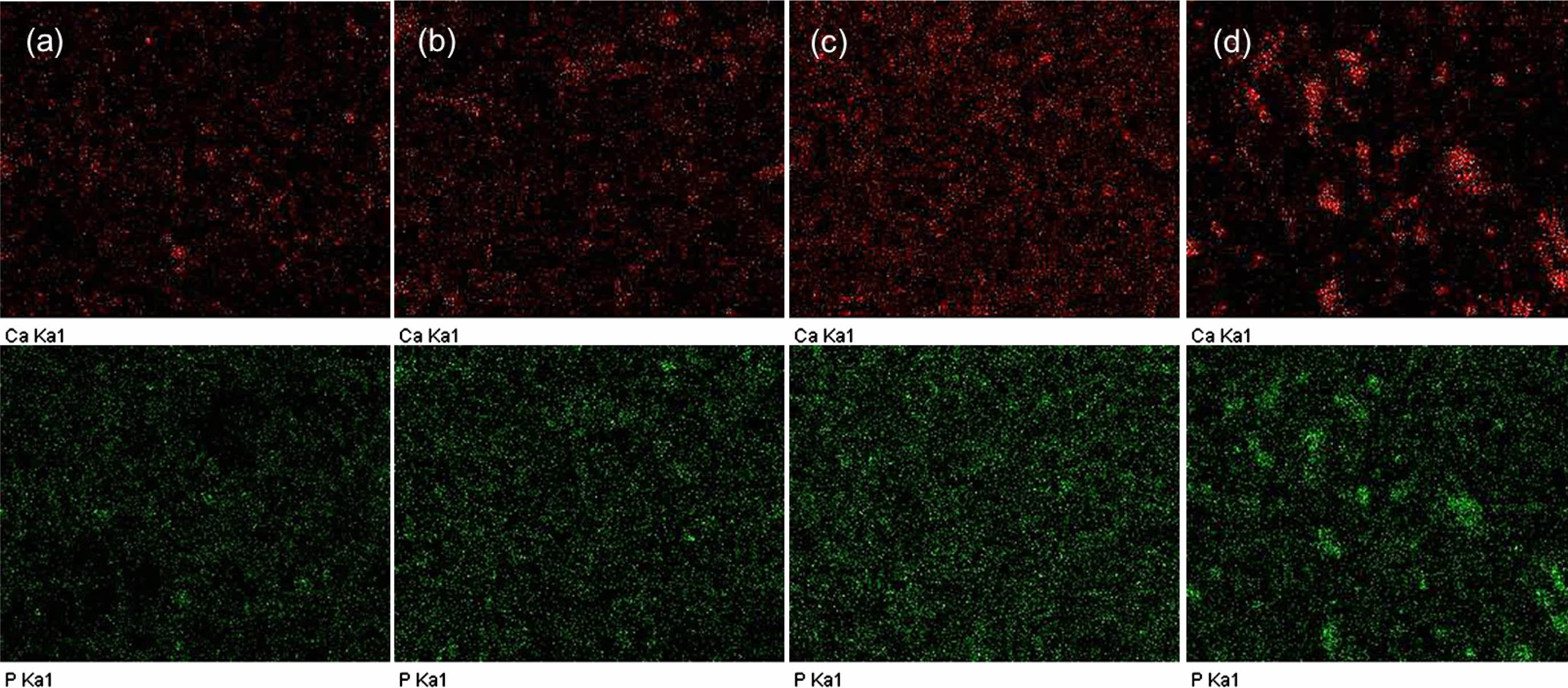
HAE 나노입자가 PCL 복합 멤브레인에 분산되어 있는 상태를 EDX Ca- 및 P-mapping 방법을 이용하여 확인하였다. Figure 5의 붉은 색 점들이 HAE 나노입자의 Ca 원소를 나타내는 것이며, 녹색의 점들이 HAE 나노입자의 P 원소를 나타내는 것이다. HAE 나노입자의 함량이 증가할수록 복합 멤브레인에서 붉은 색 및 녹색 점들이 더 많이 관찰되었고, 또한 복합 멤브레인에 HAE 나노입자가 균일하게 분산되어 있다는 것을 확인할 수 있었다.
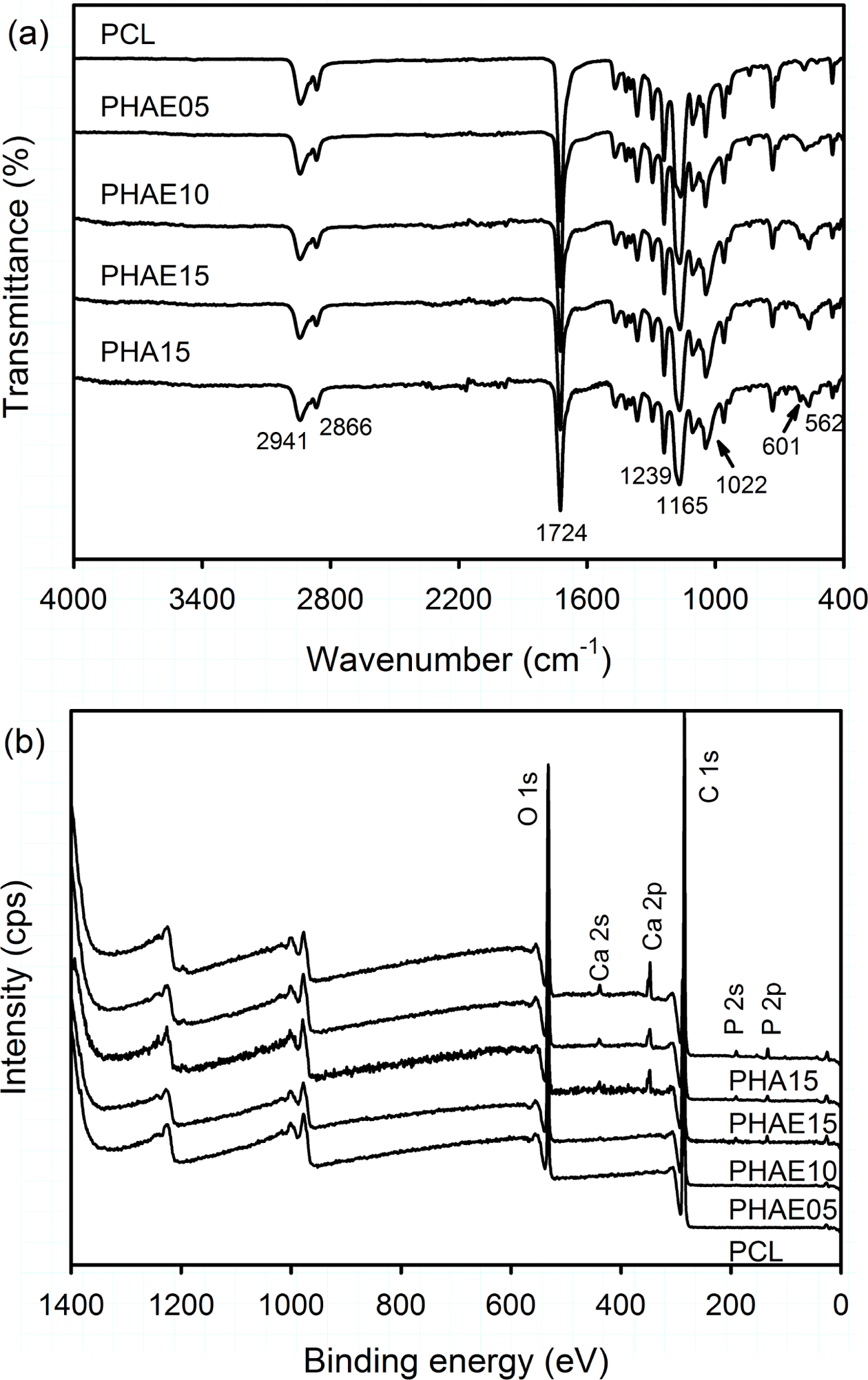
PCL 복합 멤브레인의 물리화학적 특성 분석. PCL 복합 멤브레인에 존재하는 관능기(functional group)를 확인하기 위해서 ATR-FTIR을 이용하여 분석하였다. 그 결과 Figure 6(a)에 나타낸 것처럼 2941 및 2866 cm-1에서 PCL 사슬에 존재하는 C-H stretching에 기인하는 특성 피크가 모든 PCL 복합 멤브레인에서 관찰되었다.23 또한 1724 cm-1에서 PCL의 C=O stretching에 기인하는 피크가 관찰되었고, 1239와 1165 cm-1에서 C-O-C stretching에 해당하는 피크가 확인되었다. 그리고 HAE 나노입자가 도입됨에 따라서 PO43-의 stretching vibration에 기인하는 피크가 1022, 601 및 562 cm-1에서 확인되었으나,23 EGCG에 기인하는 특성 피크는 확인이 불가능 하였다.
PCL 복합 멤브레인의 화학적 조성은 XPS를 이용하여 분석하였고, 그 결과 HAE 나노입자를 함유하지 않는 순수 PCL 멤브레인의 XPS survey scan spectrum에서 532 eV의 O 1s에 기인하는 피크와 284 eV의 C 1s에 기인하는 피크가 확인되었다(Figure 6(b)). 그러나 HAE 나노입자가 첨가된 후에는 PCL 및 HAE 나노입자에 기인하는 6개의 분리된 피크가 532 eV(O 1s), 439 eV(Ca 2s), 347 eV(Ca 2p), 284 eV(C 1s), 191 eV(P 2s) 및 133 eV(P 2p)에서 관찰되었다. 이들 피크 중에서 HAE 나노입자에 기인하는 특성 피크는 HAE 나노입자의 함량이 증가할수록 강도가 증가하는 경향을 보였다.
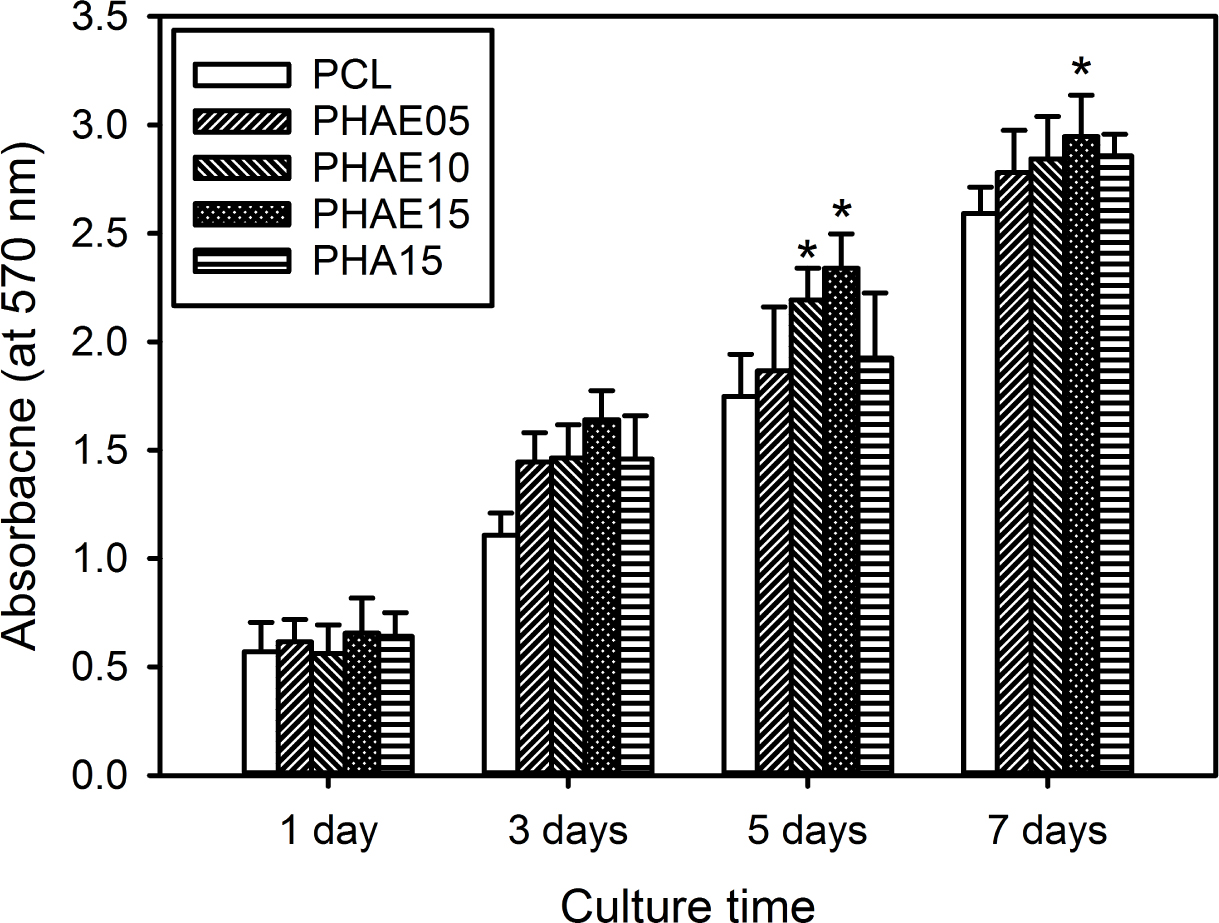
PCL 복합 멤브레인에서의 조골세포 성장 거동. GBR 멤브레인으로서 PCL 복합 멤브레인의 적용 가능성을 알아보기 위해서 PCL 복합 멤브레인 상에서의 마우스 두개관(calvaria) 유래의 조골세포인 MC3T3-E1의 성장거동을 MTT assay 방법으로 조사하였다. 모든 샘플에서 시간에 따라 세포가 성장되고 있음이 확인되었고, 또한 복합 멤브레인에의 HAE 나노입자의 도입량이 세포성장에 영향을 미친다는 것을 확인하였다(Figure 7). 즉 HAE 나노입자가 도입되지 않은 순수 PCL 멤브레인 및 EGCG를 함유하지 않는 HAE0 나노입자를 사용한 PHA15 멤브레인에 비해서도 EGCG를 함유하는 HAE 나노입자가 도입된 복합 멤브레인 상에서 조골세포가 더 빠르게 성장하는 것이 관찰되었고, 특히 PHAE15에서 세포의 성장속도가 가장 빠르다는 것을 확인하였다. 이는 HAE 나노입자 중 HA 성분의 생체활성과 EGCG의 항산화성 및 항염증성에 기인하는 것으로 판단되어지며, 또한 HAE 나노입자의 도입에 의해서 다소 증가된 표면의 거칠기도 조골세포의 성장속도에 영향을 주는 것으로 생각되어진다.16-18,24
PCL 복합 멤브레인 상에서의 세포 생존율 및 성장거동을 확인하기 위해서 SEM을 이용하여 세포와 멤브레인 사이의 상호작용을 관찰하였다. Figure 8에서 볼 수 있는 것처럼 모든 복합 멤브레인에서 배양 시간에 따른 세포 성장이 관찰되었고, 이는 복합 멤브레인의 우수한 생체적합성을 의미한다. 특히 7일간의 배양 후에 PHAE15 표면의 대부분이 조골세포로 채워져 있는 것이 관찰되었으며, 이는 MTT assay 결과와도 잘 일치하는 것이다.
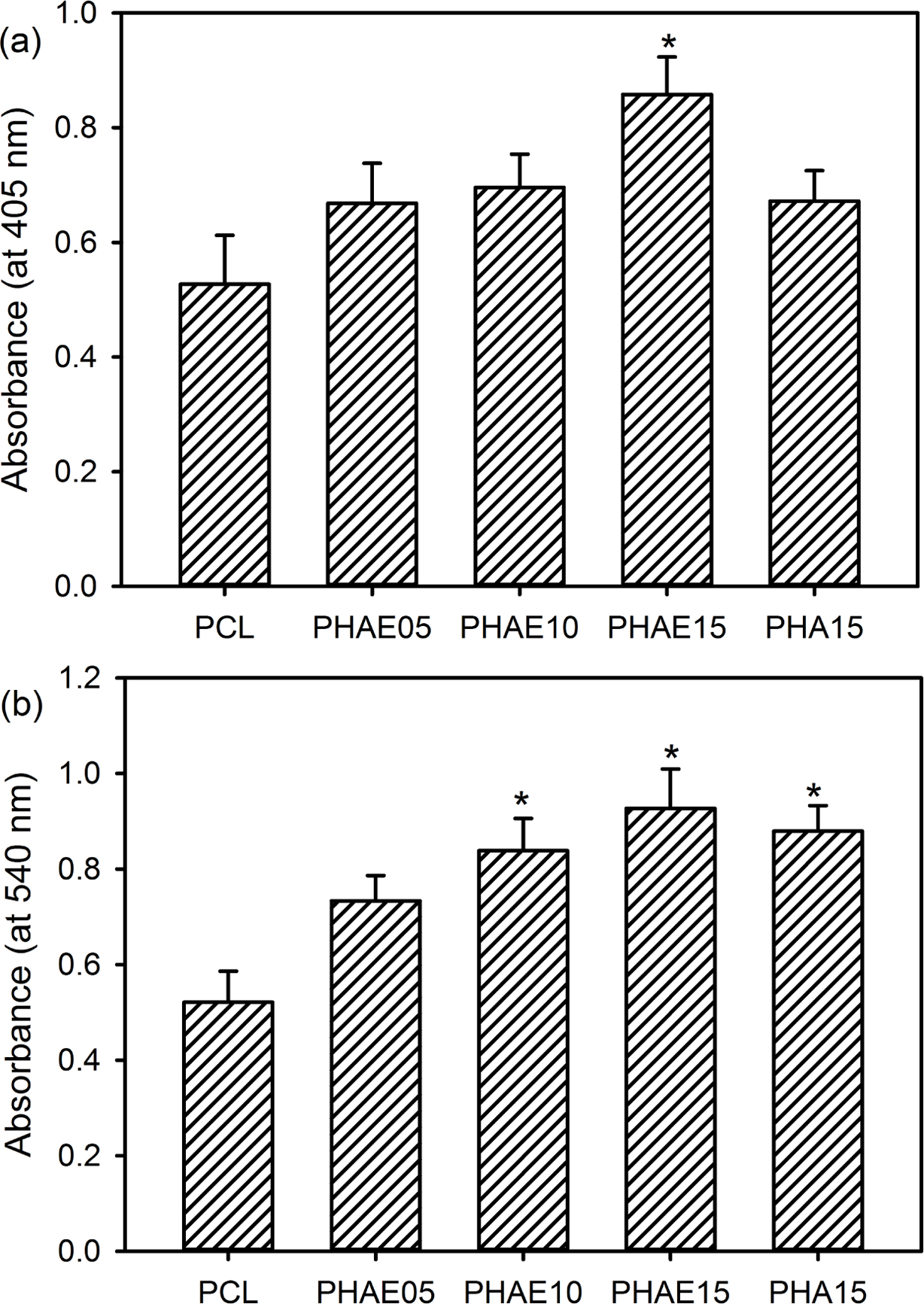
ALP 활성화도 및 광물화 반응. ALP는 뼈기질소포(bone matrix vesicles)를 구성하는 주요 성분 중의 하나이며, 유기 인산에스테르(organic phosphate esters)의 분해를 촉매 작용하는 것으로 알려져 있다.1,2 또한 뼈의 광물질 형성에 중요한 역할을 하며, 미성숙 조골세포 활성화도의 초기 지표일 뿐만 아니라 초기 조골세포 분화표지로서의 역할도 한다. 따라서 PCL 복합 멤브레인이 조골세포의 분화에 미치는 영향을 조사하기 위해서 ALP 활성화도를 평가하였다. 그 결과 PHAE15에서 배양된 세포에서 다른 복합 멤브레인에서 배양된 세포보다 높은 ALP 활성화도를 보였고, 특히 대조군으로 사용한 EGCG를 함유하지 않는 PHA15보다 PHAE15에서 배양된 세포에서 높은 ALP 활성화도를 보였다(Figure 9(a)). 기존의 연구에 의하면 녹차 카테킨, 케르세틴(quercetin) 및 캠퍼롤(kaempferol) 등과 같은 다양한 폴리페놀이 세포외 신호조절 키나제 경로(extracellular signal-regulated kinase pathway) 활성화 및 소포체(endoplasmic reticulum)와의 결합을 통해서 ALP의 활성화도를 상당히 증가시키는 것으로 보고되고 있다.25,26
조골세포는 분화한 후에 ECM의 광물화를 위한 반응을 시작하므로 이들 조골세포의 골형성 능력의 지표가 되는 광물화 반응 정도를 2가 금속이온인 칼슘이온과 선택적으로 반응할 수 있는 ARS를 이용한 염색법으로 정량하였다. 그 결과 순수 PCL 멤브레인에 비해서 HAE 나노입자가 도입된 복합 멤브레인 상에서 광물화 반응에 의해 침적된 칼슘이온의 양이 높은 것을 확인하였다(Figure 9(b)). 특히 복합 멤브레인 중에서도 PHAE15가 가장 높은 칼슘이온 침적량을 보였다. 이들 결과로부터 복합 멤브레인에 도입된 HAE 나노입자의 양이 MC3T3-E1 세포의 분화능 및 광물화 반응에 영향을 준다는 것을 확인할 수 있었다.
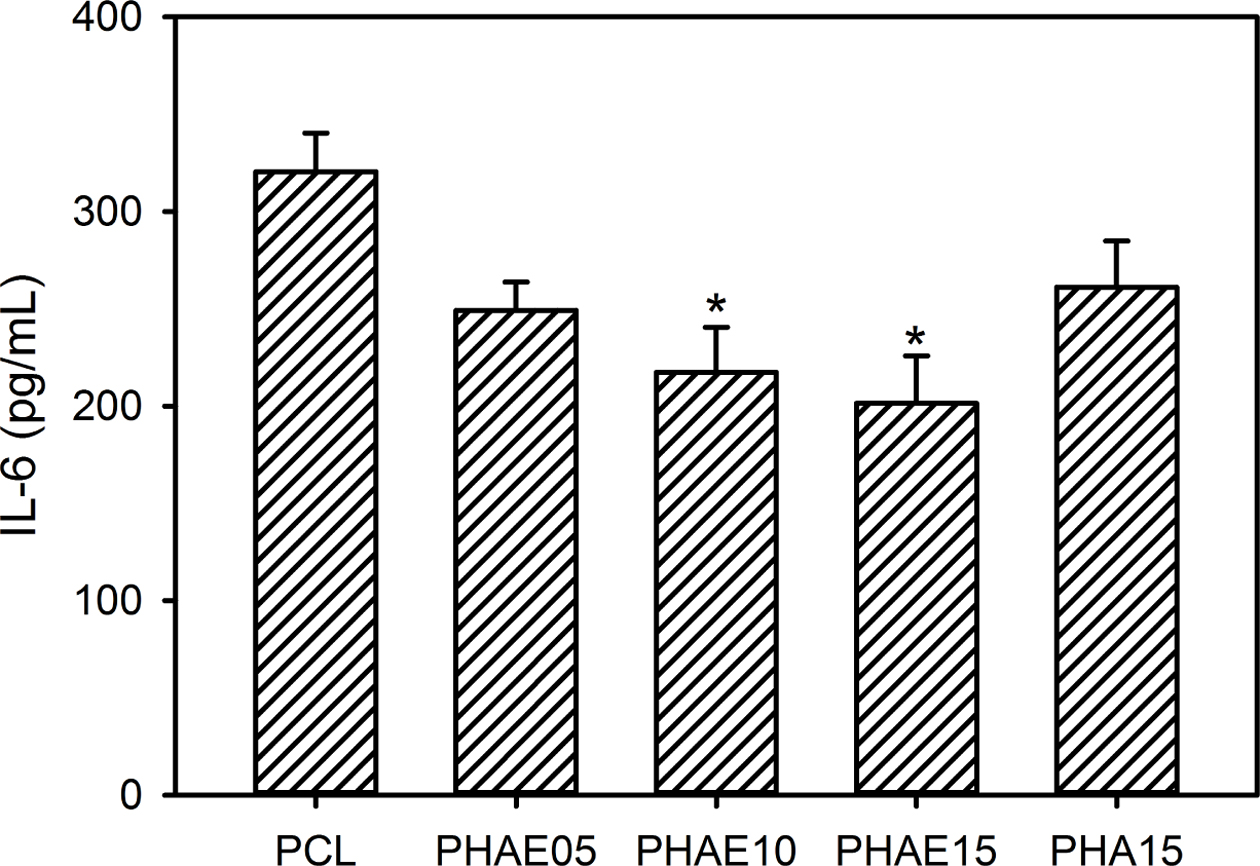
염증성 사이토카인 정량. 사이토카인(cytokine)은 면역반응에서 중요한 역할을 할 뿐만 아니라 골대사에도 영향을 주는 것으로 알려져 있다.14 IL-1β, IL-6 및 IL-17과 같은 다양한 염증성 물질들은 염증반응의 환경에서 리간드의 수용체 활성인자인 neclear factor kappa-B와 함께 골흡수를 유발하는 파골세포형성(osteoclastogenesis)을 촉진한다.14,15 또한 IL-6은 미세환경에 따라서 골형성과 골흡수에 모두 영향을 줄 수 있는 것으로 알려져 있다. 그러나 많은 양의 IL-6이 발현될 경우 세포 생존율이 떨어지고 조직학적인 손상을 유발하게 된다. 따라서 PCL 복합 멤브레인의 세포적합성을 알아보기 위해서 대식세포인 RAW 264.7 세포를 복합 멤브레인 상에서 배양하고 이들 세포에 의해서 발현되는 IL-6을 정량하였다.
Figure 10에서 볼 수 있는 것처럼 HAE 나노입자가 도입되지 않은 순수 PCL 멤브레인은 염증성 사이토카인인 IL-6의 생성을 촉진하였고, 이는 PCL 멤브레인이 LPS에 의해서 쉽게 오염이 되어 대식세포의 활성화를 촉진하였기 때문이다. 그러나 HAE 나노입자가 도입된 복합 멤브레인의 경우 PCL 멤브레인에 비해서 IL-6의 발현이 상당히 억제되었고, 특히 PHAE15의 경우 매우 적은 양의 IL-6을 분비하였다. 이들 결과로부터 HAE 나노입자가 함유하고 있는 EGCG의 항염증성 효과에 의해서 복합 멤브레인의 세포적합성이 향상되었고, HAE 나노입자의 도입량이 복합 멤브레인의 IL-6 발현을 억제시키는 가장 중요한 요소로 판단된다.14,15
|
Figure 1 SEM micrographs of (a) HAE0; (b) HAE1; (c) HAE2 nanoparticles. (d) Particle size distribution of HAE nanoparticles determined by DLS technique. |
|
Figure 2 (a) ATR-FTIR; (b) XRD spectra of commercial HA (high crystallinity), HAE0, HAE1, and HAE2 nanoparticles. |
|
Figure 3 UV-visible spectra of EGCG (18 μg/mL) and HAE nanoparticles (1 mg/mL) synthesized with different EGCG contents. |

|
Figure 4 SEM micrographs of electrospun (a) PCL; (b) PHAE05; (c) PHAE10; (d) PHAE15; (e) PHA15 composite membranes. (f) Average fiber diameter of the PCL composite membranes. |
|
Figure 5 EDX Ca-P mapping micrographs of (a) PHAE05; (b) PHAE10; (c) PHAE15; (d) PHA15 composite membranes. |
|
Figure 6 (a) ATR-FTIR; (b) XPS survey scan spectra of the PCL composite membranes. |
|
Figure 7 Cell proliferation as a function of culture time for MC3T3-E1 cells incubated on the PCL composite membranes (n=5). p*<0.05 denotes a statistically significant difference from the |

|
Figure 8 SEM micrographs of the MC3T3-E1 cells grown on (a) PCL; (b) PHAE05; (c) PHAE10; (d) PHAE15; (e) PHA15 composite membranes for different time durations. |
|
Figure 9 (a) ALP activity; (b) calcium deposition for MC3T3-E1 cells incubated on the PCL composite membranes measured after 14 days (n=6). p*<0.05 denotes a statistically significant difference from the pure PCL membrane. |
|
Figure 10 Levels of IL-6 from the RAW 264.7 cells after incubation for 24 h on the PCL composite membranes (n=5). p*<0.05 denotes a statistically significant difference from the pure PCL |
|
Table 1 Characteristics of EGCG-loaded HA Nanoparticles with Different EGCG Contents |

aWeight feed ratio of EGCG to polymer and HA precursors. bWeight content of EGCG in HAE nanoparticles, determined by UV-visible spectrophotometer. |
본 연구에서는 PCL 복합 멤브레인을 골조직 재생을 위한 GBR 멤브레인으로 적용하기 위해 전기방사법으로 제조하였다. 제조된 복합 멤브레인은 세포의 균일한 분포와 산소 및 영양분의 투과가 가능하도록 하는 상호연결된 기공구조를 가지고 있었다. EGCG를 함유하는 HAE 나노입자의 도입량은 복합 멤브레인의 세포적합성에 영향을 주었고, HAE 나노입자의 도입량이 많아질수록 조골세포의 성장 및 분화와 항염증성이 개선되었다. 특히 HAE 나노입자의 도입량이 가장 많은 PHAE15에서 조골세포의 성장 및 분화가 가장 빨랐고, 염증성 사이토카인의 발현은 가장 억제되는 것을 확인하였다. 이들 결과로부터 PCL 복합 멤브레인의 제조는 새로운 골조직 재생용 지지체의 개발에 많은 도움이 될 것으로 기대되어 진다.
- 1. H. Lee, H. Hwang, Y. Kim, H. Jeon, and G. Kim, Chem. Eng. J., 250, 399 (2014).
-

- 2. M. M. Rad, S. N. Khorasani, L. Ghasemi-Mobarakeh, M. P. Prabhakaran, M. R. Foroughi, M. Kharaziha, N. Saadatkish, and S. Ramakrishna, Mater. Sci. Eng. C, 80, 75 (2017).
-

- 3. Y. Cai, J. Guo, C. Chen, C. Yao, S. M. Chung, J. Yao, I. S. Lee, and X. Kong, Mater. Sci. Eng. C, 70, 148 (2017).
-

- 4. S. H. Lee, Y. M. Lim, S. I. Jeong, S. J. An, S. S. Kang, C. M. Jeong, and J. B. Huh, J. Adv. Prosthodont., 7, 485 (2015).
-

- 5. R. Ke, W. Yi, S. Tao, Y. Wen, and Z. Hongyu, Mater. Sci. Eng. C, 78, 324 (2017).
-

- 6. J. W. Jang, J. Kim, M. S. Kook, and K. Y. Lee, Polym. Korea, 42, 874 (2018).
-

- 7. D. E. Seo, S. I. Jeong, J. S. Park, H. J. Gwon, S. J. An, B. H. Lee, D. S. Im, H. S. Shin, and Y. M. Lim, Polym. Korea, 41, 143 (2017).
-

- 8. Y. M. Shin, H. Shin, and Y. M. Lim, Macromol. Res., 18, 472 (2010).
-

- 9. B. M. Whited, J. R. Whitney, M. C. Hofmann, Y. Xu, and M. N. Rylander, Biomaterials, 32, 2294 (2011).
-

- 10. H. Zhang, Q. W. Fu, T. W. Sun, F. Chen, C. Qi, J. Wu, Z. Y. Cai, Q. R. Qian, and Y. J. Zhu, Colloid Surf. B: Biointerfaces, 136, 27 (2015).
-

- 11. F. Fayyazbakhsh, M. Solati-Hashjin, A. Keshtkar, M. A. Shokrgozar, M. M. Dehghan, and B. Larijani, Mater. Sci. Eng. C, 76, 701 (2017).
-

- 12. M. Mohammadi, M. Alibolandi, K. Abnous, Z. Salmasi, M. R. Jaafari, and M. Ramezani, Nanomedicine, 14, 1987 (2018).
-

- 13. J. J. Johnson, H. H. Bailey, and H. Mukhtar, Phytomedicine, 17, 3 (2010).
-

- 14. R. Singh, N. Akhtar, and T. M. Haqqi, Life Sci., 86, 907 (2010).
-

- 15. B. N. Singh, S. Shankar, and R. K. Srivastava, Biochem. Pharmacol., 82, 1807 (2011).
-

- 16. T. Tominari, C. Matsumoto, K. Watanabe, M. Hirata, F. M. W. Grundler, C. Miyaura, and M. Inada, FEBS Open Bio, 5, 522 (2015).
-

- 17. G. Kuroyanagi, H. Tokuda, N. Yamamoto, S. Kainuma, K. Fujita, R. Ohguchi, T. Kawabata, G. Sakai, R. Matsushima-Nishiwaki, A. Harada, O. Kozawa, and T. Otsuka, Prostagladins Other Lipid Mediat., 128-129, 27 (2017).
-

- 18. C. Chu, J. Deng, Y. Hou, L. Xiang, Y. Wu, Y. Qu, and Y. Man, Mater. Sci. Eng. C, 76, 31 (2017).
-

- 19. M. Rajkumar, N. Meenakshisundaram, and V. Rajendran, Mater. Charact., 62, 469 (2011).
-

- 20. K. D. Son and Y. J. Kim, Biomater. Res., 21, 120 (2017).
-

- 21. B. Viswanath and N. Ravishankar, Biomaterials, 29, 4855 (2008).
-

- 22. Z. F. Zhou, T. W. Sun, F. Chen, D. Q. Zuo, H. S. Wang, Y. Q. Hua, Z. D. Cai, and J. Tan, Biomaterials, 121, 1 (2017).
-

- 23. S. Türkkan, A. E. Pazarçeviren, D. Keskin, N. E. Machin, Ö. Duygulu, and A. Tezcaner, Mater. Sci. Eng. C, 80, 484 (2017).
-

- 24. K. Fujimura, M. Okada, S. Takeda, and N. Matsumoto, Mater. Sci. Eng. C, 35, 259 (2014).
-

- 25. C. Prouillet, J. C. Maziѐre, C. Maziѐre, A. Wattel, M. Brazier, and S. Kamel, Biochem. Pharmacol., 67, 1307 (2004).
-

- 26. B. Vali, L. G. Rao, and A. El-Sohemy, J. Nutr. Biochem., 18, 341 (2007).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(3): 337-345
Published online May 25, 2019
- 10.7317/pk.2019.43.3.337
- Received on Dec 27, 2018
- Revised on Jan 28, 2019
- Accepted on Jan 29, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Young-Jin Kim
-
Department of Biomedical Engineering, Daegu Catholic University, Gyeongsan 38430, Korea
- E-mail: yjkim@cu.ac.kr
- ORCID:
0000-0002-1153-1304










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.