Carrageenans (CGs) are hydrophilic, linear sulfated polysaccharides extracted from red algae. CGs have been utilized for tissue engineering due to their biocompatibility, and excellent physical properties. However, CGs form helical structures, which give them a gel-formation ability; hence, most CG hydrogels are thermo-reversible, ion-crosslinking methods. Because these hydrogels cannot carry heat-sensitive drugs, cells, in vivo application is limited. To solve these problems, enzymatic crosslinking method based on horseradish peroxidase (HRP)-mediated reactions with hydrogen peroxide (H2O2) was utilized to synthesize CG-based hydrogels. Gelation time was controlled from 5 sec to 5 min with various concentrations of HRP (0.005-0.025 mg/mL). It was found that the H2O2 concentration (0.005-0.035 wt%) can control the elastic modulus (150-700 Pa) of the hydrogels. In vitro 2D cell viability studies demonstrated that the ka-CGPT hydrogels had excellent bioactivity. Such injectable hydrogel platforms are promising materials and will be utilized for various tissue engineering strategies.
카라기난은 붉은 해초류에서 추출한 성분이며, 황산 다당류 계열의 생체 고분자이다. 카라기난은 분자간 상호작용에 의해 열 가역적 젤을 형성하기 때문에 in vivo 실험이 제한된다. 본 연구에서는 horseradish peroxidase(HRP) 효소 매개 반응을 이용해서 주사가능한 카라기난 기반의 kappa-carrageenan-PEG-Tyramine(ka-CGPT) 하이드로젤 제조 및 그 물질의 물리화학적 특성분석을 하였다. Ka-CGPT 하이드로젤의 젤화 시간은 HRP 효소농도가 증가함에 따라 5~295초, 탄성률은 H2O2의 농도가 증가함에 따라 150~700 Pa까지 조절이 가능하였다. 또한 2차원의 in vitro 세포 실험을 통하여 좋은 세포 생존율(110~140%)을 확인하였다. 앞에서 설명했던 결과를 바탕으로 이번 연구를 통해서 ka-CGPT 하이드로젤은 생체소재 분야에서 유망한 물질로 쓰일 수 있음을 기대한다.
Keywords: injectable hydrogels, kappa-carrageenan, thermo-reversible, horseradish peroxidase (HRP), oxidation
본연구는 미래창조과학부의 재원으로 한국연구 재단 바이오의료기술개발사업(과제고유번호: NRF-2015M 3A9E2028578)과 산업통상자원부 및 한국산업기술평가관리 원의 소재부품기술개발사업(전략적핵심소재기술개발사업)의 지원으로 수행된 연구임[과제고유번호:10062079, 150 kPa 이 상의 접착력을 갖는 조직접합·치유 생체소재 개발].
고분자 하이드로젤은1,2 친수성 고분자의 삼차원 가교 망상 구조를 가지는 구조체이며, 조직 재생 의학 및 약물 전달,3,4 3차원 세포 배양,5-7 주입형 조직 공학,8,9 수술용 접착제10 등 다양한 생의학적 응용분야에서 사용되고 있다. 하이드로젤을 제조하기 위해서 사용되는 가교방식으로는 크게 2가지로 나 눌 수가 있는데, 물리적 또는 화학적 가교 방법을 사용하여 하이드로젤 네트워크를 구성할 수 있다. 물리적 가교는 다양 한 고분자 사슬간의 물리적인 얽힘에 의해 형성된다. 예를 들 어, 이온 가교 하이드로젤은 원래 하전된 고분자 사슬과 반 대 전하를 띤 이온간 상호 작용에 의해 제조된다.11 물리적 가 교 방식은 추가적으로 독성이 있는 가교제를 사용하지 않기 때문에 좋은 생체적합성을 가지나, 기계적 강도가 낮고 생리 적 환경에서 안정성이 떨어진다. 대조적으로, 화학적 가교는 고분자 사슬간에 비가역적 공유 결합을 생성하는 방식이다.
특히 화학적 광 개시제(PI) 및 자외선(UV) 등을 사용해서 광 가교가 일어나게 된다. 대표적인 예로, 아크릴 기가 있는 고 분자는 자외선 광원과 광개시제를 사용해서 화학적으로 가교 된다.12 비가역적 화학 결합을 형성하기 때문에 기계적 강도 가 좋고 생리적 환경에서 좋은 안정성을 나타내지만, UV광 원, 광 개시제 등의 화학적 가교제에 의해 세포독성을 나타 낼 수 있다는 단점이 있다. 화학적인 가교 방식 중에서 생리 적 환경에서 일어나는 효소 반응을 이용한 효소 매개의 가교 방식은 효소의 우수한 생체 적합성과 기질에 대한 특이적 반 응성으로 인해 다른 가교 시스템에 비해 많은 관심을 갖게 되 었다.13 효소 가교방식은 laccase, glucose oxidase, horseradish peroxidase(HRP) 등 다양한 효소가 하이드로젤을 제조하는데 사용되었다. 여러가지 효소 가교 반응 중에서도 HRP를 사용 한 가교 방식은 빠른 젤화 시간과 좋은 생체적합성을 가지기 때문에 다른 효소 가교 방식에 비해 하이드로젤을 제작할 때 주로 사용된다.14,15 HRP 효소 가교는 H2O2와 산화 환원 반응 (Figure 1)에 의해 페놀작용기간의 공유 결합을 형성할 수 있다. 카라기난(CG)은 붉은 해초류에서 추출한 성분으로 수용성 이며, 황산 다당류 계열의 천연 고분자이다. 카라기난은 식품, 화장품 등의 분야에서 제품의 안정제, 젤화 및 유화제로 현재 많이 사용된다.16 카라기난(CG)은 황산염기의 수에 따라서 카파, 아이오타, 람다형으로 분류된다.17 한 개의 이당류 단위체 내에 카파(κ)는 하나의 황산염 그룹을 가지고 있고 (Figure 2), iota(γ)와 lambda(λ)는 2개와 3개의 황산염 그룹을 가지고 있다.
이들의 젤 형성 과정은 카파와 아이오타 형 모두 분자간 상호작용에 의해 이중 나선 구조를 형성하여 열 가역적 젤화 반응이 유도된다. 열 가역적 특성으로 인해, 주로 이온 가교를 통해 생의학적 응용분야에 사용되었다.17 그러나 이러한 열 가역적, 이온 가교 방식은 온도에 민감한 약물, 세포 등을 담지하기 힘들고, in vivo 실험이 제한되기에 현실적으로 적용 분야가 제한된다.17
따라서 이러한 문제점을 해결하기 위해 본 연구에서는 수용성을 증가시키기 위해서 poly(ethylene glycol)기를 도입하였고, 또한 HRP, H2O2 효소 매개 반응을 이용하기 위해 tyramine을 도입하여 주사 가능한 카파-카라기난 하이드로젤 을 제조하였다. 또한 제조된 kappa-carrageenan-PEG-tyramine (ka-CGPT)의 구조분석 및 ka-CGPT 하이드로젤의 젤화 시간, 탄성률, 세포 생존율 등을 측정하여 특성분석을 하였다.
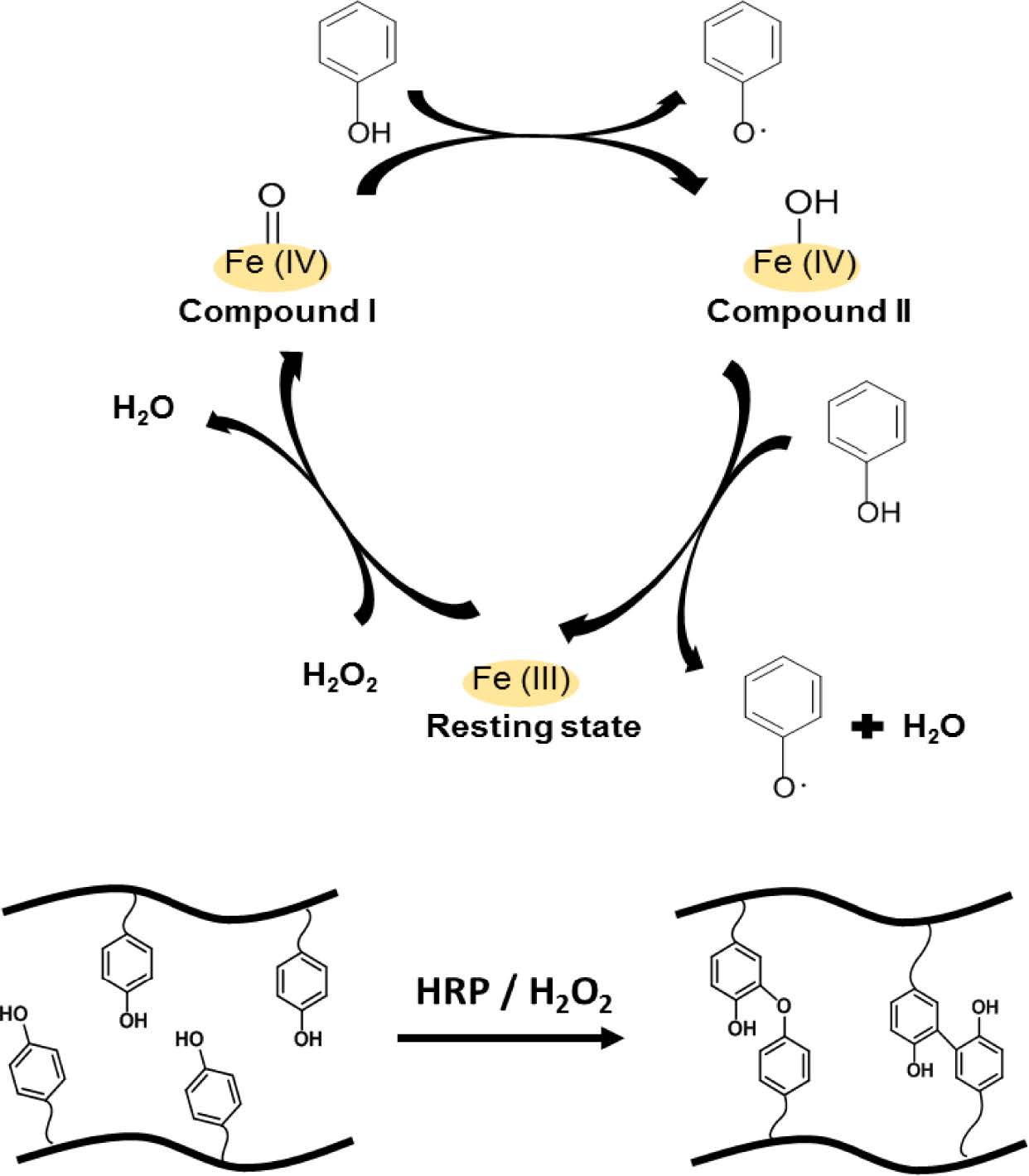
|
Figure 1 Schematic illustration of HRP mediated crosslinking method. |
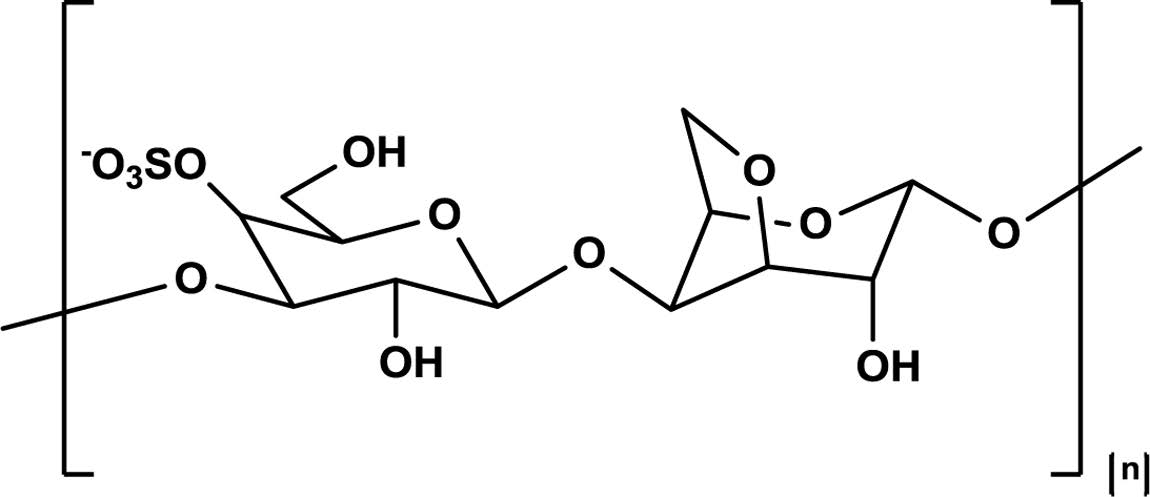
|
Figure 2 Structural disaccharide unit of κ-carrageenan. |
시료 및 시약. 카파-카라기난 중량평균 분자량(Mw, 3.0×105), hydrogen peroxide(30.0 wt%, H2O2), poly(ethylene glycol) 4 kDa, n-hydroxysuccinimide(NHS), p-nitrophenyl chloroformate( PNC), n,n-dimethylaminopyridine(DMAP), HRP, 1- ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride (EDC·HCl), Trizma® hydrochloride buffer solution(pH 8), ethylene diamine, calcium acetate, deuterium oxide(D2O)는 Sigma-Aldrich사에서 구입하여 그대로 사용하였다. 인간 피 부 섬유 아세포(hDFB)는 Lonza Incorporation에서 구입해서 사용했다. Dulbecco’s modified Eagle medium(DMEM), penicillin-streptomycin(PS), trypsin-EDTA는 Gibco BRL (Grand Island, NY, USA)에서 구입해서 사용하였고, EZCytotoxic Cell Viability Assay Kit는 ITS 바이오 회사에서 구입하여 사용했다.
카파-카라기난의 산화. ka-CG는 H2O2 및 Cu 촉매를 이용 해서 산화 환원 반응을 통해 산화되었다(Figure 3).18,19Ka- CG은 Tris 완충 용액(pH 8)으로 90 ℃에서 3시간 동안 가열 해서 용해시킨 후, 50 ℃로 냉각시켰다. 냉각된 반응액에 30% H2O2와 0.1% CuSO4 촉매 수용액을 첨가하고 50 ℃에서 5시간 교반하면 투명한 색깔의 용액이 된다. 또한 반응 이후, 반응하지 않은 H2O2, CuSO4는 고분자 투석막(MWCO 6~8 kDa) 을 사용해서 제거한다.
NH2-PEG-Tyramine 합성. 산화된 ka-CG에 페놀기를 도입하기 위해서 NH2-PEG-tyramine(TA)을 합성하였다. 처음에 PEG의 양 말단기가 아민기와 반응할 수 있는 PNC로 치환되었고, 치환된 알코올기 중 1개는 tyramine으로 치환되었고, 다른 하나는 아민기로 치환되었다. PEG(4 kDa)를 methylene chloride(MC)에 25 oC에서 용해시켰다. PNC를 N2 가스 조건 하에 25 ℃에서 MC에 용해시켰다. 또한 MC에 용해된 DMAP 용액을 PNC 용액에 첨가하였다. 그 이후, PEG 용액을 PNC 용액에 첨가하였다. 이 반응은 N2 가스 및 상온조건에서 24 시간 동안 진행되었다. 그 후 생성된 용액을 과량의 디에틸 에테르를 사용하여 2회 침전하였다. 침전 후, 생성물을 세라믹 필터로 여과하고 48시간 동안 진공 오븐에서 건조해서 PNC-PEG-PNC를 얻었다. 제조된 PNC-PEG-PNC를 N2 가스 조건 하에서 DMF에 용해시켰다. 그 이후, 반응 생성물을 N2 가스 조건하에 tyramine 용액을 서서히 떨어뜨리고 10시간 동안 교반하여 PNC-PEG-tyramine를 제조하였다. 반응된 용액에 DMF 용매에 용해된 과량의 ethylene diamine 용액을 서서히 떨어뜨리면서 24시간 동안 반응하였다. 이어서, 생성된 용액을 세라믹 필터로 여과하고 진공 오븐에서 24시간 동안 건조해서 NH2-PEG-tyramine을 얻었다. 합성의 모식도는 Figure 4에 나와 있다.
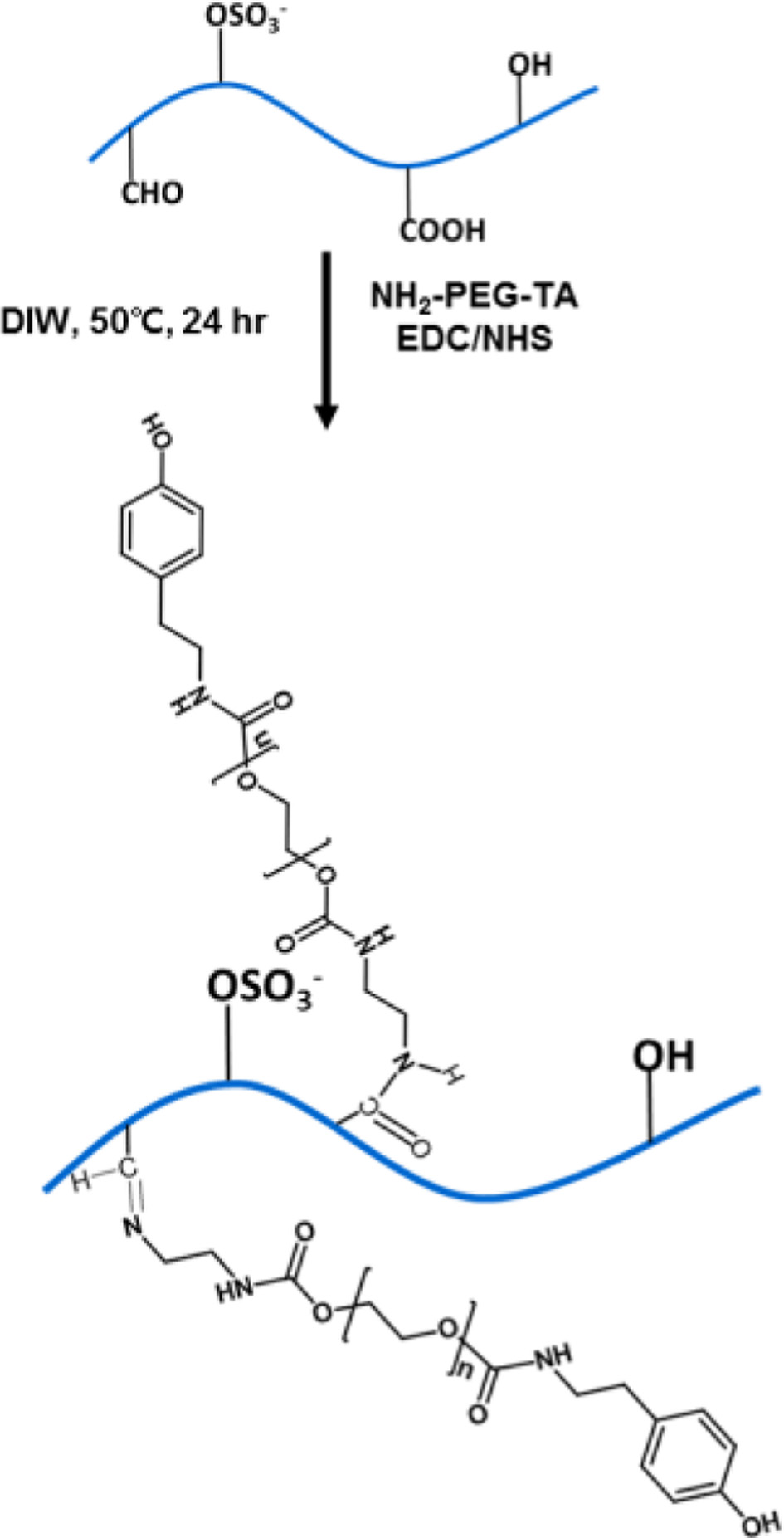
ka-CGPT 합성. ka-CGPT는 Figure 5와 같이 schiff-base 반응 또는 EDC/NHS 반응을 통해 NH2-PEG-tyramine을 결 합시켜 합성하였다. 산화된 카파-카라기난을 증류수에 용해 시킨 후, NH2-PEG-tyramine을 첨가하여 24시간 동안 50 ℃ 에서 반응시켰다. 반응 후, 고분자 투석막(MWCO 12000~ 14000 Da)을 사용하여 증류수에서 3일 동안 투석해서 미반응 물질을 제거했다. 투석된 용액은 동결 건조하여 파우더 형태의 고분자를 얻었다.
산화된 ka-CG의 산화량 정량. 산화된 ka-CG의 카복실기의 함량은 칼슘-아세테이트를 사용해서 계산하였다.19 산화된 ka-CG의 카복실산 그룹은 칼슘-아세테이트같은 약산 염과 반 응할 수 있다. 산화된 Ka-CG를 증류수에 넣고 칼슘-아세테 이트를 첨가하여 2시간 동안 반응시키고 소량의 페놀프탈레 인 용액을 소량 떨어뜨린 뒤, NaOH 수용액을 첨가해서 중 화적정방법으로 핑크색으로 변할 때까지의 부피를 측정하였 다. 초기조건은 산화되지 않은 카파-카라기난으로 산화된 ka-CG와 동일한 방법으로 측정하였다. 산화된 ka-CG의 카복실기 함량은 다음 식을 사용하여 계산하였다. COOH(%)=(Volf− Voli)×[NaOH]×카복실기 MW×100/산화된 ka-CG의 질량이다. Volf는 중화적정에 사용된 NaOH의 부피이며, Voli는 중화적 정전 대조군의 부피이다. 산화된 ka-CG의 알데히드 기의 정 량방법은 알데히드 기와 NH2-OH는 산성조건에서 oxime을 형성하며, oxime의 π-π 공역 계때문에 233 nm의 파장에서 UV 흡광도를 통해서 측정하였다. 표준 곡선을 그리기 위해 서 glyoxal에 소량의 아세트산 나트륨 용액을 첨가 후, NH2- OH 용액을 첨가하고 55℃에서 1시간 동안 반응하였다. 반응 후, 생성된 oxime용액을 증류수로 희석하고 UV-visible spectroscopy machine(V-750, jasco, Japan)으로 233 nm파장에서 흡광도를 측정했다. 초기 조건으로는 증류수를 사용하 였다. UV 흡광도에 대한 알데히드 기의 몰농도 표준 곡선을 작성했다. 산화된 ka-CG의 알데히드 기 함량을 결정하기 위 해 표준 곡선과 같은 방법으로 측정하였다. x는 산화제 용액 의 알데히드 몰농도(mol/L), Y는 233 nm에서의 UV 흡광도이다.19
합성된 ka-CGPT의 1H NMR 분석. NH2-PEG-tyramine 및 ka-CGPT의 화학 구조는 D2O를 용매로 사용하여 1H NMR spectroscopy(JNM-ECZR 600MHz, JEOL, USA)로 측정하였다.
FTIR 분석. 산화된 ka-CG의 산화 여부를 정성적으로 분석 하기 위해서 적외선 분광 광도계(Nicolet is50, Thermo Scientific, MA, USA)를 이용해서 4000~400 cm-1 파장에서 분석하였다.
ka-CGPT 하이드로젤 제조. ka-CGPT 하이드로젤은 HRP 매개 반응을 통해서 제조되었다. ka-CGPT를 증류수에 용해 시켜 10 wt% 수용액을 제조하고, 두 개의 수용액으로 분리하였다. 초기 용액은 HRP와 혼합하고 다른 용액은 H2O2와 혼합하였다(ka-CGPT 용액의 부피비:HRP, H2O2=9:1).
ka-CGPT 하이드로젤의 젤화 시간. ka-CGPT의 젤화 시간은 HRP 또는 H2O2를 각각 포함하고 있는 150.00 μL의 용 액을 1.70 mL 마이크로 튜브에서 혼합한 뒤 vial tilting 방법을 사용해서 젤화 시간을 측정했다. 사용한 HRP의 농도는 0.005~0.025 mg/mL고, H2O2의 농도는 0.035 wt%로 고정했다.
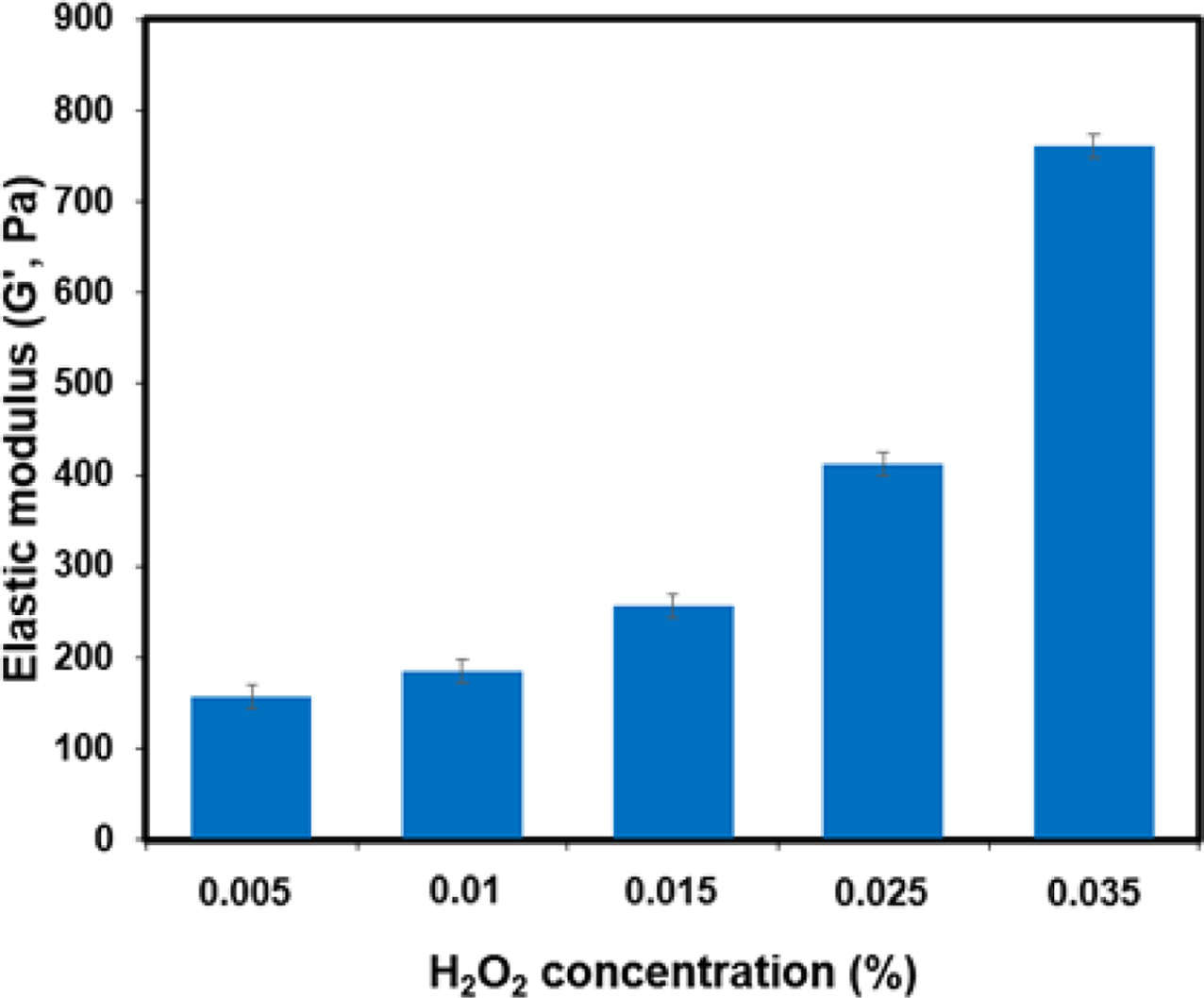
ka-CGPT 하이드로젤의 탄성률. ka-CGPT 하이드로젤의 탄성률(G')은 평행판 진동 조건(간격=0.05 cm, 직경=2.5 cm) 에 의해 0.1 Hz의 주파수 및 0.01%의 변형률을 가지는 진동 모드의 조건에서 측정하였다. HRP는 0.025 mg/mL 농도로 고 정한 후, H2O2 농도(0.005~0.035 wt%) 조건에서 탄성률을 측정했다.
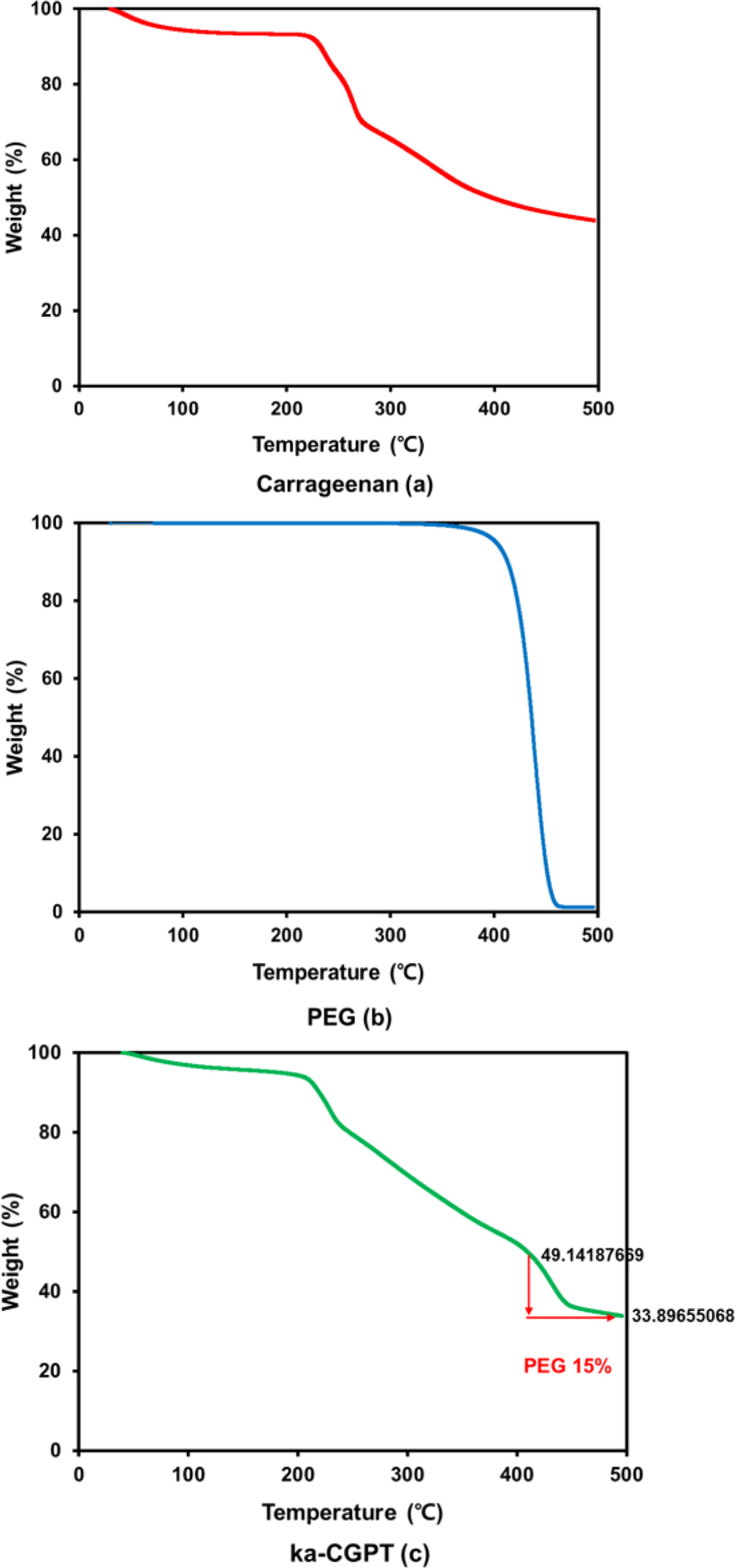
열적 특성 측정. ka-CGPT의 카라기난과 PEG의 조성에 따른 열적 특성을 TGA(TGA-Q50, TA Instruments, USA)을 사용해서 측정했다. 측정조건은 25~500 oC의 범위에서 10 ℃/ min의 속도로 높여서 열분해 거동을 측정했다.
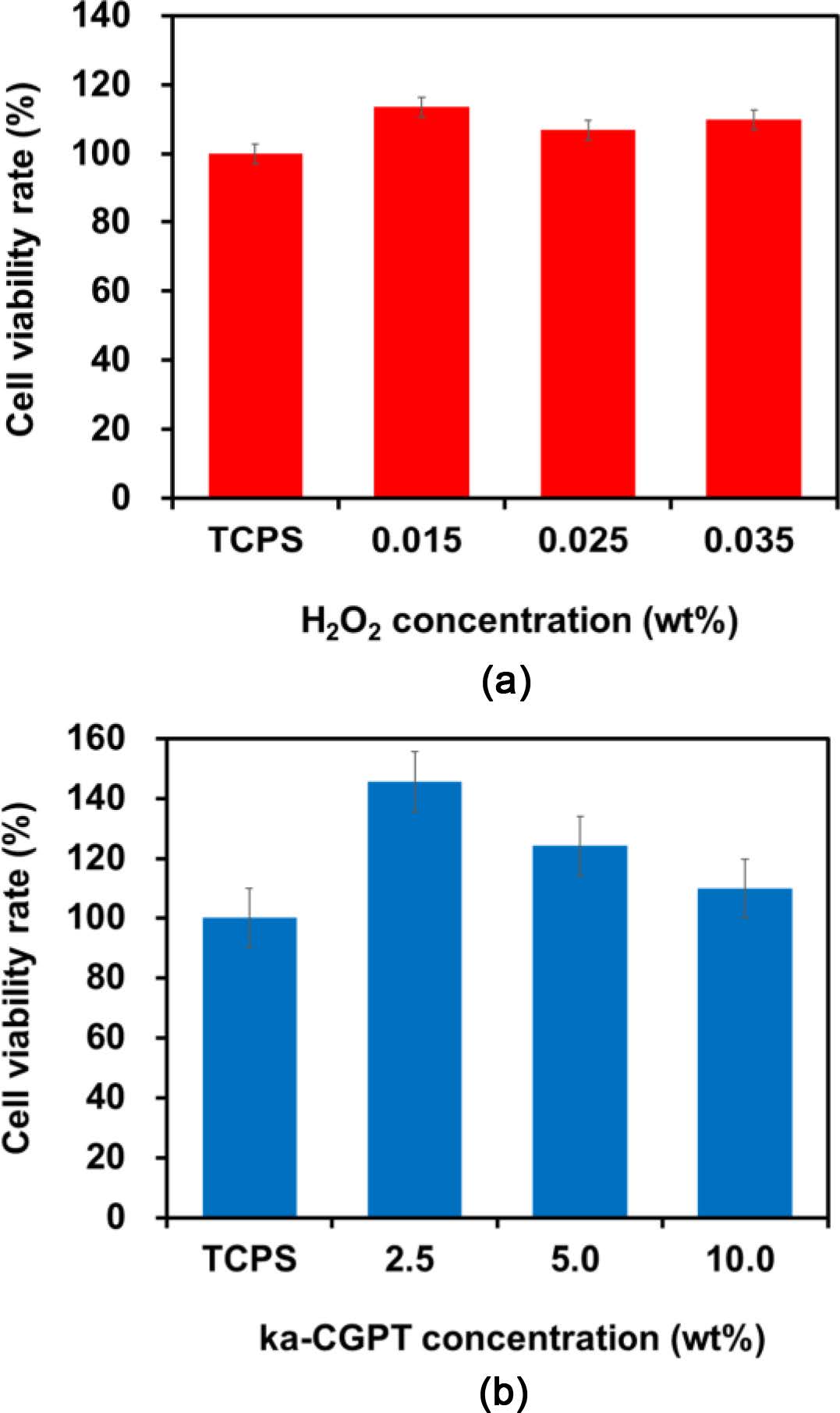
세포 독성 실험. ka-CGPT와 H2O2 농도에 따른 세포 독성 을 측정하기 위해서 WST-1 assay 방법을 사용했다. 인간 피부 섬유 아세포(hDFB)를 사용해서 세포 독성을 간접 접촉법으로 측정했다. 24 well plate에 hDFB를 5×104 cell/mL, 10% FBS, 1% PS가 보충된 DMEM 배양액을 37 ℃, 5% CO2 조건에서 조직 배양 플레이트(TCPS)에 배양한다. 사용하기 전에 ka-CGPT, HRP 및 H2O2 용액을 주사기 필터(기공 크기 200 nm)로 멸균시켰다. 그 다음, ka-CGPT 하이드로젤을 300 μL, 37 oC 및 5% CO2 조건에서 24 시간동안 DMEM 배 지에 담근 후의 용출물을 배양한 hDFB이 있는 배지에 각각 의 조건에 넣어준 후 1일 동안 WST-1 assay를 진행했다. 실 험 후, multi plate spectrophotometer(VersaMax tunable microplate reader; Molecular Devices, Sunnyvale, CA, USA) 로 450 nm의 파장에서 흡광도를 측정했다. 세포 생존율은 다음의 식을 사용하여 계산하였다. 세포 생존율(%)=(샘플 흡광 도/대조군 흡광도)×100.
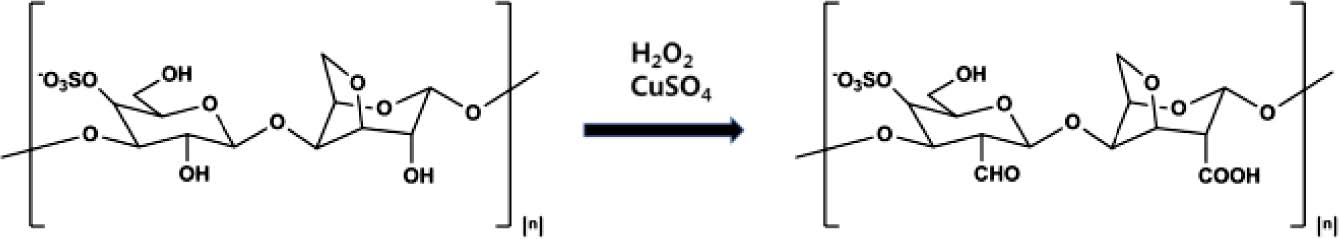
|
Figure 3 Synthesis of oxidized ka-CG. |
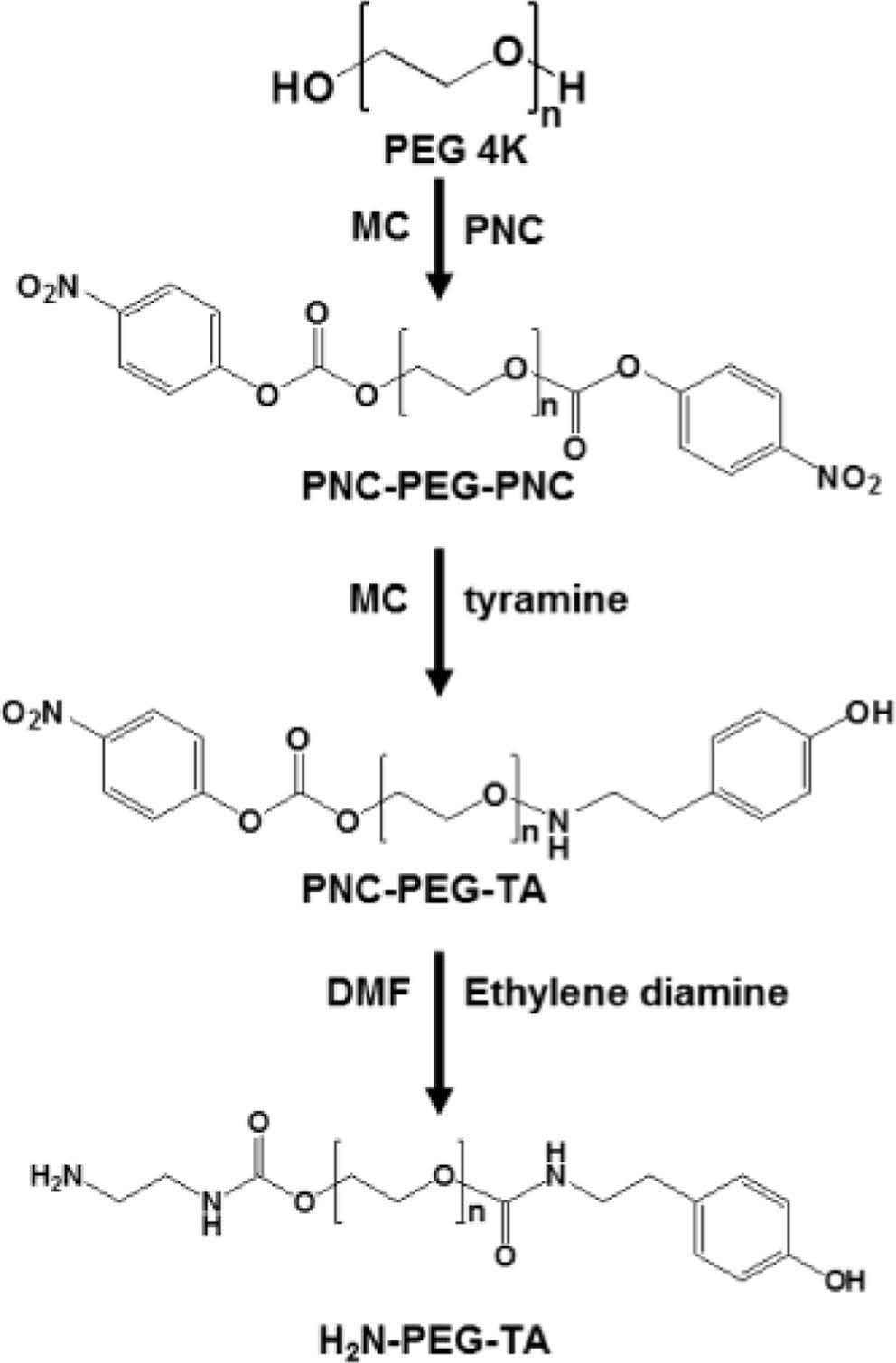
|
Figure 4 Synthesis of NH2-PEG-tyramine. |
|
Figure 5 Synthesis of ka-CGPT. |
산화된 ka-CG의 산화량 측정. ka-CG의 카복실기 및 알데 히드기를 도입하는 다양한 산화 방법 중에서 가장 환경적으 로 안전하고 경제적인 과산화수소 산화 환원 반응을 이용하 여 산화하였다.19 카복실기는 중화적정 방법을 사용해서 약 4%의 값을 얻었다. 알데히드기는 glyoxal로 표준 곡선을 구 했으며, x=(Y−0.0015)/6×10-5 식에 대입한 결과 약 91.6 μmol/ g의 값을 얻었다.
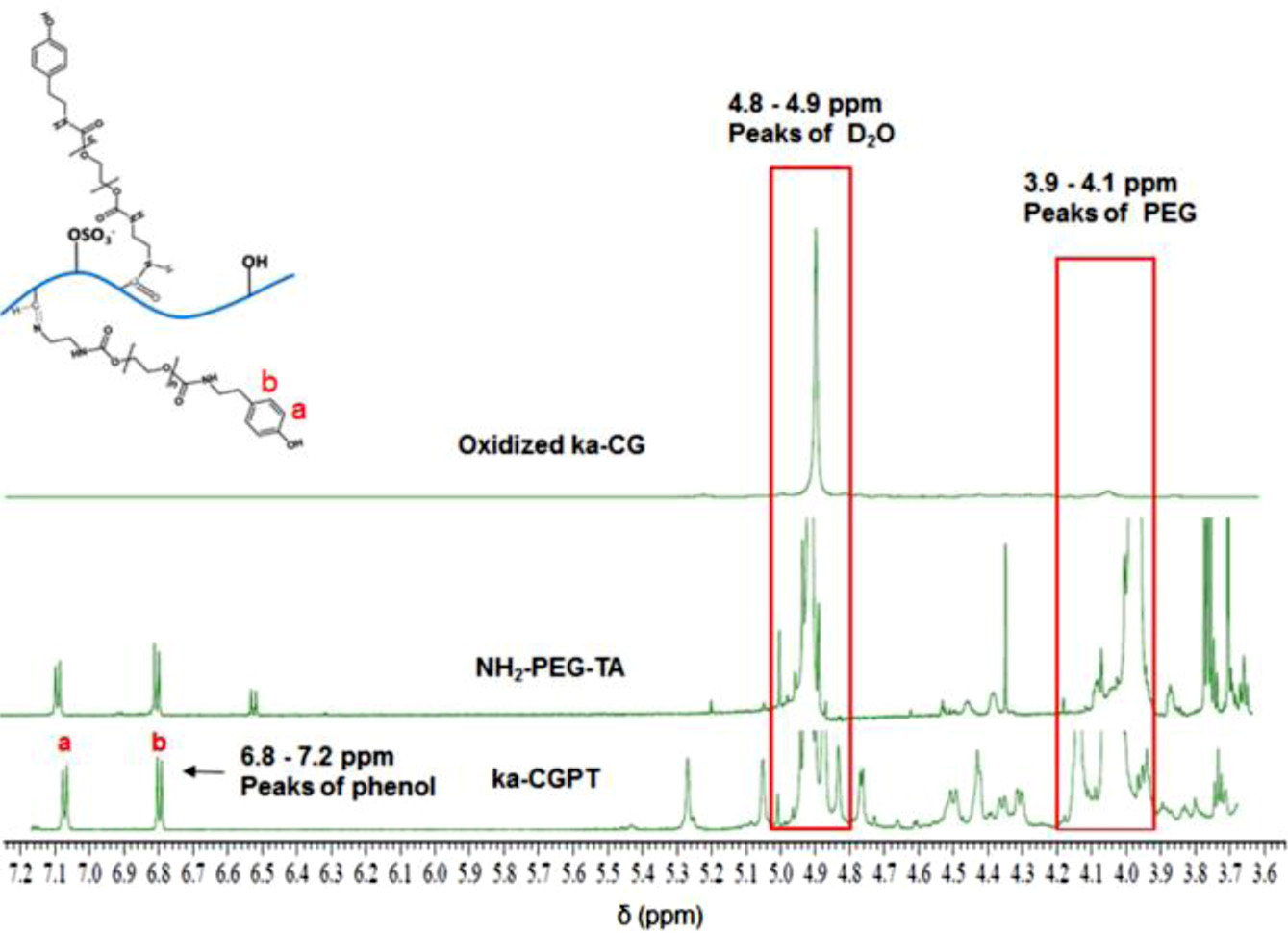
1H NMR 분석. 합성된 NH2-PEG-tyramine, ka-CGPT의 화 학 구조를 확인하기 위해 1H NMR 분석결과를 Figure 6에 나타내었다. 측정 시 사용된 용매는 D2O를 사용하여 측정했다. 측정결과 PEG 피크는 3.9~4.1 ppm에서 확인되었고, tyramine의 피크는 6.8~7.2 ppm에서 확인하였다. 측정 결과 산화된 ka-CG에 PEG 및 tyramine이 도입되었음을 알았다.
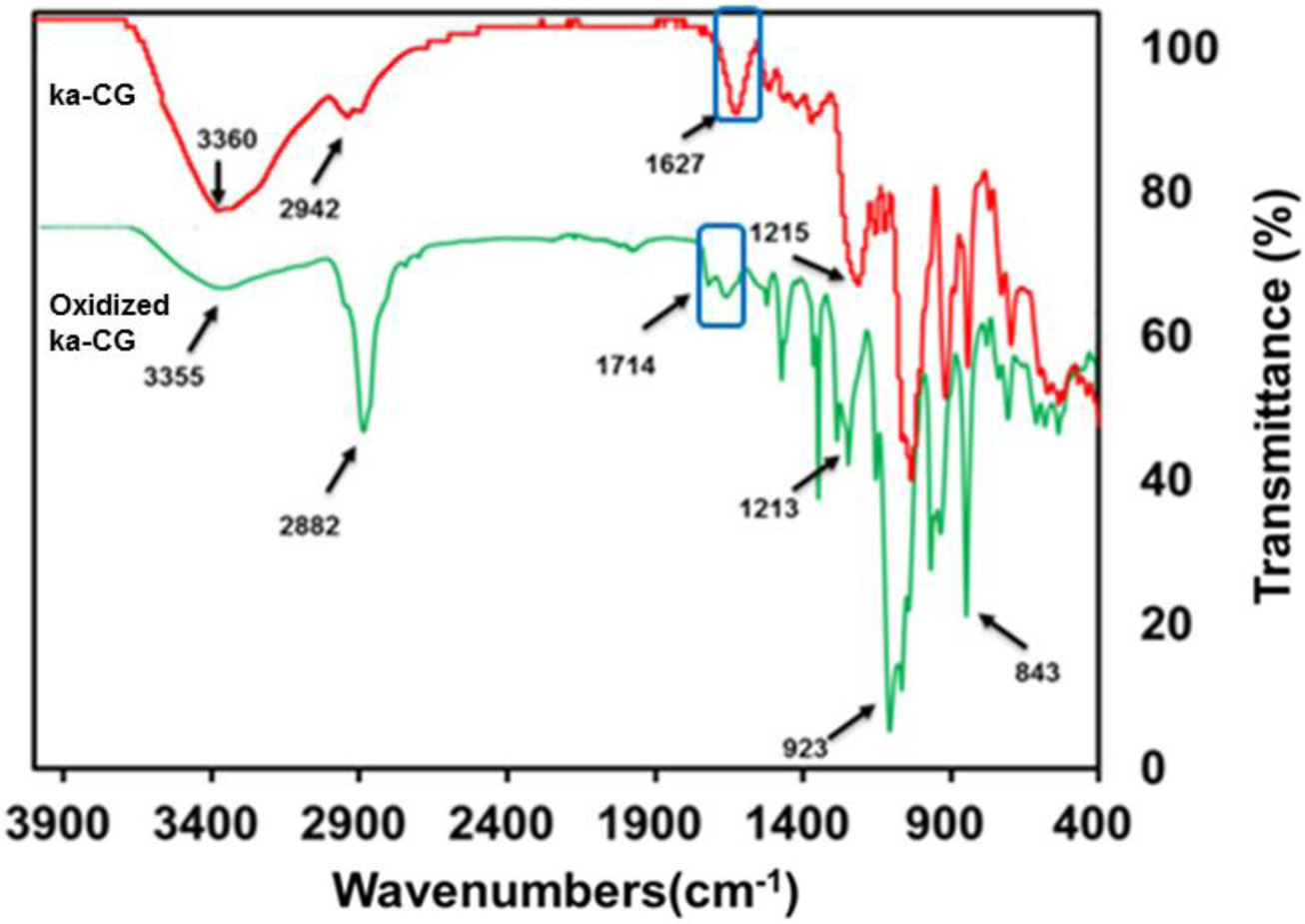
FTIR. 산화된 ka-CG의 산화 여부를 정성적으로 확인하기 위해서 FTIR 방법으로 측정하였다. 산화된 ka-CG는 3355, 2882, 1714, 1213, 923, 843 cm-1에서 피크를 관찰할 수 있었 다. OH 그룹의 신축 진동으로 인한 3000~3600 cm-1 범위의 피크, 2882 cm-1의 피크는 CH2의 비대칭 진동에 의한 것이며, 1200-1280 cm-1에서 관찰된 피크는 OSO3 −기의 S=O의 진동 으로 인해서 관찰된 결과이다. 또한 galactose-4-sulphate에 해 당하는 피크가 843 cm-1에서 관찰되었고, 3,6-anhydro-Dgalactose에 해당하는 피크가 923 cm-1에서 확인되었다. 이러한 측정 결과는 H2O2의 산화 환원 반응에 의해 ka-CG의 방향족 환 구조가 붕괴되지 않았음을 알았다. 또한 산화 이후, 1714 cm-1의 새로운 피크는 탄소와 산소 이중 결합의 신축 진 동에 의한 것이며, 1700~1750 cm-1 파장 영역이 카복실기의 피크이기 때문에 산화 후, ka-CG에 성공적으로 카복실기가 도입되었음을 알았다. 이러한 피크는 Figure 7에 나와 있다.
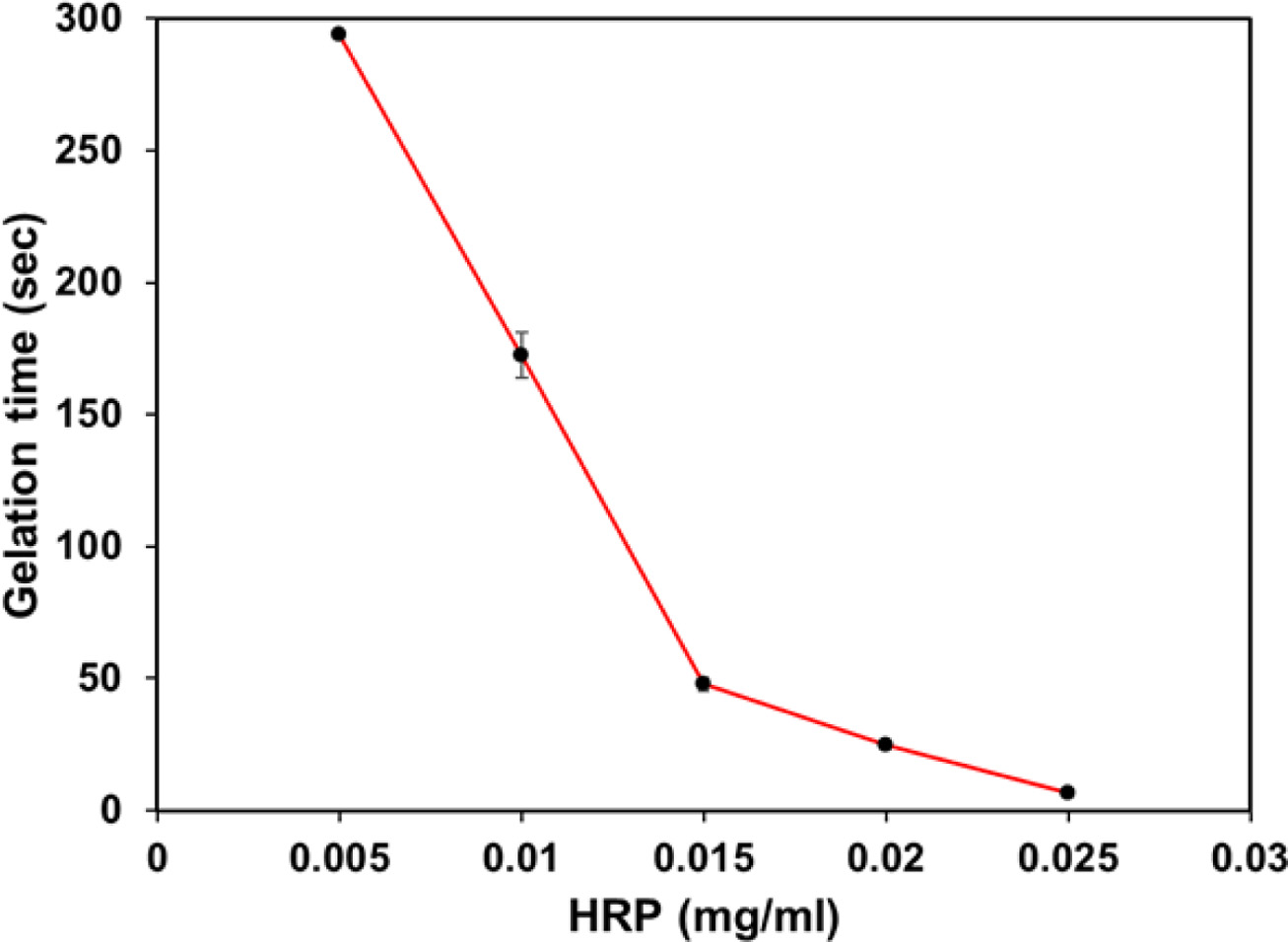
젤화 시간. ka-CGPT 하이드로젤의 젤화 시간은 vial tilting 방법으로 측정하였다. HRP를 이용한 효소 매개 반응은 HRP 의 농도가 높아질수록 젤화 시간이 감소한다. 젤화 시간 측정 시, H2O2 농도를 0.035 wt%로 고정한 후, HRP의 농도가 0.005에서 0.025 mg/mL로 증가함에 따라서 젤화 시간이 5~300초로 조절되었다(Figure 8). 이러한 결과는 HRP 농도가 높아질수록 phenoxy radical 형성 속도를 증가시키기 때문이다.
탄성률. ka-CGPT 하이드로젤의 주파수에 따른 탄성률을 측정하였다. HRP 농도는 0.025 mg/mL로 고정한 후, H2O2 농 도를 0.005에서 0.0035 wt%로 증가함에 따라서 탄성률(G')을 측정했다(Figure 9). 측정한 결과, H2O2 농도가 증가함에 따 라 탄성률이 증가하였는데 그 이유는 phenoxy radical의 총 생성량이 증가하기 때문이다.
열적 거동 측정. 합성된 ka-CGPT의 ka-CG와 PEG의 함량 을 알아보기 위해서 열적 성질을 측정한 결과를 Figure 10에 나타내었다. TGA 열 분석 방법은 온도변화에 따라서 시료의 질량 변화를 측정하는 방법이다. 분해 온도를 측정함으로써 시료 중의 성분의 함량을 측정할 수 있다. TGA 열분석 결과에 따라서 ka-CG의 질량비는 220 ℃~500 ℃에서 50% 감소 하였다. 또한 PEG는 400~460 oC에서 완전히 분해된다. 또한 ka-CGPT는 PEG의 질량이 400~460 ℃에서 15~17% 감소했 기 때문에 ka-CGPT내에 PEG 성분함량이 약15~17%임을 알 수 있다.
ka-CGPT 하이드로젤의 세포독성 실험. 인간 피부 섬유 아세포(hDFBs)에 대한 다양한 고분자 농도(2.5~10 wt%)와 H2O2 농도(0.005~0.035 wt%)에 따른 ka-CGPT 하이드로 젤 의 in vitro 조건에서 2D 세포 독성을 1일 동안 WST-1 assay 를 통해 간접적인 방법으로 측정하였다(Figure 11). 측정 결과, 다양한 고분자 농도(2.5~10 wt%)와 H2O2 농도(0.005- 0.035 wt%)에 따라서 세포 생존율이 약 110~140%의 결과를 보였다. 이러한 결과를 통해서 ka-CGPT 하이드로젤이 세포 독성이 없음을 알 수 있었다.
|
Figure 6 1H NMR spectra of NH2-PEG-TA, ka-CGPT, and oxidized ka-CG. |
|
Figure 7 FTIR spectra of ka-CG and oxidized ka-CG. |
|
Figure 8 Gelation time of ka-CGPT hydrogels. |
|
Figure 9 Elastic modulus of ka-CGPT hydrogels. |
|
Figure 10 Thermal gravimetric analysis of ka-CG (a); PEG (b); ka-CGPT (c). |
|
Figure 11 Cell viability test of hydrogels by varying concentrations of (a) H2O2; (b) ka-CGPT. |
수용성, 다당류 계열의 생체고분자인 카라기난은 고유의 생체적합성, 생분해성, 낮은 면역반응과 같은 생리학적 성질때문에 최근 생체 재료로 각광받고 있는 물질이다. 하지만, 본질적으로 열 가역적 젤을 형성하는 특성때문에 기존의 카라기난 하이드로젤은 주로 preformed 형식으로 제조되었으며, 생리적 조건에서 분해가 수 시간내에 빠르게 일어나고, 물성을 조절하기 어려우며, 자체 내 용해도가 매우 낮아 용해되는데 오랜 시간이 걸리는 한계점이 존재한다. 이에 착안하여 본 연구에서는 PEG를 도입해서 고분자의 물에 대한 용해성을 높이고, HRP 효소 매개 반응을 이용해서 주사 가능한 하이드로젤의 제조 및 특성을 분석하였다. ka-CGPT 하이드로
젤의 젤화 시간은 HRP 효소농도가 증가함에 따라 5~295초, 탄성률은 H2O2의 농도가 증가함에 따라 150~700 Pa까지 조절이 가능하였다. 또한 2차원의 in vitro 세포 실험을 통하여 좋은 세포적합성 및 세포 생존율(110~140%)을 보였다. 앞에서 설명했던 결과를 바탕으로 이번 연구를 통해서 카라기난 기반의 주입형 하이드로젤은 생체소재 분야에서 우수한 생체 소재로서 유망한 물질로 쓰일 수 있음을 기대하는 바이다.
- 1. S. M. Mihaila, A. K. Gaharwar, R. L. Reis, A. P. Marques, M. E. Gomes, and A. Khademhosseini, Adv. Healthc. Mater., 2, 895 (2013).
-

- 2. J. S. Lee, B. Wang, J. Y. Kim, Y. J. Kim, and J. H. Kim, Polym. Korea, 40, 759 (2016).
-

- 3. N. K. Singh and D. S. Lee, J. Control. Release, 193, 214 (2014).
-

- 4. I. M.-Harpaz, L. Hazanov, G. Engel, D. Yelin, and D. Seliktar, Adv. Mater., 27, 1933 (2015).
-

- 5. V. Hooshangi, M. Abasian, and Z. J. Naghadeh, Polym. Korea, 40, 829 (2016).
-

- 6. B. Y. Kim, Y. S. Lee, J. Y. Son, K. M. Park, and K. D. Park, Macromol. Biosci., 16, 1570 (2016).
-

- 7. D. Y. Kim, H. H. Park, and K. Y. Lee, Polym. Korea, 39, 412 (2015).
-

- 8. J. Dahlmann, A. Krause, L. Möller, G. Kensah, M. Möwes, and A. Diekmann, Biomater., 34, 940 (2013).
-

- 9. L. Cao, B. Cao, C. Lu, G. Wang, L. Yu, and J. Ding, J. Mater. Chem. B, 3, 1268 (2015).
-

- 10. C. Ghobril and M. Grinstaff, Chem. Soc. Rev., 44, 1820 (2015).
-

- 11. A. Atala, L. Cima, W. Kim, K. Paige, J. Vacanti, A. Retik, and C. Vacanti, J. Urol., 150, 745 (1993).
-

- 12. J. Elisseeff, K. Anseth, D. Sims, W. McIntosh, M. Randolph, and R. Langer, PNAS, 96, 3104 (1999).
-

- 13. J. Hu, G. Zhang, and S. Liu, Chem. Soc. Rev., 41, 5933 (2012).
-

- 14. J. Bae, J. Choi, Y. Lee, and K. D. Park, J. Tissue Eng. Regen. Med., 9, 1225 (2015).
-

- 15. A. Sivashanmugam, R. A. Kumar, M. V. Priya, S. V. Nair, and R. Jayakumar, Eur. Polym. J., 72, 543 (2015).
-

- 16. C. Fan, J. Fu, W. Zhu, and D. A. Wang, Acta Biomater., 33, 51 (2016).
-

- 17. R. Yegappan, V. Selvaprithiviraj, S. Amirthalingam, and R. Jayakumar, Carbohydr. Polym., 198, 385 (2018).
-

- 18. L. U. Yan, K. Qin-Ming, J. Rong, H. Xiao, and Z. Pu-Xin, Polym. Degrad. Stab., 98, 1103 (2013).
-

- 19. M. Zhu, L. Ge, Y. Lyu, Y. Zi, X. Li, D. Li, and C. Mu, Carbohydr. Polym., 174, 1051 (2017).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(2): 309-315
Published online Mar 25, 2019
- 10.7317/pk.2019.43.2.309
- Received on Dec 24, 2018
- Revised on Jan 8, 2019
- Accepted on Jan 13, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Ki Dong Park
-
Department of Molecular Science and Technology, Ajou University, 5 Wonchon, Yeongtong, Suwon 16499, Korea
- E-mail: kdp@ajou.ac.kr
- ORCID:
0000-0002-4825-6609










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.