- Synthesis of Semi-IPN Polymer Electrolytes Containing Binary Lithium Salt and Their Electrochemical Properties
Department of Engineering Chemistry, College of Engineering, Chungbuk National University, Cheongju, Chungbuk 28644, Korea
- 이성분 리튬염을 포함하는 Semi-IPN 고분자 전해질의 합성과 전기화학적 특성
충북대학교 공과대학 공업화학과
In this study, we have synthesized a poly(methylsiloxane-g-PEO) with ethylene oxide groups and prepared polymer electrolytes using lithium perchlorate (LiClO4) or LiClO4 with lithium methacrylate (BF3-LiMA). In the electrochemical measurement after UV curing of the polymer electrolyte, BF3-LiMA-introduced binary lithium salt had a high room temperature ionic conductivity of 2.63×10-5 S/cm and it was able to obtain relatively better electrochemical stability of 5 V. The prepared polymer electrolyte was then impregnated and crosslinked on the LMO electrode to fabricate a composite electrode, and a battery test consisting of a lithium/electrolyte/composite electrode was performed. As a result, although the high interface resistance of the oxidation electrode was observed in the binary lithium salt system, the capacity retention characteristic was better than that of the LiClO4 salt system.
본 연구에서는 에틸렌옥사이드기를 가지는 poly(methylsiloxane-g-PEO)를 합성하고 lithium perchlorate(LiClO4), 혹은 LiClO4와 lithium methacrylate(BF3-LiMA)를 함께 사용한 고분자 전해질을 제조하였다. 자외선 경화 후 이온전도도 측정결과 BF3-LiMA가 도입된 이성분 리튬염에서 2.63×10-5 S/cm의 높은 상온 이온전도도와 5 V 이하에서 상대적으로 더 우수한 전기화학적 안정성을 확보할 수 있었다. 또한 제조된 고분자 전해질을 LMO 전극에 함침 및 가교시켜 복합전극을 제작하였으며 리튬/전해질/복합전극으로 구성된 전지실험을 실시하였다. 그 결과 이성분 리튬염에서 산화전극의 높은 계면저항이 관찰됨에도 불구하고 단일성분 리튬염보다 우수한 수명특성을 확보할 수 있었다.
Keywords: polysiloxane, electrolyte, single ion, ionic conductivity, cycle performance
고체 고분자 전해질은 기질의 유동성을 통해 이온의 이동이 가능한 재료로서 연료전지, 태양전지 및 리튬이온 이차전지 등 에너지 저장분야에서 많은 관심을 받고 있다.1,2 특히 하이브리드 전기자동차와 같이 대형전지가 활용되는 다양한 분야에서 고출력, 고용량화에 따른 안전성 저하를 근본적으로 해결한다는 측면에서 많은 연구가 진행되고 있다.3,4 고체 고분자 전해질을 리튬이온 이차전지에 응용하기 위해서는 실온에서 10-4 S/cm 이상의 이온전도도, 전극활물질과의 낮은 전하이동저항, 넓은 전기화학적 안정성 등의 성능이 요구된다. 하지만, 현재 고체 고분자 전해질이 채용된 전지는 폭넓게 상용화되지 못하고 있는 상황으로 낮은 이온전도성, 장기충방전 운전에 기인한 리튬염의 분극현상 및 환원전극과의 높은 계면 저항성에서 원인을 찾을 수 있다.5-7
고체 고분자 전해질의 이온전도도는 낮은 유리전이온도를 갖는 분자구조의 설계를 통해 일부 해결할 수 있으나 장기운전 환경에서 발생하기 쉬운 리튬염의 분극현상은 고체 기질을 고려할 때, 쉽게 해결할 수 없는 문제이다. 분극현상을 원초적으로 차단할 수 있는 단일이온성 고분자 전해질은 이에 대한 궁극적인 대안으로 충분한 가치를 가지고 있다. 단일이온성 고분자 전해질은 리튬염 형태의 단량체를 고분자 사슬에 도입하여 음이온을 고정하는 시스템으로 분극현상을 차단할 수 있는 장점이 있다.8-10 하지만, 고정된 음이온에 의한 이온전도도의 감소는 상온에서 10-5 S/cm 이상의 전도도 확보를 어렵게 한다. 환원전극 활물질과의 높은 계면저항은 고체고분자 전해질과 고체 활물질이 만드는 계면이 통상의 액체 전해액/고체 활물질 계면과 다르기 때문으로 액체전해액 계에서는 유기 용매가 활물질, 바인더, 전도성 첨가제 등이 복합화되어 있는 전극층을 침투하여 원활한 이온의 전달이 가능하지만 고체 고분자 계에서는 불가능하기 때문이다. 따라서 이온전도성 고분자 전해질이 활물질과 함께 혼합되어 있는 복합전극의 제작 및 이온전달 통로의 확보가 필수라고 할수 있다.11 한편, 고분자 전해질이 활물질과 혼합될 경우 극성전해액에 의한 팽윤 및 용해가 일어날 가능성이 있다. 이는 장기적인 전지특성 확보에 큰 장애물이 될 수 있으므로 안정적으로 복합전극을 유지할 수 있는 방안이 고려되어야 한다. 이러한 측면에서 전해질의 역할을 수행하면서 동시에 활물질을 강하게 결착시킬 수 있는 가교결합형 고분자의 개발이 필요하다. 자외선 경화형 레진은 광개시제에 의한 다관능 단량체의 연속적인 중합이 가능한 고분자로서 가교후 용매에 팽윤될 뿐, 녹지않는 3차원 결합을 가지게 된다. 또한 자외선 경화는 열경화 대비 상대적으로 낮은 온도에서 진행하기 때문에 고열에 의한 리튬염의 분해를 막을 수 있다.12 하지만, 경화형 고분자 전해질의 전도도는 경화도에 따라 감소하기 때문에 낮은 경화도를 도입하거나 리튬이온의 이동이 용이하도록 하는 구조적 조절이 필요하다.
본 연구에서는 poly(ethylene oxide)(PEO) 가지를 가지는 폴리실록산을 합성하고 이관능 acrylate, LiClO4, 광개시제를 활용한 자외선 경화 시스템에 도입함으로써 semi-IPN(semiinterpenetrating polymer network) 구조를 갖는 고분자 전해질을 제조하였다. 또한 동일한 기질에 BF3가 추가된 lithium methacrylate(LiMA)를 도입, 이성분 리튬염을 포함하는 고분자 전해질을 합성하고 단일성분 리튬염 계열과의 특성변화를 비교 분석하였다. 특히 형성된 이성분 리튬염에 의한 이온전도도, 전기화학적 안정성의 변화를 관찰하고 기질의 유리전이온도와 연관성을 고찰하였다. 그리고 합성된 고분자 전해질을 환원전극 활물질에 함침, 가교시켜 복합전극을 구성하고 기초적인 전기화학적 특성을 평가하였다.
재료. BF3가 첨가된 lithium methacrylate(BF3-LiMA)는 이미 발표된 논문에 따라 합성하였다.13 PEO 가지를 가지는 폴리실록산 합성을 위해 poly(methyl hydrosiloxane)(PMHS, 2400 g/mol, Aldrich Co.), allyl polyether(APE, 230 g/mol, Dowcorning Co.), 염화백금산 촉매(H2PtCl6, 8 wt% 수용액, Aldrich Co.) 및 n-헥산(95%, Samchoen Chem. Co.), tetrahydrofuran(THF, 99.5%, Samchun)을 사용하였다. 고분자 전해질제조에는 lithium perchlorate(LiClO4, 99.99%, Aldrich Co.), poly(ethylene glycol)diacrylate(PEGDA, 575 g/mol, Aldrich Co.), 광개시제로 methyl benzoylformate(MBF, TCI Co.), 용매로 아세토니트릴(99.8%, Aldrich)을 정제없이 사용하였다. 전지 측정을 위해 1 M의 LiPF6가 들어있는 ethylene carbonate/diethylene carbonate=3/7(v:v) 전해액(파낙스이텍, battery grade)을 사용하였다. 전기화학적 기초특성 평가는 2016 코인셀(Hosen Co.)을 통해서 측정되었으며 환원전극 활물질로 LiMn2O4(LMO)극판(삼성SDI), 산화전극으로 리튬금속을 활용하였다.
Poly(methylsiloxane-g-PEO) 합성. PEO 가지를 가지는 폴리실록산은 Scheme 1에 나타낸 것과 같이 염화백금산 촉매의 활성으로 PMHS에 APE의 첨가반응이 진행되면서 합성된다. 구체적으로 25 ℃ 조건에서 APE 75 g과 염화백금산촉매 0.3 g이 녹아있는 반응기에 PMHS 15 g을 천천히 도입하였다. 이어서 24시간 교반 후 반응용액을 n-헥산에 두 번 침전시켜 미반응 PMHS를 제거하고 THF에 녹여 vial에 수거하였다. 그 후 60 ℃ 오븐에서 24시간 감압 건조 후 poly(methylsiloxane-g-PEO), PSiEO를 얻었다.
semi-IPN 고분자 전해질 제조. 불포화 이중결합이 양말단에 도입되어 있는 PEGDA를 가교제로 활용하여 semi-IPN 구조를 형성하였다. 구체적인 합성방법은 Scheme 2에 나타내었다. 먼저 리튬염 및 BF3-LiMA와 PEGDA를 아세토니트릴에 녹인 후 PSiEO를 첨가한다. 다음으로 혼합용액을 70 ℃ 오븐에서 24시간 동안 감압 건조하여 용매를 제거하였다. 이온전도도 측정을 위해 건조된 필름은 365 nm의 UV를 5분간 조사하여 광경화를 유도하였다.
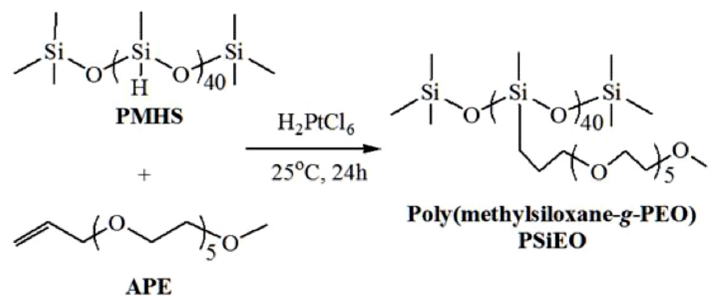
Scheme 1. Synthetic procedure for poly(methylsiloxane-g-PEO), PSiEO.
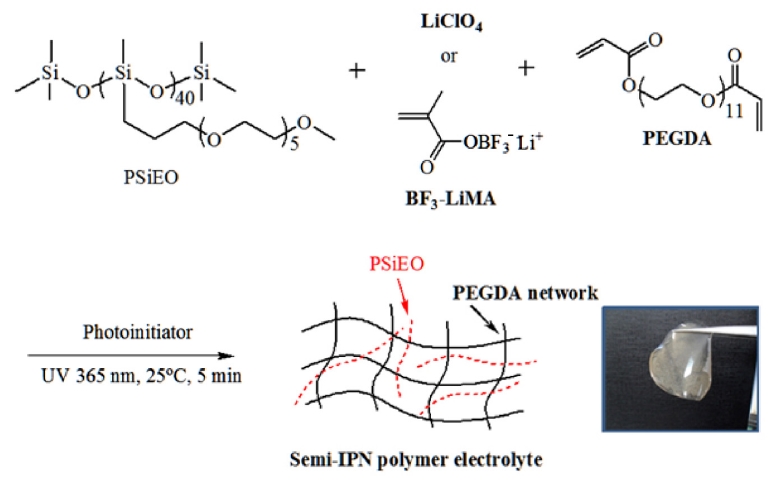
Scheme 2. Procedures for the preparation of semi-IPN polymer electrolytes.
복합전극의 제조. 고분자 전해질을 아세토니트릴에 녹여(농도: 0.55~0.68 g/mL) LMO 극판에 함침시킨 후 70 ℃ 오븐에서 24시간 동안 감압건조하였다. 다음으로 365 nm의 UV를 5분간 조사하여 가교결합을 유도, 고분자 전해질이 함침된 LMO 복합전극(P-LMO)을 제조하였다.
기기분석 및 전기화학측정. PSiEO 합성과정의 구조분석을 위해 1H NMR(핵자기공명 분광계, Bruker DPX, 500 MHz), FTIR(적외선 분광광도계, 480 plus, Jasco Co.)을 사용하였다. 또한 고분자 전해질의 열적 특성을 알아보기 위해 DSC(시차 주사 열량계, TA Q20, 승온속도 20 ℃/min)를 사용하였다. 고분자 전해질의 이온전도도는 주파수 1 Hz~1MHz 범위에서 전기화학 측정장치(1470E Multichannel Cell-test system, Solartron)를 통하여 계산되었다. 이때 사용된 고분자 전해질의 두께는 1 mm였으며 stainless steel 대칭셀로 제작하여 각 온도별로 측정하였다. 제조된 복합전극의 형상은 주사전자현미경(scanning electron microscope, SEM, Carl Zeiss Co., LEO 1530)으로 관찰하였다. 전기화학적 안정성평가는 1 mV/s 속도로 2~6 V까지 전류밀도변화를 관찰한 선형전위주사법(linear sweep voltammetry, LSV)으로 측정하였다. 이때 리튬박막을 대전극 및 기준전극으로 사용하고 stainless steel을 작용전극으로 한 3전극셀을 제작하였다. 기초적인 전지특성은 리튬금속을 산화전극, 복합전극을 환원전극으로 사용한 2016 코인셀 제조를 통해 측정되었으며 3.0~4.2 V 전압범위에서 충방전 실험을 진행하였다.
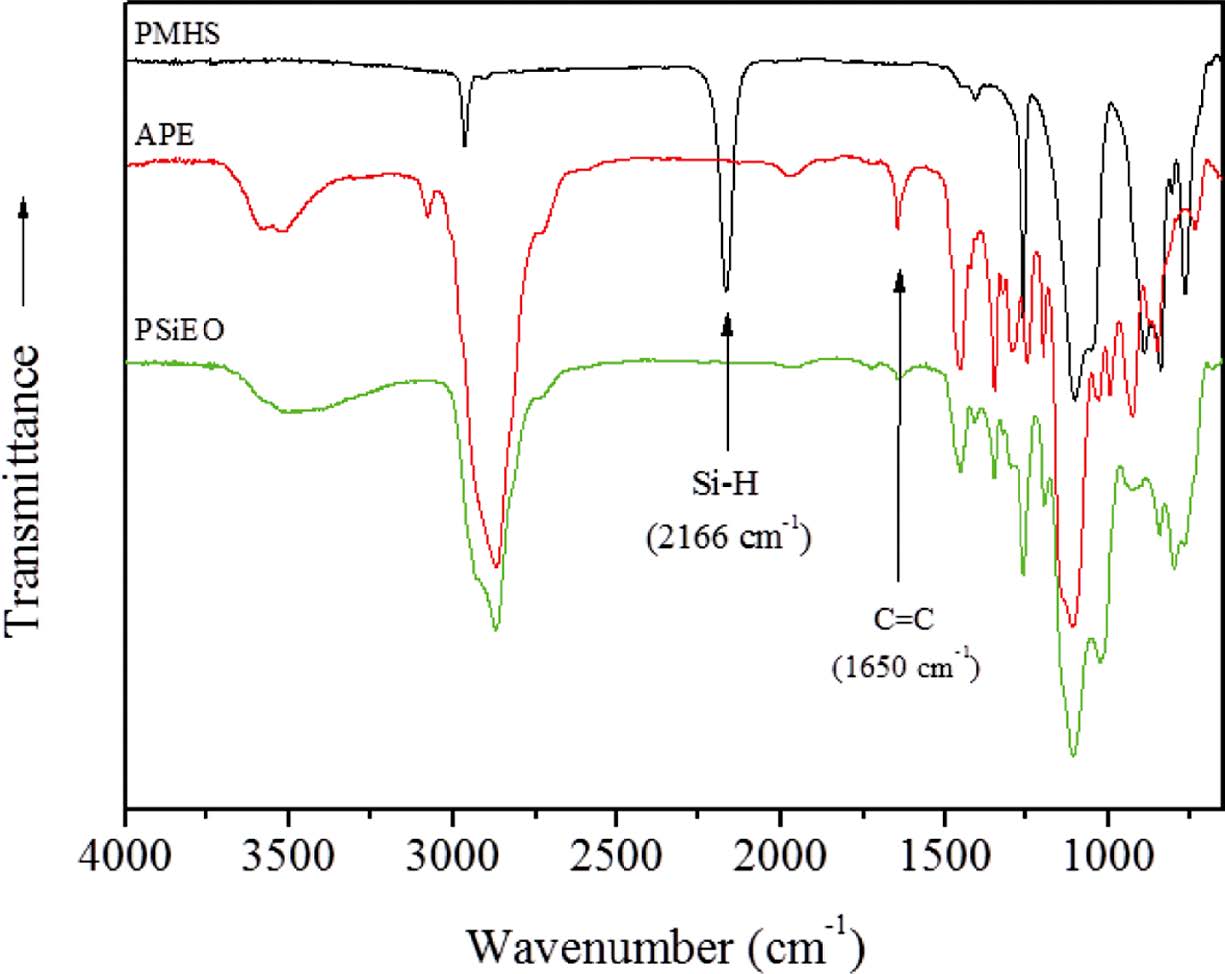
PEO 가지를 가지는 폴리실록산 고분자의 합성은 Scheme 1에 나타낸것과 같이 염화백금산 촉매하에 높은 반응성의 PMHS와 알릴그룹을 24시간 혼합함으로써 비교적 간단하게 진행된다. 반응후 과량으로 사용된 PMHS는 n-헥산의 침전과정을 통하여 제거될 수 있다. Figure 1에 나타낸 것과 같이합성 전과 후의 FTIR 피크를 비교하면 PMHS에서 발현되는 2166 cm-1의 SiH 피크가 완전히 사라지는 것을 알 수 있다.14 또한 APE의 C=C 이중결합을 나타내는 1650 cm-1의 피크 또한 크게 감소하는 것으로 추정할 때, PMHS로부터 수소제거가 진행되고 APE의 도입이 양호하게 이루어졌음을 짐작할 수 있다.
Figure 2는 합성된 PSiEO의 1H NMR 결과를 나타내었다. 실록산 주사슬(-SiCH3)에 기인하는 0.08 ppm의 피크와 APE의 첨가로부터 발현되는 0.46 ppm(Si-CH2-), 1.6 ppm(Si-CH2-CH2-) 및 3.4~3.7 ppm(-CH2-CH2-O-)의 피크를 관찰할 수 있다.
고분자 전해질은 Scheme 2에 나타낸 것처럼 PSiEO와 리튬염 및 가교제인 PEGDA를 혼합하고 광가교를 실시하여 제조되었다. 점성의 PSiEO는 유연성이 우수하지만 상온에서 필름물성을 확보할 수 없다. 따라서 본 연구에서는 자외선 가교가 가능한 시스템을 도입하였으며 결과적으로 semi-IPN 구조가 형성된다. 망상구조의 PEGDA기질에 유연한 특성의 PSiEO를 내포하는 가교결합형 복합체를 형성할 수 있다면 기계적으로 안정하면서 유연한 전해질의 특성을 그대로 유지할수 있을 것이다. 이것은 고분자 전해질이 가교될 경우 이온전도도가 크게 감소하는 기존의 연구결과를 참고했을 때, semi-IPN은 물성과 이온전도도를 동시에 확보할 수 있는 방법이 될 수 있다.
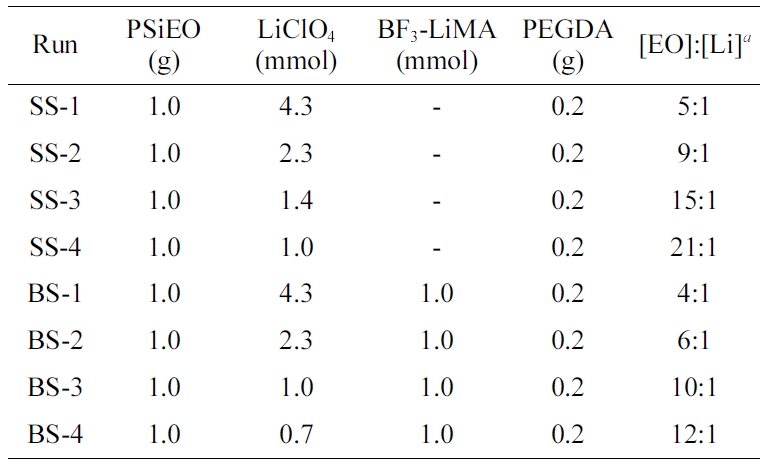
고분자 전해질 제조를 위한 자세한 혼합조성은 Table 1에 나타내었으며 크게 LiClO4만을 함유한 단일성분 리튬염계(single lithium salt, SS)와 LiClO4 및 BF3-LiMA를 모두 함유한 이성분 리튬염 계(binary lithium salt, BS)로 나눌 수 있다. BF3-LiMA는 단량체로 제조된 리튬염으로서 고분자합성과정에 참여하여 분자사슬에 도입되는 특징이 있다. 또한 전체 리튬염의 농도를 조절하여 [EO]:[Li] 비율을 4:1에서 21:1로 변화시켰다. 참고로 가교제로 사용한 PEGDA에서도 EO 기가 존재하지만 가교에 참여할 경우 사슬의 움직임이 제한되므로 본 계산에서는 PSiEO에 포함되는 EO기 만을 자유사슬로 고려하였다. 실제로 본 논문에서 나타내지는 않았지만 PEGDA의 양이 증가할수록 이온전도도가 감소되는 결과를 얻을 수 있었다.
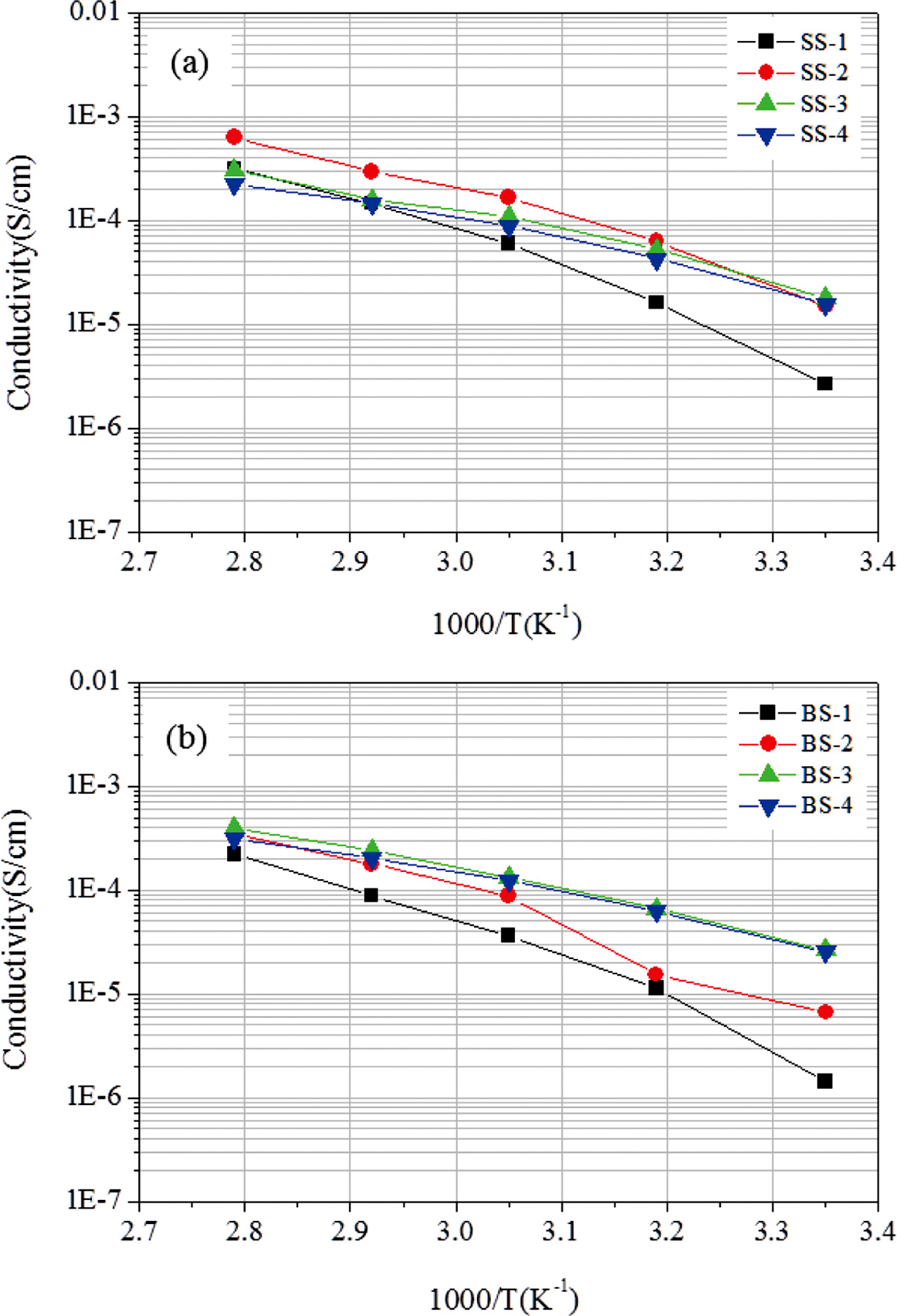
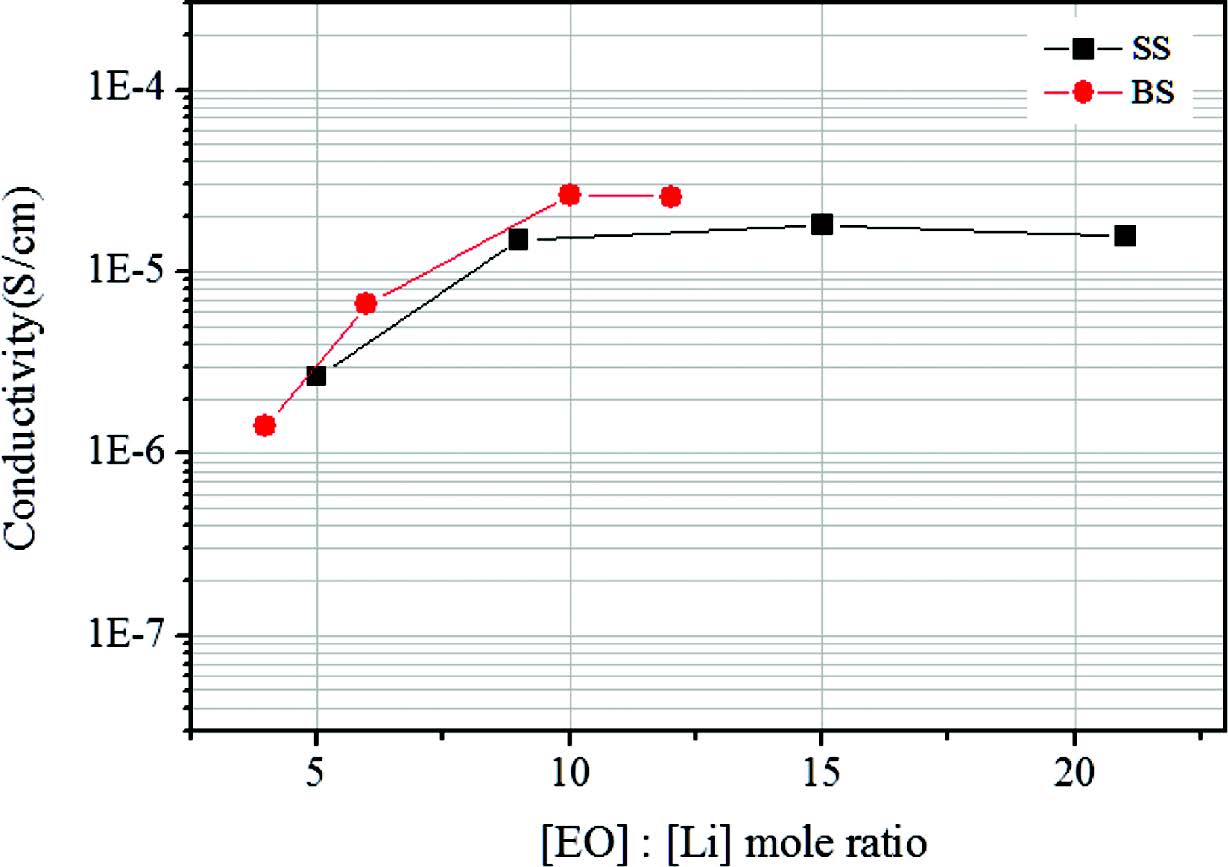
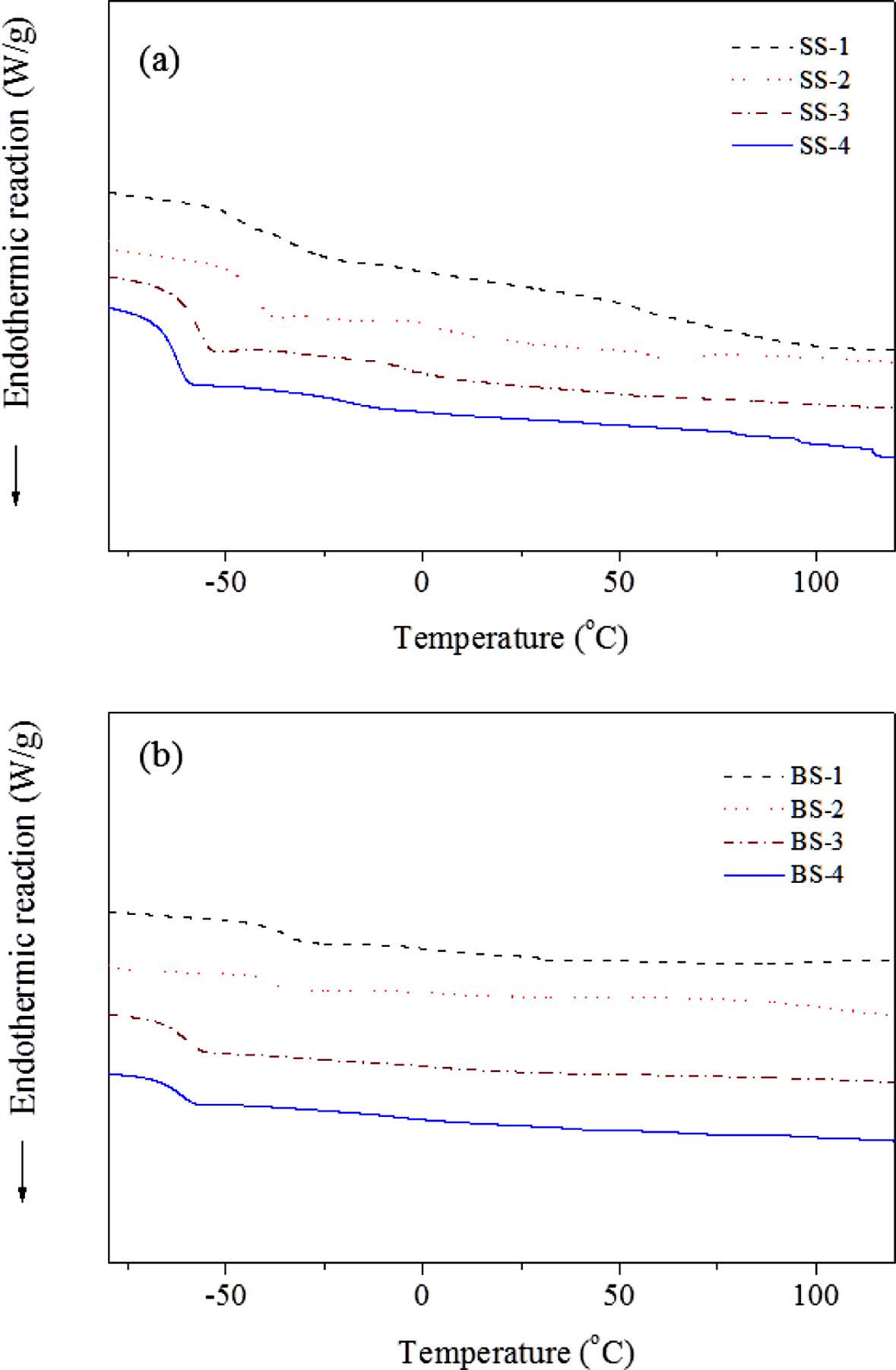
자외선 경화형 고분자 전해질의 이온 전도도는 AC impedance법을 이용하여 측정되었으며 결과를 Figure 3에 나타내었다.15 먼저 LiClO4 리튬염 계에서는 [EO]:[Li]=5:1의 경우 상온 이온전도도가 2.7×10-6 S/cm로 낮았으나 리튬이온의 농도를 낮춘 [EO]:[Li]=9:1, 15:1, 21:1에서 비교적 높은 이온전도도를 관찰할 수 있으며 모두 1×10-5 S/cm 수준 이상을 달성하였다. 일반적으로 자외선 경화형 고분자 전해질이 1×10-6S/cm 수준의 이온전도도를 보이는 것과 비교했을 때, 경화과정을 통해서도 내부에 자유롭게 존재하는 PSiEO의 영향인것으로 추측된다. 한편, BF3-LiMA를 도입하게 되면 음이온이 고정되어 있기 때문에 낮은 이온전도도가 예상되지만 리튬염의 농도가 비슷한 경우 LiClO4 리튬염 계보다 오히려 증가된 상온 이온전도도가 관찰된다. Figure 4에 나타낸 것처럼 [EO]:[Li] 비율이 12:1 이하에서는 전 구간에서 이성분 리튬염 계가 높은 이온전도도를 나타내고 최대 2.63×10-5S/cm의 값이 달성되었다. 이러한 결과는 단량체형 리튬염이 도입될 경우 이온전도도가 감소되리라는 예상과는 다르다. 따라서 BF3-LiMA의 존재가 고분자 전해질 물성에 미치는 영향을 파악하기 위하여 DSC를 측정, Figure 5에 나타내었다.
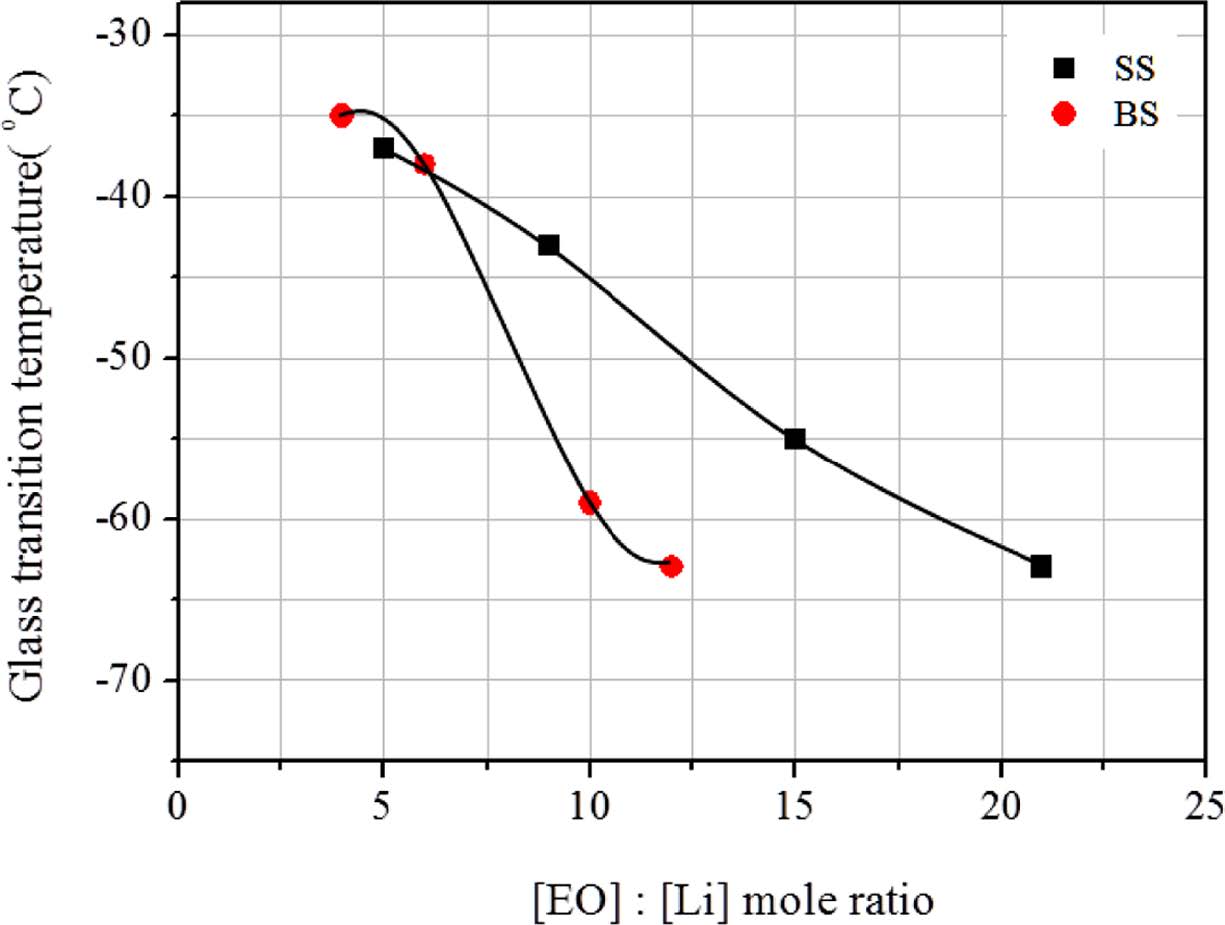
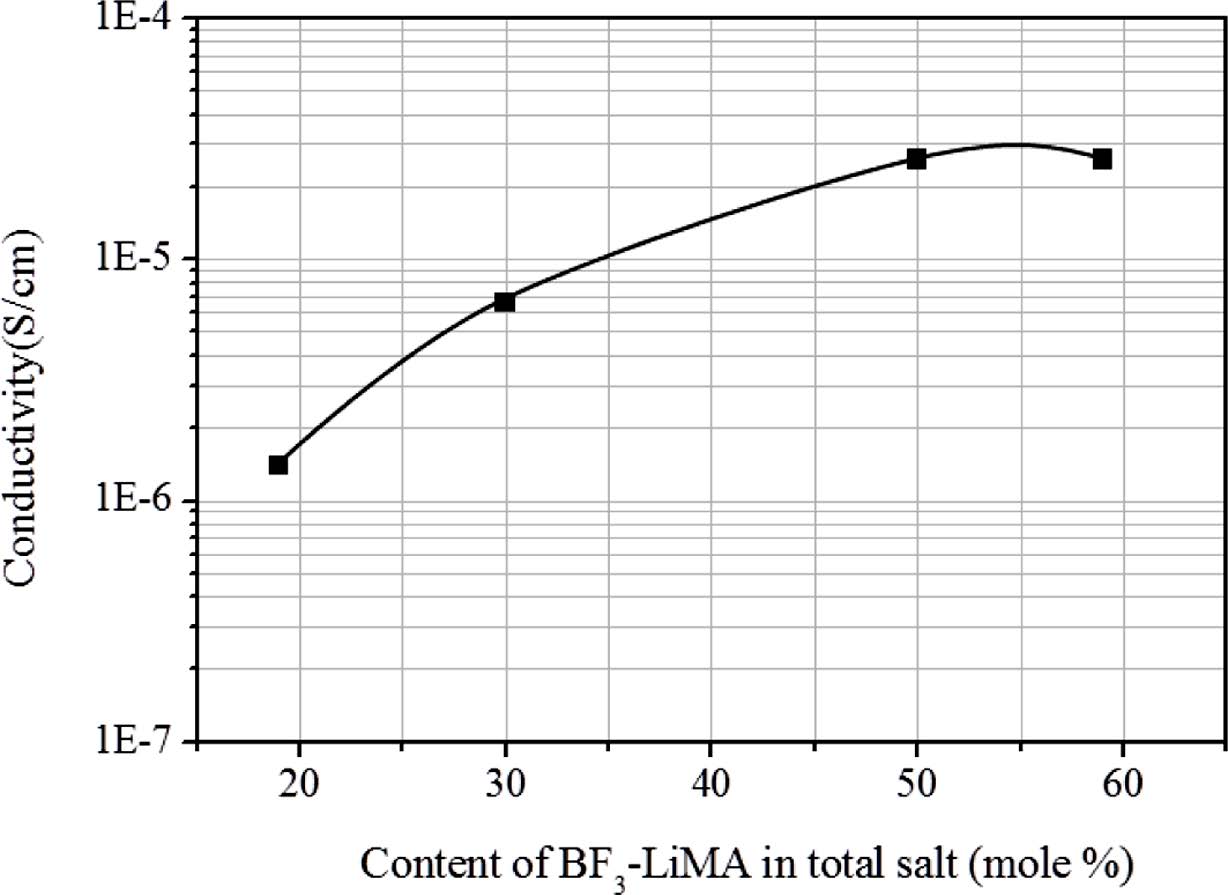
흥미롭게도 단일성분 리튬염 계 및 이성분 리튬염 계와 상관없이 리튬이온의 농도가 감소할수록 Tg 역시 감소하는 현상을 관찰할 수 있는데 SS 시료에서 [EO]:[Li]=5:1의 경우 -37 ℃가 21:1에서 -63 ℃로 나타났다. 이것은 리튬이온의 농도가 높을수록 리튬양이온과 EO기 사이의 배위결합이 다수발생, 분자운동이 방해받기 때문으로 해석할 수 있다. 따라서 리튬이온의 이동이 유리한 분자구조를 위해서는 리튬염의 농도를 감소시킬 필요가 있다. 한편, 이성분 리튬염 계에서는 더 높은 리튬농도에서 비슷한 Tg 감소가 관찰되는데, [EO]:[Li]=4:1의 -35 ℃가 12:1에서 -63 ℃로 급격히 감소하는 것을 볼 수 있다. 이 결과를 Figure 6에 정리하였으며 이성분 리튬염 계에서 리튬이온의 농도가 감소할수록 상대적으로 큰 폭의 Tg감소가 발생함을 알 수 있다. 또한 감소된 Tg는 고분자기질의 유연성을 더욱 증가시켜 상온 이온전도도에 유리한 조건을 제공하는데 Figure 7을 통하여 전체 리튬염에서 BF3-LiMA양이 증가할수록 이온전도도가 증가함을 확인할 수 있다. 이결과는 BF3-LiMA를 사용할 경우 LiClO4 대비 큰 음이온이존재함으로써 고분자 밀도가 감소하고 자유부피가 증가하기 때문으로 해석할 수 있다. 결과적으로 BF3-LiMA의 도입은 자외선 경화형 고분자 전해질에서 이온전도도의 증가를 가능하게 하였다.
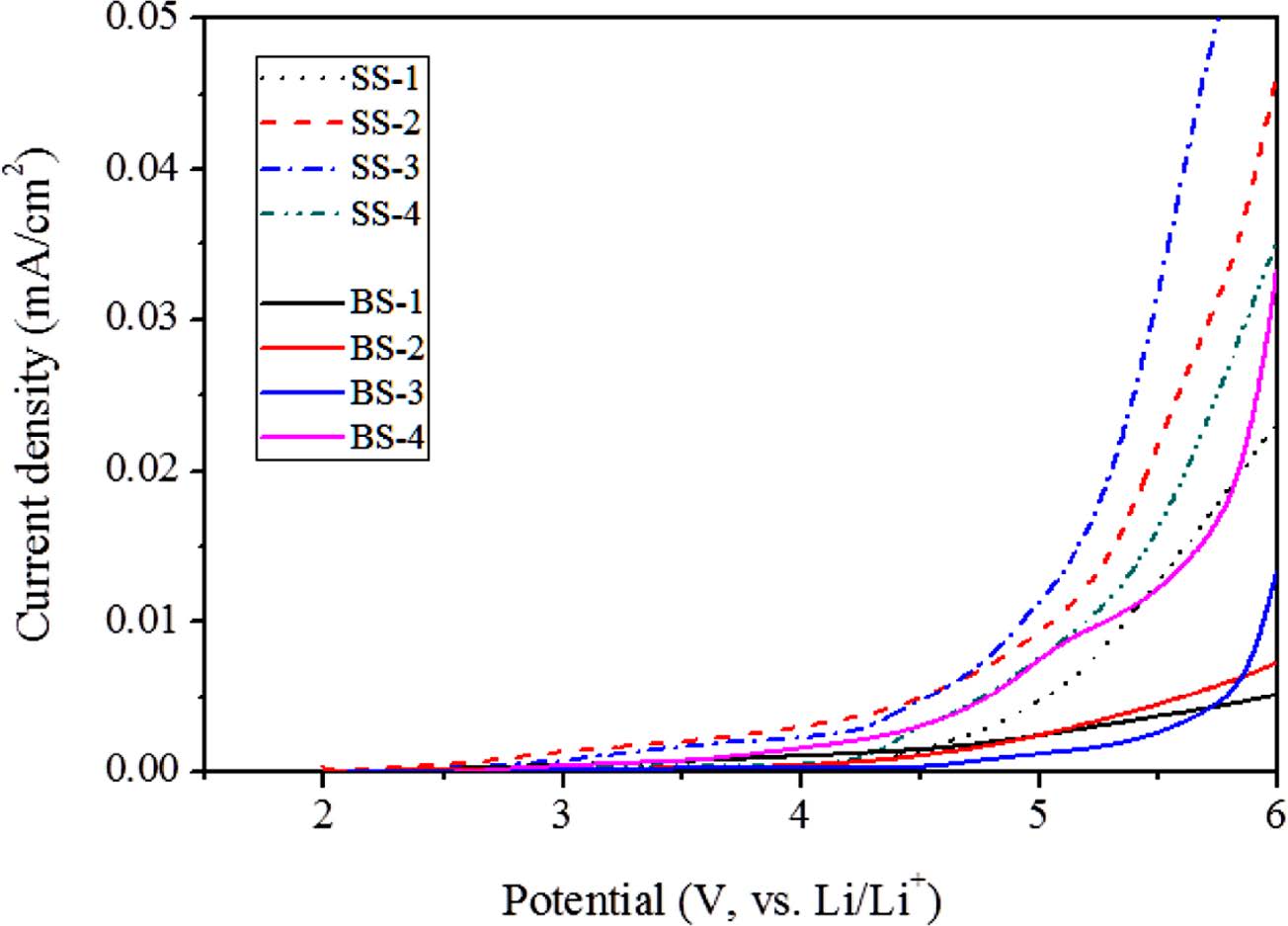
자외선 경화형 고분자 전해질의 전기화학적 안정성은 작용 전극으로 스테인레스 강, 대전극과 기준전극으로 리튬금속을 사용한 선형전위주사법(linear sweep voltammetry, LSV)으로 평가하였다. 측정결과를 Figure 8에 나타내었으며 두 결과 모두 5 V에서 0.01 mA/cm2 이하의 전류량이 관찰됨을 알 수 있다. 특히 BF3-LiMA가 도입된 BS-1~4(실선표시)에서 더 낮은 전류가 관찰되어 전기화학적 안정성이 향상됨을 알 수 있다. 공통적으로 사용된 ClO4−가 비교적 낮은 전위에서 산화분해 되는 것은 SS 및 BS 계에서 동일하지만 BF3-LiMA가 도입된 BS 계에서는 상대적으로 적은 양의 ClO4−가 존재하기 때문으로 판단된다. 따라서 LiClO4와 BF3-LiMA가 동시에 사용된 이성분 리튬염 계가 LiClO4 단독으로 사용된 계에 비해 더 높은 이온전도도와 전기화학적 안정성이 확보됨을 알 수 있다.
이성분계 리튬염으로 제조된 고분자 전해질은 일부 사용된 BF3-LiMA에서 음이온 고정에 따른 분극현상 억제효과가 기대되는데, 전지특성평가를 통해 확인해볼 필요가 있다. 전지에서 환원전극을 구성하는 대표적인 활물질인 LiMn2O4는 알루미늄에 합제된 다공성 구조로서 고분자 전해질을 전극 표면에 코팅할 경우 활물질 공극에 의한 저항이 크게 작용하게 된다. 본 연구에서는 이를 극복하기 위해 앞서 합성된 고분자 전해질을 용액공정(고분자 농도: 0.3 g/mL)으로 전극에 함침시키고, 용매를 건조한 뒤, 자외선 조사를 통해 경화를 유도하였다. 이러한 방법으로 전극에 고분자를 함침 및 건조 시키게 되면 활물질 사이의 공극을 고분자가 채우게 되어 이온전도성 채널을 확보할 수 있을 것이다. 특히 고분자는 자외선 경화를 통해 불용성의 3차원 네트워크가 형성되어 기계적, 열적으로 안정한 특성 또한 제공할 수 있다. Figure 9는 공극이 많은 LiMn2O4 활물질 자체(a), 고분자 함침과 자외선 경화를 실시한 복합전극(b) 및 측면에서 관찰한 복합전극(c)의 SEM 사진을 보여주고 있다. 무기물 입자들이 고분자 함침을 통하여 상호 연결된 모습을 볼 수 있으며, 측면사진을 통하여 전체적으로 고밀도의 고분자 코팅이 형성된 것을 확인할 수 있다.
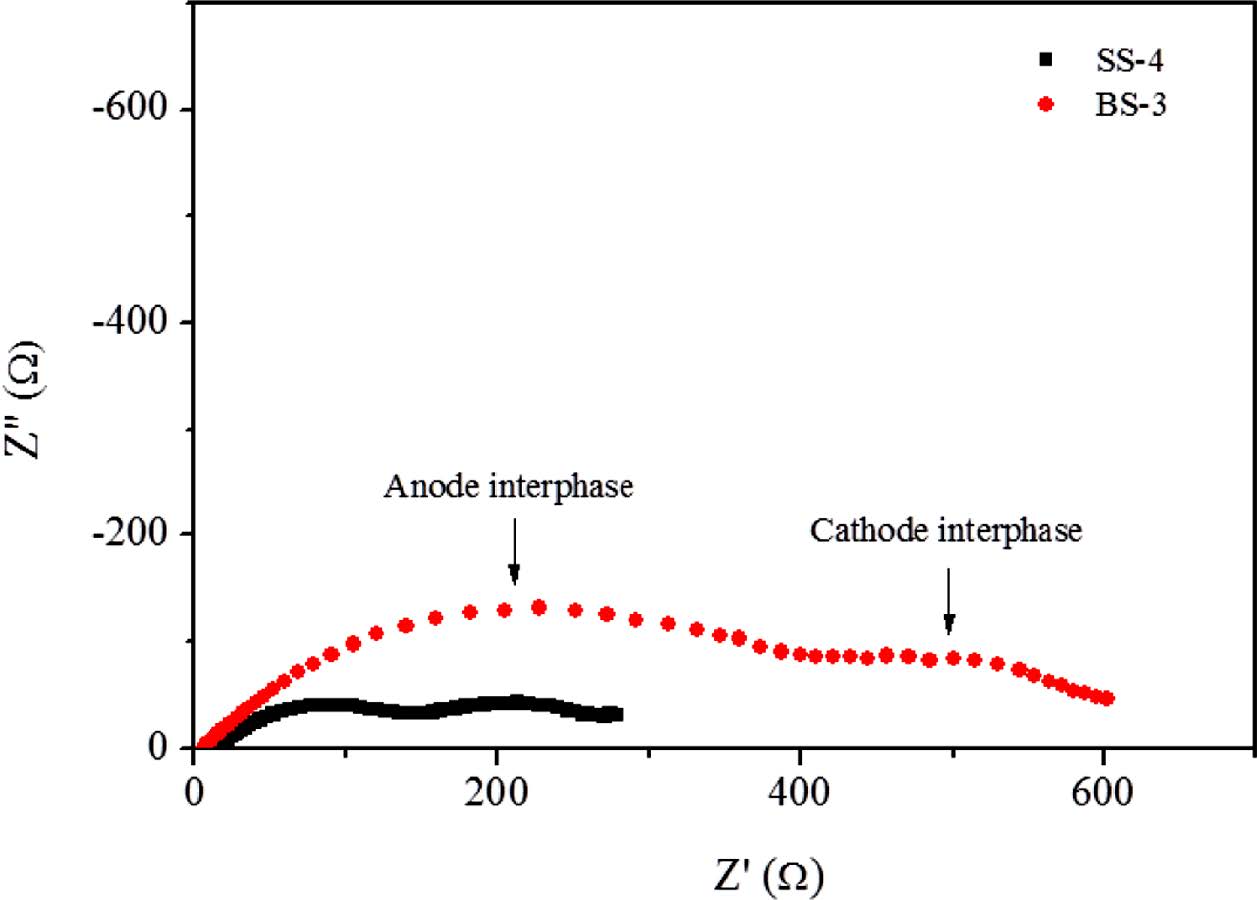
환원전극으로 LiMn2O4 및 고분자 전해질로 구성된 복합전극(P-LMO)의 전기화학적 기초특성은 리튬금속을 산화전극으로 사용한 2016 코인셀 제조를 통하여 평가하였다. 전고체전지를 개발하기 위해서는 복합전극과 고분자 전해질 및 산화전극으로 구성된 이상적인 전지구성이 필요하지만 현 단계에서는 고분자 전해질 합침의 효과를 보기 위해 LiPF6, 1M이 용해되어 있는 액체전해액을 활용하였다. 따라서 고분자 전해질을 구성하는 리튬염인 LiClO4와 LiPF6가 혼합되게 되는데, 각각 고분자 내 이온전도 및 액체전해액 내 이온전도에 유리한 특징을 가지고 있기 때문에 현 시스템과 같이 동시에 사용할 경우 시너지효과가 기대된다. Figure 10에는 복합전극을 활용한 전지(3.0-4.2 V)의 첫 방전에 따른 AC impedance 측정결과를 도시하였다. LiClO4 단독으로 사용된 단일성분 리튬염의 경우 고주파에서 나타나는 산화전극과 저주파영역의 환원전극 계면저항이 거의 동일하게 나타남을 볼 수 있다. 반면, LiClO4와 BF3-LiMA가 동시에 사용된 이성분 리튬염 계에서는 환원전극관련 계면저항은 단일성분계와 동일하나 큰 산화전극쪽 계면저항을 확인할 수 있다. 이 결과는 BF3-LiMA에 도입된 루이스산이 일부 유리되어 산화전극계면에 영향을 주기 때문으로 판단되며 향후 개선이 필요한 부분이다.16 이를 극복하기 위한 방안으로 BF3-LiMA 제조 시당량보다 적은 양의 BF3를 사용하여 유리되는 루이스산을 최소화하거나 계면 반응성이 낮은 신규 루이스산을 도입하는 방법이 검토될 수 있다. 그럼에도 불구하고 본 실험에서 고분자 전해질이 함침된 환원전극에서는 리튬염의 종류와 상관없이 비슷한 계면저항을 보여줌으로써 복합전극에 대한 활용가능성을 높여주고 있다. 물론 두 경우 모두 액체전해액 계보다 계면저항이 크게 관찰되는데, 경화된 고분자 전해질이 액체에 의해 젤화되지만 여전히 고체기질의 존재가 저항으로 작용하기 때문으로 판단된다.
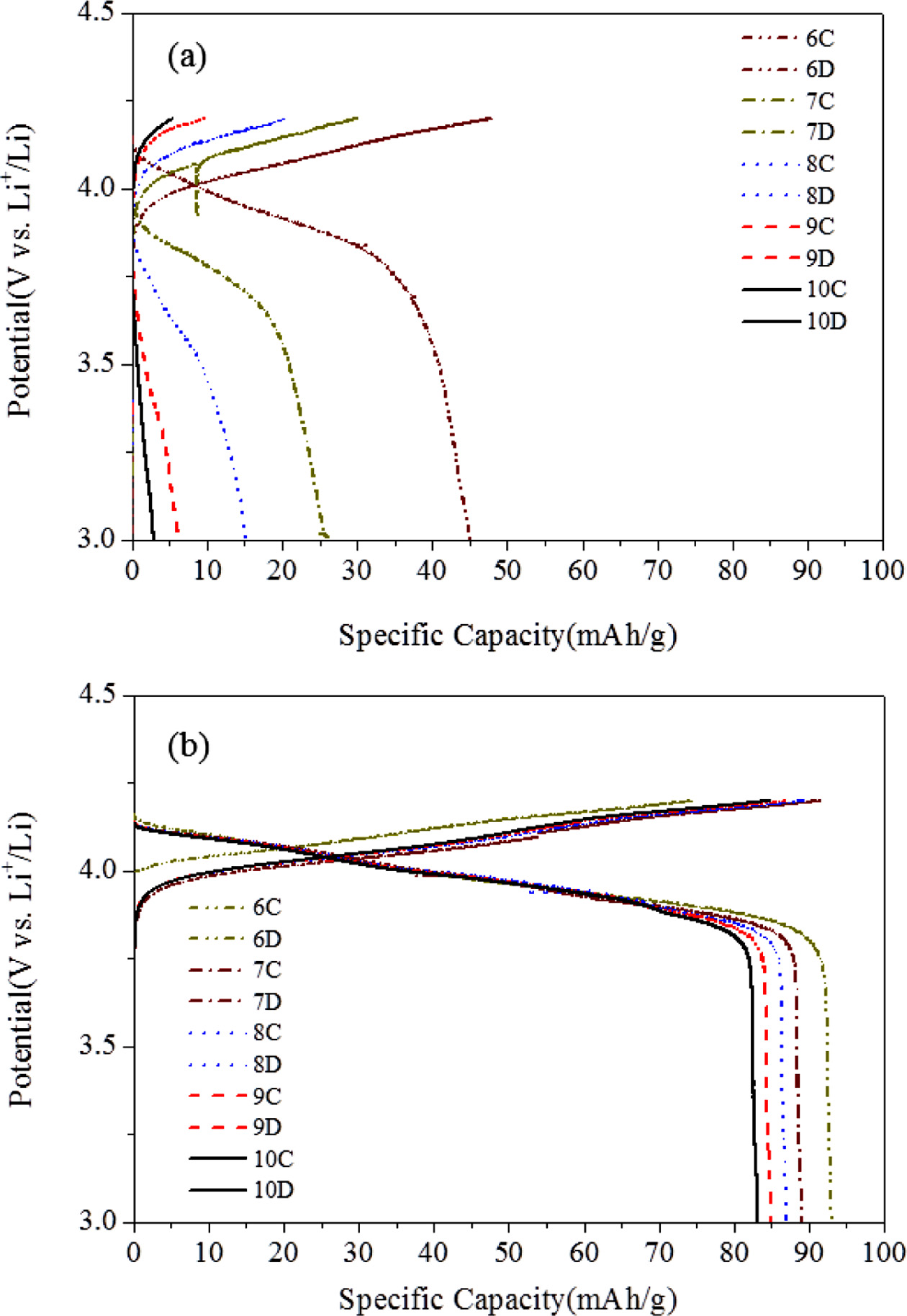
다음으로 제조된 2016 코인셀을 이용, 충방전 특성을 평가하여 Figure 11에 나타내었다. 참고로 충방전 실험 데이터는 전해질의 안정화가 이루어진 6회에서 10회까지를 표시하고 있다. 흥미롭게도 단일성분염 계 고분자 전해질 SS-4를 사용한 전지에서는 충방전 회수에 따라 급격한 방전용량 감소가 관찰되는데 반해 이성분 리튬염 계인 BS-3 복합전극에서는 비교적 우수한 용량유지가 확인된다. 실제, SS-4 계 전지의 방전용량은 6회 45mAh/g에서 10회 3 mAh/g 수준으로 낮다. 하지만, BS-3 계에서는 6회 93 mAh/g에서 10회 83 mAh/g가 얻어졌다. 이 결과는 LiClO4 염에서 발생하는 분극현상이 전지 장기수명에 큰 영향을 주기 때문으로 해석할 수 있으며 결과적으로 음이온이 고정된 BF3-LiMA가 도입되어 전지의 장기수명에 좋은 영향을 주었다고 사료된다. 물론 액체전해질 자체만 사용했을 때인 100 mAh/g와 비교했을 때 83%의 용량유지 결과이지만 고분자 전해질에 대한 BF3-LiMA 도입은 전고체전지 설계에서 중요한 역할을 할 것으로 기대된다.17
|
Figure 1 FTIR spectra of PMHS, APE and synthesized poly(methylsiloxane-g-PEO), PSiEO. |

|
Figure 2 1H NMR spectra of poly(methylsiloxane-g-PEO), PSiEO in CDCl3. |
|
Figure 3 Ionic conductivity of polymer electrolytes with single salt (a); binary salt (b) at different temperature. |
|
Figure 4 Ionic conductivity of polymer electrolytes at 25 ℃ as a function of [EO]:[Li] ratio in single salt and binary salt system. |
|
Figure 5 DSC curves of polymer electrolytes with single salt (a); binary salt (b) at a scan rate of 20 ℃/min. |
|
Figure 6 Relationship between glass transition temperature and lithium salt concentration in polymer electrolytes. |
|
Figure 7 Effect of BF3-LiMA content on room temperature ionic conductivity in total salt of polymer electrolytes. |
|
Figure 8 Comparison of LSV curves for polymer electrolytes consist of single or binary salt with scan rate of 1 mV/s at 25 ℃. |

|
Figure 9 SEM images of original cathode material (a); cathode active material impregnated with polymer electrolyte (b); cross sectional view of composite electrode (c). |
|
Figure 10 Nyquist plots of Li/electrolyte/P-LMO cell after first discharge in the range of 4.2 V and 3.0 V. |
|
Figure 11 Voltage profile of charge-discharge corresponding to 6th to 10th cycle of the Li/electrolyte/P-LMO cell composed of SS-4 (a); BS-3 (b). |
|
Table 1 Components and [EO]:[Li] Ratios of Solid Polymer Electrolyte |
aCalculated by considering only the EO in PSiEO. |
본 연구에서는 PMHS에 대한 APE의 정량적인 부가반응을 통하여 poly(methylsiloxane-g-PEO)를 합성하였으며 LiClO4 단독(단일성분 리튬염계) 혹은 LiClO4와 BF3-LiMA가 혼합(이성분 리튬염계)되어 사용된 자외선 경화형 고분자 전해질을 제조하였다. 이온전도도 측정결과 [EO]:[Li] 비율 12:1보다 고농도의 리튬이온에서는 이성분 리튬염계가 더 높은 상온 이온전도도를 보여주었다. 이 결과는 BF3-LiMA 리튬염에 존재하는 큰 음이온이 고분자의 밀도를 감소시키고 유리전이온도를 낮추기 때문으로 확인되었다. 따라서 BF3-LiMA를 많이 도입할수록 유리전이온도는 감소하고 이온전도도는 증가하였다. BF3-LiMA의 도입은 고분자 전해질의 전기화학적 특성에도 긍정적 효과를 나타내어 단일성분 리튬염계보다 전반적으로 5 V 이하에서 우수한 전압 안정성이 확보되었다. 고분자 전해질로 제작한 리튬/전해질/복합전극의 전지실험에서는 이성분 리튬염계에서 큰 산화전극 계면저항이 형성되는것을 관찰하였지만 충방전 실험을 통해 10회 방전에서도 이론용량의 83% 수준의 용량유지를 확보할 수 있었다. 결과적으로 LiClO4와 BF3-LiMA로 구성된 고분자 전해질은 높은 이온전도도, 상대적으로 우수한 전기화학적 안정성 및 전지용량 유지율 확보가 가능한 재료로서 차후 전고체 전지의 구성과 관련된 연구에 폭넓게 활용될 것으로 기대된다.
- 1. A. Sakuda, A. Hayashi, and M. Tatsumisago, J. Power Sources, 195, 599 (2010).
-

- 2. M. Higa, K. Yaguchi, and R. Kitani, Electrochim. Acta, 55, 1380 (2010).
-

- 3. C. Sun, J. Liu, Y. Gong, D. P. Wilkinson, and J. Zhang, Nano Energy, 33, 363 (2017).
-

- 4. Z. Li, J. Huang, B. Liaw, V. Metzler, and J. Zhang, J. Power Sources, 254, 168 (2014).
-

- 5. K. Pozyczka, M. Marzantowicz, J. R. Dygas, and F. Krok, Electrochim. Acta, 227, 127 (2017).
-

- 6. S. Gomari, M. Esfandeh, and I. Ghasem, Solid State Ionics, 303, 37 (2017).
-

- 7. L. Porcarelli, M. A. Aboudzadeh, L. Rubatat, J. R. Nair, A. S. Shaplov, C. Gerbaldi, and D. Mecerreyes, J. Power Sources, 364, 191 (2017).
-

- 8. Y. Zhang, Y. Chen, Y. Liu, B. Qin, Z. Yang, Y. Sun, D. Zeng, A. Varzi, S. Passerini, Z. Liu, and H. Cheng, J. Power Sources, 397, 79 (2018).
-

- 9. R. Rohan, Y. Sun, W. Cai, Y. Zhang, K. Pareek, G. Xu, and H. Chen, Solid State Ionics, 268, 294 (2014).
-

- 10. J. M. G. Cowie and G. H. Spence, Solid State Ionics, 123, 233 (1999).
-

- 11. I. V. Ferrari, M. Braglia, T. Djenizian, P. Knauth, and M. L. Di Vona, J. Power Sources, 353, 95 (2017).
-

- 12. A. Chamaani, M. Safa, N. Chawla, and B. El-Zahab, ACS Appl. Mater. Interfaces, 9, 33819 (2017).
-

- 13. W.-C. Kang, H.-G. Park, K.-C. Kim, and S.-W. Ryu, Electrochim. Acta, 54, 4540 (2009).
-

- 14. K. D. Safa, T. Shahin, and H. Akbar, J. Organometal. Chem., 694, 4107 (2009).
-

- 15. P. Bruce, “Electrical Measurement on Polymer Electrolytes”, in Polymer Electrolyte Reviews-1, J. MacCallum and C. Vincent, Editors, Elsevier Applied Science, New York, p 237 (1987).
- 16. F. Krok, J. R. Dygas, B. Misztal-Faraj, Z. Florjanczyk, and W. Bzducha, J. Power Sources, 81, 766 (1999).
-

- 17. B. Qin, Z. Liu, G. Ding, Y. Duan, C. Zhang, and G. Cui, Electrochim. Acta, 141, 167 (2014).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(1): 69-76
Published online Jan 25, 2019
- 10.7317/pk.2019.43.1.69
- Received on Jul 21, 2018
- Revised on Aug 10, 2018
- Accepted on Aug 20, 2018
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sang-Woog Ryu
-
Department of Engineering Chemistry, College of Engineering, Chungbuk National University, Cheongju, Chungbuk 28644, Korea
- E-mail: swryu@chungbuk.ac.kr
- ORCID:
0000-0002-4728-2725










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.