- Simultaneous Co-preparation of Polyol and MCC by the Liquefaction of a Biomass and Its Optimization
Eun Ju Lee, You Jin Park, Han Sol Kwon, KiRyong Ha*, and Kwang-Hee Lim†

Department of Chemical Engineering, Daegu University, Gyeongbuk 38453, Korea
*Department of Chemical Engineering, Keimyung University, Daegu 42601, Korea- 바이오매스 액화에 의한 폴리올 및 MCC 동시제조 및 최적화
대구대학교 공과대학 화학공학과, *계명대학교 공과대학 화학공학과
Lignocellulosic liquefaction of biomass (sawdust, larix kaempferi) was performed to prepare polyol and microcrystalline cellulose (MCC) simultaneously under various operating conditions such as 105-165 ℃ of liquefaction temperature, 1-5% of acid catalyst (sulfuric acid), 300-500% of solvent/biomass ratio (SBR). Biomass liquefaction scheme was designed to construct its optimal operating conditions according to central composite design (CCD) composed of 16 runs of experiments using response surface methodology. The optimal condition of liquefaction to prepare simultaneously MCC as well as polyol turned out to be Run 2 out of 16 runs of experiments, in which the liquefaction temperature, the SBR, the concentration of acid catalyst (sulfuric acid) were 165 ℃, 300% and 1%, respectively.
폴리올 및 microcrystalline cellulose(MCC)의 동시제조를 위하여 바이오매스(톱밥, larix kaempferi) 액화(liquefaction) 공정조건의 반응표면분석법에 따른 적정조건을 구축하기 위하여, 바이오매스 액화실험을 Run 1부터 16까지의 CCD(central composite design) 실험계획에 따라서 수행하였다. 바이오매스 액화온도(105-165 ℃), 산촉매로서 sulfuric acid 농도(1-5%)와, 용매와 바이오매스의 비(SBR)(300-500%)의 각 바이오매스 액화공정 조건에서 바이오매스 액화실험을 각각 수행하였다. 본 연구에서 바이오매스 액화에 의한 MCC와 폴리올의 동시제조에서 최적화 조건은 Run 2로서, 최적화 액화조건은 액화온도, SBR 및 산촉매 농도가 각각 165 ℃, 3:1, 1%이었다.
Keywords: lignocellulosic liquefaction, polyol, microcrystalline cellulose, co-preparation, optimization
본 연구는 한국산업기술평가관리원(No.10053875) 의 지원을 받아 수행되어 이에 감사를 드립니다.
폴리우레탄은 우수한 기계적 물성, 단열성, 충격 흡수성, 흡음 특수성 및 뛰어난 가공성과 같은 장점으로 인하여 산업에서 널리 사용되고 있다.1 이러한 폴리우레탄의 사용량 증가와 함께 환경오염 및 폐기물 처리와 같은 문제점 역시 함께 증가하고 있으며, 이러한 문제점들을 해결하기 위하여 국내외에서는 탄소중립인 바이오매스로부터의 유래한 바이오 폴리올을 이용한, 생분해성인 바이오 폴리우레탄 제조에 관한 연구가 활발히 진행 중이다.2 이러한 바이오 폴리우레탄 고분자 복합체의 기계적 강도를 증가시키기 위해 실리카, 유리섬유, 카본블랙(carbon black) 등 다양한 보강재가 사용되어 왔으며 최근에는 친환경 소재를 고분자 복합체의 충전제로 사용하는 연구 또한 활발히 진행되고 있다.3-4 친환경소재 중에서 셀룰로오스 기반의 microcrystalline cellulose(MCC)는 지구상에서 가장 풍부하고, 경제성, 재생가능성, 생분해성 및 환경친화성을 가진 물질이며 산으로 가수분해하여 무정형 영역을 제거하는 공정을 통하여 저비용으로 제조할 수 있는 장점을 가진 물질이다.5 또한 MCC는 고분자 복합체에 충전재로서 사용하여, 수출용 자동차에 내장재로 사용되는 폴리우레탄의 바이오함량 규제를 극복하기 위하여 바이오함량을 직접적으로 제고시킬 수 있는 방법이 될 수 있다. 이러한 MCC의 충전재로서의 특성은 친수성 충전재와 소수성 고분자 매트릭스 사이의 부착성(adhesion)에 의하여 결정되며,6 MCC를 폴리우레탄과 같은 고분자 복합체의 충전재로 사용하여 친환경적이면서 기계적 물성이 강화된 고분자 복합체를 제조하는 연구가 수행되어 왔다.6-9 Wu 등은7 폴리우레탄 매트릭스에 MCC를 분산시킨 복합체를 제조하고 MCC를 비충전한 폴리우레탄과 물성을 비교하였는데, 경도와 강도 물성이 향상되었고 적정 MCC 충전율은 5 wt%라고 보고하였다. Glowinska와 Datta는6 수산기를 가진 대두유기반 폴리올, 바이오글리콜과 여러가지 wt%의 MCC로 구성된 바이오폴리우레탄 복합체를 제조하였다. 이러한 바이오폴리우레탄 복합체는 Wu 등의7 경우와 같이 셀룰로오스 기반의 MCC가 5 wt%일 때에 0 wt% 경우보다 바이오폴리우레탄 복합체의 인장강도가 13.6% 증가하여 가장 컸고, MCC가 10, 15 및 20 wt%로 증가할수록 인장강도는 감소하여서 0 wt%보다 바이오폴리우레탄 복합체의 인장강도가 오히려 감소하였다. Zhang 등은8 물을 용매로 한 waterborne 폴리우레탄과 실란커플링제인 3-aminopropyltriethoxysilane(APS)로 표면개질된 nanocrytalline cellulose(NCC)의 복합체를 제조하고, 광학적 및 기계적 성능의 현저한 개선을 보고하였다. 그럼에도 불구하고 나노입자의 큰 응집성(cohesion)에 기인하여 첨가되는 개질 NCC를 최대 2%로 제한하여서, NCC로 폴리우레탄 복합체의 바이오함량을 직접적으로 제고시키는 데는 한계가 있었다. Yang 등은9 폴리우레탄과 MCC 또는, Kim 등에10 따라서 APS로 표면개질한 MCC(MCC-APS)의 폴리우레탄 복합체를 제조하고 복합체의 물성을 측정하였다. 그 결과로서 MCC-APS로 표면개질한 MCC의 폴리우레탄 복합체의 경우에는 Glowinska와 Datta6 및 Wu 등의7 경우와 다르게, MCC-APS가 증가할수록 인장강도와 탄성률은 증가하였는데, MCC-APS가 10 wt%인 경우가 MCC가 10 wt%인 경우보다 인장강도와 탄성률이 각각 5% 및 46% 만큼 증가하였다.
한편, MCC 제조에서 MCC 제조공정인 알칼리 전처리, 표백 및 산가수분해의 적정 공정조건를 위하여 선행연구자들에 의한 여러 연구가 수행되었다.11-13 또한 바이오폴리우레탄의 제조를 위한 반응물인 바이오폴리올의, 바이오매스 액화에 의한 제조에도 많은 연구가 수행되어 왔다.14-17 Horvath는14 목재 용해도와 관련하여, 1) 목재 swelling은 효과적인 용매의 수소결합 강도가 용매의 무결정형 셀룰로오스의 밀착결합구간으로 침투를 가능하게 하고, 용매의 수소결합능력은 용매분자크기의 역수와 상관하고; 2) 리그닌 용해도는 탄화수소축 길이가 긴 알콜일수록 급격히 감소하고, 혼합용매의 리그닌 용해도 및 수소결합능력이 단일용매보다 더 크다고 보고하였다. Guo 등은15 물대(Giant reed)를 산성화 폴리에틸렌글리콜에서 액화시켜서 적정조건에서 85.2%의 최대 액화율을 보고하였다. Hassan과 Shukry는16 사탕수수대(bagasse)와 목화대(cotton stalks)를 폴리에틸렌글리콜 또는 글리세린(glycerine)을 용매로 하고 황산을 산촉매로 사용하여 액화시킨 결과로서, 단일용매(폴리에틸렌글리콜)의 경우에는 비액화율이 약 20%이었으나 복합용매(폴리에틸렌글리콜과 글리세린)를 사용하였을 때에는 비액화율이 10% 미만이며, OH가(OH value)는 액화시간이 커질수록 감소하였다고 보고하였다. Hu와 Li는17 바이오디젤 생산공정의 부산물로서 26-40%의 유기 불순물이 존재하는 crude 글리세롤(glycerol)을 액화용매로 선택하여 옥수수대(corn stover)를, 전 공정인 산촉매 액화공정과 후 공정인 알칼리촉매 액화공정으로 구성된 액화공정으로 액화시켜서 OH가가 536-936 mgKOH/g인 폴리올을 제조하였다고 보고하였다. 한편, Yang 등은18 폐 커피분말과 lignocellulosic 바이오매스를 혼합하고 NaOH 촉매를 사용하여 임계점 이하의 열수에서 액화하였는데, 적정온도는 250 ℃이었고, 폐 커피분말과 옥수수 대(corn stalk)가 가장 액화공정의 시너지효과를 가지는 원료조합이었다고 보고하였다. 또한 Feng 등은19 lignocellulosic 바이오매스를 마이크로웨이브(microwave) 에너지를 이용한 dielectric 가열을 통한 산촉매 하의 methanolysis에 의한 직접적인 액화공정에 의하여 메틸 레브리네이트(methyl levulinate)의 30% 수율을 보고하였다.
그러나 바이오매스 액화에 의하여 바이오폴리올과 MCC를 동시제조하고 동시제조에 대한 적정공정 조건에 대한 선행연구는 거의 없는 실정이다. 기존 MCC 제조공정에서는 리그노셀루로식(lignocellulosic) 바이오매스에서 리그닌과 헤미셀룰로오스를 제거하고, 셀룰로오스를 산가수분해하여 MCC를 제조하나, 제거된 리그닌과 헤미셀룰로오스의 산업폐기물이 생성되어서 원료인 리그노셀루로식 바이오매스의 가용성이 저하되고 환경문제를 발생시킨다. 이러한 문제점을 개선하기 위하여 본 연구에서는 바이오매스 액화를 통한 MCC 및 리그노셀루로식 폴리올의 동시제조를 수행하였다. 본 논문(part 1)에서는 산촉매와 Horvath에14 따라서, 분자량이 큰 폴리에틸렌글리콜보다는 에틸렌글리콜을 채택한 복합용매를 사용하여 바이오매스를 액화시키고 MCC 및 리그노셀루로식 폴리올의 동시제조를 수행하였다. 또한 MCC 및 리그노셀루로식 폴리올의 동시제조에 대한 최적공정 조건을 도출하였다. 또한 후속논문(part 2)에서는 바이오매스 액화에 의해 제조된 리그노셀루로식 폴리올을 사용하여 바이오폴리우레탄 폼을 제조하고 물성평가를 수행하여, 바이오폴리우레탄 폼 제조에 관한 적정공정 조건을 제시하였다.
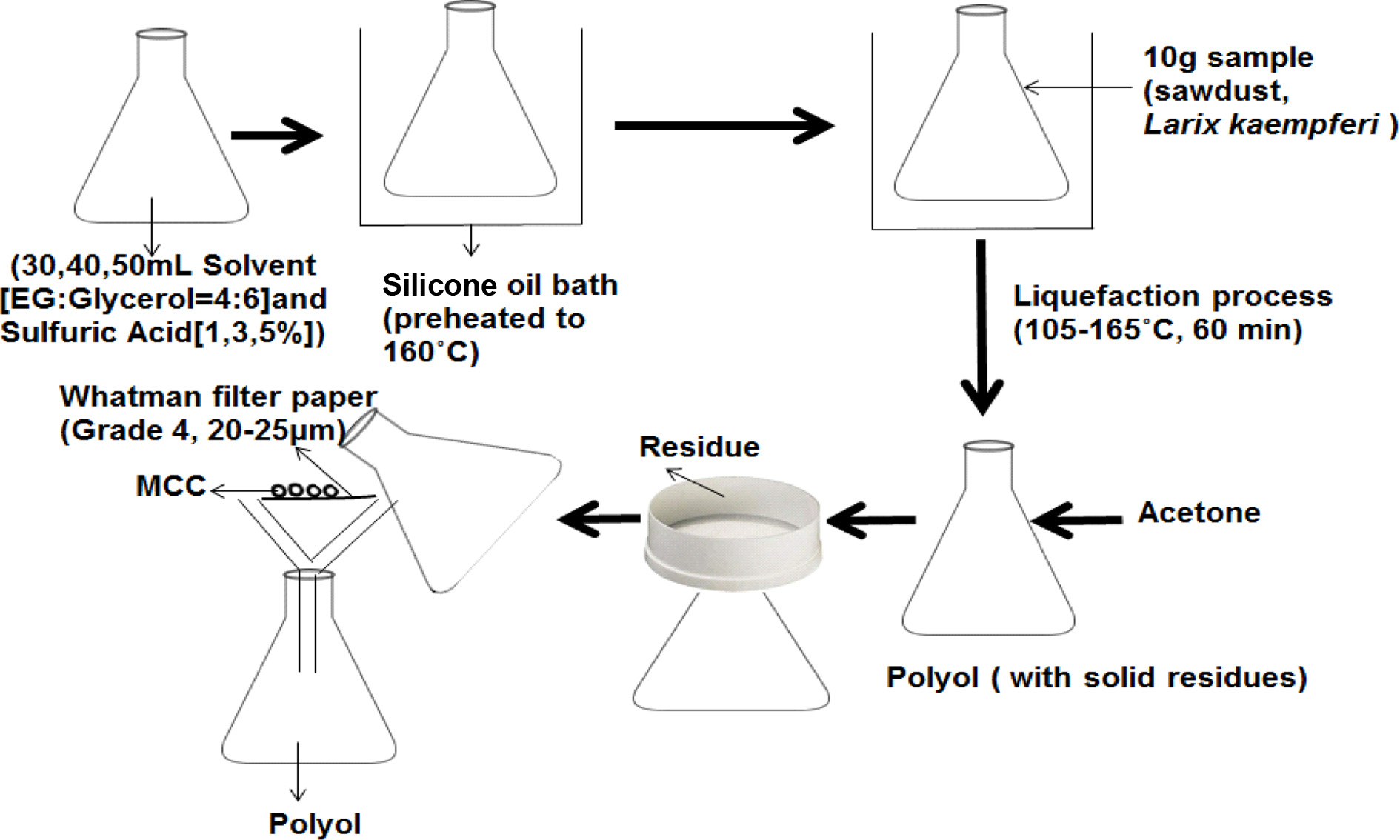
바이오매스 액화에 의한 MCC 및 폴리올 동시제조 및 최적화. 바이오매스 액화(liquefaction) 공정조건의 반응표면분석법(RSM, response surface methodology)에 따른 적정조건을 구축하기 위하여, 바이오매스 액화 공정조건의 CCD(central composite design) 실험계획을 구축하였다. 바이오매스 액화공정조건의 세 가지 변수로서 Table 1과 같이 바이오매스 액화온도, 산촉매로서 sulfuric acid 농도와, 에틸렌글리콜과 글리세린의 혼합용매(4:6)와 바이오매스의 비에 대한 각각의 범위를 설정하고, 헤미셀룰로오스와 리그닌 및 비결정형(amorphous) 셀룰로오스의 바이오매스 액화 및 액화된 바이오매스에 남아있는 결정형(crystalline) 셀룰로오스의 분리를 통하여 바이오매스 액화에 의한 MCC 및 폴리올 동시제조를 Figure 1과 같이 수행하였다. 이와 같이 동시제조된 미세결정 MCC에 대한 특성연구를 수행하였다. 바이오매스 액화에 의한 MCC 및 폴리올 동시제조 실험에서의 액화율, MCC 수율, 산가 및 OH가 등의 실험결과에서 반응표면분석법에 따른 바이오매스 액화의 최적화를 상용 소프트웨어인 statistica(ver. 10)를 활용하여 수행하였다. 또한 분리된 MCC의 XRD 분석을 통하여 바이오매스 액화의 최적조건을 도출하였다.
바이오매스 액화실험. Table 2와 같은 입도분포를 가지는 바이오매스(톱밥, larix kaempferi)에 대한 액화 공정조건의 반응표면분석법에 따른 적정조건을 구축하기 위하여, 바이오매스 액화실험을 Table 3과 같은 Run 1부터 16까지의 CCD 실험계획에 따라서, 바이오매스 액화온도(105, 135 및 165 ℃), 산촉매로서 sulfuric acid 농도(1, 3 및 5%)와, 용매와 바이오매스의 비(300, 400 및 500%)의 각 바이오매스 액화공정 조건에서 각각 60분 동안 수행하였다. 또한 바이오매스의 시간에 따른 액화추이를 관찰하기 위하여, Table 3에 주어진 CCD실험계획 중에서 Run 1부터 Run 10에 주어진 실험조건에 따른 바이오매스 액화공정 조건에서 각각 10, 20, 30 및 45분 동안의 바이오매스 액화실험을 추가적으로 수행하였다. Figure 1에 도시된 바이오매스 액화실험 절차는 다음과 같다. 환류냉각기(reflux condenser)와 교반기가 설치된 Figure 2와 같은 250 mL의 바이오매스 액화반응기를 실리콘오일 bath에 담가서 실험계획에 정해진 바이오매스 액화온도를 유지하게 한 후에, 180-850 μm(80-20 mesh) 톱밥형태의 낙엽송 시료 10 g을 바이오매스 액화반응기에 넣고 에틸렌글리콜과 글리세린이 4대 6으로 혼합된 용매를 실험계획에 정해진 비만큼 투입하였다. 그리고 투입된 시료 위에 실험계획에 정해진 농도의 황산을 첨가하였다. 교반을 300 rpm으로 수행하면서 투입된 시료를 실험계획에 정해진 시간 동안 액화시키고 바이오매스 액화반응기를 상온에서 식혔다.
바이오매스 액화율. 상온에 식힌 바이오매스 액화반응기내의 총 액화바이오매스(total liquefied biomass) 중에서 2 g을 50 mL아세톤에 넣고 하루 동안 용해시켰다. 용해된 시료를 180 μm(No. 80, 80 mesh) 표준체에 통과시켜서 통과하지 못하고 걸러진 고상의 residue를 제거하고, 통과된 시료를 105 ℃에서 건조하여 무게를 측정하고, residue의 건조무게를 측정하여 액화율(liquefaction yield)을 eq. (1)과 (2)와 같이 산출하였다.
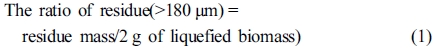

MCC 수율. 액화바이오매스 2 g을 50 mL아세톤에 넣고 하루 동안 용해시킨 후 용해된 시료를 180 μm(No. 80, 80 mesh)의 표준체에 통과시켜 걸러진 residue를 제거하고, 통과된 시료를 75 μm(No. 200, 200 mesh)의 표준체에 다시 통과시킨후에 걸러진 sub-residue를 제거하고 통과된 시료를 다시 25 μm의 여과지(Whatman filter paper, grade 4, pore size 20-25 μm)로 필터링한 여과지를 105 ℃에서 건조시키고 무게를 측정하여 MCC(25-75 μm)의 수율을 산출하였다. 25 μm 이하로 필터링된 폴리올(polyol)은 따로 보관을 하고, 제거된 residue 및 sub-residue는 각각 105 ℃에서 건조하여 무게를 측정하였다.
산가. ASTM D4662에 따라 액화바이오매스 2 g을 50 mL의 에탄올에 넣고 교반시키고 1% phenolphthalein용액 1 mL를 넣은 후 하루 동안 교반시켰다. pH meter(720P istek)로 초기 pH를 측정하고 0.1 N KOH용액을 떨어뜨리면서 색이 변하는 시점의 양을 종말점으로 적정하였다. 공시약(blank)은 50 mL의 에탄올에 1 mL의 1% phenolphthalein용액을 넣고 교반시킨 후 동일한 방법으로 0.1 N KOH 용액으로 적정하였다. 적정 후에 산가(acid number)를 eq. (3)을 사용하여 구하였다.

OH가. ASTM D4274에 따라 액화바이오매스 1 g을 25 mL phthalation reagent에 넣고 heating stirrer를 이용하여 110 ℃에서 20분 동안 교반시켰다. 교반 후 50 mL의 pyridine과 25 mL의 증류수를 첨가하고 1 mL의 1% phenolphthalein 용액을 첨가하여 교반하였다. pH meter(720P istek)로 초기 pH를 측정하고 1 M NaOH 용액을 떨어뜨리면서 색이 변하는 시점의 양을 종말점으로 적정하였다. 공시약(blank)은 25 mL phthalation reagent에 50 mL의 pyridine과 25 mL의 증류수를 첨가하고 1 mL의 1% phenolphthalein 용액을 첨가하여 교반시킨 후 동일한 방법으로 1 M NaOH 용액으로 적정하였다. 적정 후에 OH가(hydroxyl number)를 eq. (4)를 사용하여 구하였다.

XRD 분석. 바이오매스 액화온도 165 ℃의 Run 2, 4, 6 및 8의 실험조건으로 제조된 바이오매스의 액화 폴리올에서 분리한 residue 및 MCC의 결정성 분석으로서 분리된 residue 및 MCC의 XRD 분석을 X선 회절장치(Multi-Function X-ray Diffractometer, PANalytical, EMPYREAN, Netherlands)를 사용하여 40 KV 및 30mA의 조건에서 Cu-Kα선(λ=1.541874 Å)으로 10-40o의 스캔범위에서 수행하였다.
FTIR 분석. 바이오매스 액화실험에서 Run 6 및 8의 실험 조건으로 제조된 바이오매스의 액화 폴리올과 액화 폴리올에서 분리한 MCC의 특성 분석으로서 FTIR(PerkinElmer, Frontier) 분석을 수행하였다.
GPC 분석. 바이오매스의 액화 폴리올의 분자량을 측정하기 위하여 GPC(gel permeability chromatography) 분석을 GPC 시스템(Alliance e2695, Waters, USA, detector-RI)을 사용하여 수행하였다. Standard로서 PS 1060, 1320, 2980, 6940, 19500, 51200, 124000, 282000, 667000, 1390000, 2700000을 사용하였고, THF(Merck)를 용매로 사용하여 35 ℃에서 1 mL/min의 유량으로 column(Waters Styragel HR3, HR4, HR5E)을 통과시켜서 분자량을 측정하였다.
|
Figure 1 Schematic diagram of co-preparation process for lignocellulosic-polyol and MCC by sawdust-liquefaction and subsequent MCCseparation. |

|
Figure 2 Lignocellulosic liquefaction apparatus. |
|
Table 1 Experimental Design Levels of Chosen Process Variables |
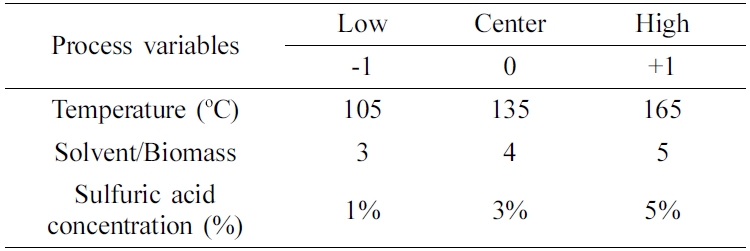
*The concentration of catalyst (sulfuric acid) was calculated as weight content (%) based on the amount of the liquefaction solvent. |
|
Table 3 Experimental Matrices for Central Composite Design (CCD) |
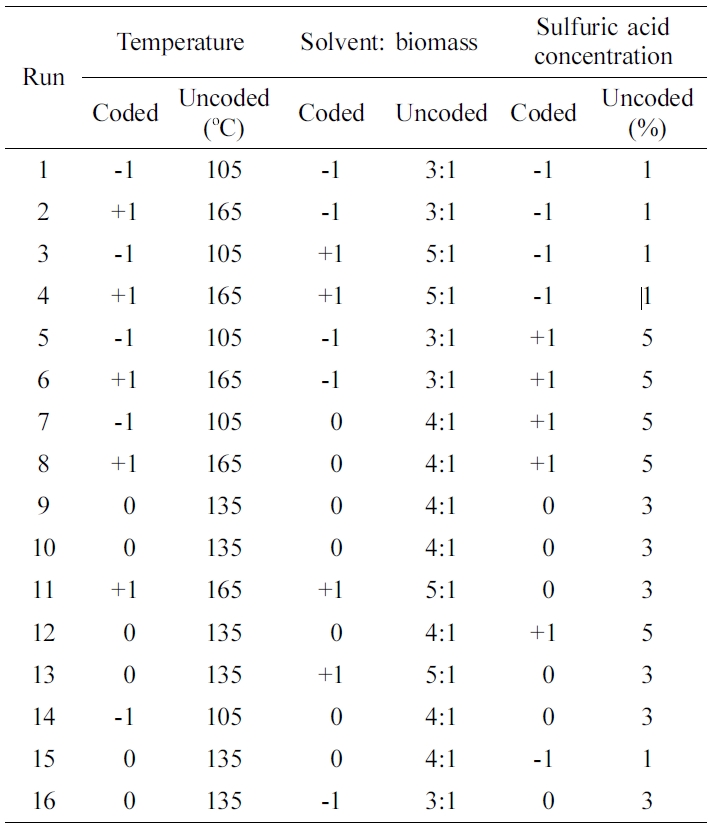
*Liquefaction time of each run of the experiments is 60 min. |
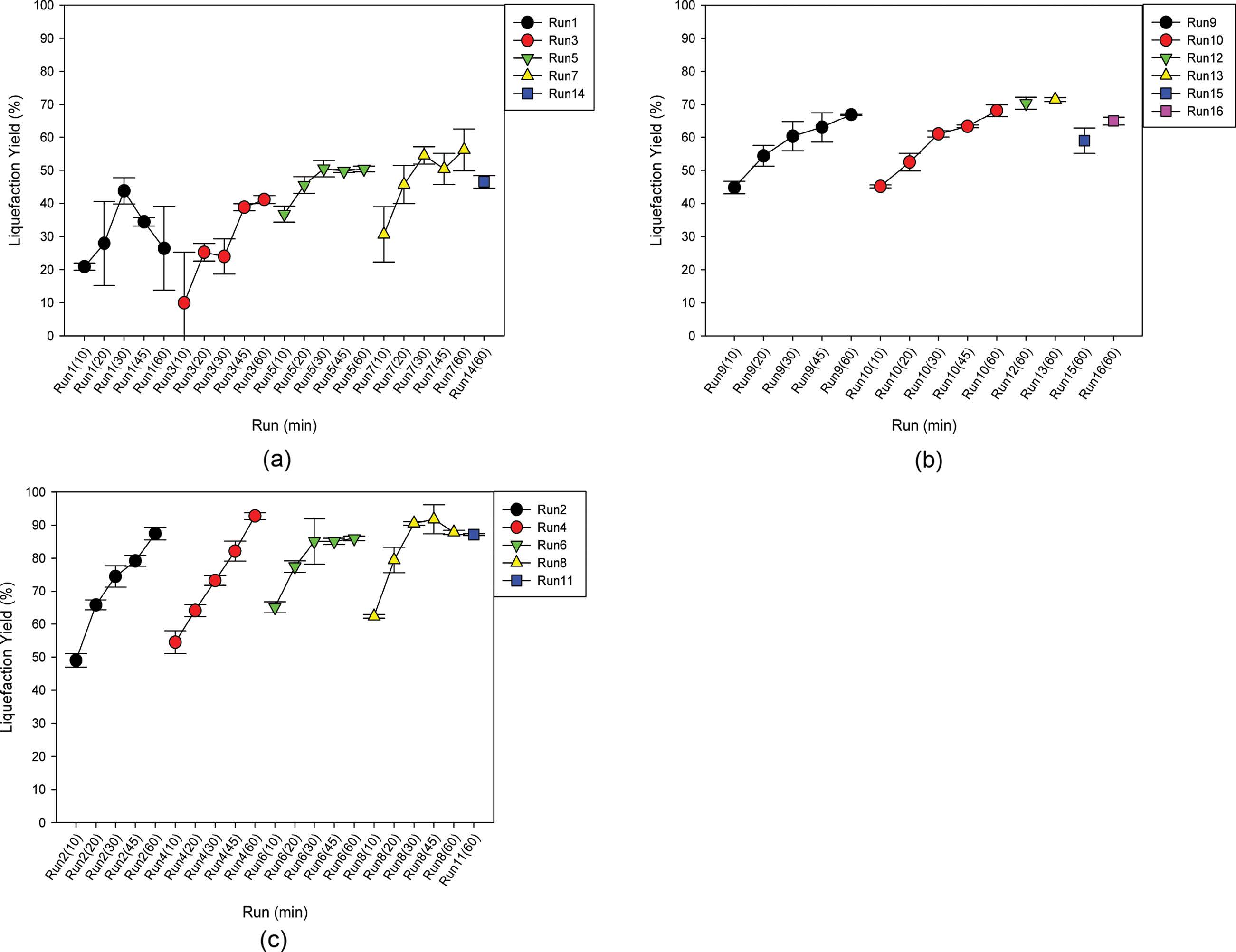
Lignocellulose 액화율. 액화온도에 따른 lignocellulose의 액화율 분석은 다음과 같았다. 액화온도가 105 ℃인 경우에는 Figure 3(a)에서와 같이 액화실험 조건인 Run 1, 3, 5, 7 및 14가 해당되며 액화율이 액화시간에 따라서 증가하여 20-55%에 분포하였고, 용매 대 바이오매스 비(SBR, solvent to biomass ratio)가 증가할 때에 액화율 변화가 미미하였으나, 산촉매 농도는 증가할수록 액화율이 증가하였다. 액화온도가 135 ℃의 경우에는 Figure 3(b)에서와 같이 액화실험조건인 Run 9, 10, 12, 13, 15 및 16이 해당되며 액화율은 마찬가지로 시간에 따라 증가하였으며 105 ℃인 경우보다 증가하여 40-70%이었고 산촉매 농도가 증가하면 액화율은 다소 증가하고, 산촉매 농도가 감소하면 액화율이 감소하였다. 한편, SBR이 증가하면 액화율이 증가하였다. 마지막으로 액화온도가 165 ℃의 경우에는 Figure 3(c)에서와 같이 액화실험 조건인 Run 2, 4, 6, 8 및 11이 해당되며, 액화율은 50-95%에 분포하여 가장 높았고, 시간에 따라서 가장 급격한 액화율 증가를 보였다. 또한 SBR이 증가할수록 액화율은 증가하였고, 산촉매 농도가 증가할수록 초기에는 액화율이 증가하나 액화 종료시점(60 min)에는 산촉매 농도와 액화율은 무관하였다. 이와 같이, 저온(105 ℃)에서는 SBR보다 산촉매 농도의 증가에 따라서 액화율이 증가하였으나, 고온(165 ℃)에서는 산촉매 농도보다 SBR의 증가에 따라서 액화율이 증가하였다. 한편, 중온(135 ℃)에서는 산촉매 농도와 SBR의 증가에 따라서 각각의 액화율이 증가함이 관찰되었다. 따라서 액화온도가 감소할수록 바이오매스 액화에 대한 산의 촉매 역할이 더욱 커짐이 관찰되었다. 또한 lignocellulose 액화시간인 60분을 기준으로 lignocellulose의 액화율은 액화온도가 165 ℃인 Run 2 및 4에서 90% 이상으로 가장 높았다.
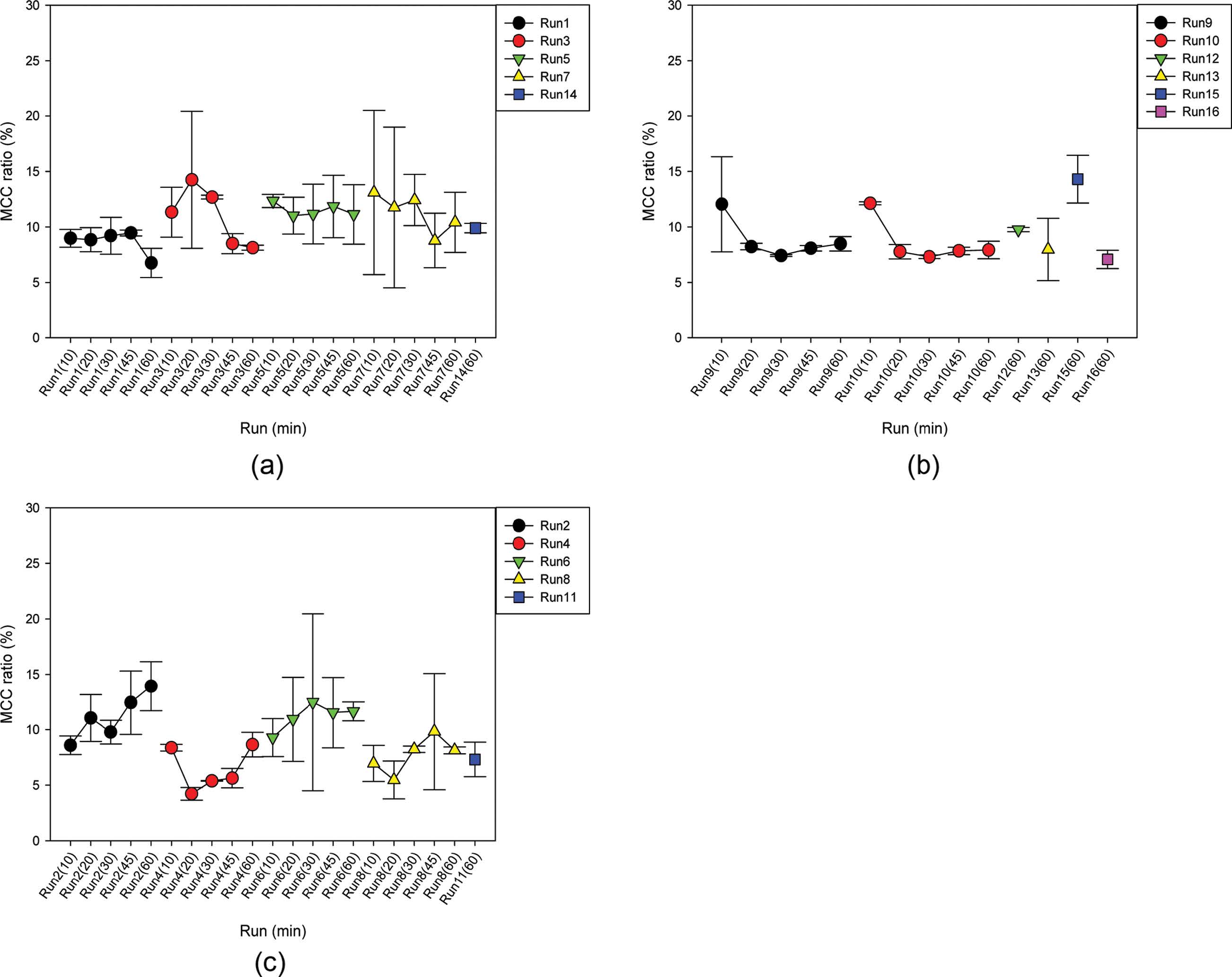
MCC 수율. 액화온도가 105 ℃인 경우(Run 1, 3, 5, 7 및 14)에는 Figure 4(a)에서와 같이 MCC 수율이 시간에 따라 감소하여 5-15%의 분포를 보였다. 이와 같이 시간에 따른 MCC 수율 감소는 구해진 MCC에 부착 및 동반되는 리그닌 또는 헤미셀룰로오스가 용해 및 제거되어 MCC가 시간에 따라서 정제됨을 의미한다. SBR이 증가하였을 때에, 산촉매 농도 1%에서는 MCC 수율이 3-5% 정도 증가하였으나, 산촉매 농도 5%에서는 SBR이 증가하여도 MCC 수율이 거의 비슷하였다. 또한 산촉매 농도가 증가하였을 때에, SBR이 3:1에서는 MCC수율이 약 3%가 증가하였으나, SBR이 5:1에서는 산촉매 농도가 증가하여도 MCC 수율이 거의 비슷하였다. 한편, 액화온도가 135 ℃의 경우(Run 9, 10, 12, 13, 15 및 16)에는 Figure 4(b)와 같이 MCC 수율은 액화시간 20분 이전까지는 감소하였으나 그 이후에는 거의 변하지 않았다. 이는 구해진 MCC에 부착 및 동반되는 리그닌 또는 헤미셀룰로오스가 20분 이전에 용해 및 제거되어, 액화온도가 105 ℃인 경우보다 MCC가 더 빠르게 정제됨을 의미한다. MCC 수율은 약 6-13%의 분포를 보였고, 산촉매 농도가 낮아지면 MCC 수율이 약 5% 정도 증가하였으나 SBR은 증가해도 MCC 수율이 비슷하였다. 마지막으로 액화온도가 165 ℃의 경우(Run 2, 4,6, 8 및 11)에는, 더 낮은 액화온도의 경우와 다르게 MCC에 리그닌 또는 헤미셀룰로오스가 제거되어 구해진 MCC의 셀룰로오스 순도가 높으며, 셀룰로오스에 대한 지속적인 산가수분해에 의하여 MCC 수율이 시간에 따라 증가하여 MCC 분포는 Figure 4(c)와 같이 약 5-15%의 분포를 보였다. SBR이 증가하면 MCC 수율이 약 5% 정도 감소하였으나 산촉매 농도는 증가하여도 MCC 수율의 변화가 없었다. Lignocellulose 액화시간인 60분을 기준으로 MCC 수율은 액화온도가 165 ℃인 Run 2와 액화온도가 135 ℃인 Run 15에서 가장 높았다. 따라서 lignocellulose 액화율과 MCC 수율을 동시에 고려하였을 때에 Run 2가 최적화 조건으로 도출되었다.
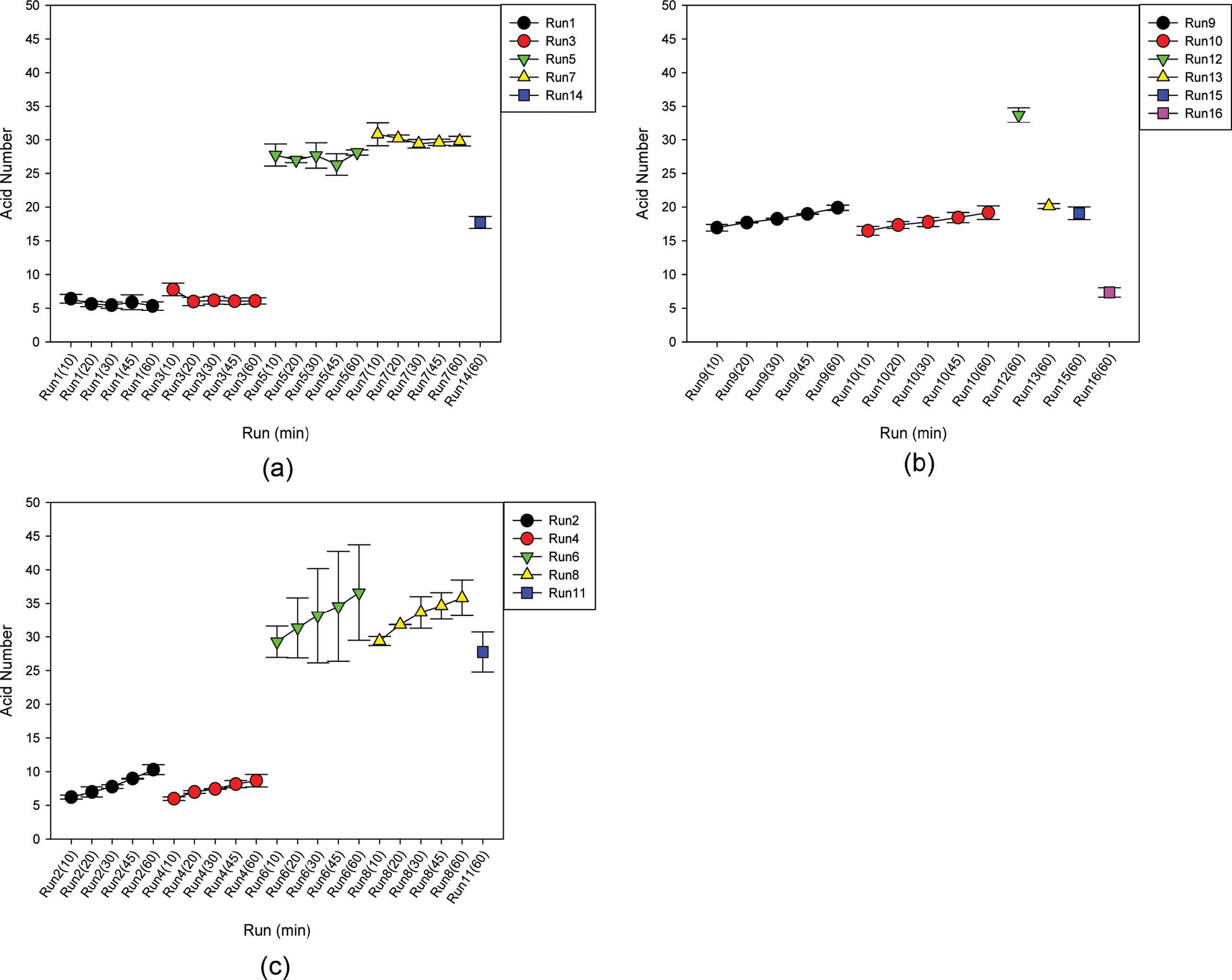
산가(Acid Value). 액화온도에 따른 lignocellulose-액화 폴리올의 산가 추세는 다음과 같았다. 액화온도가 105 ℃인 경우(Run 1, 3, 5, 7 및 14)에는 Figure 5(a)에서와 같이 산가가 5-30 mgKOH/g에 분포하였고 액화시간이 증가하여도 변화가 없었다. SBR이 증가함에도 산가는 비슷하였으나, 산촉매 농도가 증가하면 산가가 증가하였다. 한편, 액화온도가 135 ℃의 경우(Run 9, 10, 12, 13, 15 및 16)에는 Figure 5(b)와 같이 산가가 5-33 mgKOH/g에 분포하였고, 액화시간이 증가할수록 lignocellulose 내부에 존재하거나 탄수화물(carbohydrates)이나 리그닌이 액화 중에 산화되어진 산성물질이 생겨나서 산가는 천천히 증가하였으며, 산촉매 농도가 증가하면 마찬가지로 산가가 증가하였다. 마지막으로 액화온도가 165 ℃의 경우(Run 2, 4, 6, 8 및 11)에는 Figure 5(c)와 같이 산가가 5-35 mgKOH/g에 분포하였고, 액화시간이 증가할수록 산가는 약간 증가하였으며 산촉매 농도가 증가하면 마찬가지로 산가가 증가하였다. 따라서 액화온도와 관계없이 산촉매 농도가 증가할수록 산가가 증가하였다.
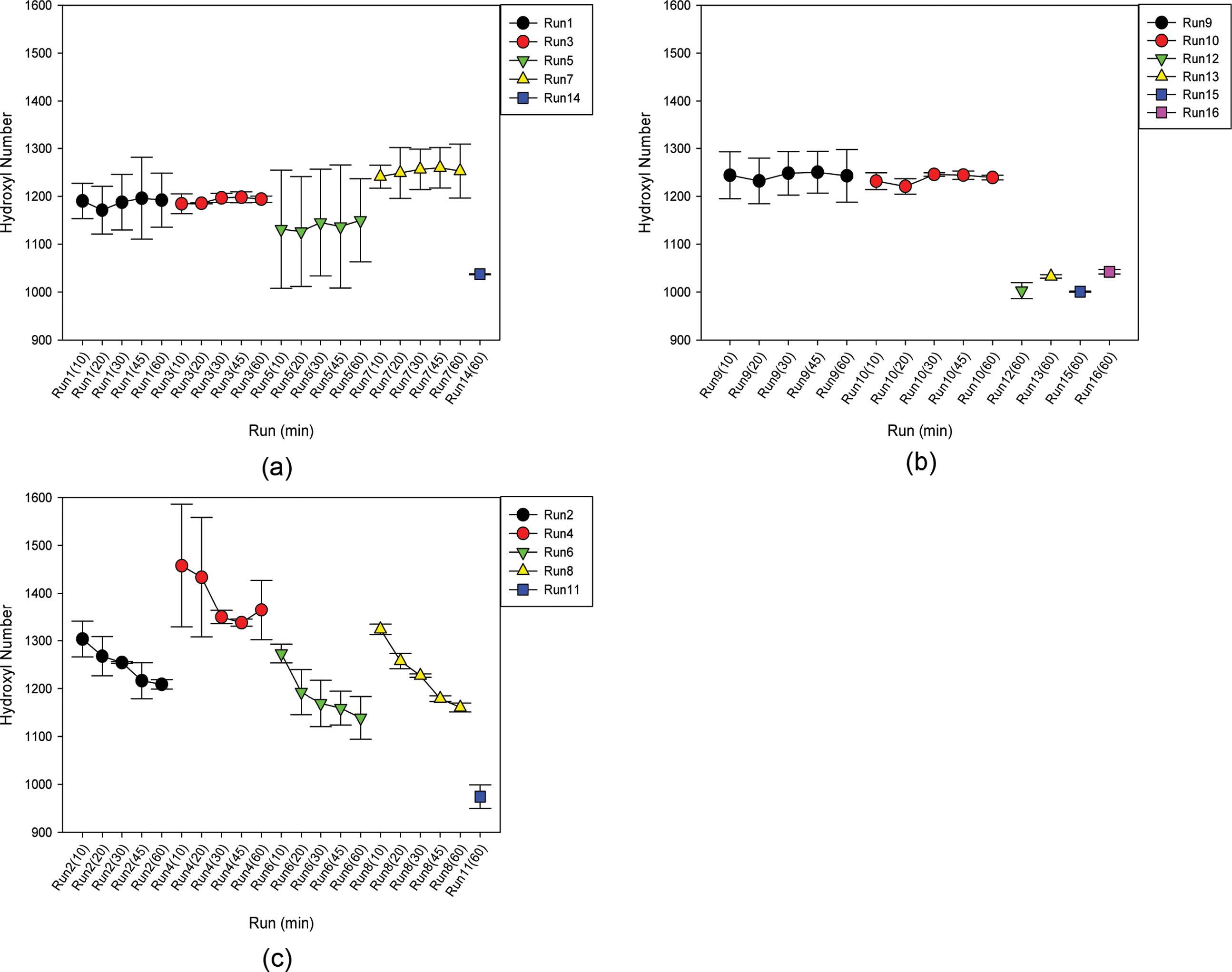
OH가(OH Value). 액화온도에 따른 lignocellulose-액화 폴리올의 OH가 추세는 다음과 같았다. 액화온도가 105 ℃인 경우(Run 1, 3, 5, 7 및 14)에는 Figure 6(a)에서와 같이 OH가 1050-1250 mgKOH/g에 분포하였고 액화시간이 증가하여도 OH가의 변화가 없었다. SBR이 증가하였음에도 불구하고, 산촉매 농도가 같은 1%에서는 OH가가 비슷하였으나, 산촉매 농도도 1에서 5%로 증가한 경우에는 OH가가 증가하였다. 한편, 액화온도가 135 ℃의 경우(Run 9, 10, 12, 13, 15 및 16)에는 Figure 6(b)와 같이 OH가가 1000-1250 mgKOH/g에 분포하였고, 액화시간이 증가하여도 마찬가지로 OH가의 변화가 없었다. OH가는 SBR이 4:1 및 산촉매 농도 3%에서 최대치를 보였다. 마지막으로 액화온도가 165 ℃의 경우(Run 2, 4, 6, 8 및 11)에는 Figure 6(c)와 같이 OH가 1100-1450 mgKOH/g에 분포하였고, 액화시간이 증가할수록 용매와 lignocellulosic 액화성분간의 반응뿐만20 아니라 산가수분해된 lignocellulosic 액화폴리올의 탈수(dehydration) 및 용매의 열산화분해(thermal oxidative degradation)때문에21 OH가의 감소가 발생하였다. 이러한 OH가의 감소는 lignocellulose의 다당류와 폴리올 용매간의 응축(condensation)으로 인한 hydroxy glucosides의 생성에도21 기인하였다. 또한 산가를 나타내는 lignocellulose의 산성물질과 폴리올 용매간의 산촉매 하에서 탈수(dehydration) 반응은16 에스테르를 생성하고, 액화온도 165 ℃에서 액화시간이 증가함에 따라서 OH가를 급격히 감소시켰다. 그러나 이러한 현상은 액화온도가 105 및 135 ℃와 같이 저온과 중온인 경우에는 보이지 않았다. 한편, SBR이 증가하면 OH가가 증가하고 산촉매 농도가 증가하면 OH가는 감소하였다.
CCD 실험설계에 의한 반응표면분석(RSM) 결과. Lignocellulose 액화율 결과 값에 대해 반응표면분석법을 적용한 회귀분석(regression)에서 구하여진 2차 회귀모델식은 eqs. (5) 및 (6)와 같다.
Response surface equation of model-predicted lignocelluloseliquefaction yield(z1) versus [temperature(x) and SBR(y)]:
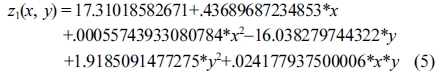
Response surface equation of model-predicted lignocelluloseliquefaction yield(z1) versus [temperature(x) and sulfuric acid concentration(y)]:
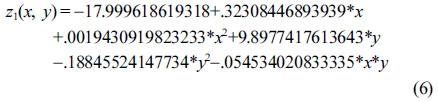
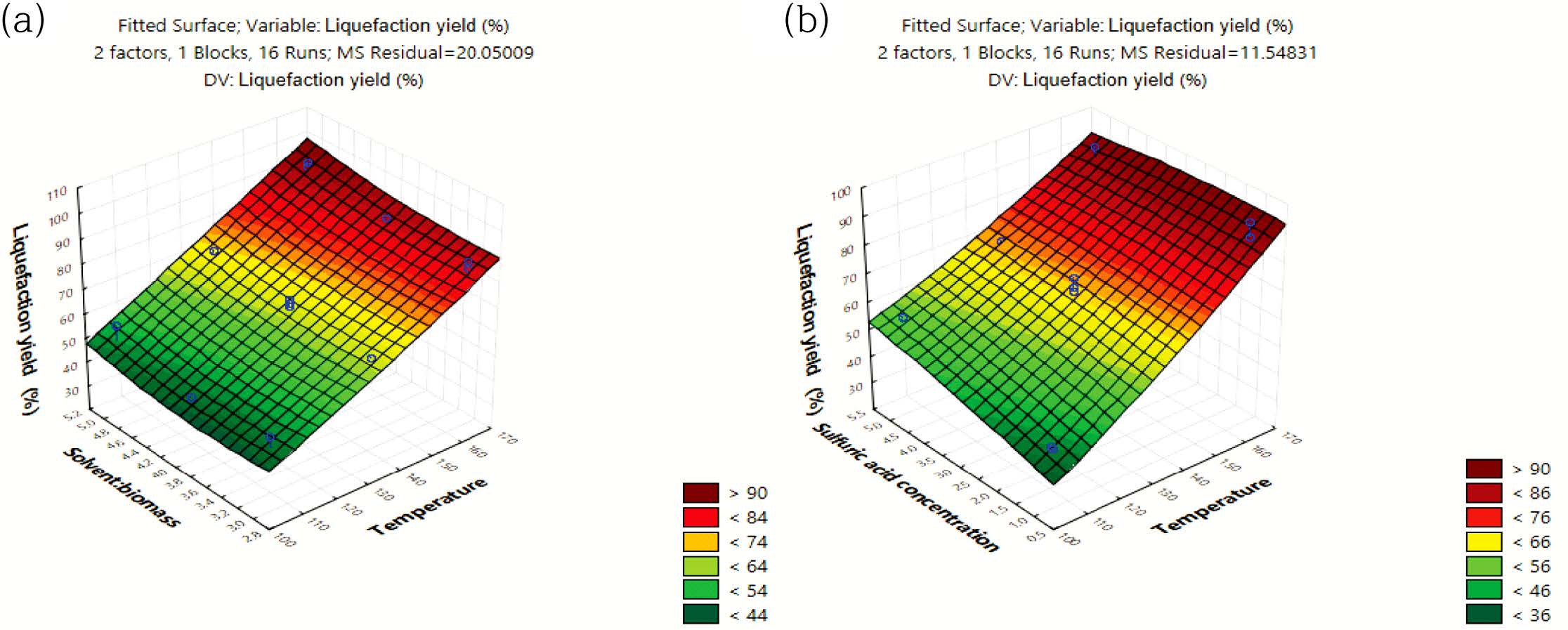
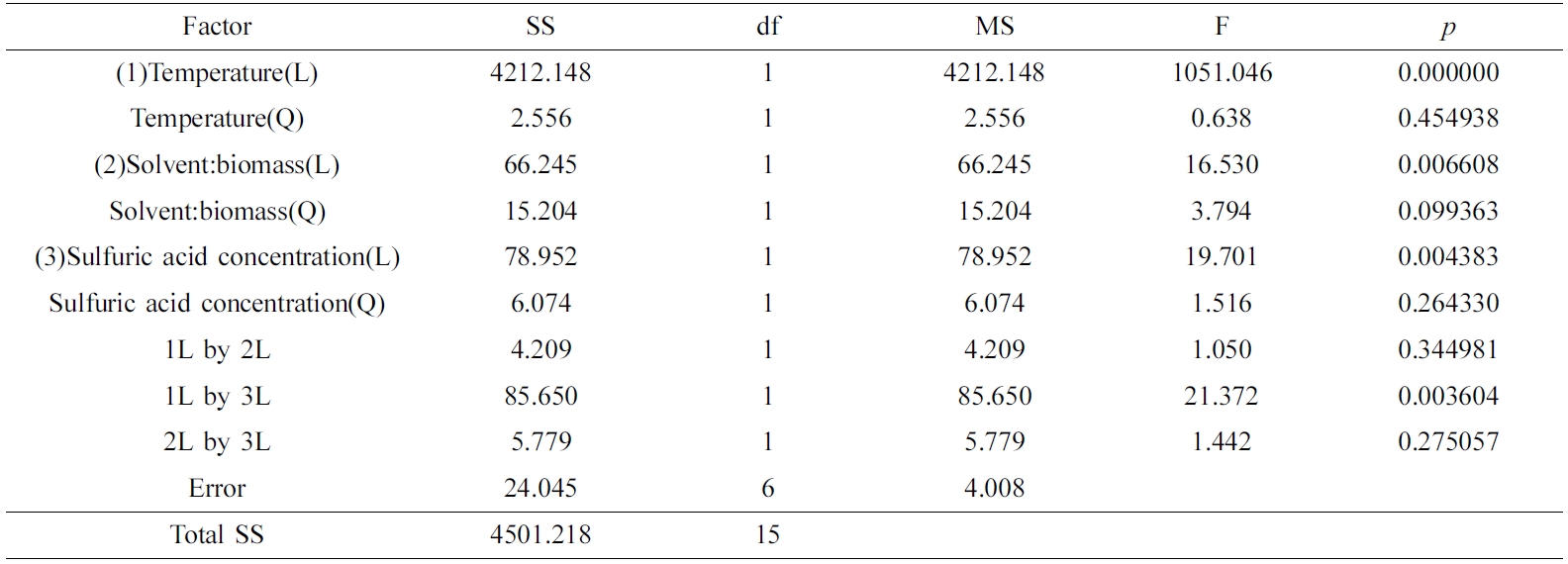
Table 4의 ANOVA 결과에서 p값이 0.05보다 적은 경우를 유의하다고 가정했을 때에, 액화율은 액화온도에 절대적으로 유의한 선형의 상관관계를 보였고, 산촉매 농도와 SBR에는 각각 지극히 유의한 선형의 상관성을 보였다. Figure 7(a) 및 7(b)와 같이 액화온도가 증가할수록 모델예측(model-predicted)된 액화율(z1)은 선형으로 증가하였고, 이에 따라서 액화온도로서 165 ℃가 최적 액화온도로 도출되었다.
한편, MCC 수율(%) 결과 값에 대해 반응표면분석법을 적용한 회귀분석(regression)에서 구하여진 2차 회귀모델식은 eqs. (7) 및 (8)과 같다.
Response surface equation of model-predicted MCC yield(z2) versus [SBR(x) and sulfuric acid concentration(y)]:
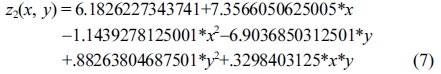
Response surface equation of model-predicted MCC yield(z2) versus [temperature(x) and sulfuric acid concentration(y)]:
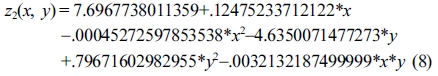
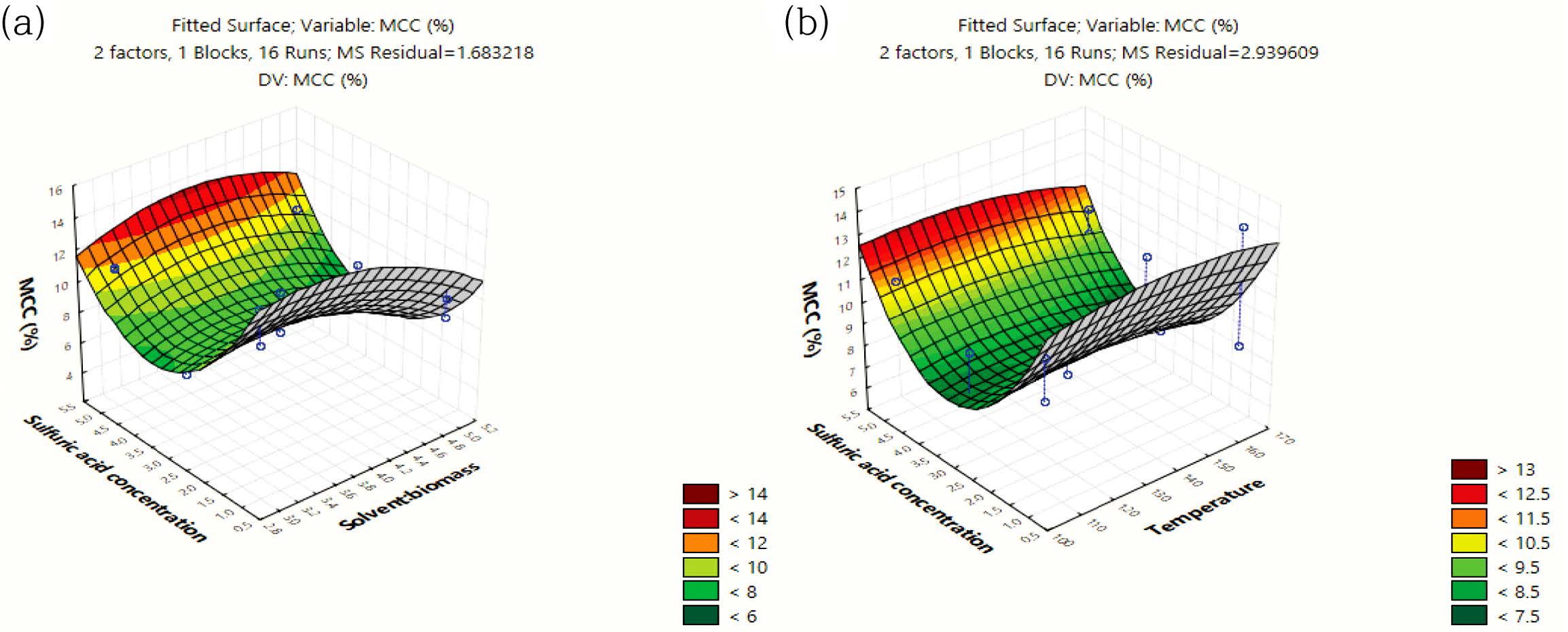
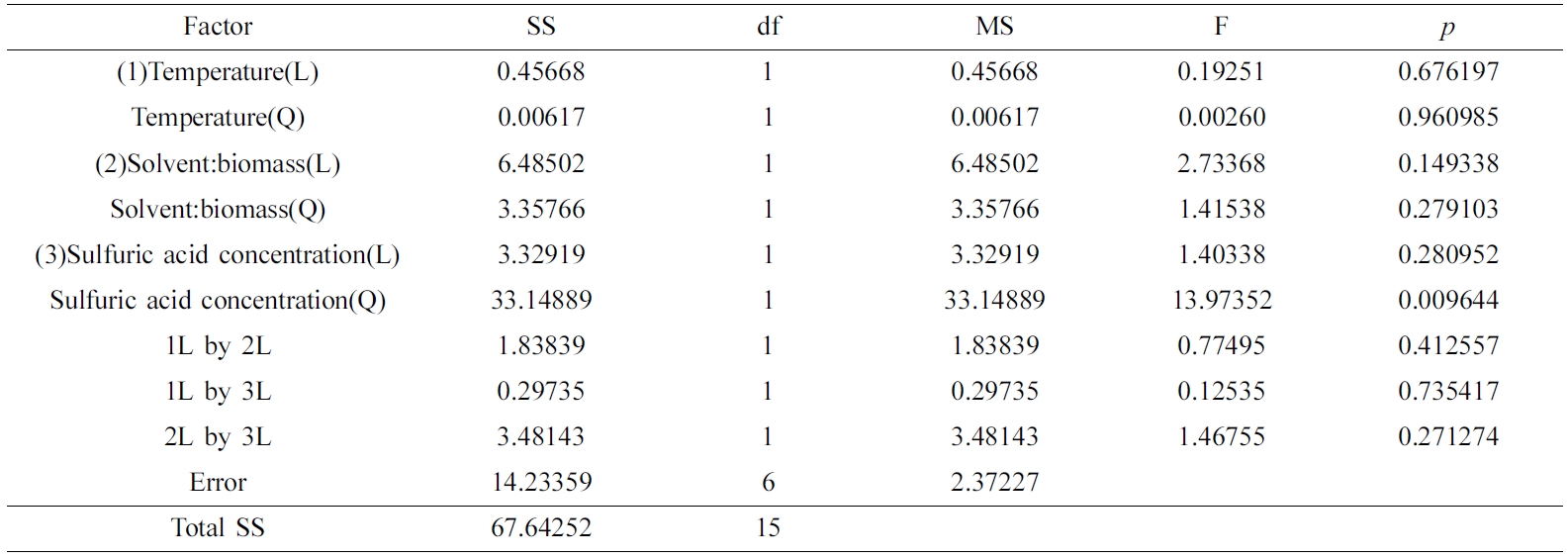
MCC(%) 수율은 Table 5의 ANOVA 결과와 같이 산촉매농도의 자승(quadratic)에 매우 유의한 상관관계를 보였다. 모델예측(model-predicted)된 MCC(%) 수율(z2)은 Figure 8(a) 및 8(b)와 같이 산촉매 농도에 대하여 포물선 거동을 보였으므로, 산촉매 농도가 중간범위의 농도보다 높거나 낮을 때에 MCC(%) 수율이 더 높은 값을 보였다. 따라서 반응표면분석 결과로서, 최대의 액화율과 MCC(%) 수율을 위한 본 연구의 공정조건은 액화온도가 165 ℃이고 산촉매 농도가 1% 또는 5%로 도출되었다.
한편, 산가 및 OH가에 대한 공정변수들의 상관관계를 다음과 같이 분석하였다. 산가의 결과 값에 대해 반응표면분석법을 적용한 회귀분석(regression)에서 구하여진 2차 회귀모델식은 eqs. (9) 및 (10)과 같다.
Response surface equation of model-predicted acid number(z3) versus [SBR(x) and sulfuric acid concentration(y)]:
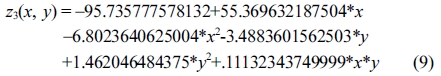
Response surface equation of model-predicted acid number(z3) versus [temperature(x) and sulfuric acid concentration(y)]:
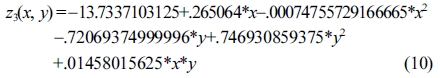
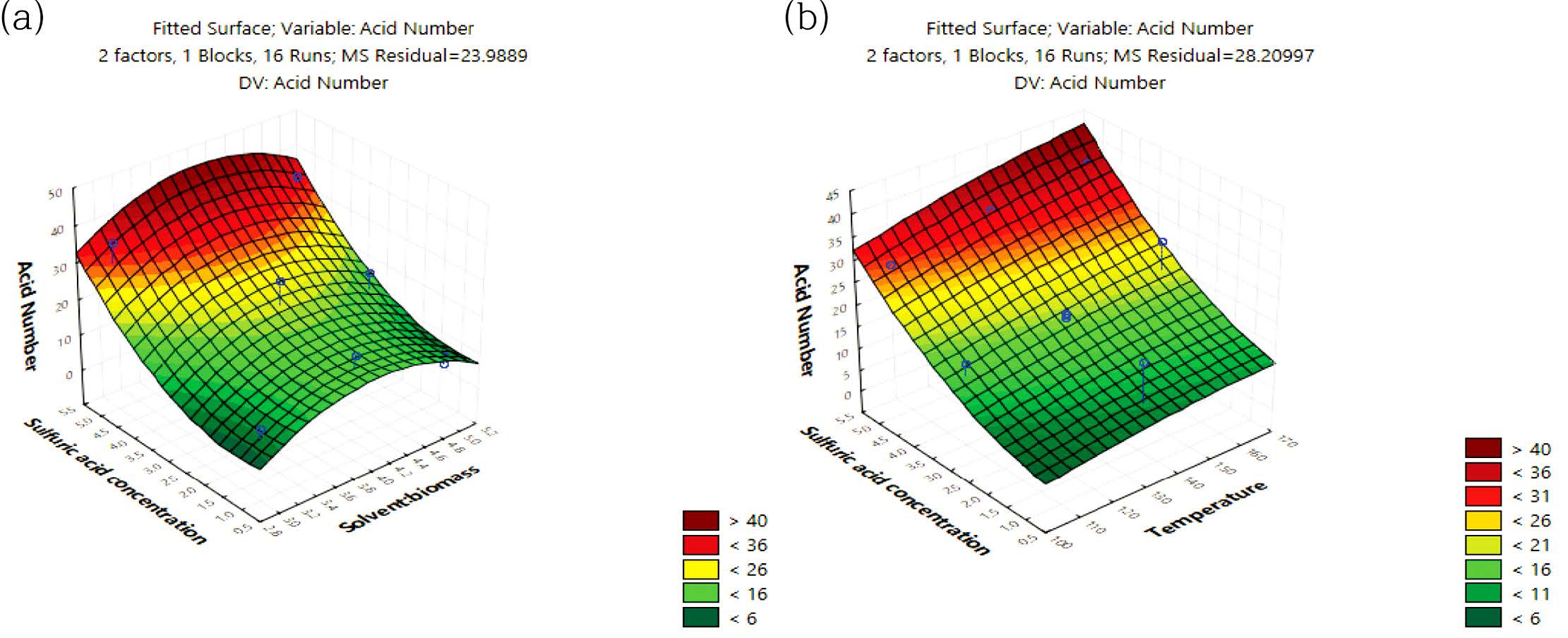
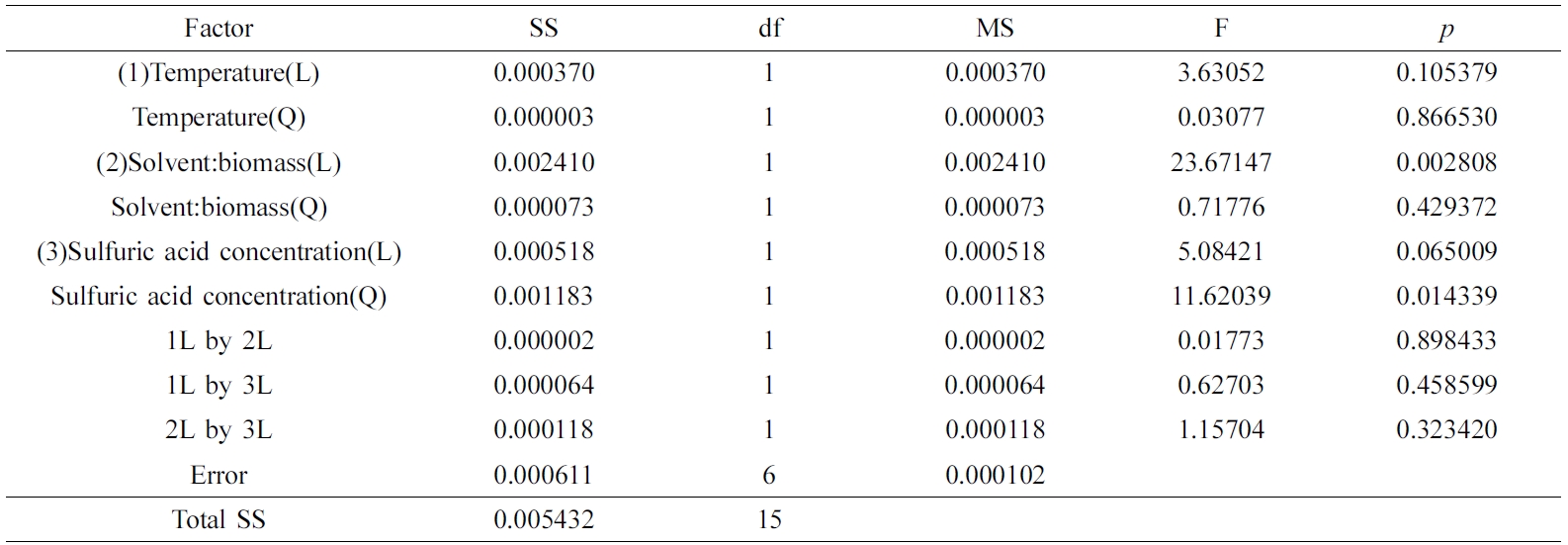
산가는 Figure 9(a) 및 9(b)와 같이 산촉매 농도가 증가함에 따라서 포물선으로 급격히 증가하는 모델예측(modelpredicted) 거동을 보였는데, 산가는 Table 6의 ANOVA 결과와 같이 산촉매 농도의 자승(quadratic)에 매우 유의한 상관관계를 보였다.
또한 OH가의 결과 값에 대해 반응표면분석법을 적용한 회귀분석(regression)에서 구하여진 2차 회귀모델식은 eqs. (11) 및 (12)와 같다.
Response surface equation of model-predicted hydroxyl number(z4) versus [temperature(x) and SBR(y)]:
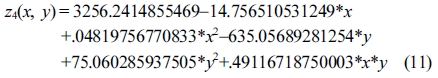
Response surface equation of model-predicted hydroxyl number(z4) versus [temperature(x) and sulfuric acid concentration(y)]:
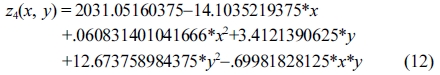
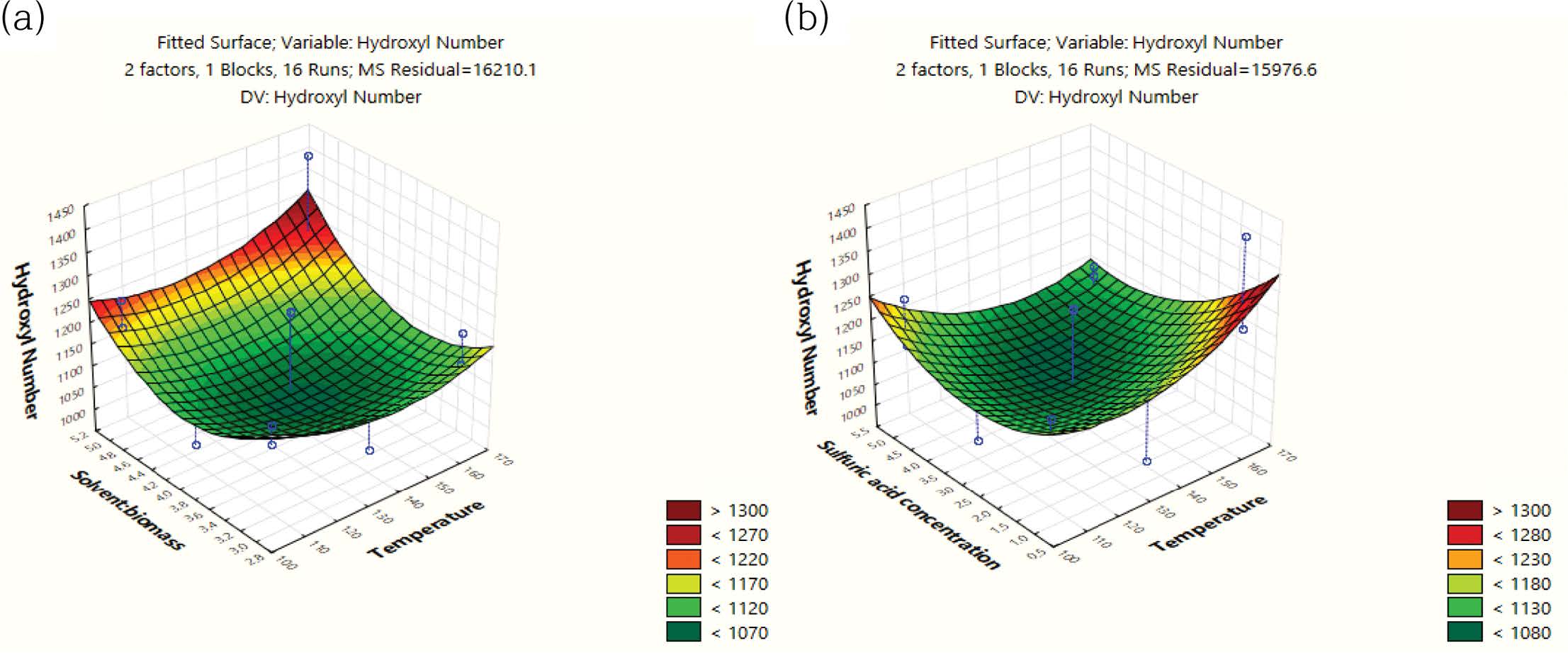
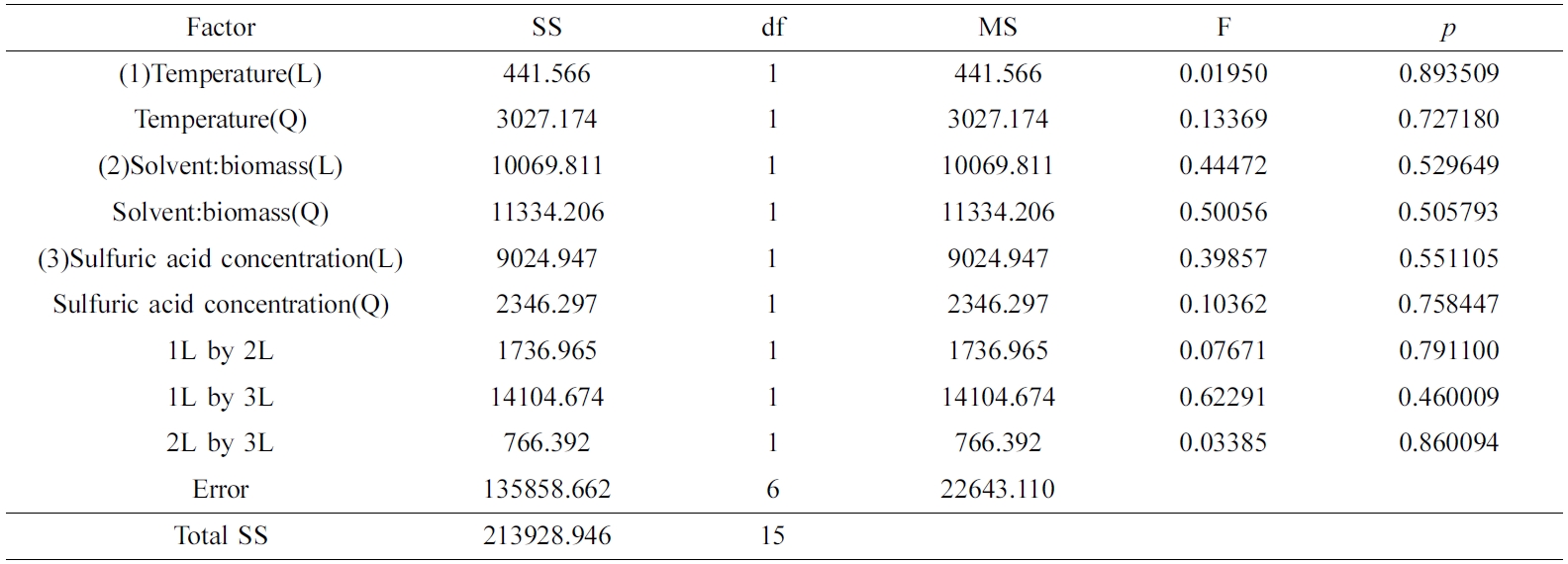
그러나 OH가는 Table 7의 ANOVA분석과 같이 세 가지 공정변수 각각에 대하여 유의도가 낮은 상관관계를 보였고, Figure 10(a) 및 10(b)와 같은 모델예측(model-predicted) 거동을 보였다.
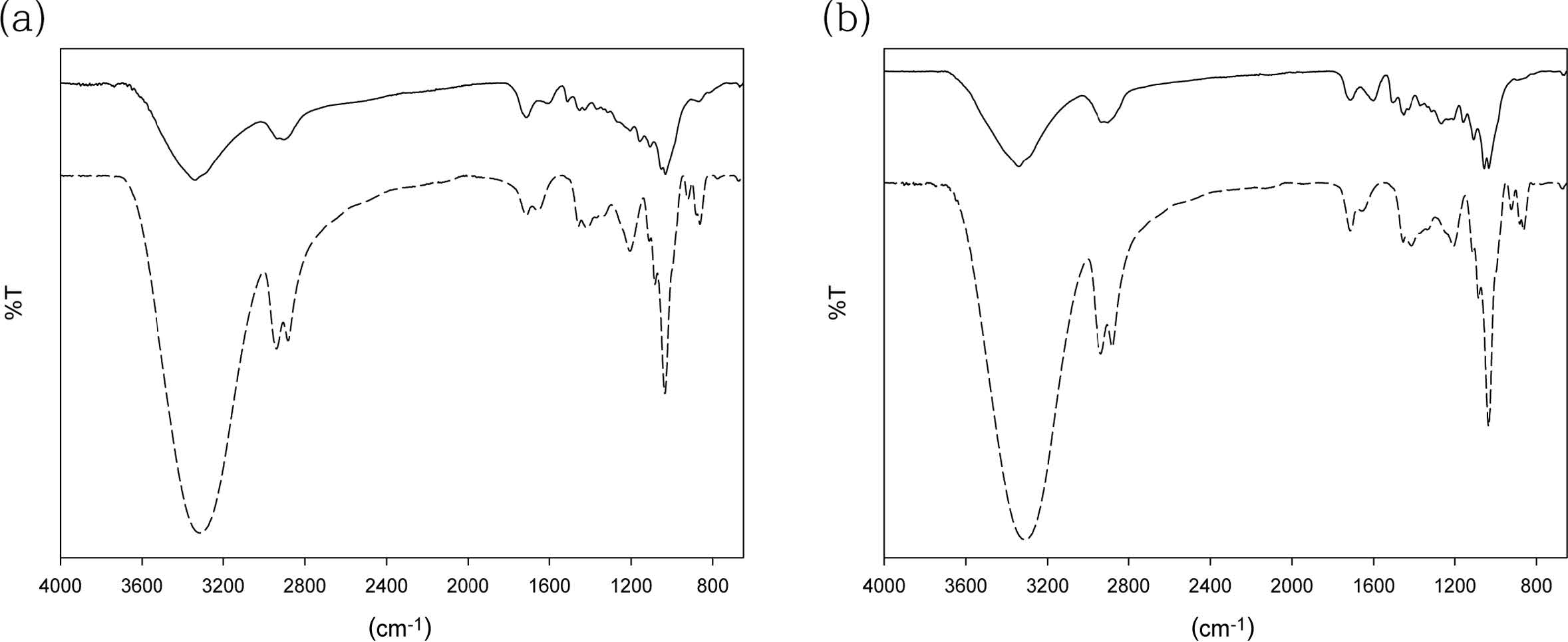
Lignocellulose 액화 동시제조 폴리올 및 MCC의 FTIR 분석결과. 액화시간 60분의 조건으로 제조된 액화바이오매스폴리올 및 액화바이오매스 폴리올에서 분리한 MCC의 FTIR spectrum은 Figure 11과 같다. Figure 11의 FTIR spectrum에서 액화바이오매스 폴리올이 MCC보다 더 크고 강한 수소결합이 된 알콜의 O-H 신축진동에 의한 피크(3000-3600 cm-1)를 나타내었다. 한편, MCC 경우의 –OH기 피크(3000-3600 cm-1)는 결정성 셀룰로오스에 존재하는 수소결합에 관여하는 O-H 신축진동에 의한 피크이었다. Kim과 Sung은22 cotton liner 펄프, oil palm fruit bunch 표백소다펄프, 침엽수 표백크라프트 펄프 기반 MCC 및 상용화된 Avicel-MCC(PH 101)의 FTIR 결과에서 상용화된 Avicel-MCC만이 다른 펄프 기반 MCC와 –OH기 피크(3000-3600 cm-1)가 상이하였으며, 이는 셀룰로오스의 수화로 인한 표면 친수성 변화의23,24 결과로서 보고하였다. 본 연구에서의 MCC 경우의 –OH기 피크는 Kim과 Sung이22 보고한 표면 친수성이 변화된 상용화된 Avicel-MCC의 –OH기 피크와 형태와 특성이 거의 일치함이 관찰되었다. 셀룰로오스의 가수분해와 에틸렌글리콜과의 축합에서 생성된 ethylene glycol-glucosides로부터 발생한 2-hydroxyethyl levulinate에서 유래하는 에스테르의 C=O 신축진동을 나타내는 피크가, Run 6(Figure 11(a))보다 SBR이 더큰 Run 8(Figure 11(b))의 액화바이오매스의 FTIR 스펙트럼의 1730 cm-1에서 더 강하게 나타났다. 또한 액화바이오매스폴리올이, 리그닌을 나타내는 피크인 C=C 결합(1633 cm-1) 및 벤젠 skeleton 진동(1513 cm-1), 셀룰로오스와 리그닌을 나타내는 피크인 C-H 진동(1412 cm-1), 리그닌을 나타내는 피크인 C-O-C 진동(1203 cm-1) 및 셀룰로오스와 헤미셀룰로오스를 나타내는 피크인 C-O 진동(1033 cm-1)에서 MCC보다 더 강한 피크를 보였다. 그 이유는 액화바이오매스 폴리올 내에 액화된 리그닌과 헤미셀룰로오스와 그 분해산물이 존재하는 반면에, MCC 경우는 solvolysis에 의하여 리그닌과 헤미셀룰로오스가 액화되어 고상 밖으로 용출된 것에 기인한다.
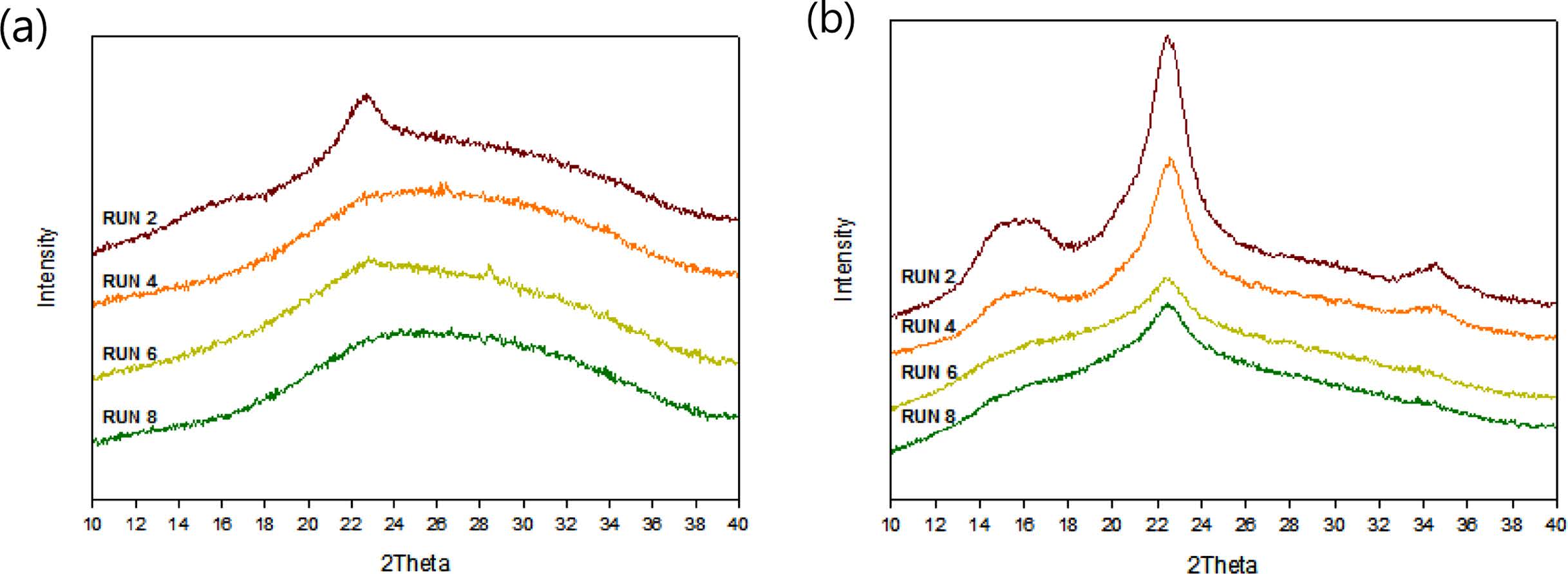
분리된 MCC 특성. 바이오매스 액화실험에서 최대 액화율과 MCC(%) 수율을 위한 반응표면분석법에 의한 MCC와 폴리올의 동시제조의 최적화 액화조건으로서 액화온도가 165 ℃이고 산촉매 농도가 1 또는 5%로 도출되었다. 따라서 실험조건을 액화온도가 165 ℃인 Run 2, 4, 6 및 8로 한정하였고, Run 2, 4, 6 및 8에서 각각 분리시킨 residue와 동시제조된 MCC의 XRD 분석 결과는 각각 Figure 12(a) 및 12(b)와 같다. 결정형 셀룰로오스의 결정구조는 XRD 스펙트럼의 15°, 16.4° 및 22.5°의 2θ 값에서 구분된 피크를 가진다.25 분리시킨 residue의 Figure 12(a)와 같은 XRD 분석 결과에서 Run 2에서는 다른 Run과 다르게 22.5°의 2θ 값에서 피크가 나타났음에도 불구하고, 결정형 셀룰로오스 입자에 부착 또는 수반된 무정형 셀룰로오스(amorphous cellulose) 또는 리그닌과 헤미셀룰로오스로 인하여 다른 전형적인 셀룰로오스 결정 피크가 나타나지 않았다. 한편, 바이오매스 액화실험에서 동시제조된 MCC의 Figure 12(b)와 같은 XRD 분석 결과에서는 전형적인 결정형 셀룰로오스의 피크가 나타났는데, 셀룰로오스 결정피크가 발달한 순서는 Run 2[SBR, 3:1; sulfuric acid 1%] > Run 4[SBR, 5:1; sulfuric acid 1%] > Run 6[SBR, 3:1; sulfuric acid 5%] > Run 8[SBR, 5:1; sulfuric acid 5%] 이었다. 따라서 산촉매 농도가 5%보다 낮은 1%에서 결정형셀룰로오스 피크가 더욱 발달함이 관찰되었고, 또한 각각의 산촉매 농도에서는 SBR이 5:1보다 작은 3:1에서 결정형 셀룰로오스 피크가 더욱 발달함이 관찰되었다. 이러한 현상은 톱밥(larix kaempferi)의 산가수분해에 있어서 산촉매 농도가 너무 크면 톱밥으로부터 용출되어 용매에 용해되었던 리그닌, 헤미셀룰로오스 및 셀룰로오스가 고상의 셀룰로오스에 재반응하여서 셀룰로오스의 결정도를 저해하는 것으로 해석된다. 또한 주어진 산촉매 농도에서 SBR이 너무 큰 경우에도, 폴리올 용매가 고상의 셀룰로오스의 표면 근처로 침투하여 셀룰로오스의 결정도를 저해하는 것으로 해석된다. 추가적으로 CCD 실험계획에 따라서 동시제조된 MCC의 XRD 결과 중에서, Run 2 경우가 Figure 12(b)에서 참고문헌과25 같이 XRD 스펙트럼의 15°, 16.4° 및 22.5°의 2θ 값에서 구분된 피크를 가짐이 관찰되었다. 한편, XRD 스펙트럼에서는 명확하게 관찰되지 않지만 무정형 성분(amorphous component)의 halo 피크는 21° 근처에서 생성되는 것으로 알려져 있다.26 Awa 등은25 온전한 MCC(Avicel, PH101)와 90분 이내 동안 기계적으로 파쇄한 MCC의 결정도(crystallinity index)를 각각 curve fitting 방법으로26 구하였는데, 각각 85.8%와 70.1~83.6%라고 보고하였다.
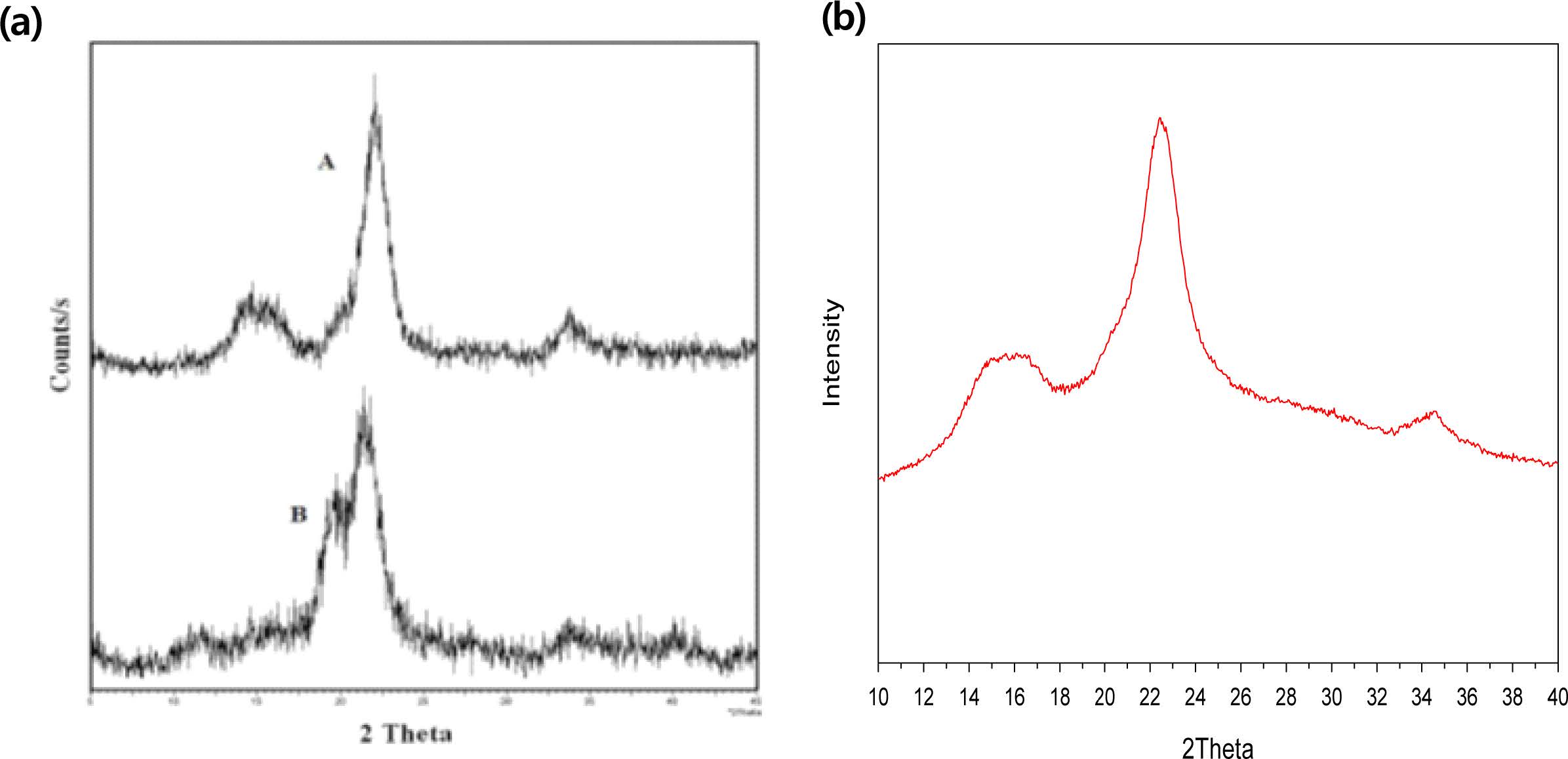
Figure 12(b)에서 Run 2 경우가 셀룰로오스의 결정 피크가 가장 발달됨이 관찰되어서, Run 2가 본 연구에서 동시제조된 MCC의 최적조건임이 입증되었다. 한편, 본 연구에서 Run 2의 실험조건에 의하여 동시제조된 MCC, Pachuau 등에27 의해서 제조된 MCC 및 상업용 MCC인 Avicel(PH101)의 XRD 분석결과를 Figure 13과 같이 비교하였다. 그 결과로서 본 연구에서 Run 2의 실험조건에 의하여 동시제조된 MCC의 XRD피크가 Pachuau 등에27 의해서 제조된 MCC보다 더욱 발달하였음이 관찰되었다. 또한 본 연구에서 동시제조된 MCC의 경우에는 셀룰로오스 외에 톱밥으로부터 용출되어 용매에 용해되었다가, 동시제조된 MCC에 재응축(recondensation)된 리그닌도 동반된 복합물이어서 순수한 셀룰로오스의 결정도를 산출하기가 어려우나, 본 연구에서 Run 2의 실험조건에 의하여 동시제조된 MCC의 XRD 피크가 Awa 등의25 결과에서의 결정도가 83.6%로 보고된 MCC의 XRD 피크와 매우 유사함이 관찰되었다.
바이오매스 액화에 의한 MCC 및 폴리올 동시제조 및 최적화 조건. 바이오매스 액화에 의한 MCC와 폴리올의 동시제조에서 lignocellulose 액화율과 MCC 수율 및 결정도를 고려한 최적화 액화조건은 Table 3의 실험조건 중에서 Run 2로 나타났다. 특히 Run 2에서 분리된 MCC의 결정 피크의 특성이 상업용 MCC인 Avicel과 유사하였다. 따라서 lignocellulose 액화율, MCC 수율 및 MCC 결정도에 따른 최적화 액화조건은 액화온도, SBR 및 산촉매 농도가 각각 165 ℃, 3:1, 1%이었다.
Lignocellulose 액화 폴리올의 GPC 분석결과. 바이오매스 액화에 의한 MCC와 폴리올의 동시제조에서 최적화 액화조건(Run 2)으로 제조한 폴리올에 대한 분자량 분석 결과는 Mn, Mw 및 MP가 각각 2750, 3274 및 3208로 나타났다. 따라서 polydispersity 값은 1.19를 보였고, 비교적 균질한 분자량 분포를 나타내었다.
|
Figure 3 Liquefaction-yield of saw dust of Larix kaempferi at the liquefaction-temperature of 105 ℃ (a), 135 ℃ (b) and 165 ℃ (c): (a) Run 1, 3, 5, 7 and 14; (b) Run 9, 10, 12, 13, 15 and 16; (c) Run 2, 4, 6, 8 and 11 (The liquefaction yields for each run from run 1 through 10 were shown at five liquefaction times of 10, 20, 30, 45 and 60 min while the liquefaction-yield for each run from run 11 through 16 was shown at the liquefaction time of only 60 min). |
|
Figure 4 MCC(%)-yield from the liquefaction of saw dust of Larix kaempferi at the liquefaction-temperature of 105 ℃ (a), 135 oC (b) and 165 ℃ (c): (a) Run 1, 3, 5, 7 and 14; (b) Run 9, 10, 12, 13, 15 and 16; (c) Run 2, 4, 6, 8 and 11 (The MCC(%)-yields for each run from run 1 through 10 were shown at five liquefaction times of 10, 20, 30, 45 and 60 min while the MCC(%)-yield for each run from run 11 through 16 was shown at the liquefaction time of only 60 min). |
|
Figure 5 Acid number of liquefied saw dust of Larix kaempferi at the liquefaction-temperature of 105 ℃ (a), 135 ℃ (b) and 165 ℃ (c): (a) Run 1, 3, 5, 7 and 14; (b) Run 9, 10, 12, 13, 15 and 16; (c) Run 2, 4, 6, 8 and 11 (The acid numbers for each run from run 1 through 10 were shown at five liquefaction times of 10, 20, 30, 45 and 60 min while the acid number for each run from run 11 through 16 was shown at the liquefaction time of only 60 min). |
|
Figure 6 Hydroxyl number of liquefied saw dust of Larix kaempferi at the liquefaction-temperature of 105 ℃ (a), 135 ℃ (b) and 165 ℃ (c): (a) Run 1, 3, 5, 7 and 14; (b) Run 9, 10, 12, 13, 15 and 16; (c) Run 2, 4, 6, 8 and 11 (The hydroxyl numbers for each run from run 1 through 10 were shown at five liquefaction times of 10, 20, 30, 45 and 60 min while the hydroxyl number for each run from run 11 through 16 was shown at the liquefaction time of only 60 min). |
|
Figure 7 Response surface plot of the model-predicted liquefaction yield (%) versus: (a) temperature and SBR; (b) temperature and sulfuric acid concentration. |
|
Figure 8 Response surface plot of the model-predicted MCC yield (%) versus: (a) SBR and sulfuric acid concentration; (b) temperature and sulfuric acid concentration. |
|
Figure 9 Response surface plot of the model-predicted acid number versus: (a) SBR and sulfuric acid concentration; (b) temperature and sulfuric acid concentration. |
|
Figure 10 Response surface plot of the model-predicted hydroxyl number versus: (a) temperature and SBR; (b) temperature and sulfuric acid concentration. |
|
Figure 11 FTIR spectra for liquefied biomass[---] and MCC[−−] prepared using the liquefaction conditions of Run 6(a) and Run 8(b) from CCD of this study. |
|
Figure 12 XRD spectrum of residue and MCC obtained from the experiments of Run 2, 4, 6 and 8: (a) residue; (b) MCC. |
|
Figure 13 XRD spectrum: (a) Avicel(PH101) as commercial MCC (A) and MCC prepared by Pachau et al.24(B); (b) MCC prepared from Run 2 in this study. |
|
Table 4 Analysis of Variance for the Response Surface Quadratic Model on the Liquefaction Yield |
|
Table 5 Analysis of Variance for the Response Surface Quadratic Model on the MCC Yield (%) |
|
Table 6 Analysis of Variance for the Response Surface Quadratic Model on the Acid Number |
|
Table 7 Analysis of Variance for the Response Surface Quadratic Model on the Hydroxyl Number |
바이오매스(톱밥, larix kaempferi) 액화(liquefaction) 공정조건의 반응표면분석법(RSM)에 따른 적정조건을 구축하기 위하여, 바이오매스 액화실험을 Run 1부터 16까지의 CCD(central composite design) 실험계획에 따라서 수행하였다. 바이오매스 액화온도(105, 135 및 165 ℃), 산촉매로서 sulfuric acid 농도(1, 3 및 5%)와, 혼합용매[에틸렌글리콜과 글리세린의 혼합용매(4:6)]와 바이오매스의 비(300, 400 및 500%)의 각 바이오매스 액화공정 조건에서 바이오매스 액화실험을 각각 60분 동안 수행하고, 추가적으로 각각 10, 20, 30 및 45분동안 수행하였다. Lignocellulose 액화율은 액화온도가 감소할수록 바이오매스 액화에 대한 산의 촉매 역할이 더욱 커짐이 관찰되었다. 또한 lignocellulose 액화시간인 60분을 기준으로 lignocellulose의 액화율은 액화온도가 165 ℃인 Run 2 및 4에서 90% 이상으로 가장 높았다. 한편, lignocellulose 액화시간인 60분을 기준으로 MCC 수율은 액화온도가 165 ℃인 Run 2와 액화온도가 135 ℃인 Run 15에서 가장 높았다. 따라서 lignocellulose 액화율과 MCC 수율을 동시에 고려하였을 때에 Run 2가 최적화 조건으로 도출되었다. Lignocellulose-액화 폴리올의 산가 추세는 액화온도와 관계없이 산촉매 농도가 증가할수록 산가가 증가하였다. 또한 lignocellulose-액화 폴리올의 OH가 추세는 액화온도 165 ℃에서 액화시간이 증가함에 따라서 OH가를 급격히 감소시켰으나, 이러한 현상은 액화온도가 105 및 135 ℃와 같이 저온과 중온인 경우에는 보이지 않았다.
CCD 실험설계에 의한 반응표면분석(RSM) 결과로서, 액화율은 액화온도에 절대적으로 유의한 선형의 상관관계를 보였고, 산촉매 농도와 SBR에는 각각 지극히 유의한 선형의 상관성을 보였다. 액화온도가 증가할수록 액화율은 선형으로 증가하였고, 이에 따라서 액화온도로서 165 ℃가 최적 액화온도로 도출되었다. 한편, MCC(%) 수율은 산촉매 농도의 자승(quadratic)에 매우 유의한 상관관계를 보였는데, MCC(%) 수율은 산촉매 농도가 중간범위의 농도보다 높거나 낮을 때에 MCC(%) 수율이 더 높은 값을 보였다. 따라서 반응표면분석 결과로서, 최대의 액화율과 MCC(%) 수율을 위한 본 연구의 공정조건은 액화온도가 165 ℃이고 산촉매 농도가 1% 또는 5%로 도출되었다. 한편, 분리된 MCC의 XRD 특성으로서, 산촉매 농도가 5%보다 낮은 1%에서 결정형 셀룰로오스 피크가 더욱 발달함이 관찰되었고, 또한 각각의 산촉매 농도에서는 SBR이 5:1보다 작은 3:1에서 결정형 셀룰로오스 피크가 더욱 발달함이 관찰되었다. 따라서 바이오매스 액화에 의한 MCC와 폴리올의 동시제조에서 최적화 조건은 액화온도, SBR 및 산촉매 농도가 각각 165 ℃, 3:1, 1%로서 Run 2의 실험조건과 일치하였다. 또한 이러한 최적화조건은, 통계적 방법인 반응표면분석과 분리된 MCC의 XRD 특성을 고려하지 않고 lignocellulose 액화율과 MCC 수율만을 동시에 고려한 최적화조건과 일치하였다.
- 1. S. H. Yoo, H. J. Song, and C. K. Kim, Polym. Korea, 36, 721 (2012).
-

- 2. H. Deka, N. Karak, R. D. Kalita, and A. K. Buragohain, Polym. Degrad. Stabil., 95, 1509 (2010).
-

- 3. K. Benhamou, H. Kaddami, A. Magnin, A. Dufresne, and A. Ahmad, Carbohydr. Polym., 122, 202 (2015).
-

- 4. C. Zhang, H. Wu, and M. R. Kessler, Polymer, 69, 52 (2015).
-

- 5. J.-H. Lee, J.-H. Lim, K.-Y. Kim, and K.-M. Kim, Polym. Korea, 38, 74 (2013).
-

- 6. E. Glowinska and J. Datta, Cellulose, 23, 581 (2016).
-

- 7. Q. Wu, M. Henriksson, X. Liu, and L. A. Berglund, Biomacromolecules, 8, 3687 (2007).
-

- 8. H. Zhang, Y. She, X. Zheng, H. Chen, and J. Pu, Chinese J. Polym. Sci., 32, 1363 (2014).
-

- 9. Y. Yang, H. Kim, K.-H. Lim, and K. Ha, Polym. Korea, 42, 1 (2018).
- 10. H. Kim, S. Park, Y. Yang, K.-H. Lim, and K. Ha, Polym. Korea, 40, 925 (2016).
-

- 11. R. D. Kalita, Y. Nath, M. E. Ochubiojo, and Burangohain, Colloids Surf. B: Biointerfaces, 108, 85 (2013).
-

- 12. S. Suvachitanont and P. Ratanapan, J. Chem. Eng., 7, 1136 (2013).
- 13. M. A. Nassar and M. H. E. Shakankery, Int. Res. J. Pure Appl. Chem., 4, 871 (2014).
- 14. A. L. Horvath, J. Phys. Chem., 35, 77 (2006).
- 15. Z. Guo, Y. Liu, F. Wang, and X. Xiao, J. Cent. South Univ., 21, 1756 (2014).
-

- 16. El-B. M. Hassan and N. Shukry, Ind. Crops Prod., 27, 33 (2008).
-

- 17. S. Hu and Y. Li, Bioresour. Technol., 161, 410 (2014).
- 18. L. Yang, Q. He, P. Harvard, K. Corscadden, C. Xu, and X. Wang, Bioresour. Technol., 237, 108 (2017).
-

- 19. J. Feng, J. Jiang, C. Hse, Z. Yang, K. Wang, J. Ye, and J. Xu, Sustainable Energy Fuels, http://doi.org/10.1039/C7SE00579B (2018).
-

- 20. Y. Yao, M. Yoshioka, and N. Shiraishi, J. Appl. Polym. Sci., 60, 1939 (1996).
-

- 21. Y. Kurimoto, S. Doi, and Y. Tamura, Holzforschung, 53, 617 (1999).
-

- 22. D.-S. Kim and Y. J. Sung, J. Korea TAPPI, 48, 29 (2016).
- 23. S. Y. Oh, D. I. Yoo, Y. Shin, H. C. Kim, H. Y. Kim, Y. S. Chung, and J. H. Youk, Carbohydr. Res., 340, 2376 (2005).
-

- 24. K. Leppanen, S. Andersson, M. Torkkeli, M. Knaapila, N. Kotelnikova, and R. Serimaa, Cellulose, 16, 999 (2009).
-

- 25. K. Awa, H. Shinzawa, and Y. Ozaki, AAPS PharmSciTech, 16, 865 (2015).
-

- 26. D. Ciolacu, F. Ciolacu, and VI. Pola, Cell. Chem. Technol., 45, 13 (2011).
- 27. L. Pachuau, D. C. Vanlalfakawma, S. K. Tripathi, and H. Lalhlenmawia, J. Appl. Pharm. Sci., 4, 87 (2014).
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(1): 17-31
Published online Jan 25, 2019
- 10.7317/pk.2019.43.1.17
- Received on Apr 30, 2018
- Revised on Sep 5, 2018
- Accepted on Sep 17, 2018
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kwang-Hee Lim
-
Department of Chemical Engineering, Daegu University, Gyeongbuk 38453, Korea
- E-mail: khlim@daegu.ac.kr
- ORCID:
0000-0001-7768-1797










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.